Гены материнского эффекта. Кодирование белков ооцита
Добавил пользователь Morpheus Обновлено: 29.01.2026
Как гены контролируют формирование градиентов, а следовательно, и план строения будущего организма в ходе оогенеза? Естественно, что наиболее удобным объектом исследования этого контроля является знаменитая плодовая мушка дрозофила в силу ее хорошей генетической изученности.
Яйцеклетка дрозофилы развивается из общей с трофоцитами клетки-предшественника. Эти клетки-предшественники выделяются очень рано, после того как ядра будущих половых клеток попадают в ту область полярной плазмы, в образовании которой важную роль играет ген oscar.
Каждая такая клетка претерпевает 4 деления, так что возникает 16 клеток, одна из которых будет половой. Остальные клетки становятся питающими (трофоцитами) и соединены с яйцеклеткой цитоплазматическими мостиками, по которым в нее поступают различные вещества, принимающие участие в формировании градиентов. ДНК хромосом трофических клеток претерпевают многократное деление (так называемая политенизация), что существенно активизирует их функционирование в процессе обслуживания яйцеклетки.
Из материнской ткани образуется также около 1000 мелких фолликулярных клеток, окружающих будущий ооцит с трофическими клетками.
Будущий передний конец эмбриона располагается в области яйцеклетки, прилежащей к трофоцитам, а более выпуклая поверхность яйца становится брюшной частью эмбриона.
Далее начинается активное функционирование материнских генов в питающих клетках. Можно выделить три системы генов, особенно важных для формирования градиентов. Первая система генов обеспечивает формирование анимально-вегетативного (головно-хвостового) градиента (рис. 2). Вторая — дорзо-вентрального (спино-брюшного) градиента. Третья — синтез продуктов, необходимых для формирования специфических головных и хвостовых структур.
Наиболее изучена первая система генов. Среди них главным является ген bicoid, содержащий так называемый гомеобокс, специфическую, консервативную последовательность ДНК из 180 нуклеотидных пар. В случае его мутации нарушается развитие головного конца дрозофилы. У эмбрионов — носителей мутации по этому гену — задняя часть развивается нормально, но нарушено развитие передних брюшных сегментов, а вместо головы и груди развиваются структуры, свойственные заднему концу.
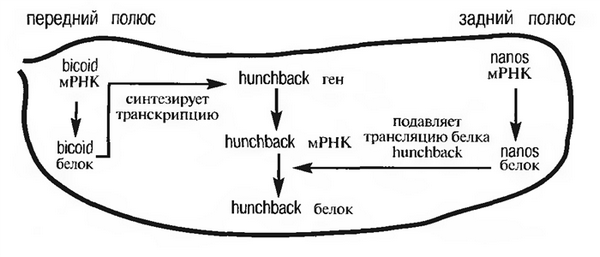
Рисунок 2 - Схема взаимодействия генов, отвечающих за формирование передне-заднего градиента яйца [1]
Если методами молекулярной генетики исследовать локализацию соответствующей матричной РНК, то можно проследить ее транспорт из питающих клеток в передний полюс развивающегося ооцита. В результате формируется четко выраженный анимально-вегетативный градиент распределения продукта этого гена. Белки, управляющие программой развития зародыша, принято называть морфогенами.
С другой стороны, питающие клетки, окружающие задний полюс яйцеклетки, «поставляют» в нее РНК, синтезированную геном nanos. У мутантов nanos нарушается развитие заднего конца зародыша. Если nanos РНК инъецировать в передний конец эмбриона, она может индуцировать формирование в головном конце различных структур, свойственных заднему полюсу. Белок nanos синтезируется в области заднего полюса и затем транспортируется в область брюшных сегментов.
В формировании плана строения организма на самых ранних этапах созревания яйцеклетки принимает участие еще один очень важный ген, который активно функционирует не только в материнском, но и в зиготическом геноме (т. е. в геноме самой оплодотворенной яйцеклетки). Это ген hunchback. Он активируется белком bicoid, а потому его продукт накапливается, как и bicoid, в передней половине зародыша и подавляет гены, активные в брюшных сегментах, так что в зоне его распределения формируются головные и грудные структуры.
В норме белок nanos тормозит синтез белка материнской РНК hunchback. Именно это и является основной его функцией. Если имеют место мутации, нарушающие функционирование как nanos, так и hunchback, то развивается нормальный организм.
Отсюда следует, что продукт гена hunchback «мешает» развитию хвостового конца, а блокирующий эффект со стороны гена nanos как бы устраняет чинимые им помехи (рисунок 3).
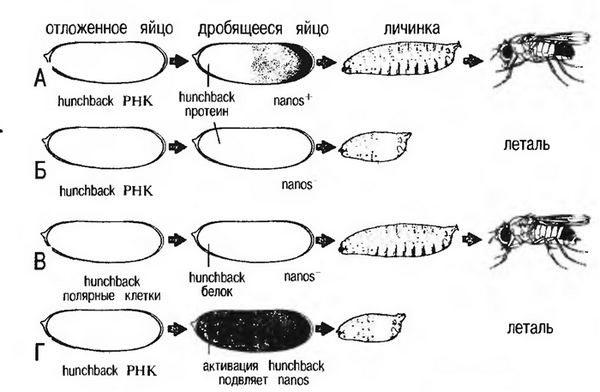
Рисунок 3 - Схема регуляции развития зародыша дрозофилы с участием генов hunchback и nanos [1]
A. Вот что происходит в норме. В отложенном яйце матричная РНК hunchback распределена равномерно по всему объему. Однако белок hunchback (как запасенный до оплодотворения, так и синтезированный в яйце после оплодотворения) в заднем полюсе отсутствует, поскольку функция его матричной РНК блокирована белковым продуктом гена nanos, накапливающимся в хвостовом отделе. Hunchback не дает развиваться хвостовым структурам в переднем отделе эмбриона, а в задних отделах ген nanos блокирует его синтез, и хвостовые структуры развиваются, как и положено в норме.
Б. А вот что случается, если ген nanos мутировал и потерял способность «работать». Поскольку его продукт отсутствует, продукт гена hunchback распространяется по всему яйцу и мешает формированию хвостовых структур. Развитие нарушается, и на стадии личинки муха погибает.
B. Однако, если наряду с отсутствием продукта гена nanos в отложенной яйцеклетке в результате соответствующей мутации подавлен синтез продукта гена hunchback, ничто не мешает формированию хвостовых структур.
Головные структуры также формируются, поскольку в оплодотворенной яйцеклетке продукт гена hunchback накапливается только в передней (головной) области эмбриона. Налицо, таким образом, все условия для нормального развития.
Г. Если с помощью специальных методов заставить ген hunchback работать с повышенной активностью, то белка nanos не хватит для того, чтобы целиком блокировать синтез его белкового продукта, даже если ген nanos нормален. Тогда белок hunchback накапливается в достаточно большом количестве, чтобы помешать формированию хвостовых структур.
Вторая и третья системы генов контролируют формирование спино-брюшного градиента и работают по тому же самому принципу, как и первая, только участвуют в этой «работе» другие гены.
Итак, неоднородность цитоплазмы созревающей яйцеклетки и формирование полярных градиентов, химически преформирующих план строения будущего организма, реализуется на основе взаимодействия трех систем генов и при участии питающих клеток материнского организма, окружающих ооцит.
Гены материнского эффекта. Кодирование белков ооцита
Эпигенетическая регуляция ооцита. Геномный импринтинг
Кроме регуляции на уровне транскрипции и трансляции, на экспрессию специфических генов влияют эпигенетические регуляторные механизмы ооцита, сперматозоида и раннего эмбриона. Эта регуляция осуществляется через процесс геномного импринтинга, а также всю молекулярную программу через глобальные изменения степени метилирования и структурного ре-моделирования хроматина. Последнее связано с существенными изменениями архитектоники ядра в процессе роста и созревания ооцита.
Хромосомы живых ооцитов мышей можно наблюдать при использовании культуральной среды, содержащей краситель Hoechst — химическое вещество, образующее хелатные соединения с малой бороздкой ДНК и испускающее синее флюоресцентное излучение при поглощении ультрафиолетовых лучей. Изначально в примордиальных и первичных фолликулах центромеры и околоцентромерный гетерохроматин располагаются на периферии ядра ооцитов. Затем, по мере роста ооцита, они распределяются по всему ядру, впоследствии скапливаясь по периферии ядрышка. Этот перинуклеолярный гетерохроматиновый ободок, или кариосфера, выглядит как яркий ореол вокруг ядрышка.
Несмотря на то что этот ареол связывают с тотальным угнетением транскрипционной активности и высокой готовностью к мейозу и развитию эмбриона, сегодня хорошо известно, что ремоделирование хроматина и угнетение транскрипции — отдельные процессы, регулируемые разными механизмами. Как и в соматических клетках, важную роль в масштабном ремоделировании хроматина больших ооцитов играют гистондеацетилазы, так как их ингибирование приводит к разрушению архитектоники кариосферы и нарушениям конфигурации мейотических хромосом и веретена деления.
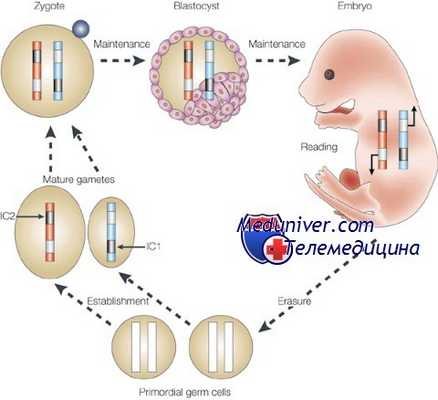
Другой важный установленный механизм эпигенетической регуляции — контроль активации и угнетения транскрипционной активности через процессы деметилирования и метилирования соответственно. В то время как геном предшественников соматических клеток подвергается реметилированию уже перед гаструляцией к 6,5 дпк, геном предшественников ППК остается деметилированным еще к 12,5 дпк. К 15,5 дпк происходит частичное метилирование, завершающееся к 18,5 дпк. Геном эмбриона инактивен вплоть до двухклеточной стадии развития у мышей (восьмиклеточной у человека), после чего он активируется при помощи тотального деметилирования.
Такие глобальные изменения метилирования следует отличать от Х-инактивации и геномного импринтинга. Если коротко, Х-инактивация — сложный и во многом случайный процесс, при котором одна из Х-хромосом у самок млекопитающих (с генотипом XX) инактивируется, чтобы обеспечить эквивалентное количество Х-сцепленных генов у эмбрионов с женским XX- и мужским XY-генотипом. Инициация этого процесса контролируется локусом, именуемым центром Х-инактивации (Xic), расположенным на Xql3. Этот локус содержит специфический транскрипт Х-инактивации (Xist), на котором записана некодирующая мРНК, покрывающая Х-хромосому в цис-положении, и запускает инактивацию.
Геномный импринтинг
И наконец, более геноспецифичный механизм эпигенетической регуляции — геномный импринтинг, с помощью которого осуществляется предопределенный дифференциальный сайленсинг материнских и отцовских аллелей. В процессе гаметогенеза определенные гены аутосом гиперметилируются (сайленсинг) в зависимости от их родительской принадлежности. Будучи однажды установленными, эти метки (импринты), как предполагают, становятся защищенными от тотального деметилирования генома.
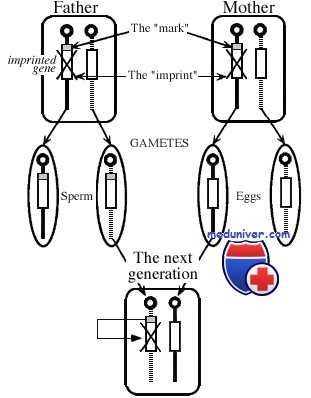
Импринтинг для разных генов может происходить в разное время в процессе оогенеза, сперматогенеза и эмбриогенеза. Зачастую врожденные синдромы и раковые опухоли возникают в результате неэффективного сайленсинга или инактивации аллеля соответствующего родителя.
Если предположить, что ВРТ достоверно связаны с дефектами импринтинга, следует изучить все возможные причины их появления, включая контролируемую гиперстимуляцию яичников, культивирование эмбрионов и сами клинические состояния, послужившие причиной бесплодия, так как дефекты импринтинга могут сами являться причиной бесплодия. Понятно, что необходимы дальнейшие интенсивные исследования в этой области, которые позволят понять, могут ли таким образом механизмы импринтинга влиять на развитие ВРТ.
Если мы говорим о половом размножении, требуется как минимум два различных пола. Человек — удобный пример для обсуждения, а грибы — неудобный, потому что у грибов может быть до 36 000 полов. Воистину свобода самоопределения!
Эмбрион не имеет половых признаков до 4–5 недель эмбрионального развития. Половая железа нового существа представляет собой мешочек, в который заселяются предшественники половых клеток. Только потом запускается одна из выбранных программ развития. Опустим подробности выбора пола и патологий, связанных с этим процессом. Важно, что выбор в данном случае происходит не по воле родителя, и тем более не по «календарю» или таблице зачатия — это молекулярно-генетический процесс. Самое важное для понимания полового размножения в целом: полный набор хромосом здорового человека включает в себя 23 пары.
Хромосома — это не абстрактное понятие, а одна большая свернутая молекула ДНК, удерживаемая белками. При этом хромосомы каждой пары, несмотря на то, что в них заключена информация об одном и том же, могут нести различные варианты генов (аллели). Половые клетки человека содержат всего 23 хромосомы (а яйцеклетка — еще и митохондриальную ДНК, важную маленькую молекулу!). Это не значит, что гаметы (половые клетки) представляют собой порубленные напополам клетки тела. Их образованию предшествует изящное, похожее на танец, деление клетки, в ходе которого хромосомы каждой пары обмениваются друг с другом фрагментами и расходятся по разным клеткам. Этот танец называется мейоз. По сути, любой ДНК-тест — это анализ талантов ваших хромосом. Потом гаметы встретятся и получится совершенно новый человек, удивительно похожий отдельными чертами на родителей. Но нам интересно то, что происходит накануне.
Образование яйцеклеток у женщин происходит в период эмбрионального развития. Этот процесс называется «о(в)огенез» (дословно — образование яйца). Его можно поделить на три этапа: размножение, рост, созревание. После того как пол эмбриона определен как женский, мешочек с предшественниками половых клеток становится яичником. Клетки-предшественницы начинают активно делиться подобно большинству клеток нашего тела. Пока что они все одинаковые, и нужно просто сделать как можно больше клеток. Возможность увеличить число будущих яйцеклеток у женщины есть только в ходе эмбрионального развития. Далее клетки переходят к следующему этапу — росту. Во время роста и ядро, и сама клетка существенно увеличиваются в размерах, накапливая запасы разных молекул, которые понадобятся, когда оплодотворение все-таки произойдет. Финальный этап развития яйцеклетки — мейоз — начинается еще в эмбрионе. Потом наступает пауза, и окончательное созревание яйцеклетки происходит у женщин раз в месяц с пубертатного периода до менопаузы.
Деление при созревании яйцеклетки имеет тот же базовый принцип, что был указан выше: происходит «танец хромосом». У яйцеклеток есть две особенности. Первая заключается в том, что после деления не все клетки станут яйцеклетками и какие-то из них будут использованы в качестве вспомогательного ресурса яйцеклеток. Второе интересное свойство: окончательное созревание яйцеклетки заканчивается только после оплодотворения. По большей части, клеточная биология интересна клеточным биологам. Для простых смертных важно ответить на вопросы в духе «Как привязанность к «Ягуару» в 9-м классе/работа на химическом производстве/5-летний стаж курения (нужное подчеркнуть) смогли повлиять на мои яйцеклетки?» Курение, алкоголизм и стрессовые ситуации ведут к окислительному стрессу в организме. Иными словами, «токсичные ситуации» и вредные привычки стимулируют выработку активных форм кислорода в организме. Негативное влияние окислительного стресса на репродуктивную функцию женщины доказывают через исследование яичников, цикла, развитие фолликула и анализ случаев невыношенной беременности. Нужно беречь себя и свои яйцеклетки от активных форм кислорода. Просто потому что других внутри вас нет.

С мужчинами все несколько иначе. На протяжении всей жизни у них в семенниках есть пул стволовых клеток, которые могут дать начало клеткам семенной жидкости. С пубертатного возраста клетки готовы к делению. Нужно разделить пазл генетического материала человека на две половины (посчитать число способов, которыми это можно сделать, — отдельная математическая задача). После того как клетки поделились, каждая из них получает гаплоидный набор хромосом. Нужно собрать сперматозоид — компактную клетку со жгутиком. Помимо известной функции доставки генетического материала, сперматозоид также должен активировать яйцеклетку, которая «остановилась в развитии».
Образование спермы происходит постоянно, полный цикл регенерации запаса составляет до 3 месяцев. Образование гамет (половых клеток) мужчины отличается от образования гамет женщины. Во-первых, оно более массовое, во-вторых — помимо тех клеток, что станут сперматозоидами, всегда остаются стволовые клетки-предшественницы. Несмотря на то, что будущие сперматозоды и яйцеклетки защищены от внешней среды, деление клеток — это всегда большой риск. Доказано, что в ходе образования сперматозоидов частота возникновения мутаций при делении снижается у молодых мышей и резко возрастает у старых. Помимо этого, риск возникновения мутации в гамете выше именно у мужчин, а не у женщин. Клетки с мутациями, разумеется, менее живучи. Большинство из них просто не доползает до яйцеклетки.

Удивительное заключается в том, что человек представляет собой случайный набор генов, случайно собранный от других людей, живших в разное время. При этом наше тело исправно работает. Среди генов, впрочем, можно найти довольно много мусора. Есть такие гены, которые пока не мешают никому жить. Они существуют в теле в двух вариантах: в «сломанном» и «нормальном». Благодаря работе «нормального» повреждений не заметно, а человек может и не знать, что является носителем «гена муковисцидоза» или «гена фенилкетонурии». Это ни в коем случае не специальный ген с болезнью — это вариант гена (аллель), который кодирует нефункциональный белок. Парадоксальная ирония: люди, идеально совместимые друг с другом душой, телом и бытом, могут также иметь сходные мутации в одной из копий гена! При этом они, сами не зная о своем особом статусе, являются носителями очень неприятного заболевания. Вероятность рождения больного ребенка у такой пары составляет 25%. Из-за двух поломанных копий одного и того же гена, доставшихся ему от мамы с папой, жизнь такого ребенка (и его родителей) будет во много раз сложнее.
Процессы, связанные с планированием семьи, требуют, прежде всего, осознанности. Ответственность за собственный генетический материал — крупица в море бесконечных вопросов, ответы на которые не стоит искать на форумах для беременных. Вместе с этим, создание новой человеческой жизни — это не только анализы, фолиевая кислота, большой живот и «смотри, он толкает ножкой». Этот серьезный процесс запускают два человека, и им обоим следует понимать, что они делают.
Если вы планируете детей и этот текст вызвал у вас вопросы, рекомендуем обратиться к нам напрямую.
Мутагены — это физические или химические агенты, которые провоцируют формирование необратимых структур, таким образом повышая частоту мутаций. Последние иногда приводят к канцерогенезу, поэтому значительное количество мутагенов также являются канцерогенами.
Враг №1: ультрафиолет. Мутаген физической природы, который особенно часто встречается в районе экватора и в областях озоновых дыр — ультрафиолетовый свет в диапазоне 260–280 нм. Основания ДНК поглощают ультрафиолет в этом диапазоне, что может приводить к разрыву связи между двумя цепями ДНК. Свободные нуклеотиды попарно сшиваются с соседними, как показано на картинке.
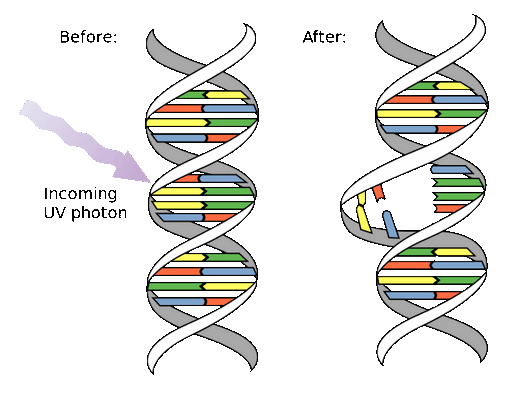
Если эта ошибка остается неисправленной, синтез белка и репликация ДНК усложняется во много раз — это и есть мутагенез. Солнечный свет нужен для выработки витамина D. Однако образование пиримидиновых димеров является одной из основных причин меланомы. Помимо этого, ультрафиолетовое излучение вредно для глаз. Вывод: длительное пребывание на солнце вредно. Солнечные ожоги опасны. Пренебрегать кремами с UV-фильтрами и находиться под прямыми солнечными лучами — легкомысленно, а ходить в солярий запрещено категорически. Прочее взаимодействие с солнцем (пробежка по пляжу на рассвете, например) нужно и полезно.
Доказано, что в построении защиты от УФ-излучения помогают жирорастворимые нутриенты. Это такие микроэлементы, как каротиноиды, флавоноиды, токоферолы и омега-3 ненасыщенные жирные кислоты. Усвоение нутриентов, содержащих эти вещества, имеет генетическую обусловленость. С одной стороны, это очень удобно, с другой — если у вас низкая усваиваемость витамина А или нарушения липидного обмена, но вы любите путешествовать в районе экватора, то лучше подстраховаться заранее.
Враг №2: активные формы кислорода Самый распространенный мутаген. Хитрость заключается в том, что эти активные формы генерируются в ходе самых обычных химических реакций, которые протекают в человеческом теле. Тут может возникнуть недоумение, ведь кислород — это газ, который содержится в атмосфере нашей планеты, с ним ассоциируется дыхание полной грудью, свежесть и еще какие-то приятные ощущения из рекламы стиральных порошков.
Разгадка кроется в названии. Кислород окисляет вещества, которые встречает на своем пути. Вспомните перекись водорода, которую выливают на разбитую коленку — примерно то же самое происходит в клеточных масштабах при выделении активных форм кислорода. Активные формы кислорода разрушают мембраны, из которых построены живые клетки, выдергивают отдельные основания из цепи ДНК и вносят разрывы. Страшно не только то, что они делают, но и то, как изощренно это происходит. Поскольку выделение АФК осуществляется постоянно, при поломке нейтрализующего их механизма клетки постоянно подвергаются бомбардировке мутагенами и гибнут в муках.
Доказано: от окисления и активных радикалов спасают антиоксиданты. Это вещества, которые содержатся в свежих ягодах и фруктах, зеленом чае, орехах и красном вине. Они переводят радикалы в неактивную форму. Иными словами, антиоксиданты — это такие альтруисты. Они выходят на улицу, видят, как хулиганы разрушают стены, и принимают удар на себя. Антиоксиданты обладают множеством чудесных свойств, одно из которых — защита от старения. Согласно некоторым гипотезам, старение ассоциировано с выделением АФК. Отдельно выделяется легион — витамин Е — собирательное название для нескольких жирорастворимых веществ, обладающих антиоксидантной активностью. При поступлении в пищеварительную систему ингредиенты витамина Е проходят отбор в печени, и уже в круг обмена веществ вступает в основном альфа-токоферол.
Важно учитывать собственную генетическую предрасположенность к усвоению витаминов, так как антиоксиданты при чрезмерном потреблении вредны: они могут препятствовать усвоению других микроэлементов.
Враг № 3: афлатоксины. Название принадлежит группе ядов-канцерогенов, вырабатываемых некоторыми видами плесени. Афлатоксины — это ответ на детский вопрос: «Почему нельзя есть землю и опавшие листья?», на взрослый вопрос: «Почему у чая есть срок годности?» и на старческий вопрос: «Почему нельзя есть заплесневевшую крупу?» Когда условия хранения не соблюдаются, на продукте, как на питательной среде, растут плесневые грибы рода Aspergillus. Опасность может подстерегать в крупах, специях, орехах, чае, молоке, яйцах, мясе, сухофруктах, хлебе и промышленных соках. Плесень может вырасти в результате неправильного или длительного хранения, а ароматизирующая добавка заглушит неприятный запах. Если доза афлатоксинов не смертельная, но регулярная, это может послужить причиной для развития цирроза и рака печени. Особую опасность продукты с афлатоксинами представляют для будущих матерей: помимо общего отравления, афлатоксины могут нарушить эмбриогенез.
Доказано: полезные пищевые привычки помогут избежать этого врага. Будьте аккуратны и не ешьте просроченные продукты. Старайтесь тщательно мыть продукты и готовить еду непосредственно перед употреблением. Впрочем, люди с непереносимостью глютена, лактозы или кофеина в отношении афлатоксина чувствуют себя немного спокойнее: больше половины продуктов из группы риска уже исключены из их меню. Такая особенность пищевого поведения, как привычка переедать, может быть вдвойне вредна в данной ситуации.
Враг №4: бензол. Бензол — химическое соединение, без которого невозможно представить современную жизнь. Это токсин и канцероген, который входит в состав нефти и бензина, а также широко применяется в производстве лекарств, пластмасс, резины и красителей. Если поместить человека в замкнутое пространство и постепенно закачивать туда бензол, то сначала он почувствует эйфорию. Затем появятся сонливость, тошнота, головная боль, мышечные подергивания. Если оставить испытуемого в этой камере на длительное время, то он умрет, если же его выпустить, то можно будет наблюдать целый комплекс расстройств, вызванных отравлением бензолом. Однако нам интересно не это. Бензол часто встречается в некачественной косметической продукции и пластмассовых изделиях, то есть не исключено систематическое отравление бензолом в небольших количествах, что может провоцировать возникновение различных видов гемато-онкологических заболеваний.
Доказано: витамины группы В — Ниацин, фолат и кобаламин — необходимы для репарации ДНК. Дефицит этих витаминов в первую очередь заметен при отравлении бензолом. Зачастую люди получают витамины этой группы с мясом животных. Подробнее узнать о том, на какие процессы влияют витамины группы В и как диагностировать их недостаток, можно по ссылке.
Берегите себя. Враги в лице мутагенов могут быть повсюду. Когда речь заходит о здоровом образе жизни, тем, кто пытается изменить все своими силами, приходится балансировать между массой советов и здравым смыслом. Граница зыбкая и устоять на ней больше шансов у того,, кто знает себя и не наносит себе вред.
Гены материнского эффекта
Эти гены контролируют формирование градиентов в ходе оогенеза. Анимально-вегетативный, дорсо-вентральный и терминальные структуры формируются несколькими независимыми генными системами.
Можно выделить две основные системы генов, особенно важных для формирования анимально-вегетативного градиента (передне-заднего).
Результаты эмбриологических экспериментов свидетельствуют о существовании в яйцах насекомых по крайней мере двух организующих центров: переднего и заднего. Именно эти области формируют два градиента: в передней и задней частях зародыша.
Среди генов первой группы главным является bicoid. У его мутантов вместо передних структур формируется дополнительный тельсон. Этот ген транскрибируется в клетках овариолы яичника и можно проследить транспорт этих клеток в анимальный полюс ооцита. Поэтому его мРНК обнаруживается исключительно в передней части ооцита. Но при ее трансляции белковый продукт гена формирует градиент с наибольшей концентрацией в передней части яйца и фоновой концентрацией – в задней. Для поддержания стабильности этого продукта в переднем полюсе зародыша необходима активность еще двух генов exuperantia и swallow. При их мутациях градиент белка bicoid становится размытым и зародыши не формируют передних структур.
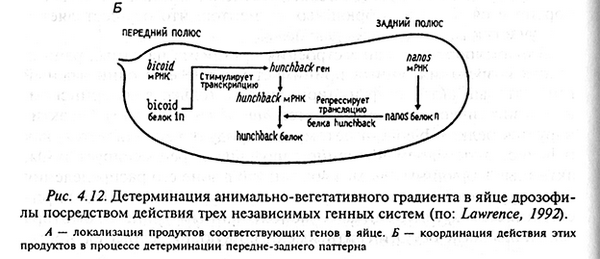
С другой стороны, фолликулярные клетки поставляют в ооцит мРНК, синтезированную геном nanos и концентрирующуюся на заднем конце зародыша. У мутантов по этому гену нарушается развитие заднего конца зародыша. Для его активации необходимы 5 генов с материнским эффектом. Белок образуется в области заднего полюса и затем транспортируется в область брюшных сегментов.
В формировании плана строения на самых ранних этапах созревания ооцита принимает участие еще один важный ген – hunchback. Он активируется геном bicoid, поэтому его продукт тоже накапливается в передней половине зародыша. Этот ген репрессирует гены, активные в брюшных сегментах, так что в зоне его распределения формируются головные и грудные структуры. Оказывается, белок гена bicoid обнаруживается в ядрах и содержит гомеодомен, с помощью которого он может связываться с ДНК и регулировать таким образом экспрессию генов. Было показано, что белок гена bicoid способен присоединяться к 5 сайтам, расположенным выше промотора гена hunchback и все эти участки имели общую последовательность. В норме белок nanos способен блокировать трансляцию мРНК hunchback, вероятно, в этом и заключается его основная функция, и в результате формируются задние структуры зародыша.
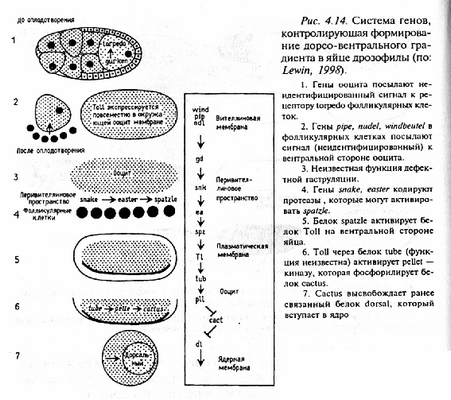
В торая система генов контролирует формирование дорсо-вентрального градиента. Последовательность активации этих генов представлена на рис. Как следует из рисунков, гены посылают сигнал (неизвестной природы) к рецептору, кодируемому геном torpedo, который функционирует в фолликулярных клетках. Белок torpedo частично гомологичен рецептору фактора роста (ЕGF-рецептору) позвоночных и имеет экстра-целлюлярную часть, способную связывать лиганд из ооцита. Затем гены pipe, nudel, windbeutel, функционирующие в фолликулярных клетках, посылают сигнал (также неидентифицированный) в вентральную область ооцита. После оплодотворения гены snake, easter, кодирующие протеазы, активируют ген spatzle, так что сигнал возвращается в ооцит. Продукт spatzle активирует toll на вентральной стороне яйца. Продукт этого последнего активирует продуцируемую геном реllе киназу. Она в свою очередь фосфорилирует продукт гена сасtus. В результате этого процесса высвобождается белковый продукт гена dorsal, поступающий в ядра клеток. Активация tоll-рецептора ведет к высвобождению белка dorsal из комплекса dorsal-cactus, так что создается градиент распределения белка dorsal, действующего как транскрипционный фактор.
Существует третья система генов, контролирующих формирование градиентов в оогенезе. Эта группа генов контролирует формирование терминальных структур, т.е. акрона (несегментированного головного конца) и тельсона (несегментированного хвостового конца). Ключевую роль в этом процессе играет ген torso. При отсутствии его продукта ни акрон, ни тельсон не развиваются, так что эмбрион оказывается полностью сегментированным. Активация белка torso осуществляется как на переднем, так и на заднем концах зародыша продуктом гена torsoless, функционирующим в фолликулярных клетках.
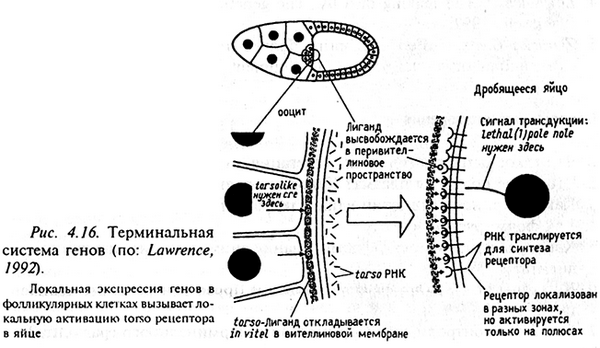
И так, гетерогенизация цитоплазмы созревающего ооцита и формирование полярных градиентов, химически преформирующих план строения будущего организма, реализуется на основе взаимодействия трех систем генов и при участии питающих клеток материнского организма, окружающих ооцит.
gap-гены
Сегрегационные гены последовательно активируются в процессе индивидуального развития. В первую очередь активируются gap-гены (от англ. gap — брешь, пролом, щель). Их транскрипция стимулируется продуктами генов материнского эффекта, формирующими градиенты в ходе оогенеза. Они начинают функционировать на синцитиальной стадии развития, когда к 10—11-му циклу клеточного деления ядра мигрируют к периферии развивающегося эмбриона и "прочитывают" позиционную информацию, возникшую благодаря активности генов материнского организма, формируя на поверхности яйца синцитий. В результате этого процесса зародыш подразделяется на несколько пространственных доменов. Мутации gар-генов вызывают выпадения групп сегментов, характер их экспрессии изменяется во времени, но зоны экспрессии не перекрываются.
pаir-rulе-гены
На фоне специфического распределения продуктов gар-генов под их влиянием активируются, раir-rulе-гены, которые "дробят" зародыш на повторяющиеся домены шириной по два парасегмента, в одном из которых этот ген активен, в другом — нет. Благодаря функционированию этих генов зародыш подразделяется на отдельные сегменты. Нарушение их функционирования ведет к выпадению отдельных (чередующихся) сегментов.
Читайте также:
