Гены возрастной дегенерации макулы. Особенности картирования
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
ГБУЗ «НИИ — ККБ №1 им. проф. С.В. Очаповского» Минздрава Краснодарского края, отделение травматологии и ортопедии №1, Краснодар, Россия
ФГБНУ «НИИ клинической и экспериментальной лимфологии», ул. Тимакова, 2, Новосибирск, Российская Федерация, 630060
НИИ клинической и экспериментальной лимфологии Сибирского отделения РАМН, Новосибирск
Новосибирский филиал ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Новосибирск, ул. Колхидская, 10, Российская Федерация, 630096
ФГБНУ «Научно-исследовательский институт экспериментальной и клинической медицины», Новосибирск, Россия
Полиморфизм генов цитокинов у пациентов с возрастной макулярной дегенерацией
Журнал: Вестник офтальмологии. 2016;132(2): 8‑13
Цель — проведение анализа полиморфизма промоторных регионов генов цитокинов TNF-A863C; TNF-A308G; TNF-A238G; IL1β-C-31T; IL4-C590T; IL6-C174G; IL10A-1082G и IL10-А592C у пациентов с возрастной макулярной дегенерацией (ВМД) для выявления единичных и комплексных генотипов, ассоциированных с заболеванием. Материал и методы. Обследованы 102 пациента с ВМД на базе Новосибирского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» и 100 пациентов без ВМД аналогичного возраста. Исследование проводили методом анализа полиморфизма длин рестрикционных фрагментов. Результаты. Частота генотипов TNF-308 GA и IL10-1082 GG увеличена в группе пациентов с ВМД. Минорный генотип TNF-308 АA протективен в отношении заболевания. Выявлено 48 комплексных генотипов, позитивно ассоциированных, и 32 комплексных генотипа, негативно ассоциированных с ВМД. Уровень специфичности комплексных генотипов составляет 98—99%, при этом значения OR более высоки, чем при анализе моногенотипов. Заключение. Комплексный анализ генов цитокинов важен в исследовании механизмов патогенеза, возможных терапевтических стратегий этой болезни и может отражать особенности баланса про- и противовоспалительных цитокинов при развитии ВМД.
Возрастная макулярная дегенерация (ВМД) — сложное, многофакторное нейродегенеративное заболевание тканей глазного дна, которое становится причиной нарушения и потери зрения у людей пожилого и старческого возраста [1]. В основе патогенеза ВМД лежат характерные для старения дистрофические процессы с поражением хорио-капиллярного слоя пигментного эпителия, мембраны Бруха и хориоидеи сетчатки [2, 3] с последующим формированием хориоидальной неоваскуляризации (ХНВ) [4]. Сложные взаимодействия средовых и генетических факторов определяют склонность человека к развитию заболевания. К факторам риска развития ВМД относят кардиоваскулярные заболевания, пожилой и старческий возраст, атеросклеротические изменения сосудов, особенности питания, курение, светлый цвет глаз. Конкретные молекулярно-генетические механизмы развития ВМД, способствующие переходу нормальных физиологических возрастных изменений сетчатки в патологический процесс, на сегодняшний день обсуждаются. Известно, что повреждение сосудов, ишемия и гипоксия сетчатки сопровождаются целым комплексом клеточных и воспалительных процессов и каскадом реакций с участием воспалительных цитокинов [5, 6]. Для ХНВ характерно нарушение нормального баланса цитокинов, в частности, рядом авторов показано снижение количества апоптогенного цитокина TNFa, влияющего на апоптоз эндотелиоцитов и определяющих превалирование в хориоидее и сосудах сетчатки глаза пролиферативных процессов над апоптотическими [7]. С другой стороны, есть данные об увеличении экспрессии TNF и IL-1β ретинальным пигментным эпителием (РПЭ), объясняющие воспалительный компонент ХНВ, а также изменение баланса IL-2, IL-6 и IL-10, но их роль до конца не ясна [8].
Поэтому, наряду с процессами дистрофических изменений сетчатки в межклеточном матриксе, патологического ангиогенеза, нарушения липидного обмена, окислительного стресса, широко обсуждаются процессы иммунного воспаления как фактора развития ВМД. Кроме того, выявлена ассоциированность отдельных полиморфизмов генов IL4, IL6, IL8, IL10, IL18 с развитием ВМД и ХНВ [9, 10]. Показано, что генетический полиморфизм промоторных регионов генов цитокинов оказывает влияние на их транскрипционную активность, что приводит к межиндивидуальным различиям продукции цитокинов [11]. Мы предположили, что полиморфизм генов ключевых цитокинов может быть важной детерминантой развития ВМД, и провели анализ полиморфизма полиморфных вариантов генов цитокинов TNF-A863C; TNF-A308G; TNF-A238G; IL1β-C-31T; IL4-C590T; IL6-C174G; IL10-A 1082G и IL10-А592C у пациентов с ВМД относительно здоровых аналогичного возраста. Предполагается, что носители различных генотипов в полиморфных регуляторных участках генов обладают различным базовым уровнем продукции цитокинов, что в свою очередь может оказывать влияние на характер развития патологического процесса.
Материал и методы
Обследованы 202 человека (404 глаза), прошедшие диагностическое обследование на базе Новосибирского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» в 2013—2014 гг. Все пациенты фенотипически относились к представителям европеоидного населения РФ и идентифицировали себя и своих родителей как лиц русской национальности, длительное время проживающих на территории Сибири, языком общения которых является русский. Все пациенты в зависимости от наличия ВМД были разделены на 2 группы: основную группу составили 102 пациента с ВМД, группу сравнения — 100 человек без ВМД. Характеристика обследованных групп представлена в табл. 1.

Таблица 1. Характеристика групп обследованных Примечание. АГ — артериальная гипертензия.
Критериями включения в основную группу являлись наличие диагноза ВМД и возраст старше 60 лет, в группу сравнения — отсутствие диагноза ВМД в аналогичном возрасте. Критерием исключения для обеих групп являлось наличие у пациентов острых и обострения хронических воспалительных заболеваний органа зрения, глаукомы, увеита различной этиологии, полной осложненной катаракты, отслойки сетчатки, рубеоза радужки.
Также из исследования исключались пациенты с сахарным диабетом, аутоиммунными и опухолевыми процессами любой локализации. Диагноз ВМД поставлен на основании результатов стандартного офтальмологического обследования, включающего визометрию, тонометрию, биомикроскопию, офтальмоскопию, периметрию, оптическую когерентную томографию макулярной области. Исследование было одобрено комитетом по биомедицинской этике Новосибирского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова». У всех пациентов было получено информированное согласие на забор крови, а также использование данных исследования в научных целях.
Исследовали однонуклеотидный полиморфизм (SNP — single nucleotide polymorphism) промоторного региона генов TNFα-863 C→A, TNFα-308 G→A, TNFα-238 G→A, IL1β-31 С→T, IL4−590 С→T, IL6−174 G→C, IL10−1082 G→A и IL10−592 А→С. Генотипирование осуществляли методом рестриктного анализа длин продуктов амплификации (RFLP — restriction fragment length polymorphism). Участки промоторного региона генов амплифицировали с использованием пары специфичных праймеров [12], затем продукты амплификации подвергали гидролизу эндонуклеазами рестрикции («СибЭнзим», Новосибирск). Электрофорез проводили в 2,5% агарозном геле.
При статистическом анализе результатов исследований использовали такие показатели, как частота встречаемости генотипов и их комбинаций, отношение шансов (OR, odds ratio) с расчетом 95% доверительного интервала (95% Confidence Interval — 95% CI) [13—15]. Распределение генотипов по исследованным полиморфным локусам проверяли на соответствие равновесию Харди—Вейнберга [13]. Достоверность различий частот распределения изучаемых признаков в альтернативных группах определяли по критерию χ 2 с поправкой Йетса на непрерывность и двустороннему варианту точного метода Фишера для четырехпольных таблиц [16]. Для оценки диагностической значимости генетических признаков использовали показатель специфичности, расчет которого осуществляли с использованием общепринятых методов медико-биологической статистики [17]. При OR больше 1 специфичность рассчитывали как долю отрицательных результатов генетического теста в группе сравнения, а при OR меньше 1 — как долю отрицательных результатов генетического теста в основной группе [18].
Результаты и обсуждение
Исследовано 8 полиморфных вариантов 5 генов цитокинов TNF-A863C; TNF-A308G; TNF-A238G; IL1β-C31T; IL4-C590T; IL6-C174G; IL10-A1082G и IL10-А592C у пациентов с ВМД и в группе относительно здоровых лиц аналогичного возраста без признаков ВМД. Все полиморфные сайты локализованы в промоторных регионах генов и ответственны за уровень их экспрессии. Частоты генотипов исследуемых генов в сопоставляемых группах находятся в равновесии Харди—Вейнберга. Достоверные различия частот отдельных генотипов между группами показаны только для двух полиморфных позиций. Наличие в геноме пациентов гетерозиготного генотипа TNF-308 GA (OR = 2,91 95% CI 1,39—6,11) и IL10−1082 GG (OR = 2,21 95% CI 1,08—4,52), частота которых увеличена в группе пациентов с ВМД, является фактором риска развития заболевания. В то же время минорный генотип TNF-308 АA протективен в отношении заболевания (OR = 0,22 95% CI 0,06—0,81). Не следует забывать, однако, что при любом процессе воспаления цитокины образуют определенную регуляторную сеть (каскад цитокинов) с многофункциональным действием. Взаимосвязь между цитокинами приводит к тому, что в действии многих из них наблюдается синергизм, а некоторые цитокины являются антагонистами. Аналогичную «сеть» образуют и гены цитокинов. Поэтому при исследовании ассоциированности генов цитокинов с заболеванием необходимо, по возможности, учитывать каскадность цитокинов со сложной прямой и обратной связью и с клетками — носителями соответствующих рецепторов. Поэтому было принято решение проанализировать частоту встречаемости комплекса полиморфных вариантов генов ряда ключевых цитокинов, выявляемых в геноме каждого обследуемого пациента. В данном исследовании были проанализированы 8 полиморфных вариантов 5 ключевых генов цитокинов и проведен дальнейший анализ комплексных генотипов генов цитокинов, позволяющий выделять при высокой их специфичности носителей с высокими значениями отношений шансов развития ВМД. Выявлено 48 комплексных генотипов, позитивно ассоциированных с заболеванием и достоверно различающихся между группами. В табл. 2 представлены генотипы со значением показателя OR больше 5. Уровень специфичности комплексных генотипов составляет 98—99%, при этом значения OR более высоки, чем при анализе моногенотипов. Нами установлены максимальные значения OR, равные 10,76, при носительстве комплексных генотипов TNF-863 CC: IL1B-31 TT: IL6−174 GC: IL10−592CC и TNF-863 CC:TNF-238 GG:IL1B-31 TT:IL6−174 GC:IL10−592CC при 99% специфичности. При гомозиготном носительстве во всех позитивно ассоциированных с ВМД генотипах, включая непредставленные в табл. 2, соблюдается определенный баланс про- и противовоспалительных цитокинов. Провоспалительные цитокины представлены генотипами, ассоциированными с низким уровнем транскрипционной активности гена, в то время как генотипы гена IL10 в двух полиморфных позициях представлены генотипами, ассоциированными с высоким уровнем экспрессии. Негативно ассоциированы с ВМД 32 комплексных генотипа, часть из которых со значениями OR меньше 0,3 представлена в табл. 3. В негативно ассоциированных с заболеванием комплексных генотипах провоспалительный цитокин TNFa в полиморфной позиции -863 представлен в основном гетерозиготным генотипом, ответственным за более высокий уровень белкового продукта. В комплексах, содержащих 3 полиморфные позиции промоторного региона гена TNFa, в позиции -308 представлен генотип АА, ответственный за высокий уровень белкового продукта и встречающийся в популяции с частотой всего 1,54%. Противовоспалительный цитокин IL10 в позиции -1082 представлен либо гомозиготным генотипом АА с низким уровнем экспрессии, либо гетерозиготным генотипом, а в позиции -592 — преимущественно гетерозиготным генотипом, также ответственным за более низкий уровень белкового продукта.
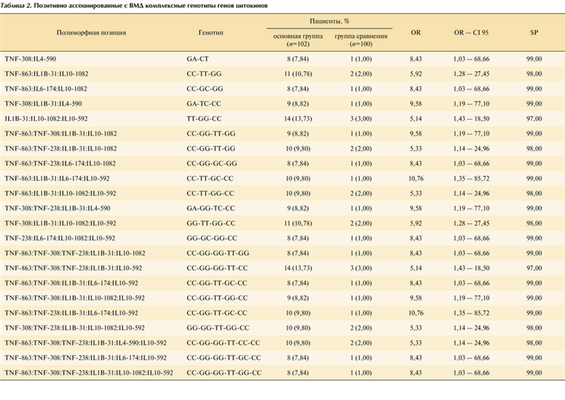
Таблица 2. Позитивно ассоциированные с ВМД комплексные генотипы генов цитокинов
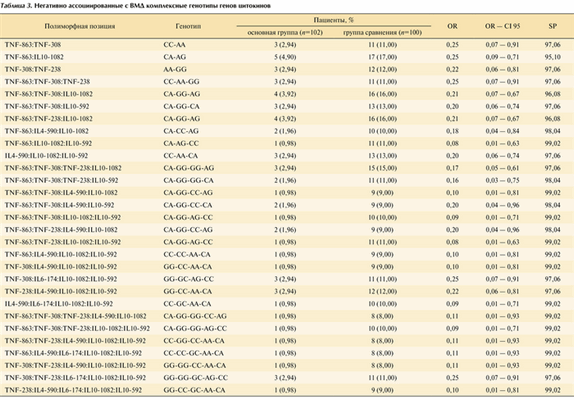
Таблица 3. Негативно ассоциированные с ВМД комплексные генотипы генов цитокинов
Кроме более специфичного выделения групп повышенного риска развития заболевания, комплексный анализ позволяет критически посмотреть на некоторые ассоциации единичных полиморфных позиций с заболеванием. Так, выявленная в нашем исследовании ассоциированность TNF-308 GA с ВМД реализуется только в комплексе с IL4-C590Т генотипом. Во всех остальных комплексных генотипах эта позиция представлена ассоциированным с низким уровнем продукции генотипом TNF-308GG. Аналогично протективный в отношении заболевания минорный генотип TNF-308 АA реализуется только в сложном генотипе из трех полиморфных позиций промоторного региона данного гена. В то же время моногенотип IL10−1082 GG, частота которого повышена у пациентов с ВМД, является составляющей компонентой большинства комплексных генотипов, ассоциированных с патологией. Кроме того, в комплексных генотипах более четко прослеживается и смещение баланса про- и противовоспалительных цитокинов за счет их асссоциированности с определенным уровнем белковой продукции.
Заключение
Таким образом, проведенное исследование показало, что комплексный анализ полиморфных вариантов генов цитокинов оказался более информативным при рассмотрении вопроса о роли генетической компоненты в развитии ВМД. Комплекс генотипов цитокинов, присутствующий в геноме каждого пациента, оказался более тесно ассоциирован с развитием возрастной патологии в сравнении с характером ассоциированности ВМД с единичными полиморфными участками регуляторных областей генов цитокинов. Нам представляется, что дальнейшие исследования в этом направлении могут предоставить возможность значительного повышения прогностической значимости выявления различных комплексов генов цитокинов и других регуляторных белков у пациентов на ранних этапах развития ВМД с целью формирования групп повышенного риска развития этой офтальмопатологии.
Участие авторов:
Концепция и дизайн исследования: А.Ш., В.К., В.Ч., А.Е., Л.Д., Н.К., А.Т.
Гены возрастной дегенерации макулы. Особенности картирования
Непараметрический анализ связи признаков (болезней) в генетике
Один из типов непараметрического анализа — метод больных сибсов. При этом анализируют сибсов, конкордатных по болезни, тем самым устраняя проблему определения непенетрантного носительства патологических аллелей. Нет необходимости делать предположения о количестве локусов, участвующих в развитии признака или типе его наследования.
Взамен сибсов анализируют, чтобы определить, имеются ли в пораженных парах сибсов аллели, встречающиеся чаще, чем ожидаемые 50%. При использовании метода больных сибсов их ДНК систематически анализируют с использованием сотен полиморфных маркеров для всего генома (так называемое геномное сканирование) для поиска регионов, которые встречаются у сибсов значительно чаще, чем ожидается.
Когда обнаруживается повышенная частота сцепления с полиморфным маркером, предполагают, что локус, участвующий в развитии болезни, расположен близко к этому маркеру. Случайно ли отклоняется степень сцепления аллелей от ожидаемых 50%, можно оценить с помощью отношения шансов в форме максимального правдоподобия, рассчитав NPL-оценку повышения сцепления аллелей, подобно тому, как модельный анализ сцепления использует LOD-оценку частоты рекомбинации между двумя локусами, если она менее 50%.
Чем больше анализируется полиморфных локусов в геноме при повышенной частоте общих аллелей, тем более вероятно, что какой-то локус чисто случайно окажется похожим на значимо повышенное сцепление аллелей. Чтобы понять, почему так происходит, рассмотрим пример с подбрасыванием монеты.
Маловероятно, чтобы единственный эксперимент из пяти попыток дал пять выпадений орла, но такое весьма вероятно, если эксперимент повторять сотни раз. При типичном геномном сканировании с использованием около 400 маркеров непараметрические пороги оценки LOD для определения значимости повышенной частоты общих аллелей предполагают уменьшение риска неправильно определенной значимости за счет случайных отклонений от ожидаемых уровней.

При этой установке оценка LOD больше, чем приблизительно 3,6, вероятность случайного совпадения аллелей в локусе будет менее чем 1 из 20; оценка LOD больше, чем 5,4 — менее чем в 1из 1000 исследований.
Хотя метод больных сибсов не требует каких-либо, возможно ошибочных, предположений о числе задействованных локусов и взаимодействии в них аллелей, это достигается ценой низкой чувствительности и точности метода. Низкая чувствительность проявляется в том, что необходимо множество пар сибсов для обнаружения значимого отклонения от ожидаемой частоты в 50%. Предположим, аллель в локусе болезни имеет частоту 10% в популяции и увеличивает риск болезни в 4 раза у гетерозигот и в 16 раз у гомозигот.
В этой ситуации при наилучших обстоятельствах, чтобы обнаружить повышение частоты общих аллелей примерно на 60%, потребуется 185 пар сибсов. Если локус сравнительно редкий или вызывает значительно меньшее увеличение риска болезни, чем 4-х кратное у гетерозигот, повышение частоты общих аллелей будет пропорционально меньше. В этом случае для обнаружения локуса потребуется значительно больше пар сибсов, тысячи или десятки тысяч.
Таким образом, фактически, метод больных сибсов вряд ли применим для идентификации локусов с небольшим числом редких аллелей или аллелем, делающим только незначительный вклад в развитие болезни.
Кроме этого, метод отличается низкой точностью. Поскольку не предполагается, что задействован единственный ген или конкретный тип наследования, невозможно точно определить факт рекомбинации между локусом-кандидатом и фенотипом болезни. При модельном методе анализа сцепления для точного картирования моногенной болезни используют ближайшие маркеры с любой стороны гена болезни, рекомбинирующие с геном болезни, по крайней мере, один раз, определяя тем самым границы узкого критического интервала, в котором должен находиться ген болезни.
В противоположность свободные от модели методы могут идентифицировать только широкие регионы повышения частоты общих аллелей, а не узкий критический регион, ограничивающий позицию гена, способствующего появлению сложного признака. Тем не менее после использования непараметрического метода анализа сцепления для выделения областей интереса поиск вариантов в данных областях, находящихся в неравновесном сцеплении с геном болезни, может быть использован эффективно. Комбинированный подход имел определенный успех в обнаружении аллелей при таких комплексных болезнях, как воспалительная болезнь кишечника и возрастная дегенерация макулы (ВМД).
Непараметрический анализ сцепления количественных признаков
Методы анализа сцепления без модели, основанные на общих аллелях, также могут использоваться для поиска локусов, задействованных в формировании количественных многофакторных признаков. Хотя доступно множество методов, один интересный пример — метод высокодискордантных пар сибсов. Здесь также нет необходимости делать предположения о количестве локусов или типе наследования.
Выбирают пары сибсов с величинами физиологического показателя, находящимися в противоположных концах нормальной кривой распределения и считают их рассогласованными по данному количественному признаку. Можно считать весьма маловероятным наличие общих аллелей в локусах, содействующих развитию признака.
Затем ДНК дискордантных сибсов подвергают систематическому анализу с использованием полиморфных маркеров по всему геному для поиска регионов, которые реже встречаются у сибсов по сравнению с ожидаемым случайным распределением. Если обнаруживается снижение числа общих аллелей полиморфного маркера, это указывает, что маркер связан с локусом, аллели которого содействуют изучаемому физиологическому показателю.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Возрастная дегенерация макулы. Причины, диагностика, лечение
Этиология и встречаемость возрастной макулярной дегенерации. Возрастная дегенерация макулы (ВМД) (MIM №603075), — прогрессирующая болезнь макулы, участка сетчатки, ответственного за центральное зрение, критически важное для точного зрения (например, чтения). Возрастная дегенерация макулы (ВМД) — одна из наиболее частых форм слепоты у пожилых. Начало симптоматики проявляется у 30% всех людей старше 75 лет; около четверти этих людей имеют тяжелое заболевание со значительной утратой зрения.
Возрастная дегенерация макулы (ВМД) редко обнаруживают у лиц моложе 55 лет. Приблизительно 50% генетического риска в популяции обеспечивается полиморфным вариантом Tyr402His, в гене фактора комплемента Н (CFH). В отличие от этого, полиморфные варианты в двух других генах альтернативного пути комплемента, фактора В (CFB) и компонента комплемента 2 (С2), приводят к значительному снижению риска возрастной дегенерации макулы (ВМД).
Дополнительно к полиморфизмам в трех генах факторов комплемента у небольшого процента пациентов с возрастной дегенерацией макулы (ВМД) обнаружены мутации в других локусах. У 7 из 402 пациентов с возрастной дегенерацией макулы (ВМД) были обнаружены различные гетерозиготные миссенс-мутации в гене FBLN5, кодирующем фибулин 5, компонент внеклеточной матрицы, участвующий в сборке волокон эластина.
Все больные имели небольшую циклическую друзу и отслойку сетчатки. Возрастная дегенерация макулы (ВМД) также обнаружена среди родственников лиц с болезнью Штаргардта, рецессивной формы макулярной дегенерации с ранним началом, наблюдаемой у лиц, гомозиготных по мутациям в гене АВСА4. Пораженные родственники гетерозиготны по мутациям АВСА4. Мутации в каждом из этих локусов вызывают только небольшую часть большого числа больных с возрастной дегенерацией макулы (ВМД).
Патогенез возрастной дегенерации макулы (ВМД)
В основе патофизиологии возрастной дегенерации макулы (ВМД) лежит воспаление. В настоящее время считают, что воспалительная симптоматика старческих изменений играет большую роль в сетчатке индивидуумов, предрасположенных к возрастной дегенерации макулы (ВМД), из-за сниженной активности альтернативного пути комплемента в ограничении воспалительного ответа. Воспаление повреждает фоторецепторы макулы, вызывая атрофию сетчатки.
Возрастная дегенерация макулы (ВМД) подразделяют на «сухой» тип (атрофичный) и «влажный» (неососудистый или экссудативный). Ранние формы возрастной дегенерации макулы (ВМД) обычно «сухие». Их характеризует гигантская «мягкая» друза — клинический и патологический признак возрастной дегенерации макулы (ВМД). Друза представляет собой скопление внеклеточного материала за сетчаткой в области макулы.
Хотя небольшие «твердые» друзы в виде мелких зернистых отложений, обычно обнаруживаемые в сетчатке в норме, не связаны с дегенерацией макулы, крупная «мягкая» друза тесно коррелирует с возрастной дегенерацией макулы (ВМД), предвещая патологию сетчатки. По мере развития возрастной дегенерации макулы (ВМД) появляется уменьшение и потеря ткани сетчатки в различных областях. Примерно у 10% пациентов преобразование пигмента эпителия сетчатки происходит в месте большой мягкой друзы.
Отмечают также прорастание в субретинальное пространство новых кровеносных сосудов (неоваскуляризация), растущих из хориоидеи.
Они очень ломкие, легко повреждаются и кровоточат в сетчатку, приводя к «влажному» типу возрастной дегенерации макулы (ВМД).
Друза содержит факторы комплемента, включая фактор комплемента Н. Если последний — отрицательный регулятор альтернативного каскада комплемента, и вариант Tyr402His менее способен к торможению активизации комплемента, то этот вариант, вероятно, будет функциональным, предрасполагающим к возрастной дегенерации макулы (ВМД). Важно, что варианты фактора комплемента Н вызывают повышенный риск как для «влажной», так и «сухой» формы, указывая, что эти два проявления болезни имеют общую основу.
Варианты Leu9His и Arg32Gln фактора В и варианты Glu318Asp интрона 10 С2 в значительной степени уменьшают риск ВМД (отношения шансов 0,45 и 0,36 соответственно). Механизм снижения риска возрастной дегенерации макулы (ВМД) вариантами генов фактора В и С2 компонента комплемента пока не известен, но, вероятно, также связан с их влиянием на активизацию комплемента.
Хотя ясно, что факторы влияния окружающей среды содействуют возрастной дегенерации макулы (ВМД), единственный идентифицированный до настоящего времени негенетический фактор риска — курение. Интересно, что курение значительно уменьшает сывороточный уровень фактор комплемента Н. Причина эпидемии возрастной дегенерации макулы (ВМД) в развитых странах неизвестна.

Фенотип и развитие возрастной дегенерации макулы (ВМД)
Возрастная дегенерация макулы (ВМД) приводит к изменениям в центральной области сетчатки, легко выявляющимся при офтальмоскопии (рис. С-2, см. цв. вклейку). Пациенты жалуются на снижение центрального зрения, затрудняющее или делающее невозможным чтение или управление автомобилем. При «сухом» типе ВМД снижение зрения обычно прогрессирует медленно. В отличие от этого, кровотечение из новых сосудов может привести к отслойке сетчатки или кровоизлиянию под сетчатку и вызвать быструю утрату зрения. Периферическое зрение обычно сохранено.
Особенности фенотипических проявлений возрастной дегенерации макулы (ВМД):
• Возраст начала: старше 50 лет
• Постепенная потеря центрального зрения
• Друзы на макуле
• Изменения в эпителии пигмента сетчатки
• Дополнительная васкуляризация (в виде «подтеканий»)
Лечение возрастной дегенерации макулы (ВМД)
При «сухом» типе возрастной дегенерации макулы (ВМД) специфического лечения нет. Показано прекращение курения. В крупных клинических исследованиях показана возможность замедления развития болезни у больных с друзами промежуточного размера или единственной крупной друзой при использовании антиоксидантов (витамины А и Е, b-каротин) и цинка. b-Каротин, вероятно, не показан курильщикам, поскольку некоторые исследования указывают, что это увеличивает риск развития опухолей легкого и ИБС.
Для «влажного» типа возрастной дегенерации макулы (ВМД) потерю зрения можно замедлить термической лазерной коагуляцией, фотодинамической терапией и внутривенными введениями ингибитора фактора роста эндотелия сосудов (пегаптаниб).
Риск наследованиявозрастной дегенерации макулы (ВМД)
Роль как генетических, так и средовых влияний показана близнецовыми исследованиями, конкордантность у монозиготных близнецов — 37%, значительно ниже 100%, ожидаемых для чисто генетического заболевания, но все же значительно больше, чем 19% конкордантности у дизиготных близнецов, что указывает на существенный генетический вклад в это заболевание. Родственники пациентов первой степени родства имеют в 4,2 раза больший риск болезни по сравнению с общей популяцией. Таким образом, возрастная дегенерация макулы (ВМД) входит в категорию генетических многофакторных болезней.
Несмотря на большое число подтверждений семейного накопления при возрастной дегенерации макулы (ВМД), наиболее тяжело пораженных индивидуумов выявляют не в семьях с четким менделирующим типом наследования.
Пример возрастной дегенерации макулы (ВМД). К.Д., 60-летняя женщина, обратилась к офтальмологу в связи со стандартным обследованием глаз. Она не осматривалась в течение 5 лет. К.Д. сообщила об отсутствии изменений в остроте зрения, но обратила внимание на более длинный период адаптации к изменению освещенности. Ее мать ослепла из-за возрастной дегенерации макулы (ВМД) в 70 лет. Больная выкуривает пачку сигарет за день. При обследовании сетчатки у нее выявлено множество друз (желтых отложений, обнаруживаемых под пигментным эпителием сетчатки).
Некоторые из них были большого размера и мягкие. Ей сообщили, что у нее есть начальные признаки возрастной дегенерации макулы (ВМД), вызывающей утрату центрального зрения, со временем приводящей к слепоте. Хотя специфического лечения для этого заболевания нет, как меру, предпринимаемую для замедления развития болезни, рекомендуют прекращение курения, прием антиоксидантов (витамины С, Е и бета-каротин) и цинка.
Возрастная дегенерация макулы — прогрессирующая болезнь участка сетчатки, ответственного за центральное зрение. Она вызывает слепоту у 1,75 млн американцев старше 50 лет. Болезнь характеризуется накоплением внеклеточных белковых отложений, так называемых друз, за сетчаткой в области желтого пятна (макулы).
Хотя существует подтверждение генетического вклада в болезнь, большинство больных с возрастной макулярной дегенерацией (ВМД) не происходят из семей с явно менделирующим типом наследования. Важен вклад окружающей среды — показан повышенный риск дегенерации макулы у курильщиков по сравнению с некурящими.
Геномный анализ ассоциации по схеме случай-контроль, использовавший только 100 000 SNP, обнаружил ассоциацию аллелей в двух частых SNP с возрастной макулярной дегенерацией (ВМД). Оба аллеля показали 4-кратное увеличение отношения шансов для болезни у обследованных гетерозиготных по любому из этих аллелей SNP и приблизительно 6-7 кратное увеличение отношения шансов для болезни у гомозигот для любой из аллелей риска.
Исследование данных НарМар обнаружило, что два SNP находятся в неравновесном сцеплении с блоком SNP размерами приблизительно в 41 килобазу в хромосоме 1. Оба SNP расположены в пределах интрона гена, кодирующего фактор комплемента Н (CFH), регулятор альтернативного пути активации комплемента. Просмотр SNP в неравновесном сцеплении с двумя SNP, показавшими положительную ассоциацию, обнаружил несинонимичный SNP, замену тирозина на гистидин в 402 позиции белка CFH (Tyr402His).
Мутация Tyr402His, встречающаяся с частотой 26-29% у белых и африканцев, показала более тесную ассоциацию с возрастной макулярной дегенерацией (ВМД), чем два SNP, использованные в оригинальном наборе SNP для геномного анализа ассоциации. Ассоциация Tyr402His с геном, кодирующим CFH, использована в других исследованиях ВМД типа случай-контроль, и оказалась ответственной за 43% всего генетического вклада в болезнь.
Учитывая, что друзы содержат фактор комплемента и CFH обнаруживается в тканях сетчатки вокруг друз, можно предположить, что вариант Tyr402His хуже защищает от нежелательного воспаления, считающегося ответственным за образование друз и патологию сетчатки. Таким образом, вероятно, Tyr402His — вариант в локусе CFH, ответственном за повышение риска ВМД.
На основе опыта работы с ассоциацией CFH были исследованы варианты других компонентов системы комплемента как возможные локусы возрастной дегенерации макулы (ВМД). Оказалось, что SNP в двух других генах системы комплемента, фактора В и фактора комплемента 2, защищают от ВМД; в обоих случаях некоторые из SNP изменяли аминокислотную последовательность и таким образом воздействовали на функцию белков, кодируемых этими генами. Считают, что варианты этих трех локусов вносят наибольший генетический вклад в эту болезнь.
На примере возрастной дегенерации макулы (ВМД) можно видеть, что полногеномный анализ ассоциации при комплексной болезни привел к идентификации тесно сцепленных частых SNP, оказавшихся в свою очередь в неравновесном сцеплении с частым кодирующим SNP в гене фактора комплемента Н, функционально включенным в развитие болезни. Это открытие, в свою очередь, привело к идентификации других SNP в системе комплемента, которые также предрасполагают или защищают от болезни.
Взятые вместе, эти результаты дают ключи к патогенезу возрастной дегенерации макулы (ВМД) и показывают, что метаболизм комплемента может быть удачной целью нового лечения. Ожидают, что значительное число генетических вариантов, ответственных за комплексные болезни, будут успешно идентифицированы методом полногеномного анализа ассоциаций с маркерами НарМар, что даст понимание и потенциальные терапевтические цели для многих частых болезней, вызывающих смертность и инвалидность в популяции.
Макулодистрофия (возрастная макулярная дегенерация) - симптомы и лечение
Что такое макулодистрофия (возрастная макулярная дегенерация)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Казанцевой Екатерины Игоревны, офтальмолога со стажем в 6 лет.
Над статьей доктора Казанцевой Екатерины Игоревны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Макулодистрофия (макулярная дегенерация, или макулопатия) — это обширная группа хронических прогрессирующих заболеваний, при которых постепенно поражается центральная зона нервной ткани глаза — макулярная область сетчатки. Сопровождается снижением центрального зрения. Как правило, поражает оба глаза.
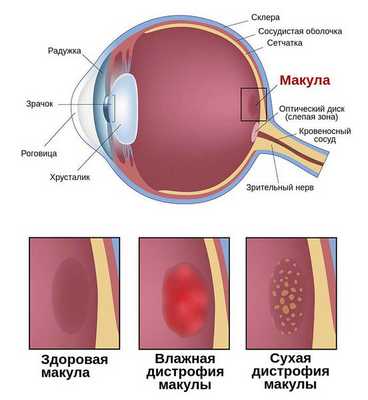
Заболевания, разрушающие макулярную область, входят в пятёрку главных причин снижения остроты зрения у взрослого населения России [1] . Одной из распространённых форм макулодистрофии является возрастная макулярная дегенерация, или, как её ещё называют, сенильная (старческая) макулодистрофия. Этой форме и посвящена данная статья.
Возрастная макулодистрофия — одна из основных причин необратимого ухудшения и потери зрения у людей старше 50 лет во всём мире [1] .
В основном данное заболевание поражает женщин, причём после 75 лет оно встречается в два раза чаще. Причина такой закономерности пока неизвестна.
В основе возрастной макулодистрофии лежит нарушение питания центральной зоны сетчатки. Причин такого нарушения множество. Прежде всего оно возникает в результате старения, о чём говорит связь частоты появления болезни с возрастом. Отдельная роль отводится наследственности [5] .
Другим доказанным фактором риска является курение. Отказ от этой пагубной привычки может снизить риск развития макулодистрофии в несколько раз [4] .
Также риск появления возрастной макулодистрофии повышают сердечно-сосудистые заболевания, особенно атеросклероз, атеросклеротические бляшки на сонной артерии и гипертоническая болезнь [6] .
Вероятность развития дистрофии повышается у людей, которые употребляют больше насыщенных жиров и холестерина, а также при высоком индексе массы тела. Ниже риск разрушения макулы у людей, потребляющих достаточное количество омега-3 полиненасыщенных жирных кислот — содержатся в морской рыбе, мясе диких животных, морских водорослях и др.
Одной из важных причин появления макулодистрофии является избыточная инсоляция — облучение солнечным светом. При попадании на сетчатку ультрафиолета коротковолнового или синего спектра видимого света в ходе фотохимических реакций формируются свободные радикалы. Они повреждают мембраны клеток, т. е. фоторецепторов [19] . В норме для защиты сетчатки от действия свободных радикалов в тканях присутствует антиоксидантная защита. При макулодистрофии в системе формирования свободных радикалов и антиоксидантной защиты возникает дисбаланс [8] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы макулодистрофии
При возрастной макулодистрофии зрение снижается постепенно и безболезненно в течение нескольких лет. Пациенты замечают снижение остроты зрения, которое не получается скорректировать подбором очков. Также появляются жалобы на затуманивание зрения, трудности при чтении, снижение контрастной чувствительности, особенно в помещении с плохим освещением или в сумерках.
Иногда при запущенных стадиях центральное зрение снижается до такой степени, что пациенты видят лишь боковым зрением или эксцентрично, а в центре — только чёрное или серое пятно.

На начальных стадиях развития возрастной макулодистрофии жалоб у пациентов может и не быть, поэтому заболевание становится находкой во время офтальмологического осмотра, проводимого по другому поводу [15] .
Патогенез макулодистрофии
Несмотря на многочисленные исследования возрастной макулодистрофии, патогенез этого заболевания до сих пор остаётся невыясненным. Но часть основных звеньев патогенеза всё же изучена.
C возрастом между слоями сетчатки откладываются продукты жизнедеятельности фоторецепторов — липофусцин, или пигмент "старости". Их называют друзами. Они возникают из-за ухудшения питания тканей и замедленного выведения из них продуктов обмена.
![Друзы [13]](/pimg3/geni-vozrastnoy-degeneratsii-DA6F.jpg)
Механизм формирования друз похож на процесс образования атеросклеротических бляшек артерий. Избыточное отложение липофусцина способствует повреждению пигментного эпителия и фоторецепторов, так как это вещество способно под воздействием света производить активные формы кислорода, включая перекисное окисление липидов. Этот процесс ещё больше усугубляется при большом количестве ультрафиолета [19] . В итоге повреждаются окружающие клетки и ткани.
Далее патогенез может пойти по одному из путей:
- возникают обширные участки атрофии сетчатки — формируется сухая форма заболевания;
- высвобождаются факторы роста сосудов или VEGF с развитием неоваскуляризации — формируется влажная форма макулодистрофии.
Все эти процессы протекают с выраженной дисфункцией макулы и резким ухудшением центрального зрения.
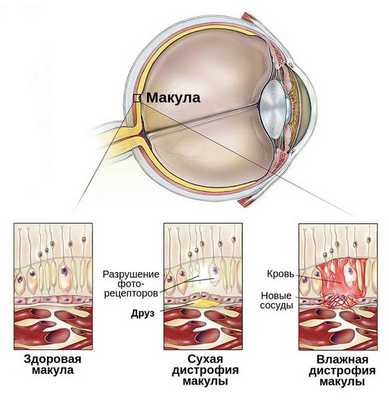
Классификация и стадии развития макулодистрофии
Разные подходы и взгляды на патогенез макулодистрофии, развитие методов диагностики стали причиной появления нескольких вариантов классификаций возрастной макулодистрофии.
Одна из международных классификаций была принята в 1995 году. В ней разделяли обширное понятие "возрастная макулодистрофия" следующим образом:
- ранние формы заболевания, или возрастная макулопатия — образование друз, диспигментация;
- поздние формы заболевания, или, собственно, сама возрастная макулярная дегенерация — географическая атрофия и хориоидальная неоваскуляризация — разрастание сосудов.
Но большинство офтальмологов в России используют в своей практике классификацию макулодистрофии, основанную на этапах развития дистрофического процесса. Кацнельсон Л. А. с соавторами выделяют три формы (стадии) заболевания [9] :
- Сухая форма (неэкссудативная). На начальном этапе может никак себя не клинически проявлять либо сопровождаться снижением центрального зрения при плохом освещении или в сумерках. Далее нарушение центрального зрения прогрессирует. Это проявляется наличием друз, дефектов пигментного эпителия, перераспределением пигмента, атрофией пигментного эпителия. На данном этапе заболевание может остановиться в своём развитии и не переходить в другие формы.
- Влажная форма (экссудативная). Она отличается процессами, которые возникают в ответ на прогрессивную отёк и ишемию сетчатки в виде неоваскуляризации сетчатки — разрастания сосудов. Является более агрессивной формой, чем сухая, и влечет за собой более быстрое и прогрессивное ухудшение центрального зрения. Проявляется быстрым снижением центрального зрения, искривлением предметов, появлением серого пятна перед глазом.
- Рубцовая форма. Является финалом заболевания. Проявляется стойким снижением остроты зрения вплоть до потери центрального зрения. Пациенты зачастую видят периферией или эксцентрично. Под сетчаткой формируется грубая соединительная ткань на фоне ранее новообразованных сосудов. Атрофируется пигментный эпителий и слой фоторецепторов, в результате чего макулярная зона становится нефункциональной или малофункциональной.
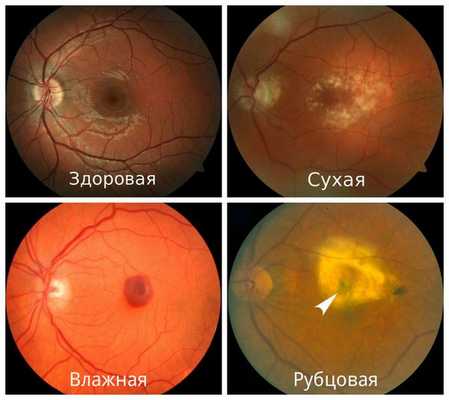
Осложнения макулодистрофии
Так как заболевание на начальных стадиях протекает практически бессимптомно, очень высок риск того, что впервые макулодистрофия обнаружится только тогда, когда сетчатка уже будет достаточно повреждена. Это состояние будет сопровождаться стойким снижением остроты и качества центрального зрения.
К тому же при нерегулярных осмотрах врача-офтальмолога можно пропустить переход возрастной макулодистрофии из сухой формы во влажную, из-за чего пациент не получит своевременное и эффективное лечение.
Осложняет ситуацию то, что сетчатка очень чувствительна к ишемии, которая усугубляется из-за прогрессирующей болезни. Если не провести эффективное лечение, то время до полного ухудшения макулодистрофии может исчисляться в месяцах. Поэтому при несвоевременном обращении за специализированной помощью пациент необратимо теряет центральное зрение на один глаз, и получает высокий риск развития данного заболевания и аналогичного исхода на втором глазу. В результате человек становится инвалидом [16] .
Диагностика макулодистрофии
Первым этапом диагностики является самодиагностика с помощью теста Амслера. Для этого пациент располагает тест на расстоянии 15-20 см от лица, сосредотачивает свой взгляд на центральной точке, прикрывает ладонью один глаз и оценивает квадраты и линии вокруг точки: есть ли искривления, искажения, все ли квадраты одинаковое или появились серые пятна. Потом тоже самое он повторяет и для второго глаза.
Такой периодический самоконтроль должен проводить каждый пациент с сухой формой возрастной макулодистрофии. При первых признаках искажений линий требуется немедленное обратиться к специалисту.

На картинке справа проиллюстрировано то, как видит тест Амслера пациент с сухой макулодистрофией развитой стадии или с рисками перехода из сухой формы во влажную; слева — зрение пациента без макулодистрофии или на начальных стадиях сухой формы болезни.
В целом диагностика возрастной макулодистрофии базируется на основных и дополнительных методах исследования.
Основные данные врач получает при стандартном офтальмологическом осмотре:
- сбор жалоб;
- уточнение истории болезни;
- оценка зрительных функций и данных офтальмоскопии, а лучше — биомикроофтальмоскопии (осмотр глазного дна).
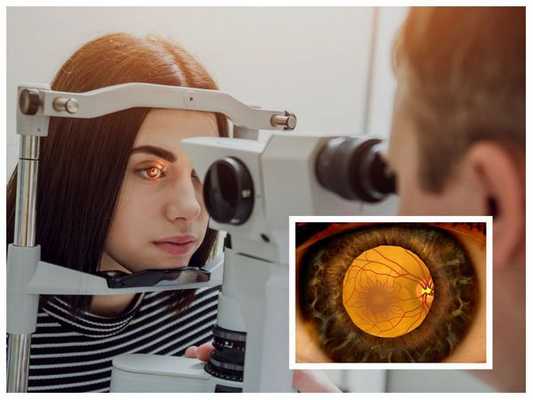
К дополнительным методам диагностики относятся:
- флуоресцентная ангиография;
- ангиография с индоцианином зелёным;
- оптическая когерентная томография сетчатки;
- электроретинография.
Наиболее информативными методами выявления патологии сетчатки являются флуоресцентная ангиография и ангиография с индоцианином зелёным. Они визуализируют новообразованные сосуды, состояние пигментного эпителия и кровеносного русла глазного дна в целом. Для проведения этих двух методик использую различные модели фотокамер, а также флуоресцеин или индоцианин зелёный, которые вводят внутривенно перед исследованием. Однако при планировании и проведении данных манипуляций стоит помнить, что эти препараты могут вызывать аллергические реакции и другие побочные эффекты. Поэтому отбор пациентов для таких видов исследований должен быть тщательным.
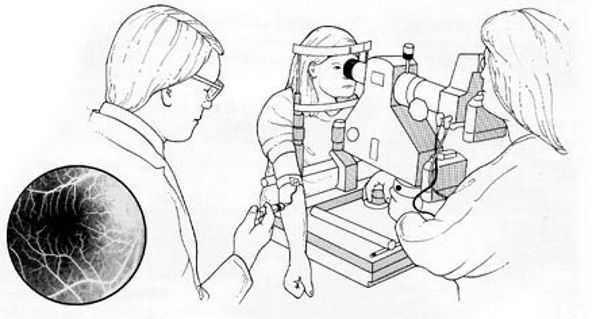
Противопоказания к ангиографии:
- а ллергические реакции в анамнезе; в стадии обострения;
- заболевания сердечно-сосудистой системы в стадии обострения;
- острый и хронический гломерулонефрит ; в стадии обострения;
- хроническая почечная недостаточность в стадии обострения;
- беременность и кормление грудью.
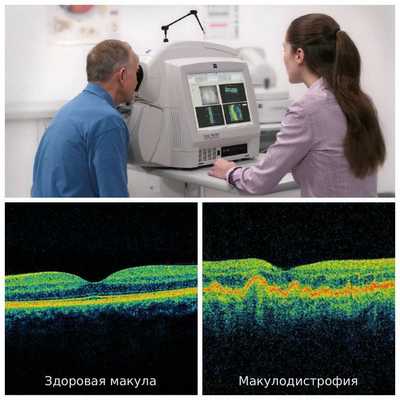
Наиболее информативным и безопасным методом диагностики для пациента является оптическая когерентная томография (ОКТ). Она используется для оценки морфологической и топографической оценки макулярной зоны, показывает структурные изменения сетчатки. Этот способ позволяет не только выявить начальные проявления возрастной макулодистрофии, такие как друзы и дефекты пигментного эпителия, но и уже явные признаки влажной формы болезни — отслойку пигментного эпителия и нейроэпителия, появление новых сосудов под сетчаткой. Эти данные являются основными показателями эффективности лечения, с помощью который оценивается дальнейшая тактика ведения пациента [2] .
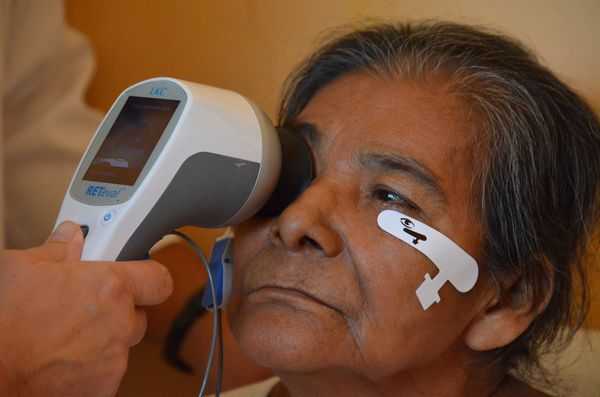
Для определения степени функционального поражения сетчатки центральной зоны используется электроретинография (ЭРГ). Она может проводиться на начальных этапах болезни, когда морфологические изменения ещё не заметны, но уже присутствуют симптомы. Хотя, как показывает практика, функциональные нарушения в слоях сетчатки при возрастной макулодистрофии в явной степени появляются только на развитых и далеко зашедших стадиях заболевания [10] [11] .
Лечение макулодистрофии
Несмотря на большие успехи в диагностике возрастной макулодистрофии на ранних этапах развития, лечение этой патологии остаётся проблемой. Ни один из существующих вариантов лечения не способен полностью предупредить развитие возрастной макулодистрофии. FDA (управление по санитарному надзору за качеством пищевых продуктов и медикаментов) не одобрило ни одного лекарства от сухой макулодистрофии [14] .
При высоких рисках развития и начальных стадиях сухой макулодистрофии в первую очередь рекомендуется проводить курсы антиоксидантной терапии [18] . Они позволяют нормализовать обменные процессы и увеличить антиоксидантную защиту сетчатки. Согласно результатам исследований, лечение антиоксидантами и микроэлементами (цинком и медью) при продолжительных курсах снижают частоту развития поздних стадий возрастной макулодистрофии почти на четверть [12] .
Среди веществ с антиоксидантным эффектом, защищающих сетчатку от окислительного стресса и развития макулодистрофии, главное место занимают каротиноиды. Организм человека не способен синтезировать данные вещества, поэтому их количество в клетках сетчатки напрямую зависит от качества пищи. Каротиноиды содержатся в моркови, цитрусах, томатах, шпинате, кукурузе. Из поступаемой пищи только зеаксантин и лютеин транспортируются белками плазмы крови в фоторецепторы сетчатки, где они уже формируют жёлтый пигмент — ксантофилл. Он как раз и является главной защитой при окислительном стрессе, блокируя ультрафиолет [9] [13] . Также антиоксидантным воздействием на сетчатку обладают антоцианозиды, которые содержатся в экстракте плодов черники.
Для того, чтобы данные витаминно-минеральные комплексы работали, необходимо, чтобы все компоненты находились в правильных пропорциях: лютеин — минимум 2 мг, антоцианы — минимум 10 мг, цинк — более 10 мг, медь — менее 1 мг.
Однозначного ответа о длительности курсового лечения нет. По мнению некоторых авторов, витаминно-минеральные комплексы идут как заместительная терапия, их следует принимать постоянно [4] .
Как показали результаты всемирных клинических исследований, анти-VEGF препараты эффективны в отношении остроты зрения по сравнению с другими методами лечения — использования глюкокортикостероидов, лазерного лечения и др. Поэтому они заслуженно стали препаратами первой линии выбора при лечения влажной макулодистрофии, причиной которой является образование новых кровеносных сосудов.
Прогноз. Профилактика
Пациентам с сухой возрастной макулодистрофией рекомендуется принимать добавки с антиоксидантами — каротиноиды, витамины, микроэлементы. При лечении влажной формы болезни одним из главных и решающих факторов является время, так как перспектива лечения будет напрямую зависеть от своевременно начатой эффективной терапии, т. е. от начала постановки ингибиторов VEGF. Чем раньше начато правильное лечение, тем лучше результат. Терапевтическим окном считают один год от начала заболевания. Важен ежемесячный мониторинг показателей остроты зрения, данных ОКТ и биомикроофтальмоскопии для оценки необходимости повторных инъекций после стандартной "загрузочной дозы".
Стандартное ведение сухой возрастной макулодистрофии предполагает самоконтроль пациента с помощью теста Амслера, регулярные осмотры один раз в 6-12 месяцев с контролем остроты зрения и проведением биомикроофтальмоскопии, а также приём антиоксидантов. Регулярные осмотры позволят как можно раньше выявить признаки перехода болезни из сухой формы во влажную.
Не смотря на довольно простые меры профилактики влажной формы заболевания, меньше половины пациентов в России получают регулярное лечение сухой макулодистрофии, остальные либо получают его нерегулярно, либо оставляют заболевание вовсе бесконтрольным (18,2 %) [14] .
Курсовое лечение сухой макулодистрофии в условиях стационара не имеет смысла, так как весь объём наблюдений и необходимой замещающей терапии можно выполнять на уровне поликлиники.
Для профилактики возрастной макулодистрофии требуется ещё в молодом возрасте исключить факторы риска: курение, наличие в рационе большого количества насыщенных жирных кислот, избыточную инсоляцию. Если факторы риска не удалось исключить, то после 50-ти лет нужно начинать профилактический приём витаминно-минеральных комплексов с каротиноидами.
Читайте также:
- Критика или критиканство. Как научиться грамотно критиковать?
- Предраковые состояния желудка - диагностика кишечной метаплазии
- Диагностика двойни. Сосудистые анастомозы в монохориальной плаценте. Фето-фетальный трансфузионный синдром.
- Лучевая диагностика инфаркта почки
- Примеры кровоизлияния, симулирующей меланому хориоидеи
