Гепатопульмональный синдром
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Журнал имени Г.Н. Сперанского
издается с мая 1922 года
Каталог
2017 / Том 96 / № 6
Е.И. Кондратьева, О.М. Цирульникова, А.Ю. Воронкова, О.И. Маломуж, Н.А. Ильенкова, Н.Ю. Каширская, В.Д. Шерман
Н.В. Петрова, Н.Ю. Каширская, Т.А. Васильева, А.Ю. Воронкова, Е.И. Кондратьева, В.Д. Шерман, О.Г. Новоселова, С.А. Красовский, А.В. Черняк, Е.Л. Амелина, Е.К. Гинтер, С.И. Куцев, Р.А. Зинченко
И.Н. Протасова, С.В. Домрачева, О.Ю. Волкова, В.А. Каленский, О.В. Перьянова, О.Ф. Веселова, Е.Н. Бочанова, Т.А. Елистратова, Н.В. Бахарева, С.В. Сидоренко
Ю.А. Козлов, В.А. Новожилов, И.Н. Вебер, К.А. Ковальков, Д.М. Чубко, А.А. Распутин, П.Ж. Барадиева, А.Д. Тимофеев, Д.А. Звонков, А.В. Елисеев, Е.В. Полуконова, М.М. Шароглазов
Д.Ю. Овсянников, Д.Ю. Николаева, М.Г. Кантемирова, О.А. Коровина, А.А. Глазырина, Д.Ф. Быков, П.А. Фролов, М. Даниэл-Абу, С.М. Семятов, И.Е. Колтунов
Л.В. Горленко, Г.Н. Янкина, Т.В. Давыдова, С.В. Вторушин, Е.В. Лошкова, Е.И. Кондратьева, В.А. Желев, Т.С. Кривоногова
Н.Е. Щиголева, А.П. Пономарева, Н.С. Рачкова, Е.В. Костырко, П.В. Шумилов, А.А. Бологов, Е.Ю. Сергиенко
Л.А. Федорова, Е.С. Пушкова, С.Б. Зимин, И.А. Корсунский, Н.В. Зиновьева, А.П. Продеус, А.А. Корсунский
И.Г. Тулузановская, Н.А. Жученко, М.С. Балашова, М.И. Филимонов, Т.П. Розина, О.С. Глотов, А.Ю. Асанов
Коллектив кафедры педиатрии РМАНПО, педиатрического факультета РМАНПО, сотрудники ДГКБ им. З.А. Башляевой, многочисленные выпускники кафедрыпедиатрии РМАНПО, члены редколлегии журнала Педиатрия
Искать статью, автора
СТАТЬИ ПО НАЗВАНИЯМ
Архив журнала
Пресс-конференция к 100-летию журнала «Педиатрия» имени Г.Н. Сперанского»
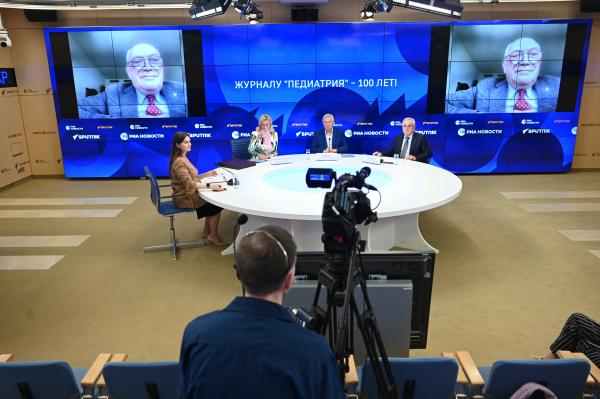
Состоялся выпуск специальной программы на телеканале "Россия сегодня", посвященный 100-летию журнала «Педиатрия» имени Г.Н. Сперанского».
РУМЯНЦЕВ Александр Григорьевич - ЗАСЛУЖЕННЫЙ ВРАЧ РОССИЙСКОЙ ФЕДЕРАЦИИ
Указом Президента Российской Федерации, за заслуги перед государством и многолетнюю добросовестную работу присвоено почетное звание «ЗАСЛУЖЕННЫЙ ВРАЧ РОССИЙСКОЙ ФЕДЕРАЦИИ» РУМЯНЦЕВУ Александру Григорьевичу
Обновление разделов сайта
Российская научно-практическая конференция «Менингококковая инфекция - недооцененные проблемы. Другие бактериальные и вирусные поражения нервной системы» 15-16 февраля 2022 г

Мы приглашаем принять участие всех желающих 15-16 февраля в Российской научно-практической конференции «Менингококковая инфекция - недооцененные проблемы. Другие бактериальные и вирусные поражения нервной системы».
Материалы сайта предназначены для лиц 18 лет и старше.
Адрес для корреспонденции: 115054, Москва, М-54, а/я 32.
Индексы для индивидуальных подписчиков: 71458, 71695 (год)
Индексы для предприятий и организаций: 71459, 71696 (год)
Международный индекс:
ISSN 0031-403X (Print)
ISSN 1990-2182 (Online)
Импакт-фактор журнала можно уточнить на сайте: www . elibrary . ru
Гепатопульмональный синдром

В настоящее время наблюдается неуклонный рост числа больных с заболеваниями печени, которые в большинстве случаев сопровождаются возникновением различных осложнений вплоть до появления печеночной недостаточности. В частности хроническая печеночная недостаточность может развиваться практически при всех заболеваниях печени, но чаще наблюдается при циррозе печени (ЦП). Течение ЦП подразумевает формирование синдромов и симптомов, которые проявляются в той или иной мере. Одним из синдромов, который встречается у больных с ЦП, является гепатопульмональный синдром (ГПС). Изучая литературные данные необходимо отметить, что примерно у 70% больных с ЦП наблюдается одышка. Более детальный осмотр и исследование газового состава крови позволяет обнаружить отклонение от нормы у 45% больных с ЦП, которые являются кандидатами на трансплантацию печени (ТП) [1].
Гепатопульмональный синдром – это синдром, имеющий определенный симптомокомплекс, включающий патологическое артерио-венозное шунтирование в сосудах легких, артериальную гипоксемию и заболевание печени и/или портальную гипертензию.
Впервые связь между легочной патологией и заболеваниями печени была обнаружена в 1884 году. Однако, термин ГПС был использован в клинической практике только в 1977 году когда была обнаружена дилатация легочных сосудов [1,2].
В настоящее время выделяют два типа ГПС:
1-й тип ГПС характеризуется диффузной дилатацией прекапиллярного русла легких. Ингаляция кислорода улучшает оксигенацию крови.
2-й тип ГПС связан с дилатацией артериол и формированием артерио-венозных шунтов. Ингаляция кислорода не обладает положительным эффектом.
Патологические изменения в легких у больных с ЦП впервые были описаны Berthelot P. et al. (1966). Berthelot P. et al. установил наличие тотальной дилатации сосудов в легких [9].
В настоящее время рассматривают три основных патологических процесса, которые приводят к нарушению газообмена в легких при ГПС: нарушение вентиляционно-перфузионного отношения, снижение диффузии кислорода и наличие патологических артерио-венозных шунтов в легких [10].
Нарушение вентиляционно-перфузионного отношения возникает в результате дилатации сосудов в легких. Это приводи к тому, что молекулы кислорода не достигают эритроцитов, которые находятся в центре капилляра. Данная ситуация провоцируется и поддерживается гипердинамическим типом кровообращения. В результате гипердинамического типа кровообращения возрастает скорость кровотока в легочных капиллярах, а это в свою очередь приводит к уменьшению времени, отведенному на диффузию молекулы кислорода через альвеолярно-капиллярную мембрану в направлении к эритроциту [9]. Дополнительная ингаляция кислорода позволяет создать давление, которое помогает молекуле кислорода достигнуть центра капилляра [9].
Патологические внутрилегочные артерио-венозные шунты приводят к сбросу венозной крови в легочные вены, что усугубляет явления гипоксемии. В норме артерио-венозные шунты не превышают 5% [4,7,8,11]. При ЦП и ПГ под влиянием вазоактивных веществ происходит формирование патологических шунтов.
По литературным данным основную роль в патогенезе ГПС играют вазоактивные субстанции, такие как окись азота (NO), эндотелин-1 (ЕТ-1), фактор некроза опухоли (TNF-α), окись углерода (СО) и другие вазоактивные пептиды. Вазодилататоры в результате патологии печени не поддаются инактивации и поступают в системный кровоток [1,9].
NO играет ведущую роль в формировании и поддержании вазодилатации у больных с ЦП. NO синтезируется в эндотелии из L-аргинина при участии NO синтетазы. С увеличение концентрации NO связывают дилатацию сосудов легких, снижение сосудистого сопротивления, формирование стойких участков патологических артерио-венозных шунтов [9,11]. Роль NО в патогенезе ГПС доказана в результате проведенных исследований. В-первых фиксируется высокая концентрация NO в выдыхаемом воздухе у больных с ЦП и ГПС. Во-вторых, установлено, что после ТП концентрация NO в крови снижается, одновременно происходит уменьшение вазодилатации, внутрилегочного шунтирования и повышается насыщение артериальной крови кислородом [9,12].
Транслокация эндотоксинов из просвета кишечника в системный кровоток способствует повышению уровня воспалительных цитокинов, включая TNF-α [12]. Высокая концентрация эндотоксинов в крови наблюдается у 30% больных с ЦП Класса С [13].
ЕТ-1 синтезируется эндотелиальными клетками и может играть определенную роль в дилатации внутрилегочных сосудов [14]. В норме ЕТ-1 синтезируется печенью и принимает участие в регуляции сосудистого тонуса в результате взаимодействия с рецепторами ЕТА и ЕТВ. В гладкой мускулатуре сосудов располагаются рецепторы ЕТА, которые в результате их активации вызывают вазоконстрикцию. Рецепторы ЕТВ находятся в эндотелии легочных сосудов и обладают вазодилатирующим эффектом. Таким образом, баланс, поддерживаемый ЕТ-1, позволяет регулировать сосудистый тонус [14]. Лабораторные данные показали, что при заболеваниях печени вызывают в сыворотке крови обнаруживается высокая концентрация ЕТ-1 [15,16]. ЕТ-1 поступает в легочный кровоток, воздействует на рецепторы ЕТВ, вызывая дилатацию легочных сосудов [17].
Экспериментальные данные доказали роль ЕТ-1 и TNF-α в патогенезе ГПС. Воспроизведение ЦП в эксперименте в результате перевязки общего желчного протока продемонстрировало высокую концентрацию данных вазодилататоров и формирование ГПС [15,16,17].
Еще одним веществом, обладающим вазодилатирующим эффектом является СО. Уровень карбоксигемоглобина у больных с ГПС остается высоким, что служит доказательством того, что СО может способствовать внутрилегочной вазодилатации [18].
Таким образом, увеличение концентрации вазоактивных субстанций приводит к дилатации сосудов легких, снижению сосудистого сопротивления и формированию стойких патологических артерио-венозных шунтов [2,19].
Клинические симптомы ГПС включают в себя наличие заболевания печени и/или проявления ПГ, а также цианоз, одышку, которая уменьшается в положении лежа (платипноэ), изменения дистальных фаланг пальцев по типу «барабанных палочек» и «часовых стекол». Еще одной особенностью течения ГПС является ортодеоксия, т.е. ухудшение насыщения кислородом артериальной крови при переходе из горизонтального положения в вертикальное [1,9].
Диагностические критерии, которые могут подтвердить данный диагноз, включают в себя оценку газового состава крови, как в вертикальном, так и горизонтальном положении, контрастную эхокардиографию, радиоизотопное сканирование, пульмоноангиографию [7,20,21,22].
Исследования газового состава крови могут подтвердить диагноз ГПС. Особое значение в исследовании газового состава крови придается больным, которые являются кандидатами на ТП. Исследование газового состава крови является обязательным для выявления ГПС у больных с ЦП [23,24]. Наиболее простым и неинвазивным методом диагностики является пульсоксиметрия. Пульсоксиметрия позволяет выявить гипоксемию у больных с ЦП [23,25]. Больным с ЦП, у которых предполагается наличие ГПС, исследуется газовый состав крови в вертикальном и горизонтальном положении. Ортодеоксия проявляется снижением РаО2 более чем на 5% при переходе из горизонтального в вертикальное положение тела [26].
В настоящее время существуют два основных метода диагностики артерио-венозных анастомозов и дилатации легочных сосудов, которые могут подтвердить диагноз ГПС: контрастная эхокардиография и сканирование легких с использованием радиоактивного макроагрегатного альбумина (МАА) [21].
В основе контрастной эхокардиографии лежит внутривенное введение микропузырьков, полученных в результате встряхивания раствора. Размер микропузырьков превышает 25 мкм и поэтому задерживается в капиллярах легких, диаметр которых в норме не превышает 5-8 мкм. Появление микропузырьков в левых отделах сердца может указывать на патологию сердца (дефект межжелудочковой или межпредсердной перегородки) или на дилатацию сосудов легких и артерио-венозный шунт. При дефекте перегородок сердца микропузырьки поступают в левые отделы сердца в течение 3-х сердечных циклов от момента введения раствора. Визуализация микропузырьков между 4-м и 6-м сердечными циклами указывает на патологию легких и соответственно позволяет диагностировать ГПС [27,28].
Вторым методом, позволяющим диагностировать внутрилегочную сосудистую патологию, является радиоизотопное сканирование легких с использованием МАА, меченым технецием 99 [29]. Диаметр МАА от 10 до 90 мкм и в норме задерживается в сосудах легких. У больных с внутрилегочной вазодилатацией и артерио-венозным шунтом МАА накапливается в головном мозге, почках, печени, селезенке [9,17].
Исследование опубликованное Hopkins W.E. et al. (1992) демонстрирует сравнительный анализ эффективности данных методик. По данным автора у 15 из 40 больных с ЦП были выполнены исследования. Контрастная эхокардиография позволила выявить ГПС у 7 из 15 больных (46%). Радиоизотопное сканирование легких подтвердило наличие ГПС только у 3 из 15 больных (20%) [29].
Таким образом, контрастная эхокардиография является в настоящее время методом выбора для диагностического поиска и верификации ГПС.
Пульмоноангиография оказывается информативной у больных с большими артерио-венозными шунтами, когда наблюдается тяжелая гипоксемия при отсутствии ответа на ингаляцию 100% кислорода (прирост РаО2
Рентгенография легких может показать усиление легочного рисунка в нижних отделах легких.
Компьютерная томография с высоким разрешением используется для исключения у больных легочной патологии. Однако, отсутствие сосудистой аномалии не может исключить ГПС [9].
Рассматривая возможные варианты лечения ГПС, следует отметить, что в настоящее время отсутствует эффективная терапия ГПС. Основываясь на представлении о патогенезе ГПС, где ведущая роль отводится вазодилататорам, были предложены разные варианты медикаментозной терапии. В литературе можно найти упоминания об использовании N-нитро-L-аргинин метилового эфира, метиленового синего, сомастотина [15,17]. Однако, эффективность препаратов оказалась не достаточно высокой и носила кратковременный характер [2,19,31,32].
Учитывая возможную роль эндотоксемии и TNF-α в развитии ГПС предпринимались попытки улучшить оксигинацию крови в результате деконтаминации кишечника или применения пентосксифиллина в качестве ингибитора TNF-α [1,33]. Данное исследование не продемонстрировало ожидаемого результата в виде улучшения газообмена [34,35].
Анализ литературы показал, что определенное место в лечении больных с ГПС отводится хирургическим методам, среди которых часто упоминается чрезъяремное внутрипеченочное портосистемное шунтирование (transjugular intrahepatic portosystemic shunt-TIPS) и селективная эмболизация артерио-венозных шунтов [7,36].
TIPS позволяет провести эффективную декомпрессию портальной системы, так как способствует частичному сбросу крови в системный кровоток и снижению портального давления, поэтому широко используется у больных с ЦП и ПГ. Первые результаты применения TIPS у больных с ГПС носили обнадеживающий характер, так как демонстрировали улучшение газообмена [37]. Однако, отдаленные результаты не продемонстрировали достаточных положительных результатов, поэтому роль TIPS в лечении ГПС остается не доказуемой [9,32].
Литературные данные демонстрируют положительные результаты, которые достигаются в результате эмболизации отдельных артерио-венозных шунтов [9,38].
В качестве временной поддерживающей терапии при тяжелых формах гипоксемии используется ингаляция увлажненным кислородом. Оксигенотерапия применяется у больных, которые находятся в листе ожидания ТП [21].
ТП в настоящее время остается единственным эффективным методом лечения ГПС. Согласно литературным данным примерно в 80% случаев отмечается положительная динамика течения ГПС после ТП [1,33]. Снижение уровня артериальной гипоксекии может наблюдаться в течение года после ТП. Ряд авторов продемонстрировали, что РаО220% являются предиктором высокой летальности (>67%) после ТП [5,39]. Данное заключение легло в основу концепции «трансплантационное окно» для больных с ГПС. В соответствии с концепцией показатель РаО2
ГПС является фактором, ухудшающим прогноз у больных с ЦП. Летальность среди данной категории больных выше, чем у больных с ЦП, но без ГПС [5,40]. Исследование, представленное Swanson K.L. et al. (2005), демонстрирует правомочность данного заключения. После ТП 5-и летняя выживаемость больных с ГПС не превышает 23%, выживаемость больных без ГПС составляет 63% [5]. Наблюдения показали, что больные с тяжелой гипоксимией и РаО2
ГПС оказывает серьезное влияние на прогноз и продолжительность жизни больных с ЦП и ПГ. Современные представления о патогенезе и механизмах развития вазодилатации лежат в основе попыток выработать эффективный вид терапии. На сегодняшний день единственным методом лечения, который способен повлиять на течение заболевания, является ТП. Учитывая несоответствие между количеством больных, нуждающихся в ТП и возможностью предоставить донорский орган, поиски медикаментозной терапии ГПС остаются актуальными.
Гепатопульмональный синдром у женщины с циррозом печени
Гепатопульмональный синдром (ГПС) является тяжелым осложнением терминальных заболеваний печени. ГПС включает в себя триаду следующих признаков: заболевания печени; дилатация легочных сосудов; гипоксемия (при отсутствии кардиореспираторных заболеваний). Клиническим проявлением ГПС является цианоз, изменение концевых фаланг пальцев в виде барабанных палочек и платипноэ на фоне цирроза печени (ЦП). Представлено клиническое наблюдение ГПС у молодой женщины с ЦП, который разрешился после проведения ортотопической трансплантации печени.
Ключевые слова
Об авторах
Федеральное государственное бюджетное образовательное учреждение высшего образования «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Министерства здравоохранения Российской Федерации
Россия
Чучалин Александр Григорьевич – доктор медицинских наук, профессор, академик Российской академии наук, заведующий кафедрой госпитальной терапии педиатрического факультета Федерального государственного бюджетного образовательного учреждения высшего образования «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Министерства здравоохранения Российской Федерации, председатель правления Российского респираторного общества
117997, Москва, ул. Островитянова, 1
Государственное бюджетное учреждение здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края
Россия
Мирцхулава Нона Георгиевна – кандидат медицинских наук, врач-пульмонолог, заведующая пульмонологическим отделением
350012, Краснодар, ул. Красных Партизан, 6 / 2
Государственное бюджетное учреждение здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края
Россия
Дремов Денис Викторович – врач-пульмонолог пульмонологического отделения
350012, Краснодар, ул. Красных Партизан, 6 / 2
Государственное бюджетное учреждение здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края
Россия
Панасенкова Юлия Сергеевна – кандидат медицинских наук, врач-пульмонолог пульмонологического отделения
350012, Краснодар, ул. Красных Партизан, 6 / 2
Список литературы
1. Кrowka M.J. Hepatopulmonary syndromes. Gut. 2000; 46 (1): 1–4. DOI: 10.1136/gut.46.1.1.
2. EASL Clinical Practice Guidelines: Liver transplantation. J. Hepatol. 2016; 64 (2): 433–485. DOI: 10.1016/j.jhep.2015.10.006.
3. Schenk P., Schöniger-Hekele M., Fuhrmann V. et al. Prognostic significance of the hepatopulmonary syndrome in patients with cirrhosis. Gastroenterology. 2003; 125 (4): 1042–1052. DOI: 10.1016/s0016-5085(03)01207-1.
4. Seward J.B., Hayes D.L., Smith H.C. at al. Platypnea-orthodeoxia: clinical profile diagnostic workup, management and report of seven cases. Mayo Clin. Proc. 1984; 59 (4): 221–231. DOI: 10.1016/s0025-6196(12)61253-1.
5. Авдеев С.Н. Гепатопульмональный синдром. Consilium Medicum. 2016; 18 (3): 30–35. DOI: 10.26442/2075-1753_2016.3.30-35.
6. Ивашкин В.Т., Морозова М.А., Маевская М.В. Гепатопульмональный синдром. Трансплантология. 2009; (2): 5–8.
7. Robin E.D., Laman D., Horn B.R., Theodore J. Platipnea related to orthodeoxia caused by true vascular lung shunts. N. Engl. J. Med. 1976; 294 (17): 941–943. DOI: 10.1056/NEJM197604222941711.
8. Bruix J., Bosch J., Kravetz D. et al. Effects of prostaglandin inhibition on systemic and hepatic hemodynamic in patients with cirrhosis of the liver. Gastroenterology. 1985; 88 (2): 430–435. DOI: 10.1016/0016-5085(85)90503-7.
9. Cremona G., Higenbottam T.W., Mayoral V. et al. Elevated exhaled nitric oxide in patients with hepatopulmonary syndrome. Eur. Respir. J. 1995; 8 (11): 1883–1885. DOI: 10.1183/09031936.95.08111883.
10. Gotway M., Dotson R., Dawn S. et al. Hypoxemia in a patient with end-stage liver disease. Clin. Pulm. Med. 2005; 12 (1): 61–66. DOI: 10.1097/01.cpm.0000151446.75296.3e.
11. Davis H.H., Schwart D.J., Lefrak S.S. et al. Alveolar-capillary oxygen disecuilibrium in hepatic cirrhosis. Chest. 1978; 73 (4): 507–511. DOI: 10.1378/chest.73.4.507.
13. Offer J., Green L., Houghton A.R., Campbell J. A case of hepatopulmonary syndrome. Echo. Res. Pract. 2015; 2 (2): K25–27. DOI: 10.1530/ERP-14-0100.
14. Kamath P.S. Portopulmonary hypertension and hepatopulmonary syndrome. J. Gastroenterol. Hepatol. 2002; 17 (Suppl. 3): S253–255. DOI: 10.1046/j.1440-1746.17.s3.9.x.
15. Abrams G.A., Nanda N.C., Dubovsky E.V. et al. Use of macroaggregated albumin lung perfusion scan to diagnose hepatopulmonary syndrome: a new approach. Gastroenterology. 1998; 114 (2): 305–310. DOI: 10.1016/S0016-5085(98)70481-0.
17. Rodrigues-Roisin R., Krowka M.J.? Hervé P. et al. Pulmonary-Hepatic vascular Disorders (PHD). Eur. Respir. J. 2004; 24 (5): 861–880. DOI: 10.1183/09031936.04.00010904.
Гепатопульмональный синдром - современное состояние проблемы Текст научной статьи по специальности «Клиническая медицина»
The article highlights the main causes, mechanisms of hepatopulmonary syndrome, its clinical manifestations and diagnostic methods. The modern approaches to treatment and unfavorable prognosis of this serious complication of chronic liver disease and / or portal hypertension.
Похожие темы научных работ по клинической медицине , автор научной работы — Григоренко Е. И.
Hepatopulmonary syndrome - current state of problem
The article highlights the main causes, mechanisms of hepatopulmonary syndrome, its clinical manifestations and diagnostic methods. The modern approaches to treatment and unfavorable prognosis of this serious complication of chronic liver disease and / or portal hypertension.
Текст научной работы на тему «Гепатопульмональный синдром - современное состояние проблемы»
Гепатопульмональный синдром - современное состояние проблемы
Крымский государственный медицинский университет им. С.И. Георгиевского, Симферополь
Ключевые слова: цирроз печени, портальная гипертензия, гепатопульмональный синдром
Изменения в системе кровообращения, связанные с циррозом печени лежат в основе не только портальной гипертен-зии, но и расстройств циркуляции во всех органах, включая легкие. Вовлечение сосудов малого круга кровообращения у больных с портальной гипертен-зией ведет к развитию гепатопульмо-нального синдрома (ГПС) или порто-пульмональной гипертензии, которые являются её серьёзным осложнениями с высоким риском летальности.
Под ГПС понимают нарушение функции легких у больных с печеночной недостаточностью или циррозом печени, которое характеризуется артериальной гипоксемией (Ра О2 < 70 мм рт ст) в покое, обусловленной внутрилегочным артериовенозным шунтированием или выраженной дилятацией легочных капилляров и нарушением вентиляцион-но-перфузионных отношений [2].
Распространенность ГПС, по различным литературным данным, широко варьирует и колеблется в пределах от 4 до 80% [1,3,4]. В определённой мере это зависит от применяемых диагностических критериев и контингентов обследованных. Так, распространенность ГПС у лиц, нуждающихся в трансплантации печени, составляет 18%, а находящихся в месте ожидания достигает 80% [5]. Наиболее часто ГПС развивается у больных циррозом печени с явлениями портальной гипертензии, но он может наблюдаться также у лиц с хроническими и острыми формами гепатитов без признаков портальной гипертен-зии [6,7,8,9]. Описаны случаи ГПС при внепеченочной портальной гипертензии - при синдроме Бадда-Киари [8].
У больных с хроническим заболеванием печени, особенно на далеко зашедших стадиях, гипоксемия может быть обусловлена многими причинами. Это и цирротическая кардиомиопатия, и ограничение экскурсии легких в результате
выраженного асцита, гидроторакса или уменьшения мышечной массы, и непосредственное поражение бронхо-легочной системы воспалительным процессом (пневмония, бронхит) [11]. Диагноз же ГПР является правомочным при соблюдении трех критериев: наличия артериальной гипоксемии, дилята-ции сосудов легких и заболевания печени и/или портальной гипертензии [1,3].
Механизм развития ГПС сложен и не до конца изучен. Не вызывает сомнений связь между портальной гипертензией и дилятацией легочных сосудов. При портальной гипертензии имеет место транслокация грамм-негативных бактерий и эндотоксинов, что ведет к активации высвобождения медиаторов воспаления - TNF, а также NO, которые проявляют свои вазоактивные свойства. Ключевая роль повышения продукции NO в легких в патогенезе ГПС подтверждена многими экспериментальными и клиническими исследованиями ([6,11). Прогрессированию ГПС способствует также система эндотелина-1 [14]. Повышенная экспрессия эндотелинового рецептора типа В на поверхности эндо-телиональных клеток ассоциирована с повышенной выработкой NO [6]. Изменения сосудов легких при ГПС характеризуются расширением их на уровне прекапилляров и капилляров (увеличение диаметра от 15 до 60 мкн, max - до 500 мкн), а также образованием прямых артериовенозных шунтов. Следствием этого является шунтирование крови справа налево и несоответствие между вентиляцией и перфузией легких. В результате развивается нарушение окси-генации крови и дыхательная недостаточность [15].
Согласно современным представлениям, в основе ГПС лежит 3 механизма:
• дисбаланс между вентиляцией и перфузией
• внутрилегочное артерио-венозное шунтирование
• нарушение диффузии кислорода [3,6,12,15].
Ведущее значение при этом отводится дисбалансу между вентиляцией и перфузией альвеол вследствие дилятации сосудов.
Патогенез гепатопульмонального синдрома схематично представлен на рис. 2
Характерными клиническими симптомами ГПС является одышка, усиливающаяся в вертикальном положении и цианоз [3,6,11]. Нарастание одышки при изменении положения тела из горизонтального в вертикальное носит название ортодезоксия - платипноэ. Данный симптом объясняется тем, что сосуды при ГПС расширяются преимущественно в нижних отделах легких и давление кислорода в артериальной крови в положении стоя снижается. Одышка неуклонно прогрессирует и со временем становится постоянной. При тяжелом ГПС имеют место телеангиоэктазии, изменения дистальных фаланг пальцев по типу барабанных палочек, цианоз губ и ногтевых лож. У некоторых больных могут развиваться такие внелегочные осложнения ГПС, как полицитемия и внутричерепные кровоизлияния [3,6].
Согласно классификации Европейского респираторного общества, тяжесть ГПС определяется степенью гипоксии, основанной на изменении парциального давления кислорода в артериальной крови (Ра О2 ):
• мягкая (Ра О2 > 80 мм рт ст)
ном мозге. Этот метод применяется как для диагностики ГПС, так и для определения объема шунтирования.
Ангиография сосудов легких дает возможность определить топографию расширенных сосудов и вариант ГПС. Тип А характеризуется расширением прека-пиллярных сосудов, при типе В обнаруживаются артерио-венозные шунты, т.е. сосудистые мальформации. Необходимо помнить, что при типе В вдыхание кислорода не улучшает функцию легких.
Рис 1. Нарушение диффузионно-перфузионного соотношения (Lange P.A. et al, Ann Intern. Med, 1995; 122:521-529)
• умеренная (80 > Pа О2 > 60 мм рт ст)
Начальным этапом диагностики ГПС является проведение пульсоксиметрии, которая позволяет оценить сатурацию крови кислородом [17]. При сатурации крови менее 92% в вертикальном положении и/или снижении этого показателя более чем на 4% в горизонтальном положении, определяют газовый состав крови в положении лежа и стоя. При обнаружении снижения парциального давления кислорода, которое нарастает при переходе в вертикальное положение тела, рекомендуется проведение дальнейшего исследования - неинвазивной контрастной эхокардиографии или сцинтиграфии [17].
При контрастной эхокардиографии в периферическую вену больного вводится легочно-независимый контрастный препарат (гелофундол). Контрастное вещество в норме не проходит через легочные капилляры и поэтому не достигает левых отделов сердца. При наличии внутрилегочных шунтов контраст через 3-6 сердечных циклов определяется в левых отделах сердца.
При перфузионной сцинтиграфии с альбуминовыми макроагрегатами (размером > 20 мкг), содержащими технеций (99т Т с) в норме весь введенный препарат задерживается в капиллярной
Лечение и прогноз
Развитие ГПС значительно ухудшает качество жизни больных и резко ухудшает прогноз, о чем свидетельствуют результаты крупного проспективного исследования, проведенного в 2003 году [18]. При наблюдении за 111 больными ЦП, из которых у 27(24%) был диагностирован ГПС, выявлено достоверное (р < 0,05) сокращение выживаемости этих лиц до 10,6 месяцев, по сравнению с
Рис 2. Патогенез гепатопульмонального синдрома [10]
сети легких. При наличии дилятации 40,8 мес в отсутствие данного синдрома.
легочных сосудов или внутрисердечного шунтирования справа налево эти макро-агреганты выявляются в других органах, в первую очередь, в селезенке и голов-
Рис. 3. Контрастная ЭХО-КГ. Данные эхокардиографии при ГПС. Отмечается появление микропузырьков в левом предсердии после внутривенного введения контраста (А). У здорового человека этого не происходит (Б).
Стандартной схемы лечения ГПС не существует. В настоящее время отсутствуют эффективные препараты, способные предотвратить дилятацию сосудов легких. Предпринимались попытки внутривенного введения метиленовой сини - ингибитора гуанилциклазы, опосредующей внутрилегочные эффекты NO, которые не увенчались успехом[18]. Применение октреотида и простаглан-динов было неэффективным и приводило к незначительному улучшению [2]. Бета-блокаторы и нитраты, применяющиеся с целью снижения давления в портальной системе, не оказывают существенного влияния на течение ГПС [6].Селективная эмболизация крупных сосудистых мальформаций для снижения объема шунтирования у части больных дает положительный результат. В отдельных случаях используется трансюгулярное портосистемное шунтирование (TIPS) с целью коррекции портальной гипертензии. Чаще TIPS
Рис 4. Алгоритм диагностики ГПС
применяется как промежуточный этап лечения у больных перед трансплантацией печени. Обсуждается использование антибиотиков для подавления эндо-токсин-индуцированного выброса цито-кинов [3,6,19].
У больных с тяжелой гипоксемией (Ра О 2 > 60 мм рт ст) в покое осуществляется постоянная оксигенотерапия [2], часто с помощью переносных си-стем.Следует помнить, что аппаратное дыхание ухудшает функцию легких, поскольку в результате положительного конечного экспираторного давления уменьшается сердечная фракция выброса. Необходимо избегать препаратов с отрицательным инотропным действием, которые способны усиливать гипоксию тканей.
Радикальным методом лечения ГПС в случаях прогрессирующей и рефрактерной гипоксемии является пересадка печени, которая существенно улучшает
прогноз больных и во многих случаях приводит к полному устранению синдрома.
Таким образом, ГПС является тяжелым осложнением в большинстве случаев далеко зашедшего заболевания печени, которое ассоциировано с крайне неблагоприятным прогнозом. В основе патогенеза ГПС лежит недостаточная инактивация возоактивных субстанций, в результате чего происходит выраженная дилятация артериол и капилляров легких, образование сосудистых маль-формаций и сброс крови по артерио-венозным шунтам. Основной клинический симптом ГПС — прогрессирующая одышка по типу платипное и цианоз. Эффективные консервативные способы лечения ГПС в настоящее время отсутствуют. Единственным длительно эффективным методом лечения является трансплантация печени.
1. Абдуллаев С.М. Гепатопульмональный синдром //Клиническая гепатология.- 2007.-№2.- С.43-46
2. Майер К.-П. Гепатит и последствия гепатита.- М.: гэотар-мед, 2004.- 720с.
3. Herve P., Le Pavec J., Sztrymf B. et al. Pulmonary vascular abnormalities in cirrhosis. Best Pract Res Clin Gastroenterol., 2007, 21(1), 141-59.
4. SchenkP., Fuhrmann V., Madl C. et al. Hepatopulmonary syndrome: preva—lence and
predictive value of various cut offs for arterial oxygenation and their clinical consequences. Gut, 2002, 51(6), 853-9.
5. Kim B.J., Lee S. C., Park S.W. et al. Characteristics and prevalence of intra- pulmonary shunt detected by contrast echocardiography with harmonic imaging in liver transplant candidates. Am J Cardiol., 2004, 15, 94(4), 525- 8.
6. Hoeper M.M., Krowka M.J., Strassburg C.P. Portopulmonary hypertension and hepatopulmonary syndrome. Lancet, 2004, 1, 363, 1461-8.
8. De B.K., Sen S., Biswas P.K. et al. Occurrence of hepatopulmonary syn—drome in Budd-Chiari syndrome and the role of venous decompression. Gastroenterology, 2002, 122(4), 897903.
9. Teuber G., Teupe C., Dietrich C.F. et al. Pulmonary dysfunction in noncir—rhotic patients with chronic viral hepatitis. Eur. J. Intern. Med. 2002, 13(5), 311-318.
10. Fuhrmann V., Madl C., Mueller C. et al. Hepatopulmonary syndrome in patients with hypoxic hepatitis. Gastroenterology, 2006, 131(1), 69-75.
11. Moller S, Krag A, Henriksen JH, Bendtsen F. Pathophysiological aspects of pulmonary complications of cirrhosis. Scand J Gastroenterol., 2007, 42(4), 419-27.
12. Kuntz E., Kuntz H-D. Hepatology, Principles and Practice, 2nd ed., 2006, XIII, 906p.
13. Strassburg C.P. Gastrointestinal disorders of the critically ill. Shock liver. Best Pract Res Clin Gastroenterol., 2003, 17(3), 369-81.
15. Rodriguez-Roisin R., Krowka M.J., Herve P., Fallon M.B. ERS Task Force Pulmonary-Hepatic Vascular Disorders (PHD) Scientific Committee. Pulmonary-Hepatic vascular Disorders (PHD). EurRespir J., 2004, 24(5), 861-80.
16. Deibert P., Allgaier H.P., Loesch S. et al. Hepatopulmonary syndrome in patients with chronic liver disease: role of pulse oximetry. BMC Gastroenterol., 2006, 25, 6, 15.
17. Schenk P., Schoniger-Hekele M., Fuhrmann V. et al. Prognostic signifi—cance of the hepato-pulmonary syndrome in patients with cirrhosis. Gastroenterology, 2003, 125(4), 1042-52.
19. Lasch H.M., Fried M.W. et al. Use of transjugular intrahepatic portosys—temic shunt as a bridge to liver transplantation in a patient with severe hepatopulmonary syndrome. Liver Transpl., 2001, 7(2), 147-9.
Гепатопульмональний синдром - сучасний стан проблеми
У статп висв^леш основш причини виникнення, мехашзми розвитку гепато-пульмонального синдрому, його кшшчш прояви i методи дiагностики. Представлеш сучасш шдходи до лжування та несприятливий прогноз цього тяжкого ускладнення хрошчного захворювання печшки та/або пор-тально! гшертензп.
Hepatopulmonary syndrome - current state of problem
The article highlights the main causes, mechanisms of hepatopulmonary syndrome, its clinical manifestations and diagnostic methods. The modern approaches to treatment and unfavorable prognosis of this serious complication of chronic liver disease and / or portal hypertension.
Гепатопульмональный синдром
Гепатопульмональный синдром — это патологические изменения в легочных сосудах, возникающие на фоне хронических заболеваний печени. Основной причиной служит цирроз, реже состояние сопровождает хронические гепатиты, желчнокаменную болезнь, печеночные сосудистые патологии. Симптомы: одышка, усиливающаяся в вертикальном положении тела, периоральный цианоз и акроцианоз, деформации пальцев, похожие на «барабанные палочки» и «часовые стекла». Диагностика включает трансторакальную контрастную ЭхоКГ, метод радиоизотопного сканирования, ангиопульмонографию. Поддерживающее лечение предполагает кислородотерапию и селективную эмболизацию сосудов, а радикальное — пересадку печени.
МКБ-10
Общие сведения
Гепатопульмональный синдром (ГПС) — типичное осложнение терминальной стадии печеночных заболеваний, которое в современной гепатологии встречается, по разным данным, у 4-47% пациентов. Большой разбег в статистических данных обусловлен отсутствием четких диагностических критериев и сложностью раннего выявления ГПС, поскольку его симптомы накладываются на проявления основной патологии. Впервые патогенетическая связь между поражениями легких и печени замечена в 1884 году доктором М. Флюкигером, а спустя 100 лет ученые Т.С. Кеннеди и Р.Дж. Кнудсон подробно описали признаки синдрома.
Причины
Гепатопульмональный синдром возникает у 4-19% больных, страдающих циррозом печени, и у 15-20% людей, которые ожидают очереди на трансплантацию органа. Иногда патология развивается при нелеченых хронических гепатитах, осложненном течении желчнокаменной болезни. К редким причинам относят портальную гипертензию без цирроза — при тромбозе воротной вены, синдроме Бадда-Киари, врожденном печеночном фиброзе. Корреляция между тяжестью состояния и риском гепатопульмонального синдрома не прослеживается.
Патогенез
Морфологическим субстратом гепатопульмональных нарушений является прекапиллярно-капиллярная дилатация (функциональное шунтирование). При этом в легких раскрываются уже имеющиеся артериовенозные шунты и расширяется микроциркуляторное русло («плевральные спидеры»). Кроме того, у пациентов увеличивается количество артериовенозных шунтов, что связано с прогрессированием портальной гипертензии.
Центральную роль в патогенезе гепатопульмонального синдрома играет увеличение синтеза оксида азота — вещества с выраженными вазодилатирующими свойствами. Также в механизме развития болезни важное значение имеют фактор некроза опухолей, бактериальные липополисахариды, эндотелин-1. Эти вещества усиливают выработку окиси азота, способствуют накоплению в крови карбоксигемоглобина и нарушают диффузию газов в легких.
Результатом микро- и макроизменений в легочной паренхиме становится уменьшение эффективной легочной вентиляции, что проявляется выраженной артериальной гипоксемией. Из-за более низкого насыщения кислородом крови активизируется дыхательный центр, что вызывает тахипноэ и другие нарушения. Когда компенсаторные механизмы не справляются с возрастающей гипоксемией, у больных нарастает дыхательная недостаточность.
Симптомы
Основной признак ГПС — выраженная одышка в покое и при физической нагрузке. Ее отличительной чертой является платипноэ — резкое усугубление симптоматики при переходе из горизонтального в вертикальное положение, что вызвано снижением парциального напряжения кислорода в крови. По этой причине больные с гепатопульмональными нарушениями не переносят даже легкую физическую нагрузку, и их качество жизни значительно снижено.
Длительно существующий гепатопульмональный синдром сопровождается признаками дыхательной недостаточности: синюшностью кожи носогубного треугольника и кончиков пальцев, деформацией дистальных фаланг пальцев в виде «барабанных палочек», а ногтей — по типу «часовых стекол». На коже резко увеличивается число сосудистых «звездочек», что является признаком системного расширения сосудов.
Осложнения
При заболевании прогрессирующе ухудшается оксигенация крови, возникает ишемия всех внутренних органов, которая усугубляет явления портальной гипертензии. Гепатопульмональный синдром зачастую заканчивается смертью пациента от дыхательных нарушений и терминальной стадии печеночной недостаточности. Средняя продолжительность жизни больных при сочетании печеночного цирроза с ГПС — 10,6 месяцев, тогда как пациенты без этого синдрома живут до 40,8 месяцев.
Диагностика
При первичной диагностике больного с хроническим печеночным заболеванием и жалобами на одышку пульмонолог выполняет пульсоксиметрию. В случае перепадов pO2 на 3-10 мм рт. ст. при изменении горизонтального положения тела на вертикальное врач может заподозрить гепатопульмональный синдром. Для верификации диагноза назначаются следующие методы исследования:
- Трансторакальная контрастная эхокардиография. «Золотой стандарт» используется для выявления внутрилегочного шунтирования. Пациенту вводят контраст, образующий микропузырьки в сосудах. При визуализации этих пузырьков в левых камерах сердца диагноз подтверждается, поскольку в физиологических условиях они не могут проходить через легочные капилляры малого диаметра.
- Радиоизотопное сканирование. Чтобы подтвердить вазодилатацию, в кровеносное русло вводятся крупные частицы альбумина, которые в норме не проникают через узкие капилляры легких. При интенсивном артериовенозном шунтировании до 60% меченных изотопом частиц проходят через легочную ткань и накапливаются во внутренних органах.
- Ангиопульмонография. При тяжелой гипоксемии в качестве подготовки к инвазивному лечению проводится рентгеноконтрастная визуализация артериовенозных шунтов в легких. Во время исследования врач изучает состояние сосудистой сети, оценивает размеры крупных легочных артерий и периферических мелких сосудов.
- Анализ газового состава крови. Гепатопульмональный синдром диагностируют при уменьшении диффузии оксида углерода в легких менее 80% и снижении насыщения крови кислородом менее 92%. Для подтверждения диагноза рекомендована функциональная проба с чистым кислородом: при внутрилегочном шунтировании pO2 составляет менее 70 мм Hg.
Лечение гепатопульмонального синдрома
Консервативная терапия
Медикаментозные методы лечения ограничены. Больным рекомендуют препараты для стабилизации состояния и коррекции основного заболевания, а также применяют антагонисты вазодилататоров, чтобы замедлить прогрессирование гепатопульмонального синдрома. Врачи используют аэрозольную форму L-NAME и антидепрессанты из группы селективных ингибиторов обратного захвата серотонина, однако они дают только временное улучшение.
В клинической практике для уменьшения симптоматики дыхательной недостаточности пациентам проводят респираторную поддержку — интраназальные ингаляции увлажненного кислорода. Метод эффективен на начальной стадии ГПС, однако при системной вазодилатации он не дает должного эффекта. В экспериментальных исследованиях показана эффективность совместного назначения кислородотерапии и блокаторов фактора некроза опухолей, которые улучшают легочной газообмен.
Хирургическое лечение
При умеренной степени дыхательных расстройств показана селективная эмболизация крупных артериовенозных шунтов. Вмешательство выполняется для коррекции симптоматики и улучшения качества жизни пациентов. Единственным радикальным методом лечения является ортотопическая пересадка печени или комплексов печень-легкие, печень-легкие-сердце. У 85% больных в течение года после трасплантации органов гепатопульмональный синдром исчезает.
Прогноз и профилактика
Гепатопульмональный синдром — неблагоприятное состояние, вызывающее смерть 62-84% пациентов, которым не была проведена печеночная трансплантация, в первый год после постановки диагноза. После пересадки органов прогноз улучшается, однако до 15% больных продолжают страдать от симптомов гепатопульмонального синдрома в посттрансплантационном периоде. Профилактика состояния заключается в ранней диагностике и лечении болезней печени, предупреждении цирроза и портальной гипертензии.
3. Гепатопульмональный синдром/ В.Т. Ивашкин, М.А. Морозова, М.В. Маевская// Трансплантология. — 2009.
4. Гепатопульмональный синдром// С.В. Курсов, К.Г. Михневич, Н.В. Лизогуб, С.Н. Скороплет// Медицина неотложных состояний. — 2009.
Читайте также:
- Иглорефлексотерапия вегето-сосудистой дистонии. Пунктационная рефлексотерапия при нейроциркуляторной дистонии
- Абсцесс простаты
- Гемодинамика при клапанном стенозе легочной артерии. Шумы при клапанном стенозе легочной артерии
- Миома матки при беременности
- Стандартные отведения ЭКГ (Эйнтховенские отведения)
