Гипофиз плода. Формирование гипофиза эмбриона
Добавил пользователь Morpheus Обновлено: 30.01.2026
Гипофиз плода. Формирование гипофиза эмбриона
Гипофиз образуется из двух отдельных закладок, которые объединяются друг с другом. Одна из этих закладок, называемая карманом Ратке, представляет собой продолжение стомодеальной впадины. Это выстланное эктодермой пространство, форма которого напоминает палец перчатки, растет вдоль средней линии, по направлению к processus infundibuli, расположенному на дне промежуточного мозга. Первоначальные отношения структур, участвующих в этом процессе, лучше всего видны в конце четвертой недели развития. В это время ясно видно, что карман Ратке образуется с наружной стороны ротовой пластинки.
Другая закладка гипофиза представляет собой processus infundibuli, который образуется в районе дна промежуточного мозга. Эта ткань имеет также эктодермальное происхождение, но ее гистологическое строение в соответствии с ее возникновением из нервной трубки с самого начала отличается от строения эпителиальной части, образующейся из выстилки кармана Ратке. Впоследствии из processus infundibuli образуется так называемая нервная часть (pars neuralis) дефинитивного гипофиза.
Стомодеальная часть гипофиза в процессе дальнейшего развития испытывает существенные изменения. Карман Ратке вытягивается и его слепой конец близко подходит к processus infundibuli. К этому времени краниальный конец хорды, который первоначально находился в контакте с processus infundibuli, начинает регрессировать. В ходе этого процесса первоначальный стебелек, соединяющий карман Ратке со стомодеумом, истончается и теряет связь со стомодеальным эпителием. Одновременно с этим первоначально мелкая стомодеальная впадина становится значительно глубже благодаря росту прилежащих носовых и верхнечелюстных отростков и нижнечелюстной дуги.
Яркую картину этого процесса углубления можно получить при сравнении первоначального поверхностного положения кармана Ратке с расположением той линии, вдоль которой можно видеть регрессию его стебелька у более поздних эмбрионов и, У различных млекопитающих наблюдается значительное разнообразие в некоторых деталях строения гипофиза, хотя все млекопитающие содержат одни и те же основные части. У многих видов (как, например, у кошки и собаки) стомодеальная ткань простирается значительно дальше по каудальной стороне нервной части, чем это наблюдается у человека.
У таких видов промежуточная часть совершенно закрывает нервную, в то время как у человека она покрывает только переднюю поверхность ее. Размеры остаточной полости также сильно варьируют. У человека она превращается в узкую щель, которая неполностью отделяет переднюю долю от промежуточной части. У других же видов остаточная полость образует четкую границу между этими двумя частями гипофиза. Это обстоятельство значительно облегчает их разделение, когда требуется приготовить из них экстракты для различных экспериментальных целей. Как у человека, так и у большинства наземных млекопитающих промежуточная часть так плотно прилегает к нервной части, что отделить их друг от друга очень трудно.
Однако у китообразных остается еще соединительная ткань между карманом Ратке и processus infundibuli, вследствие чего промежуточная часть может быть легко и четко отделена от нервной даже во взрослом состоянии.
Это обстоятельство очень полезно в экспериментальной работе при определении природы гормонов, которые вырабатываются в каждой отдельной части этой сложной и очень важной эндокринной железы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Публикации в СМИ
Гипопитуитаризм — недостаточность функции гипофиза или гипоталамуса с уменьшением или прекращением продукции одного или нескольких тропных гормонов передней доли или АДГ.
Этиология • Опухоли гипофиза, обычно аденомы (см. Аденома гипофиза) и краниофарингиомы (см. Краниофарингиома), могут привести к разрушению компонентов гипофизарно-гипоталамической системы с соответствующими гормональными выпадениями • Синдром Шеена • Оперативное удаление опухолей гипофиза или других опухолей головного мозга может вызвать повреждение гипоталамуса и/или гипофиза • Редкие причины: саркоидоз, гемохроматоз, болезнь Хенда–Шюллера–Крисчена, туберкулёз, сифилис, грибковые инфекции.
Генетические аспекты • Синдром 18р- (147250, делеция в хр. 18, Â ), а также (146390, Â ): характерны слияние резцов верхней челюсти, гипоплазия гипоталамуса и гипофиза, недостаточность СТГ • Дефицит гипофизарного фактора транскрипции (241540, 3q); отсутствие стебля гипофиза и задней доли, гипоплазия передней доли, врождённый гипопитуитаризм в сочетании с несахарным диабетом, гипогликемией, гипоплазией половых органов.
Факторы риска • Травмы головы • Беременность и роды.
Патоморфология • Деструкция передней доли гипофиза • Атрофия коры надпочечников, щитовидной железы, гонад.
Клиническая картина определяется недостаточностью отдельных гормонов гипофиза (чаще изолированные дефициты СТГ и гонадотропинов, особенно у детей; изолированные дефициты ТТГ и АКТГ редки) или большинства из них (пангипопитуитаризм, или болезнь Симмондса). При медленно прогрессирующей деструкции ткани гипофиза прежде всего формируется недостаточность СТГ и гонадотропинов, и лишь позднее развивается недостаточность ТТГ, АКТГ и пролактина.
• Недостаточность СТГ у детей вызывает гипофизарную карликовость (см. Карликовость гипофизарная) и другие формы карликовости.
• Недостаточность гонадотропинов (ЛГ и ФСГ). Аменорея и гипотрофия половых органов у женщин, снижение потенции и либидо у мужчин. При недостатке надпочечниковых андрогенов из-за сопутствующего дефицита АКТГ исчезают волосы на лобке и в подмышечных областях, особенно у женщин.
• Недостаточность ТТГ вызывает гипотиреоз.
• Недостаточность АКТГ вызывает вторичную недостаточность надпочечников. Вторичную недостаточность по некоторым клиническим проявлениям отличают от первичной (вызванной поражением надпочечников) •• Гиперпигментация кожи и слизистых оболочек характерна для первичного поражения надпочечников ••• Гиперпигментация возникает вследствие эффектов стимулирующего меланоциты гормона (этот гормон аденогипофиза и АКТГ образуются из одной большой молекулы-предшественника — проопиомеланокортина, уровень же АКТГ увеличивается в ответ на снижение содержания кортизола в плазме) ••• При вторичной надпочечниковой недостаточности уровень АКТГ (а значит, и стимулирующего меланоциты гормона) низок; следовательно, гиперпигментация для данного состояния не характерна •• При вторичной надпочечниковой недостаточности электролитный дисбаланс (чаще снижение уровня Na+ и повышение уровня K+ в сыворотке) минимален, т.к. секреция альдостерона (задерживает Na+) в коре надпочечников в большей мере зависит от ренина и ангиотензина, чем от АКТГ.
• Недостаточность пролактина может стать причиной послеродовой недостаточной лактации при синдроме Шеена, но не вызывает других клинических проявлений.
• Недостаточность АДГ вызывает несахарный диабет (см. Диабет несахарный).
Диагностика
• Первый этап диагностики гипопитуитаризма — оценка функции органов-мишеней; наличие гипопитуитаризма часто предполагают при сочетанных нарушениях функции нескольких органов-мишеней (например, щитовидной железы, надпочечников или гонад).
• Оценка гормонов гипофиза •• СТГ. Базальный уровень СТГ обычно низок для прямого определения, поэтому для обнаружения неадекватной секреции гормона проводят провокационные пробы ••• Гипогликемия, вызванная инсулином, — наиболее эффективный стимулятор СТГ. Препарат инсулина в дозе 0,1–0,15 ЕД/кг вводят в/в, а уровень СТГ измеряют через 30, 60 и 90 мин. Вслед за уменьшением концентрации глюкозы, обычно максимальной через 30 мин, следует подъём СТГ до уровня, превышающего у здоровых лиц 8–10 нг/мл. При проведении пробы необходимо тщательно наблюдать за больным; появление при гипогликемии симптомов со стороны ЦНС требует немедленного внутривенного введения р-ра декстрозы ••• Аргинин, глюкагон с пропранололом и физическая нагрузка — другие методы стимуляции секреции СТГ •• Уровень других гормонов гипофиза определяют радиоиммунологически, однако низкое содержание гормонов с трудом позволяет разграничивать патологию от нормы, поэтому оценку проводят только в особых ситуациях ••• При гипофункции щитовидной железы (например, низкое содержание Т4 и низкое поглощение Т3) высокий уровень ТТГ говорит о поражении самой железы; низкая (или на нижней границе нормы) величина ТТГ позволяет с большой вероятностью предполагать гипопитуитаризм ••• При недостаточности надпочечников (например, при низком уровне кортизола сыворотки) уровень АКТГ повышен; низкий (или на нижней границе нормы) уровень АКТГ с большой вероятностью предполагает гипопитуитаризм ••• У женщин в постменопаузе или у мужчин с неадекватной функцией яичек (низкий уровень тестостерона) уровни ЛГ и ФСГ высокие; низкие (или на нижней границе нормы) значения предполагают гипопитуитаризм.
• Другие провокационные пробы •• Гипогликемия, вызванная инсулином, также стимулирует секрецию кортизола. Уровень кортизола можно определять в тех же образцах крови, в которых измерялся уровень СТГ. Увеличение кортизола в сыворотке (по меньшей мере от 10 мкг% до уровня 20 мкг% или выше) указывает на нормальную функцию всей гипоталамо-гипофизарно-надпочечниковой системы •• Метирапоновый тест ••• Метирапон ингибирует 11- b -гидроксилирование (этап образования кортизола из его предшественника, 11 дезоксикортизола). Пероральное назначение метирапона вызывает снижение образования кортизола, что стимулирует выброс АКТГ из гипофиза. Повышение содержания АКТГ стимулирует выработку 11-дезоксикортизола ••• Повышение уровня 11-дезоксикортизола сыворотки после введения метирапона указывает на то, что резервный АКТГ в гипофизе и ответ надпочечников на АКТГ нормальны.
Специальные исследования • Исследование полей зрения • Рентгенография органов грудной клетки, черепа, костей рук, запястья (для определения костного возраста у детей) • МРТ или КТ головного мозга.
Лечение
• Причину гипофизарной недостаточности (например, растущая опухоль гипофиза) следует установить до начала терапии (если последняя возможна). При опухоли гипофиза показана транссфеноидальная резекция в сочетании с лучевой терапией.
• Гормональная заместительная терапия (дозы препаратов и схемы лечения подбирают индивидуально) •• Соматотропин — для стимуляции роста у детей с изолированным дефицитом СТГ или с пангипопитуитаризмом •• Тиреоидные гормоны — в качестве заместительной терапии •• Гидрокортизон — в качестве заместительной терапии •• Комбинация «эстроген–прогестерон» — для нормализации менструальной функции, тестостерон — мужчинам для восстановления либидо и потенции •• Гонадотропины или гонадолиберин — при бесплодии.
Наблюдение. Оценку состояния пациента после гормональной терапии осуществляют через 3 и 12 мес. Для больных с опухолью гипофиза в план исследования включают оценку полей зрения, функции щитовидной железы и надпочечников, визуализацию «турецкого седла».
МКБ-10 • E23.0 Гипопитуитаризм • E23.1 Медикаментозный гипопитуитаризм • E89.3 Гипопитуитаризм, возникший после медицинских процедур
Развитие эндокринной системы плода.
Становление и развитие эндокринной системы плода необходимо рассматривать в тесном взаимодействии с эндокринной системой материнского организма и плаценты. Лишь в отдельных случаях эндокринная система плода функционирует изолированно от соответствующих систем матери и плаценты. Типичным примером в этом отношении является продукция плодом соматотропного гормона гипофиза.
Половые гормоны женских (эстрогены) и мужских (тестостерон) гонад образуются в антенатальном периоде в незначительном количестве. Этим гормонам принадлежит важная роль в процессах дифференцировки наружных и внутренних половых органов.
На 9-й неделе развития у плода можно отметить первые признаки продукции АКТГ. АКТГ стимулирует функцию коркового вещества надпочечников с образованием кортизола и дегидроэпиандростерона. Кортизол плода играет важную роль в синтезе сурфактантной системы, которая способствует созреванию легочной ткани. При недостаточной продукции кор-тизола наблюдается недостаточное созревание легочной ткани плода.
Дегидроэпиандростерон из надпочечников плода поступает в плаценту, где из него синтезируется гормон эстриол. Он является основным эстрогеном плаценты (90 % эстрогенов в крови матери представлены эстриолом). Следовательно, содержание эстриола в крови матери отражает состояние не только плода, но и плаценты (фетоплацентарной системы), что имеет очень важное диагностическое значение.
Продукция тиреотропного гормона (ТТГ) гипофиза начинается приблизительно на 12-й неделе внутриутробной жизни, что сопровождается началом образования тиреоидных гормонов (Т3 и Т4)- ТТГ, как и Т4, матери не переходят через плаценту. Переход Т3 от матери к плоду ограничен. Вследствие этого система ТТГ — щитовидная железа плода функционирует в значительной степени изолированно от соответствующей системы матери. Тиреоидные гормоны плода играют очень важную роль в процессах феталь-ного роста и развития, особенно в оссификации костей скелета и зубов, а также в формировании нервной системы.
Развитие поджелудочной железы у эмбриона человека начинается на 3—4-й неделе онтогенеза. К 17-й неделе отмечается высокая концентрация фетального инсулина. У плода инсулин играет роль гормона роста, в то время как в материнском организме инсулин обеспечивает надлежащий уровень глюкозы как у матери, так и у плода. Инсулин, образующийся в организме матери, не переходит через плаценту к плоду; равным образом инсулин плодового происхождения не переходит в материнский кровоток, что, по-видимому, обусловлено высокой молекулярной массой данного гормона. Поэтому предположение о том, что сахарный диабет у беременных протекает легче, чем у небеременных, в результате компенсации за счет плода, в настоящее время считается необоснованным.
Развитие эндокринной системы
Эндокринная система является одной из первых систем , которые развиваются в процессе внутриутробного развития.
Надпочечники
Кора надпочечника плода может быть выявлена в течение четырех недель после начала беременности . Кора надпочечников развивается от утолщения промежуточной мезодермы. Через пять-шесть недель беременности мезонефрос дифференцируется в ткань, известную как гребень гонады.
Гонадальный гребень производит стероидогенные клетки как для половых желез, так и для коры надпочечников. Мозговое вещество надпочечников происходит из эктодермальных клеток . Клетки, которые станут тканью надпочечников, перемещаются забрюшинно в верхнюю часть мезонефроса.
Через семь недель беременности к клеткам надпочечников присоединяются симпатические клетки, которые происходят из нервного гребня, чтобы сформировать мозговое вещество надпочечников . В конце восьмой недели надпочечники инкапсулируются и образовывают отдельный орган над развивающимися почками. При рождении надпочечники весят примерно от восьми до девяти граммов (вдвое больше, чем у взрослых надпочечников) и составляют 0,5% от общей массы тела. В 25 недель развивается зона коры надпочечников у взрослых, которая отвечает за первичный синтез стероидов в первые недели после рождения.
Щитовидная железа
Щитовидная железа развивается из двух различных кластеризаций эмбриональных клеток. Одна часть связана с утолщением дна глотки, которое служит предшественником фолликулярных клеток, продуцирующих тироксин (Т 4 ). Другая часть - от хвостовых отростков четвертых глоточно-паховых мешочков, что приводит к парафолликулярным кальцитонин-секретирующим клеткам. Эти две структуры становятся очевидными к 16-17 дням беременности.
Около 24-го дня беременности развивается нижняя кишка, тонкий, похожий на колбу дивертикул срединного зачатка . Примерно от 24 до 32 дней беременности срединный зачаток превращается в двухлопастную структуру. К 50 дню беременности медиальный и боковой зачаток сливаются воедино. На 12 неделе беременности щитовидная железа плода способна накапливать йод для производства ТРГ , ТТГ и свободного гормона щитовидной железы. В 20 недель плод может реализовать механизмы обратной связи для производства гормонов щитовидной железы. Во время развития плода Т 4 является основным гормоном щитовидной железы, вырабатываемым этим органом , тогда как трийодтиронин (Т 3 ) и его неактивное производное, обратный Т 3 , не обнаруживаются до третьего триместра.
Паращитовидные железы
Как только плод достигает четырех недель беременности, начинает развиваться околощитовидная железа . Человеческий эмбрион образует пять наборов глоточных оболочек, покрытых энтодермой. Третий и четвертый мешки ответственны за развитие нижней и верхней околощитовидных желез, соответственно. Третий глоточный мешок встречает развивающуюся щитовидную железу, и они мигрируют вниз к нижним полюсам долей щитовидной железы. Четвертый глоточный мешок позже сталкивается с развивающейся щитовидной железой и мигрирует к верхним полюсам долей щитовидной железы. Через 14 недель беременности околощитовидные железы начинают увеличиваться с 0,1 мм в диаметре до приблизительно 1 - 2 мм при рождении. Развивающиеся околощитовидные железы физиологически функциональны, начиная со второго триместра.
Исследования на мышах показали, что вмешательство в ген HOX15 может вызвать аплазию околощитовидной железы , что позволяет предположить, что этот ген играет важную роль в развитии околощитовидной железы. Также было показано, что гены TBX1 , CRKL , GATA3 , GCM2 и SOX3 играют решающую роль в формировании околощитовидной железы. Мутации в генах TBX1 и CRKL коррелируют с синдромом DiGeorge , в то время как мутации в GATA3 также приводят к DiGeorge-подобному синдрому. Пороки развития в гене GCM2 привели к гипопаратиреозу. Исследования мутаций гена SOX3 показали, что он играет роль в развитии околощитовидной железы. Эти мутации также приводят к различной степени гипопитуитаризма.
Поджелудочная железа
Фетальная поджелудочная железа человека начинает развиваться к четвертой неделе беременности. Пять недель спустя начинают появляться альфа- и бета-клетки поджелудочной железы . Через восемь-десять недель развития поджелудочная железа начинает вырабатывать инсулин , глюкагон , соматостатин и полипептид поджелудочной железы .
На ранних стадиях развития плода количество панкреатических альфа-клеток превышает количество панкреатических бета-клеток. Альфа-клетки достигают своего пика в средней стадии беременности. Начиная со средней стадии и до срока родов, количество бета-клеток продолжает увеличиваться, пока они не достигнут приблизительного соотношения 1: 1 с альфа-клетками. Концентрация инсулина в поджелудочной железе плода составляет 3,6 пмоль / г через семь-десять недель от начала беременности , а затем повышается до 30 пмоль / г через 16-25 недель беременности. В ближайшей перспективе концентрация инсулина увеличивается до 93 пмоль / г. Эндокринные клетки рассеиваются по всему организму в течение 10 недель. На 31 неделе развития островки Лангерганса дифференцируются.
В то время как поджелудочная железа плода имеет функциональные бета-клетки к 14-24 неделе беременности, количество инсулина, выделяющегося в кровоток, является относительно низким. В исследовании беременных женщин, имеющих плод в середине беременности и на ближайших стадиях развития, у плодов не было повышения уровня инсулина в плазме в ответ на инъекции высоких уровней глюкозы.
В отличие от инсулина, уровни глюкагона в плазме плода относительно высоки и продолжают увеличиваться в процессе развития. На средней стадии беременности концентрация глюкагона составляет 6 мкг / г по сравнению с 2 мкг / г у взрослых людей. Как и инсулин, уровни глюкагона в плазме плода не изменяются в ответ на инфузию глюкозы. Однако было показано, что исследование инфузии аланина беременным женщинам повышает концентрацию пуповинной крови и материнского глюкагона, демонстрируя реакцию плода на воздействие аминокислот.
В то время как альфа- и бета-клетки плода поджелудочной железы полностью развились и способны к синтезу гормонов во время оставшегося созревания плода, островковые клетки относительно незрелы в своей способности продуцировать глюкагон и инсулин. Считается, что это является результатом относительно стабильных уровней концентраций глюкозы в сыворотке плода, достигнутых благодаря материнскому переносу глюкозы через плаценту. С другой стороны, стабильные уровни глюкозы в крови плода могут быть связаны с отсутствием сигналов поджелудочной железы, инициируемых инкретинами во время кормления. Кроме того, клетки островков поджелудочной железы плода не способны в достаточной степени продуцировать цАМФ и быстро разлагать цАМФ под действием фосфодиэстеразы.необходимо секретировать глюкагон и инсулин.
Во время развития плода хранение гликогена контролируется фетальными глюкокортикоидами и плацентарным лактогеном . Инсулин плода ответственен за увеличение поглощения глюкозы и липогенеза на стадиях, приводящих к рождению. Фетальные клетки содержат большее количество рецепторов инсулина по сравнению со взрослыми клетками, а фетальные рецепторы инсулина не подавляются в случаях гиперинсулинемии . Для сравнения, гаптические рецепторы глюкагона плода снижены по сравнению со взрослыми клетками, а гликемический эффект глюкагона ослаблен. Это временное физиологическое изменение способствует увеличению скорости развития плода в последнем триместре. Плохо управляемый сахарный диабет уматери связан с макросомией плода , повышенным риском выкидыша и дефектами развития плода. Гипергликемия у матери также связана с повышенным уровнем инсулина и гиперплазией бета-клеток у доношенного ребенка. Дети матерей-диабетиков подвержены повышенному риску таких состояний, как: полицитемия , тромбоз почечной вены , гипокальциемия , респираторный дистресс-синдром , желтуха , кардиомиопатия , врожденные пороки сердца и неправильное развитие органов.
Гонады
Репродуктивная система начинает развиваться через четыре-пять недель беременности с миграцией половых клеток. Бипотенциальная гонада является результатом формирования медиовентральной области урогенитального гребня. Через пять недель развивающиеся половые железы отрываются от зачатка надпочечников. Гонадальная дифференциация начинается через 42 дня после зачатия.
У мужчин яички формируются в шесть недель плода, а клетки Сертоли начинают развиваться к восьми неделям беременности. SRY , определяющий пол локус, служит для дифференцировки клеток Сертоли . Клетки Сертоли являются источником происхождения антимюллеровского гормона . Синтезированный анти-мюллеровский гормон инициирует ипсилатеральную регрессию мюллерового тракта и тормозит развитие внутренних особенностей женщины. На 10 неделе беременности клетки Лейдига начинают вырабатывать гормоны андрогены. Гормон андрогена дигидротестостерон отвечает за развитие наружных половых органов у мужчин.
Яички опускаются во время пренатального развития в двухэтапном процессе, который начинается в восемь недель беременности и продолжается до середины третьего триместра. Во время трансабдоминальной стадии (от 8 до 15 недель беременности) губная связка сокращается и начинает утолщаться. Черепно-компенсационная связка начинает разрушаться. Эта стадия регулируется секрецией инсулиноподобного 3(INSL3) фактора ,( релаксиноподобный фактор, продуцируемый яичками) , и G-связанный рецептор INSL3, LGR8.
В течение трансигинальной фазы (от 25 до 35 недель беременности) яички опускаются в мошонку. Эта стадия регулируется андрогенами, генитально-бедренным нервом и пептидом, связанным с геном кальцитонина. Во втором и третьем триместре развитие яичка заканчивается уменьшением клеток Лейдига плода и удлинением и обвиванием семенных канатиков .
Исследования экспрессии генов показывают, что специфический комплемент генов, такой как фоллистатин и множественные ингибиторы циклинкиназы, участвует в развитии яичников. Ассортимент генов и белков, таких как WNT4, RSPO1, FOXL2, и различных рецепторов эстрогена, - предотвращают развитие яичек или линии мужского пола.
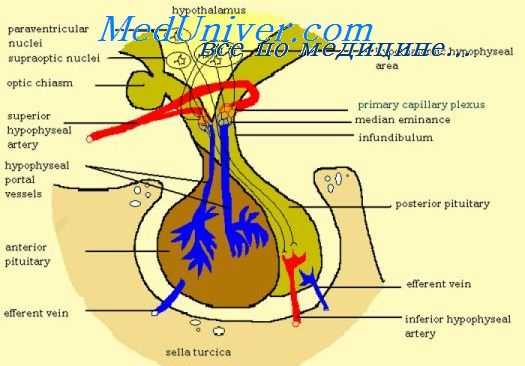
Гипофиз
Гипофиз формируется в ростральной нервной пластинке. Мешочек Ратке, полость эктодермальных клеток ротоглотки , образуется между четвертой и пятой неделями беременности и при полном развитии вызывает рост передней доли гипофиза. К семи неделям беременности начинает развиваться сосудистая система передней доли гипофиза. В течение первых 12 недель беременности передний гипофиз подвергается клеточной дифференцировке. На 20 неделе беременности гипофизарная портальная система уже сформирована.
Мешочек Ратке растет в направлении третьего желудочка и сливается с дивертикулом. Это устраняет просвет, и структура становится расщелиной Ратке. Задняя доля гипофиза формируется из дивертикула. Части ткани гипофиза могут оставаться в средней линии носоглотки. В редких случаях это приводит к функционированию эктопических гормон-секретирующих опухолей в носоглотке.
Функциональное развитие передней доли гипофиза включает пространственно-временную регуляцию транскрипционных факторов, экспрессируемых в стволовых клетках гипофиза, и динамические градиенты локальных растворимых факторов. Координация дорсального градиента морфогенеза гипофиза зависит от нейроэктодермальных сигналов от морфогенетического белка 4 инфундибулярной кости (BMP4). Этот белок отвечает за развитие первоначальной инвагинации мешка Ратке. Другими важными белками, необходимыми для пролиферации клеток гипофиза, являются фактор роста фибробластов 8 (FGF8)] Wnt4, и Wnt5. На паттерны развития вентрального отдела и экспрессию факторов транскрипции влияют градиенты BMP2 и другого белка (SHH). Эти факторы важны для координации ранних моделей клеточной пролиферации.
Через шесть недель после начала беременности кортикотрофные клетки могут быть идентифицированы. К семи неделям беременности передний гипофиз способен секретировать АКТГ. В течение восьми недель беременности соматотрофные клетки начинают развиваться с цитоплазматической экспрессией гормона роста человека. Как только плод достигает 12 недель развития, тиреотрофы начинают экспрессировать бета-субъединицы для ТТГ, в то время как гонадотрофы должны экспрессировать бета-субъединицы для ЛГ и ФСГ. Плоды мужского пола преимущественно продуцируют LH-экспрессирующие гонадотрофы, в то время как женские плоды продуцируют равную экспрессию LH и экспрессирующих FSH гонадотрофов. На 24 неделе беременности начинают появляться лактотрофы, экспрессирующие пролактин.
Гипофиз
Гипофиз представляет собой железу размером с горошину, расположенную внутри костной структуры (турецкого седла) у основания головного мозга. Турецкое седло защищает гипофиз, но оставляет очень мало места для его расширения. Гипофиз контролирует функцию большинства других желез внутренней секреции, поэтому его иногда называют главной железой. В свою очередь, гипофиз в значительной степени контролируется гипоталамусом, областью мозга, которая находится чуть выше гипофиза. Определяя уровни гормонов, вырабатываемых железами, находящимися под контролем гипофиза (железами-мишенями), гипоталамус или гипофиз могут определить, какая стимуляция требуется железам-мишеням. Гипофиз состоит из двух отдельных частей: передняя доля, на долю которой приходится 80% веса гипофиза и задняя (задняя) доля. Доли соединены с гипоталамусом ножкой, содержащей кровеносные сосуды и отростки нервных клеток (нервные волокна или аксоны). Гипоталамус контролирует переднюю долю, высвобождая гормоны через соединительные кровеносные сосуды. Он контролирует заднюю долю с помощью нервных импульсов.
Гормоны, вырабатываемые гипофизом, не все вырабатываются непрерывно. Большинство из них высвобождаются вспышками каждые 1–3 часа с чередующимися периодами активности и бездействия. Некоторые из гормонов, такие как адренокортикотропный гормон ( АСTH ), гормон роста и пролактин, следуют циркадному ритму: уровни повышаются и снижаются предсказуемо в течение дня, обычно достигая пика непосредственно перед пробуждением и падая до минимума непосредственно перед сном. Уровни других гормонов варьируются в зависимости от других факторов. Например, у женщин уровень лютеинизирующего гормона и фолликулостимулирующего гормона, контролирующих репродуктивную функцию, изменяется в течение менструального цикла.
Передняя доля гипофиза вырабатывает и высвобождает (секретирует) шесть основных гормонов:
Адренокортикотропный гормон ( АКТГ ), также называемый кортикотропином , стимулирует надпочечники к выработке кортизола и других гормонов.
Фолликулостимулирующий гормон и лютеинизирующий гормон (гонадотропины), которые стимулируют яички к выработке спермы, яичники к выработке яйцеклеток и половые органы к выработке половых гормонов ( тестостерон и эстроген ) .
Гормон роста, который регулирует рост и физическое развитие и оказывает важное влияние на форму тела, стимулируя формирование мышц и уменьшая жировую ткань.
Пролактин, который стимулирует молочные железы груди производить молоко
Тиреотропный гормон, который стимулирует щитовидную железу вырабатывать гормоны щитовидной железы.
Передняя доля также вырабатывает несколько других гормонов, в том числе тот, который вызывает потемнение кожи (гормон, стимулирующий бета-меланоциты), и те, которые подавляют болевые ощущения (энкефалины и эндорфины) и помогают контролировать иммунную систему (эндорфины).
Задняя доля гипофиза вырабатывает только два гормона:
Вазопрессин (также называемый антидиуретическим гормоном) регулирует количество воды, выделяемой почками, и поэтому важен для поддержания водного баланса в организме .
Окситоцин заставляет матку сокращаться во время родов и сразу после родов, чтобы предотвратить чрезмерное кровотечение. Окситоцин также стимулирует сокращения молочных протоков в молочной железе, которые перемещают молоко к соску (приток) у кормящих женщин. Окситоцин играет дополнительную роль как у мужчин, так и у женщин.
Патология гипофиза
Гипофиз может работать со сбоями по нескольким причинам, обычно в результате развития доброкачественной опухоли (аденомы). Опухоль может избыточно продуцировать один или несколько гормонов гипофиза или опухоль может давить на нормальные клетки гипофиза, вызывая недостаточное производство одного или нескольких гормонов гипофиза. Опухоль также может вызывать увеличение гипофиза с нарушением или без нарушения выработки гормонов. Иногда наблюдается перепроизводство одного гормона опухолью гипофиза и одновременно недопродукция другого из-за давления.
Синдром пустого турецкого седла
У людей с синдромом пустого турецкого седла имеется дефект тканевого барьера, который в норме удерживает спинномозговую жидкость вокруг головного мозга отдельно от турецкого седла. В результате спинномозговая жидкость оказывает повышенное давление на гипофиз и стенки турецкого седла. Турецкое седло может увеличиваться, а гипофиз может уменьшаться, в результате чего седло кажется пустым при визуализирующих исследованиях.Синдром пустого турецкого седла чаще всего возникает у женщин среднего возраста с избыточной массой тела и повышенным артериальным давлением. Реже это состояние возникает после операции на гипофизе, лучевой терапии или инфаркта (смерти) опухоли гипофиза.
Синдром пустого турецкого седла может вообще не вызывать симптомов и редко вызывает серьезные симптомы. Около половины пострадавших страдают головными болями, а у некоторых также наблюдается высокое кровяное давление. В редких случаях наблюдается подтекание ликвора из носа или проблемы со зрением.
Перепроизводство гормонов гипофиза вызывает нарушения, в том числе
Акромегалия или гигантизм : Гормон роста
Болезнь Кушинга : адренокортикотропный гормон ( АКТГ ),
Галакторея (выделение грудного молока мужчинами или женщинами, когда последние не беременны): пролактин
Эректильная дисфункция : пролактин
Бесплодие (особенно у женщин): пролактин
Недостаточная продукция гормонов гипофиза вызывает нарушения, в том числе
Центральный несахарный диабет : вазопрессин
Гипопитуитаризм : множество гормонов
Можно диагностировать нарушение функции гипофиза с помощью нескольких тестов. Визуализирующие исследования, такие как компьютерная томография (КТ) или магнитно-резонансная томография (МРТ), могут показать, увеличился ли гипофиз (например, при наличии опухоли гипофиза ) или уменьшился (например, при гипопитуитаризме ). Такие тесты обычно могут определить, существует ли опухоль в железе. Врачи могут измерить уровень гормонов гипофиза, обычно с помощью простого анализа крови. Врачи выбирают, какие уровни гормонов гипофиза они хотят измерить, в зависимости от симптомов человека. Иногда уровни гипофизарных гормонов трудно интерпретировать, потому что уровни сильно меняются в течение дня и в зависимости от потребностей организма. Для этих гормонов измерение случайного образца крови не дает полезной информации. Для некоторых из этих гормонов врачи назначают вещество, которое обычно влияет на выработку гормонов, а затем измеряют уровень гормона. Например, если вводить инсулин , уровни АCTH , гормона роста и пролактина должны повышаться. Вместо непосредственного измерения уровня гормона роста врачи часто измеряют другой гормон, инсулиноподобный фактор роста 1 (IFG-1). Гормон роста вырабатывается вспышками, и его уровень быстро падает, но уровень IFG-1 отражает общую суточную выработку гормона роста. По всем этим причинам интерпретация результатов анализа крови на гормоны гипофиза сложна.
Читайте также:
