Гипокалиемия при тиреотоксикозе. Феномен Хегглина при тиреотоксикозе
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
В последнее десятилетие с диагностической целью широко применяют йодсодержащие рентгеноконтрастные препараты. Абсолютное количество йода, вводимого при этом, в 200 000 — 350 000 раз превышает суточную потребность в элементе. В течение жизни человек потребляет всего около 3—5 г йода, в то время как при проведении коронарной ангиографии доза вводимого парентентерально йода составляет около 25—52 г. В связи с этим при проведении диагностических исследований с использованием рентгеноконтрастных препаратов следует принимать во внимание возможность развития йодиндуцированных состояний, особенно у лиц старшей возрастной группы, среди которых распространенность тиреоидной патологии особенно высока. Наличие автономных образований в щитовидной железе (ЩЖ), часто нераспознанных, может привести к развитию йодиндуцированного тиреотоксикоза (ЙИТ) после введения фармакологических доз йода, что в свою очередь может вызвать ухудшение течения ИБС и развитие аритмических осложнений.
В литературе продолжает обсуждаться вопрос о необходимости введения скрининга на выявление функциональных нарушений ЩЖ и проведения УЗИ ЩЖ до введения йодсодержащих рентгеноконтрастных препаратов. Спорным остается вопрос о необходимости превентивного лечения тиреостатическими препаратами лиц, составляющих группу риска по развитию ЙИТ.
Ключевые слова
Для цитирования:
For citation:
Рентгеноконтрастные средства (РКС), применяемые при ангиокардиографии
Наибольшее количество РКС вводят в организм при проведении коронаровентрикулографии, а также баллонной ангиопластики и стентирования. Частота проведения этих диагностических и лечебных процедур увеличивается год от года.
РКС начали использовать практически сразу после открытия В. К. Рентгеном Х-лучей. За всю историю развития РКС в качестве контрастных атомов были изучены многие химические элементы, в частности висмут, барий, тантал, стронций, йод, бром, фтор и др. Из них оптимальными оказались соединения йода и бария. Йод является универсальным компонентом РКС благодаря сочетанию следующих свойств: высокой плотности, относительно низкой токсичности, прочного ковалентного связывания с ароматическими кольцами, что позволяет получать стабильные соединения (в растворах РКС присутствует не более 0,1% свободного йода или йодидов) [2].
Впервые в 1929 г. R. dos Santos и соавт. использовали РКС для контрастирования артериальной системы. Прижизненная ангиография стала диагностической процедурой.
Отечественная химико-фармацевтическая промышленность выпускает 2 современных трийодированных РКС — триомбраст и йодамид. Применяют их для ангиокардиографии, аортографии, артериографии, селективной ангиографии.
Фармакокинетика йодсодержащих РКС для внутрисосудистого введения
Особенностью фармакокинетики ангиографических средств является высокая скорость их экскреции из организма почками при условии нормального функционирования мочевыделительной системы. Это в первую очередь объясняется низким связыванием этих веществ с транспортными белками крови. Одними из первых распределение трийодированных РКС после однократного внутривенного введения изучили Е. McChesney и J. Hoppe (1957). Они наблюдали за изменением содержания препарата в тканях и органах кошек и его выделением с мочой через 0,5, 1, 3 и 5 ч. В порядке убывания величины этого показателя ткани можно расположить следующим образом: кровь (11%), скелетная мускулатура (9%), печень (7%), почки (2,5%). Приведенный характер распределения соответствует 30-й минуте наблюдения. В мочу за указанное время поступает около 40% вещества.
С целью выяснения возможной роли непосредственного взаимодействия молекул рентгеноконтрастных препаратов с ЩЖ была изучена кинетика поглощения меченных радиоактивным йодом РКС этой тканью [2]. Результаты исследования показали интенсивное включение радиоактивного йода в ЩЖ после введения меченного триомбраста. И хотя общее количество связанного препарата было незначительным (ко 2-му часу исследования доля поглощенного радиоактивного йода составляла 0,5% от введенной дозы) из-за малого размера самой железы (около 0,01% от массы тела), удельная радиоактивность (или концентрация в ткани) была высокой. Со временем она не уменьшалась, как в других тканях, а возрастала. Интересно отметить, что в первые 5 мин удельная радиоактивность ЩЖ соответствовала концентрации РКС в крови и только через 0,5 ч начиналась фаза интенсивного поглощения радиоактивного йода. Это приводило к возрастанию концентрации последнего в ЩЖ, которая ко 2-му часу исследования превышала его концентрацию в плазме почти в 50 раз.
Метаболизм йодсодержащих РКС
Результаты исследования метаболизма йодсодержащих рентгеноконтрастных препаратов в организме животных и человека позволяют выделить 3 пути их биотрансформации: конъюгацию, расщепление боковых цепей, дейодирование.
Среди путей метаболизма РКС особый интерес представляет их дейодирование. Именно дейодирование может быть одной из причин длительной блокады йодпоглотительной функции ЩЖ. Печень и периферические ткани млекопитающих содержат дей- одиназы, которые могут дейодировать РКС [2] подобно тироксину [3, 10, 16, 23].
Вывод о возможности дейодирования РКС подтвержден в работе М. Kelly и соавт. (1981), в которой с помощью потенциометрического титрования и йодселективных электродов показано выделение йодидов с мочой у кроликов и человека после знутривенного введения им 3 ионных (метризоат, диатризоат и йодталамат) и 3 неионных (метризамид, йопамидол и С29) препаратов. Экскреция йодидов с мочой увеличивалась при повышении дозы этих контрастных веществ. Если учесть, что внеклеточный пул йодидов у человека составляет около 1 мг, то отщепление лишь 1% йода, входящего в состав РКС, может привести к возрастанию этого уровня в 100—200 раз. Такая йодная нагрузка влияет на обмен йода в организме, изменяя метаболизм тиреоидных гормонов, и является причиной подавления функции ЩЖ. Не исключено также, что отщепивший от РКС иод может связываться с белковыми структурами в печени или почках, меняя их функции. Однако до настоящего времени механизм дейодирования и зависимость его интенсивности от функционального состояния печени и почек, т. е. органов, от- . етственных за выделение РКС из организма, слабо изучены. До сих пор не выяснено, какие биологические катализаторы ответственны за отщепление йода от молекул РКС и от каких факторов зависит путь их биотрансформации.
Механизм воздействия йодсодержащих РКС на функцию ЩЖ
Одним из побочных эффектов РКС является изменение функции ЩЖ. Хотя прошла уже почти четверть века с момента обнаружения у РКС данного эффекта, достаточно полного ответа на вопрос, почему так быстро и на такой продолжительный период блокируется функция ЩЖ, до настоящего времени не получено. Эффект РКС отличается от действия неорганического йода. РКС частично подавляет поглощение йода ЩЖ, в то время как натрия йодид в течение первых 5 сут полностью блокирует поступление радиоактивного йода в ЩЖ. Другим важным отличием РКС от натрия йодида является то, что тирео- статический эффект РКС отмечается и через 30—50 дней после введения препаратов, в то время как даже самые высокие дозы натрия йодида (850 мг/кг) угнетают функцию ЩЖ в течение 10—14 дней [2]. Полученные результаты свидетельствуют о том, что действие РКС на ЩЖ значительно сложнее, чем действие натрия йодида, и его механизм не может быть объяснен только процессом дейодирования. Кроме влияния на йодпоглотитель- ную функцию ЩЖ, РКС могут влиять на секрецию тиреоидных гормонов, их транспорт системой крови и взаимодействие с клетками-мишенями. У лиц с нормальной функцией ЩЖ РКС снижают концентрацию в сыворотке трийодтиронина (Т3), увеличивают уровень реверсивного Т3. Эти изменения сопровождаются подавлением активности 5"-дейодиназы и снижением превращения тироксина (Т4) в Т3. Отдаленные эффекты РКС зарегистрировали Н. Brenel и соавт. У больных без патологии ЩЖ через 6 нед после введения РКС наблюдалось увеличение концентрации Т3 в сыворотке, снижение уровня тиреотропного гормона (ТТГ) и уменьшение его секреции, стимулированной ти- ролиберином. Эти реакции сохранялись в течение 6 мес. Важно подчеркнуть, что, согласно наблюдениям авторов, влияние РКС на уровень тиреоидных гормонов было выражено сильнее у тех больных, которые проживали в условиях йодного дефицита. Кроме того, блокирующий эффект зависел от исходного состояния ЩЖ и уровня потребления йода.
В ЩЖ существует особый регуляторный механизм, обеспе- -швающий нормальное функционирование органа в присутствии избытка йода. Когда человек с нормальной функцией ЩЖ получает большое количество йода, то происходит транзиторное снижение синтеза тиреоидных гормонов в течение примерно 48 ч. Избыток йода подавляет присоединение молекулярного йода к тиреоглобулину и образование Т3 и Т4 из моно- и дийодтирози- на. Этот процесс называется подавляющим эффектом Вольфа- Чайкова. Впоследствии синтез тиреоидных гормонов вновь становится нормальным, несмотря на продолжение действия фармакологических доз йода, т. е. восстанавливается эутиреоз. Феномен "ускользания" от эффекта Вольфа—Чайкова является адаптационным процессом и связан со снижением интратирео- идного содержания йода. Наиболее вероятный механизм развития этого явления — снижение активности натрий-йодного симпортера, приводящее к уменьшению поступления элемента в ЩЖ. Таким образом, несмотря на высокое содержание йода в плазме, интратиреоидное содержание его снижается. Когда уровень йода в железе оказывается ниже значений, поддерживающих эффект Вольфа—Чайкова, происходят восстановление процесса органификации и нормализация функции ЩЖ. Феномен "ускользания" от эффекта Вольфа—Чайкова является внутриклеточным механизмом регуляции обмена йода и не зависит от ТТГ. Кроме того, в ответ на введение больших количеств йода уменьшается освобождение тиреоидных гормонов из ЩЖ с компенсаторным увеличением базального и стимулированного тиролиберином уровня ТТГ (но в пределах нормальных значений). После прекращения приема элемента уровни тиреоидных гормонов и ТГГ возвращаются к исходным значениям [1].
По данным американских исследователей, пограничное количество йода, которое не оказывает влияния на функцию ЩЖ, составляет 500 мкг/сут [19]. В исследовании Peters и соавт. прием 1,5 мг йода в неделю в течение 6 нед с последующим приемом 2 мг йода еженедельно в течение 1,5 мес не влияет на тиреоидную функцию [15]. По данным других исследований, прием 500 мкг йода в день вызывает существенное увеличение базальной и стимулированной тиролиберином концентрации ТТГ [4, 9]. По данным R. Wahl и соавт., введение 1500 мкг йода в день в течение 15 дней здоровым людям приводит к значительному уменьшению концентрации сывороточного тироксина и увеличению уровня ТТГ [22]. Тем не менее многие люди регулярно принимают огромные дозы йода — от 10 до 200 мг в день — без каких-либо побочных эффектов [5]. Например, в составе амиодарона, содержащего 75 мг йода в капсуле, в составе пищевых продуктов (морепродуктов, молочных продуктов, обогащенных пищевыми добавками, в состав которых входит йод).
Как было отмечено выше, количество йода, вводимого в составе рентгеноконтрастных препаратов при коронарографии, в 200 000—350 000 раз превышает суточную потребность в элементе и составляет около 25—52 г. Лица, не имеющие патологии ЩЖ в анамнезе, как правило, сохраняют толерантность к приему больших доз йода и у них сохраняется эутиреоз. У лиц с предшествовавшими заболеваниями ЩЖ, особенно в йоддефицит- ных регионах, может развиться гипотиреоз в ответ на поступление в ЩЖ избыточных количеств йода или ЙИТ.
Гипотиреоз, индуцированный йодом (ЙИГ)
Считается, что развитие ЙИГ связано с персистированием эффекта Вольфа—Чайкова. У здоровых лиц такой эффект йодсодержащего препарата исчезает через 1—2 нед. У лиц с предшествующими заболеваниями ЩЖ может развиться гипотиреоз. Развитие гипотиреоза может быть обусловлено наличием скрытого дефекта метаболизма йода в ЩЖ, проявляющегося под действием избытка элемента. Наиболее часто ЙИГ встречается у лиц с существующими или перенесенными заболеваниями ЩЖ, такими как аутоиммунный тиреоидит, диффузный токсический зоб, после резекции ЩЖ по поводу узлового зоба. ЙИГ может носить явный или субклинический характер (т. е. в лабораторных анализах определяется нормальный уровень свободных фракций Т4 и Т3 при повышении уровня ТТГ). При обследовании определяется повышение уровня йода в плазме, снижение захвата радиоактивного йода ЩЖ. Больные могут предъявлять жалобы на болезненность в области ЩЖ. После введения РКС функция ЩЖ, как правило, восстанавливается через 2—6 мес. Если сохраняется гипотиреоз, проводят заместительную терапию L-тироксином под контролем уровня ТТГ.
Тиреотоксикоз, индуцированный йодом
Введение йода как в органической, так и в неорганической форме может приводить к развитию ЙИТ. Существует большое количество клинических наблюдений, свидетельствующих о воздействии РКС на функцию ЩЖ, вплоть до развития тиро- токсического криза после проведения диагностической процедуры с использованием йодсодержащих РКС. В Германии проводили сравнительное изучение последствий проведения коронарографии и холангиографии на функцию ЩЖ [14]. После коронарографии экскреция йода в течение 6 мес так и не вернулась к исходному уровню, а уровень ТТГ достоверно снизился. В группе после холангиографии (вводится около 0,6% йода от уровня, вводимого при коронарографии) все пациенты остались эутиреоидными. В другом исследовании 28 пациентам, включая 33 пациента с заболеваниями ЩЖ, было введено 100 мл йогек- соладо проведения компьютерной томографии [18]. Показатели функции ЩЖ измеряли до ведения препарата, через 1 нед и 1 мес после. Захват 131 1 уменьшился на 53% через 1 нед после введения йогексола, но нормализовался через несколько недель, за исключением 1 пациента. Восемь из 22 пациентов с болезнью ЩЖ имели временное изменение функции ЩЖ. У 4 пациентов уровень ТТГ был увеличен через 1 нед после введения йогексола. У 4 других пациентов развился тиреотоксикоз, сохранявшийся в течение нескольких месяцев.
ЙИТ чаще всего развивается у лиц с автономными образованиями в ЩЖ. Развитие тиреотоксикоза при наличии автономных узлов зависит от уровня потребления йода и размеров гиперфункционирующего узла [12]. При увеличении потребления йода его накопление в автономных узлах возрастает и может вызывать усиление синтеза и секреции тиреоидных гормонов, приводящее к тиреотоксикозу [6]. При узловом эутиреозном зобе очень часто обнаруживается автономная ткань, и именно она ответственна за развитие тиреотоксикоза после поступления в организм йода с РКС [7].
Автономию можно определить как функционирование фолликулярных клеток ЩЖ в отсутствие нормального физиологического стимула — ТТГ [19]. Об автономии свидетельствуют локальные изменения, проявляющиеся наличием высокоактивных очагов, видимых при сканировании ЩЖ. Такие изменения могут иметь вид одиночной гиперфункционирующей аденомы или, чаще, множественных автономных участков. Тиреоидные гормоны, секретируемые этими узлами, подавляют функцию гипофиза и снижают уровень ТТГ в сыворотке, приводя к ослаблению стимуляции неавтономной ткани. Автономные участки могут быть как моно-, так и поликлональными. Очаги автономии чаще появляются при многоузловых зобах, их частота выше у пожилых людей [12, 13, 17]. При увеличении потребления йода лицами с компенсированной функциональной автономией в узловой ткани возрастают синтез и секреция тиреоидных гормонов, и узловой зоб трансформируется из эутиреоидного в токсический. Об автономной секреции свидетельствует сниженная концентрация ТТГ в отсутствие тиреостимулирующих антител и диффузного токсического зоба. Однако автономная секреция в условиях дефицита йода может не проявляться, хотя именно в этих случаях ее диагностика должна иметь особое значение для прогнозирования ЙИТ. На автономию указывает присутствие "горячих" очагов в ЩЖ при сцинтиграфии, причем их сохранение на фоне введения супрессивных доз Т3 подтверждает диагноз. Однако применительно к больным с тяжелой кардиальной патологией возможность использования этого теста крайне ограниченна.
Развитие функциональной автономии преимущественно у лиц пожилого возраста определяет клинические особенности данного заболевания. Обычные симптомы тиреотоксикоза, такие как зоб, тахикардия, похудание, потливость, тремор рук и тела, повышенная возбудимость, могут быть выражены незначительно или отсутствовать. В клинической картине, как правило, доминируют сердечно-сосудистые и психические расстройства: апатия, депрессия, отсутствие аппетита, слабость, сердцебиение, нарушения сердечного ритма, симптомы недостаточности кровообращения. Часто больные страдают сопутствующими заболеваниями сердечно-сосудистой системы, патологией пищеварительного тракта, неврологическими заболеваниями, что маскирует основную причину заболевания. Повышенная чувствительность к адренергической стимуляции при тиреотоксикозе может увеличивать частоту желудочковых аритмий, особенно у больных с предшествующей сердечной патологией. Вначале мерцательная аритмия обычно носит пароксизмальный характер, но при сохраняющемся тиреотоксикозе становится постоянной. У больных с тиреотоксикозом и мерцательной аритмией повышен риск тромбоэмболических осложнений. При длительно существующем тиреотоксикозе у больных может развиться дилатационная кардиомиопатия, которая обусловливает снижение функциональной активности сердца и появление симптомов сердечной недостаточности.
В последнее время в литературе обсуждается вопрос о целесообразности превентивной тиреостатической терапии при введении РКС. В работе Н. Siggelkow и соавт. изучали пациентов с компенсированной автономией после коронарной ангиографии [21]. Из 1177 пациентов 51 имел критерии автономии (отрицательный тест с тиролиберином, повышенный захват 99п 'Тс, нормальный уровень Т3 и Т4). Тиреостатическую терапию начинали за 1 день до ангиографии и продолжали в течение 14 дней. Часть пациентов получали 20 мг/день тиамазола, другая — 900 мг/день натрия перхлората, третья группа не получала никаких препаратов. Через 30 дней после ангиографии в группе пациентов, которые не получали тиреостатической терапии, отмечены 2 случая тиреотоксикоза, уменьшение захвата 99т Тс, подавление уровня ТТГ и достоверное повышение содержания свободных фракций Т4 и Т3. В то же время у лиц, принимавших тиреоста- тические препараты, имелось по 1 случаю тиреотоксикоза, уровни свободных фракций Т4 и Т3, ТТГ и 99т Тс остались неизменными. Из этого следует, что кратковременная тиреостати- ческая терапия дает защитный эффект у пациентов с "эутиреоидной" автономией. Однако в некоторых случаях тиреотоксикоз не был предотвращен.
Н. Fritzsche и соавт. рекомендуют всем пациентам, которым планируется проведение коронарографии, проводить профилактику ЙИТ [8].
Тиреотоксикоз
Тиреотоксикоз – это состояние, связанное с избытком гормонов щитовидной железы в организме. Также такое состояние называется гипертиреоз. Это не диагноз, а следствие некоторых заболеваний щитовидной железы или воздействия внешних факторов.
1. Заболевания, сопровождающиеся избыточной продукцией гормонов щитовидной железы.
А) Диффузный токсический зоб (Болезнь Грейвса, Базедова болезнь). Это заболевание в 80-85 % случаев является причиной тиреотоксикоза.
Вследствие каких-либо причин происходит сбой в иммунной системе. Такие заболевания, когда клетки иммунной системы начинают вырабатывать вещества, которые атакуют собственные органы называются аутоиммунными. Болезнь Грейвса – аутоиммунное заболевание.
Б) Токсическая аденома и многоузловой токсический зоб.
Наличие узла (узлов) щитовидной железы, который в избытке продуцирует гормоны щитовидной железы. Это заболевание чаще встречается у пожилых людей.
В) Тиреотропинома – это образование гипофиза, которое в избытке синтезирует тиреотропный гормон (ТТГ), который стимулирует работу щитовидной железы. Очень редкое заболевание. Протекает с клиническими признаками тиреотоксикоза.
2. Заболевания, связанные с деструкцией (разрушением) ткани щитовидной железы и выходом гормонов щитовидной железы в кровь.
К этим заболеваниям относятся деструктивные тиреоидиты (подострый тиреоидит, тиреотоксикоз при аутоиммунном тиреоидите, послеродовый тиреоидит, безболевой тиреоидит).
К этой группе заболеваний можно также отнести кордарон-индуцированный (амиодарон-индуцированный) тиреотоксикоз. Это тиреотоксикоз, который возникает в результате лечения йодсодержащими антиаритмическими препаратами (Амиодарон, Кордарон). Прием препаратов вызывает деструкцию (разрушение) клеток щитовидной железы и выход гормонов в кровь.
3. Ятрогенный тиреотоксикоз – тиреотоксикоз, вызванный передозировкой препаратов тиреоидных гормонов (L-тироксин, Эутирокс – препараты для лечения гипотиреоза – состояния, связанного со снижением продукции тиреоидных гормонов).
Помимо увеличения размеров щитовидной железы, к основным симптомам тиреотоксикоза относятся:
высокое артериальное давление;
недостаточность кровообращения, часто проявляющаяся в виде нарушений ритма сердца;
повышенная возбудимость и быстрая утомляемость;
нарушения внимания и памяти;
дрожь (тремор) тела и особенно пальцев рук;
повышение сухожильных рефлексов;
потеря веса при хорошем или даже повышенном аппетите. Вес уменьшается из-за усиленного теплообмена, требующего большого количества энергии. Отдельные больные, наоборот, набирают вес благодаря аппетиту, не соответствующему скорости метаболизма;
повышенная температура тела;
расслаивание и ломкость ногтей;
ломкость и выпадение волос;
неустойчивый и частый стул;
нарушение функции печени вплоть до гепатита;
развитие недостаточности надпочечников;
нарушение менструального цикла у женщин вплоть до аменореи;
снижение либидо у мужчин;
поражение молочных и грудных желез;
нарушение толерантности к углеводам вплоть до развития сахарного диабета;
Основным направлением в диагностике тиреотоксикоза – это диагностика, осуществляемая по внешним признакам, указанным выше. Кроме этого, необходимо проводить:
Гормональное исследование крови;
Определение антител – подтверждение аутоиммунной природы заболевания.
УЗИ щитовидной железы.
В некоторых случаях врач может назначить исследование – сцинтиграфию щитовидной железы. Это исследование показывает, насколько щитовидная железа может захватывать йод и другие вещества (технеций). Это исследование позволяется уточнить причину тиреотоксикоза. Для болезни Грейвса характерен усиленный интенсивный захват радиофармпрепарата. Для тиреотоксикоза вследствие деструкции (разрушения) ткани щитовидной железы характерно уменьшение захвата или отсутствие захвата йода (технеция).
При наличии эндокринной офтальмопатии, экзофтальма выполняется УЗИ глазницы или магнитно-резонансная или компьютерная томография области глазниц.
При лечении данного заболевания выделяют три главных пути: традиционный (консервативный), хирургический, а также терапия радиоактивным йодом.
Под хирургическим способом лечения тиреотоксикоза понимают удаление части щитовидной железы для сокращения выработки гормонов. Этот метод применим и эффективен в случае возникновения в органе узелковых образований и/или уплотнений, которые и вызывают нарушение.
Лечение радиоактивным йодом подразумевает прием специальным препаратов, содержащих І131.
Консервативное лечение заключается в уменьшении уровня выбросов гормонов щитовидной железой при помощи фармацевтических препаратов.
Гипокалиемия при тиреотоксикозе. Феномен Хегглина при тиреотоксикозе
Гипокалиемия при тиреотоксикозе. Феномен Хегглина при тиреотоксикозе
Выраженную гипокалиемию отмечает также и Н. А. Кандренкова (1966). При параллельном изучении содержания электролитов в крови и изменений ЭКГ аспирант нашей кафедры Н. М. Салихова установила понижение содержания калия в плазме крови соответственно тяжести тиреотоксикоза; так, при легкой степени количество калия было 17,2 мг%±0,73 (норма— 16,0—20 мг%), при средней тяжести содержание калия было—16,8 мг%±0,35, тогда как при тяжелом тиреотоксикозе уровень калия в крови был только 13,9±0,49 мг%. Эти данные оказались статистически достоверными.
Изменения в содержании натрия не были столь закономерными. Не менялся также и калий в эритроцитах. Степень снижения калия в крови соответствовала выраженности ЭКГ-изменений, что позволяет связывать их отчасти с нарушениями электролитного баланса.
Изучение уровня калия в крови и моче в динамике показало, что при улучшении состояния и снятии тиреотоксикоза содержание калия в крови нормализуется.
При одновременном исследовании ЭКГ и ФКГ у 150 больных тиреотоксикозом А. Г. Салимьяновой были установлены у подавляющего числа больных удлинение электрической систолы по длине интервала QRST и увеличение систолического показателя по сравнению с должными величинами. Наряду с изменениями соотношений между электрической и механической систолой, А. Г. Салимьянова установила также у многих больных наличие синдрома Хеггли-на — преждевременное появление II тона. В несколько меньшем проценте случаев подобные изменения были описаны В. А. Шульман (1966).
При обследовании 73 больных тиреотоксикозом он обнаружил положительный феномен Хегглина у 19 больных. Укорочение механической систолы происходило за счет обеих составляющих ее фаз — фазы изометрического сокращения и фазы изгнания.
Хегглин трактует описанный им феномен как проявление энергетически-динамической недостаточности сердца, которая может развиться при различных заболеваниях, сопровождающихся выраженными сдвигами в электролитном обмене. Однако наблюдения ряда авторов показали, что феномен Хегглина может возникать не только при электролитных сдвигах, но и при выраженной гиперфункции миокарда.
Удлинение электрической систолы расценивается многими как проявление дистрофических процессов в миокарде (А. А. Кедров, 1963; Е. М. Сазонова, 1960; В. Н. Бриккер, 1960, и др.). Хотя электрическая систола и не отражает непосредственно сократительные свойства миокарда, все же учет ее представляет большую ценность, так как характеризует состояние электролитных сдвигов, которые нередко предшествуют нарушениям сократительной функции сердечной мышцы. В последних работах Hegglin (1961) склонен связывать укорочение Q — II тон с увеличением силы сердечных сокращений.
Можно согласиться с мнением многих авторов, расценивающих ЭКГ-изменения в ранних стадиях тиреотоксикоза как проявления усиления сокращений миокарда, что, возможно, связано с воздействием катехоламинов.
Помимо удлинения электрической систолы, почти у всех больных тиреотоксикозом А. Г. Салимьяновой было установлено укорочение механической систолы (по интервалу I—II тон), которое, по мнению многих авторов (С. Б. Фельдман, 1965; В. Л. Карпман, 1965), дает ценную информацию о функциональном состоянии миокарда. Аналогичные изменения в виде укоре чения механической и электрической систолы было установлено А. М. Гуровой и В. Е. Герцен (1965) у 45 больных тиреотоксикозом.
Несомненно, при состояниях гипертиреоза имеет место гиперфункция миокарда, причем по мере усиления тяжести тиреотоксикоза увеличивается частота появления синдрома Хегглина и, наоборот, в процессе лечения и снятия тиреотоксикоза исчезает и синдром Хегглина. Помимо изменения временных показателей, у некоторых больных регистрировались дополнительно III и IV тоны, которые также могут служить показателем изменений сократительных свойств миокарда. Появление III тона объясняется быстрым, пассивным заполнением левого желудочка из-за разницы давления в предсердии и желудочке.
Во время активного заполнения левого желудочка может возникнуть IV тон благодаря систоле предсердия. Дополнительные тоны могут появляться и в физиологических условиях у молодых людей до 30 лет. В более пожилом возрасте их наличие расценивается как патологическое явление. На возникновение III тона у больных тиреотоксикозом указывают многие авторы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тиреотоксикоз
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение
Тиреотоксикоз — клинический синдром, возникающий при повышенном содержании в крови гормонов щитовидной железы. Избыток этих гормонов влияет на функционирование различных органов и систем. Больные жалуются на сухую кожу, ломкость волос, одутловатость лица, может наблюдаться мелкий тремор век, пальцев и даже всего тела. Возникают небольшие колебания температуры, повышенная нервная возбудимость, потливость, чувство жара, суетливость. Наблюдаются внезапные приступы мышечной слабости. Человек становится неуживчивым, мнительным, избыточно деятельным. Нарушается сон.
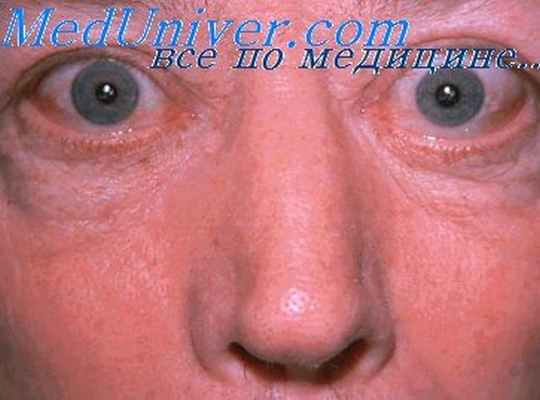
У больного появляется припухлость и потемнение кожи верхних век, слезотечение, светобоязнь, чувство давления и «песка» в глазах, пучеглазие (экзофтальм). При поражении глаз средней или тяжелой степени может отмечаться снижение остроты зрения, больные не могут сомкнуть веки, поэтому развивается поражение роговицы и склер (изъязвление, присоединение инфекции).
У некоторых больных на передней поверхности голени развивается поражение кожи и подкожной жировой клетчатки - четко очерченные уплотнения багрово-синюшного цвета (узловатая эритема). У мужчин иногда отмечается утолщение фаланг пальцев рук за счет отека тканей.
В связи с влиянием гормонов щитовидной железы на сердечно-сосудистую систему больных беспокоят нарушения сердечного ритма (тахикардия, экстрасистолия, мерцательная аритмия).
Часто встречаются нарушения со стороны желудочно-кишечного тракта. Даже при повышенном аппетите уменьшается масса тела за счет ускоренного обмена веществ. Могут наблюдаться приступы боли в животе, рвота, расстройство стула, иногда запоры. В тяжелых случаях поражается печень - регистрируется ее увеличение, болезненность, редко желтуха.
Под воздействием провоцирующих факторов (стрессовых ситуаций, физического перенапряжения, инфекционных заболеваний, оперативного вмешательства) может возникнуть тиреотоксический криз. В результате внезапного высвобождения в кровь большого количества гормонов щитовидной железы больные становятся беспокойными, значительно повышается температура тела, резко усиливается тахикардия, дыхание учащается, повышается артериальное давление.
Разновидности тиреотоксикоза
I. Тиреотоксикоз, обусловленный повышенной продукцией гормонов щитовидной железы:
- Болезнь Грейвса (диффузный токсический зоб).
- Многоузловой токсический зоб.
- Токсическая аденома щитовидной железы.
- Рак щитовидной железы.
- ТТГ-секретирующая аденома гипофиза.
- Хорионэпителиома.
- Struma ovarii (опухоль яичника).
- Функционирующие метастазы рака щитовидной железы.
- Медикаментозный тиреотоксикоз.
- Тиреотоксическая фаза деструктивных тиреоидитов (подострый, послеродовый).
Возможные причины тиреотоксикоза
Повышение гормонов щитовидной железы в крови может наблюдаться по нескольким причинам:
- как результат повышения продукции тиреоидных гормонов в щитовидной железе;
- как результат разрушения ткани щитовидной железы и попадания в кровь большого количества тиреоидных гормонов;
- при передозировке препаратов тиреоидных гормонов или в результате побочных эффектов медикаментозной терапии амиодароном.
Если узел, продуцирующий гормоны в повышенном количестве, одиночный, то говорят о токсической аденоме.
Диффузный токсический зоб - это аутоиммунное заболевание, при котором появляются антитела к структурным компонентам клеток собственной щитовидной железы. Антитела – это специальные белки иммуноглобулины (Ig), которые вырабатывает иммунная система в ответ на попадание любого чужеродного агента в организм для борьбы с ним. В данном случае иммунная система распознает ткань щитовидной железы как чужеродную.
Эти антитела оказывают на щитовидную железу стимулирующее действие, вызывая ее гиперфункцию с увеличением объема, массы железы, а следовательно, и концентрации тиреоидных гормонов в крови. Антитела способны преодолевать плацентарный барьер и вызывать тиреотоксикоз новорожденных. Поэтому выявление антител у беременных женщин имеет большое значение для будущего ребенка.
Тиреотоксикоз может наблюдаться на фоне подострого тиреоидита. Подострый тиреоидит (воспаление ткани щитовидной железы) возникает в результате вирусного заболевания и протекает как типичное воспаление. В период, предшествующий развитию заболевания, могут наблюдаться боли в мышцах, недомогание, субфебрильная лихорадка, общая слабость, боль в горле, утомляемость. Затем появляется умеренная или сильная боль в области щитовидной железы, часто иррадиирущая в уши, челюсть или горло. Иногда отмечается боль при глотании и поворотах головы. Щитовидная железа обычно несколько увеличена, нарастающий фиброз железы (разрастание соединительной ткани) проявляется повышением ее плотности.
В развитии подострого тиреоидита выделяют 4 фазы. Первая - тиреотоксическая, которая длится от 4 до 10 недель. Она развивается в острой стадии заболевания за счет повышения проницаемости сосудов на фоне воспаления и повышенного выброса ранее синтезированных тиреоидных гормонов. У больных выявляются симптомы тиреотоксикоза. Когда запасы гормонов в щитовидной железе истощаются, наступает эутиреоидная фаза, которая длится 1–3 недели. Ее сменяет гипотиреоидная фаза, продолжающаяся от 2 до 6 месяцев, и затем наступает выздоровление.
Явления тиреотоксикоза могут манифестировать на фоне послеродового тиреоидита через 1,5-3 месяца после родов.
Хорионэпителиома - злокачественное новообразование, которое образуется из клеток эпителия хориона во время или после беременности чаще в матке и продуцирует гормон хорионический гонадотропин. Этот гормон – слабый стимулятор клеток щитовидной железы. Но при его высоких концентрациях (300 000 ед./л) может возникнуть тиреотоксикоз.
Struma ovarii, или опухоль яичника - относится к тератомам (опухолям из нетипичной ткани для данной локализации), в которых тиреоидная ткань преобладает или составляет значительный компонент опухоли. В 20-30% случаев опухоль бывает представлена только тканью щитовидной железы. 5-6% этих опухолей продуцируют тиреоидные гормоны в количестве, достаточном для развития тиреотоксикоза.
Крупные гормонально-активные метастазы фолликулярного рака щитовидной железы – очень редкие причины тиреотоксикоза.
Тиреотоксикоз может возникнуть при передозировке тиреоидных гормонов, вследствие неадекватной йодной профилактики или на фоне применения амиодарона.
Амиодарон – высокоэффективный и широко применяемый в кардиологии антиаритмический препарат. Дисфункция щитовидной железы - частое побочное действие амиодарона, обусловленное или чрезмерным бесконтрольным синтезом гормонов в ответ на йодную нагрузку и/или деструкцией железы. Амиодарон-индуцированный тиреотоксикоз имеет большое значение, поскольку он усугубляет течение сердечно-сосудистого заболевания.
К каким врачам обращаться при тиреотоксикозе
При первых проявлениях тиреотоксикоза необходимо обратиться к врачу-терапевту или врачу общей практики. При подтверждении диагноза после проведения комплекса лабораторно-диагностических мероприятий врач-эндокринолог назначает терапию, проводит ее коррекцию и следит за течением заболевания.
Диагностика и обследования при тиреотоксикозе
В диагностике заболевания помимо подробного опроса и осмотра больного, при котором выявляют признаки тиреотоксикоза, используют данные лабораторных и инструментальных методов исследований.
- Клинический анализ крови с определением концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоформулу и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов).
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Субклинический тиреотоксикоз
Продолжаем тему стёртых, "замаскированных" состояний в эндокринологии. Для начала нужно определится с понятиями.
Следующая картинка: в анализах сниженный ТТГ ниже 0.4 мМЕ/мл (ниже нижней границы по лаборатории!) с нормальным уровнем Т4 свободного и/или нормальным уровнем Т3 свободного и является понятием субклинического тиреотоксикоза.
У большинства специалистов принято определение субклинического тиреотоксикоза (СТир) - "Это феномен, при котором определяется сниженный уровень ТТГ при нормальных уровнях свободного Т3 и Т4"(по V.Fadeyev).
Определение уровня ТТГ является самым частым гормональным исследованием в мире! Его сниженный или подавленный уровень требует интерпретации достаточно часто.
Если с истинным синдромом тиреотоксикоза всё понятно, то со стёртой его формой – «субклиническим тиреотоксикозом» ещё придётся поломать голову эндокринологу.
Субклинический тиреотоксикоз (официальная аббревиатура СТир) может иметь или не иметь заметные симптомы. Но на то этот симптом и «субклинический», и главными вопросами тут будут являться: опасно ли это? И надо ли это состояние лечить? Для выяснения первого вопроса - надо выяснить причину появления СТир.
Причинами могут быть:
- многоузловой токсический зоб
- одноузловой зоб с преобразованием в токсическую аденому (при размерах узла более 2,5 см)
- Хаши–токсикоз при АИТ
- дебют ДТЗ (диффузно-токсического зоба) в стёртом варианте,
- СТир как симптом опухоли, локализацией вне щитовидной железы ( например, опухоли лёгких)
- передозировка Л-тироксина
- действие других лекарств (например после рентгенконтрастного исследования с применением большой дозы йода)
- синдром эутиреоидной патологии и др.
Естественно, причину устанавливает врач, вы можете только помочь ему – подробно рассказывая об изменении самочувствия в течение ближайших 3-6 месяцев.
Интересный факт: бывает - физиологическое снижение ТТГ от 0,1 - 0,39, характерно для первого триместра беременности, а вот при зачатии двойни, уровень ТТГ может опускаться до 0,005 мМЕ/мл – и это не является патологией. Поэтому, перед началом диагностики и лечения молодым женщинам, а иногда и женщинам после 45 лет, нужно определить с помощью теста или анализа крови на ХГЧ – не беременны ли вы?
Для уточнения диагноза сдаётся развёрнутый анализ крови на тиреоидные гормоны: ТТГ, Т4 свободный, Т3 свободный, антитела к ТПО, антитела к ТГ, антитела к рецептору ТТГ. Доктор решает – делать ли сцинтиграфию щитовидной железы или кривую захвата йода, реже МРТ органов шеи.
Для того, чтобы определиться с лечением, учитывают:
- причину, вызвавшую СТир
- возраст пациента
- сопутствующие заболевания, особенно сердечно-сосудистые, перенесённый инсульт, наличие мерцательной аритмии или фибриллиции предсердий, сердечной недостаточности и некоторых других
- степень тяжести состояния.
Степени тяжести СТир. Их бывает всего две
1 степени – с уровнем ТТГ от 0,1-0,39 мМЕ/мл
2 степени – с уровнем ТТГ ниже 0,1 мМЕ/мл.
Кроме того сублинический тиреотокискоз может быть стойким (перманентным) или преходящим (транзиторным) - от этого также будет зависеть терапия.
Лечение СТир показано обязательно для следующих групп пациентов:
- пациентам моложе 65 лет, при симптомах тиреотоксикоза, особенно если повышены антитела к рецептору ТТГ или усилен захват йода при проведении кривой захвата йода/признаки тиреотоксикоза по сцинтиграфии щитовидной железы
- пациентам старше 65 лет с признаками/без признаков ТТЗ, с наличием ишемической болезни сердца, стенокардии, мерцательной аритмии, стенокардии Прицметалла, перенесённым инсультом или транзиторной ишемической атакой
- пациентам с доказанной причиной СТир - токсическая аденома или многоузловой токсический зоб, лечение чаще радиойодом
- Хирургическое лечение рекомендуется пациентам с СТир в сочетании с очень большим зобом, симптомами компрессии сдавления), сопутствующим гиперпаратиреозом или при подозрении на рак ЩЖ
- кроме того, лечение субклинического тиреотоксикоза показано при тяжёлом остеопорозе с переломами в анамнезе или без, так как СТир повышает риски переломов у пожилых пациентов в разы (особенно старше 65 лет)
Тиреостатические препараты (Тирозол, Мерказолил, Пропицил) являются средством первого выбора в лечении молодых пациентов с болезнью Грейвса (диффузно-токсическим зобом), протекающей с СТир 2-й степени, и у пациентов старше 65 лет с Болезнью Грейвса , протекающей с СТир 1-й степени, поскольку вероятность ремиссии после 12–18 мес терапии тиреостатиками высока и может достигать 40–50%.
Терапия радиоактивным йодом показана в ситуации плохой переносимости тиреостатиков, а также при рецидиве тиреотоксикоза и у пациентов с сопутствующей сердечной патологией.
Если принято решение пожизненной терапии тиростатиками, такие случаи тоже бывают (когда невозможно оперировать щитовидную железу) – надо помнить, что эти препараты могут вызывать резкое падение уровня лейкоцитов – лейкопению с переходом в агранулоцитоз, ангину, то есть надо периодически (1 раз в 3 мес.) контролировать клинический анализ крови и, желательно, биохимию печени – АЛТ, АСТ, ГГТП.
В остальных случаях показано наблюдение за состоянием щитовидной железы, прежде всего за состоянием гормонального фона, сначала контроль ТТГ, Т4 свободного, Т3 свободного через 3 месяца, а при отсутствии симптомов и динамики уровня гормонов – контроль анализов каждые 6-12 месяцев.
Читайте также:
