Гистологическое строение саркомы Капоши.
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Саркома Капоши – заболевание, связанное с вирусом герпеса; чаще встречается у людей, зараженных вирусом иммунодефицита человека. Несмотря на стандартную противовирусную терапию, болезнь может прогрессировать, и лечение саркомы мягких тканей может быть неэффективным. И вновь на помощь ученым приходят генные технологии. Обнаружен связывающий углерод белок, который способствует быстрому росту опухоли. Блокирование этого белка замедлит рост опухоли (в том числе, подавляя в ней образование сосудов), что откроет новые перспективы для лечения больных саркомой Капоши.
Саркома Капоши (ангиосаркома Капоши) – это многоочаговая злокачественная опухоль, которая поражает весь организм; происходит из эндотелия сосудов и обладает различным клиническим течением. Чаще всего болезнь проявляется новообразованиями кожи, но способна затрагивать и слизистые оболочки, и лимфатическую систему, и внутренние органы (прежде всего, легкие и ЖКТ). Выделяют четыре клинические формы саркомы Капоши: классическая (европейская), иммуносупрессивная, эндемическая (африканская) и эпидемическая (ассоциированная со СПИДом).
Обычно у опухоли пурпурная окраска, но иногда цвет имеет различные оттенки: красный, фиолетовый или бурый. Опухоль может быть плоской или слегка возвышаться над кожей, представляет собой безболезненные пятна или узелки. Саркома Капоши часто сочетается с повреждением слизистой неба, лимфоузлов. Течение заболевания медленное. Обнаружение саркомы Капоши при ВИЧ-инфекции дает основание для постановки диагноза СПИД. Саркома мягких тканей характеризуется малосимптомным течением и сходством клинической картины с доброкачественными опухолями и неопухолевыми заболеваниями.
Диагностика
Проводится полный осмотр кожи, а также слизистых рта и половых органов.
При наличии отметин на коже саркому Капоши в LISOD диагностируют с помощью биопсии. Образец ткани с отметины направляют в ведущие патоморфологические лаборатории Израиля и Германии, где достоверно определяют, о каком типе опухоли идет речь. Чтобы диагностировать легочную саркому Капоши, проводят бронхоскопию: вводится специальный прибор – бронхоскоп, с помощью которого специалист определяет, есть ли характерные отметины на легких. Также для диагностики этого вида саркомы используются рентгеновские снимки легких.
Для диагностики саркомы Капоши в кишечнике в эндоскопическом отделении, оснащенном точным современным цифровым оборудованием, проводят колоноскопию (исследование стенок толстой кишки). В LISOD эта процедура комфортна и безболезненна.
Лечение
Полную информацию о диагностике и лечении этого вида рака Вам предоставят консультанты Информационной службы LISOD:
- 0-800-500-110 (бесплатно для звонков со стационарных телефонов по Украине)
- или +38 044 520 94 00 – ежедневно с 08:00 до 20:00.
Выбор метода зависит от типа саркомы Капоши и клинического течения заболевания. План лечения в LISOD принимается на междисциплинарной онкологической конференции.
Лучевая терапия с успехом используется в клинике для лечения больных с единичными опухолевыми элементами при всех типах саркомы. Облучение применяют для относительно больших и глубоких отметин на коже. Радиационная терапия также подходит для всех участков тела, включая половой член и стопы, где другие локальные терапии могут быть слишком болезненны.
Местная химиотерапия. Некоторые опухоли, например внутри рта, вылечиваются маленькими дозами химиотерапии, которые вводятся гиподермической иглой.
При ограниченных поражениях используются: хирургический метод, криотерапия жидким азотом, фотодинамическая терапия.
Стандартная химиотерапия – препараты принимаются орально или инъекционно – лечит как существующие опухоли, так и предотвращает новые.
Саркома Капоши в легких или кишечнике требует системного лечения. Без него эти образования могут вызвать серьезное заболевание. Проводится системная полихимиотерапия или паллиативная монохимиотерапия.
Симптомы

Лучевой терапевт. Клинический онколог. Израиль
Записаться на прием
Саркома мягких тканей возникает в любой части тела. При классической форме саркомы Капоши первичные очаги поражения чаще располагаются на конечностях – стопах и переднебоковых поверхностях голеней.
Симметричность и многоочаговость – важная особенность саркомы Капоши. Саркома мягких тканей имеет вид округлого узла беловатого или желтовато-серого цвета с бугристой или гладкой поверхностью. На коже встречаются пятна, узелковоподобные бляшки, опухоли, реже – веррукозные и везикулезные элементы. Цвет очагов поражения меняется от красновато-синюшного до темно-бурого, очертания самые разнообразные, границы четкие, консистенция плотноэластическая; при пальпации очаги безболезненны, их поверхность часто неровная, имеются геморрагии, отложения гемосидерина.
Опухоли могут изъязвляться. Болезнь сопровождается отеком пораженной конечности. В редких случаях появляются буллезные высыпания, плоские бородавчатые бляшки на подошвах и ладонях. Встречаются изолированные поражения только половых органов, ушных раковин, глаз, слизистых оболочек рта и др. Субъективно больных беспокоят боль, ломота, жжение, парестезии, ограничение подвижности в суставах. Саркома Капоши – системное заболевание, поэтому в процесс могут вовлекаться лимфатические узлы, кости, висцеральные органы и др.
В отличие от классической формы саркомы Капоши, наблюдаемой у пожилых мужчин и протекающей с поражением кожи голеней и стоп, (саркома мягких тканей чаще встречается на нижних конечностях) эпидемическая саркома Капоши не имеет излюбленной локализации. Первый очаг может возникнуть на любом участке кожи, иногда на слизистой рта, половых органов или глаз. Как правило, вначале появляется безболезненный одиночный багровый или фиолетовый узел, либо пятно. Иногда очагов изначально несколько.
Дальнейшее развитие заболевания может быть разным. В одних случаях узлы и пятна не меняются годами, в других – стремительно, за несколько недель, разрастаются и распространяются. При быстром росте нередко возникает боль, а окружающая кожа в результате кровоизлияний становится желто-зеленой. В центре разросшейся опухоли часто формируется очаг некроза и изъязвление. Обычно опухоль легко кровоточит. Бляшки и узлы часто сливаются, вокруг возникает сильнейший отек. В полости рта очаги локализуются на твердом небе. Вначале появляется фиолетовая эритема, затем на ее месте образуются склонные к изъязвлению бляшки или узлы.
Факторы риска
К группам риска относятся:
- вич-инфицированные мужчины, особенно гомосексуалисты;
- пожилые мужчины средиземноморского происхождения;
- лица из экваториальной Африки;
- лица с пересаженными органами (реципиенты).
Частая смена половых партнеров повышает риск инфицирования. Вирус обнаружен в сперме, секрете предстательной железы, мочеиспускательном канале, прямой кишке. Часто заражение происходит при внутривенном введении наркотиков. Кроме того, ВГЧ-8 может передаваться от матери к плоду, однако риск такого вида заражения крайне низкий. Вирус встречается в большом количестве в слюне и передается при поцелуях.
Также факторами риска развития саркомы Капоши являются рецидивирующая рожа, длительный лимфостаз конечностей, продолжительный прием антибиотиков, глюкокорртикоидов и других иммуносупрессоров, травмы и отморожения конечностей.
Профилактика
Вопросы и ответы
В разделе публикуются вопросы пациентов и ответы наших специалистов. Вопрос каждого человека касается конкретной проблемы, связанной с его заболеванием. Пациентам отвечают израильские клинические онкологи и главный врач LISOD, д.м.н., профессор Алла Винницкая.
Ответы специалистов основаны на знаниях принципов доказательной медицины и профессиональном опыте. Ответы соответствуют исключительно предоставленным сведениям, имеют ознакомительный характер и не являются врачебной рекомендацией.
Основная цель раздела – дать информацию пациенту и его семье, чтобы вместе с лечащим врачом принять решение о виде лечения. Предложенная Вам тактика лечения может отличаться от принципов, изложенных в ответах наших специалистов. Не стесняйтесь задать лечащему врачу вопрос о причинах отличий. Вы должны быть уверены, что получаете правильное лечение.
Имеются специальные показания для послеоперационной профилактической или иначе - адьювантной химиотерапии ( видимо «Ад+Юв» и означает «адьювантная») при саркомах: это размеры опухоли ( как правило > 5 cм.) и т.н. дифференциация ( в вашем случае G3 –низкодифференцированная, т.е. агрессивная по течению) . Очень важно расстояние от удаленной опухоли до хирургических краев – при расстояниях менее 1 см. также рекомендуется послеоперационное облучения для снижения риска рецидива. ADCI – видимо, сокращение от названия лекарств, входящих в рекомендуемый протокол – адриамиицин, дакарбазин, цисплатин и ифосфамид. (Мы ограниичиваемся АI - адриамиицином и ифосфамидом). Я бы начал с ревизии гистологического материала в нашей референтной лаборатории в Германии. Проводилось ли иммунгистохимическое исследование препартов? Если речь идет действительно о саркоме, важно знать какой именно (под мезенхимомой понимают наличие нескольких видов сарком в одной опухоли – в таких случаях для прогноза - важно знать какой тип преобладает).
Добрый день! По предоставленной документации, ситуация достаточно непонятная. Химиотерапия проведена как при лимфоме, хотя Вы пишете, что гистологически установлена тимома. Это два различных заболевания. Не исключено, что оба они у Вас имеются! Следует пересмотреть КТ грудной и брюшной полостей. Находка в области поджелудочной железы может быть связана с лимфомой, а может являться и самостоятельным заболеванием (третьим?). Из рекомендаций - ревизия гистологических препаратов в референтной лаборатории в первую очередь.
Виталий, основным методом лечения таких опухолей является хирургическое вмешательство. В случае неоперабельности проводится химиотерапия с целью уменьшить опухоль и вновь взвесить хирургию. Не исключено, что после операции также неоходима лучевая терапия на ложе опухоли. У нас мы бы сделали ревизию гистологического материала и снова взвесили возможность оперативного вмешательства. При возможности полного удаления опухоли прогноз благоприятный.
Гистологическое строение саркомы Капоши.
Гистологическое строение саркомы Капоши.
Для гистологической картины саркомы Капоши, вне зависимости от клинического типа и локализации патологического процесса, характерны хаотичный, незавершенный ангиогенез, пролиферация веретенообразных клеток, образующих переплетающиеся пучки, и разрастание грануляционной ткани различной степени зрелости, инфильтрированной иммунокомпетентными клетками, в ранних и прогрессирующих очагах — лимфоцитами, в более «старых» и регрессирующих — плазматическими клетками и макрофагами.
Различные сочетания этих основных морфологических компонентов опухоли обусловливают многообразие гистологических форм саркомы Капоши.
Начальная стадия пятна саркомы Капоши характеризуется разрастанием в верхней части дермы сосудов капиллярного типа с широкими просветами, нередко «зазубренными» очертаниями, однослойной эндотелиальной выстилкой. Эндотелиальные клетки укрупнены, имеют вытянутую форму, напоминающую веретенообразные клетки, ядра их могут быть неправильной формы, гиперхромными. Отдельные скопления веретенообразных клеток встречаются вне связи с кровеносными сосудами. Васкулярные пролифераты окружены отечной рыхлой соединительной тканью, инфильтрированной лимфоцитами и плазматическими клетками. Могут присутствовать экстравазаты эритроцитов, а также сидерофаги. В некоторых очагах разветвленные, расширенные, бескровные лимфоподобные капиллярные пространства разделены прослойками коллагеновых волокон, что придает опухоли вид высокодифференцированной ангиосаркомы или прогрессирующей лимфангиомы. Этот дизагрегантный саркомоподобный вид заставил некоторых авторов обозначить его как особый вариант заболевания.
Папулы и бляшки саркомы Капоши представлены разрастаниями небольших солидных пучков веретенообразных клеток вокруг сосудов и придатков кожи. Иногда встречаются клетки овальной формы с обильной цитоплазмой, напоминающие эпителиоидные гистиоциты, в комбинации с хаотичными расширенными и щелевидными сосудистыми пространствами. Узлы представляют собой хорошо отграниченные разрастания хаотично переплетающихся тонких пучков веретенообразных клеток, разделенных щелевидными пространствами, содержащими эритроциты. Характерны также периваскулярная или периаппендикулярная пролиферация веретенообразных клеток, мононуклеарная иммуновоспалительная инфильтрация, отложение гемосидерина, эритрофагоцитоз.
Во всех опухолевых элементах саркомы Капоши, преимущественно по периферии, часто наблюдаются участки, напоминающие кавернозные гемангиомы, представленные порочно сформированными сосудистыми полостями, разделенными тонкими соединительнотканными перегородками.
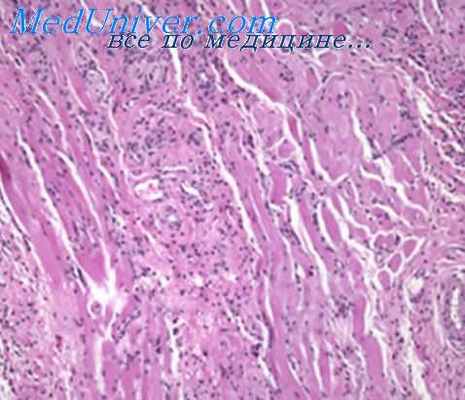
Лимфостаз при саркоме Капоши проявляется обилием резко расширенных лимфатических щелей в зоне роста опухоли, их новообразованием, отеком и плазматическим пропитыванием коллагена дермы.
Обширный некроз при саркоме Капоши относительно редок, но некроз отдельных веретенообразных клеток встречается довольно часто.
При СПИД-ассоциированной саркоме Капоши среди ранних элементов превалируют бляшки с ангиоматозными структурами и скоплениями клеток, напоминающих эпителиоидные гистиоциты, часто встречается некроз отдельных веретенообразных клеток.
Регрессирующая саркома Капоши характеризуется исчезновением веретеноклеточного компонента опухоли, склерозом и гиалинозом волокнистых структур, расположенных между сохранившимися сосудистыми каналами, сменой лимфоцитарной инфильтрации на готазмоклеточную.
При иммуногистохимическом исследовании саркомы Капоши выявляется положительная реакция на эндотелий ассоциированные антигены. CD31, CD34 и виментин экспрессируются в большинстве случаев. Однако реакция на такие маркеры, как антиген, связанный с фактором VIII и Ulex Europaeus lectin, вариабильна. Хорошо сформированные сосуды выстланы клетками, содержащими связанный с фактором V111 антиген, однако исследования реакции на этот маркер опухолевых веретенообразных клеток дают противоречивые результаты. В то же время веретенообразные клетки положительно окрашиваются на Ulex Europaeus lectin, OKM-5, E92 и НС1 — маркеры эндотелия капилляров. Иммунореактивность веретенообразных клеток варьирует в зависимости от характера элемента саркомы Капоши: в пятнистых очагах веретенообразные клетки положительны на антитела EN4 — маркер всех типов эндотелиальных клеток, но негативны на антитела PAL-E, специфичные для эндотелия кровеносных сосудов; веретенообразные же клетки узлов окрашиваются положительно как на EN4, так и на PAL-E.
Ультраструктурными исследованиями было показано, что большинство веретенообразных клеток саркомы Капоши имеет электронно-микроскопические характеристики эндотелиальных клеток.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
К вопросу о гистологическом строении саркомы Капоши
Цель: изучить гистологическое строение различных типов саркомы Капоши и морфогенетические потенции клеток сосудов в опухолевом росте.
Материалы и методы: проанализированы данные гистологического исследования саркомы Капоши от 5-ти пациентов: биопсии кожи и подкожной клетчатки у 3-х ВИЧ-инфицированных (2 мужчин и 1 женщина) и 1-го мужчины, участника ликвидации (дозиметрист) последствий аварии на Чернобыльской АЭС в 1986 г. Также исследованы опухолевые узлы саркомы Капоши желудка, лимфатического мезентериального узла и твердой мозговой оболочки женщины 41 г., умершей после аллогенной трансплантации почки по поводу гломерулонефрита, кожа при этом была интактной. Гистологические препараты окрашивались гематоксилином и эозином, пикрофуксином по Ван Гизону, алциановым синим и импрегнировались серебром по Бильшовскому.
Выводы: выделен пятый, еще не описанный в литературе, вариант саркомы Капоши - радиационный, обусловленный воздействием лучевой энергии.
Ключевые слова
Для цитирования:
For citation:
Введение
Одной из разновидностей сосудистых опухолей, по классификации ВОЗ, является так называемая «саркома Капоши» (СК), впервые описанная в 1872 г. венгерским дерматологом M. Kaposi, который рассматривал ее как злокачественное новообразование [1]. Опухоль чаще всего располагается на коже, имеет форму пятен, бляшек, узелков красного, багрового или бурого цвета, с гладкой или бородавчатой поверхностью, которая может изъязвляться и инфицироваться. Иногда поражаются слизистые оболочки (например, полости рта, желудка), лимфатические узлы и внутренние органы. Наиболее редко вовлекаются в процесс скелетные мышцы, головной мозг и почки.
СК имеет своеобразное течение, может подвергаться фиброзу, обратному развитию и довольно успешно подвергается лечению (хирургическому, радио- и химиотерапии), не приводя к летальному исходу [2,3]. В мировой литературе Саркому Капоши классифицируют на следующие четыре типа [4]:
- Классический, или спорадический, тип СК распространён в Центральной Европе, России и Италии. Наиболее часто опухоль локализуется на коже стоп, боковых поверхностей голеней, кистей. Границы очагов, как правило, чёткие. Возможны различные осложнения, а именно изъязвление, геморрагии, лимфедема, лимфоррея, болевой синдром и редко встречающиеся узловые образования во внутренних органах.
- Эндемический (африканский) тип СК распространён, в основном, у жителей Центральной Африки. Заболевание начинается преимущественно в детском возрасте, а его пик приходится на первый год жизни ребёнка. Одним из вариантов является лимфаденопатическая форма у детей, которая быстро прогрессирует и приводит к смерти. Трехлетняя выживаемость при такой форме приближается к нулю. Как правило, поражаются внутренние органы и лимфоузлы, кожные поражения редки и минимальны.
- Эпидемический тип СК, или ВИЧ-ассоциированный тип. Наличие опухоли является характерным признаком ВИЧ-инфекции. Характерен молодой возраст пациентов, яркость окраски и сочность элементов сыпи. Локализация опухолей — на кончике носа и слизистых оболочках, твёрдом небе и верхних конечностях. Отмечается быстрое течение заболевания с обязательным вовлечением лимфоузлов и внутренних органов.
- Иммунно-супрессивный, или ятрогенный, посттрансплантационный, тип протекает, как правило, хронически и доброкачественно. Развивается чаще всего после пересадки почки, при которой назначаются особые типы иммунносупрессоров, через период от нескольких месяцев до нескольких лет. Наибольший риск развития саркомы — в первые 2 года после трансплантации. При отмене препаратов наступает регресс заболевания. Внутренние органы вовлекаются редко. Болезнь встречается преимущественно у мужчин среднего возраста. Патологию трудно диагностировать на ранней стадии, так как визуальных симптомов может почти не быть.
Белки KSHV нарушают контроль нормальной клеточной пролиферации и предотвращают апоптоз посредством продуцируемых вирусом ингибиторов Р53 и вирусного гомолога циклина D, таким образом латентно инфицированные клетки получают преимущество в росте. На ранних стадиях заболевания инфицированы лишь немногие клетки. На поздних — все веретенообразные клетки опухолей несут KSHV и экспрессируют маркеры как эндотелиальных, так и гладкомышечных клеток (CD31) [2].
Таким образом, целый ряд признаков отличает СК от классических сарком: Среди них наиболее существенные: 1) связь с вирусной инфекцией; 2) отсутствие прогрессивно увеличивающихся первичных очагов и наличие обильных групп высыпаний на отдаленных участках; 3) сочетание разных стадий заболевания в одних и тех же очагах; 4) спонтанное обратное развитие некоторых поражений; 5)развитие фиброза в исходе заболевания. Лишь в ряде наблюдений очаги подвергаются злокачественной трансформации [3].
СК до появления ВИЧ-инфекции в России встречалась очень редко, в виде спорадических случаев, и гистологическая диагностика ее мало известна врачам. В последние годы в связи с распространением СПИДа произошло учащение этого заболевания [6], каждый случай которого требует тщательного гистологического изучения и анализа. В связи со сказанным приводим описания наблюдений.
Материалы и методы
Исследован материал биопсий кожи и подлежащих мягких тканей опухолей нижних (2) и верхней конечностей (2) у 3 пациентов с ВИЧ-инфекцией (2 мужчин и 1 женщина) и одного мужчины, ликвидатора последствий Чернобыльской аварии в 1986 г. (дозиметриста). Кроме того, изучены опухоли желудка, твердой мозговой оболочки, лимфатических узлов, взятые при патологоанатомическом вскрытии женщины 41 г. Она умерла от печеночной недостаточности, обусловленной хроническими вирусными гепатитами В и С через 3,5 года после аллогенной трансплантации трупной почки в левую подвздошную область в связи с хроническим гломерулонефритом и уремией.
Гистологические препараты окрашивались гематоксилином и эозином, пикрофуксином по Ван Гизону, алциановым синим и импрегнировались серебром по Бильшовскому.
Результаты
Наблюдения 1 и 2. У мужчин-наркоманов 32 и 45 лет с ВИЧ-инфекцией опухоли располагались на коже нижних конечностей в виде пятен красного цвета (рис. 1а, б).
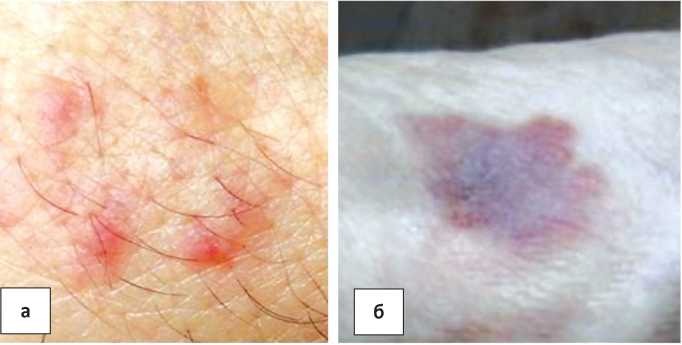
Рисунок 1. Саркома Капоши а) кожи стопы и б) голени в виде пятен у пациентов с ВИЧ-инфекцией.
Figure 1. Kaposi’s sarcoma a) skin of the foot and b) the skin from shin with spots of the patients with HIV infection.
Гистологически в дерме имелась диффузная воспалительная инфильтрация лимфогистиоцитарными элементами. На этом фоне отмечалась пролиферация эндотелиоцитов с новообразованием капилляров разнообразной формы — округлых, вытянутых, извитых, анастомозирующих между собой, а также мелких артерий мышечного типа и эктазированных вен. В некоторых эндотелиальных, перителиальных клетках и фибробластах стромы выявлялись увеличенные гиперхромные ядра с мелкими внутриядерными включениями (рис. 2а). Отдельные новообразованные сосуды венозного типа имели более крупные размеры, просветы их расширены, стенки неравномерной толщины, эндотелициты, выстилающие их, с крупными ядрами, с внутриядерными включениями. В одном из аналогичных сосудов отмечен внутрипросветный пристеночный ангиогенез, с формированием структур венозного типа (рис. 2б). В строме в отдельных участках отмечался очаговый фиброз. Отсутствовали признаки злокачественной опухоли: клеточный атипизм и полиморфизм, фигуры митотического деления, инфильтративный рост. Картина более всего соответствовала предопухолевым изменениям на фоне хронического воспалительного процесса.
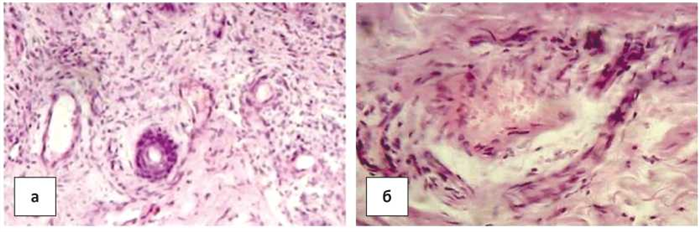
Рисунок 2. Гистологические изменения в коже при СК в стадии пятна: а) воспалительная инфильтрация дермы, пролиферация эндотелиоцитов с новообразованием капилляров, мелких артерий и вен. б) Внутипросветный, внутристеночный ангиогенез (интрасосудистая неоплазия низкой степени) в СК. Окраска гематоксилином и эозином. Ув.× 200.
Figure 2. Histological changes in the skin with SK in the spot stage: a) infl ammatory dermal infi ltration, proliferation of endotheliocytes with the formation of capillaries, small arteries and veins. b) Intraluminal, intraparietal angiogenesis (low grade intravascular neoplasia) in SK. Hematoxylin and eosin staining, × 200.
Наблюдение 3. У женщины 31 г., наркоманки, с ВИЧ-инфекцией, обнаружена опухоль кожи тыла кисти в виде узла диаметром до 2 см.
Гистологически опухоль представлена вытянутыми гиперхромными клетками с крупными ядрами и узким ободком цитоплазмы, формирующими пучки, между которыми видны тонкостенные сосуды капиллярного типа, заполненные кровью, с однослойной эндотелиальной выстилкой. В части ядер видны мелкие светлые округлые включения, характерные для герпетической инфекции (рис. 3а). Опухоль растет инфильтративно, в подкожную жировую клетчатку, формирует пучки и сосуды капиллярного типа, выстланные атипичными гиперхромными эндотелиальными клетками (рис. 3б). Отдельные сосуды имеют двухслойную стенку, представленную атипичными гиперхромными клетками. Встречаются фигуры митотического деления клеток. По гистологическому строению опухоль соответствовала веретеноклеточной ангиосаркоме с инфильтративным ростом в окружающие ткани.
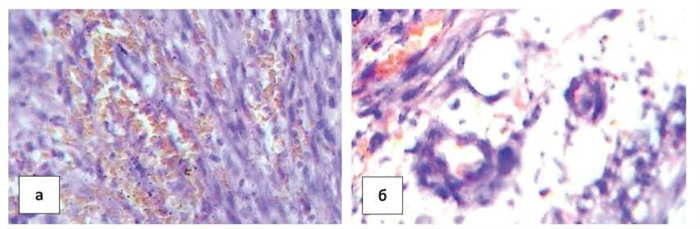
Рисунок 3. Гистологические изменения в коже при СК в стадии узла у ВИЧ-инфицированной женщины 41 г.: а) пучки вытянутых клеток с гиперхромными ядрами и узким ободком цитоплазмы. Многочисленные сосуды
капиллярного типа с однослойной эндотелиальной выстилкой между ними; б) инфильтративный рост опухоли в жировую клетчатку. Мелкие сосуды капиллярного типа с атипичными клетками в стенке. Окраска гематоксилином и эозином. Ув.× 400.
Figure 3. Histological changes in the skin with SK in the node stage of the HIV-infected woman 41-year-old. o.: a) bundles of elongated cells with hyperchromic nuclei and a narrow rim of the cytoplasm. Numerous capillary vessels with a single-layer endothelial lining between them; b) the infi ltrative tumor growth in the adipose tissue. Small vessels of capillary type with atypical cells in the wall. Hematoxylin and eosin staining, × 400.
Наблюдение 4. Пациентке (41 г.) трансплантирована аллогенная трупная почка по поводу терминальной хронической почечной недостаточности, обусловленной хроническим гломерулонефритом. Через 3,5 года диагностирован хронический вирусный гепатит В в сочетании с хроническим гепатитом С высокой активности. Смерть от острой печеночной недостаточности. При патологоанатомическом вскрытии выявлены опухоли желудка (7 полиповидных образований диаметром от 0,7 до 2,5 см), корня брыжейки (диаметром 5 см) и твердой мозговой оболочки в виде бляшки размерами 1,5 х 1 х 1 см., не распознанные при жизни больной. Какие-либо изменения кожи отсутствовали [7]. Гистологически опухоли представлены вытянутыми клетками, сходными с фибробластами, веретеновидной формы, с широким ободком цитоплазмы и крупными гиперхромными ядрами, с мелкими округлыми светлыми включениями в них. Между клетками множественные сосуды капиллярного типа с однослойной выстилкой, представленной эндотелиальными клетками, отдельные более крупные артерии и вены, в стенках их видны крупные клетки с гиперхромными ядрами. Диффузно расположены гиалиновые глобулы и скопления гемосидерина, обнаруживались также участки склероза — скопления коллагена I, II и III типов (рис. 4а, б). Таким образом, по строению опухоль соответствовала фибробластическому варианту первично множественной СК без признаков инфильтративного роста и метастазирования.
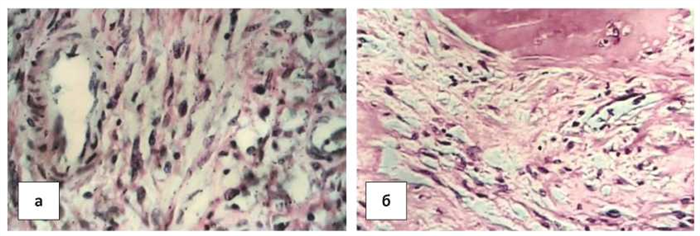
Рисунок 4. Гистологическая характеристика СК, развившейся после трансплантации трупной почки: а) пучки вытянутых клеток с гиперхромными ядрами, сходных с фибробластами. б) ангиоматозный компонент опухоли. Окраска гематоксилином и эозином. Ув.× 400.
Figure 4. Th e histological characteristic of SK developed aft er cadaveric kidney transplantation: a) bundles of elongated cells with hyperchromic nuclei similar to fi broblasts. b) angiomatous component of the tumor. Hematoxylin and eosin staining, × 400
Наблюдение 5. Пациент, 45 лет, ликвидатор последствий аварии на Чернобыльской АЭС в 1986 г., дозиметрист. Поступил в 2004 г. в военный госпиталь Ростовской области с жалобами на наличие 8 опухолевых узлов в коже и подкожной клетчатке внутренней поверхности предплечья и плеча правой руки. Кожа над ними не изменена (рис. 5а). При гистологическом исследовании выявлено, что опухоль имеет преимущественно ангиоматозное строение. В ней выявляются многочисленные сосуды капиллярного типа различных размеров и формы, выстланных эндотелиоподобными клетками (рис. 5б).
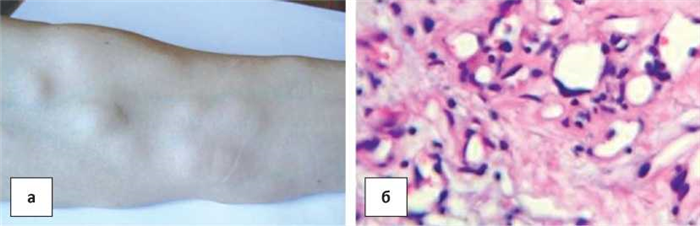
Рисунок 5. а) узлы СК на внутренней поверхности предплечья и плеча у ликвидатора последствий аварии на Чернобыльской АЭС в 1986 г. у мужчины 46 лет (дозиметриста); б) ангиоматозное строение опухоли.
Окраска гематоксилином и эозином. Ув.× 400.
Figure 5. a) SK nodes on the inner surface of the forearm and shoulder at the liquidator of the consequences of the Chernobyl accident in 1986 of a 46-year-old man (dosimetrist); b) angiomatous structure of the tumor.
Hematoxylin and eosin staining, × 400.
Часть клеток вытянутой формы, другие округлые с гиперхромными ядрами, с вирусоподобными включениями в них (рис. 6а, б).
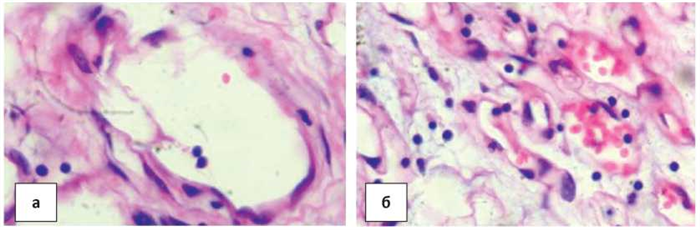
Рисунок 6. а) новообразованные сосуды типа эктазированных вен с пристеночным скоплением атипичных клеток; б) ядра эндотелиоцитов с внутриядерными включениями в атипичных капиллярах. Окраска гематоксилином и эозином. Ув.× 400.
Figure 6. a) newly formed vessels such as ectasized veins with parietal accumulation of atypical cells; b) nuclei of endotheliocytes with intranuclear inclusions in atypical capillaries. Hematoxylin and eosin staining, × 400.
Внутри сосудов формируются сосудистые почки и эндотелиальные сосочки. Аналогичного типа клетки вытянутой формы видны и в наружных слоях сосудов, в строме опухоли (рис. 7а), которая в некоторых участках богата межуточным веществом, содержащим большое количество гликозаминогликанов. В других участках в строме много коллагеновых и эластических волокон (рис.7б). Отмечается очаговый гиалиноз стромы. Опухоль растет инфильтративно в клетчатке, стенки новообразованных сосудов пропитаны фибрином, в просветах многих сосудов выявляются фибриновые тромбы.
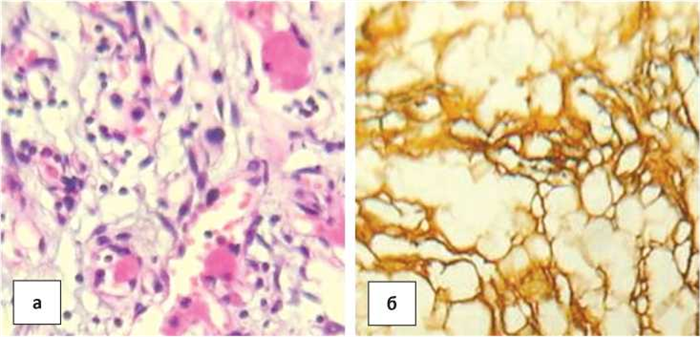
Рисунок 7. а) крупные клетки с гиперхромными ядрами в эндотелии и стенках сосудов, строме опухоли. Окраска гематоксилином и эозином. Ув.× 400; б) строма опухоли с ретикулиновыми и коллагеновыми волокнами. Окраска ретикулярными пикрофуксином по Ван Гизону. Ув.× 200.
Figure 7. a) large cells with hyperchromic nuclei in the endothelium and vessel walls, tumor stroma. Hematoxylin and eosin staining, × 200.; b) tumor stroma with reticulin and collagen fi bers. Picrofuchsin staining, × 200.
Отличительной особенностью клеточных элементов опухоли является наличие крупных гиперхромных ядер, часто с признаками амитотического деления и внутриядерными светлыми включениями, характерными для герпес-вирусных инфекций. Подобные изменения отмечаются в эндотелиоцитах, перицитах, фибробластах стромы и обусловливают выраженный полиморфизм опухолевых клеток (рис. 8). Гистологический диагноз: саркома Капоши, ангиоматозный вариант, с инфильтративным ростом в дерму и жировую клетчатку.
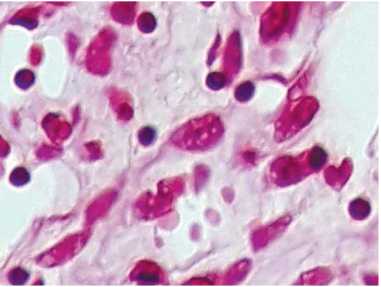
Рисунок 8. Крупные гиперхромные клетки с внутриядерными включениями, характерными для герпетической инфекции, в эндотелиоцитах, перицитах, фибробластах стромы опухоли. Окраска гематоксилином и эозином. Ув.× 400.
Figure 8. Large hyperchromic cells with intranuclear inclusions characteristic of herpetic infection in endothelial cells, pericytes, tumor stromal fi broblasts. Hematoxylin and eosin staining, × 200.
Заключение
Представляется возможным, помимо четырех, уже известных вариантов СК, выделить пятый, еще не описанный в литературе — радиационный, обусловленный воздействием лучевой энергии в период ликвидации последствий на Чернобыльской АЭС в 1986 г.
Финансирование. Исследование не имело спонсорской поддержки.
Finansing. The study did not have sponsorship.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
Список литературы
2. Казанцева К. В., Молочков А. В., Молочков В. А., Сухова Т. Е., Прокофьев А. А. и др. Саркома Капоши: патогенез, клиника, диагностика и современные принципы лечения. // Российский журнал кожных и венерических болезней. – 2015. – Т. 18, №1. – c. 7-15. eLIBRARY ID: 22968819
3. Nestor M.S., Berman B., Goldberg D., Cognetta Jr A.B., Gold M., et al. Consensus Guidelines on the Use of Superfi cial Radiation Th erapy for Treating Nonmelanoma Skin Cancers and Keloids. // J. Clin. Aesthet. Dermatol. – 2019. – V. 12(2). – P. 12-18. PMID: 30881578
4. Основы патологии заболеваний по Роббинсу и Котрану. Под ред. Е.А. Коган, Р.А. Серова, Е.А. Дубовой, К.А. Павлова. — М.: Логосфера; 2016.
5. Цинзерлинг А.В., Цинзерлинг В.А., Ариэль Б.М., Индикова М.Г., Мельникова В.Ф. и др. Современные инфекции. Патологическая анатомия и вопросы патогенеза. Руководство для врачей. –СПб.: СОТИС-Мед, 1993. eLIBRARY ID: 21666807
7. Непомнящая Е.М., Гусарев С.А., Кириченко Ю.Г. Генерализованная саркома Капоши после аллогенной трансплантации трупной почки. // Архив патологии. - 2004. – Т.66, N6. - С. 55-57. eLIBRARY ID: 17034100
8. Lever W.F., Schaumburg-Lever G. Histopathology of the skin. – Zippincoft : J. B. Company; 1975.
9. Хэм А. Кормак Д. Гистология: Пер. с англ. – М.: Мир; 1983.
Об авторах
Дерижанова Ирина Сергеевна, д.м.н., профессор, заведующая кафедрой патологической анатомии
К вопросу о саркоме Капоши
В статье перечислены типы саркомы Капоши, приведены данные о распространенности и заболеваемости. Рассмотрен случай выявления патологии у пациента молодого возраста. Показано, что в подобной ситуации оптимальным методом диагностики являются биопсия кожи и морфологическое исследование.
В статье перечислены типы саркомы Капоши, приведены данные о распространенности и заболеваемости. Рассмотрен случай выявления патологии у пациента молодого возраста. Показано, что в подобной ситуации оптимальным методом диагностики являются биопсия кожи и морфологическое исследование.
Типы саркомы Капоши: диагностика и распространенность
Выделяют четыре типа саркомы Капоши:
- классический (идиопатический);
- эндемический;
- эпидемический (ассоциированный с синдромом приобретенного иммунодефицита (СПИД));
- иммунносупрессивный (ятрогенный).
Идиопатический тип наблюдается у пациентов мужского пола, не страдающих СПИДом и не получающих иммуносупрессивную терапию. Дебют регистрируется в возрасте 50–70 лет. У мужчин саркома Капоши встречается в два-три раза чаще, чем у женщин [2].
При саркоме Капоши пурпурные, красно-синие или коричнево-черные пятна, папулы и узлы, подверженные изъязвлениям и кровотечениям, обычно локализуются на поверхности кожи и слизистых оболочках. При эпидемическом типе поражаются в основном слизистые оболочки и кожа лица и туловища, при идиопатическом – кожа нижних конечностей.
Четыре типа саркомы Капоши гистологически неразличимы, но отличаются эпидемиологией и прогнозом.
Все чаще саркома Капоши диагностируется в новой подгруппе пациентов. Речь идет о мужчинах, вступающих в половой контакт с мужчинами, но не имеющих идентифицируемого иммунодефицита. Это пятый вариант саркомы Капоши, именуемый неэпидемическим. По клиническим проявлениям и течению он напоминает классический тип [3].
Согласно результатам исследования, проведенного в больнице Bellvitge (Барселона) в 1987–2016 гг., саркома Капоши (кожные поражения) была диагностирована у 191 пациента (167 мужчин и 24 женщины в возрасте 51,95 ± 20,16 года). Классический тип заболевания выявлен у 53 пациентов, СПИД-ассоциированный – у 118, ятрогенный – у 18, эндемический – у двух пациентов. Число ежегодно диагностированных случаев достигло максимума в 1990-х гг. вследствие эпидемии СПИДа и уменьшилось к 2000 г. Однако встречаемость ятрогенной и классической форм саркомы Капоши удвоилась в течение анализируемого периода. В 137 случаях кожные проявления локализовались на коже ног. Внекожные поражения имели место у 32 пациентов. У 46 из 118 пациентов со СПИДом саркома Капоши была диагностирована одновременно с выявлением инфекции вируса иммунодефицита человека (ВИЧ) [4].
В отечественной научной литературе в основном описаны случаи СПИД-ассоциированной саркомы Капоши. Данные о неэпидемической форме в сочетании с таким иммуносупрессивным заболеванием, как псориаз, отсутствуют. В зарубежной литературе подобных клинических случаев немного. Их связывают с терапией моноклональными антителами и/или инфекцией, вызванной ВИЧ [5].
Как показывает собственный опыт, идиопатическая саркома Капоши встречается в основном у лиц старше 50 лет. Тем не менее известны случаи выявления заболевания у молодых пациентов.
Клинический случай
Больной Д. 29 лет страдает псориазом с детского возраста. При очередном поступлении в стационар при осмотре кожи туловища и конечностей обнаружены типичные инфильтрированные папулы и бляшки ярко-розового цвета, покрытые белыми чешуйками (клинические проявления псориаза). На коже правой голени – высыпания иного характера: синюшно-красные макулопапулезные элементы, единичный буроватый узел с четкими границами (рис. 1). По словам пациента, высыпания на правой голени, наблюдаемые в течение года, специалисты расценивали как проявления псориаза.
В ходе лабораторного обследования антитела к ВИЧ не обнаружены, уровень лейкоцитов в норме. При гистологическом исследовании биоптата с макулопапулезных элементов выявлены множественные новообразованные щелевидные сосуды с тонкими стенками вокруг нормальных сосудов (рис. 2). Морфологически в биоптате из узла определены преимущественно веретеновидные клетки, воспалительный инфильтрат из лимфоцитов, гистиоцитов и плазмоцитов (рис. 3).
На основании полученных данных у больного Д. диагностирована саркома Капоши.
Ранее по поводу псориаза пациент не получал иммуносупрессивную терапию, за исключением топических глюкокортикостероидов и физиотерапии (ультрафиолетовое облучение).
Рассмотренный случай свидетельствует о необходимости проявлять настороженность при обнаружении характерных для саркомы Капоши очагов у молодых пациентов. В подобной ситуации биопсия кожи и морфологическое исследование являются оптимальным методом диагностики.
Саркома Капоши у ВИЧ-негативного больного первичным миелофиброзом
Введение. Саркома Капоши (СК) — опухоль сосудистого происхождения с поражением кожных покровов, вовлечением внутренних органов и лимфатических узлов.
Цель — описать развитие СК у больного первичным миелофиброзом (ПМФ), развившейся на фоне лечения преднизолоном.
Основные сведения. Для верификации диагноза СК у больного ПМФ были использованы: гистологическое, иммуногистохимическое исследования биоптатов кожи и полимеразная цепная реакция с детекцией флуоресцентного сигнала в режиме «реального времени» в количественном формате при тестировании биологических образцов (периферическая кровь, мазок со слизистой оболочки ротоглотки, биоптаты из очагов поражений кожи) для определением активности вируса герпеса человека 8. Обследование позволило установить окончательный диагноз.
Ключевые слова
Для цитирования:
For citation:
Введение
Выделяют 4 основных варианта СК [19]:
- Классическая (идиопатическая, спорадическая, европейская) СК — встречается чаще у пожилых мужчин, характеризуется бессимптомным или малосимптомным течением, появлением пятен на нижних конечностях, в дальнейшем могут появляться болезненные образования в мягких тканях и увеличение лимфатических узлов. Прогноз — благоприятный.
- Эндемическая (африканская) СК — развивается у детей и молодых людей из африканских стран, характеризуется агрессивным течением, формированием множественных подкожных узлов и язв, поражением легких, желудочно-кишечного тракта, печени и селезенки. Прогноз — неблагоприятный.
- Эпидемическая (СПИД-ассоциированная) СК — развивается у ВИЧ-инфицированных больных. Характеризуется быстрым течением, появлением высыпаний на коже головы (нос, ушные раковины, веки) и туловище, в 10–15 % случаев возможно появление элементов на твердом и мягком небе, корне языка. Очаги поражения быстро изъязвляются, что приводит к появлению болевого синдрома и нарушению функции вовлеченного органа. Прогноз — неблагоприятный.
- Иммуносупрессивая (ятрогенная) СК — развивается у иммунокомпрометированных больных (исключение — ВИЧ-инфекция), например, у перенесших трансплантацию солидных органов (почка, печень) и получающих иммуносупрессивную терапию. Характеризуется ограниченным поражением кожных покровов в дебюте, с последующим изъявлением и появлением болевого синдрома. Отмена иммуносупрессивных препаратов приводит к регрессу новообразований.
Новообразования при СК имеют пурпурную окраску, но их цвет может варьировать от красного до фиолетового или бурого. Элементы могут быть плоскими или возвышаться над поверхностью кожных покровов, представлять собой безболезненные пятна, узелки, узлы с возможным их изъязвлением. Новообразования почти всегда располагаются на коже, реже — во внутренних органах. Гистологическая структура опухоли характеризуется множеством хаотично расположенных тонкостенных новообразованных сосудов и пучков веретенообразных клеток. Характерна инфильтрация опухоли лимфоцитами и макрофагами. Сосудистый характер опухоли резко увеличивает риск кровотечений [6, 8].
Для лечения больных СК используют цитостатические, иммуносупрессивные и противовирусные препараты [19]. Стандартная терапия СК включает использование в виде монорежима или в виде различных комбинаций цитостатических препаратов (алкалоидов — винкристин, винбластин, антрациклиновых антибиотиков — адриамицин, доксорубицин, даунорубицин, этопозид), препаратов интерферона альфа-2b, таксанов (паклитаксел или доцетаксел) и приводит к достижению хорошего, но не длительного ответа, безрецидивная выживаемость не превышает года [19]. В настоящее время исследуются таргетные препараты, влияющие на патогенетические механизмы СК, на репликацию HHV-8 и блокаду сигнальных путей VEGF, c-Kit, m-TOR (талидомид, интерлейкин-12, hCG Angiogenesis inhibitors (SU5416, IM862, fumagillin) MMP-inhibitors (Col-3), integrin-inhibitors (EMP 121976)) [20]. Продолжается поиск противовирусных препаратов в связи с неудачей применения цидофовира и фоскарнета. Интерес представляют препараты из группы ингибиторов гистон деацетилазы, способные вызывать литическую репликацию, инфицированных клеток в латентной фазе [19][20].
Цель — описать развитие СК у больного ПМФ, развившейся на фоне лечения преднизолоном.
Клиническое наблюдение
У больного, 1947 года рождения, в 2007 г. были впервые выявлены гепатомегалия (увеличение правой доли печени до 180 мм), спленомегалия (селезенка — 164 × 84 мм), признаки портальной гипертензии (увеличение диаметра воротной вены до 17 мм, селезеночной — до 13 мм). С 2015 г. у больного отмечено появление подагрического артрита, двухростковой цитопении неясной этиологии, в связи с чем был обследован гематологом. В крови: лейкоциты — 2,0 × 10 9/ л, гемоглобин — 102 г/л, эритроциты — 3,22 × 10 12 /л, тромбоциты — 370 × 10 9 /л, миелоциты — 1 %, палочкоядерные — 23 %, сегментоядерные — 29 %, лимфоциты — 34 %, моноциты — 10 %, СОЭ — 19 мм/час, общий белок — 68 г/л, маркеры вирусных гепатитов и ВИЧ — отрицательные. В миелограмме: пунктат костного мозга был беден клеточными элементами, бластные клетки — 3 %, отмечалась задержка созревания гранулоцитов, плазматические клетки составили 28 %. По результатам иммунохимического анализа белков сыворотки крови и концентрированной мочи было выявлено уменьшение концентрации IgM в сыворотке крови до 56 МЕ/мл, при отсутствии моноклональной секреции в сыворотке крови и белка Бенс-Джонса в моче. При гастроскопии выявлены смешанный рефлюкс-гастрит, дуоденит, при колоноскопии — долихосигма, внутренний геморрой в стадии обострения. На основании результатов обследования, проведенного по месту жительства, была заподозрена множественная миелома. В 2016 г. было выполнено обследование, включавшее в себя пункцию костного мозга, его цитологическое и иммунофенотипическое исследования. По данным миелограммы, количество плазматических клеток соответствовало норме, иммунофенотипическое исследование не выявило наличия аберрантных В-лимфоцитов и Т-лимфоцитов. Отмечалось увеличение размеров селезенки до 175 × 95 мм. Окончательный диагноз установлен не был, в связи с чем до 2017 г. больной не получал цитостатическую терапию.
В октябре 2017 г. больной был направлен в ФГБУ «НМИЦ гематологии» для уточнения диагноза и определения дальнейшей тактики лечения. При обращении предъявлял жалобы на боли в поясничном отделе позвоночника и тазобедренных суставах, слабость и повышенную утомляемость, рецидивирующий стоматит. При осмотре состояние было расценено как средней степени тяжести, кожные покровы были обычной окраски, чистые. Периферические лимфатические узлы не пальпировались. Живот был увеличен в объеме за счет гепатомегалии и спленомегалии (печень на 5 см выступала из-под края реберной дуги, селезенка — на 8 см). В анализе крови: гемоглобин — 100 г/л; эритроциты — 3,29 × 10 12 /л; тромбоциты — 270 × 10 9 /л; лейкоциты — 1,79 × 10 9 /л, лактатдегидрогеназа (ЛДГ) — 865,1 Ед/л. При молекулярно-генетическом исследовании клеток крови была обнаружена мутация типа 2 (инсерция) в 9-м экзоне гена CALR. В миелограмме: пунктат костного мозга был умеренно-клеточный, бластные клетки составляли 3,6 %, резко сужен гранулоцитарный росток (8,4 %), лимфоциты — 16,8 %, моноциты — 2,4 %, значительно расширен эритроидный росток (68,8 %), мегакариоциты — в достаточном количестве, плазматические клетки — 0,4 %. При стандартном цитогенетическом исследовании пунктата костного мозга выявлен кариотип 46XY [20]. При гистологическом исследовании трепанобиоптата костного мозга морфологическая картина соответствовала миелопролиферативному заболеванию, ПМФ, фиброзная/остеосклеротическая стадия, степень фиброза стромы при гистохимическом исследовании с импрегнацией серебром составила более 50 %. По данным ультразвукового исследования (УЗИ) органов брюшной полости выявлены гепатомегалия (левая доля печени — 130 × 63 мм, правая — 185 × 111 мм), спленомегалия (размеры селезенки — 195 × 74 мм), портальная гипертензия (диаметр воротной вены — 18 мм, селезеночной вены — 18 мм). На основании результатов обследования, согласно критериям ВОЗ [28], был установлен диагноз Ph-негативное хроническое миелопролиферативное заболевание (ХМПЗ): ПМФ, промежуточная — 2-я группа риска (3 балла по DIPSS) [29]. По данным иммунохимического исследования белков сыворотки крови и концентрированной мочи в сыворотке крови была выявлена следовая моноклональная секреция А каппа, уменьшение концентрации иммуноглобулина М, увеличение концентрации бета-2-микроглобулина до 3,96 мг/л. При низкодозовой компьютерной томографии (КТ) костей скелета были обнаружены единичные участки разрежения костной ткани, наиболее крупные в проекции задней верхней ости подвздошной кости, размерами 16,5 × 10,5 мм, в верхней правой лонной кости — 18 × 11 мм, в теле третьего сакрального позвонка — 18 × 14 мм, солитарное образование в левой половине лобной пазухи размерами 30,5 × 11 × 16 мм, мягкотканной плотности, а также мягкотканные компоненты в костномозговых каналах большеберцовых и плечевых костей. От проведения биопсии мягкотканных компонентов больной отказался. Согласно критериям ВОЗ [28] был установлен сопутствующий диагноз «моноклональная гаммапатия неясного значения» (МГНЗ) [30].
Наличие у больного глубокой лейкопении не укладывалось в типичную картину ПМФ и было расценено как проявление гиперспленизма, возникшего на фоне длительной портальной гипертензии. Отнесение больного в промежуточную 2-ю группу риска по шкале DIPSS [29] послужило показанием к назначению с февраля 2018 г. терапии ПМФ: гидроксикарбамид — 1000 мг/сут., преднизолон — 20 мг/сут. в течение 2 мес. с последующей полной отменой в течение 1 мес. [31]. Однако больной не выполнил рекомендации по быстрой отмене глюкокортикостероидных гормонов и дальнейший прием преднизолона контролировал самостоятельно. Терапия глюкокортикостероидами осложнилась кровотечением из прямой кишки в октябре 2018 г., а в ноябре 2018 г. при фиброгастроскопии было выявлено кровотечение из ангиоэктазии желудка. При проведении лечения с конца 2018 г. больной отметил появление потливости и синюшных, плотных, бугристых образований на коже предплечий (рис. 1). По месту жительства была выполнена биопсия новообразования на левом предплечье. При гистологическом исследовании биоптата морфологическая картина была расценена как лейомиома. В ноябре 2018 г. больной прекратил прием преднизолона и отметил кратковременное улучшение состояния в виде уменьшения потливости, стабилизации количества и размеров образований на коже.
В 2019 г. в связи с увеличением количества кожных элементов на предплечьях и голенях по месту жительства была выполнена биопсия новообразований кожи на голени и на левом предплечье (рис. 2). При гистологическом исследовании, хотя опять была заподозрена лейомиома, проводился дифференциальный диагноз между СК и веретеноклеточной гемангиомой. Для уточнения причины поражения кожных покровов больной был повторно направлен в ФГБУ «НМИЦ гематологии». При обращении в ФГБУ «НМИЦ гематологии» в июне 2019 г. предъявлял жалобы на потливость, стоматит, многочисленные образования на кожных покровах кистей, предплечий и в области левого коленного сустава. При осмотре кожные покровы были обычной окраски, влажные, на кистях, предплечьях, левой нижней конечности в области коленного сустава определялись многочисленные элементы, синюшного цвета, выступавшие над поверхностью кожи с шелушением в центре. Живот был увеличен в объеме за счет гепатоспленомегалии (печень выступала из-под края реберной дуги на 7 см, селезенка — на 10 см). Продолжал принимать гидроксикарбамид в дозе 1000 мг через день.
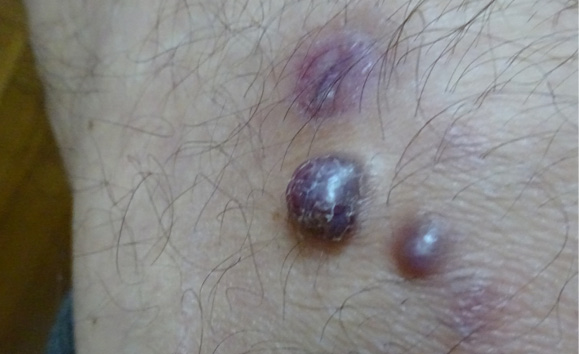
Рисунок 1. Новообразования синюшного цвета на левом предплечье
Figure 1. Cyanotic neoplasms on the left forearm
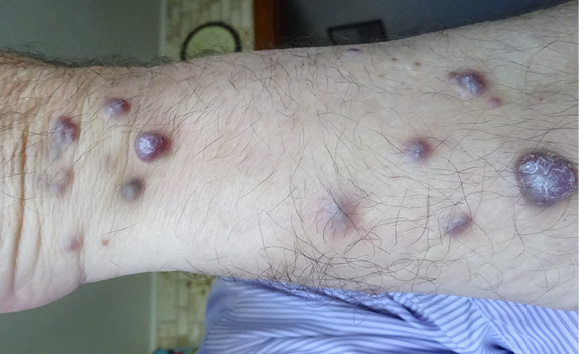
Рисунок 2. Многочисленные бугристые новообразования синюшного цвета на левом предплечье
Figure 2. Numerous tuberous neoplasms of cyanotic color on the left forearm
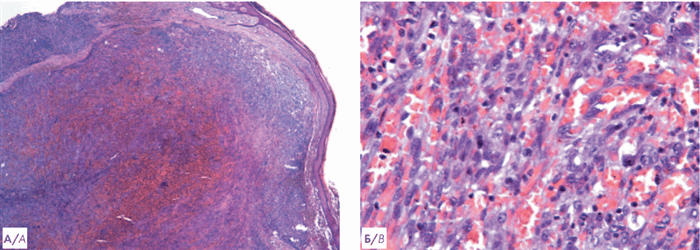
Рисунок 3. А — гистологическое исследование биоптата кожи. Гематоксилин и эозин. Увеличение ×50. Массивный узловой пролиферат в дерме (указан стрелкой), отмечается формирование множественных сосудистых пространств; Б — гистологическое исследование биоптата кожи. Гематоксилин и эозин. Увеличение ×400. На большем увеличении визуализируются участки веретеноклеточной и эпителиоидной морфологии опухолевых клеток, формирующих сосудистые щели
Figure 3. А — histological examination of skin biopsy. Hematoxylin and eosin. Magnification ×50. Massive nodular proliferate in the dermis (indicated by an arrow), the formation of multiple vascular spaces is noted; B — histological examination of skin biopsy. Hematoxylin and eosin. Magnification ×400. At a larger magnification, spindle cell and epithelioid morphology of tumor cells forming vascular slots are visualized
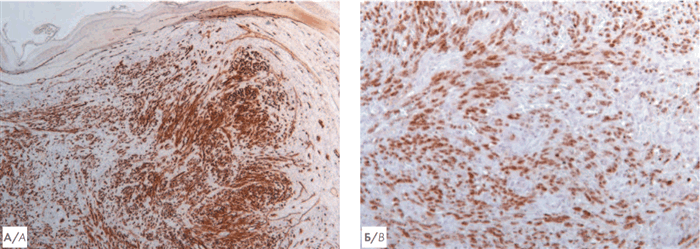
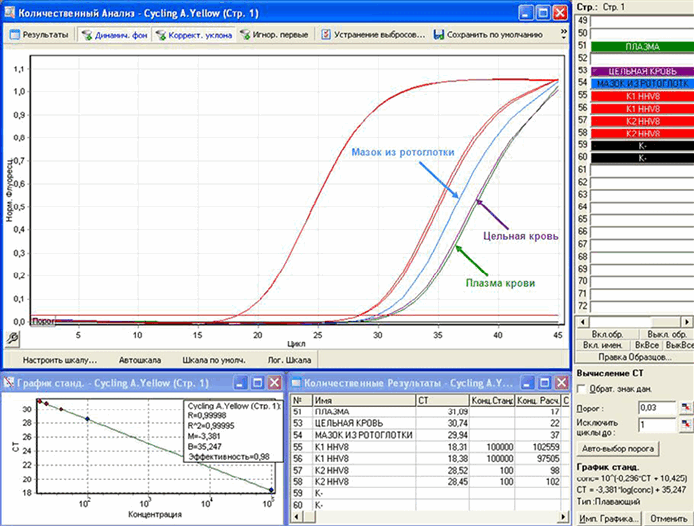
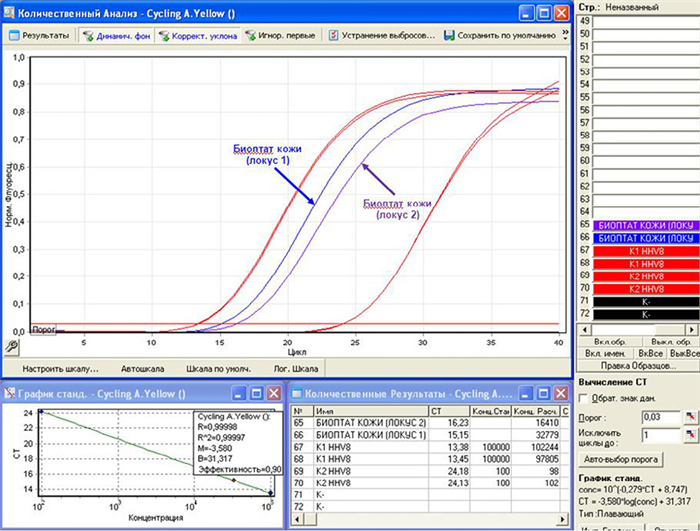
Рисунок 5. А — анализ результатов исследования образцов цельной крови, плазмы крови, мазков со слизистой оболочки ротоглотки, полученных методом ПЦР в реальном времени; Б — анализ результатов исследования образцов биоптатов кожи из очагов поражений, полученных методом ПЦР в реальном времени
Figure 5. А — analysis of the results of the study of samples of whole blood, blood plasma, smears from the mucous membrane of the oropharynx obtained by real-time PCR; B — analysis of the results of the study of samples of skin biopsy samples from lesions obtained by real-time PCR
Таблица 1. Результаты количественного определения ДНК HHV-8 методом ПЦР-РВ в различных типах биологического материала больного
Table 1. The results of the quantitative determination of HHV-8 DNA by PCR-RT in various types of patient biological material
Читайте также:
