Гормоны аденогипофиза и их эффекты в организме. Cоматотропин. Пролактин. Тиреотропин. Фоллитропин (ФСГ). Адренокортикотропный гормон (АКТГ).
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
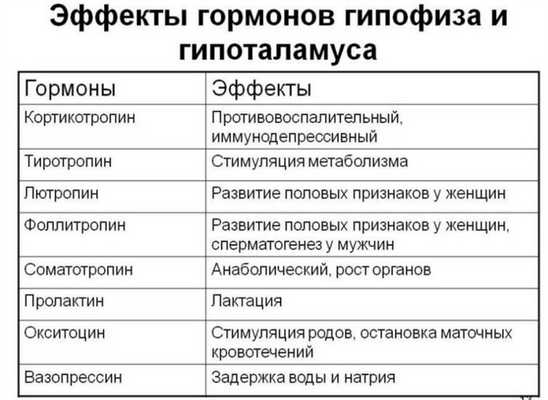
Соматотропин секретируется аденогипофизарными клетками непрерывно и «вспышками» через 20—30 мин и 3—5 ч с отчетливой суточной ритмикой — повышение секреции соматотропина происходит во время глубокого сна, на ранних его стадиях (народная мудрость гласит: «человек растет, когда спит»). Секреция соматотропина стимулируется гипоталамическим нейропептидом соматолиберином, в механизме действия которого основным вторичным посредником является Са2+.
Подавляется секреция соматотропина гипоталамическим соматостатином, приводящим к снижению концентрации ионов кальция в соматотрофах аденогипофиза. Увеличивается секреция гормона после мышечных нагрузок, под влиянием травм, инфекций, голодания. Стимулируют продукцию соматотропина вазопрессин, глюкагон, эстрогены (увеличивая число рецепторов соматолиберина на соматотрофах), дофамин, норадреналин, эндорфин и серотонин, причем последний обеспечивает рост секреции гормона в начале глубокого сна, а также изменения обмена веществ. Так, гипогликемия активирует секрецию соматолиберина и соматотропина, а гипергликемия — тормозит; избыток аминокислот и снижение свободных жирных кислот в крови активируют их секрецию. Эти влияния реализуются через специальные ре-цепторные нейроны гипоталамуса, воспринимающие сдвиги биохимического состава крови и участвующие в регуляции обмена веществ. Угнетает синтез и секрецию гормона повышение в крови содержания прогестерона и свободных жирных кислот. Механизм отрицательной обратной связи в саморегуляции уровня гормона в крови реализуется стимуляцией сомато-тропином нейросекреции соматостатина.
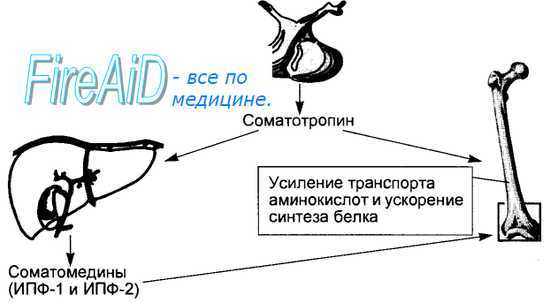
Рис. 6.7. Механизм действия соматотропина.
Секретируемый аденогипофизом соматотропин оказывает эффект на рост, стимулируя транспорт в клетку аминокислот и синтез белка. Эффект соматотропина опосредуется сомато-мединами или инсулиноподобны-ми факторами роста (ИПФ-1, в большей степени, и ИПФ-2), образуемыми в печени.
Механизм действия соматотропина на клетки-эффекторы заключается в его связывании с двумя молекулами мембранных рецепторов, активации тирозинкиназы — протеинкиназы С, фосфорилировании и активации ци-топлазматических белков. Гормон-рецепторный комплекс активирует и мембранную фосфолипазу С, что ведет к образованию диацилглицерола, мобилизации внутриклеточного кальция и активации протеинкиназы С. Следствием является фосфорилирование и активация цитоплазматических белков, стимулирование транскрипции генов и синтез новых белков. Специфические рецепторы к гормону имеются на клетках жировой, мышечной, хрящевой и лимфоидной ткани, клетках печени, поджелудочной железы, кишечника, половых органов, мозга, легких, сердца и почек.
Соматотропин участвует в регуляции роста и развития организма. Повышая синтез хрящевой ткани в эпифизарных отделах костей, гормон в детском возрасте стимулирует рост тела в длину, а активирование периостального роста увеличивает толщину и ширину костей. Возрастание массы тканевых структур происходит в мышечной и соединительной ткани, растет масса и внутренних органов.
Основные эффекты соматотропина связаны с его влияниями на обмен веществ, приводящими к: 1) усилению липолиза и уменьшению массы жировой ткани; 2) повышению усвоения аминокислот и синтеза белков, в результате чего масса тела возрастает за счет нежировой ткани; 3) увеличению глюконеогенеза и повышению уровня сахара в крови. Вместе с тем большинство ростовых эффектов гормона опосредуется специальными гуморальными факторами (гормонами) печени, почек и костной ткани, получившими название соматомедины (рис. 6.7). Поскольку эффекты соматомединов на обмен веществ во многом сходны с эффектами инсулина, а их структура имеет сходство с молекулой проинсулина, их еще называют инсулиноподобные факторы роста (ИФР). Химическая структура и основные эффекты установлены для двух факторов (ИФР-1 и ИФР-2). ИФР-1 обладает большим, чем ИФР-2, влиянием на рост, а также является основным фактором, реализующим отрицательную обратную связь в виде угнетения секреции соматолиберина и соматотропина, увеличения продукции соматостатина. Действие на хрящевую ткань инсулиноподобных факторов проявляется в виде стимуляции включения сульфата в синтезируемые протеогликаны, стимуляции включения тимидина в образуемую ДНК, активации синтеза РНК и белка. Эти эффекты выражены у ИФР-1 и ИФР-2 в 100 раз больше, чем у инсулина, а влияние на обмен глюкозы у них в 50 раз слабее, чем у инсулина. В то же время дифференцировка прехондроцитов, повышение транспорта аминокислот через их клеточную мембрану обеспечиваются не соматомединами, а самим соматотропином. Несмотря на то что соматомедины называют инсулиноподобными факторами роста, рецепторы клеточной мембраны для них отличаются от рецепторов инсулина. Рецепторы инсулиноподобных факторов находятся не только в хрящевой ткани, но и в мышечной и соединительной тканях, где эти регуляторы также стимулируют митогенез и синтез белка.
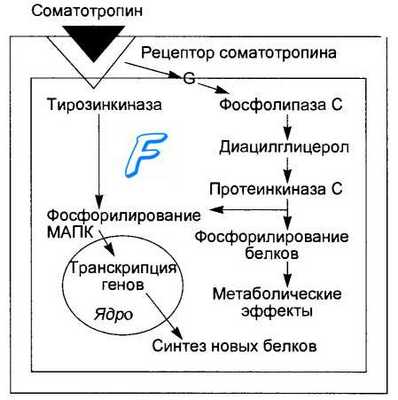
Механизм действия соматотропина. Показан клеточный механизм действия гормона. Связывание соматотропина с одной из двух молекул специфического мембранного рецептора вызывает активацию ассоциированной с ней тирозин-киназы, что ведет к фосфорилирова-нию и активации митогенактивируе-мой протеинкиназы (МАПК), вызывающей транскрипцию генов и синтез новых белков. Вторая молекула рецептора после связывания с соматотропином через G-белок активирует мембранную фосфолипазу С, ускорение метаболизма фосфоинозитидов ведет к образованию диацилглицерола, мобилизации внутриклеточного кальция, активации протеинкиназы С. Последняя вызывает фосфорилирование белков, активацию ферментов и метаболические эффекты, в том числе активирует транспорт аминокислот в клетку. Протеинкиназа С также вызывает фосфорилирование и активацию МАПК и других индукторов транскрипции генов, способствуя синтезу белка.
При длительной и чрезмерной секреции соматотропина хотя и сохраняется действие соматомединов на хрящевую ткань, но в целом эффекты соматотропина приобретают четкие контринсулярные черты. Они проявляются в изменениях углеводного и жирового обмена в тканях. Так, соматотропин вызывает гипергликемию из-за распада гликогена в печени и мышцах и угнетения утилизации глюкозы в тканях, благодаря повышению секреции глюкагона островками Лангерганса поджелудочной железы. Сомато-тропин увеличивает и секрецию инсулина островками Лангерганса, как за счет прямого стимулирующего действия, так и благодаря гипергликемии. Но в то же время соматотропин активирует инсулиназу печени — фермент, разрушающий инсулин, и вызывает инсулинорезистентность тканей. Подобное сочетание стимуляции секреции инсулина с его разрушением и подавлением эффекта в тканях может вести к сахарному диабету, который по происхождению называют гипофизарным. Как антагонист инсулина соматотропин проявляет свои эффекты и в метаболизме липидов. Гормон оказывает пермиссивное (облегчающее) действие по отношению к влияниям катехоламинов и глюкокортикоидов, следствием чего являются стимуляция липолиза жировой ткани, повышение уровня свободных жирных кислот в крови, избыточное образование кетоновых тел в печени (кетогенный эффект) и даже жировая инфильтрация печени. Инсулинорезистентность тканей может быть связана и с этими сдвигами жирового обмена.
Избыточная секреция соматотропина и, соответственно, возросший под его влиянием уровень ИФР-1, возникающие в раннем детстве, ведут к развитию гигантизма с пропорциональным развитием конечностей и туловища. В юношеском и зрелом возрастах избыток гормона усиливает рост эпифизарных участков костей скелета, зон с незавершенным окостенением, что получило название акромегалия. Растут кисти и стопы, нос, подбородок и т. д. Увеличиваются в размерах и внутренние органы, что называют спланхомегалия. Появляются утолщение кожи, повышенная потливость, ущемление нервов, резистентность к инсулину. При врожденном дефиците соматотропина, особенно при нечувствительности тканей к нему (при этом в организме имеет место низкий уровень ИФР-1 при высоком уровне соматотропина), формируется карликовость, называемая «гипофизарный нанизм». После выхода в 1726 г. романа Дж. Свифта «Путешествия Гулливера» таких карликов стали называть лилипутами. Приобретенный дефицит гормона в зрелом возрасте выраженного морфогенетического эффекта не вызывает.
Гормоны аденогипофиза и их эффекты в организме. Cоматотропин. Пролактин. Тиреотропин. Фоллитропин (ФСГ). Адренокортикотропный гормон (АКТГ).
Адренокортикотропный гормон (АКТГ). Регуляция секреции и физиологические эффекты кортикотропина. Болезнь Иценко - Кушинга (кушингоит).
Кортикотропин является продуктом расщепления крупного (239 аминокислот) гликопротеина проопиомеланокортина, образующегося базофильными кортикотрофами. Этот белок делится на две части, одна из которых при расщеплении служит источником кортикотропина и меланотропина, а вторая, называемая липотропином,— расщепляясь, дает, кроме меланотропина, пептид эндорфин, обладающий морфиноподобным действием и играющий важнейшую роль в антиноцицептивной (антиболевой) системе мозга и в модуляции секреции гормонов аденогипофиза.
Секреция кортикотропина происходит пульсирующими вспышками с четкой суточной ритмичностью. Наивысшая концентрация гормона в крови отмечается в утренние часы (6—8 часов), а наиболее низкая — с 18 до 2 часов ночи. Механизм регуляции секреции представлен прямыми и обратными связями. Прямые связи реализуются кортиколиберином гипоталамуса и вазопрессином. Усиливают эффекты кортиколиберина адреналин и ан-гиотензин-II, ацетилхолин, норадреналин, адреналин, серотонин, холецистокинин, бомбезин, атриопептид, а ослабляют — опиоидные пептиды, гамма-аминомасляная кислота. Глюкокортикоиды, циркулирующие в крови (кортизол), в гипоталамусе тормозят секрецию кортиколиберина, а в гипофизе — секрецию кортикотропина (обратная связь). Обратная связь имеет отрицательную направленность и замыкается как на уровне гипоталамуса (подавление секреции кортиколиберина), так и гипофиза (торможение секреции кортикотропина). Продукция кортикотропина резко возрастает при действии на организм стрессорных раздражителей, например холода, боли, физической нагрузки, повышения температуры тела, эмоций, а также под влиянием гипогликемии (снижение сахара в крови), при этом суточная ритмика секреции изчезает.
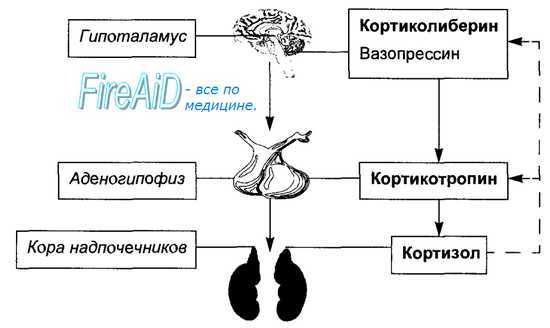
Рис. 6.6. Гипоталамо-аденогипофизарно-надпочечниковая ось регуляции.
Сплошные стрелки — стимуляция, пунктирные стрелки — отрицательная обратная связь. Основным стимулятором секреции кортикотропина аденогипофизом является гипоталамический нейропептид — кортиколиберин, слабый стимулирующий эффект на секрецию кортикотропина оказывает вазопрессин. Кортикотропин стимулирует секрецию глюкортикоидов (кортизо-ла) корой надпочечников. Содержание в крови кортизола по механизму отрицательной обратной связи подавляет секрецию кортикотропина аденогипофизом и кортиколиберина гипоталамусом.
Физиологические эффекты кортикотропина принято делить на надпочечниковые и вненадпочечниковые. Надпочечниковое действие гормона является основным и заключается в стимуляции (через системы аденилат-циклаза—цАМФ и Са2+ с последующей активацией протеинкиназы А) клеток пучковой зоны коры надпочечников, секретирующей глюкокортикоиды (кортизол и кортикостерон). Значительно меньший эффект кортикотропин оказывает на продукцию минералокортикоидов и половых стероидов клетками клубочковой и пучковой зон коры надпочечников. Под влиянием кортикотропина не только усиливается стероидогенез (синтез гормонов) за счет повышения образования и активности ферментов, но и синтез белков ткани за счет избирательной активации транскрипции генов, что при избытке гормона вызывает гипертрофию и гиперплазию ткани коры надпочечников. При этом происходит и перестройка структуры коры, с преимущественным увеличением массы клеток пучковой зоны, в ткани уменьшается содержание холестерина и аскорбиновой кислоты, опосредующей синтез гормонов. Таким образом, кортикотропин является основным звеном гипоталамо-аденогипофизарно-надпочечниковой регуляторной оси.
Вненадпочечниковое действие кортикотропина заключается в прямых эффектах гормона: 1) липолитическом действии на жировую ткань, 2) повышении секреции инсулина и соматотропина, 3) гипогликемии из-за стимуляции секреции инсулина, 4) увеличении захвата аминокислот и глюкозы мышечной тканью, 5) повышенном отложении меланина с гиперпигментацией из-за родства молекулы гормона с меланотропином.
Избыток секреции кортикотропина сопровождается развитием гипер-кортицизма с преимущественным увеличением секреции надпочечниками кортизола и носит название болезни Иценко—Кушинга. Дефицит кортикотропина ведет к недостаточности синтеза и секреции в кровь глюкокортикоидов с выраженными метаболическими сдвигами и снижением устойчивости организма к стрессорным влияниям среды.
Как известно, аденогипофиз является местом продукции тропных гормонов – адренокортикотропного (АКТГ), соматотропного (СТГ), фолликулостимулирующего (ФСГ), лютеинизирующего гормона (ЛГ), тиреотропного гормона (ТТГ), меланоцитостимулирующего (МСГ), а также пролактина, липотропина, эндорфинов. Указанные гормоны выполняют роль регуляторов деятельности периферических эндокринных желез: надпочечников, половых и щитовидной желез, а также молочных желез в период лактации у женщин.
Интенсивность продукции тропных гормонов аденогипофиза регулируется рядом гормональных и гуморальных факторов; среди которых важную роль играют следующие:
1. рилизинг-факторы тиреотропного, соматотропного, кортикотропного, гонадотропного гормонов, а также статины, продуцируемые гипоталамусом;
2. концентрация гормонов периферических эндокринных желез, обладающих способностью по принципу «обратной связи» стимулировать или тормозить продукцию рилизинг-факторов гипоталамуса и тропных гормонов аденогипофиза;
3. интенсивность центрогенных и периферических нервных влияний (адренергических, холинергических, допаминергических, пуринергических) на структуры ретикулярной формации ствола мозга, лимбическую систему;
4. интенсивность продукции цитокинов, обеспечивающих развитие адаптивных реакций.
Естественно, что нарушение функциональной активности желез внутренней секреции имеет гетерогенную природу и может чаще носить приобретенный, реже – наследственный, или врожденный, характер.
В зависимости от локализации патологии различают следующие варианты эндокринопатий:
а) первичные – при локализации патологии в периферической эндокринной железе;
б) вторичные – возникающие на фоне гипер- или недостаточной продукции гормонов аденогипофиза;
в) третичные – в случаях локализации патологии в гипоталамусе и, соответственно, при недостаточной или избыточной продукции либеринов или статинов.
Гормоны аденогипофиза, регулирующие активность периферических эндокринных желез, являются главным звеном ряда функциональных систем: гипофизарно-надпочечниковой, гипофизарно-гонадной, гипофизарно-тиреоидной. Последние оказывают регулирующее влияние на все виды обмена веществ, в частности на водно-солевой, как в условиях нормы, так и патологии различной локализации и этиологии.
Этиологические факторы и характер нарушений водно-электролитного обмена при гиперпродукции АКТГ и глюкокортикоидов. Гормон АКТГ продуцируется базофильными клетками аденогипофиза (кортиколипотропами) из общего предшественника – проопиомеланокортина (ПОМК). В структуре последнего, кроме АКТГ выделены γ- и α-меланоцитостимулирующие гормоны, β-липотропин, γ-липотропин, β- и α-эндорфины и другие соединения.
АКТГ – полипептид из 39 аминокислот, максимальная продукция приходится на утренние часы (4-6 часов), минимальная – на 18 часов. Секреция АКТГ стимулируется кортиколиберином, вазопрессином, гипоталамическим ангиотензином-II, а также холинергическими и серотонинергическими влияниями.
АКТГ – короткоживущий гормон, через несколько минут пребывания в плазме его концентрация снижается на 50%. Однако источником АКТГ в крови и тканях является ПОМК, в процессе протеолиза которого выделяется вышеперечисленный комплекс гормонов. Рецепторы АКТГ относятся к семейству G-белков, реализующих эффекты гормона на стероидогенез в надпочечниках при участии аденилатциклазы и протеинкиназ. АКТГ является стимулятором продукции не только глюкокортикоидов, но и андрогенов, в меньшей степени – минералокортикоидов.
В клинической практике выделяют так называемый синдром Иценко-Кушинга, который связан с гиперпродукцией глюкокортикоидов и соответствующими метаболическими расстройствами, в частности, нарушением водно-солевого гомеостаза. В зависимости от локализации патологии синдром Иценко-Кушинга может быть связан со следующими факторами:
1) первичным усилением продукции АКТГ (болезнь Иценко-Кушинга), возникающем в 85% случаев при микроаденоме аденогипофиза, которая является причиной развития вторичного гиперкортицизма;
В то же время различают АКТГ- или кортиколиберин-эктопированный синдром, связанный с продукцией указанных гормонов малигнизированными клетками неоплазий различной локализации и их метастазов (до 1-2% гиперкортикоидных состояний).
Симптоматика гиперкортицизма может иметь ятрогенное происхождение.
Следует отметить, что при болезни Иценко-Кушинга возникает не только гиперпродукция АКТГ, но и снижение продукции СТГ. Как правило, повышение уровня АКТГ сочетается с возрастанием продукции β-липотропина и β-эндорфина.
Характерными метаболическими и функциональными признаками гиперпродукции АКТГ и, соответственно, глюкокортикоидов являются «центральное» (туловищное) ожирение, гирсутизм, артериальная гипертензия, мышечная слабость, развитие иммунодефицитных состояний и связанные с ними активация микрофлоры, развитие инфекционного процесса.
Для гиперкортицизма характерны и нарушения водно-электролитного баланса. В связи с катаболизмом белков, составляющих остов костной ткани, возникает деминерализации костей, развитие остеопороза, который лежит в основе формирования патологических переломов ребер, позвонков, длинных трубчатых костей. В детском возрасте в связи с нарушением формирования костной ткани возникает задержка роста.
Избыточная продукция глюкокортикоидов сопровождается снижением всасывания кальция в кишечнике, одновременно развивается и гиперкальциурия. Глюкокортикоиды в избыточных концентрациях проявляют минералокортикоидную активность, вызывают интенсивную задержку натрия в почечных канальцах, развитие гипернатриемии. Последнее является одним из ведущих факторов формирования гипертензии. Наряду с кортизолом солезадерживающими свойствами обладают дезоксикортизол (вещество S), кортикостерон и дезоксикортикостерон, продукция которых возрастает под влиянием АКТГ в случаях болезни Иценко-Кушинга.
Задержка натрия и воды в сосудистой стенке приводят к повышению базального тонуса, потере эластичности сосудистой стенкой, повышению ее чувствительности даже к физиологическим концентрациям вазоконстрикторов. При длительном течении гипертензии в случаях гиперкортицизма возникают гипертрофия левого желудочка, признаки сердечной недостаточности, аритмия.
Развитие гиперкортицизма проявляется и другими синдромами: нарушением продукции гонадотропного и половых гормонов, развитием относительной недостаточности инсулина, т. е. с формированием внепанкреатической формы вторичного сахарного диабета. При этом возможны выраженные нарушения углеводного обмена и водно-электролитного баланса в виде гипергликемии, полиурии, полидипсии.
Развитие остеопороза костей под влиянием избыточных концентраций глюкокортикоидов, гиперкальциурия приводят к формированию нефрокальциноза, снижению чувствительности почечных канальцев к АДГ, полиурии, т. е. к формированию периферической формы несахарного диабета.
Особенности метаболических расстройств и водно-солевого обмена при гиперпродукции соматотропного гормона. Соматотропный гормон (СТГ) – простой мономерный белок, гормон роста и развития организма с момента рождения до юности и после полового созревания. СТГ регулирует многие метаболические процессы, антагонизируя эффекты инсулина. В свою очередь синтез и секреция СТГ регулируются гормонами гипоталамуса – соматолиберином и соматостатином, а также инсулиноподобным фактором роста-1 (ИФР-1). Секреция СТГ носит пульсирующий характер: максимальна в первые часы сна, резко возрастает при эмоциональном и физическом стрессе. СТГ стимулирует образование в гепатоцитах ИФР-1, обеспечивающего дифференцировку хондроцитов и рост хрящевой ткани, а также процессы остеогенеза. При участии ИФР-1 СТГ регулирует рост практически всех мягких тканей, в частности, способствует развитию гипертрофии миокарда и почек, эритропоэзу, заживлению ран. Метаболические эффекты гормона реализуются не только при участии ИФР-1, но и других гормональных пептидов – соматомединов (ММ ~ 5000-8000).
В условиях нормы СТГ обладает незначительным активирующим влиянием на кору надпочечников и водно-электролитный баланс, стимулирует усвоение кальция и магния костной тканью. Выраженные метаболические сдвиги возникают при гиперпродукции гормона роста и формировании клинической картины гигантизма или акромегалии. Следует отметить, что гиперпродукция СТГ при открытых зонах роста костей приводит к гигантизму, увеличению размеров внутренних органов – спланхномегалии, а при закрытых – акромегалии.
Гигантизм чаще всего формируется у мужчин в период полового созревания. Различают две формы гигантизма – акромегалическую и евнухоидную. Акромегалический гигантизм характеризуется высоким ростом с непропорциональным увеличением кистей и стоп, укрупнением черт лица, прогнатизмом нижней челюсти. Инфантильный гигантизм начинается обычно в раннем детском или препубертатном возрасте, сопровождается гипогенитализмом, физической и психической инфантильностью.
В основе гигантизма лежит опухолевое или инфекционно-токсическое поражение гипоталамо-гипофизарной системы, сопровождающееся гиперплазией эозинофильных клеток аденогипофиза (соматотропов) и гиперпродукцией СТГ. Гиперпродукция гормона роста обуславливает в ряде случаев гигантизма и развитие акромегалии при закрытии эпифизарных зон роста у людей в возрасте 20-40 лет.
Развитие акромегалии или гигантизма может возникать после черепно-мозговых травм, перенесенных в детстве инфекций, после эпидемического энцефалита, арахноидита или может носить идиопатический характер.
Как правило, возрастание уровня СТГ в крови сочетается с фазными изменениями содержания инсулина: первоначальным увеличением его уровня с последующим истощением β-клеток, развитием дефицита инсулина и возрастанием инсулинорезистентности тканей. При прогрессировании заболевания возникает гиперкальциемия, что связано с повышением функции паращитовидных желез. Одновременно в связи с деминерализацией костей повышается содержание в крови неорганического фосфора. В ряде случаев при наличии аденомы эозинофильных клеток возрастает давление на заднюю долю гипофиза, что приводит к нарушению секреции АДГ и развитию симптоматики сахарного диабета.
Клинические признаки, свидетельствующие о выраженных нарушениях функции коры надпочечников при гигантизме или акромегалии, как правило, отсутствуют. Однако при длительном течении заболевания у ряда пациентов могут появиться признаки вторичной надпочечниковой недостаточности и соответствующие нарушения водно-электролитного баланса.
Особенности метаболических расстройств и водно-солевого обмена при гиперпродукции тиреотропного гормона. Тиреотропный гормон – гликопротеид с молекулярной массой 28,3 кД, вырабатывается базофильными тиреотропами аденогипофиза на фоне стимулирующего воздействия тиролиберина. Ингибиторами секреции ТТГ являются соматостатин, тироксин и трийодтиронин, дофамин, глюкокортикоиды. Изменения продукции ТТГ возникают при гипо- и гипертиреоидных состояниях. При первичном гипотиреозе резко увеличивается продукция ТТГ, масса гипофиза возрастает. В то же время снижается выработка СТГ и АКТГ. При вторичном гипотиреозе продукция ТТГ может быть снижена, а в ряде случаев и повышена, когда имеет место продукция в гипофизе малоактивного ТТГ.
Гипертиреоз в большинстве случаев имеет не гипоталамо-гипофизарное происхождение, а связан с действием на щитовидную железу бактериально-токсических, иммуноаллергических факторов. Гипертиреоз возникает при развитии тиреотоксического зоба, доброкачественных или злокачественных опухолей. В 5% случаев развивается гипертиреоз центрального происхождения.
Симптоматика метаболических и функциональных расстройств при центральных гипо- и гипертиреозах аналогична таковой при первичном поражении щитовидной железы и будет представлена ниже.
Анализы крови. Гормоны гипофиза.
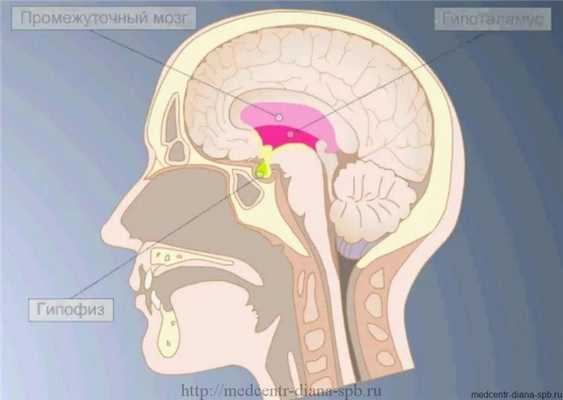
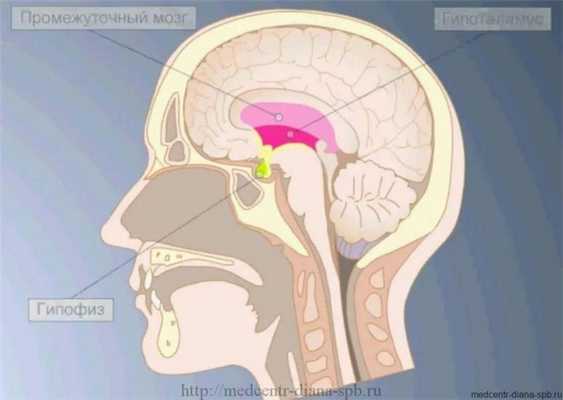
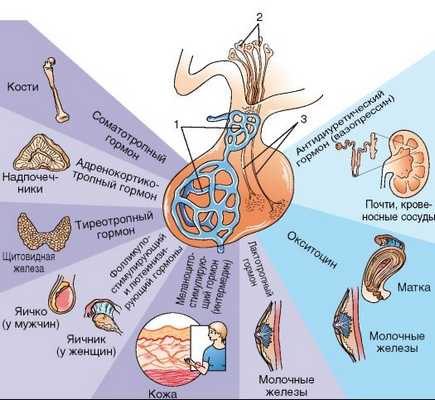
Гипофиз – небольшая эндокринная железа, которая находится в клиновидной кости головного мозга. Она вырабатывает семь основных гормонов и выбрасывает их в кровь.
Четыре гормона влияют на физиологические процессы опосредовано - повышают выработку гормонов в периферических железах, а самостоятельного эффекта на физиологические процессы не оказывают. При наработке достаточной концентрации периферических гормонов гипофиз получает сигнал, и прекращает синтезировать свои гормоны.
К гормонам гипофиза с опосредованным эффектом относят:
- Тиреотропный гормон (ТТГ), в крови здоровых мужчин и женщин его уровень должен составлять 0,4 - 4.0 мкМЕ/мл. ТТГ запускает наработку гормонов щитовидной железы - тироксина (Т4) и трийодтиронина (Т3), без участия которых невозможен ни один процесс в организме.
- Фолликулостимулирующий гормон (ФСГ), нормальные значения гормона в крови различны в зависимости от фазы менструального цикла. Так в фолликулярную фазу (это 1-14 день от начала месячных) ФСГ должен составлять 3,5 – 13 МЕ/мл, в овуляторную фазу (14-16 день) норма ФСГ 4,1 – 22 МЕ/мл, в лютеиновую фазу (с 16 дня до начала следующего цикла) норма ФСГ 1,7-7,7 МЕ/мл. При наступлении беременности концентрация гормона резко падает и в норме составляет 0,01-0,3 МЕ/мл. В период климакса, наоборот, цифры возрастают и могут составлять до 60 МЕ/мл.
- Лютеинизирующий гормон (ЛГ), его нормальные значения также зависят от цикла, в фолликулярную фазу и овуляцию нормы у женщин детородного возраста находятся в пределах 24 – 150 МЕ/л, в лютеиновую – 2-17МЕ/л. при беременности количество ЛГ значительно снижается, при климаксе увеличивается.
ФСГ и ЛГ являются гонадотропными гормонами, запускают синтез гормонов в яичниках, оказывают влияние на развитие фолликула, его созревание, овуляцию и синтез важнейших гормонов, необходимых для наступления и развития беременности: эстрадиола и прогестерона. Оказывают влияние на рост молочных желёз и выработку грудного молока, а также процесс сперматогенеза (образование и формирование сперматозоидов) у мужчин.
Следует учитывать, что гормон чувствителен к стрессовым факторам, времени суток, менструальному циклу, поэтому кровь необходимо сдавать утром, пред сдачей крови избегать физических нагрузок, стрессовых ситуаций, употребления алкоголя, женщинам рекомендуется сдавать кровь на 3-7 день менструального цикла.
Гипофиз вырабатывает три гормона прямого действия , так называемые эффекторные гормоны, они самостоятельно действуют на обменные процессы в организме человека.
- Соматотропин или соматотропный гормон (СТГ), влияет на рост костей в длину в детском и подростковом возрасте, при его сниженной выработке ребёнок будет невысокого роста, в тяжелых случаях останется карликом, при повышенном содержании возникает гигантизм. В старшем возрасте, когда хрящи окостеневают, и рост костей становится невозможным, повышенная выработка СТГ будет проявляться в виде акромегалии – расширения костей в ширину, особенно широкими становятся кисти и стопы.
Нормальные значения СТГ у мужчин составляют 0-4 мкг/л, у женщин 0-7 мкг/л, в детском возрасте цифры выше 2-10 мкг/л.
Пролактин назначается в комплексе с другими половыми гормонами при бесплодии или патологически заканчивающихся беременностях.
В статье приведены усреднённые значения, нормы могут немного отличаться для разных лабораторий.
Анализы на гормоны гипофиза выявляют тяжелые заболевания
Гормоны гипофиза считаются «дирижерами» эндокринной сферы человека, поэтому для обнаружения заболеваний, которые связаны с ней, часто проводятся анализы крови на них. Анализы на гормоны гипофиза позволяют диагностировать множество заболеваний, подтвердить предположительный диагноз.
Какие анализы нужно сдавать на гормоны гипофиза
Гипофизом называется мозговой придаток, который имеет форму округлого образования, находится на нижнем участке головного мозга в турецком седле (костном кармане). Гипофиз в человеческом организме производит гормоны, которые контролируют обмен веществ, рост, репродуктивную функцию и так далее.
Комплексное обследование, целью которого является уровень концентрации гормонов гипофиза в организме пациентов, как правило, включает в себя анализы, описанные ниже.
- Фолликулостимулирующий или ФСГ. Анализ крови на ФСГ очень важен при бесплодии, так как данный г ормон у мужчин обеспечивает образование тестостерона (мужского полового гормона), а также рост семявыводящих канальцев, это обеспечивает стимуляцию созревания сперматозоидов. Женский ФСГ создает условия для роста в яичниках фолликулов, увеличение слизистой маточной полости для зародыша, выделения эстрогенов (женских половых гормонов).
- Лютеинизирующий или ЛТГ. Это вещество в организме у мужчин обеспечивает рост концентрации в крови тестостерона, что позволяет сперматозоидам созревать. У женщин гормон ЛТГ гарантирует возникновение желтого тела с последующим производством прогестерона.
- Пролактин. Этот элемент позволяет созревшей яйцеклетке покинуть яичник, то есть, обеспечивает процесс овуляции в организме женщины. Также он несет ответственность за секрецию после рождения ребенка молока. Если концентрация гормона пролактина сокращается, процесс овуляции тормозится, итогом чего является бесплодие, при диагностике которого часто проводится анализ крови на пролактин.
- Тиреотропный или ТТГ. Гормон ТТГ выступает в роли основного гаранта секреции и биосинтеза гормональных элементов щитовидной железы.
- Адренокортикотропный.Этот элемент обеспечивает функциональность коры надпочечников.
- Соматотропный. Данное вещество известно как важный активатор биосинтеза в клетках белка, он отвечает за распад жиров, возникновение глюкозы и рост человеческого организма.
Эти анализы на гормоны гипофиза назначаются эндокринологом и гинекологом.
Зачем нужно сдавать анализы на гормоны гипофиза
Сдача крови на гормоны гипофиза – анализ, проведение которого позволяет врачу выявить или подтвердить диагноз при следующих заболеваниях:
- гигантизм;
- акромегалия (увеличение у пациента частей тела);
- несахарный диабет;
- гипофизарный нанизм;
- заболевание Иценко-Кушинга;
- гипофизарный гипогонадизм;
- гипофизарный гипотиреоз;
- gipyerprolaktinyemiya;
- синдром Шихана.
Сроки проведения анализов крови на вещества гипофиза зависят от того, в какой лаборатории проводится исследование. Срок действия гормональных анализов обязательно следует уточнить у врача.
Как подготовиться к анализам на гормоны гипофиза
Гормоны гипофиза отвечают за регулировку функционирования всех прочих эндокринных желез человека, сдача анализа крови на данные гормоны может потребоваться в целях диагностики множества заболеваний. Для получения корректных результатов крайне важно правильно подготовиться к исследованию.
Анализ на гормоны гипофиза: подготовка
Правила подготовки к анализам могут изменяться в зависимости от того, какой гормон является объектом врачебного интереса.
- Если планируется анализ крови на фолликулостимулирующий гормон (ФСГ), обязательно нужно сдавать биологический материал на голодный желудок (минимум 12 часов без пищи). Мужчины могут проходить данное исследование абсолютно в любой день, тогда как женщинам рекомендуется делать это на 19-21 или 3-8 дни цикла.
- Если объектом исследования является лютеинизирующий гормон, женщинам рекомендуется выбирать для проведения анализа крови те же самые дни цикла, как и в предыдущем варианте, мужчинам – сдавать в любое время. Обязателен отказ от пищи в течение приблизительно 8 часов перед проведением исследования.
- Пролактин у женщин диагностируется дважды в месяц, в первых двух фазах цикла, обязательна сдача крови на анализ в утренние часы и натощак. Необходим также примерно получасовой отдых перед забором биологического материала.
Общие правила подготовки к анализу крови на гормоны гипофиза
Готовясь к сдаче крови на гормоны гипофиза, пациенты вне зависимости от пола должны соблюдать следующие правила.
Если пациент будет четко придерживаться всех правил подготовки, которые приводятся ниже, корректные результаты анализов на гормоны гипофиза обеспечены.

Прием гинеколога
Гинекология – сфера медицины, которая занимается изучением полового и репродуктивного здоровья представительниц прекрасного пола, а также помогает женщинам в период вынашивания и рождения ребенка. Прием гинеколога — обязательная часть жизни каждой женщины.

Прием эндокринолога в СПБ
Эндокринология — наука, направленная на диагностику и лечение заболеваний желез внутренней секреции, которые вырабатывают важнейшие регуляторные химические вещества — гормоны. Прием эндокринолога — обязательное условие успешного лечения любой эндокринной патологии.
Как расшифровать анализы на гипофиз
Расшифровка результатов анализов на гормоны гипофиза должна производиться профессиональным врачом, так как отсутствие специальных знаний не позволит человеку получить полноценное представление о картине заболевания. Однако можно сделать общие выводы самостоятельно, зная нормы основных элементов гипофиза, которые приводятся ниже.
Показатели и норма
Ниже содержится список основных видов анализов крови на гормоны гипофиза с указанием их нормальных значений.
Адренокортикотропный
гормон (АКТГ)
Соматотропные гормон (СТГ)
пролактин
Тиреотропный гормон
- Превышение нормы, которое диагностируется при сдаче анализа на ТТГ, может говорить о наличии тиреоидита, первичного гипотиреоза. Снижение концентрации рассматривается как указатель на аденому щитовидки, вторичный гипотиреоз, тиреотоксикоз.
Фолликулостимулирующий гормон
Лютеинизирующий гормон
Расшифровывать результаты анализов должен врач — эндокринолог или гинеколог, самодиагностика в данном случае является крайне опасной для пациента.
Сколько стоят анализы на гормоны гипофиза
Анализы на гормоны гипофиза входят в перечень анализов, по которым предоставляется скидка. Стоимость в таблице указана без учетов скидки!
Остальные цены можно уточнить в прайсе клиники или у администратора клиники.
Где сделать анализы на гормоны гипофиза в Санкт-Петербурге
p style=»text-align: justify;»> Сдать анализы на гормоны гипофиза в СПБ без очереди в удобное время можно в клинике Диана. О действующих скидках на перечисленные исследования вы можете узнать на нашем сайте в прейскуранте услуг.
Читайте также:
- Лечение блефаритов, конъюнктивитов, ячменя, кровоизлияний при сахарном диабете
- Лучевая диагностика дермоидной кисты позвоночника и спинного мозга
- Оболочки яйцеклетки. Половые клетки
- Диагностика конвекситального субарахноидального кровоизлияния (кСАК) по КТ, МРТ
- Диагностика разрыва межжелудочковой перегородки. Лечение разрыва межжелудочковой перегородки.
