Инсерции как причина рака
Добавил пользователь Morpheus Обновлено: 16.01.2026
Чем отличаются наследственные, спорадические и семейные случаи заболеваний раком? Об этом рассказал д.м.н. Александр Олегович Иванцов – старший научный сотрудник лаборатории морфологии опухолей НМИЦ онкологии им. Н.Н. Петрова.
Наш организм состоит из большого числа специализированных клеток. Например, кардиомиоциты обеспечивают сокращения миокарда, лимфоциты выполняют защитную функцию, участвуя в гуморальном и клеточном иммунитете, и т.д. Ядро каждой клетки содержит ДНК. В ней заключена вся биологическая информация, необходимая для создания и функционирования клеток, органов и систем органов в целом. Наследственный материал, заключённый в ядре, представлен 23 парами хромосом ‒ 22 пары аутосом и пара половых хромосом. ДНК представляет собой длинную полимерную молекулу, состоящую из последовательности повторяющихся блоков ‒ нуклеотидов. А последовательность нуклеотидов «кодирует» информацию о различных типах РНК, необходимых для последующего биосинтеза важнейших белков.
Что такое спорадический или случайный рак?
Под влиянием внешних мутагенных факторов, например ‒ курения, ультрафиолетового или ионизирующего излучения, ‒ или спонтанно, чаще всего в процессе удвоения ДНК, в отдельных клетках организма могут происходить мутации, т.е. «поломки» ДНК. Если постепенно в одной клетке накапливается определённое количество повреждений, затрагивающих значимые участки ДНК, то это может привести к развитию опухоли. Такие опухоли называются спорадическими.
Как правило, к злокачественной трансформации приводят мутации, нарушающие баланс клеточного деления и гибели. Известно, что для возникновения трансформированного клеточного клона, т.е. раковой клетки, необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах. Онкогеном называется ген, который в норме способствует процессам деления клеток, в случае возникновения опухоли он активируется избыточно. А антионкогены в норме подавляют процесс деления или способствуют клеточной гибели, и в случае возникновения опухоли их «сдерживающий» эффект выключается. В случаях спорадического рака процесс накопления мутаций достаточно длительный и занимает десятилетия, потому заболевание чаще развивается у людей в зрелом или пожилом возрасте.
Таким образом, спорадические опухоли возникают из-за случайных или обусловленных вредными внешними факторами генетических «поломок» в изначально здоровых клетках организма. Эта группа новообразований является самой многочисленной (до 90 %). Подобные опухоли не передаются по наследству.
Что такое наследственный рак?
С другой стороны, 5-10% случаев возникновения злокачественных опухолей предопределяет наследственность. Это означает, что заболевание возникает из-за мутаций, заложенных в наших генах с самого рождения, они унаследованы от родителей. Это требует определённого пояснения. Каждый человек формируется в результате слияния одной яйцеклетки ‒ 23 хромосомы от матери, и одного сперматозоида ‒ 23 хромосомы от отца. И если в этом наборе хромосом были мутации, то они передаются потомству. После оплодотворения зародышевые клетки быстро делятся, передавая свою мутацию всем последующим поколениям соматических специализированных клеток и клеткам-предшественницам половых клеток.

Таким образом в каждой клетке уже присутствует одна из 5-9 «необходимых» мутаций. Её присутствие обычно компенсируется, организм остаётся здоровым, но количество генетических событий, необходимых для развития рака, уменьшается на 1 – это приводит к фатальной вероятности возникновения опухоли. Новообразования, возникшие у носителей подобных мутаций, называются наследственными.
Доля наследственных форм среди опухолей разных органов неодинакова. К примеру, она достаточно высока для рака яичника, молочной железы, толстой кишки, поджелудочной железы. Носительство мутаций, повышающих риск развития опухолей определённых локализаций, может передаваться по наследству. При большинстве наследственных формах рака вероятность передачи мутации потомству составляет 50%.
Что такое семейный рак?
Термин «семейный рак» описывает ситуацию, когда в пределах одной семьи наблюдается повышенная, по сравнению с популяционной, частота какого-либо одного или нескольких типов опухолей.

Иногда термин «семейный рак» употребляется как синоним наследственного рака, что не вполне верно, так как не во всех семейных случаях удаётся выявить конкретную мутацию, вызывающую заболевание. Семейная агрегация опухолей при этом может быть связана с присутствие других, пока неизвестных генетических особенностей, с наличием общих для членов одной семьи экзогенных вредных воздействий, или же сочетанием тех и других факторов.
Что делать, чтобы не пропустить наследственный или семейный рак?
Медико-генетическое консультирование помогает предположить наследственный характер опухолевого заболевания, определить необходимость генетического тестирования и интерпретировать его результаты, оценить риск развития новообразований у родственников пациента.
Зачем нужно молекулярно-генетическое тестирование?

Молекулярно-генетическое тестирование в ряде случаев позволяет решить важные для врача и онкологического пациента задачи: подтвердить диагноз наследственного рака; оптимизировать тактику лечения пациентов с наследственной опухолью; провести молекулярную диагностику у членов семьи пациента с целью исключения высокого риска развития аналогичных злокачественных новообразований; организовать комплекс мероприятий, направленных на предупреждение и раннюю диагностику онкологической патологии у здоровых родственников пациента; планировать создание семьи и деторождение, прогнозировать здоровье потомства.


Авторская публикация:
Иванцов Александр Олегович
доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Инсерции как причина рака
Крупные делеции при раке
Более 150 наследственных заболеваний обусловлены делецией генов, которые могут захватывать от нескольких нуклеотидных пар до нескольких сотен тысяч. Размер делений лежит в основе их классификации. Места развития делений обычно неслучайны: некоторые последовательности ДНК более подвержены этому событию, чем другие; спонтанные делеции часто происходят в одних и тех же последовательностях разных генов. Эта неслучайность делеции особенно заметна при исследовании генетических заболеваний.
Делеции происходят в случае гомологичной, но не равной рекомбинации между генами. Сходные последовательности в геноме могут перемещаться на протяжении митоза или мейоза, что может привести к укорочению гена. Наиболее часто мутации этого типа происходят в длинных гомологичных областях.
Повторяющиеся последовательности ДНК особенно подвержены делениям, т. к. их структура допускает возможность потерь. Данный механизм называется гомологичной, или неравной, рекомбинацией между повторяющимися элементами. Наиболее распространенная повторяющаяся последовательность — Alu-повтор (до 106 последовательностей Alu во всем геноме). Alu-повторы находятся на расстоянии 4 тыс. пар оснований, имеют длину 300 пар нуклеотидов и разделены короткими регионами, насыщенными аденозиновыми основаниями (А-регионы).
Степень гомологии Alu-элементов достигает 70—90 %; их 3'-концы включают поли-А-хвосты и внутренний промотор РНК-полимеразы III. Alu-повторы особенно подвержены частым мутациям.
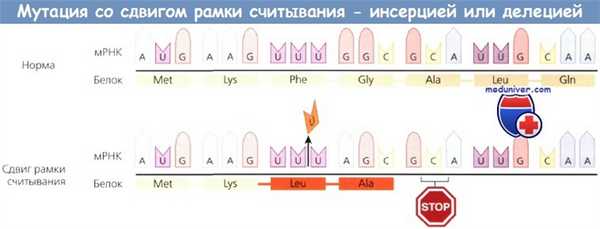
Мутация со сдвигом рамки считывания, при которой вставка (инсерция) или выпадение (делеция) пары оснований ведут к образованию стоп-кодона и, как правило, синтезу укороченного белка
В базе данных HGMD имеются сведения о больших делециях 400 генов и приблизительно о 3000 делециях меньшего размера. Идентифицировано до 2500 делений протяженностью 20 пар оснований. Это может быть результатом делеции повторов или частью процесса эксцизионной репарации. Делеции происходят не случайным образом. Имеются отдельные последовательности, более предрасположенные к делециям, которые часто содержат регионы, богатые гуанином.
Молекулярно-биологическими методами (клонирование генов, гибридизация in situ, рестрикционное картирование генов, полимеразная цепная реакция) показано, что определенная хромосомная аномалия сопровождается развитием различных злокачественных опухолей и активация того или иного онкогена происходит в большинстве случаев из этих новообразований. Наиболее частые нарушения в солидных опухолях представлены делениями в особых последовательностях генов, что проявляется утратой связывающих регионов или утратой гетерозиготности определенных аллелей.
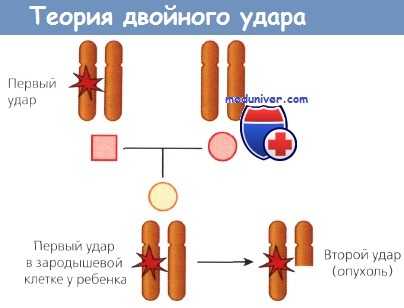
Теория «двойного удара» Knudson, объясняющая концепцию опухолевых генов-супрессоров.
Деления генетического материала в опухолевых клетках ведет к нарушениям пролиферации и дифференцировки клеток. При многих солидных опухолях человека выявлены определенные виды хромосомных делеции, например деления или мутация региона короткого плеча хромосомы 17, содержащего ген-супрессор ТР53. Тот факт, что при столь многих опухолях встречаются общие нарушения (потеря хромосомного материала), свидетельствует о локализации в этих регионах генов, регулирующих функции широкого спектра клеток.
Индукция процесса злокачественной трансформации с участием гена-супрессора опухолевого роста должна включать по меньшей мере два события: мутации или делеции в каждом из двух аллелей гена. Эта теория, предложенная Knudson, получила название теории «двойного удара» или «двойной мутации». Возможные варианты таких ударов для экспрессии рецессивного гена представлены на рисунке. Эта теория объясняет предрасположенность некоторых людей к развитию злокачественных новообразований.
Кроме того, ее разработка дала импульс к изучению генетических механизмов развития спорадических опухолей: в генетически предрасположенной клетке функции одного неизмененного аллеля достаточно для поддержания нормального роста и его регуляции; для злокачественной трансформации требуется повторная деления или мутация, чтобы инактивировать оставшийся нормальный аллель.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инверсии и транслокации генов как причина рака
Инверсии генов при раке. Возможно, инверсии представляют собой наименее распространенный вид мутаций. При данном виде нарушений участок ДНК образует петлю и меняет свое направление: 3'-конец становится 5'-концом. Размер инвертированных участков, разумеется, варьирует.
Наиболее важная инверсия из тех, что вызывают заболевания у человека, происходит в гене фактора VIII. Она ведет к развитию тяжелой гемофилии А. На сегодня злокачественные опухоли, причиной которых могли бы быть инверсии, не обнаружены.
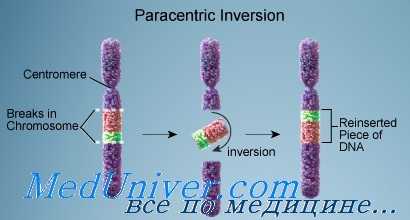
Парацентрическая инверсия
Транслокации генов при раке
В клетках злокачественных опухолей описано более 100 часто встречающихся транслокаций. Многие из них постоянно выявляются при определенных опухолях, что свидетельствует об их вовлечении в процесс злокачественной трансформации.
Некоторые транслокации могут быть вторичными в развитии более агрессивных фенотипических изменений. Генетическая нестабильность, присущая злокачественным клеткам, ведет к дальнейшему усилению кариотипических аномалий в процессе прогрессирования болезни, а дополнительные генетические нарушения повышают пролиферативный потенциал опухоли.
Единственная транслокация, как правило, не вызывает немедленное развитие опухоли; это показано на примере больных атаксией-телеангиэктазией, имеющих высокий риск лейкоза. У этих больных за много лет до развития злокачественного процесса можно выявить лимфоциты с типичной транслокацией. В таблице приведены некоторые примеры транслокаций при солидных опухолях.
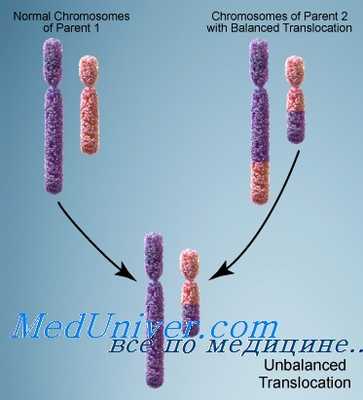
Схема транслокации
Генетическая нестабильность — распространенное явление при злокачественных новообразованиях. Наиболее ярко это выражено при ННПКРР, известном также как синдром Линча типа II.
Заболевание характеризуется нестабильностью микросателлитных последовательностей и связано с дефектами нескольких генов, ответственных за репарацию некомплементарных спаривании нуклеотидов. Частота мутаций в клетках с нарушениями таких генов значительно выше по сравнению с нормальными генами в интактных клетках.
Опухоли больных ННПКРР могут служить моделью для изучения спорадических онкологических заболеваний, т. к. во всех этих случаях развиваются сходные мутации, поражающие одни и те же гены и последовательности ДНК. Так, Krawczak показал, что спектр нуклеотидных замен в гене ТР53 при спорадических новообразованиях весьма близок к нарушениям, определяемым в опухолях больных с наследственными онкологическими синдромами.

Генетика и онкология: главные вопросы
Что такое онкоген? Как возникают мутации в ДНК? Какие мутации провоцируют рак? Кому и чем могут помочь молекулярно-генетические исследования?
На эти и другие вопросы во Всемирный день ДНК отвечает Александр Олегович Иванцов – доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.

Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Кому и чем могут помочь генетические исследования? Верно ли, что от генетического исследования может зависеть успех лечения? Кому стоит пройти генетическое исследование на мутации?
— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
Рак прямой кишки
Рак прямой кишки – одна из самых серьезных болезней нашей цивилизации, которая занимает 4 место среди всех онкологических патологий и 2-е место среди опухолей желудочно-кишечного тракта.
Рак прямой кишки – что это такое?
Это злокачественное онкологическое заболевание происходит из эпителия прямой кишки. Этой опухоли присущи характерные черты любого злокачественного образования – быстрый рост, прорастание в соседние ткани, метастазирование.
Подвержены болезни мужчины и женщины в равной степени. Рост числа заболевших отмечается с 45 лет, а пик заболеваемости приходится на 75-летних.
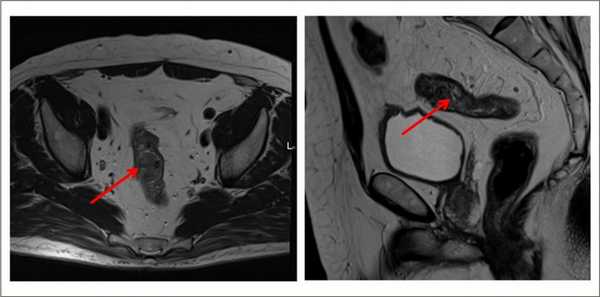
О заболевании
Слизистая оболочки конечного участка толстой кишки покрыта цилиндрическим эпителием с большим количеством желез. Их клетки продуцируют слизь. Под влиянием факторов риска появляются патологические клетки с бесконтрольным делением и утратой механизма апоптоза – запрограммированной гибели. Постепенно из них формируется опухоль прямой кишки.
Предположительно установлены причины рака прямой кишки:
- Неправильное питание.
Преобладание в рационе мясной пищи, животных жиров с одновременным дефицитом растительной клетчатки ухудшает прохождение кала, способствует запорам и развитию колоректальных опухолей. - Роль наследственности — замечена при возникновении некоторых форм новообразований.
- Предраковые патологии — полипы, болезнь Крона, неспецифический язвенный колит.
- Иммунодефицитные состояния, карцинома половых органов или молочной железы у женщин.
Виды рака прямой кишки
Тип опухоли определяется ее локализацией:
- Аноректальное расположение характерно для 5-8% случаев.
- Ампулярное встречается чаще других, до 80%. Это патология в самой широкой части кишки.
- Надампулярная локализация до 12% больных.
Характер роста опухоли может быть:
- экзофитный – растет в просвет кишечника;
- эндофитный – прорастает толщу стенки, инфильтрирует ее, может охватывать циркулярно;
- смешанный рост.
По гистологической картине новообразование бывает:
- железистый рак (аденокарцинома);
- солидный;
- перстневидно-клеточный;
- скирр;
- плоскоклеточный.
Симптомы рака прямой кишки, первые признаки
Развитие опухолевого процесса вызывает отдаленные признаки рака прямой кишки:
- слизь и кровь в кале;
- гнойные выделения;
- чувство переполненного кишечника;
- вздутие живота;
- боль в области прямой кишки;
- хроническая усталость, утомляемость;
- анемия;
- потеря веса.
На начальных стадиях проявления болезни может не быть. При выявлении анемии неизвестного происхождения стоит искать причину скрытого кровотечения. Возможно, это рак.
Поздние стадии характеризуются поражением других органов:
- прорастание в соседние органы, образование межорганных свищей;
- гнойно-воспалительные процессы – парапроктит, флегмона малого таза;
- перфорация опухоли надампулярной локализации с развитием перитонита;
- кровотечение.
Как выглядит рак прямой кишки – фото
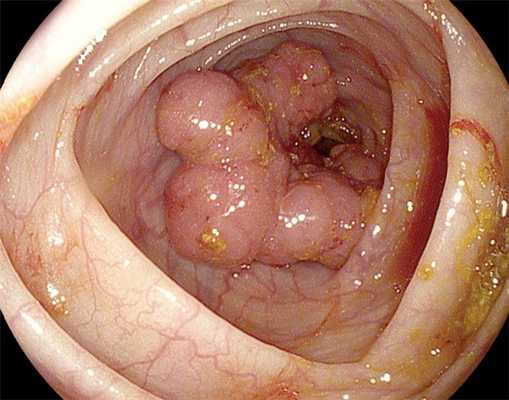
На фото рака прямой кишки можно заметить, что он значительно сужает просвет кишечника. Это является причиной запоров, переполненного живота, метеоризма.
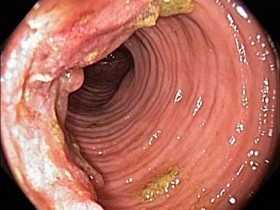
На этом фото карцинома растет инфильтративно, охватывая стенку.
Диагностика
После обращения к врачу, определяют симптомы, которые беспокоят пациента и позволяют предположить болезнь ректального отдела.
Общий анализ мочи и крови отражают состояние организма, наличие воспаления, анемию, работу почек и мочевого пузыря
Этот метод позволяет выявить опухоли аноректальной локализации. Определяют состояние сфинктера, слизистой оболочки.
Для обследования внутренней поверхности прямой кишки в более удаленных участках:
— ректороманоскопия – изучение кишечника с помощью жесткой трубки с оптическим прибором на конце;
— колоноскопия – исследование с помощью гибкого эндоскопа, позволяет обследовать весь кишечник.
Из подозрительных и измененных участков берут части тканей, которые изучаются на предмет раковых клеток или диспластических предраковых процессов.
Для дифференциальной диагностики рака, обнаружения на ранней стадии изменений, которые могут привести к онкологии.
Для определения распространенности злокачественного процесса. Можно выполнять абдоминально – через брюшную стенку, и трансректально – через анальное отверстие.
Часто возникает сочетание опухолей кишечника с гинекологическими карциномами – раком тела матки, яичников, а также молочной железы.
С применением контрастного вещества. На снимках заметны дефекты наполнения кишечника, патологические разрастания тканей, стенозы, вызванные новообразованием.
Выявляет даже небольшие по размеру патологические очаги, метастазы и инвазию опухоли в соседние органы, ее топографическое положение относительно других структур. Метод безопасен, не создает радиационную нагрузку, в отличие от КТ.
Стадии рака прямой кишки
Течение ракового процесса при отсутствии должного лечения прогрессирует. Стадия определяется по степени поражения самого кишечника, прорастанием ее через стенку, наличием метастазов в лимфоузлах, отдаленных поражениях других органов.
В связи с этим опухоли делят на 4 стадии. Такое распределение универсально для любых злокачественных опухолей.
1 стадия – опухоль небольших размеров, растет на слизистом слое, не поражает соседние органы и лимфоузлы.
2 стадия делится на А и Б. 2А – это поражение от трети до половины окружности кишечной трубки, но растет строго в стенке или просвете, метастазов нет. 2Б – размер очага такой же, но есть метастазы в околокишечных лимфоузлах.
3А – опухоль занимает более половины окружности кишки, прорастает через все слои и околокишечную клетчатку. Могут быть единичные метастазы в ближайших лимфоузлах.
3Б – любой размер опухоли, метастазы в отдаленных лимфоузлах, принимающих лимфу от ректальной области.
4 стадия – метастазы распространяются по внутренним органам и отдаленным лимфатическим узлам. Размер первичной опухоли может быть любой.
Методы лечения рака прямой кишки
Небольшой размер опухоли и ее прорастание только через слизистый и подслизистый слой прямой кишки, не затрагивая мышечный и серозный, позволяет выполнить хирургическое удаление самой опухоли. Иногда возможно проведение операции через кишку с помощью колоноскопа.
Если она проросла в мышечный слой, то показана резекция прямой кишки или экстирпация (полное удаление органа). Также удаляется параректальная клетчатка и лимфоузлы, в которых в 20% случаев уже обнаруживаются метастазы. Для проведения операции используют два доступа – лапаротомия (рассечение брюшной стенки) и лапароскопия (операция с помощью видеооборудования через несколько проколов на животе).
Тип операции выбирается исходя из локализации опухоли. Высокое расположение позволяет провести удаление новообразования и временно вывести конец кишки на брюшную стенку – сформировать колостому для дефекации. Такая манипуляция нужна, если пока сшить между собой концы кишки невозможно. Вторым этапом через некоторое время восстанавливают целостность кишечника.
При низком расположении опухолевого процесса, если ниже ее не осталось здоровых тканей, проводят удаление пораженного участка и анального отверстия, накладывают колостому на брюшную стенку.
Прогноз выживаемости
После проведения радикальной операции выживаемость в течение 5 лет колеблется в пределах 34-68%. На исход лечения влияет стадия, на которой была диагностировна опухоль, состояние самого пациента, его возраст, сопутствующие заболевания.
В зависимости от стадии опухолевого процесса, пятилетняя выживаемость определена следующими цифрами:
- 1 стадия – до 77%;
- 2 стадия – до 73%;
- 3 а стадия – 46%;
- 3 б стадия – 43%.
4 стадия не рассматривается в данной статистике. Радикальные операции зачастую провести невозможно, т.к. метастазы опухоли диссеминрованы по всему организму. Летальный исход зависит от общего состояния больного.
Противопоказания
Операция противопоказана при следующих условиях:
- тяжелые хронические заболевания пациента – артериальная гипертензия, ишемическая болезнь сердца, когда невозможно дать наркоз;
- преклонный возраст пациента;
- запущенные стадии рака.
При распространенном процессе с метастазированием во многие органы применяют паллиативные резекции, направленные на облегчение состояния больного. Симптоматические операции – наложение обходных анастомозов, чтобы разгрузить кишечник и избежать осложнений на последних стадиях рака.
Лечение до и после операции
Химиотерапия и лучевая терапия показаны для больных с опухолями 2 и выше стадиями.
Если до операции были выявлены метастазы в нескольких лимфоузлах, а опухоль проросла мышечный слой, то на этапе подготовки к операции проводят лучевую терапию коротким курсом в течение 5 дней. Это позволяет уничтожить ранние метастазы, уменьшить размер самого образования.
Лечение рака прямой кишки после хирургического вмешательства проводится после получения патоморфологических данных об удаленных тканях. Решается вопрос о проведении облучения или его сочетании с химиотерапией. Лучевая терапия после операции уничтожает оставшиеся клетки в зоне первичной опухоли и предупреждает ее рецидив. У неоперабельных больных она облегчает состояние.
Чувствительность к химиотерапии выявляется у 30% больных. Ее назначают с лечебной целью для уничтожения метастазов.
Также химиотерапию проводят адьювантно – для предупреждения распространения карциномы, если выявлялось поражение нескольких лимфоузлов. Этот способ терапии улучшает качество и продолжительность жизни пациентов с метастазами. Применяют препараты платины, 5-фторурацил, лейковарин, фолинат кальция. Лекарства вводятся внутривенно капельно, курсами по несколько дней. Также применяют химиотерапию в сочетании с лучевой до проведения операции при местнораспространенной форме рака. Такое комбинированное лечение проводят в течение 1-1,5 месяца, а после окончания облучения через 6 месяцев выполняют операцию.
Читайте также:
