Инсулинотерапия при сахарном диабете
Добавил пользователь Skiper Обновлено: 27.01.2026
Для цитирования: Майоров А.Ю. Принципы инсулинотерапии у больных сахарным диабетом I типа. РМЖ. 2000;17:680.
Эндокринологический научный центр РАМН, Москва
В следствие того что сахарный диабет I типа инсулинзависимый, введение инсулина является единственно возможным средством лечения данной категории больных. Не существует альтернативы подкожной заместительной терапии инсулином, хотя она и представляет собой лишь имитацию физиологического действия инсулина. В нормальных условиях инсулин поступает в систему воротной вены, далее – в печень, где наполовину инактивируется, оставшаяся часть оказывается на периферии. Все это происходит настолько быстро, что уровень гликемии может поддерживаться в довольно узких пределах даже после еды. Иной путь наблюдается у инсулина, введенного под кожу: он с опозданием попадает в кровоток и тем более в печень, после чего концентрация инсулина в крови длительное время остается нефизиологически повышенной. Это несовершенство подкожной инсулинотерапии и объясняет тот факт, что больные диабетом вынуждены проводить самоконтроль обмена веществ, учет своего питания, физических нагрузок и других факторов, влияющих на уровень гликемии. Но современная стратегия и тактика инсулинотерапии позволяют сделать образ жизни больных сахарным диабетом I типа очень близким к нормальному. Осуществить это можно только путем обучения больных сахарным диабетом.
Необходимость применения программ обучения при сахарном диабете признана уже давно. Еще в 1925 г. один из пионеров инсулинотерапии Э. Джослин обучал больных тому, что считал главным для успеха лечения: ежедневному трехкратному определению глюкозурии и изменению дозы инсулина на основании полученных данных. Необходимость стационарного лечения возникала при этом редко. Но с появлением препаратов инсулина пролонгированного действия развитие инсулинотерапии пошло по другому пути. Больным было запрещено самостоятельно изменять дозу инсулина, они вводили инсулин пролонгированного действия лишь 1 раз в сутки, и на долгие годы им пришлось забыть о нормальном питании, смириться с повышенным риском гипогликемий и необходимостью частых госпитализаций. К началу 80-х годов диабетологи располагали препаратами инсулина высокой степени очистки, инсулином человека, усовершенствованными средствами для введения инсулина (одноразовые инсулиновые шприцы и шприцы-ручки), методами экспресс-анализа гликемии и глюкозурии с помощью тест-полосок. Вопреки ожиданиям, их применение само по себе не привело к уменьшению числа поздних осложнений диабета и стойкому улучшению компенсации углеводного обмена. По единодушному заключению специалистов требовался новый подход, который позволил бы эффективно управлять этим сложным хроническим заболеванием путем вовлечения самого больного в активный контроль за диабетом и его лечением. В настоящее время термин “терапевтическое обучение” официально признан Всемирной организацией здравоохранения, и оно является обязательной и интегральной частью лечения сахарного диабета любого типа. В отношении больных сахарным диабетом I типа это прежде всего означает, что больной должен стать грамотным “инсулинотерапевтом”.
Общепризнанной стратегией лечения больных сахарным диабетом I типа является интенсифицированная инсулинотерапия. Под интенсифицированной инсулинотерапией подразумевается режим многократных инъекций инсулина, имитирующий физиологическую секрецию инсулина b-клетками. Как известно, в физиологических условиях базальная (фоновая) секреция инсулина происходит непрерывно (в том числе и в отсутствие приема пищи, и ночью) и составляет около 1 ЕД инсулина в час (рис. 1, а). При физической нагрузке инсулиновая секреция в норме заметно уменьшается. Чтобы поддержать гликемию в пределах нормы во время еды, требуется значительная добавочная (стимулированная) секреция инсулина (около 1–2 ЕД на каждые 10 г углеводов). Эту сложную кинетику секреции инсулина с относительно постоянным базальным и варьирующим алиментарным уровнем можно имитировать следующим образом: перед приемами пищи больной вводит различные дозы инсулина короткого действия, а фоновая инсулинемия поддерживается инъекциями инсулина пролонгированного действия. Такой вид инсулинотерапии называется также базис-болюсной инсулинотерапией.
Как бы ни приближалась интенсифицированная инсулинотерапия к физиологическим условиям, не следует забывать, что профиль действия простого инсулина, введенного подкожно, не совсем точно соответствует физиологической кинетике алиментарной секреции инсулина. Этот вид инсулинотерапии также подразумевает, что больной ежедневно несколько раз определяет уровень глюкозы крови и учитывает эти показатели при выборе дозы инсулина. Как правило, больные делают инъекции инсулина короткого действия перед едой трижды в сутки, иногда и чаще. Базальная потребность в инсулине покрывается чаще всего двумя инъекциями инсулина пролонгированного действия в сутки. Наиболее частой схемой интенсифицированной инсулинотерапии является следующая комбинация инъекций:
• утром (перед завтраком) – введение инсулина короткого и пролонгированного действия;
• днем (перед обедом) – введение инсулина короткого действия;
• вечером (перед ужином) – введение инсулина короткого действия;
• на ночь – введение инсулина пролонгированного действия (рис. 1, б).
Такая схема является базовой, у каждого больного в определенные дни она может претерпевать изменения: количество инъекций инсулина короткого действия может быть больше или меньше в зависимости от конкретных обстоятельств (например, дополнительные приемы пищи, неожиданно высокие цифры сахара крови, сопутствующие заболевания и др.). Говоря о дозах инсулина, следует подчеркнуть, что не может быть раз и навсегда “подобранной” дозы инсулина, она достаточно часто будет изменяться в соответствии с изменениями образа жизни больного. Поэтому нет смысла рассчитывать дозы для конкретного больного, исходя из теоретических предпосылок (суточная доза на 1 кг массы тела, дневная и ночная потребность, соотношение базального и прандиального уровней инсулина и т.д.), – все это будут лишь среднестатистические величины. Единственным критерием, позволяющим правильно определить дозу инсулина, являются цифры гликемии, измеряемой самим больным.
Рис. 1. Физиологическая секреция инсулина и режим интенсифицированной инсулинотерапии
При подборе дозировки инсулина пролонгированного действия не следует забывать, что профиль действия инсулина зависит и от величины дозы: меньшая доза действует менее продолжительное время, чем большая. Это может привести к такой ситуации, когда слишком маленькая утренняя доза инсулина пролонгированного действия не позволяет обеспечить достаточной базальной инсулинемии ко времени ужина (обычно в таких случаях говорят, что инсулин “не дотягивает”), поэтому уровень глюкозы крови перед ужином заметно повышается (рис. 2, а). В этом случае необходимо либо делать дополнительную инъекцию инсулина короткого действия в полдник (рис. 2, б), либо посоветовать больному вводить небольшую добавочную дозу инсулина пролонгированного действия перед обедом (рис. 2, в). Таким образом, иногда возникает необходимость в трехкратном введении инсулина пролонгированного действия в сутки. Такой вариант инсулинотерапии встречается все чаще и чаще.
Рис. 2. Различные варианты режима интенсифицированной инсулинотерапии
В настоящее время преимущественное распространение получили препараты человеческого инсулина. При этом в качестве инсулинов пролонгированного действия наиболее удобно пользоваться препаратами НПХ-инсулина, потому что их в отличие от цинк-инсулинов можно смешивать в одном шприце и вводить вместе с инсулином короткого действия. Говоря о последних достижениях в области интенсифицированной инсулинотерапии, следует отметить появление на рынке так называемых короткодействующих аналогов инсулина человека, или инсулинов ультракороткого действия. Дело в том, что при подкожной инъекции простого инсулина его действие начинается через 30–40 мин, концентрация в сыворотке достигает пика позднее (2–4 ч после инъекции) и остается повышенной дольше (длительность действия до 6–8 ч), чем при нормальной секреции инсулина поджелудочной железой. Чтобы свести к минимуму этот недостаток лечения, подкожные инъекции человеческого инсулина короткого действия обычно рекомендуют производить примерно за полчаса до еды, а в промежутках между основными приемами пищи делать дополнительные “перекусы”. Это может создать существенные неудобства для больных, особенно для тех, кто ведет активный образ жизни. Путем изменения структуры молекулы человеческого инсулина можно получить аналоги с новыми свойствами. После подкожной инъекции это ведет к более быстрому всасыванию (0–15 мин), более быстрому наступлению пика действия (45–60 мин) и более короткой продолжительности действия (3–4 ч) по сравнению с обычным инсулином. Профиль действия такого инсулина обеспечивает больным большую гибкость в отношении режима дня, питания и физической активности.
В настоящее время неопровержимо доказано, что для предотвращения поздних осложнений сахарного диабета самым главным является постоянное поддержание уровня гликемии, близким к нормальному. У больных сахарным диабетом I типа достичь этого можно только с помощью интенсифицированной инсулинотерапии. Самым крупным исследованием, посвященным изучению влияния интенсифицированной инсулинотерапии и хорошего контроля сахарного диабета на частоту и степень тяжести поздних осложнений, явилось многоцентровое исследование DCCT (Diabetes Control and Complications Trial). Оно проводилось с 1982 по 1993 г. в 29 диабетологических центрах США и Канады. В исследовании участвовал 1441 больной сахарным диабетом I типа, пациенты были разделены на 2 группы. 1-я группа включала 726 человек без осложнений (группа первичной профилактики), 2-я – 715 человек с признаками диабетической ретинопатии (группа вторичной профилактики). В каждой группе одним пациентам назначалась традиционная терапия, а другим – интенсивная. Целью традиционной терапии была клиническая компенсация – отсутствие симптомов гипергликемии, кетонурии, частых и тяжелых гипогликемий. Достигалось это за счет одной или двух инъекций инсулинов короткого и пролонгированного действия, периодического самоконтроля гликемии или глюкозурии, обучения принципам диеты. Больные, как правило, не проводили самостоятельной ежедневной коррекции доз инсулина, обследование выполнялось 1 раз в 3 мес. При интенсивной терапии преследовались те же клинические цели, а кроме того, поддержание гликемии на уровне, максимально приближенном к таковому у здоровых людей (3,9–6,7 ммоль/л перед едой и менее 10 ммоль/л после еды). Интенсивная терапия предусматривала режим многократных инъекций инсулина (3 в день и более) или использование носимого дозатора инсулина, частое (4 раза в день и более) измерение уровня гликемии, обучение больных принципам самостоятельной адаптации доз инсулина. Больные посещали свой центр ежемесячно, регулярно связывались с врачом по телефону. У больных обеих групп регулярно измеряли уровень гликированного гемоглобина (объективно свидетельствующего о степени компенсации углеводного обмена), а также проводили тесты для оценки ретинопатии (фотографирование глазного дна), нефропатии (микроальбуминурия, протеинурия, клубочковая фильтрация) и нейропатии. Продолжительность наблюдения за больными колебалась от 3 до 9 лет (средняя составила 6,5 лет). На протяжении всего исследования уровень гликированного гемоглобина HbA1c в группе интенсивного лечения поддерживался на уровне, близком к 7%, тогда как в группе с традиционной инсулинотерапией он был около 9% (т.е. таким же, как исходный). Было показано, что развитие и прогрессирование диабетической ретинопатии в группе интенсивной терапии снизилось почти на 60%, тяжелой непролиферативной и пролиферативной ее форм, требующих лазеркоагуляции, – на 50%. В результате интенсивной терапии на 34–56% снизилась частота диабетической нефропатии, оцениваемая по уровню экскреции белка с мочой. Также статистически достоверно снизилась частота клинической нейропатии (на 60%) и макрососудистых осложнений (на 41%). Риск снижения различных осложнений в группах первичной и вторичной профилактики показан в таблице.
На первый взгляд интенсифицированная инсулинотерапия кажется обременительной для больных, в конечном же счете благодаря ей качество жизни пациентов повышается, поскольку они свободно изменяют как состав пищи, так и время ее приема. При введении инсулина короткого действия перед едой больные обучаются заранее выбирать необходимую его дозу в зависимости от запланированного на этот прием количества углеводов (в том числе разрешается употреблять в небольшом количестве сладости), которое они могут произвольно менять, и величины гликемии в данный конкретный момент. Являясь основой лечения сахарного диабета I типа, интенсифицированная инсулинотерапия не может рассматриваться отдельно от других его важнейших компонентов – самоконтроля обмена веществ, либерализованной диеты, учета физической активности и обучения, в противном случае достигнутый лечебный эффект будет минимальным. Было бы ошибочным считать, что сам по себе перевод больного на режим многократных инъекций автоматически значительно улучшит компенсацию. Некоторые больные и сегодня отказываются от интенсифицированной инсулинотерапии не только из-за необходимости частых инъекций, но и потому, что не знают тех преимуществ, которые она дает. С этой точки зрения обучение больных диабетом должно играть основную роль в формировании мотивации к переходу на более сложный, но и более эффективный путь лечения данного заболевания.
2. Бергер М., Старостина Е.Г., Йоргенс В., Дедов И.И. Практика инсулинотерапии. 1-е рус. изд. Berlin, Springer-Verlag, 1995.
3. Дедов И.И., Анциферов М.Б., Галстян Г.Р. и др. Обучение больных сахарным диабетом. М., 1999.
4. Дедов И., Йоргенс В., Старостина Е. и др. Книга о сахарном диабете. Руководство для больных сахарным диабетом, получающих инсулин. 1-е рус. изд. Mainz, Kirchheim-Verlag; 1990.
5. Кохен М. Сахарный диабет. Краткое руководство по лечению. М., 1997.
7. A Desktop Guide to Type 1 (Insulin-dependent) Diabetes Mellitus. European Diabetes Policy Group. Brussels, 1998.
8. Hirsch B., Farkas-Hirsch R., Skyler S. Intensive insulin therapy for treatment of type 1 diabetes. Diabetes Care 1990; 1: 1265-83.
9. The Diabetes Control and Complications Trial Research Group. The effects of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977-86.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Инсулинотерапия: виды, принципы, особенности и показания
Для лечения людей с сахарным диабетом 1 типа единственным методом лечения в клинической практике является инсулинотерапия. В некоторых ситуациях такая методика лечения применяется для лиц со 2 типом диабета. Лечение заключается во введении определенного количества препарата инсулина для компенсации в организме дефицита инсулина. Его основная цель заключается в Поддержании нормогликемии или близко к таковой, что предотвращает развитие поздних осложнений.
Виды инсулинотерапии
В зависимости от скорости начала воздействия на организм вводимых препаратов, необходимого времени для достижения пика и длительности действия, различают несколько разновидностей терапии, каждая из которых имеет свои особенности.
Традиционная инсулинотерапия
Такой тип лечения не является распространенной схемой инсулинотерапии при СД 1 типа, т.к получить хороший контроль уровня гликемии практически невозможно.
Чаще всего при лечении сахарного диабета 2 типа используют такой режим, когда вводятся инсулины короткой и средней продолжительности действия два раза в сутки.
Данный режим требует, чтобы у больного в обязательном порядке были три основных и три промежуточных приема пищи, причем желательно, чтобы количество углеводов в этих приемах пищи и было одинаковым каждый день.
Более простым вариантом этого режима будет введение смешанного инсулина дважды в сутки.
В этом случае каждая из инъекций комбинированная, поскольку состоит на треть из инсулина короткого, и на 2/3 пролонгированного действия. Утренний «короткий» инсулин предназначен для усвоения глюкозы, поступившей за завтраком. А «длинный» инсулин помогает усваивать углеводы в промежутке между завтраком и ужином, а также те, которые поступили в организм за обедом.
Вечерний «короткий» инсулин работает над усвоением углеводов, поступивших в организм во время ужина. «Длинный» инсулин обеспечивает нормальный уровень сахара в крови с вечера до утра. Существенным недостатком такого способа лечения являются два момента:
- принимать пищу человек должен всегда в одно и то же время (это важно для каждого приема пищи);
- каждый прием пищи должен содержать только определенное количество углеводов. Их подсчет ведется в ХЕ — хлебных единицах.
Если поесть раньше установленного времени или в продуктах будет содержаться превышающее норму количество ХЕ, это чревато возникновением гипергликемии. В случае более позднего приема пищи или недостаточного количества хлебных единиц, возможна гипогликемия. И тот, и другой вариант очень нежелателен. Чтобы достичь компенсации с применением традиционного метода, надо быть предельно дисциплинированным человеком.
Базис-болюсная, или интенсифицированная терапия
У здоровых людей уровень выработки инсулина в промежутках между едой и ночью относительно стабилен. Этот показатель является базальной, или базисной, секрецией инсулина. Такая секреция необходима для поддержания нормогликемии и обмена веществ в промежутках между едой и ночью.
А в период от начала поступления еды в организм и в течение следующих 20-40 минут синтезируется болюсный инсулин. Задача этого типа выработки инсулина — помочь клеткам усвоить поступающую в них глюкозу, и часть глюкозы под воздействием того же гормона превращается в гликоген. Гликоген, это резерв глюкозы, который откладывается в «энергетическом депо» — печени, мышцах (основное депо) и жировой ткани. Если продуцируется недостаточное количество инсулина для выполнения вверенных ему функций, излишки сахара остаются в крови. Чтобы этого избежать, человеку с сахарным диабетом вводят вечером и/или утром инсулин пролонгированного действия. Инсулин короткого или ультракороткого действия вводится на основные приемы пищи и дополнительно для коррекции уровня сахара в крови. Использование такой схемы инсулинотерапии позволяет корректировать дозу инсулина по уровню сахара в данный момент и вести более гибкий режим дня. Таким образом можно добиться лучшего контроля заболевания. Это позволяет максимально близко воспроизвести естественную работу поджелудочной железы. При такой схеме инсулинотерапии важно обучение больного коррекции доз инсулина.
Помповая инсулинотерапия
Особенностью этого типа лечения инсулином является использование специального электронного приспособления — инсулиновой помпы. Через катетер аппарат вводит подкожно ультракороткий или короткий инсулин. Помпа подает инсулин в двух режимах:
Автоматическая подача доз инсулина в течение суток называется базальной подачей. Непрерывная его подача замещает длинный инсулин. Возможность устанавливать в течение суток с интервалом 30 или 60 минут необходимую дозу препарата позволяет максимально имитировать физиологическую секрецию инсулина.
Болюсная подача инсулина осуществляется человеком путем нажатия определенных кнопок и ввода необходимой информации. Такая подача инсулина замещает инъекции инсулина на еду и коррекцию уровня сахара. Помпа позволяет вводить болюс в трех режимах:
- Стандартный / Нормальный — вся доза инсулина вводится сразу.
- Растянутый / Квадратный — вся доза инсулина подается равномерно в течение заданного времени.
- Несколько волн / Двойной — сочетание первых двух типов болюса. Часть дозы подается сразу, оставшаяся доза — в течение заданного времени.
Все настройки в помпе индивидуальны и настраиваются врачом.
Основные принципы инсулинотерапии

Основной принцип инсулинотерапии — персонифицированный подбор доз инсулина и обучение больного корректировать дозы инсулина с учетом таких факторов, как физическая нагрузка, сопутствующие заболевания, изменение режима дня и т.д.
Универсальной схемы распределения доз инсулина не существует. Главный критерий адекватности дозы инсулина — уровень сахара в крови. Правильно подобранная доза пролонгированного (базального) инсулина «удерживает» уровень сахара в крови ночью и в промежутках между едой. Адекватность дозы ультракороткого/короткого (болюсного) инсулина оценивается через 2-3 часа после приема пищи.
Как правило, на завтрак требуется больше инсулина, чем на обед и ужин. Помните, что это индивидуальный показатель, и обсудите это со своим лечащим врачом.
Показания к инсулинотерапии
Этот способ лечения по определенной схеме используется при:
- недостаточной выработке этого гормона поджелудочной железой,
- неэффективности используемых для снижения уровня сахара в крови пероральных препаратов;
- острые осложнения, вызванные гипергликемией (кетоацидоз, кома гиперлактацидемическая и гиперосмолярная)
Временное назначение лечения инсулином касается лиц, нуждающихся в большем количестве инсулина в определенный период, например, при гестационном сахарном диабете (диабете беременных).
Этот способ лечения по определенной схеме может использоваться при частых гипергликемиях. Также назначается терапия инсулином после полного или частичного удаления поджелудочной железы (в последнем случае, если серьезно пострадали β-клетки). Есть и еще ряд заболеваний и состояний, при которых доктор может назначить такую терапию.
Как подготовиться

Подготовительные мероприятия очень просты, они не занимают много времени. Перед началом необходимых манипуляций следует вымыть руки с мылом и тщательно вытереть их. В настоящее время большинство инсулинов производится в предварительно заполненных одноразовых шприц-ручках или картриджах для многоразовых шприц-ручек. Если же у вас препарат во флаконе, то верхнюю часть флакона с инсулином необходимо протереть смоченной в спирте салфеткой. После этого предпринимаются следующие действия:
- убедитесь в правильном выборе активности препарата;
- если вы используете микс-инсулины, то есть комбинацию инсулинов разной продолжительности действия, перемешайте их перед использованием;
- накрутите иглу на шприц-ручку;
- спустите 1-2 единицы инсулина, чтобы проверить проходимость иглы и работу шприц-ручки;
- наберите необходимую дозу инсулина.
Техника инъекции

Чтобы инъекция инсулина была сделана правильно, предлагается следующий алгоритм ее проведения:
- выбрать место для инъекции инсулина;
- снять с иглы наружный защитный колпачок;
- сформировать складку указательным и большим пальцем, если это требуется;
- ввести иглу подкожно под углом 90 или 45 градусов;
- нажимая на поршень шприц-ручки, ввести инсулин, не отпуская при этом кожную складку;
- после того как введен весь препарат, иглу вынимать надо не сразу, а по истечении 15-20 секунд;
- извлечь иглу и отпустить кожную складку;
- пользуясь наружным защитным колпачком иглы, отвернуть иглу и утилизировать ее;
- надеть колпачок на шприц-ручку.
Техника инъекции инсулина может изменяться в зависимости от используемой длины иглы, степени развития подкожно-жировой клетчатки. Проконсультируйтесь со своим лечащим доктором.
Перед инъекцией место ее проведения протирать спиртом не нужно. Растирать его после укола тоже не следует.
Правила
Существует ряд условий, необходимых к выполнениюпри лечении диабета инсулином. Одним из самых важных является правильный расчет количества препарата. Его вводят как раз столько, сколько нужно для утилизации глюкозы. Инсулинотерапия должна быть максимально приближена к физиологической секреции инсулина. Чтобы в точности выполнить эти требования, пациенту предлагается определенная схема введения лекарства.
Ее составление — прерогатива лечащего врача. Чаще всего суточная доза препарата делится следующим образом:
- короткий или ультракороткий (болюсный) инсулин вводится на приемы пищи и для коррекции гипергликемии;
- инъекция длинного препарата делается перед сном или 2 раза в день (утром и вечером).
Уколы делают специальными инсулиновыми шприцами с тонкой иглой. Но в последние годы более популярны шприц-ручки. Их преимущества:
- удобство использования;
- возможность делать инъекцию в любое время в любом месте;
- более удобный набор дозы.
Вводить препарат в места с аномалией жировой ткани — липодистрофией — нельзя. Расстояние между двумя инъекциями должно составлять не менее двух сантиметров. Для профилактики опасных осложнений сахарного диабета категорически не рекомендуется самостоятельно менять схему ввода инсулина или отменять лечение этим гормоном.
Противопоказания к инсулинотерапии
Противопоказанием для инсулинотерапии является гиперчувствительность к препарату.
Питание при инсулинотерапии

Для людей с сахарным диабетом, получающих инсулинотерапию, вне зависимости от типа диабета, очень важно учитывать следующие факторы:
- пища должна содержать ровно столько энергии, сколько необходимо человеку с диабетом для удовлетворения энергетических потребностей организма;
- в рационе необходимо поддерживать количественный баланс жиров, белков и углеводов;
- необходимо соблюдать соотношение введенной дозы инсулина и количества углеводов в приеме пищи (этот показатель является индивидуальным).
- капусты в свежем и квашеном виде;
- помидоров и огурцов;
- зеленого горошка;
- шпината и салата.

Важную роль в лечении играет соблюдение диеты и постоянный контроль содержания глюкозы в крови. Для этого используют глюкометры. Современные аппараты:
Простое тестирование шаг за шагом
Если у Вас сахарный диабет чаще проводите самоконтроль! Это поможет достичь целевых уровней глюкозы крови, поддержать хорошее самочувствие и снизить риск развития осложнений.
© ООО "ЛайфСкан Раша", 2021. GL-OTB-2100002. 121614 г. Москва, ул. Крылатская, д. 17, корп. 4, эт. 2, пом I, ком. 2
Инсулинотерапия при сахарном диабете
Инсулинотерапия. Новые реалии
Ежегодная смертность от диабета в мире превышает суммарную летальность от ВИЧ, туберкулеза и малярии. Несмотря на огромные усилия в достижении и поддержании оптимального контроля гликемии, войну против диабета 2‑го типа мы пока проигрываем. Такое мнение высказал профессор А.С. Аметов на пленарном заседании «Инсулинотерапия: новые реалии 2020». В ходе мероприятия эксперты обсудили возможности оптимизации терапии с помощью базальных аналогов инсулина и комбинированных инъекционных препаратов.
Война, которую можно выиграть
Заведующий кафедрой эндокринологии и диабетологии РМАНПО Минздрава России, профессор, д.м.н. А.С. Аметов отметил: ежегодно в мире от диабета умирают пять миллионов человек. Суммарно это больше, чем от инфекционных заболеваний: от ВИЧ и туберкулеза погибают по 1,5 млн человек, от малярии – 0,6 млн.
«Мы научились снижать сахар, гликированный гемоглобин, но проигрываем войну против диабета 2‑го типа», – подчеркнул профессор.
СД 2‑го типа развивается медленно и незаметно, происходят метаболические нарушения, включая прогрессирующее снижение массы функционирующих бета‑клеток. Падает секреция инсулина, бета‑клетки теряют чувствительность, вслед за этим нарушается толерантность к глюкозе и развивается диабет.
Очень важно сразу после постановки диагноза приступить не только к контролю, но и к управлению гликемией. При СД 2‑го типа внимание сфокусировано на двух ключевых моментах регулирования гомеостаза глюкозы: адекватной секреции инсулина бета‑клетками и способности периферических тканей реагировать на инсулин.
«Управляя гликемией, как далеко нужно зайти в снижении гликированного гемоглобина? Какое лечение следует назначить пациенту после метформина при уровне гликированного гемоглобина 8% и выше? – задал вопрос профессор А.С. Аметов, на который сразу же и ответил. – Если целью является снижение уровня гликированного гемоглобина, можно использовать все существующие классы сахароснижающих препаратов, но при выборе схемы терапии нужно практиковать персонифицированный подход, учитывая особенности течения диабета у конкретного пациента».
Необходимость индивидуального подхода к терапии пациента с СД2 профессор А.С. Аметов проиллюстрировал на примере четырех клинических случаев, где уровень гликированного гемоглобина у пациентов был схожим – 7,7%, а суточная вариабельность гликемии при этом сильно отличалась. «Разве пациенты нуждаются в одинаковой терапии? Нет. Это четыре разных случая», – отметил он.
Основной «игрок» в обеспечении гомеостаза глюкозы
Главный «игрок» в обеспечении гомеостаза глюкозы – инсулин. Гормон запускает экспрессию более 100 различных генов, а потому его значение не следует трактовать примитивно, подчеркнул профессор А.С. Аметов.
«Инсулинотерапия при сахарном диабете второго типа – это преодоление инсулинорезистентности на уровне печени, почек и других тканей, а не вариант заместительной гормональной терапии, – отметил профессор. – О заместительной терапии мы ведем речь только на поздних этапах сахарного диабета 2‑го типа».
Целью назначения базального инсулина пациентам с СД2 является обеспечение постоянного уровня инсулина между приемами пищи, что сводит к минимуму риск гипогликемии, особенно в ночное время. При этом доза базального инсулина подбирается исходя из уровня гликемии натощак, а не показателя гликированного гемоглобина, уточнил докладчик.
Идеальный базис для рациональных комбинаций
Профессор Аметов, ссылаясь на результаты исследования по изучению распределения концентрации инсулина и динамики глюкозы на флюктуацию в течение суток под авторством проф. Becker R.H., где в качестве базального инсулина пациентам вводился гларгин‑300, определил главное преимущество применения базального инсулина при СД2.
«На примере инсулина гларгин‑300 было продемонстрировано равномерное распределение глюкозоснижающего эффекта в течение суток. Фактически не было условий для гипо- или гипергликемии», – рассказал он.
Говоря о кардиобезопасности, которая также изучалась в рамках исследования, докладчик отметил улучшение эндотелиальной функции при сахарном диабете 2‑го типа на фоне терапии инсулином гларгин‑300. При этом раннее добавление базального инсулина в схемы лечения СД2 при наблюдении за пациентами в течение шести лет выявило нейтральное действие в отношении сердечно‑сосудистой системы, оно не ускоряет, а возможно даже замедляет прогрессирование атеросклероза.
«Базальный инсулин – идеальный фундамент для любых рациональных комбинаций с сахароснижающими препаратами. Мы получаем хороший метаболический контроль», – заключил профессор.
От исследований к реальной клинической практике
Потребность в инсулине при СД2 продиктована разными клиническими ситуациями, отметила заведующая кафедрой эндокринологии РНИМУ им. Н.И. Пирогова, профессор, д.м.н. Т.Ю. Демидова. Это может быть и генетически детерминированный диабет, и ситуация, когда потребность в интенсификации терапии связана с плохим гликемическим контролем или снижением секреторного потенциала бета‑клеток.
«Сегодня мы ищем возможные способы модификации механизмов, лежащих в основе диабета второго типа. Контроль гликемии – единственный предиктор благоприятного или неблагоприятного метаболического, кардиоваскулярного и почечного прогноза. Хороший контроль улучшает отдаленные результаты», – уточнила докладчик. Раннее достижение целевых значений гликемии является залогом эффективного управления диабетом.
Россия была включена в программу IDMPS 8, где оценивали уровень контроля гликемии пациентов, проживающих в разных странах. В среднем доля пациентов, принявших участие в программе, которые достигли индивидуального целевого значения гликированного гемоглобина, находилась на уровне 49,8%.
По данным динамического мониторинга HbA1c, в семи регионах России его показатели приближались к 9%. Это как раз та ситуация, когда необходимо инициировать переход на инсулинотерапию, прокомментировала результаты исследования профессор Демидова.
Рациональные комбинации и «уходящие» лекарства
Говоря о схемах комбинированной терапии при СД2, Т.Ю. Демидова рассказала о результатах метаанализа Morten Hasselstrom, в ходе которого оценивались риски сердечно‑сосудистых событий, тяжелой гипогликемии и смертности от всех причин при использовании нескольких комбинаций пероральных и инъекционных сахароснижающих препаратов.
Оказалось, что комбинация базального инсулина и агонистов рецептора ГПП‑1 (арГПП‑1) во многом превосходит варианты сочетания пероральных сахароснижающих лекарственных средств. Возможной причиной Т.Ю. Демидова назвала модификацию патогенетических механизмов при применении комбинации инсулина и арГПП‑1.
Кстати, тот же метаанализ заставил профессиональное сообщество еще раз задуматься о роли препаратов сульфанилмочевины в терапии пациентов с СД2. Как отметила профессор Демидова, они должны уходить из практики.
«Эти препараты блестяще служили предшествующие десятилетия, сегодня мы должны отставить их в сторону – они не дают никаких преимуществ, кроме снижения глюкозы крови», – подчеркнула она.
Не ждать, а начинать…
Исследование профессора J. Rosenstock, в ходе которого анализировались данные реальной клинической практики и сравнивалась эффективность одновременной или последовательной стартовой терапии базальным инсулином и арГПП‑1, отчасти дает ответ на вопрос, какова же оптимальная схема стартовой терапии сахарного диабета 2‑го типа, пояснила профессор Т.Ю. Демидова. Пациенты с HbA1c выше 9% были включены в программу интенсификации терапии. При одновременном введении комбинации базального инсулина и арГПП‑1 в качестве стартовой терапии пациенты получили самые значимые преимущества по сравнению с группами, где инъекционные препараты вводились последовательно: 45,3% достигли уровня гликированного гемоглобина менее 7% к шестому месяцу терапии (рис. 1).
«Не ждать, а начинать раньше. Не надо думать: чем позже, тем лучше сработает», – именно таким правилом, по мнению Т.Ю. Демидовой, должен руководствоваться врач, выбирая схему комбинированной терапии для пациента с высокими показателями гликированного гемоглобина.
Инсулинотерапия
По своему химическому строению инсулин представляет собой белок, который вырабатывается в бета- клетках поджелудочной железы и выделяется в кровь. Инсулин является основным регулятором углеводного обмена в организме человека. У пациентов с сахарным диабетом имеет место снижение выработки этого гормона или полное ее отсутствие. Единственным способом лечения таких пациентов является введение инсулина извне. До того как инсулин был впервые выделен из поджелудочной железы животных и начал использоваться в терапии сахарного диабета многие пациенты умирали от смертельных осложнений этого заболевания, таких как диабетическая кома. Первые препараты инсулина получали из поджелудочных желез свиней и крупного рогатого скота. В последние годы в основном используют препараты человеческого инсулина , которые получают генно-инженерным путем. Преимуществом человеческого инсулина является то, что организм не воспринимает его как чужеродное вещество.
Инсулин обладает несколькими свойствами, которые определяют принципы инсулинотерапии. Во-первых, при приеме через рот инсулин разрушается в кишечнике, проще говоря переваривается. Поэтому, основной способ введения инсулина – подкожные инъекции. Второй особенностью инсулина является наличие суточных колебаний его концентрации в крови человека. Существует постоянный, базальный уровень инсулина и пики концентрации связанные с повышением глюкозы в крови после приема пищи. При терапии инсулином необходимо не только обеспечить этот базальный уровень, но и имитировать физиологические пики концентрации с помощью дополнительных введений инсулина перед едой.
Терапию инсулином начинают после тщательного обследования и постановки диагноза. Грамотное лечение возможно только при скрупулезном выполнении назначений врача. Лечение требует активного участия пациента. Поэтому, перед началом лечения следует разобраться во всех тонкостях подбора доз инсулина, обучиться методам самоконтроля и инсулинотерапии. Задавайте врачу как можно больше вопросов. Чем лучше вы разберетесь в своем заболевании, тем грамотнее и эффективнее будет ваше лечение.
Классификация инсулинов и лекарственные формы
По длительности действия различают инсулины ультракороткого, короткого и продленного (пролонгированного) действия . Различия заключаются во времени начала действия, пике активности и продолжительности действия.
Схема терапии может включать одну или две инъекции инсулина продленного действия и три-четыре инъекции короткодействующего инсулина перед приемами пищи. Дозы инсулина подбираются индивидуально в зависимости от уровня сахара в крови и объемов принимаемой пищи (рассчитывают количества хлебных единиц в порции).
Для удобства применения выпускают смешанные инсулины , в которых содержится инсулин короткого и продленного действия. Причем выпускаются такие инсулины с различным соотношением «короткой» и «длинной» частей: от 10/90% до 50/50%.
В России существуют препараты с различной концентрацией инсулина в растворе: 40 Ед в 1 мл препарата и 100 Ед в 1 мл препарата. Когда вы покупаете инсулин не забывайте обращать на это внимание, использование препарата с другой концентрацией в той же дозе может привести к передозировке или наоборот – к отсутствию эффекта.
Инсулин выпускается в различных лекарственных формах: флаконы с раствором, шприц-ручки с раствором, инсулиновые помны. Принципиальных различий в результатах лечения между инсулиновой помпой и режимом введения инсулина много раз в день с помощью шприцов или шприц-ручек нет. Решение о выборе препарата принимает врач совместно с пациентом.
Инсулин вводят подкожно. Для инъекций используются несколько областей: передняя поверхность живота, передне-наружная поверхность бедер, наружная поверхность плеч, ягодицы. Следует помнить, что инсулин из различных областей всасывается с разной скоростью. Например, быстрее всего из области живота. Места введения инсулина следует менять, однако смена мест инъекций должна быть одинаковой каждый день, в противном случае это может привести к колебаниям уровня сахара крови.
Эффективная инсулинотерапия основана не только на грамотном расчете доз инсулина и аккуратном введении препарата. Залогом успешного лечения являются методы самоконтроля. Для обучения больных основам лечения и самоконтроля существуют специальные школы диабета. По всем вопросам, которые возникают у вас в ходе лечения, обращайтесь к лечащему врачу.
Инсулинотерапия при сахарном диабете
ФГБУ "Эндокринологический научный центр" Минздравсоцразвития, Москва
Значение и преимущества своевременного назначения инсулина пациентам с сахарным диабетом 2-го типа
ФГБУ "Эндокринологический научный центр" Минздравсоцразвития, Москва
Своевременное начало инсулинотерапии при сахарном диабете 2-го типа (СД2) обеспечивает лучший гликемический контроль, снижает отрицательные последствия хронической глюкозотоксичности и липотоксичности. Достижение и поддержание стойкой компенсации заболевания являются главными условиями профилактики хронических осложнений СД. Согласно рекомендациям ADA, инсулинотерапию следует применять в начале заболевания, если это обусловлено клинической ситуацией, или присоединяя к терапии пероральными сахарснижающими препаратами (ПССП), когда не достигнуты целевые значения HbA1c, несмотря на применение одного таблетированного препарата или более.
ФГБУ "Эндокринологический научный центр" Минздравсоцразвития, Москва
Сахарный диабет 2-го типа (СД2) является прогрессирующим заболеванием, которое характеризуется постепенным ухудшением функции β-клеток и уменьшением их количества [1]. Регуляция гомеостаза глюкозы зависит от механизма обратной связи в системе печень — периферические ткани — β-клетки поджелудочной железы. В норме β-клетки быстро адаптируются к снижению чувствительности к инсулину на уровне печени или периферических тканей, повышая секрецию инсулина и предотвращая развитие гипергликемии натощак. При СД2 гипергликемия натощак развивается в случаях недостаточной выработки и секреции инсулина, необходимого для преодоления инсулинорезистентности [2].
У пациентов с СД2 поддержание гликемического контроля имеет большое значение для снижения сопутствующего риска поздних осложнений заболевания. Кроме постпрандиальной гликемии (ППГ), уровень глюкозы плазмы натощак (ГПН) также является важным фактором, влияющим на уровни гипергликемии и HbA1с. Уровень гликемии перед завтраком является наиболее стабильным показателем, не зависящим от последующих приемов пищи или физической активности. В нормальных физиологических условиях уровень ГПН определяется продукцией глюкозы клетками печени и контролируется выработкой инсулина [3]. У пациентов с СД2, когда секреция инсулина снижена относительно имеющегося уровня гликемии, необходима соответствующая терапия, которая должна интенсифицироваться по мере прогрессирования заболевания.
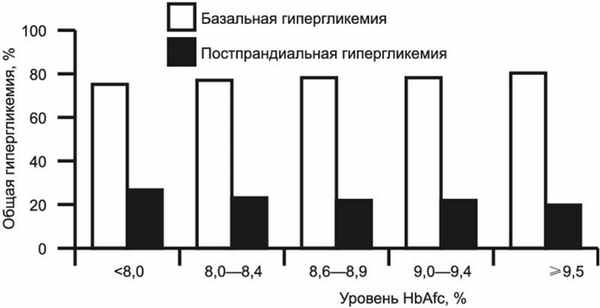
Данные исследования UKPDS [4] показали, что поддержание целевого уровня ГПН может снизить уровень HbA1с и риск развития поздних осложнений диабета, таких как ретинопатия и нефропатия. Недавний метаанализ [5] показал, что ГПН является основным компонентом общей гликемии у пациентов с СД2, не компенсируемых на терапии пероральными сахароснижающими препаратами (ПССП). Добавление базального инсулина к терапии ПССП снижает уровень HbA1с и вклад базальной гликемии, повышая роль постпрандиальной гликемии независимо от уровня HbA1с [5] (рис. 1). Рисунок 1. Вклад ГПН и ППГ в общий уровень гипергликемии у пациентов с СД2.
У многих больных невозможно достичь целевых значений НbА1с, применяя только ПССП. Согласно рекомендациям ADA/EASD, а также российским стандартам специализированной медицинской помощи больным СД, для снижения риска микрососудистых и макрососудистых осложнений целевой уровень HbA1с не должен превышать 7% [6, 7].
Однако для ряда пациентов (впервые выявленный СД, молодой возраст, отсутствие макрососудистых осложнений) уровень HbA1с может быть установлен ниже рекомендуемых значений. Ранний гликемический контроль имеет особое значение для этих пациентов, так как предотвращает развитие осложнений СД [8]. Напротив, у пациентов с небольшой ожидаемой продолжительностью жизни, длительной декомпенсацией и выраженными сердечно-сосудистыми осложнениями с целью снижения риска гипогликемий может применяться менее строгий гликемический контроль.
Начало инсулинотерапии является важным этапом в терапии СД2. Своевременное начало инсулинотерапии обеспечивает лучший гликемический контроль, снижает отрицательные последствия хронической глюкозотоксичности и липотоксичности, уменьшает нагрузку на секреторную функцию β-клеток, увеличивает продолжительность эндогенной секреции инсулина. Вопрос о сроках начала инсулинотерапии при СД2 остается крайне сложным. Его следует решать индивидуально, анализируя показания, противопоказания и цели терапии. Достижение и поддержка стойкой компенсации заболевания является главным условием профилактики и своевременного лечения хронических осложнений СД. У пациентов с длительным течением заболевания часто развивается вторичная резистентность к ПССП, которая является следствием снижения массы β-клеток и/или увеличении инсулинорезистентности. В дебюте СД2 инсулин требуется 2—3% больных, а через 10—15 лет от начала заболевания у половины пациентов предшествующее лечение ПССП становится неэффективным и появляются показания к инсулинотерапии.
Ежегодно инсулинотерапию назначают 5—10% больным СД2 [9, 10]. В то же время около 30—40% пациентов для постоянного контроля гликемии нуждаются в долгосрочной инсулинотерапии, однако ее часто не назначают в связи с определенными опасениями как со стороны пациентов, так и врачей. Раннее назначение инсулина при наличии показаний очень важно с точки зрения снижения частоты микрососудистых осложнений СД, включая ретинопатию, нейропатию и нефропатию.
Показаниями для назначения инсулина при СД2 являются: временное повышение потребности в инсулине, резкое снижение инсулиновой секреции, случаи резистентности гипергликемии к другим формам терапии. Инсулинотерапия при СД2 может быть временной и пожизненной. Временная инсулинотерапия показана при необходимости хирургического вмешательства, острых инфекциях, инсульте, инфаркте миокарда, беременности и лактации. Пожизненную инсулинотерапию назначают при вторичной резистентности к ПССП. Побочными эффектами инсулинотерапии при СД2 является: прибавка массы тела, частое чувство голода, задержка жидкости и натрия, риск гипогликемий.
Существуют разные режимы инсулинотерапии: инсулин пролонгированного действия перед сном в сочетании с диетотерапией или дневным приемом таблетированных препаратов; двукратное введение инсулина короткого и пролонгированного действия перед завтраком и ужином; комбинированная терапия таблетированными препаратами и инсулином; интенсивная инсулинотерапия в базис-болюсном режиме.
Исследования с участием пациентов с СД2 показали преимущества раннего назначения инсулина гларгин. Так, в исследовании INSIGHT было показано, что у больных СД2, не получавших ранее сахарснижающие средства или принимавших 1—2 ПССП в субмаксимальных дозах, назначение инсулина гларгин и самостоятельное изменение его дозы с использованием простого алгоритма безопасно и позволяет чаще добиться физиологического контроля гликемии, чем стандартный подход, предполагающий увеличение дозы ПССП или присоединения новых таблетированных препаратов [11].

Преимущества раннего применения инсулина гларгин по сравнению с модификацией образа жизни были продемонстрированы также в 9-месячном международном исследовании TULIP [12], в котором приняли участие 211 пациентов с неконтролируемым СД2 (средний уровень HbA1с 7,6%) и ИМТ 24—35 кг/м 2 , получавшие максимальные дозы метформина и препаратов сульфонилмочевины в течение 2 лет и более. В группе инсулина гларгин значительно большее количество больных достигли целевого уровня HbA1с (<7%), чем в группе модификации образа жизни (66 и 38% соответственно; p<0,0001). В исследовании LAPTOP проведено сравнение раннего назначения инсулина гларгин и комбинированных инсулинов (70/30) у больных СД2 и неэффективности терапии ПССП (ГПН >6,7 ммоль/л, HbA1с 7,5—10,5%) [13]. Анализ данных, полученных через 24 нед, показал большую эффективность инсулина гларгин в достижении уровня HbA1с ≤7,0% и ГПН ≤5,6 ммоль/л при меньшем количестве эпизодов гипогликемии (рис. 2). Рисунок 2. Количество гипогликемий при терапии инсулином гларгин и комбинированном инсулине.
Многие публикации свидетельствуют об улучшении показателей углеводного обмена и снижении частоты ночных гипогликемий при однократном применении инсулина гларгин перед сном у больных с СД2 в сравнении с инсулином НПХ [14—16]. Во всех исследованиях продемонстрировано значимое снижение утренней гликемии натощак. В отношении уровня HbA1с в одних исследованиях получен эффект, сопоставимый с таковым при применении НПХ, а в других — отмечено достоверное снижение этого уровня при применении гларгина. Кроме того, при переводе на инсулин гларгин отмечалось значимое снижение клинически значимых в первую очередь ночных гипогликемий. В исследовании Н. Yki-Jarvinen и соавт. [17], в которое были включены 426 больных СД2 с неэффективностью терапии ПССП, лечение инсулином гларгин в течение 1 года приводило к сопоставимому с терапией HПХ снижению уровня HbA1с и улучшало показатели гликемии в вечернее время (р<0,01). В группе терапии инсулином гларгин реже встречались эпизоды гипогликемии, особенно в ночное время.
В исследовании The Treat-to-Target [15] не только сравнивали эффекты терапии инсулином гларгин и HПХ, но и был выработан алгоритм несложного и безопасного применения инсулина у больных СД2. Целью лечения 764 пациентов с неэффективностью терапии ПССП (HbA1с 8,6±0,9%) являлось достижение гликемии натощак ≤5,6 ммоль/л и уровня HbA1с 1с в группе терапии инсулином гларгин достигли 58% пациентов, а в группе терапии HПХ — 57,3% (эти различия оказались несущественными). Однако эффективность терапии, определенная как достижение целевых значений HbA1с без эпизодов ночной гипогликемии, была достигнута у большего числа больных в группе терапии инсулином гларгин (33,2% против 26,7%; р<0,05). Достижение целевых значений ГПН без гипогликемий также наблюдалось у большего числа больных группы гларгина (22,1% больных достигли ГПН <5,6 ммоль/л и 33,2%; p<6,7 ммоль/л, тогда как в группе HПХ — 15,9 и 25,7% соответственно; p<0,03).
Неоспоримым преимуществом инсулина гларгин перед инсулином НПХ является лучший суточный профиль действия, позволяющий достигать улучшения уровней глюкозы натощак и HbA1с с меньшим риском гипогликемий, в том числе в ночное время. Такие результаты были получены в исследовании ATLANTUS [18], в котором приняли участие около 5000 больных СД2. Исследование, проведенное на базе более тысячи исследовательских центров 59 стран, подтвердило уникальный 24-часовой профиль действия гларгина, позволяющий проводить интенсивную титрацию дозы при низком риске развития тяжелых гипогликемий. Исследование включало много различных групп пациентов с длительностью СД2 более 12 лет, и во всех этих группах терапия гларгином продемонстрировала существенные преимущества по сравнению с ранее проводимой терапией.

С января 2008 г. по июль 2009 г. проводилась наблюдательная программа LAURUS (Lantus Utilisation in Russia) по применению инсулина гларгин у пациентов с СД2 в повседневной клинической практике в Российской Федерации. Программа продемонстрировала улучшение контроля гликемии при переводе пациентов с СД2 с инсулина НПХ на инсулин гларгин (снижение показателей HbA1с и ГПН) при меньшем числе и меньшей выраженности гипогликемических эпизодов. В группе инсулина гларгин значительно большее число больных достигло целевых значений HbA1с ( <7%) после 3 мес плановой терапии (рис. 3). Рисунок 3. Доля пациентов с СД2, достигших целевых значений HbA1с. Наряду с улучшением показателей утренней гликемии и HbA1с, доза инсулина гларгин значимо не менялась на протяжении периода наблюдения [19]. Это показывает, что улучшение углеводного обмена связано с меньшей вариабельностью гликемии в течение суток при применении инсулина гларгин в сравнении с инсулином НПХ. В повседневной практике (в отличие от клинических исследований) врачами и пациентами недостаточно используется возможность титрации дозы инсулина гларгин, который при своевременном назначении и интенсификации терапии позволяет достигать целевых значений углеводного обмена с минимальным риском гипогликемий.
В ряде контролируемых исследований, а также по данным долгосрочных регистров, показано, что длительная терапия инсулином гларгин у больных СД2 не сопровождается отрицательным влиянием на массу тела [20, 21]. В работе S. Schreiber и соавт. [22] наблюдалась тенденция к уменьшению ИМТ больных: исходно 29,0±4,7 кг/м 2 ; через 3 мес — 28,7±4,5 кг/м 2 ; через 9 мес — 28,5±4,8 кг/м 2 [22]. Продление наблюдения до 32 мес показало, что при продолжении лечения ИМТ не менялся.
К настоящему времени накопилось много данных, предполагающих влияние нормогликемии, достигнутой на фоне инсулинотерапии, на снижение сердечно-сосудистого риска (ССР). В то же время результатов клинических исследований, подтверждающих эту гипотезу, у больных с нарушенной гликемией натощак (НГТ), нарушением толерантности к глюкозе (НТГ) или СД2 небольшой продолжительности практически нет. Завершенное недавно исследование ORIGIN (Outcome Reduction with an Initial Glargine Intervention) было направлено на изучение влияния раннего назначения инсулинотерапии инсулином гларгин на сердечно-сосудистые события у больных с повышенным уровнем ГПН, НТГ или СД2 небольшой продолжительности. В исследование было включено 12 537 пациентов (81,9% имели СД2, 6,3% — впервые выявленный СД, 11,5% — НГТ или НТГ; средняя ГПН составила 7,3 ммоль/л) с повышенным риском кардиоваскулярных событий (не менее одного фактора риска к началу исследования: микроальбуминурия, гипертрофия миокарда левого желудочка, инфаркт миокарда в анамнезе). Целью исследования являлось получение данных об эффекте инсулина гларгин относительно уменьшения ССР. Первичными конечными точками являлись: нелетальный инфаркт миокарда, инсульт или смерть от сердечно-сосудистых причин, дополнительными — случаи реваскуляризации любой локализации (коронарной, каротидной, периферических артерий) и госпитализации, связанные с сердечной недостаточностью при безопасном достижении нормогликемии натощак (≤ 5,3 ммоль/л) как у больных с диабетом, так и у лиц с предиабетом. Вторичными конечными точками являлось определение возможности уменьшения общей смертности, частоты диабетических микрососудистых осложнений (ретинопатия, нефропатия), а также замедления темпа прогрессирования НГТ и НТГ в СД2. Также принимались во внимание случаи возникновения онкологических заболеваний, динамика веса [23]. Пациенты в зависимости от лечения были рандомизированы на две группы: одна группа получала инсулин гларгин, другая — стандартную терапию (определяемую исследователем). Средняя продолжительность периода лечения составила 6,2 года. Результаты исследования показали, что частота сердечно-сосудистых событий достоверно не отличалась между группами: 2,94 и 2,85 на 100 человеко-лет соответственно, для основных первичных конечных точек (риск развития события, 1,02; 95% доверительный интервал [ДИ]= 0,94—1,11; р=0,63) и 5,52 и 5,28 на 100 человеко-лет соответственно, для дополнительных первичных конечных точек (риск развития события, 1,04; 95% ДИ=0,97—1,11; р=0,27).
Спустя 3 мес после завершения терапии новые случаи СД были выявлены у 30% больных в группе терапии гларгином и 35% — в группе стандартного лечения среди 1456 пациентов без СД в начале исследования (отношение шансов, 0,80; 95% ДИ=0,64—1,00; р=0,05).
Среднее увеличение веса в группе терапии гларгином составило 1,6 кг (-2,0—5,5), в то время как в группе стандартной терапии вес снизился в среднем на 0,5 кг ( -4,3—3,2).
За время исследования не выявлено достоверной разницы между двумя группами в отношении онкологических заболеваний (отношение рисков, 1,00; 95% ДИ=0,88—1,13; р=0,97); общей смертности (отношение рисков, 0,98; 95% ДИ=0,90—1,08; р=0,70), а также микрососудистых осложнений (отношение рисков, 0,97; 95% ДИ=0,90—1,05; р=0,43).
Таким образом, в исследовании ORIGIN показано отсутствие влияния раннего назначении инсулина в терапии СД2 на увеличение или снижение риска возникновения сердечно-сосудистых событий и онкологических заболеваний в сравнении со стандартными схемами лечения. Также показано снижение прогрессирования НГТ и НТГ в СД2 у больных, получавших гларгин.
Также убедительно показана возможность достижения почти нормальных уровней ГПН и HbA1с и поддержания этих параметров в течение 6 лет при применении однократной инъекции инсулина продленного действия как в монотерапии, так и в комбинации с ПССП, при самоконтроле ГПН и ее использовании для коррекции дозы инсулина [24].
В заключение необходимо подчеркнуть, что начало инсулинотерапии является важным этапом в терапии больных СД2. Согласно рекомендациям ADA [25], инсулинотерапию следует применять в начале заболевания, если это обусловлено клинической ситуацией, или присоединяя к терапии ПССП, когда не достигнуты целевые значения HbA1с, несмотря на применение одного или более таблетированных препаратов. Как врач, так и пациент должны внимательно анализировать возможные психологические препятствия, связанные с назначением инсулина и тесно сотрудничать для выработки оптимальной схемы терапии, которая позволит достичь индивидуально определенных целей лечения.
Читайте также:
