Использование анионного интервала
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Температурная коррекция Рн и показателей газового состава крови
Измерение газового состава крови и рН производится при температуре 37 °С, то есть при нормальной температуре тела. Если температура тела больного изменена, то значения этих показателей inpivo будут отличаться от измеренных и эти неверные данные будут фигурировать в анализах, полученных из лаборатории. Необходимость внесения соответствующих поправок на температуру вызывает споры. Нормальные значения показателей для условий нормотермии хорошо известны, однако подобные ориентиры для гипотермии и гипертермии отсутствуют. Изменения кислотно-основного баланса при снижении или повышении температуры могут носить гомео-статический характер. Лечение расстройств кислотно-основного равновесия надо проводить, ориентируясь на некорригированные показатели, измеренные при 37 "С. Температурная коррекция газов крови и рН полезна при отслеживании динамики этих величин при изменениях температуры тела. Температурную коррекцию можно также использовать при сравнении содержания газов в крови и выдыхаемом газе (например, при измерении парциального давления двуокиси углерода в конце выдоха).
Анионный и осмоляльный интервалы
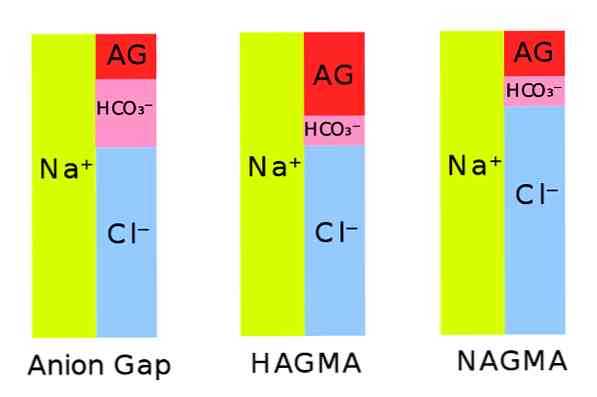
Знание величины анионного интернала (анионный провал, anion gap, AG) позволяет установить причину метаболического ацидоза. Метаболический ацидоз может сочетаться с нормальной величиной AG (гилерхлоремический ацидоз) или с увеличенным AG (нормохлоремнческий ацидоз). Анионный интервал вычисляют по формуле:
Осмоляльный интервал — это разница между измеренной осмоляльностыо плазмы и осмоляльностью, вычисленной по формуле:
осм = 2(Na + J+ [глюкоза]/18 - [BUN]/2,8 + [этанол]/4,6,
где осм — осмоляльность, a BUN — концентрация азота мочевины в крови. Если измеренная осмоляльность превышает вычисленную более чем на 10, то, следовательно, в крови присутствуют осмотически активные неучтенные частицы, метаболитами которых могут быть органические кислоты. Метаболический ацидоз в сочетании с увеличенным осмоляльным интервалом характерен для отравлений метанолом и этиленгликолем.
Разница в концентрации сильных ионов
Расчет разницы концентрации сильных ионов (strong ion difference, SID) — это год оценки кислотно-основных нарушений, базирующийся на подходе Стюарта симии кислотно-основного равновесия. Данный подход подразумевает, что пере-ш, влияющими на рН, являются только напряжение двуокиси углеродность концентраций сильных ионов и концентрация неопределяемых сильных ионов.
SID вычисляют по формуле:
SID = [Na + +K + ] - [СГ]. Есть и другой способ вычисления SID:
SID = [нСО~] + 0,28 х альбумин (г/л)+неорганический фосфат (ммоль/л).
В норме величина SID равна 40 ммоль/л. Классификация первичных нарушений кислотно-основного баланса, построенная на представлениях о SID, приведена
в табл. 24-5. Метаболический ацидоз сочетается с уменьшением SID, а метаболический алкалоз сочетается с увеличением SID.
Значения анионных щелей, применение и болезни
анионный зазор или анионный промежуток известен как различие, которое существует между положительным зарядом (катион) и отрицательным зарядом (анион), измеренным в жидкостях организма. Термин анионный разрыв используется в большинстве случаев для измерения или анализа сыворотки крови (плазмы крови без фибриногена). Также возможно сделать измерения этих ионов в моче.
Дифференциация между анионами и катионами происходит благодаря концентрации натрия, хлора и бикарбоната (в форме СО2 всего или HCO3) которые существуют в жидкостях организма (в основном в плазме крови).
Он используется для клинических диагнозов, в основном для диагностики измененных психических состояний, метаболического ацидоза, почечной недостаточности и других патологий..
- 1 Основной принцип
- 2 значения
- 2.1 Низкий
- 2.2 Нормальный
- 2.3 Высокий
- 2.4 Среднее
- 3.1 Низкий анионный зазор
- 3.2 Высокий анионный зазор
- 4.1 Вызвано низким анионным зазором
- 4.2 Вызвано высоким анионным зазором
Основной принцип
Основной принцип анионной щели заключается в том, что плазма (в основном используемая) электрически нейтральна. Результат, который мы ищем, заключается в измерении уровней кислотности в используемой жидкости организма (либо в плазме, либо в моче)..
Принцип электрической нейтральности жидкости гласит, что результирующая разница между измеренными катионами и анионами (измеренные катионы - измеренные анионы) равна результирующей разнице между неизмеренными катионами и анионами (неизмеренные катионы - неизмеренные анионы), и это в свою очередь равно щелевой контакт или анионный зазор.
Наиболее часто используемым катионом для измерений является натрий (Na + ), в то время как анионы, используемые для измерения, представляют собой хлорид (Cl - ) и бикарбонат (HCO)3 - ).
Что касается неизмеренных анионов, то это сывороточные (сыворотка), фосфатные (РО) белки4 3- ), сульфат (SO)4 2- ) и органические анионы.
И неизмеренными катионами мог быть магний (Mg + ) или кальций (Ca + ). Будучи формулой для расчета анионной щели или анионной щели: Анионная щель = Na + -(Cl - +HCO3 - ).
ценности
Нормальные значения анионного разрыва исторически менялись. Это связано с методами, используемыми для обнаружения ионов. Ранее для выполнения измерений использовались колориметры или фотометрия, и это давало значения от 8 до 16 ммоль / л (ммоль / л) и от 10 до 20 ммоль / л как нормальные значения..
В настоящее время используются специальные ионные электроды. Это датчики, которые переводят активность определенного иона, растворенного в растворе, в электрический потенциал..
Указанный электрический потенциал измеряется ph-метром для определения кислотности, поэтому значения согласно текущей классификации:
низкий
Анионный зазор, рассчитанный как низкий, ниже 3 ммоль / л.
нормальный
Нормальные значения - это те, которые выше 3 ммоль / л, но ниже 11 ммоль / л..
высокая
Большой анионный зазор возникает, когда расчетное значение превышает 11 ммоль / л..
средний
Некоторые авторы согласны с тем, что предполагаемое среднее значение составляет 6 ммоль / л..
Полученные результаты, однако, могут варьироваться в зависимости от используемого оборудования. В связи с этим, медицинское сообщество не всегда соглашается с использованием стандартного значения для интерпретации этих расчетов.
Для решения этой проблемы каждая лаборатория имеет или должна иметь свои собственные контрольные интервалы.
приложений
Применение тестов на анионный разрыв является практически клиническим. Он заключается в оценке кислотно-щелочных изменений, особенно в выявлении метаболических нарушений, которые приводят к повышению кислотности плазмы крови..
В этих тестах делается попытка определить значения для химических веществ, загруженных положительно или отрицательно, и в зависимости от расчета анионной щели это будет способствовать установлению соответствующих медицинских диагнозов..
Низкий анионный зазор
Увеличение концентрации неизмеренных катионов или уменьшение неизмеренных анионов считается малой анионной щелью.
Патологий, связанных с низким значением анионной щели, несколько, но физиологические причины, приводящие к этому значению, очень сложны..
Например, люди, страдающие миеломным IgG (тип рака, вызываемого злокачественными плазматическими клетками), вырабатывают большое количество парапротеинов.
Увеличение выработки этих молекул приводит к низким значениям анионной щели у этих пациентов.
Высокий анионный зазор
Гипотетически, высокий анионный разрыв может возникнуть из-за уменьшения неизмеренных катионов или увеличения неизмеренных анионов.
Тем не менее, клинический опыт показывает, что обычно увеличение анионной щели происходит из-за увеличения неизмеренных анионов. Клиническим примером этого является метаболический ацидоз.
болезни
Вызвано низким анионным зазором
Заболевание, чаще всего связанное с низким анионным разрывом, представляет собой гипоальбуминемию. Это заболевание характеризуется низкой концентрацией белка в крови под названием альбумин.
Другим заболеванием, связанным с низким анионным разрывом, является рак миеломы IgG крови. Этот тип рака вызван злокачественными плазматическими клетками.
![]()
Другие патологии, связанные с низкими значениями анионного промежутка: гиперкальциемия, гипермагниемия (высокий уровень кальция и магния в плазме, соответственно) и отравление литием.
Последнее может встречаться у психиатрических пациентов, получающих лекарства для стабилизации настроения.
Вызвано высоким анионным зазором
Высокие анионные разрывы указывают, главным образом, на возможный метаболический ацидоз. Метаболический ацидоз возникает, когда организм вырабатывает избыток кислоты или когда выделительная система (почки) не эффективно удаляет кислоты.
Частью патологий, связанных с метаболическим ацидозом, являются: почечная недостаточность, лактоацидоз, пироглутаминовый ацидоз и отравления толуолом, метанолом и этиленгликолем..
Отравления метанолом, толуолом и этиленгликолем могут происходить при проглатывании или вдыхании химических веществ с этими компонентами.
К таким химическим веществам относятся растворители краски, гидравлическая тормозная жидкость и антифриз. Метаболический ацидоз предрасполагает к дисфункции сердца и деминерализации костей, в частности.
Высокий уровень альбумина в плазме вызывает состояние, называемое гиперальбуминемией. Гиперальбуминемия может быть вызвана различными причинами, включая СПИД, хронические воспалительные заболевания, нарушения костного мозга и даже обезвоживание..
Среди других менее распространенных заболеваний, связанных с высоким анионным разрывом, миеломный рак IgA и метаболический алкалоз.
Использование анионного интервала
Осмоляльный интервал в норме и при отравлении
Осмоляльный интервал соответствует разнице между измеренной осмоляльностью (по методу понижения точки замерзания) и величиной, рассчитанной по формуле:
2Na + + глкюкоза/18 + AMК/28, где АМК — азот мочевины крови.
Мнемоническое выражение для запоминания причин возникновения этого интервала — МЭ-ДИЭ: метанол, этанол, диуретики (маннитол, сорбитол, глицерин), изопропанол или этиленгликоль.
Вклад, вносимый любым химическим веществом в осмолярность раствора, пропорционален количеству его молекул. Один миллимоль вещества увеличит измеренную осмоляльность на 1 мосм. Одна молекула этанола с молекулярной массой 46 обладает такой же осмотической активностью, что и одна молекула альбумина молекулярной массой 66 500. Таким образом, в любой заданной весовой концентрации вещества с легкими молекулами осмотически значительно активнее соединений с тяжелыми молекулами.
Простые эфиры гликолей и их метаболиты осмотически активны, однако их молекулярная масса больше, чем у этанола и других спиртов с мелкими молекулами, поэтому низкие концентрации первых не приводят к заметному осмотическому эффекту. В результате осмоляльный интервал может быть нормальным на поздних стадиях отравления метанолом и этиленгликолем, когда эти вещества полностью метаболизированы.
Осмоляльный интервал как критерий отравления
• Если М-С (измеренная осмоляльность-расчетная осмоляльность) больше 10 мосм/кг Н2О, возможны:
(1) лабораторная ошибка,
(2) снижение содержания воды в сыворотке,
(3) присутствие веществ с низкой молекулярной массой, не включенных в уравнение для расчета осмоляльности• Если М нормальная, а С низкая, возможно снижение содержания воды в сыворотке, связанное с гиперпротеинемией и гиперлипидемией
• Если М высокая, а С нормальная или низкая, интервал соответствует неопределяемым осмолям: сорбитола, этанола, маннитола, метанола, глицерина, этиленгликоля, диатризоата натрия, ацетона, изониазида, эфира трихлорэтана.
*М— измеренная осмоляльность
*С — расчетная осмоляльностьОтравления с метаболическим ацидозом с высоким анионным интервалом и нормальным осмоляльным интервалом
а) Железо. Боли в животе, кровавая рвота, понос, рентгено-контрастные пятна.
б) Толуол. Вдыхание клея, запах, гипокалиемия, обусловленная почечным канальцевым ацидозом.
в) Фенформин. Гипогликемия.
г) Лактоацидоз. Сердечно-легочный дистресс, эпилептические припадки, железо и т. д.
д) Паральдегид. Запах.
е) Салицилаты. Положительный результат анализа сыворотки, дыхательный алкалоз.
ж) Уремия. Высокий уровень креатина в сыворотке.
з) Кетоацидоз. Высокий уровень кетоновых тел.![Варианты нарушения кислотно-щелочного равновесия (КЩР)]()
Осмоляльный интервал при отравлении этанолом
Если измеренный уровень этанола ниже спрогнозированного по осмоляльному интервалу, следует предположить присутствие других осмотически активных веществ, например метанола, этиленгликоля, изопропилового спирта или ацетона.
Наличие осмоляльного интервала при повышении анионного в отсутствие выявляемого этанола должно вызывать сильные подозрения на интоксикацию метанолом или этиленгликолем. Если высокий анионный интервал не объясняется подъемом уровня лактата, диагноз отравления каким-то из названных веществ можно считать почти точным, поскольку они ведут к образованию органических кислот, отличных от молочной.
В принципе, по осмоляльному интервалу можно достоверно оценить уровень спиртов в организме. Однако зачастую повышение этого интервала не объясняется увеличенной концентрацией этанола. На точность формул, используемых для его расчета, могут влиять обезвоживание и регидратация.
Большинство этих формул основано на допущении, согласно которому сыворотка примерно на 93 % состоит из воды, однако эта количественная "константа" способна изменяться в зависимости от степени обводненности организма. У обезвоженного больного доля воды в сыворотке может падать до 0,89, а после регидратации увеличиваться до 0,94.
Повышать осмоляльный интервал способны и патологические процессы, связанные с алкоголизмом. Алкогольный кетоацидоз с необъяснимым осмоляльным и большим анионным интервалами будет имитировать отравление этиленгликолем или метанолом; неопределяемые осмоли здесь результат патологического состояния организма.
Повышенный осмоляльный интервал может объясняться метаболитами токсинов, разницей в формулах, использованных для его расчета, и непостоянством входящих в эти формулы "констант".
Запомнить этиологические агенты ацидоза с увеличенным анионным интервалом помогает мнемоническое выражение: I Love Chocolate Raspberry Truffle MUDPIES:
I Iron (железо), isoniazid (INH) (изониазид), ibuprofen (ибупрофен),
L Lithium (литий), lactate (лактат),
С Carbon monoxide (угарный газ), cyanide (цианид), caffeine (кофеин),
R Respiratory dysfunction (дыхательная дисфункция), beta-adrenergic agents (бета-адренергические агенты), benzyl alcohol (бензиловый спирт),
T Toluele (толуол),
M Methanol (метанол), metabolic dysfunction (метаболическая дисфункция),
U Uremia (уремия), hepatorenal dysfunction (почечно-печеночная дисфункция),
D Diabetic ketoacidosis (диабетический кетоацидоз),
Р Paraldehyde (паральдегид), phenformin (фенформин),
I Idiopathic (идиопатический процесс), iron (железо), INH, ibuprofen (ибупрофен),
Е Ethanol (этанол), ethylene glycol (этиленгликоль),
S Salicylates (салицилаты), hydrogen sulfide (сероводород), strychnine (стрихнин), seizures (эпилептические припадки), starvation (голодание), sympathomimetic amines (симпатомиметические амины).Если включить этанол в формулу для расчета осмоляльности, она примет следующий вид:
2[Na + ] + глюкоза/18 + (азот мочевина сыворотки)/2,8 + этанол/4,6.
Обычно среднее значение равно (6 +/— 2) мосм/л. Использование обеих формул (см. выше) дает сходные значения для расчетной осмоляльности.
У многих спиртов (например, метанола, этанола, изопропанола) температура кипения ниже, чем у воды. Поскольку эти летучие соединения могут оставаться в паровой фазе, не конденсируясь в сыворотке, осмоляльность, определенная путем измерения давления паров, может оказаться ложнонормальной. Метод понижения точки замерзания не создает такой проблемы и является предпочтительным для больного, потреблявшего алкоголь. В противном случае есть опасность того, что потенциально серьезное алкогольное отравление останется невыявленным.
Рутинное применение такого показателя, как осмоляльный интервал, для диагностирования алкогольной интоксикации часто приводит к ложноположительным и ложноотрицательным результатам.
Алкогольный кетоацидоз и осмоляльный интервал
Повышение осмоляльного интервала при алкогольном кетоацидозе лишь частично объясняется осмотической концентрацией этилового спирта. Увеличение концентраций эндогенных глицерола, ацетона и метаболитов последнего — одна из существенных причин высокого осмоляльного интервала у алкоголиков.
При алкогольном ацидозе наблюдается метаболический ацидоз с повышением как анионного, так и осмоляльного интервалов. Аналогичная картина сопутствует потреблению метанола и этиленгликоля. Таким образом, при подозрении на него, прежде чем назначить больным алкогольную терапию и/или гемодиализ, необходимо исключить алкогольный и молочно-кислый ацидоз.
Увеличение как анионного, так и осмолярного интервала при отравлении
Анионный интервал бывает нормальным на ранних стадиях отравления метанолом и этиленгликолем, когда одновременный прием этанола препятствует образованию кислотных метаболитов этих веществ. Осмоляльный интервал может быть нормальным на поздних стадиях такого отравления, когда метанол и этиленгликоль полностью метаболизируются. Повышение как анионного, так и осмоляльного интервала должно сразу вызывать подозрение на отравление этиленом или этиленгликолем.
Необходимо начать лечение бикарбонатом и этанолом (или 4-метилпиразолом), рассматривая вопрос о возможном назначении гемодиализа.
![Показатели кислотно-щелочного равновесия (КЩР) в норме]()
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.Анионный интервал в норме и при отравлении
К веществам, вызывающим метаболический ацидоз без нарушения анионного интервала, относятся ацетазоламид, амфотерицин В, амилорид, спиронолактон и толуол.
Анионный интервал может быть нормальным на ранних стадиях отравления метанолом и этиленгликолем, когда одновременное потребление этанола препятствует образованию метаболитов указанных веществ.
Анионный интервал вычисляется по формуле: АИ = Na + -(Cl - +HCО3 - ).
Молочно-кислый ацидоз. Расчет анионного интервала (норма составляет 12+/—4 ммоль/л) не обязательно позволяет обнаружить клинически значимый молочно-кислый ацидоз. Гиперлактатемия — признак неэффективной оксигенации тканей, означающий плохой прогноз для больных в критическом состоянии. Молочно-кислый ацидоз можно определить как рН ниже 7,4 при концентрации лактата в крови более 2,5 ммоль/л.
Его уровень считается высоким (смертность обычно 100 %) при концентрации выше 10 ммоль/л, умеренным (смертность обычно 75 %) при концентрации 5—9,9 ммоль/л и слабым (смертность около 35 %) при 2,5—4,9 ммоль/л. Когда уровень лактата очень высок, анионный интервал соответствует верхнему пределу нормы или превышает его, однако у 50 % больных с умеренным подъемом уровня лактата и до 80 % пациентов со слабым его увеличением может наблюдаться нормальный анионный интервал.
Поэтому гиперлактатемию следует также включать в дифференциальную диагностику ацидоза без нарушений анионного интервала. Поскольку нормальное значение последнего не исключает повышенного уровня лактата в крови, а рН может вернуться к норме в результате корректировки вентиляции или вливания бикарбоната, единственной альтернативой остается непосредственное измерение концентрации лактата в крови.
Ограничения при использовании в диагностике анионного интервала кратко представлены ниже.Ограничения метода анионного интервала:
1. Примерно у 1/3 пациентов с анионным интервалом от 20 до 30 мэкв/л органического ацидоза не выявляется.
2. Увеличение концентрации кетоанионов и лактата недостаточно для объяснения всего увеличения анионного интервала при органическом ацидозе.
3. У пациентов с классическим в остальных отношениях неосложненным диабетическим кетоацидозом может присутствовать или развиваться позднее метаболический ацидоз с нормальным анионным интервалом.
4. После купирования лактоацидоза может развиваться "лишний" алкалоз, поскольку "избыток" лактата обычно превышает снижение уровня бикарбоната.
5. Точную связь между повышением анионного интервала и снижением уровня бикарбоната при ацидозе с большим анионным интервалом определить трудно.Причины падения сывороточного анионного интервала
Используемый сейчас нормальный диапазон анионного интервала (12 +/— 4 ммоль/л) установлен с применением технических средств, доступных в 70-е годы, однако большинство клинических лабораторий сейчас использует более современные методы.
Консультация с клинической или больничной лабораторией позволит избежать неправильной интерпретации клиницистом расчетного значения анионного интервала.![Методы измерения анионного интервала]()
Факторы, приводящие к его снижению, перечислены ниже. Связь между увеличением анионного интервала и снижением уровня бикарбоната Wrenn количественно охарактеризовал как дельта-интервал, который равен разности между величинами этих отклонений. Если дельта-интервал больше +6, обычно присутствует метаболический ацидоз, если меньше —6, речь, как правило, идет о гиперхлоремическом ацидозе.
Процессы, влияющие на анионный интервал:
- Высокий анионный интервал
- Метаболический ацидоз*
- Обезвоживание или потеря жидкости с относительно небольшим количеством неопределяемых анионов
- Вливание растворов солей органических кислот (лактата, ацетата, цитрата, пенициллина, карбенициллина)
- Пониженный уровень неопределяемых катионов (калия, кальция, магния)
- Алкалиемия*
- Систематическая недооценка сывороточного уровня хлорида (у азотемических больных, получающих аллопуринол)**
- Случайная лабораторная ошибка*
- Низкий анионный интервал
- Увеличение объема за счет чистой воды или жидкости, содержащей относительно мало неопределяемых анионов
- Систематическая недооценка сывороточного уровня натрия (гипернатриемия, повышенная вязкость, гиперлипидемия)***
- Систематическая переоценка сывороточного уровня хлорида (бромизм, интоксикация йодидом, гиперлипидемия)*
- Повышенный уровень неопределяемых катионов (калия, кальция, магния, иммуноглобулина G, лития, полимиксинов)*
- Пониженный уровень неопределяемых анионов (гипоальбуминемия)*
- Ацидемия вследствие дыхательного или гиперхлоремического метаболического ацидоза***
- Случайная лабораторная ошибка** Правдоподобные клинические ситуации, при которых анионный интервал может превышать 6 мэкв/л.
** Систематические ошибки объясняются лабораторными методами, используемыми для измерения концентрации конкретных ионов в описанных условиях.
*** Ацидемия, обычно сочетающаяся с ацидозом при высоком анионном интервале, имеет тенденцию снижать увеличение анионного интервала, вызванное повышенной концентрацией неопределяемых анионов.
![Показатели кислотно-щелочного равновесия (КЩР) в норме]()
![Варианты нарушения кислотно-щелочного равновесия (КЩР)]()
Анионный разрыв: ценности, применение и болезни
Видео: Анионный разрыв: ценности, применение и болезни
Содержание:
В анионная щель или анионный промежуток известен как различие между положительным зарядом (катион) и отрицательным зарядом (анион), измеренным в жидкостях организма. Термин анионный разрыв используется в большинстве случаев для измерения или анализа сыворотки крови (плазмы крови без фибриногенов). Эти ионы также можно измерить в моче.
Дифференциация между анионами и катионами происходит благодаря концентрациям натрия, хлора и бикарбоната (в форме CO2 всего или HCO3), которые существуют в жидкостях организма (в основном в плазме крови).
Он используется для клинической диагностики, в основном для диагностики измененных психических состояний, метаболического ацидоза, почечной недостаточности и других патологий.
Основным принципом анионного промежутка является то, что плазма (в основном используемая) электрически нейтральна. Желаемый результат - измерить уровень кислотности используемой жидкости организма (плазмы или мочи).
Принцип электрической нейтральности жидкости гласит, что результирующая разница между катионами и измеренными анионами (измеренные катионы - измеренные анионы) равна результирующей разнице между катионами и неизмеренными анионами (неизмеренные катионы - неизмеренные анионы), а это, в свою очередь, равно объединительной щели или анионной щели.
Наиболее часто используемый катион для измерений - это натрий (Na + ), а измеряемые анионы - хлорид (Cl – ) и бикарбонат (HCO3 – ).
Что касается неизмеренных анионов, это сывороточные белки (сыворотка), фосфаты (PO4 3- ), сульфат (SO4 2- ) и органических анионов.
А неизмеренные катионы могли быть магнием (Mg + ) или кальций (Ca + ). Формула для расчета анионной щели или анионной щели: Анионная щель = Na + - (Cl – + HCO3 – ).
Нормальные значения анионной щели исторически менялись. Это связано с методами, используемыми для обнаружения ионов. Раньше для проведения измерений использовались колориметры или фотометрия, которые давали нормальные значения концентраций от 8 до 16 миллимоль / литр (ммоль / л) и от 10 до 20 ммоль / л.
В настоящее время используются специфические ионные электроды. Это датчики, которые переводят активность определенного иона, растворенного в растворе, в электрический потенциал.
Указанный электрический потенциал измеряется pH-метром для определения кислотности, поэтому значения согласно действующей классификации следующие:
Низкий
Рассчитанный как низкий анионный зазор составляет менее 3 ммоль / л.
Обычный
Нормальные значения - это те, которые выше 3 ммоль / л, но ниже 11 ммоль / л.
Высоко
Большой анионный разрыв возникает, когда расчетное значение превышает 11 ммоль / л.
В среднем
Некоторые авторы сходятся во мнении, что оценочное среднее значение составляет 6 ммоль / л.
Однако полученные результаты могут отличаться в зависимости от используемого оборудования. Из-за этого медицинское сообщество не всегда соглашается с использованием стандартного значения для интерпретации этих расчетов.
Для решения этой проблемы каждая лаборатория имеет или должна иметь свои собственные эталонные интервалы.
Приложения
Применение тестов анионной щели практически клиническое. Он заключается в оценке кислотно-щелочных изменений, особенно в выявлении метаболических нарушений, которые приводят к повышению кислотности плазмы крови.
Эти тесты направлены на определение значений положительно или отрицательно заряженных химических веществ, и, в зависимости от расчета анионного промежутка, это будет служить для установления соответствующего медицинского диагноза.
Низкая анионная щель
Увеличение концентрации неизмеренных катионов или уменьшение неизмеряемых анионов считается малой анионной щелью.
Существуют различные патологии, связанные с низким значением анионной щели, но физиологические причины, которые приводят к этому значению, очень сложны.
Например, люди с миеломой IgG (тип рака, вызываемого злокачественными плазматическими клетками) вырабатывают большое количество парапротеинов.
Увеличение продукции этих молекул приводит к низким значениям анионной щели для этих пациентов.
Высокая анионная щель
Гипотетически, большая анионная щель может возникать из-за уменьшения неизмеренных катионов или увеличения неизмеренных анионов.
Однако клинический опыт показывает, что обычно увеличение анионной щели происходит из-за увеличения неизмеряемых анионов. Клиническим примером этого является метаболический ацидоз.
Вызвано низким анионным зазором
Заболевание, чаще всего связанное с низким анионным разрывом, - это гипоальбуминемия. Это заболевание характеризуется низкой концентрацией белка крови, называемого альбумином.
Еще одно заболевание, связанное с низким анионным разрывом, - это рак крови Myeloma IgG. Этот тип рака вызывается злокачественными плазматическими клетками.
Другие патологии, связанные с низкими значениями анионной щели: гиперкальциемия, гипермагниемия (высокие уровни кальция и магния в плазме соответственно) и интоксикация литием.
Последнее может произойти у психиатрических пациентов, принимающих лекарства для стабилизации настроения.
Вызвано большим анионным промежутком
Высокие анионные промежутки в основном указывают на возможный метаболический ацидоз. Метаболический ацидоз возникает, когда организм производит избыток кислоты или когда выделительная система (почки) не удаляет кислоты эффективно.
Частью патологий, связанных с метаболическим ацидозом, являются: почечная недостаточность, лактоацидоз, пироглутаминовый ацидоз и отравление толуолом, метанолом и этиленгликолем.
Отравление метанолом, толуолом и этиленгликолем может произойти в результате проглатывания или вдыхания химикатов с этими компонентами.
К таким химическим веществам относятся разбавители для краски, гидравлическая тормозная жидкость и антифриз. Метаболический ацидоз, в частности, предрасполагает к сердечной дисфункции и деминерализации костей.
Повышенный уровень альбумина в плазме вызывает заболевание, называемое гиперальбуминемией. Гиперальбуминемия может быть вызвана множеством причин, включая СПИД, хронические воспалительные состояния, заболевания костного мозга и даже обезвоживание.
Другие менее распространенные заболевания, связанные с высоким анионным разрывом, включают миелому IgA, рак крови и метаболический алкалоз.
Читайте также:
- Внезапная потеря зрения
- Портокавальный анастомоз при циррозе печени. Техника наложения портокавального анастомоза.
- Синдром Ciancia - клиника, диагностика
- Лучевая диагностика злокачественной амелобластомы и амелобластического рака челюсти
- Предоперационная подготовка при ранениях: дренирование плевральной полости