Классификация опухолей височной кости
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
ГБУ НИИ нейрохирургии им. Н.Н. Бурденко
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва;
Отделение нейрохирургии Нижегородского научно-исследовательского института травматологии и ортопедии
МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИРЦ» Минздрава России, Москва, Россия
Эпидемиология, диагностика, клиническая симптоматика и классификация первичных злокачественных опухолей, поражающих основание черепа
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2016;80(3): 106‑113
В обзоре литературы представлена современная информация по распространенности, встречаемости, клиническим проявлениям, диагностике и классификации первичных злокачественных опухолей, поражающих основание черепа (ПЗООЧ). В структуре общей онкологической заболеваемости злокачественные опухоли головы и шеи составляют 5% всех ежегодных смертей от рака в США, они одни из пяти самых встречаемых групп опухолей у мужчин во всем мире. Чаще всего эти опухоли возникают на шестой декаде жизни, и в 2 раза чаще у мужчин, чем у женщин. В России по состоянию на 2012 г. заболеваемость ПЗООЧ составила 0,62% от всех впервые выявленных злокачественных опухолей и насчитывает 0,66 случая на 100 000 населения, значительно превышая общемировой уровень (0,44 на 100 000). Среди всех злокачественных опухолей основания черепа примерно половина имеет эпителиальную природу и поражает передние отделы основания черепа. Наиболее частыми гистологическими вариантами являются плоскоклеточный рак, аденокарцинома и неходжкинская B-клеточная лимфома. Лечение опухолей, поражающих основание черепа, является междисциплинарной проблемой и входит в сферу интересов отоларингологов, стоматологов, офтальмологов, нейрохирургов, пластических хирургов, радиологов, химиотерапевтов. На начальном этапе обследования наиболее важными для верификации, определения стадийности и выработки правильной тактики лечения онкологического процесса являются: физикальный и эндоскопические осмотры; эндоскопическая трансназальная биопсия опухоли; КТ и МРТ; ПЭТ/КТ (позитронно-эмиссионная томография с компьютерной томографией); УЗИ. В обзоре приведены критерии стадийности по системе TNM для злокачественных опухолей полости носа и околоносовых пазух в соответствии с 7-й версией TNM рекомендаций Американского объединенного комитета по раку (AJCC). В зависимости от локализации (опухоли верхнечелюстной пазухи, полости носа или лабиринта решетчатых костей) и гистологической структуры опухоли стадирование по классификации TNM различается и соответственно изменяются тактика комплексного лечения и группа прогноза.
Эпидемиология
В структуре общей онкологической заболеваемости злокачественные опухоли головы и шеи составляют 5% всех ежегодных смертей от рака в США. Эти злокачественные опухоли входят в список пяти самых встречаемых опухолей у мужчин во всем мире и занимают 6-7-е место по распространенности среди всех злокачественных новообразований [1]. По данным литературы, при адекватном комплексном лечении 5-летняя выживаемость больных с раком головы и шеи составляет 80%. Средний возраст при диагностировании плоскоклеточного рака головы и шеи составляет примерно 60 лет, однако частота заболевания людей среднего возраста (моложе 45 лет) начинает возрастать, что, вероятно, связано с распространением вируса папилломы человека (ВПЧ) [2].
Публикации, посвященные опухолям головы и шеи, распространяющимся на основание черепа, малочисленны [3]. Следует отметить, что опухоли основания черепа многообразны по морфологической структуре и локализации. Чаще всего встречаются эпителиальные раки, исходящие из околоносовых пазух, при этом их трудно дифференцировать с опухолями верхних отделов носоглотки. Морфологически эти новообразования могут быть очень близки, но между ними имеются принципиальные различия в лечении и исходах заболевания. Кроме того, в области головы и шеи могут встречаться опухоли, исходящие из костной и хрящевой ткани. Как правило, эти опухоли злокачественны и способны к метастазированию.
Опухоли могут проникать интракраниально, разрушая кости основания черепа или распространяясь через естественные отверстия (периневрально), поражая несколько анатомических зон, при этом нередко страдают функционально важные структуры основания черепа. Распространение опухоли на наружное основание, область подвисочной и крылонебной ямок, глазницу в сочетании с интракраниальным ростом требует согласованных действий онкологов и нейрохирургов, а также радиологов и химиотерапевтов [4].
Среди всех злокачественных опухолей, поражающих основание черепа, примерно половина имеет эпителиальную природу и поражает передние отделы основания черепа [5]. Подавляющее большинство этих опухолей развиваются из слизистой оболочки полости носа и околоносовых пазух.
Злокачественные опухоли околоносовых пазух, поражающие основание черепа, составляют 0,2% от всех злокачественных опухолей и 3-5% от злокачественных новообразований, поражающих верхние дыхательные пути. Наиболее частым источником этих опухолей является верхнечелюстная пазуха и слизистая оболочка полости носа. Чаще всего они возникают на шестой декаде жизни, и у мужчин в 2 раза чаще, чем у женщин. По последним данным, у мужчин наблюдается рост заболеваемости [6], который, помимо ВПЧ, обусловлен другими канцерогенными факторами. Так, формальдегид достоверно повышает риск развития плоскоклеточного рака и аденокарциномы. Иприт, асбест, никель и радий вызывают развитие плоскоклеточного рака, а древесная пыль и работы с кожей предрасполагают к развитию аденокарциномы [7]. Доказанным является влияние ВПЧ на малигнизацию процесса при инвертированной папилломе и плоскоклеточном раке [8]. Известно также, что ВПЧ-индуцированный плоскоклеточный рак околоносовых пазух имеет лучший прогноз по сравнению с другими формами [9].
В России по состоянию на 2012 г. заболеваемость злокачественными опухолями полости носа, околоносовых пазух, носоглотки и среднего уха составляет 0,54% от всех впервые выявленных злокачественных опухолей. Заболеваемость мужчин в 2 раза превышает заболеваемость женщин, общая заболеваемость составляет 0,66 случая на 100 000 населения, значительно превышая общемировой уровень (0,44 на 100 000) [10].
В 46% случаев источником опухолей является полость носа, в 33% - верхнечелюстная пазуха, другие локализации составляют 20%. Самые распространенные гистологические варианты: плоскоклеточный рак - 42%; неходжкинская В-клеточная лимфома - 11%; аденокарцинома - 10%. При исходном росте опухоли в полости носа быстрое появление симптомов обструкции дыхательных путей позволяет раньше установить диагноз, что отражается в статистике распределения по классификации TNM. Так, встречаемость T1 и Т4 опухолей полости носа составляет 44,9 и 22,5% соответственно. Опухоли околоносовых пазух длительно растут бессимптомно, поэтому чаще обнаруживаются на поздних стадиях: встречаемость T1 и Т4 опухолей околоносовых пазух составляет 10 и 55% соответственно. Та же закономерность прослеживается и в отношении стадий заболевания: опухоли полости носа IV стадии составляют 21%, в то время как опухоли IV стадии околоносовых пазух составляют в среднем 52%. При установлении диагноза опухоль часто не имеет регионарных и отдаленных метастазов. Так, регионарное метастазирование отмечается в среднем в 20% случаев, а отдаленное - лишь в 10%. Общая 5-летняя выживаемость на фоне комплексного лечения при злокачественных опухолях полости носа и околоносовых пазух составляет 55,8%. Она выше при опухолях полости носа (68%), чем при опухолях околоносовых пазух (от 42 до 48%). Наиболее благоприятным гистологическим вариантом с точки зрения общей 5-летней выживаемости среди наиболее распространенных эпителиальных опухолей является аденокарцинома (63,7%), затем следуют плоскоклеточный рак (53%) и все остальные эпителиальные опухоли (37,8%) [11].
В настоящее время, по данным Национального института здоровья США, проводится более 900 активных клинических исследований по злокачественным новообразованиям указанной локализации, однако какого-то однозначного алгоритма диагностики и лечения не разработано, например, больные раком основной пазухи из подавляющего большинства таких исследований исключаются.
В период с 2000 по 2015 г. в России было выполнено 9 научных исследований по данной проблеме: 3 исследования - в НИИ нейрохирургии им. Н.Н. Бурденко 12; 2 работы - в Российском онкологическом научном центре им. Н.Н. Блохина (Москва) [15, 16]; по одной работе в Российском научно-исследовательском нейрохирургическом институте им. проф. А.Л. Поленова (Санкт-Петербург) [17], Северном государственном медицинском университете (Архангельск) [18], Медицинском радиологическом научном центре РАМН (Обнинск) [19], Институте повышения квалификации ФМБА (Москва) [20].
В этих работах были затронуты преимущественно хирургические аспекты лечения больных со злокачественными опухолями основания черепа, а также вопросы химиотерапии и лучевой терапии опухолей без интракраниального роста.
Нозологические формы первичных злокачественных опухолей, поражающих основание черепа
Первичные злокачественные опухоли, поражающие основание черепа (ПЗООЧ), являются гетерогенной группой опухолей, что обусловлено широким разнообразием тканей, локализующихся в этой анатомически сложной области. При интракраниальной инвазии опухоли пациенту необходима, в дополнение к онкологической, нейрохирургическая помощь, которая в ряде случаев носит экстренный характер при наличии признаков внутричерепной гипертензии и вклинения. Переход в плоскоклеточную форму рака органов головы и шеи является финальной точкой процесса изменения тканей эпителия из нормального состояния в гиперплазию, дисплазию, карциному in situ и, наконец, инвазивную карциному [21]. Появляющиеся частичные повреждения хромосом ассоциированы с различными стадиями развития опухоли. Основные генетические изменения, включая потерю гетерозиготности определенных хромосом (3p14, 9p21, 17p13, 8p, 11q, 13q, 14Q, 6р, 4q27 и 10q23) и увеличение экспрессии, удаление, усиление регулирования или снижение регулирования некоторых онкогенов или опухолевых супрессоров, в том числе рецептора эндотелиального фактора роста (EGFR), р53, Rb, p65, циклооксигеназы 2 (ЦОГ-2), р16, циклина D1 и фосфатазы, гомолога ангиотензина (PTEN), являются характерными для каждой из патологических стадий данного заболевания [21].
Основные гистологические группы первичных синоназальных злокачественных опухолей отличаются выраженным разнообразием и описаны в классификации ВОЗ [22].
1. Эпителиальные опухоли
• Плоскоклеточный рак (карцинома)
• Опухоли слюнных желез
• Синоназальная недифференцированная карцинома (sinonasalis undifferent carcinoma, SNUC)
2. Нейроэктодермальные опухоли
3. Нейроэндокринные опухоли
• Синоназальная нейроэндокринная карцинома (sinonasalis neuroendocrine carcinoma - SNEC)
Классификация опухолей височной кости
Классификация гломусных опухолей височной кости
Хотя гломусные опухоли являются в целом доброкачественными и медленно растущими, их осложнения и летальность обусловлены положением этих новообразований на основании черепа и прилегающей задней черепной ямке, а также в области черепно-мозговых нервов, обеспечивающих координацию, глотание и голосообразование.
В прошлом возможности диагностики этих опухолей значительно превышали возможности лечения. Развитие методов лечения наконец-то достигло равенства с диагностическими технологиями. По общему мнению, лечение гломусных опухолей должно быть хирургическим.
Онкологи утверждают, что для полного излечения необходима радикальная резекция. Вследствие технических возможностей, на сегодняшний день, проблемы резектабельности опухоли уступили проблемам функциональных результатов, то есть качеству послеоперационного выживания. Восстановление значительных дефектов, наряду с восстановлением сниженной функции черепных нервов, необходимо для минимизации основного риска, являющегося причиной критики хирургических вмешательств, т. е. возможности значительной функциональной недееспособности.
Болезненные последствия могут быть достоверно предсказаны, а исходы контролироваться. Проблемы внутричерепного распространения опухоли хорошо изучены.
Тем не менее, продолжается дискуссия о противопоставлении оперативному лечению лучевой терапии и стереотаксической радиохирургии. Данных для разрешения этой дилеммы не существует. Лучевая терапия и стереотаксическая радиохирургия предполагают низкую частоту осложнений, при этом пациенту приходится сосуществовать с биологически измененной опухолью.
В этой статье рассматриваются хирургические стандарты, доминирующие в хирургии гломусных опухолей. Также рассмотрены внутричерепные осложнения, лечение, пластика дефектов, и восстановление черепно-мозговых нервов. Лучевая терапия и стереотаксическая радиохирургия подробно описаны в отдельных статьях на сайте.
Для планирования хирургического вмешательства и обеспечения стандартизации результатов лечения необходима классификация гломусных опухолей.
Oldring и Fisch в 1979 году признали эту необходимость и предложили ABCD систему классификации. Эта система была дополнена в 1982 году включением внутричерепных осложнений и подклассов опухолей типов С и D.
Классификация гломусных опухолей Glasscock-Jackson сохранила классические барабанный и яремный подклассы, расширяя подклассы распространения опухоли. Внутричерепное распространение выражается в виде индекса, например, GJ-тип IV означает опухоль луковицы яремной вены, с распространением в полость черепа на 2,0 см.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Классификация доброкачественных опухолей височной кости
Развитие хирургии височной кости (ВК) началось и продолжалось благодаря технологическим достижениям в лечении воспалительных заболеваний среднего уха и сосцевидного отростка. Антибиотики и микрохирургия, а также удивительные события в нейроангиографии и визуализации потрясающе расширили возможности нейроотологии.
Тем не менее опухоли височной кости могут вызывать значительные проблемы даже при использовании самых современных методов. Являясь частью основания черепа, височная кость относительно недоступна. Кроме того, отдаленные заболевания височной кости обычно проявляются поздно. Глубокие карманы височной кости являются типичными локализациями для развития заболеваний, проявляющихся только если процесс достигает среднего уха.
Эмбриология височной кости сложна, и отражает вклад всех зародышевых листков. Следовательно, возможно появление разнообразных типов опухолевых клеток, как доброкачественных, так и злокачественных. Зачастую каждая разновидность опухоли может быть уникальной и весьма редкой, опровергая традиционные клинические представления о диагностике и/или лечении. Современные хирургические протоколы лечения доброкачественных поражений, особенно гломусных опухолей, направлены на полное удаление опухоли с целью максимального улучшения качества жизни после операции путем минимизации косметических и неврологических дефектов.
Подход к лечению доброкачественных поражений создавался в содружестве с нейрохирургами, челюстно-лицевыми хирургами, специалистами по пластической хирургии и нейрорадиологами; тем не менее, злокачественные новообразования височной кости продолжают оставаться сложной проблемой. Пациенты по-прежнему умирают при прогрессировании заболевания, с невыносимой болью, неврологическими нарушениями, и всеми признаками истощения, столь характерного для терминальной стадии рака головы и шеи.
В этой и последующих статьях на сайте рассматриваются опухоли височной кости, описываются редкие поражения и основное внимание уделено наиболее распространенным доброкачественным поражениям — гломусной опухоли. Концепция лечения гломусных опухолей может быть применена и к более редким поражениям.
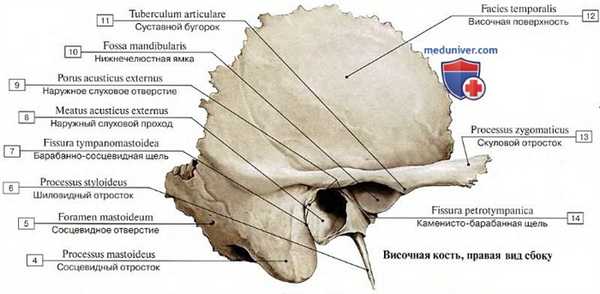
В височной кости выделяют четыре части — pars petrosa (каменистая часть), pars squamosa (чешуйчатая часть), сосцевидный отросток и барабанная часть. Все это составляет нижнебоковую основу черепа и почти полностью сформировано в момент рождения, развитие полностью завершается к трем годам. Помимо костной структуры височная кость содержит почти все ткани: эпителиальную, нервную, эпидермальную, сосудистую, хрящевую и железистую. В височной кости может возникнуть почти любой тип опухоли.
На нижне-боковой поверхности находятся костная и хрящевая части наружного слухового прохода. Лимфооток от ушной раковины и наружного слухового прохода осуществляется в околоушные и пре- и позадиушные лимфатические узлы. Венозный отток идет во внутреннюю яремную вену.
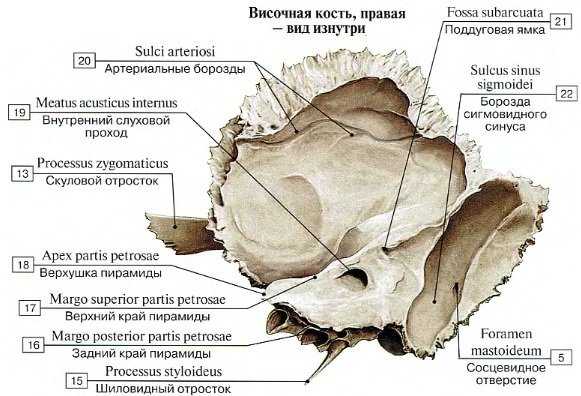
Передняя поверхность входит в состав дна средней черепной ямки. Кпереди височная кость граничит со слуховой трубой, внутренней сонной артерией и каменистой бороздой с сигмовидным синусом. В верхушке пирамиды находится коленчатый ганглий, особая эмбриологическая структура, являющаяся типичным местом развития множества опухолей.
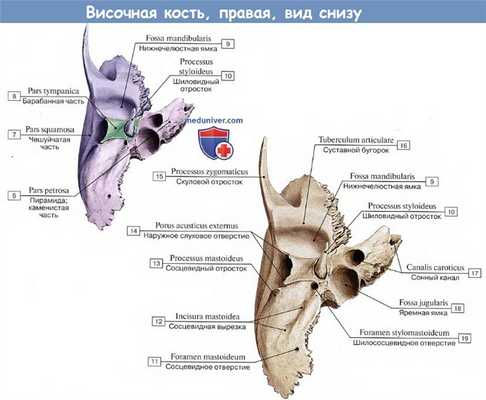
Носоглотка имеет важные анатомические взаимосвязи с височной костью. С заднемедиальной стороны расположена каменистая часть внутреннего слухового прохода с его содержимым. Кпереди находится суставная ямка, полуканал напрягающей барабанную перепонку мышцы и канал внутренней сонной артерии. Подвисочная ямка располагается далее кпереди. Луковица яремной вены объединяет внутреннюю яремную вену и сигмовидный синус и синус расположен в pars venosa каменисто-затылочной щели. Кпереди от луковицы находится pars nervosa, в которой проходят IX, X и XI черепно-мозговые нервы. Рядом с луковицей имеется сонно-яремная пластинка, отделяющая ее от внутренней сонной артерии.
Пневматизированные пространства височной кости являются магистралью для распространения опухоли, варьируя в зависимости от степени и протяженности пневматизации. Барабанная перепонка служит преградой к распространению патологического процесса из наружного слухового прохода. Кость лабиринта относительно устойчива к распространению опухоли и служит временным барьером. Наряду с нервно-сосудистыми структурами, отверстие Гушке (Huschke), неполное закрытие барабанного кольца (дефект развития нижней стенки костной части наружного слухового прохода) может способствовать внутричерепному распространению опухоли, в околоушное пространство, в подвисочную ямку и наоборот.
В дополнение к упомянутому ранее основному околоушному лимфатическому дренажу, который играет важную роль в заболеваниях наружного слухового прохода, лимфоотток осуществляется верхними шейными, глубокими яремными, позадиушными и глубокими задними лимфатическими сосудами. Хотя у внутреннего уха нет известного лимфатического дренажа, лимфоотток из системы среднего уха, сосцевидного отростка, и евстахиевой трубы осуществляется в глубокие яремные и заглоточные узлы. Значение лимфатической системы в опухолях височной кости и их лечении малоизучено.
При всем многообразии видов опухолей височной кости, каждый из них встречается редко; фактически, встречаемость некоторых опухолей височной кости мала для полноценного описания.
Для классификации доброкачественных опухолей височной кости служит анатомическая схема:
I. Доброкачественные опухоли наружного слухового прохода:
1. Остеома
2. Экзостоз
3. Фиброзная дисплазия
4. Лангергансоклеточный гистиоцитоз (ранее—гистиоцитоз X)
5. Папиллома
6. Периневральная опухоль
7. Параганглиома
8. Гемангиома
II. Доброкачественные опухоли среднего уха:
1. Аденома
2. Менингиома
3. Хордома
4. Параганглиома
5. Гемангиоперицитома
6. Шваннома
III. Доброкачественные опухоли внутреннего уха/верхушки пирамиды:
1. Параганглиома
2. Липома
3. Шваннома
4. Гемангиома
5. Гемангиоперицитома
6. Холестериновая киста верхушки пирамиды (прежнее название — гранулема)
7. Опухоль эндолимфатического мешка
Наряду с акустической невриномой, гломусная опухоль является наиболее часто встречающейся опухолью в практике современных отонейрохирургов. К счастью, рак височной кости встречается редко.
В целом доброкачественные опухоли височной кости развиваются медленно и постепенно, с минимальными жалобами до тех пор, пока опухоль не начнет прогрессировать. Динамика этих поражений может быть настолько медленной, что неврологическая симптоматика компенсируется, и поэтому может быть не замечена пациентом. В конечном счете эти поражения приводят к поражению черепно-мозговых нервов, что вызывает тугоухость, вестибулярную дисфункцию, нарушение глотания, дисфагию с нарушением функции языка, парез лицевого нерва и офтальмологические нарушения. Доброкачественные опухоли в области яремного отверстия могут также вызвать иррадиирующую оталгию, дисфагию, лицевые или головные боли.
Доброкачественные опухоли височной кости концептуально хорошо представлены гломусными опухолями, диагностика и лечение которых применимы к более редким поражениям.
В любом случае пациентам с оталгией, кровавыми или слизисто-гнойными выделениями из уха, длительно текущим наружным отитом, с поражением/грануляциями в наружном слуховом проходе или прогрессирующим поражением черепно-мозговых нервов, особенно в пожилом возрасте и с длительным анамнезом хронического среднего отита, должна выполняться срочная биопсия. Мы рассматриваем злокачественные новообразования здесь только для дифференциации их от доброкачественных опухолей.
Тактика как при доброкачественных, так и злокачественных заболеваниях зависит от их типа и распространенности. Сложные решения используются только в случае осложнений. Полное удаление опухоли имеет первостепенное значение и, если это возможно, должно быть выполнено достаточно гибко, с разумным сохранением жизненно важных структур. Когда это считается невозможным, тактика реконструкции дефектов черепа и черепно-мозговых нервов должна быть тщательно спланирована еще до операции. Далее за обсуждением конкретных опухолей следует изложение концепции лечения при доброкачественных поражениях на примере гломусных опухолей.
Кафедра оториноларингологии Российского университета Дружбы народов, Москва
Кафедра челюстно-лицевой хирургии и хирургической стоматологии Российского национального медицинского университета им. Н.И. Пирогова Минздравсоцразвития России, Москва
Кафедра оториноларингологиии Российского университета дружбы народов, Москва, Россия, 117198
Этиология и патогенез гломусных опухолей (хемодектом) основания черепа
Журнал: Вестник оториноларингологии. 2016;81(3): 26‑29
Цель работы — описать историю развития этиологии и патогенеза гломусной опухоли (хемодектомы) основания черепа. В работе приведены хронологические таблицы развития исследований этиологии, патогенеза, хирургического лечения при данном заболевании, анализ и обсуждение спорных мест номенклатуры.
Локализация и функции гломусов головы и шеи
В 1941 г. S. Guild [1] описал сосудистую ткань на луковице яремной вены и на мысе улитки, которую он назвал гломусной тканью. Новообразования, которые возникали из этой ткани, в различные периоды времени получали название рецептом, хемодектом, нехромафинных опухолей, экстраадреналовых гломусных опухолей, а также опухолей, напоминающих каротидное тельце (carotidbodyliketumors).
Гломусная опухоль (хемодектома) — это новообразование из органов эндокринной системы, которые способны продуцировать биогенные амины, а также выполнять хеморецепторную функцию — реагировать на изменения концентрации О 2 , СО 2 и рН крови и передавать информацию об этом в бульбарные центры головного мозга [2, 3]. Гломусы имеют общее происхождение с мозговым слоем надпочечника и возникают из эмбриональных симпатических клеток нервной ткани [4]. Другими словами — это совокупность нейроэктодермальных клеток экстраадреналовой локализации. На этапе внутриутробного развития данная система как эндокринный орган функционирует до тех пор, пока не завершится формирование мозгового вещества надпочечников — основного источника катехоламинов. Функции клеток гломусов идентичны таковым в мозговом веществе надпочечников. Как и надпочечники, они могут содержать катехоламины и выделять их по изменениям нейрональных или химических сигналов наподобие обычных эндокринных органов.
Самым крупным органом из этой группы принято считать само мозговое вещество надпочечника, вторым по размеру — аортальный гломус [4]. Остальные гломусы, локализация которых представлена в табл. 1, имеют значительно меньшие размеры в пределах 0,6—4 мм в диаметре.

Таблица 1. Гломусные опухоли (хемодектомы) и места их исходного роста в организме человека
Таким образом, гломусные опухоли (хемодектомы) могут возникать во всех местах нервной системы. Остановимся только на тех, которые локализуются в области головы и шеи.
Блуждающие, яремные и барабанные гломусы представляют собой цепочку, идущую по ходу ветвей языкоглоточного и блуждающего нервов с локализацией:
— в области нижнего, среднего и верхнего узлов блуждающего нерва;
— в адвентиции луковицы яремной вены;
— в области мыса улитки;
— по ходу барабанной ветви IX нерва (нерва Якобсона);
— по ходу заднеушной ветви X нерва (нерва Арнольда).
История изучения и проблемы терминологии
История исследования опухолей, растущих из гломусов основания черепа, сравнительно невелика. Впервые барабанный и яремный гломус описал в 1941 г. S. Guild [1]. Опухоль, возникающую из них, впервые обнаружил в 1945 г. H. Rosenwasser [5].
С момента первого описания опухоли ее название неоднократно изменялось. До настоящего времени специалисты, занимающиеся этой патологией, называют ее по-разному. Часто при микроскопии ставят диагноз гемангиомы [6, 7]. В хронологической последовательности история терминологии гломусных опухолей представлена в табл. 2 [8].

Таблица 2. Хронология изменения терминов гломусных опухолей
Название хемодектомы или рецептомы предполагает функциональную роль гломусов только в качестве рецепторных образований.
Однако установлено, что помимо рецепторной функции, они обладают эндокринной активностью и могут секретировать биологически активные вещества, например катехоламины или серотонин. Немаловажным моментом может являться то, что с этими опухолями имеют дело и общие хирурги-онкологи, и сосудистые хирурги, и оториноларингологи [9], которые в своих работах чаще всего обозначают их как гломусные или хемодектомы. Термин «параганглиома» для них достаточно редкий. Однако иногда гломусными опухолями называют новообразования барорецепторов (тельца Барре—Масона и т. д.) [9], не имеющих отношения к симпатико-адреналовой системе. Термин «нехромаффинная параганглиома», периодически используемый и сейчас, основан на реакции осаждения солей хромовой кислоты клетками опухоли, что дает возможность судить о наличии или отсутствии их симпатической активности. В настоящее время эта реакция представляет только исторический интерес. Соответственно, устарел и термин.
Деление гломусных опухолей (хемодектом) по классификации ВОЗ на симпатические и парасимпатические представляется недостаточно обоснованным, поскольку не учитывается возможность существования неактивных форм. Могут существовать также опухоли, секретирующие множество биогенных аминов, как относящихся к парасимпатическому или симпатическому отделу нервной системы, так и не относящихся ни к одному из них.
Другая часть термина указывает либо на исходную локализацию (яремная, барабанная или вагусная гломусная опухоль), либо на зону поражения — среднее ухо, сосцевидный отросток или блуждающий нерв) [5].
Даже при небольшом объеме новообразования поражаются как пирамида височной кости, так и яремное отверстие. У многих больных зона распространения захватывала основание черепа, верхние отделы шеи, а также головной мозг. Поэтому имеет смысл остановиться на термине гломусная опухоль (хемодектома). Например, гломусная опухоль (хемодектома) основания черепа с ростом в заднюю черепную ямку или с распространением в заднюю черепную ямку и паравертебрально. Исходную локализацию при распространенной опухоли можно определить на основании детального анализа хронологии симптомов заболевания [10].
Этиология гломусных опухолей
Этиология гломусных опухолей (хемодектом) основания черепа в настоящее время неизвестна. Анализ данных литературы, а также собственных наблюдений показал, что в 75% наблюдений этим заболеванием страдают лица женского пола в возрасте 40—45 лет. Вероятно, этиологическим моментом служит перестройка гормональной системы организма. В молодом возрасте фактором, вызывающим рост опухоли, может явиться беременность. В возрасте 20—30 лет чаще встречаются гормонально-активные формы.
Если сделать небольшой экскурс в историю, то можно вспомнить, что существуют уницентрическая [11] и мультицентрическая теории возникновения опухолей [12]. По первой теории, новообразование под воздействием различных онкогенов может возникать из одного зачатка, в частности из гломуса. Согласно второй, онкогенный фактор может быть общим для нескольких гломусов сразу. Возможно, этим фактом объясняется наличие множественных фopм опухолей [13—18], двусторонних яремных гломусных опухолей, сочетание опухоли яремного гломуса с забрюшинной феохромоцитомой, диссеминированных форм и т. д. [19]. Гломусные опухоли могут сочетаться с невриномой слухового нерва [20]. Описан единственный случай сочетания гломусной опухоли (хемодектомы) с арахноидальной кистой задней черепной ямки [21]. Иногда гломусные опухоли могут быть первично-множественными. Первично-множественные гломусные опухоли (хемодектомы) бывают синхронными и метахронными. Первично-множественные синхронные новообразования в пределах височной кости и основания черепа могут восприниматься как один распространенный процесс, а первично-множественные метахронные новообразования этой локализации — как рецидив опухоли после ранее возникшего удаленного очага [10, 12, 13, 18].
Некоторые исследователи связывают образование гломусных опухолей с хронической гипоксией. При ней наблюдалась гипертрофия гломусов в ответ на длительную кислородную недостаточность [22], например при врожденных пороках сердца.
Генетический аспект гломусных опухолей
Имеются данные о роли наследственного фактора в возникновении гломусных опухолей, передача которого происходит по аутосомно-доминантному типу [23]. Существует семейные формы этих опухолей [24, 25], составляющие, по данным литературы, менее 1—2% от общего числа наблюдений.
Анализ генома хемодектом выявил значительную разницу между наследственными и спорадическими опухолями по наличию или отсутствию хромосомы 11q23 соответственно. Другими словами, если наличие данной хромосомы установлено, то гломусные опухоли (хемодектомы) могут передаваться по наследству. Если ее нет, то опухоль, если когда-нибудь возникнет, то спорадически, как и любое другое новообразование. Таким образом, ранняя идентификация 11q23 может служить индикатором наследственного фактора онкогенеза данного вида опухолей [26, 27].
В заключение следует отметить, что гломусные опухоли (хемодектомы) основания черепа были описаны сравнительно недавно — в 1945 г. Они возникают из гломусов, расположенных в среднем ухе или яремной ямке, и относятся к экстраадреналовой эндокринной системе. Способны реагировать на изменения концентрации СО 2 , информируя об этом бульбарные центры головного мозга, а также продуцировать биогенные амины. Могут расти как экстра-, так и интракраниально. Возникают в период эндокринных изменений организма. Причиной также могут служить хроническая гипоксия и наследственная предрасположенность. О наследственном характере хемодектом можно судить только в тех случаях, если больному меньше 18 лет, а также в случае билатеральных или множественных опухолей и положительного тестирования на указанные выше гены. Наследование происходит по аутосомно-доминантному типу. Тестирование на определенные гены позволяет определить спорадический или генетически детерминированный характер гломусной опухоли (хемодектомы).
ЛОР-клиника Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского, Москва
Кафедра болезней уха, горла и носа Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия, 119991
Отдел заболеваний уха, лаборатория патологической анатомии ЛОР-органов НКЦ оториноларингологии ФМБА России
Кафедра болезней уха, горла и носа Первого МГМУ им. И.М. Сеченова, Москва, Россия, 119991
Опыт хирургического лечения гломусных опухолей
Журнал: Вестник оториноларингологии. 2017;82(1): 15‑19
Цель исследования — определить особенности хирургического лечения и послеоперационного ведения пациентов с различными типами гломусной опухоли. Представлен опыт хирургического лечения 15 пациентов с гломусной опухолью височной кости различной степени распространенности и локализации. Сделан вывод о том, что объем дообследования и хирургического лечения зависит от распространенности новообразования. При опухолях типа В, С, D перед операцией необходимо выполнение эмболизации питающих сосудов.
Гломусные опухоли также известны как параганглиомы височной кости [1]. Это доброкачественные, медленно растущие, обильно васкуляризованные, локально инвазивные новообразования, развивающиеся из клеток паранганглиев, ассоциированных с симпатическими и парасимпатическими ганглиями. В области височной кости гломусные опухоли чаще всего локализуются в области луковицы яремной вены, а также на промонториальной стенке барабанной полости, исходя из тимпанального сплетения. Среди доброкачественных новообразований среднего уха гломусные опухоли занимают второе место после невриномы преддверно-улиткового нерва.
Анатомы и патоморфологи описывали гломусные тельца достаточно давно. В 1840 г. G. Valentin [2] в своих работах упоминает «ganglia tympanica», скопление хромаффинных клеток на промонториальной стенке барабанной полости. В 1878 г. W. Krause описал эту ткань как «glandulatympanica» (цит. по [3]). Позже S. Guild на большом гистологическом исследовании секционных образцов височных костей описал до 12 «гломусных формирований» вдоль хода нерва Якобсона в каждом ухе: они имели тенденцию группироваться в пределах барабанных канальцев, на базальном завитке улитки и в костном канале ниже processus cochleariformis и сухожилия мышцы, напрягающей барабанную перепонку [4]. Гломусную опухоль как гиперплазию гломусных телец впервые представил P. Masson [3] в 1924 г. В 1945 г. H. Rosenwasser [5] впервые описал пациента с диагностированной яремной гломусной опухолью. При этом H. Rosenwasser был первым, признавшим происхождение этих новообразований от гломусных телец луковицы яремной вены, и впервые предложил хирургическую технику удаления яремной гломусной опухоли. В дальнейшем F. Capps [6] выполнил мобилизацию и смещение лицевого нерва, окклюзию сигмовидного синуса и лигирование внутренней яремной вены на шее. M. Shapiro и D. Neues [7] при описании операции по удалению яремного гломуса, которая включала в себя мастоидэктомию, транспозицию лицевого нерва кпереди, лигирование внутренней яремной вены и снабжающих опухоль артериальных разветвлений на шее, подчеркивали значение управляемой гипотензии и гипотермии, предотвращающие неконтролируемое интраоперационное кровотечение.
Гломусные тельца или нехромаффинные параганглии — нормальные компоненты диффузной нейроэндокринной системы, сопровождающие черепномозговые нервы [2, 8, 9]. Функция большинства параганглиев, находящихся в голове и шее, неясна; существует одно исключение — каротидное тело, являющееся хеморецептором. Гломусные тельца среднего уха (glomustympanicum) также могут служить хеморецепторами, обеспечивающими регулирование перепадов давления в морфологических и анатомических структурах среднего уха [10]. В височной кости гломусные тельца сопровождают барабанный (или Якобсонов) нерв, ветвь языкоглоточного нерва, нерв Арнольда, ушную ветвь блуждающего нерва [8]. Паренхима параганглиев состоит из двух типов первичных клеток. Клетки I типа являются более распространенными и, как правило, круглыми с нечеткими границами. Клетки II типа имеют меньшие размеры и неправильную форму.
Большинство параганглиом основания черепа обнаруживаются по ходу барабанной ветви IX пары черепных нервов в адвентиции луковицы яремной вены (так называемый «яремный гломус»), в барабанных канальцах или по ходу малого каменистого нерва. Приблизительно 1—3% параганглиом производят катехоламины и могут быть локально инвазивными, но редко метастазируют [1, 11, 12]. Тимпанальные гломусные опухоли — параганглиомы среднего уха, растут из нерва Якобсона [13]. Термин «яремно-тимпанальный гломус» может быть использован, когда опухоль настолько большая, что нет возможности определить, откуда она исходит, или когда яремная гломусная опухоль распространяется в среднее ухо [14]. Новообразования обнаруживаются в 2—5 раз чаще у женщин, чем у мужчин [13].
Наследственной форме гломусной опухоли присущ аутосомно-доминантный тип наследования. Параганглиомы головы и шеи могут быть единственными или множественными. Множественные опухоли, как правило, встречаются при наследственных формах (в 30—40% наследственных случаев) [15].
Описано озлокачествление опухоли, что, вероятно, связано с мутациями генов P53 и p16INK4A [18]. Метастазирование гломусных опухолей при этом происходит примерно в 4% случаев [17,18]. Пропорциональное уменьшение доли клеток II типа и более слабое окрашивание клеток типа I, как было изучено, коррелируют с увеличением степени дифференцировки опухоли. Метастатическое поражение отличается от многоцентрового поражения в зависимости от местоположения. Метастазы обнаруживаются в легких, лимфатических узлах, печени, позвонках, ребрах и селезенке.
Этиология гломусных опухолей до сих пор остается неизвестной [14]. Однако анализ литературы, посвященной изучению спорадических случаев опухолей каротидных телец, показал более частое их распространение у людей, живущих на больших высотах над уровнем моря, и у людей с хронической обструктивной болезнью легких. Таким образом, в этиологии данных новообразований важную роль может играть хроническая гипоксия [19].
В настоящее время используются две обширные классификации гломусных опухолей, по Glasscock—Jackson [20] (табл. 1) и U. Fisch и D. Mattox [21] (табл. 2).

Таблица 1. Классификация по Glasscock—Jackson (1982 г.)

Таблица 2. Классификация по U. Fisch и D. Mattox (1988 г.)
«Золотым стандартом» лечения параганглиом является их хирургическое удаление, что особенно важно в ранние сроки опухолевого процесса, когда можно не только полностью удалить новообразование, но и улучшить качество жизни пациента, восстановив слух. Еще одним направлением лечения гломусных опухолей является лучевая терапия (гамма-нож). При отсутствии возможности полного удаления опухоли возможно сочетание хирургии и радиотерапии, замедляющей рост образования. При наличии противопоказаний к операции проводится только лучевая терапия [12, 17, 18].
Цель исследования — определить особенности хирургического лечения и послеоперационного ведения пациентов с различными типами гломусной опухоли.
Пациенты и методы
В клинике болезней уха, горла и носа Первого МГМУ им. И.М. Сеченова с 2014 г. по настоящее время находились 15 пациентов с гломусными опухолями среднего уха/височной кости типов А, В и С в возрасте от 27 до 63 лет (средний возраст — 47,2±11,6 года), 2 мужчин и 13 женщин. Распределение пациентов по распространенности новообразования в соответствии с классификацией U. Fisch и соавт. в модификации M. Sanna (2005 г.) представлено в табл. 3.

Таблица 3. Распределение пациентов по типу гломусной опухоли (классификация по U. Fisch, 1988)
Давность заболевания составляла от 2 до 8 лет (в среднем 5 лет). Частота встречаемости различных клинических проявлений гломусной опухоли у обследованных пациентов представлена в табл. 4.

Таблица 4. Клиническая симптоматика гломусных опухолей
Отоскопически выявлялось пульсирующее образование ярко-розового или красного цвета, прилежащее к барабанной перепонке, в некоторых случаях (3 пациента) барабанная перепонка отсутствовала, а новообразование выбухало в просвет слухового прохода.
При опухоли типа, А в дообследование включали МСКТ височных костей, а также аудиологическое исследование. При большей распространенности новообразования (тип В, С, D) всем пациентам обязательно проводили МСКТ и МРТ височных костей с контрастированием. Пример МРТ представлен на рисунке.
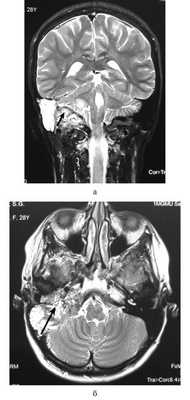
МРТ основания черепа. Гломусная опухоль c распространением в заднюю черепную ямку (стрелки). а — коронарная проекция; б — аксиальная проекция.
В некоторых случаях для уточнения взаимоотношений новообразования с внутренней сонной артерией проводили КТ или МР-ангиографию. Также пациенты были консультированы неврологом, отоневрологом и нейрохирургом. При опухолях типа В, С, D за сутки до предполагаемой операции выполняли селективную эмболизацию сосудов, питающих новообразование.
Результаты и обсуждение
В подавляющем большинстве случаев (14 пациентов) кровоснабжение опухоли осуществлялось из нескольких источников, преимущественно за счет ветвей восходящей глоточной и затылочной артерий. У 2 пациентов дополнительным источником кровоснабжения являлись ветви позвоночной артерии. У всех пациентов удалось добиться эмболизации всех ветвей, питающих опухоль, что позволило минимизировать интраоперационную кровопотерю, максимальный объем которой не превышал 500 мл. Кроме того, в ходе ангиографии уточнялись взаимоотношение новообразования с внутренней сонной артерией, аномалии строения последней, возможные дополнительные источники кровоснабжения из системы внутренней сонной артерии, проходимость внутренней яремной вены, сигмовидного синуса, а также исключали многоочаговость опухоли.
На этапе хирургического лечения проводили ревизию барабанной полости, при этом во всех случаях использовался заушный подход. При необходимости для лучшей визуализации гипотимпанума выполняли каналопластику, включающую снятие костных навесов, ограничивающих необходимый обзор. После удаления новообразования коагулировали питающие сосуды, располагавшиеся на промонториальной стенке или в области гипотимпанума. Оссикулярная система среднего уха у всех пациентов была интактна. В 4 случаях возникла необходимость проведения мирингопластики в связи с прорастанием новообразования в барабанную перепонку. При опухоли типа В дополнительно проводили вскрытие клеток сосцевидного отростка. При наличии гломусной опухоли яремной вены выполняли заушный разрез с переходом на шею, отступя 6 см от переходной складки с формированием надкостничного лоскута. После вскрытия всех клеток сосцевидного отростка, обнажения лицевого нерва с его последующим отведением кпереди выделяли и перевязывали яремную вену. Сигмовидный синус обнажали, перевязывали, а также дополнительно тампонировали с помощью гемостатических материалов. После перевязки сосудов новообразование удаляли вместе с частью яремной вены и сигмовидного синуса. У двух пациентов была обнаружена деструкция лицевого нерва гломусной опухолью на протяжении тимпанального и мастоидального отделов. В этом случае выполняли вставку фрагментов n. suralis или n. auriularis magnus. У одного пациента через 6 мес наблюдали постепенное восстановление функции лицевого нерва. Во втором случае отмечали слабую положительную динамику в виде уменьшения асимметрии лица в покое, что связано с длительным сроком пареза лицевого нерва до операции (более 2 лет).
При опухоли типа C во всех случаях новообразование интимно прилежало к твердой мозговой оболочке задней черепной ямки, в некоторых случаях при выделении опухоли отмечали линейные разрывы последней (5 пациентов). Проводили закрытие твердой мозговой оболочки фасцией височной мышцы с дополнительной герметизацией с помощью клея BioGlue («CryoLife, Inc.»). После чего послеоперационную полость заполняли жировой аутотканью, взятой с передней брюшной полости. У двух больных в послеоперационном периоде отмечали ликворею, которая в одном из случаев на 5-е сутки купировалась самостоятельно, в другом случае потребовалась установка люмбального дренажа, который был удален через 5 сут.
В послеоперационном периоде всем пациентам проводили антибиотикотерапию, системную гормональную терапию, симптоматическое лечение.
У пациентов с опухолью типа С и D (8 случаев) в послеоперационном периоде наблюдали парез лицевого нерва II — V степени по шкале Хаус—Брэкман. В послеоперационном периоде данной группе больных проводили лейкопластырное натяжение, лечебную гимнастику. Постепенное восстановление функции наблюдали в сроки от 10 дней до 7 мес.
Заключение
Гломусная опухоль, являясьдоброкачественной, обладает инвазивным ростом и может вызывать поражение черепных нервов, внутренней сонной артерии, головного мозга. До сих пор дискутабельным является преимущественный метод лечения данной группы новообразований, однако только с помощью хирургического лечения можно добиться полного удаления опухоли. Трудность локализации, близость к жизненно важным сосудисто-нервным образованиям, высокая степень васкуляризации, возможность распространения в полость черепа требуют мультидисциплинарного подхода с участием нейрохирургов, сосудистых хирургов, а также всестороннего предоперационного обследования данной группы пациентов и проведения эмболизации питающих сосудов. Не менее важным является выявление новообразования на ранней стадии и своевременное направление пациентов в высокоспециализированные стационары, для чего необходимо повышение информированности врачей поликлинического звена о данной патологии.
Конфликт интересов: авторы статьи подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Читайте также:
