Краниоцеребральная гипотермия. Эффекты краниоцеребральной гипотермии
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Целью данной работы является оптимизация нутритивной поддержки пациентов в остром периоде ишемического инсульта в процессе комплексной терапии с применением краниоцеребральной гипотермии (КЦГ). В исследование были включены 27 пациентов с ишемическим инсультом, разделенных на две группы. В первой группе (n = 14) наряду с общепринятой комплексной терапией применялась КЦГ, во второй, контрольной группе, КЦГ не применялась. У пациентов проводилось динамическое исследование REE, RQ, суточных потерь белков. В ходе исследования было выявлено достоверное снижение REE на 17-19 % у пациентов в процессе КЦГ на фоне снижения температуры головного мозга на 3-4 °С и неизменной базальной температуры. Впоследствии REE после процедуры согревания возвращался к исходному уровню. Потери белков снижались на 26-28 %, при этом после процедуры согревания данный показатель оставался ниже, чем у пациентов контрольной группы. Полученные данные необходимо учитывать при назначении нутритивной поддержки у пациентов с КЦГ с целью избегания гипералиментации, гипергликемии, что может увеличивать объем вторичных повреждений головного мозга.
Ключевые слова
Об авторах
ФГАОУ ВО «Российский университет дружбы народов»; ГБУЗ «Городская клиническая больница имени В.В. Виноградова» Департамента здравоохранения г. Москвы
Россия
ФГБНУ «Федеральный научно-клинический центр реаниматологии и реабилитологии»; ФГАОУ ВО «Российский университет дружбы народов»
Россия
ГБУЗ «Городская клиническая больница имени В.В. Виноградова» Департамента здравоохранения г. Москвы
Россия
ГБУЗ «Городская клиническая больница имени В.В. Виноградова» Департамента здравоохранения г. Москвы
Россия
Список литературы
1. Drury P., Levi C., Mc/nnes E et al. Management of fever, hyperglycemia, and swallowing dysfunction following hospital admission for acute stroke in New South Wales, Australia. Int J Stroke 2014; 9: 23-31.
2. Prasad K., Krishnan P. R. Fever is associated with doubling of odds of short-term mortality in ischemic stroke: an updated meta-analysis. Acta Neurol Scand 2010; 122: 404-8.
3. George Ntaios, Tomasz Dziedzi, Patrik Michel, Vasileios Papavasileiou, Jesper Petersson, Dimitre Staykov, Brenda Thomas, and Thorsten Steiner. European Stroke Organisation (ESO) guidelines for the management of temperature in patients with acute ischemic stroke. 2015; 1.
4. Karaszwski B., Wardlaw J. M., Marshall / et al. Early brain temperature elevation and anaerobic metabolism in human acute ischaemic stroke. Brain, 2009, v. 132, p. 955-964.
5. Van der Worp H. B., Sena E. S., Donnan G. A., Howells D. W., Macleod M. R. Hypotermia in animal models of acute ishaemic stroke: a systematic review and meta-analysis. Brain 2007; 130: 3063-74.
6. Шевелев О. А., Бутров А. В., Ходоро-вич Н. А., Смоленский А. В., Каленова И.Е, Бояринцев В. В., Чебоксаров Д. В., Шаринова И. А., Аржадеев С. А. / Краниоцеребральная гипотермия. Теория и практика / Методические рекомендации. Москва, Криотехномед, 2017
7. Arthur RH van Zanten, MD Ph D. Therapeutic hypothermia: Still a place? Metabolic effects. 9.50 AM, Friday 21 March 2014, Copper Hall, Brussels /S/CEM. Материалы конференции.
Краниоцеребральная гипотермия. Эффекты краниоцеребральной гипотермии
ФГАОУ ВО «Российский университет дружбы народов» Министерства науки и высшего образования России, Москва, Россия
ФГАОУ ВО «Российский университет дружбы народов», Москва, Россия
ФГАОУ ВО «Российский университет дружбы народов» Министерства науки и высшего образования России, Москва, Россия;
ФГБНУ «Федеральный научно-клинический центр реаниматологии и реабилитологии», Москва, Россия
ГБУЗ «Городская клиническая больница имени В.В. Виноградова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Городская клиническая больница имени В.В. Виноградова» Департамента здравоохранения Москвы, Москва, Россия
ФГБНУ «Федеральный научно-клинический центр реаниматологии и реабилитологии», Москва, Россия;
ФГБУ «Клиническая больница №1» Управления делами Президента РФ, Москва, Россия
ФГБНУ «Федеральный научно-клинический центр реаниматологии и реабилитологии», Москва, Россия;
ФГБУ «Клиническая больница №1» Управления делами Президента РФ, Москва, Россия
Краниоцеребральная гипотермия — эффективное средство нейропротекции у пациентов с инфарктом мозга
Журнал: Анестезиология и реаниматология. 2018;(3): 58‑63
ФГАОУ ВО «Российский университет дружбы народов» Министерства науки и высшего образования России, Москва, Россия
Инфаркт мозга является одной из основных причин смерти и инвалидизации работоспособного населения России, и до настоящего времени в мире нет препаратов с доказанным нейропротективным эффектом. Цель исследования — оценить клиническую эффективность краниоцеребральной гипотермии (КЦГ) в остром периоде инфаркта мозга и ее влияние на результаты лечения в отдаленном периоде. Материал и методы. В исследование включены 113 пациентов с диагнозом «инфаркт мозга», которых распределили на четыре группы. 1-я А группа (n=20), основная — пациенты с легкой и средней степенью неврологических нарушений (по шкале NIHSS 8—12 баллов), которым наряду со стандартной фармакотерапией в 1-е сутки лечения начинали сеанс КЦГ; 1-я Б группа (n=8), контрольная — пациенты с аналогичной степенью неврологических нарушений, которым проводили стандартную фармакотерапию без КЦГ; 2-я А группа (n=39), основная — пациенты с тяжелыми неврологическими нарушениями и нарушениями крайней степени тяжести (по шкале NIHSS 13 баллов и более), которым наряду со стандартной фармакотерапией в 1-е сутки лечения начинали сеанс КЦГ; 2-я Б группа (n=36), контрольная — пациенты с аналогичной степенью неврологических нарушений, которым проводили стандартную фармакотерапию без КЦГ. Для оценки температуры головного мозга использовали неинвазивный компьютеризированный диагностический радиотермометр РТМ-01-РЭС, позволяющий регистрировать среднюю температуру в объеме тканей. Степень неврологического дефицита исследовали по шкале NIHSS, степень инвалидизации на 90-й день от начала заболевания — по модифицированной шкале Рэнкина. Результаты. У пациентов основных групп отмечено выраженное уменьшение уровня неврологического дефицита в остром периоде уже через 24 ч от начала проведения КЦГ (p
Известно, что гипертермия осложняет течение острого периода ишемического инсульта (ИИ) [1, 2] и является предиктором неблагоприятного исхода заболевания [3, 4]. Повышение базальной температуры при тяжелой нейротравме и остром нарушении мозгового кровообращения приводит к увеличению смертности в 2—3 раза [3, 5]. При этом локальное повышение температуры в зоне пенумбры при инфаркте мозга даже без значительных изменений базальной температуры ведет к увеличению объема вторичных повреждений [6, 7]. Применение терапевтической гипотермии является перспективным в коррекции общей и церебральной гипертермии, однако результаты исследований до настоящего времени не представляют собой достаточную доказательную базу.
В ходе исследований показано, что в результате быстрой инфузии холодного кристаллоидного раствора у пациентов значительно улучшались показатели неврологического дефицита по шкале оценки тяжести инсульта NIHSS без нарастания основных побочных эффектов [8]. Высказывалось предположение, что для уменьшения отека головного мозга, чаще всего возникающего в течение первых 72 ч от начала клинических проявлений, может потребоваться более длительная гипотермия (48—72 ч), но рост числа осложнений, связанный с увеличением длительности охлаждения, ограничивал применение методов общего охлаждения организма [9, 10]. В определенной степени проблему мог решить метод селективной краниоцеребральной гипотермии (КЦГ). В ряде отечественных работ показано снижение неврологического дефицита при применении КЦГ у пациентов в остром периоде развития инфаркта мозга, однако данных об улучшении функционального результата в отдаленном периоде не получено [12—14].
В связи с неоднозначными результатами применения гипотермии при И.И. Европейская ассоциация по борьбе с инсультом предложила провести контролируемые рандомизированные исследования и контролируемые клинические испытания для обеспечения статистически значимой доказательной базы [5]. В этих целях в 2014 г. организовано многоцентровое исследование эффективности терапевтической гипотермии при ИИ (программа EuroHyp-1) [11]. Евросоюзом на проведение исследования выделено 11 млн евро, и в нем участвуют сотрудники крупных клиник 20 стран Европы. Результаты этого исследования могут оказаться чрезвычайно важными, поскольку данные об эффективности терапевтической гипотермии при острой фокальной ишемии головного мозга противоречивы.
Цель исследования — оценить клиническую эффективность КЦГ в остром периоде инфаркта мозга и ее влияние на результаты лечения в отдаленном периоде.
Материал и методы
В исследование включены 113 пациентов с диагнозом «инфаркт мозга», находившихся на стационарном лечении в ГБУЗ «Городская клиническая больница имени В.В. Виноградова» департамента здравоохранения города Москвы в 2015—2017 гг.
Критериями включения пациентов в исследование служили: давность заболевания не более 24 ч от начала клинических проявлений; диагноз «инфаркт мозга», подтвержденный методами нейровизуализации; степень неврологического дефицита по шкале NIHSS более 8 баллов. Критериями исключения из исследования были: угрожающее жизни нарушение ритма сердца; терминальное состояние; кровотечение; внутримозговое кровоизлияние; субдуральная гематома; субарахноидальное кровоизлияние; степень инвалидизации по модифицированной шкале Рэнкина >2; температура тела ниже 36 °C, частота сердечных сокращений менее 50 ударов/мин, возраст более 80 лет.
Пациентов распределили на чеыре группы.
1-я, А группа (n=20), основная — пациенты с легкой и средней степенью неврологических нарушений (по шкале NIHSS 8—12 баллов), которым наряду со стандартной фармакотерапией в 1-е сутки лечения начинали сеанс КЦГ; 1-я Б группа (n=18), контрольная — пациенты с аналогичной степенью неврологических нарушений, которым проводили стандартную фармакотерапию без КЦГ; 2-я, А группа (n=39), основная — пациенты с тяжелыми неврологическими нарушениями и нарушениями крайней степени тяжести (по шкале NIHSS 13 и более баллов), которым наряду со стандартной фармакотерапией в 1-е сутки лечения начинали сеанс КЦГ; 2-я Б группа (n=36), контрольная — пациенты с аналогичной степенью неврологических нарушений, которым проводили стандартную фармакотерапию без КЦГ. Пациенты всех групп сравнимы по исходному уровню неврологического дефицита (по шкале NIHSS), уровню сознания (по шкале комы FOUR), возрасту и полу (табл. 1). Таблица 1. Характеристика исходных данных у обследованных больных Примечание. Данные представлены в виде среднего значения и среднего квадратичного отклонения (M±σ).
Следует отметить, что шкала комы FOUR имеет определенные преимущества перед шкалой комы Глазго у пациентов с неврологическими патологиями, а именно точнее детализирует неврологический статус, распознает синдром «запертого» человека, позволяет оценить рефлексы ствола мозга, дыхательный паттерн, выявляет различные стадии дислокации головного мозга. Шкала комы FOUR также предоставляет дополнительную информацию о прогнозе у больных с низким баллом по шкале комы Глазго. Вероятность внутрибольничного летального исхода выше у больных с наименьшим баллом по шкале FOUR, чем у пациентов с наименьшим баллом по шкале комы Глазго.
КЦГ выполняли при помощи специального гипотермического шлема аппарата терапевтической гипотермии АТГ-01 («КриоТехноМед», Россия), с помощью которого обеспечивали отведение теплоты от волосистой поверхности кожи головы, поддерживая температуру кожи на уровне 5—7 °С по стандартной методике [14]. По окончании сеанса проводили поэтапное согревание больных в течение 24 ч с повышением температуры шлема на 1 °C каждый час. В ходе исследования выявлено, что тактика жесткого планирования длительности сеанса неэффективна, так как в некоторых случаях после начала согревания у пациентов отмечалось возвращение неврологического дефицита, поэтому в дальнейшем избрали персонифицированный подход к определению длительности процедуры охлаждения и кратности сеансов охлаждения. Так, у крайне тяжелых пациентов общая длительность процедуры варьировала от 24 ч до 13 сут. В течение всего периода лечения в отделениях стационара проводили динамическую оценку уровня неврологического дефицита по шкале NIHSS. Уровень сознания оценивали по шкале комы FOUR.
Эффективность КЦГ оценивали по уровню летальности в течение всего периода наблюдений, по данным динамики изменения неврологического дефицита по шкале NIHSS в среднем на 20-й (20±5) день и степени инвалидизации по модифицированной шкале Рэнкина в среднем на 90-й (90±10) день от начала заболевания. Пациентам проводили динамический термомониторинг с регистрацией аксиллярной, тимпанической и церебральной температур. Для оценки температуры головного мозга использовали неинвазивный компьютеризированный диагностический радиотермометр РТМ-01-РЭС (ООО «Фирма РЭС», Россия), позволяющий регистрировать среднюю температуру в объеме тканей на глубине 5—6 см.
Для статистической обработки использовали стандартный пакет статистических программ SPSS, применяли общепринятые параметрические (t-критерий Стьюдента) и непараметрические (U-критерий Вилкоксона и критерий Манна—Уитни) методы статистики. Для оценки статистической значимости различий между процентными долями двух выборок использовали критерий Фишера. Для групп вычисляли среднее арифметическое (М), среднее квадратичное отклонение (σ) и уровень статистической значимости (р). Статистически значимыми считали различия результатов не менее 95%.
Результаты
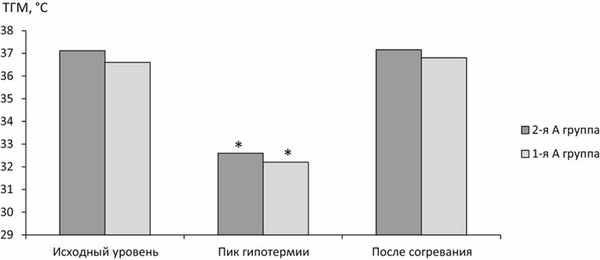
Усредненные по 18 областям измерений исходные параметры составили: у пациентов 1-й, А группы — 36,64±0,34 °С; 1-й Б группы — 36,79±0,27 °С; 2-й, А группы — 37,12±0,85 °С; 2-й Б группы — 37,24±1,19 °С. В результате применения КЦГ произошло статистически значимое снижение температуры головного мозга (рис. 1). Рис. 1. Динамика церебральной температуры у пациентов, получавших КЦГ. Примечание. * — различия при сравнении показателей с исходным уровнем статистически значимы (р<0,01). КЦГ — краниоцеребральная гипотермия; ТГМ — температура головного мозга.
Аксиллярная температура статистически незначимо снижалась от 36,62±0,11 до 36,57±0,21 °С и от 36,67±0,31 до 36,4±0,22 °С у пациентов 1-й, А и 2-й, А групп соответственно.
По данным табл. 3, увеличилась доля пациентов, которые в дальнейшем смогли вернуться к своим повседневным обязанностям. Низкая доля пациентов, имеющих на 90-й день 5 баллов по модифицированной шкале Рэнкина, объясняется недостатком ухода вне условий стационара, вследствие чего у данных пациентов возникали осложнения с дальнейшим летальным исходом. У пациентов с исходным уровнем неврологического дефицита 13 баллов и более, получавших КЦГ, отмечено статистически значимое снижение летальности по сравнению с пациентами, не получавшими КЦГ.
Основной причиной летальных исходов в остром и подостром периодах являлся нарастающий отек головного мозга, а в сроке 30 дней и более — тромбоэмболия легочной артерии и пневмония. У выписанных пациентов основными причинами смерти в течение 90 дней от начала заболевания были пневмония, повторное острое нарушение мозгового кровообращения и сахарный диабет в стадии декомпенсации.
В ходе исследования выявлено снижение степени неврологического дефицита у пациентов, которым проводили КЦГ как компонент комплексной терапии в остром периоде, что подтверждает нейропротективный потенциал терапевтической гипотермии у больных с данной патологией. Напомним, гипертермия является предиктором неблагоприятного исхода заболевания [3, 4]. При этом эффект наиболее выражен у пациентов с глубоким неврологическим дефицитом. Так, на 6-е сутки именно у пациентов 2-й, А группы отмечены наиболее значительное повышение уровня сознания и снижение неврологического дефицита. Данный факт можно объяснить уменьшением выраженности отека головного мозга у пациентов с тяжелой степенью заболевания. Можно предположить, что терапевтический эффект у пациентов 1-й, А группы обусловлен стабилизацией зоны пенумбры.
На 20-й день от начала заболевания у пациентов 2-й, А и 2-й Б групп в отличие от пациентов 1-й, А и 1-й Б групп не выявлено статистически значимых различий в среднем значении степени неврологического дефицита. Это объясняется отчасти небольшой выборкой, отчасти тем, что у пациентов 2-й Б группы с наиболее глубоким неврологическим дефицитом наступил летальный исход к 20-м суткам, в то время как наиболее тяжелые пациенты 2-й, А группы продолжали лечение в условиях стационара.
Целью нашего исследования являлась в том числе оценка эффективности метода КГЦ в отдаленном периоде, так как отдельные пациенты, перенесшие инфаркт мозга, погибают именно в данном периоде. Статистически значимое снижение степени инвалидизации по модифицированной шкале Рэнкина подтвердило гипотезу об эффективности метода КГЦ в комплексе со стандартной терапией. Следует отметить, что снижение данного показателя отмечалось не только за счет уменьшения числа пациентов (летальный исход), имевших 6 баллов по указанной шкале, но и вследствие увеличения доли пациентов с хорошим и удовлетворительным исходом.
Заключение
Применение краниоцеребральной гипотермии в комплексе со стандартной терапией в остром периоде инфаркта мозга позволяет снизить степень неврологического дефицита, повысить уровень сознания пациентов, уменьшить степень инвалидизации и летальность на 90-й день от начала лечения. Краниоцеребральную гипотермию можно оценить как эффективный метод лечения инфаркта мозга, однако определение длительности и кратности сеансов требует персонифицированного подхода на основе оценки состояния пациента и динамики его неврологического статуса. Метод можно рекомендовать для лечения инфаркта мозга в отделениях реанимации и интенсивной терапии.
Финансирование. Авторы заявляют об отсутствии финансовой поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Краниоцеребральная гипотермия vs общая гипотермия
В профессиональном медицинском сообществе сложилось предубеждение, что метод Общей Терапевтической Гипотермии (ОТГ), применяемый с целью нейропротекции, несмотря на многочисленные побочные эффекты и сложность проведения процедуры, предпочтительнее Краниоцеребральной Терапевтической Гипотермии (КЦГ). Команда «КриоТехноМед» ставит одной из целей своей деятельности развенчать этот миф и предоставить доказательства преимуществ методики КЦГ, которую можно воспроизводить на аппарате отечественного производства «АТГ-01».
Сила Холода
В настоящее время терапевтическая гипотермия является единственным доказанным методом нейропротекции после периода глобальной ишемии и эффективным способом борьбы с лихорадкой, существенно ухудшающей течение и исходы заболеваний, обусловленных острыми поражениями головного мозга (инсульты, черепно-мозговые травмы). В мировой практике доминирует применение общего охлаждения – Общая Терапевтическая Гипотермия (ОТГ) с помощью поверхностного отведения тепла или интракорпорального охлаждения крови.
Гипотермия как методика включена в «Методические рекомендации по проведению реанимационных мероприятий Европейского Совета по реанимации» (Euroreanimation-2010), а в развитых странах оснащенность клиник аппаратами общей гипотермии доходит до 80%. До настоящего момента оснащенность ими клиник России составляет менее 1%, и то, это импортные аппараты для общей гипотермии.
Долгожданная Альтернатива
Компания «КриоТехноМед» разработала более безопасную методику и оборудование краниоцеребральной гипотермии "АТГ-01". Его суть заключается в контролируемом охлаждении мозга путем отведения тепла от поверхности головы с помощью шлемов-криоаппликаторов. Благодаря этому снижается метаболизм нейронов, укрепляется прочность мембран клеток, уменьшается их потребность в кислороде, и это в результате делает клетки мозга более жизнеспособными.
Успешная пострегистрационная апробация АТГ-01 (2015 – 2018гг) — в 20 клиниках России и Казахстана пролечено более 5 000 пациентов
Наша технология позволяет 2-кратно уменьшить смертность при инсультах и снизить неврологический дефицит, в 1,5 раза сократить сроки пребывания в отделениях реанимации и качественно улучшить фармако-экономические показатели медицинской помощи.
Никаких эмоций и лирики, только факты
Мы бы хотели предоставить Вам доказательства того, почему КЦГ безопаснее, эффективнее и проще в эксплуатации.
Преимущество №1
Известно, что эффекты нейропротекции проградиентно нарастают по мере снижения температуры мозга, в частности, понижение температуры на 1°С обеспечивает повышение устойчивости нейронов к гипоксии и уменьшает потребление кислорода на 5-7%. Допустимый уровень понижения температуры тела ограничен диапазоном +32-35°С, что в первую очередь связано с риском развития осложнений со стороны сердечно-сосудистой системы (важно отметить, что допустимый уровень понижения температуры мозга существенно ниже - +29°С). Поэтому при ОТГ можно понизить температуру мозга не ниже базальной, то есть только на 3-5°С. Технология краниоцеребральной гипотермии (КЦГ) позволяет добиться понижения температуры мозга на 7-10°С (это допустимо), что кратно больше, чем при ОТГ и, соответственно, кратно эффективнее оказывается инициируемая нейропротекция.
Ссылки на подтверждающие исследования:
Влияние краниоцеребральной гипотермии на метаболизм у пациентов в остром периоде ишемического инсульта. Торосян Б.Д., Бутров А.В., Шевелев О.А., Чебоксаров Д.В., Артюков О.П. Медицинский алфавит. 2018. Т. 1. № 9 (346). С. 41-44.
Терапевтическая гипотермия как метод альтернативного прекондиционирования. Шевелев О.А., Петрова М.В., Саидов Ш.Х., Ходорович Н.К., Бочкина Н.С., Шевелева Е.О. Вестник неврологии, психиатрии и нейрохирургии. 2018. № 11. С. 50-59.
Преимущество №2
ОТГ в отличие от КЦГ по выше изложенным причинам не может охладить мозг до +25-27°С. А именно при этой температуре развивается обратимая депрессия метаболизма, сопровождающаяся выраженным подавлением сигнальных взаимодействий в головном мозге, падает биоэлектрическая активность по данным ЭЭГ, которые при согревании быстро восстанавливаются, как и способность к ауторегуляции мозгового кровотока.
Ссылки на подтверждающие исследования:
Eldadah BA., Faden AI., Caspase pathways, neuronal apoptosis, and CNS injury//J Neurotrauma, 2000, 17, 811-29
Преимущество №3
В области «полутени» при инсульте и нейротравме нарушается микроциркуляция, развивается отек, приводящий к компрессии мелких, средних и магистральных сосудов, в связи с чем доставка холодной крови при общей гипотермии затруднена в первую очередь к тем областям мозга, которые более всего нуждаются в понижении температуры. ОТГ не сможет эффективно решить эту проблему.
Преимущество №4
При ишемическом инсульте в области ядра инсульта и «полутени» развивается воспаление, формируются области с предельно высоким теплообразованием – локусы «пожара обмена», очаговая гипертермия, в результате чего температура отдельных участков мозга достигает критических значений – до +41°С и выше и, практически всегда превышает базальную температуру. В этих условиях недостаточный локальный кровоток не может обеспечить эффективную конвекцию и отведение тепла от разогретых участков мозга. Понижение температуры осуществляется за счет теплопроведения, то есть энергия теплоты передается от относительно разогретых участков мозга – к более холодным. Данный тип теплопередачи значительно менее эффективен, чем конвекционный, а тепловой поток зависит от теплопроводности и теплоемкости тканей, уровня метаболической активности в очаге и Δt°С теплый/холодный, которая в условиях ОТГ не велика.
Ссылки на исследования:
Eldadah BA., Faden AI., Caspase pathways, neuronal apoptosis, and CNS injury//J Neurotrauma, 2000, 17, 811-29
Bokesch PM., Halpin DP., Ranger WR. e/a/ Immediate –early gene expression in ovine brain after hypothermic circulatory arrest: effects of aptiganel//Ann Thorac Surg, 1997, 64, 1082-7
Преимущество №5
В отличие от КЦГ применение ОТГ требует обязательной глубокой седации, применения ИВЛ и препаратов, блокирующих эндогенные механизмы терморегуляции и мышечную дрожь.
Какие здесь минусы?
Во-первых, инструментальное и фармакологическое сопровождение ОТГ делает её неприемлемой в случаях развития ишемического инсульта средней тяжести, когда пациент находится в сознании, а глубокая седация делает невозможным контроль неврологического статуса пациента. В тоже время, это большая группа больных, требующая проведения нейропротективной терапии, и, что особенно важно, наиболее перспективная в части позитивного неврологического прогноза течения заболевания.
Во-вторых, помимо того, что эти процедуры нужно качественно выполнить, это серьезные финансовые затраты.
Ниже приведен только один пример фармакологического сопровождения (не считая расходные материалы, трудовые затраты и пр.). Как правило, в отделении реанимации и интенсивной терапии для больных с ОНМК используются медикаментозные методы коррекции температуры тела человека с использованием препаратов:
- Цераксон – 2000мл - 2 000 руб./пациент/день
- Мексидол – 4-8 мл - 1 500 руб. (упаковка)/пациент/день)
- Церебролизин – 20-30 мл - 708 руб./пациент/день
- Маннитол - 200-400 мл - 2 800 руб./пациент/день
- Альтеплаза - 0,9 мг/кг (40-90 мл) - 57 600 руб./ампула (1 ампула на больного от веса) (одномоментно).
Учитывая опыт работы на наших клинических базах, экономия затрат на фармакологическое сопровождение при лечении 800 пациентов для больницы может составить до 9 миллионов рублей в год.
В заключение
Мы ведем активную исследовательскую деятельность эффективности КЦГ с применением аппаратов "АТГ-01" в течение последних восьми лет. Проведены многочисленные мультицентровые клинические исследования и пострегистрационная апробация в 20-ти клиниках РФ. Пролечено более 5 000 пациентов без побочных эффектов и осложнений!
Клинически доказано, что что применение нашей технологии:
- уменьшает смертность при инсультах и тяжелых ЧМТ в 2 раза,
- повышает уровень сознания при тяжелых патологических состояниях в 2 раза,
- позволяет снизить время пребывания в ОРИТ и сократить затраты на фармакологическое сопровождение.
Результаты наших исследований и апробации отражены в многочисленных отчетах и отзывах ведущих профильных специалистов в реаниматологии, представлены на многочисленных форумах.
Если же документального подтверждения недостаточно, мы готовы показать наше оборудование в действии.
Краниоцеребральная гипотермия. Эффекты краниоцеребральной гипотермии
Краниоцеребральная гипотермия. Эффекты краниоцеребральной гипотермии
В клинической медицине краниоцеребральная гипотермия используется в комплексном интенсивном лечении больных, которые находятся в кризисном состоянии, сопровождающемся гипоксией головного мозга. Широкое распространение этот метод получил в хирургии, акушерстве, реаниматологии, неонатологии и др.
В наркологии краниоцеребральная гипотермия впервые была применена для реанимации больных с тяжелыми формами белой горячки, при нарастании отека — набухания головного мозга.
Клинический опыт и новые данные о механизмах этого метода свидетельствуют о возможности использования его в наркологии не только при алкогольных психозах. Такие ургентные состояния в клинике алкоголизма, как абстинентный синдром, тяжелые запои, расстройство сферы влечений по компульсивному типу, острая алкогольная интоксикация являются прямыми показаниями к проведению краниоцеребральной гипотермии, тем более что медикаментозная, например детоксикационная, терапия в таких случаях нередко малоэффективна и чревата серьезными осложнениями.
Однако купирование указанных состояний с использованием общепринятых режимов краниоцеребральной гипотермии, предусматривающих форсированное охлаждение церебральных структур до средней и глубокой степени (с проведением нейровегетативной блокады и наркоза), во-первых, технически сложно, а во-вторых, было бы при данной патологии несоизмеримо с массивным лечебным воздействием.

В этой связи мы поставили перед собой задачу разработать щадящие режимы краниоцеребральной гипотермии применительно к больным алкоголизмом. Теоретическими предпосылками и обоснованием лечебного использования поверхностной церебральной гипотермии явились данные о ведущей роли в патогенезе тяжелых клинических проявлений алкоголизма гемодинамических, метаболических, гипоксических и других расстройств, а также возможность модуляции низкими температурами биохимических процессов и др.).
В зависимости от диапазона температурных воздействий установлены следующие варианты влияния их на биохимические процессы in vitro и in vivo: 1) сохранение в неизменном виде; 2) стимуляция; 3) снижение активности, ингибирующее, затормаживающее действие; 4) криоповреждающее действие (так называемые денатурационные эффекты).
В соответствии с этими данными, при слабых степенях охлаждения (начальная стадия гипотермии) в условиях отсутствия медикаментозной неировегетативной блокады в результате адаптационной перестройки в организме срабатывают физиологические механизмы защиты от холода (холодовая дрожь, терморегуляционный мышечный тонус, несократительный биохимический термогенез и др.).
При этом увеличивается потребление кислорода (в среднем на 87%), повышается теплопродукция (на 25—45%), усиливается и стабилизируется общая и церебральная гемодинамика, резко катализируются метаболические процессы, повышается толерантность головного мозга к гипоксии. Дискретная неглубокая гипотермия в диапазоне адаптационных возможностей организма вызывает интенсификацию метаболического термогенеза, в результате чего сгорание алкоголя и продуктов его метаболизма значительно усиливается.
В экспериментах установлено, что при экстракраниальном гипотермическом воздействии в результате быстрой отдачи тепла от наружного покрова головы достигается увеличение градиента температур между поверхностными слоями большого мозга и подкорковыми его структурами. Этим многие авторы объясняют наступление положительного терапевтического эффекта.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Механизмы нейропротекции при церебральной гипотермии (обзор)
Обзор посвящен рассмотрению нейропротекторных механизмов терапевтической гипотермии с позиций метаболической депрессии и реакций геномного перепрограммирования нейронов, развивающихся при понижении температуры головного мозга.
К объяснению эффектов влияния низких температур привлечена концепция гипотермического прекондиционирования, основанная на развитии типовых неспецифических реакций, обеспечивающих формирование цитопротекторного фенотипа нейронов при действии потенциально опасных раздражителей — ишемии, реперфузии и переохлаждения. Показана роль краниоцеребральной гипотермии, как методики селективного гипотермического воздействия на головной мозг с целью нейропротекции и коррекции нарушений температурного баланса головного мозга.
Подход к терапевтической гипотермии как к гипотермическому прекондиционированию позволяет существенно расширить области ее применения и использовать в различных методических вариантах.
Ключевые слова
Об авторах
Федеральный научно-клинический центр реаниматологии и реабилитологии; Российский университет дружбы народов
Россия
141534, Московская область, Солнечногорский район, д. Лыткино, д. 777 ;
117198, г. Москва, ул. Миклухо-Маклая, д. 6
Федеральный научно-клинический центр реаниматологии и реабилитологии; Российский университет дружбы народов
Россия
141534, Московская область, Солнечногорский район, д. Лыткино, д. 777 ;
117198, г. Москва, ул. Миклухо-Маклая, д. 6
Федеральный научно-клинический центр реаниматологии и реабилитологии
Россия
141534, Московская область, Солнечногорский район, д. Лыткино, д. 777
Список литературы
1. Лабори А., Гюгенар П. Гибернотерапия в медицинской практике. М.: Медгиз; 1956: 281.
2. Неговский В.А. Оживление организма и искусственная гипотермия, М.: Медгиз; 1960: 302.
3. Lampe J.W., Becker L.B. State of the art in therapeutic hypothermia. Annu Rev Med. 2011; 11: 104–110. DOI: 10.1146/annurev-med052009-150512
4. Bernard S.A., Buist M. Induced hypothermia in critical care medicine: a review. Crit Care Med. 2003; 31: 2041–2051. DOI: 10.1097/01.CCM.0000069731.18472.61
5. Den Hertog H.M., van der Worp H.B., Tseng M.C., Dippel D.V. Cooling therapy for acute stroke. Cochrane Database Syst Rev. 2009; 130: 3063–3074. DOI: 10.1002/14651858.CD001247.pub2
6. Cooper D.J., Nichol A.D., Bailey M., Bernard S. Effect of Early Sustained Prophylactic Hypothermia on Neurologic Outcomes Among Patients With Severe Traumatic Brain Injury: The POLAR Randomized Clinical Trial. JAMA. 2018; 320 (21): 2211–2220. DOI: 10.1001/jama. 2018.17075.
8. Шевелев О.А., Бутров А.В., Каленова И.Е., Шаринова И.Е. Краниоцеребральная гипотермия в терапии ишемического инсульта. Боль, обезболивание, интенсивная терапия. 2012; 1: 605–608.
9. Бутров А.В., Шевелев О.А., Чебоксаров Д.В., Бунтина М.А. Применение краниоцеребральной гипотермии у больных с острым нарушением мозгового кровообращения под контролем радиотермометрии. Вестник интенсивной терапии. 2014; 5: 47.
10. Торосян Б. Д., Бутров А. В., Шевелев О. А., Чебоксаров Д. В., Покатилова Н. С. Влияние краниоцеребральной гипотермии на потребление кислорода, обмен и показатели центральной гемодинамики у пациентов в остром периоде ишемического инсульта. Медицинский алфавит.2017; 17 (314): 29–32.
11. Rzechorzek N.M., Connick P., Patani R., Selvaraj B.T., Chandrana S. Hypothermic Preconditioning of Human Cortical Neurons Requires Proteostatic Priming. EBioMedicine. 2015; 2 (6): 528–535. DOI: 10. 1016/j.ebiom.2015.04.004
13. Murry C.E., Jennings R.B., Reimer K.A. Preconditioning with ischemia: A delay of cell injury in ischemic myocardium. Circulation. 1986; 74: 1124–1136. DOI: 10.1161/01.CIR.74.5.1124
14. Khoury N., Koronowski K.B. Perez-Pinzon M.F. Long-term window of ischemic tolerance: An evolutionarily conserved form of metabolic plasticity regulated by epigenetic modifications? Neurol Neuromedicine. 2016; 1 (2): 6–12. PMID: 27796011 PMCID: PMC5081687 DOI: 10.29245/2572.942x/2016/2.1021
15. Stenzel-Poore M.P, Stevens S.L., Simon R.P. Genomics of preconditioning. Stroke. 2004; 35: 2683–2686. DOI: 10.1161/01.STR.0000143735.89281.
17. Jackson C.W., Escobar I., Xu J., Perez-Pinzon M.A. Effects of ischemic preconditioning on mitochondrial and metabolic neruoprotection: 5' adenosine monophosphate-activated protein kinase and sirtuins. Brain Circ. 2018; 4: 54–61. PMID: 18417696 PMCID: PMC2678917 DOI: 10.1523/JNEUROSCI.5471-07.2008
18. Jiang S., Wu Y., Fang D., Chen.. Hypothermic preconditioning but not ketamine reduces oxygen and glucose deprivation induced neuronal injury correlated with downregulation of COX-2 expression in mouse hippocampal slices. Journal of Pharmacological Sciences. 2018; 137: 30–37. DOI: 10.1016/j.jphs.2018.04.001
19. Шевелев О.А., Бутров А.В. Технологии лечебной гипотермии в интенсивной терапии и реаниматологии. Неотложная медицина. 2010; 3: 45–49.
20. Busto R., Deitrich W.D., Globus M.Y. Small differences in intraischemic brain temperature critically determine the extent of ischemic neuronal injury. Cereb Blood Flow Metab. 1987; 7 (6): 729–738. DOI: 10.1038/jcbfm.1987.127
21. Ruborg R., Gunnarsson K., Ström J.O. Predictors of post-stroke body temperature elevation. BMC Neurology. 2017; 17: 218. DOI: 10.1186/s12883-017-1002-3.
22. Santillo E., Antonelli-Incalzi R. Protection of coronary circulation by remote ischemic preconditioning: An intriguing research frontier. Cardiol. Plus. 2018; 3: 21–29. DOI: 10.4103/cp.cp_9_18
23. Lange R., Ingwall J., Hale S.L. Preservation of high-energy 40. phosphates by verapamil in reperfused myocardium. Circulation. 1984; 70: 734–741.
24. Kremastinos D.Th. The phenomenon of preconditioning today. Hell. J. Cardiol. 2005; 46: 1–4.
25. Anwar Abd-Elfattah S., Jian-Huo Guo, Shi-Ping Gao, Ahmed Elwatidy F., Ibrahim Hegab M., David Salter R., Mohammad Alfagih R., Nermine Abd-Elfattah A. Preconditioning of Healthy, Stunned, Infarcted, Hypertrophied and Failing Hearts: Role of Conditioning Reserve in Supplemental Cardioprotection. Clinics in Surgery. 2019; 4: 1–13
26. Ravincerova T., Farkasova V., Arkasova, Griecsova L., Carnicka S., Muraricova E., Barlaka E., Kolar F., Bartekova M., Lonek L., Slezak J., Lazou A. Remote Preconditioning as a Novel «Conditioning» Approach to Repair the Broken Heart: Potential Mechanisms and Clinical Applications. Physiol. Res. 2016; 65: 55–64.
27. Kawada T., Akiyama T., Shimizu S. Detection of endogenous acetylcholine release during brief ischemia in the rabbit ventricle: a possible trigger for ischemic preconditioning. Life Sci. 2009; 85: 597–601. DOI: 10.1016/j.lfs.2009.08.015
29. Singh L., Kulshrestha R., Singh N., Jaggi A.S.. Mechanisms involved in adenosine pharmacological preconditioning-induced cardioprotection. Korean J Physiol Pharmacol. 2018; 22 (3): 225–234. DOI: 10.4196/kjpp.
30. Wang C., Hu S.M., Xie H., Qiao S.G., Liu H., Liu C.F. Role of mitochondrial ATP-sensitive potassium channel-mediated PKC-ε in delayed protection against myocardial ischemia/reperfusion injury in isolated hearts of sevoflurane-preconditioned rats. Braz J Med Biol Res. 2015; 48 (6). DOI: 10.1590/1414-431x20143876
32. Randall М. Enhanced cardiac preconditioning in the isolated heart of the transgenic ( (mREN-2)27) hypertensive. Cardiovascular. Research. 1997; 33: 400–409. PMID: 9074705
33. Лихванцев В.В., Мороз В.В., Гребенчиков О.А., Гороховатский Ю.И., Заржецкий Ю.В., Тимошин С.С., Левиков Д.И., Шайбакова В.Л. Ишемическое и фармакологическое прекондиционирование. Общая реаниматология. 2011; 7 (6): 59. DOI: 10.15360/1813-9779-2011-6-59.
34. Hausenloy D.J., Candilio L., Laing C., Kunst G., Pepper J., Kolvekar S., Evans R., Robertson S., Knight R., Ariti C., Clayton T., Yellon D. M. Effect of remote ischemic preconditioning on clinical outcomes in patients undergoing coronary artery bypass graft surgery (ERICCA): rationale and study design of a multi-centre randomized double-blinded controlled clinical trial. Clinical Research in Cardiology. 2012; 101: 339–348. DOI: 10.1007/s00392-011-0397-x
35. Murry C.E., Richard V. J., Jennings R. B., Reimer K. A. Myocardial protection is lost before contractile function recovers from ischemic preconditioning. Am. J. Physiol. 1991; 260: 796–804. DOI: 10.1152/ajpheart.1991.260.3.H796
38. Park H.A., Jonas E.A. N-Bcl-xL, a therapeutic target for neuroprotection. Neural Regen Res. 2017; 12: 1791–1794. DOI: 10.4103/1673-5374.219033
39. Gidday J.M. Cerebral preconditioning and ischaemic tolerance. Nat Rev Neurosci. 2006; 7: 437–448. DOI: 10.1038/nrn1927
40. Miller D.J., Fort P.E. Heat Shock Proteins Regulatory Role in Neurodevelopment. Front. Neurosci. 2018. DOI: 10.3389/fnins.2018.00821
41. Chang-Jin Park, Young-Su Seo. Heat Shock Proteins: A Review of the Molecular Chaperones for Plant. Immunity Plant Pathol J. 2015; 31 (4): 323–333. DOI: 10.5423/PPJ.RW.08.2015.0150.
42. Chatterjee S., Burns N.F. Targeting Heat Shock Proteins in Cancer: A Promising Therapeutic Approach. Int J Mol Sci. 2017; 18 (9). DOI: 10.3390/ijms18091978.
43. Yan Jun Song Chong, Bin Zhong Xian,, Bao Wang. Heat shock protein 70: A promising therapeutic target for myocardial ischemia–reperfusion injury. J of cellular Physiology. 2018; 234: 1190–1207. DOI: 10.1002/jcp.27110
45. Gidday J.M.. Cerebrovascular ischemic protection by pre- and postconditioning. Brain Circ. 2015; 1: 97–103 DOI: 10.4103/2394-8108.166379
46. Miyata Y., Yahara I. The 90 kDa heat shock protein Hsp90 binds and protects casein kinase II from self-aggregation and enhances its kinase activity. J. Biol. Chem. 1992; 267: 7042–7047.
47. Mosser D. D., Caron A. W., Bourget L. Role of the human heat shock protein hsp70 in protection against stress-induced apoptosis. Mol. Cell. Biol. 1997; 17: 5317–5327. DOI: 10.1128/MCB.17.9.5317
48. Wang Y., Reis C., Applegate R., Stier G., Martin R., Zhang J.H. Ischemic conditioning-induced endogenous brain protection: Applications Pre-, Per- or Post-Stroke. Exp Neurol. 2015; 272: 26–40. DOI: 10.1016/j.expneurol.2015.04.009
49. Kitagawa K., Matsumoto M., Tagaya M. Ischemic tolerance phenomenon found in the brain. Brain Res. 1990; 528 (1): 21–24. DOI: 10.1016/0006-8993 (90)90189-I
50. Yu S., Zhao M., Guo Т. Hypoxic preconditioning up-regulates glucose transport activity and glucose transporter (GLUT1 and GLUT3) gene expression after acute anoxic exposure in the cultured rat hippocampal neurons and astrocytes. Brain Res. 2008; 1211: 22–29. PMID: 18474279 DOI: 10.1016/j.brainres.2005.04.029
51. Shpargel K.B., Jalabi W., Jin Y. Preconditioning paradigms and pathways in the brain. Cleve Clin J Med. 2008; 75 (2): 77. PMID: 18540152 DOI: 10.3949/ccjm.75.suppl_2.s77
52. Gidday, J.M. Cerebral preconditioning and ischaemic tolerance. Nat Rev Neurosci. 2006; 7: 437–448. DOI: 10.1038/nrn1927
53. Guimarães Filho MA, Cortez E, Garcia-Souza ÉP, Soares Vde M, Moura AS, Carvalho L, Maya MC, Pitombo MB. Effect of remote ischemic preconditioning in the expression of IL-6 and IL-10 in a rat model of liver ischemia-reperfusion injury. Acta Cir Bras. 2015; 30 (7): 452–460. DOI: 10.1590/S0102-865020150070000002.
55. Atochin D.N., Clark J., Demchenko I.T. Rapid cerebral ischemic preconditioning in mice deficient in endothelial and neuronal nitric oxide synthases. Stroke. 2003; 34 (5): 1299–1303. DOI: 10.1161/01.STR.0000066870.70976.57
56. Щербак, Н.С., Русакова А.Г., Галагудза М.М., Юкина Г.Ю., Баранцевич Е.Р., Томсон В.В., Шляхто Е.В. Изменение экспрессии белка Bcl-2 в нейронах полей гиппокампа после применения ишемического посткондиционирования головного мозга. Морфология. 2015; 148: 21–27.
57. Щербак, Н.С., Галагудза М.М., Юкина Г.Ю., Баранцевич Е.Р., Томсон В.В., Шляхто Е.В. Роль АМРА-рецепторов в механизмах нейропротективного эффекта ишемического посткондиционирования головного мозга. Артериальная гипертензия. 2015; 21: 155–163.
58. Щербак, Н.С. Овчинников Д.А., Галагудза М.М., Юкина Г.Ю., Баранцевич Е.Р., Томсон В.В., Шляхто Е.В. Влияние ишемического посткондиционирования на экспрессию белка Bcl-2 в нейронах неокортекса при глобальной ишемии-реперфузии головного мозга у крыс. Трансляционная медицина. 2016; 3 (1): 63–72.
59. Самойленкова Н.С., Гаврилова С.А., Кошелев В.Б. Защитный эффект гипоксического и ишемического прекондиционирования при локальной ишемии мозга крыс. Доклады академии наук (ДАН). 2007; 414 (2): 283–285.
60. Шевелев О.А., Каленова И.Е., Шаринова И.П., Бутров А.В. Опыт применения терапевтической гипотермии в лечении ишемического инсульта. Неврология, нейропсихиатрия, психосоматика. 2012; 2: 41–45.
61. Шевелев О.А., Бутров А.В., Каленова И.Е. Терапевтическая гипотермия в неотложных состояниях. Медицинский алфавит. Неотложная медицина. 2011; 3: 46–50.
62. Doberentz E., Markwerth P., Wagner R., Madea B. Expression of Hsp27 and Hsp70 and vacuolization in the pituitary glands in cases of fatal hypothermia. Forensic Science, Medicine and Pathology. 2017; 13: 312–316. DOI: 10.1007/s12024-017-9884-3
63. Peretti D., Bastide A., Radford H., Verity N., Molloy C., Guerra Martin M., Moreno J.A., Steinert J.R., Smith T., Dinsdale D., Willis A.E., Mallucci G.R. RBM3 mediates structural plasticity and protective effects of cooling in neurodegeneration. Nature. 2015; 518: 236–239.
64. Rzechorzek N.M. Hypothermic preconditioning in human cortical neurons: coupling neuroprotection to ontogenic reversal of tau. Edinburgh Research Archive, 2015.
65. Rzechorzek N.M., Connick P., Patani R., Selvaraj B.T., Chandrana S. Hypothermic Preconditioning of Human Cortical Neurons Requires Proteostatic Priming. EBioMedicine. 2015; 2 (6): 528–535. PMID: 26287272 PMCID: PMC4534756 DOI: 10.1016/j.ebiom.2015.04.004
67. Hayward J.N., Baker M.A. Role of cerebral arterial blood in the regulation of brain temperature in the monkey. Am. J. Physiol. 1968; 215: 389–403. PMID: 4969787 DOI: 10.1152/ajplegacy.1968.215.2.389
68. Cabanac M., Brinnel H. Blood flow in the emissary veins of the human head during hyperthermia. European Journal of Applied Physiology and Occupational Physiology. 1985; 54 (2): 172–176. DOI: 10.1007/BF02335925
70. Mariak Z., White M. D., Lewko J. Direct cooling of the human brain by heat loss from the upper respiratory tract. Journal of Applied Physiology. 1999; 87 (5): 1609–1613. DOI: 10.1152/jappl.1999.87.5.1609
71. Ma W., Liu W., Li M. Analytical heat transfer model for targeted brain hypothermia. International Journal of Thermal Sciences. 2016; 100: 66–74. DOI: 10.1016/j.ijthermalsci.2015.09.014
72. Uyðun M., Serhan Küçüka M., Özgür Çolpan C. 3B modeling and temperature distribution of human brain. 2016; 20th National Biomedical Engineering Meeting (BIYOMUT). DOI: 10.1109/BIYOMUT.2016.7849378
73. Веснин С.Г., Седанкин М.К. Математаческое моделирование собственного излучения тканей человека в микроволновом диапазоне. Биомедицинская радиоэлектроника. 2010; 9: 33–43.
75. Westwater E.R., Mätzler C., Crewell S. A review of surface-based microwave and millimeter-wave radiometric remote sensing of the troposphere. Radio Science Bulletin. 2004; 3010: 59–80. DOI: 10.23919/URSIRSB.2004.7909438
76. Колесов С.Н., Воловик М.Г., Кравец П.Я. Тепловидение и радиотермометрия при черепно-мозговой травме. В кн.: Коновалов А.Н. (ред.). Клиническое руководство по черепно-мозговой травме. М.: «Антидор»; 1998: 429–439.
77. Чебоксаров Д.В., Бутров А.В., Шевелев О.А. Диагностические возможности неинвазивного термомониторинга головного мозга. Анестезиология и реаниматология. 2015; 60 (1): 66–69.
78. Шевелев О.А., Бутров А.В., Чебоксаров Д.В., Ходорович Н.А., Лапаев Н.Н., Покатилова Н.С. Патогенетическая роль церебральной гипертермии при поражениях головного мозга. Клиническая медицина.2017; 95 (4): 302–309.
79. Molojavyi A., Preckel B., Comfère T. Effects of ketamine and its isomers on ischemic preconditioning in the isolated rat heart. Anesthesiology. 2001; 94 (4): 623–629. DOI: 10.1097/00000542-200104000-00016
80. Kozlowski R.Z., Ashford M.L. Barbiturates inhibit ATP-K+ channels and voltage-activated currents in CRI-G1 insulin-secreting cells. Br. J. Pharmacol. 1991; 103 (4): 2021–2029. PMID: 1912991
81. Tsutsumi Y., Oshita S., Kitahata H. Blockade of adenosine triphosphatesensitive potassium channels by thiamylal in rat ventricular myocytes. Anesthesiology. 2000; 92 (4): 1154–1159. DOI: 10.1097/00000542-200004000-00034
82. Lochner A., Genade S., Tromp E. Ischemic preconditioning and the beta-adrenergic signal transduction pathway. Circulation. 1999; 9: 958–966. PMID: 10468527 DOI: 10.1161/01.cir.100.9.958
83. Cain B.S., Meldrum D.R., Cleveland J.C Jr. Clinical L-type Ca (2+) channel blockade prevents ischemic preconditioning of human myocardium. Mol. Cell Cardiol. 1999; 31 (12): 2191–2197. PMID: 10640446 DOI: 10.1006/jmcc.1999.1039
84. Мattia C., Coluzzi F. COX-2 inhibitors: pharmacological data and adverse effects. Minerva Anestesiol. 2005; 7: 461–470. PMID: 16012420
Читайте также:
