Лечение эзофагитов при нейтропении - рекомендации
Добавил пользователь Skiper Обновлено: 28.01.2026
Лечение воспаления легких (пневмоний) при нейтропении - рекомендации
Легкие у больных с опухолевыми заболеваниями поражаются инфекцией чаще всего. В ряде случаев (при нейтропении) рентгенологически определить инфильтрат достаточно трудно. Тем не менее в соответствии с рентгенологической картиной выделяют два типа поражения легких.
Локализованный инфильтрат легких. Инфекция легких у больных с гематологическими заболеваниями без нейтропении протекает аналогично таковой в общей популяции. Ее могут вызвать вирусы (аденовирусы, вирусы парагриппа), микоплазма, хламидии или типичные бактерии (пневмококк, гемофильная палочка). Кроме того, в качестве возбудителя могут выступать легионеллы.
Пациенты со специфическим поражением легких относятся к группе высокого риска развития обструктивной бронхопневмонии, для диагностики которой необходимо проведение бронхоскопии. При выявлении участков некроза или абсцессов в легких в качестве возбудителей следует заподозрить анаэробы, что требует соответствующей коррекции антибиотикотерапии.
Грибковая пневмония, особенно вызываемая криптококками и гистоплазмами, может обусловливать изменения, рентгенологически неотличимые от метастазов. В ряде случаев необходимость установления диагноза требует проведения биопсии. Местный инфильтрат в легких может быть проявлением токсического действия некоторых химиопрепаратов (метотрексат, циклофосфан или блеомицин), хотя гораздо чаще эти препараты вызывают интерстициальные изменения в легких.
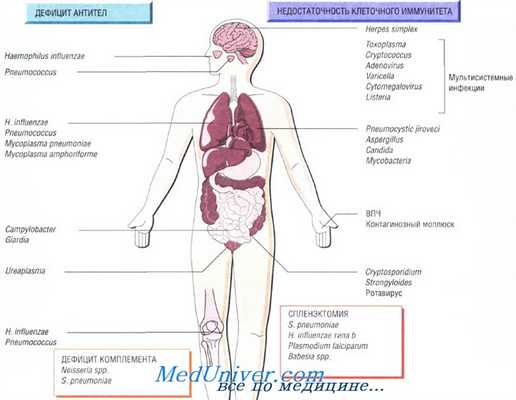
Причины инфекций при иммунодефиците
У пациентов с нейтропенией, длящейся менее 14 дней, доминирующей причиной пневмонии являются бактериальные возбудители. При более длительной нейтропении и у пациентов после аллогенной трансплантации костного мозга значительную часть возбудителей представляют грибы (кандиды и аспергиллы). Вирусы, например респираторно-синцитиальный вирус, вирус простого герпеса или цитомегаловирус, могут вызывать локализованные инфильтраты, которые в последующем чаще распространяются на все легкое.
Если клиническая ситуация не является критической, то антибиотики широкого спектра действия пациентам с локализованными инфильтратами назначают не позже 48—72 ч. В случае если клиническая ситуация стабилизируется или улучшается в течение 72 ч, то терапию продолжают 10—14 дней. Если в течение 72 ч клиническая ситуация ухудшается, необходимы дальнейшие диагностические мероприятия для исключения других возбудителей.
В качестве таких мероприятий используют бронхоальвеолярный лаваж (если содержание тромбоцитов более 30•10 9 /л). Если число тромбоцитов превышает 50•10 9 /л, то можно проводить трансбронхиальную биопсию. При неэффективности таких диагностических процедур, может быть рекомендована трансторакальная биопсия легкого.
Диффузные интерстициальные инфильтраты легких. Диффузные инфильтраты легких могут вызывать бактериальные, вирусные и грибковые патогены, а также простейшие. Pneumocystis carinii являются одной из наиболее частых причин возникновения интерстициальных легочных инфильтратов у больных без нейтропении. Примерно у 25 % больных после аллогенной трансплантации костного мозга инфильтраты в легких вызываются цитомегаловирусом. Инфицирование некоторыми другими вирусами также может приводить к возникновению интерстициальных инфильтратов. К группе этих возбудителей можно отнести аденовирусы, вирусы парагриппа и герпес-вирусы.
При нейтропении интерстициальные инфильтраты могут быть вызваны бактериальными возбудителями: грамположительными, грамотрицательными, а также грибами. В этих случаях необходимо немедленно начать лечение антибиотиками широкого спектра действия с бисептолом и одновременно проводить активные диагностические мероприятия начиная с бронхоальвеолярного лаважа. При неэффективности антибиотикотерапии показано гистологическое исследование. Если бронхоальвеолярный лаваж не дал диагностической информации, следует ставить вопрос о проведении трансбронхиальной и трансторакальной биопсии легкого.
Последний метод имеет наибольшую диагностическую ценность.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Материалы конгрессов и конференций
Связь нейтропении (в основном при лейкозах или агранулоцитозах) и инфекции была впервые отмечена более 100 лет назад. В 1960-х годах некоторыми исследователями была показана количественная взаимосвязь глубины и длительности падения содержания циркулирующих нейтрофильных лейкоцитов с числом развивающихся инфекционных эпизодов. В то же время изолированная нейтропения (врожденная, циклическая, идиопатическая) встречается достаточно редко. Чаще всего это состояние развивается наряду с анемизацией и тромбоцитопенией как одно из проявлений депрессии костного мозга у пациентов, получающих цитостатики или облучение по поводу опухолевых заболеваний. Нейтропения при этом сочетается с той или иной степенью поражения кожных покровов и слизистых, а также некоторых звеньев гуморального иммунитета. Учитывая высокую опасность инфекции у больных с нейтропенией, важным представляется рассмотреть все аспекты, влияющие на ее возникновение, характер протекания и лечение.
Физические барьеры на пути инфекции и их повреждение.
Основными физическими барьерами на пути микробного проникновения в организме являются кожа и слизистые. Здоровая кожа эффективно препятствует инвазии микроорганизмов. Значительно нарушают проницаемость кожных покровов постоянные сосудистые катетеры. Даже при наличии имплантируемого порта катетера кожная флора (в основном коагулазонегативные стафилококки) при инъекциях может проникать в кровоток. Чаще всего встречается инфекция внутренней поверхности катетера. Внутривенные катетеры нередко являются входными воротами для инфекции, вызванной коагулазонегативными стафилококками, грибами рода Candida и, реже, Aspergillus spp.
Слизистая ротовой полости часто повреждается при проведении цитостатической или лучевой терапии, особенно в случае нейтропении. Участки повреждения могут стать входными воротами для таких микроорганизмов, вегетирующих в полости рта, как зеленящие стрептококки, Stomatococcus mucilaginosus, Capnocytophaga spp., а также грибы.
В кишечнике содержится огромное количество микроорганизмов. Преобладают в этом сообществе анаэробы, препятствующие появлению экзогенных, потенциально более опасных микробов, что получило название колонизационной резистентности. Применение антибактериальных препаратов часто приводит к нарушению колонизационной резистентности вследствие изменения в микробном соотношении алиментарного канала. Снижение данного вида резистентности приводит к повышенному росту дрожжеподобных грибов, к колонизации госпитальными штаммами грамотрицательных бактерий и энтерококками.
Нарушение фагоцитарной защиты.
Нейтрофильные лейкоциты, фагоцитируя патогены, проникшие через физические защитные барьеры, являются критическим компонентом естественной защиты организма. Нейтропения приводит к тому, что бактериальные и грибковые возбудители, попадая во внутреннюю среду, получают возможность беспрепятственно размножаться, формировать локальный очаг, распространяться и вызывать быстротекущий сепсис. Клинически это было подтверждено в исследовании J.P.Bodey, показавшем, что риск инфекционных осложнений превышает 50% при уменьшении числа нейтрофилов в крови ниже 0,5х10 9 /л.
Активированные тканевые макрофаги представляют еще один важный элемент защиты организма в отношении таких внутриклеточных микроорганизмов как микобактерии, листерии, бруцеллы и токсоплазмы. Содержание макрофагов меньше подвержено колебаниям при химиотерапии, но в случае повреждения их функции, что наблюдается при применении стероидов, первичная резистентность в отношении этих патогенов значительно снижается.
Профилактика бактериальной инфекции
Пациенты со значительным и продолжительным снижением защитных механизмов (глубокая длительная нейтропения) нуждаются в ограничении контактирования с микробами окружающей среды. С этой целью их помещают в чистые или стерильные палаты с ламинарным потоком фильтруемого воздуха (особенно в случае аллогенной трансплантации костного мозга) и исключают прием пищевых продуктов, не прошедших термообработку. Для предотвращения инвазии резидентной флоры с кожи, слизистой дыхательных путей и алиментарного тракта у таких пациентов профилактически применяют противомикробные препараты. Это позволяет снизить риск развития инфекции.
Профилактическое назначение антибиотиков при нейтропении.
Профилактическое назначение антибиотиков может принести пользу в случае высокого риска быстротекущей и потенциально жизнеопасной инфекции. К недостаткам профилактики относят повышение токсичности лечения и возможность суперинфекции резистентными штаммами бактерий и грибов. Это соображение легло в основу принципа использования профилактики только у пациентов с наибольшим риском инфекции и в ограниченный период времени.
К такой группе больных, возможно нуждающихся в профилактическом назначении антибиотиков, относят в первую очередь тех, кто имеет глубокую нейтропению (ниже 100 клеток в 1 мкл), поражение кожи и слизистых (сосудистый катетер, выраженный мукозит), а также подвергаемых эндоскопическим исследованиям (гастроскопия и бронхоскопия), имеющих перидонтальные и одонтогенные инфекционные процессы и опухолевую обструкцию бронхов.
В последнее время чаще применяется абсорбирующиеся препараты, обладающие системным действием. Это может быть ко-отримоксазол (Бисептол, Котрим) в дозе 960 мг 2 раза в сутки, а также такие фторхинолоны как офлоксацин (Таривид) 4 мг 2 раза в сутки или ципрофлоксацин (Ципробай, Цифран) 500 мг 2 раза в сутки.
Диагностика и лечение инфекции у больных с нейтропенией
Особенности нейтропенической инфекции
Течение инфекции у больных с нейтропенией отличается тяжестью и быстрым прогрессированием. Даже небольшая отсрочка введения противоинфекционных препаратов значительно ухудшает прогноз лечения. Другой особенностью протекания инфекции в условиях нейтропении является скудность ее клинических проявлений. Повышение температуры зачастую является единственным проявлением текущего инфекционного процесса. Для характеристики данной группы пациентов широко используется термин фебрильная нейтропения. Согласно критериям Американского общества инфекционных заболеваний фебрильную нейтропению определяют как однократное повышение температуры тела, измеренной в ротовой полости пациента, более 38.3 0 С или ее двукратное повышение более 38.0 0 С с интервалом в 1 час при содержании нейтрофилов крови менее 1000 клеток в 1 мкл. В случае возникновения данного осложнения доктор должен решить вопрос о немедленном начале антибиотикотерапии.
Лечение фебрильной нейтропении
В подавляющем большинстве случаев лечение фебрильной нейтропении начинается эмпирически, то есть до получения подтверждения инфекции бактериологическими методами, в связи с чем используются антибиотики широкого спектра действия. Обязательным является применение препаратов, направленных против опасных грамотрицательных возбудителей (в том числе синегнойной палочки) ввиду остроты и тяжести инфекционных осложнений, вызываемых этими патогенами. Помимо антибиотиков в последние годы большое внимание стали также уделять применению гранулоцитарного и гранулоцитарно-макрофагального колониестимулирующих факторов, способных уменьшить глубину и длительность нейтропении.
Применение комбинированной антибиотикотерапии
Исторически при лечении инфекции у пациентов с нейтропенией часто использовались комбинации беталактамных антибиотиков и аминогликозидов, активных против различных грамотрицательных возбудителей и обладающих синергизмом in vitro. В то же время использование аминогликозидсодержащих комбинаций увеличивает риск нефротоксичности. Клиническое преимущество таких комбинаций показано только при инфекциях, обусловленных грамотрицательными бактериями у пациентов с длительной гранулоцитопенией. Число таких больных невелико и составляет менее 5 % по данным трех последних исследований EORTC. В остальных случаях при отсутствии грамотрицательной бактериемии в гемокультуре эмпирическое назначение аминогликозида можно быстро прекратить.
Монотерапия
Появление в клинической практике активных антибиотиков с широким спектром действия, таких как цефтазидим (Фортум, Тазицеф), имипенем (Тиенам), меропенем (Меронем), цефепим (Максипим), пиперациллин/тазобактам (Тазоцин), открыло новые возможности терапии. Использование одного антибиотика у больных с нейтропенической инфекцией могло бы снизить токсичность и уменьшить затраты на лечение. Первое сравнительное клиническое исследование с цефтазидимом показало, что его применение не менее эффективно, чем использование комбинации карбенициллина, цефалотина и гентамицина. Эффективность комбинации имипенема и амикацина оказалась соотносимой с эффективностью монотерапии имипенемом (76% и 72% соответственно). Аналогичные данные были получены при сравнении эффективности монотерапии меропенемом с комбинацией цефтазидима и амикацина у больных с нейтропенической инфекцией. Несколько исследований проводилось с цефалоспоринами 4 генерации. Эффективность цефепима при сравнительных исследованиях оказалась не меньшей, чем у комбинации цефтазидима с амикацином и пиперациллина с гентамицином. В одном крупном контролируемом исследовании применение монотерапии пиперациллином/тазобактамом у больных с фебрильной нейтропенией оказалось не менее эффективным, чем комбинированная терапия цефтазидимом и амикацином.
В цитируемых исследованиях многие эпизоды нейтропенической лихорадки возникали у пациентов с лимфомами и солидными опухолями, получающих менее агрессивную цитостатическую терапию, чем больные лейкозами. У значительной части из них не удавалось выявить микробиологических или клинических признаков инфекции (за исключением лихорадки в период нейтропении), и эмпирическая антибиотикотерапия в данной группе, как правило, была высоко эффективна. Нет сомнений, что у этих пациентов монотерапия антибиотиком широкого спектра действия (цефепимом, цефтазидимом, имипенемом или меропенемом) на первом этапе вполне адекватна, и ее модифицирование необходимо лишь при получении клинических или микробиологических данных. Подобная схема не всегда применима к подгруппе пациентов с глубокой длительной нейтропенией. У части этих пациентов монотерапия может быть эффективна, однако, ввиду высокой опасности инфекции, обусловленной грамотрицательными бактериями, комбинированную терапию целесообразно назначить уже на первом этапе лечения.
Модифицирование первоначальной схемы противоинфекционной терапии
В этом случае, как правило, проводят модифицирование первоначальной схемы с учетом вероятности возбудителя. Частота грамположительной флоры, резистентной к антибиотикам первой линии терапии, достаточно высока. При отсутствии результатов бактериологического исследования к проводимой терапии добавляют гликопептиды (ванкомицин или тейкопланин), обладающие высокой активностью в отношении полирезистентной грамположительной флоры. Эти препараты обычно не включают в первую линию терапии по двум причинам: во-первых, отсрочка их назначения не ухудшает окончательных результатов лечения, а, во-вторых, гликопептиды обладают определенной нефротоксичностью. В некоторых центрах, широко применяющих гликопептидные антибиотики, появление ванкомицинрезистентных энтерококков создает серьезную проблему селекции крайне опасного возбудителя. Все эти соображения позволяют в большинстве случаев отложить начало применения гликопептидов до получения результатов бактериологических исследований или выявления неэффективности первой схемы.
Грибы являются второй частой причиной инфекционных осложнений, требующей модифицирования первоначальной схемы лечения. По данным различных контролируемых исследований, раннее эмпирическое назначение Амфотерицина В (Фунгизон) позволяет ликвидировать признаки инфекции приблизительно у 10% пациентов, лихорадящих на фоне антибиотикотерапии широкого спектра действия в течение 4-5 суток. Токсичность Амфотерицина В существенна, и в последние годы для лечения нейтропенической лихорадки используют азоловые препараты (флуконазол и итраконазол). Недостатком эмпирического использования флуконазола является отсутствие эффекта в отношении грибов рода Aspergillus. Итраконазол обладает более широким спектром активности, однако он не имеет парентеральной формы, а его фармакокинетические параметры при пероральном приеме нестабильны. Второй проблемой является рост числа резистентных к азоловым препаратам форм кандиды, развивающийся при широком их использовании. Поэтому в настоящее время, несмотря на определенную токсичность, основным препаратом для эмпирической терапии грибковых инфекций остается Амфотерицин В благодаря наиболее широкому спектру активности, проявляемой, в том числе в условиях нейтропении.
Улучшить переносимость Амфотерицина В позволяет создание липосомальных, менее токсичных и более эффективных форм препарата. Особенно это важно при лечении аспергиллезных инфекций, когда требуется вводить его высокие дозы. Исследование по применению липосомальной формы Амфотерицина В (Амбисома) показало, что его использование не менее эффективно и значительно менее токсично, чем применение Амфотерицина В.
Применение современных схем лечения фебрильной нейтропении позволило в десять раз сократить смертность от этого грозного осложнения, составлявшую в 1960-х годах до 50-70%. Это расширило возможности химиотерапии за счет более безопасного ее проведения.
Лечение эзофагитов при нейтропении - рекомендации
Течение инфекций при нейтропении - особенности диагностики
Подход к диагностике и лечению инфекции у больных с нейтропенией имеет ряд особенностей. Уменьшение количества нейтрофилов значительно ослабляет местную воспалительную реакцию, и клинические проявления инфекции могут быть сглажены или даже отсутствовать, несмотря на наличие пневмонии, пиелонефрита или абсцесса. В частности, кашель и рентгенологические признаки инфильтрации легких при пневмонии в условиях нейтропении развиваются значительно реже, чем при нормальном содержании нейтрофилов.
Гипертермия часто является единственным клиническим признаком текущего инфекционного процесса. В то же время лихорадка у 20—40 % больных с выраженной нейтропенией может развиться как реакция на трансфузии препаратов крови, введение колониестимулирующих факторов (Г-КСФ и ГМ-КСФ) или распад опухоли. Отличить эти гипертермические реакции от лихорадки, вызванной инфекцией, сложно. Одним из перспективных направлений дифференциальной диагностики повышения температуры тела инфекционной и неинфекционной природы является изучение содержания в крови биологически активных соединений, концентрация которых возрастает при тяжелой инфекции.
К этим соединениям относят эндотоксин, провоспалительные цитокины (ФНОа, ИЛ-1, -6 и -8, ИФН-у), белки острой фазы (С-реактивный белок) и прогормоны (прокальцитонин). Их уровень при тяжелой инфекции, в частности при бактериемии, может увеличиваться в сотни раз. В то же время чувствительность и специфичность исследования каждого из них в отдельности неравнозначна. Например, уровень С-реактивного белка в крови может повышаться как при тяжелой инфекции, так и при миеломной болезни или при воспалительных процессах аутоиммунной природы. Концентрация многих провоспалительных цитокинов возрастает при тяжелой инфекции только на короткий период времени (часы), что также затрудняет интерпретацию полученных результатов. Тем не менее в ряде исследований показано, что содержание прокальцитонина и ИЛ-8 в крови коррелирует с тяжестью нейтропенической инфекции, определяя ее прогноз.
В частности, в Германском проспективном исследовании уровень ИЛ-8 в крови больных с нейтропенией и лихорадкой оказался значительно повышенным при грамотрицательной бактериемии. Смертность среди больных с уровнем ИЛ-8 более 2000 нг/мл составила 27 % против 0,008 % в группе больных, у которых он был ниже. В аналогичном исследовании уровень прокальцитонина более 1 нг/мл у больных с нейтропенией и лихорадкой определял высокую вероятность бактериемии, а более 2 нг/мл — тяжелого сепсиса. До настоящего времени нет четких критериев, позволяющих абсолютно уверенно дифференцировать лихорадку, вызванную инфекцией, от гипертермии иной природы.
Развитие лихорадки у больных с нейтропенией определяет необходимость проведения физикального и инструментального обследования для выявления очага и признаков генерализации инфекции. Кроме того, необходимо проведение мероприятий, направленных на обнаружение возбудителя, его идентификацию и оценку антибиотикочувствительности.
При подозрении на респираторную инфекцию обычно проводят рентгеновское исследование грудной клетки. Оно позволяет идентифицировать очаговые и диффузные изменения в легочной паренхиме. При компьютерной томографии (КТ) высокого разрешения визуализируются очаги, невидимые при стандартной рентгенографии (до 30—60 %, по некоторым данным). Кроме того, КТ позволяет определить очаг для проведения биопсии. Рекомендуется использовать КТ при инфекции, нечувствительной к начальной схеме антибиотикотерапии, а также при подозрении на грибковое поражение легких.
Рентгенологические исследования, несмотря на высокую диагностическую значимость, не являются специфичными для конкретных возбудителей, и необходимо бактериологическое обследование. В ряде случаев выявить возбудителя позволяет исследование мокроты. В то же время микроорганизмы, выделенные из мокроты, редко являются диагностически значимыми, так как высока вероятность попадания микрофлоры из верхних отделов дыхательных путей и ротоглотки.
Более качественный материал для бактериологического исследования может быть получен при использовании бронхоскопии с «защищенными» щетками. Проведение бронхоальвеолярного лаважа позволяет получить диагностический материал из дистальных отделов бронхов. В тех случаях, если проведение всех описанных диагностических мероприятий не дало возможности определить причину изменений в легких, а состояние больного позволяет использовать инвазивные методики, проводят пунк-ционную или открытую биопсию легких. Эти методики также рекомендуют при необходимости гистологического исследования.
При подозрении на инфекционное поражение органов брюшной полости (боли, нарушение стула) проводят ультразвуковое исследование, а при необходимости КТ.
Библиотека
Инфекционные осложнения у пациентов с ослаблением защитных механизмов могут вызывать представители нормальной флоры кожи и слизистых, а также представители экзогенной флоры, попадающие в организм при употреблении контаминированной пищи или жидкости. Организм препятствует инвазии экзогенных микроорганизмов, если их количество ниже минимального порога, требующегося для колонизации. Опасность представляют повторные и более длительные контакты с патогеном, особенно при повреждении физических защитных барьеров, как, например, при наличии язвы на слизистой или кожного дефекта (сосудистого катетера).
Средства контроля инфекции, передающейся воздушным путем, применяются лишь у пациентов с тяжелыми нарушениями иммунитета (трансплантация костного мозга). Необходимо учитывать сохранение жизнеспособности грамположительных бактерий (стафилококки) и, в особенности, спор грибов (Aspergillus spp.) в воздушной среде в течение нескольких недель. Споры грибов представляют наибольшую опасность, так как они могут концентрироваться в параназальных синусах и, формируя участки роста, вызывать заражение нижнего респираторного тракта. Эта опасность значительно возрастает при строительстве вблизи стационара, когда земляные работы способствуют попаданию спор грибов из почвы с пылью в воздух. Избежать этого можно путем фильтрации воздуха, позволяющей удалить сверхмелкие частицы, с последующей подачей его ламинарным (несмешивающимся) потоком в палату. Существует и более экономичный метод, когда фильтруемый воздух подается в палату под избыточным давлением, препятствуя забросу не стерильного воздуха.
Безусловно, следует исключать прямой контакт персонала, имеющего признаки вирусных простудных заболеваний, с пациентами. Во всех палатах с подачей фильтруемого воздуха регламентируется процедура входа для персонала. В частности, обязательной является обработка рук антисептиками, одевание маски и специальной обуви.
Влажные поверхности способствуют размножению бактерий, особенно таких, как синегнойная палочка. Данный микроорганизм способен выживать в раковинах, унитазах и даже в некоторых дезрастворах. Мытье раковин, унитазов, полов и поверхностей в чистых и стерильных палатах должно осуществляться с использованием дезрастворов, сохраняющих бактерицидные свойства в присутствии биологических жидкостей (кровь, стул и др.). После мытья все предметы должны быть тщательно просушены. Обработка предметов в сухожаровом шкафу при температуре 70-80С помогает значительно снизить их обсемененность синегнойной палочкой и другими бактериями.
Свежие фрукты и овощи нередко загрязнены микроорганизмами почвы, а в некоторых случаях и такими фекальными бактериями как кишечная палочка, клебсиела и синегнойная палочка. Штаммы кишечной палочки, резистентные к различным антибиотикам, выделяются у 50-80% людей в нормальной популяции. Эти микробы могут являться резервуаром плазмид, переносящих резистентность к антибиотикам на другие аэробные бактерии кишечника. Таким образом, свежие овощи и фрукты могут даваться пациентам с нейтропенией только после тщательного мытья и обработки.
4.2 Применение миелостимуляторов для профилактики нейтропении и нейтропенической инфекции после химиотерапии.
Существует прямая зависимость риска развития фебрильной нейтропении от длительности и выраженности снижения лейкоцитов. В связи с этим в последние годы большое внимание уделялось профилактическому применению препаратов, способных уменьшить продолжительность и выраженность нейтропении. Эти препараты, называемые миелоцитокинами, появились в клинической практике в начале 1980х годов. Миелоцитокины - гранулоцитарный и гранулоцитарно-макрофагальный колониестимулирующие факторы (Г-КСФ и ГМ-КСФ) - представляют собой полипептиды, ускоряющие образования и созревание нейтрофилов, эозинофилов и моноцитов. Г-КСФ способен также ускорять выход созревших нейтрофилов из депо костного мозга. Использование этих препаратов позволяет стимулировать гранулоцитопоэз и сократить длительность критической нейтропении. Контролируемые исследования по профилактическому назначению Г-КСФ и ГМ-КСФ показали их высокую эффективность в предотвращении числа инфекционных эпизодов у больных солидными опухолями и лимфомами, получавшими гемодепрессивную химиотерапию. В то же время смертность от инфекции в большинстве случаев не изменилась.
Скорее всего, это определялось общей низкой инфекционной летальностью при стандартной химиотерапии. Напротив, у пожилых больных с острыми лейкозами ранняя постхимиотерапевтическая летальность достигает 30-50%, что в значительной степени обусловлено тяжелой нейтропенической инфекцией. В контролируемом исследовании профилактическое назначение ГМ-КСФ у пожилых больных (55-70 лет) с острыми нелимфобластными лейкозами позволило в 2 раза сократить частоту тяжелой инфекции и ранней летальности после химиотерапии. Это увеличило общую выживаемость в сравнении с контрольной группой. [Rowe J.M., Blood, 1995, 86, 457-462]. Аналогичное исследование, проведенное у больных с нелимфобластными лейкозами и стандартным риском, получавших профилактически Г-КСФ, выявило сокращение длительности глубокой нейтропении и госпитализации, а также уменьшило необходимость проведения противогрибковой терапии. Это позволило значительно сократить затраты на лечение.
Таблица 4
Показания для назначения миелоцитокинов при профилактике нейтропении и нейтропенической инфекции.
4.3 Профилактическое назначение антибиотиков при нейтропении.
4.3.1 Подгруппы больных с нейтропенией, которым показана химиопрофилактика инфекции
Профилактическое назначение антибиотиков может принести пользу в случае высокого риска быстротекущей и потенциально жизнеопасной инфекции. Однако эффективность антибактериальной профилактики нельзя преувеличивать. К недостаткам профилактики относят повышение токсичности лечения и возможность суперинфекции резистентными штаммами бактерий и грибов (особенно при длительных профилактических курсах). Это соображение легло в основу принципа использования профилактики только у пациентов с наибольшим риском инфекции и в ограниченный период времени.
- глубокую нейтропению (ниже 0.1х109/л),
- поражение кожи и слизистых (сосудистый катетер, выраженный мукозит),
- при эндоскопических исследованиях (гастроскопия и бронхоскопия),
- перидонтальные и одонтогенные инфекционные процессы и опухолевую обструкцию бронхов.
Могут также быть приняты во внимание индивидуальные обстоятельства (уровень гигиенических навыков пациента, нахождение в период цитопении в больнице или в домашних условиях).
Таблица 5
Показания для профилактики инфекций различной этиологии
4.3.2 Химиопрофилактика инфекций у онкологических больных
Существует взаимосвязь между колонизацией ротоглотки и нижних отделов желудочно-кишечного тракта грамотрицательными аэробными бактериями и последующей бактериемией. Одна только изоляция пациента и снижение поступления бактерий с пищей недостаточна, вследствие чего у этих больных применяют деконтаминацию кишечника. С этой целью применялись режимы, включающие энтеральное назначение не абсорбирующихся антибиотиков, активных, главным образом, в отношении грамотрицательных аэробных возбудителей. Исторически часто использовалась комбинация гентамицина, ванкомицина и нистатина. Данный режим нередко вызывал диспептические явления у пациентов и, кроме того, снижал колонизационную резистентность кишечника вследствие повреждения анаэробной флоры. Сохранить колонизационную резистентность позволили разработанные в последующем методы селективной деконтаминации.
4.3.3 Селективная пероральная антимикробная деконтаминация
- не абсорбирующиеся препараты (фрамицидин или неомицин) вместе с колистином или полимиксином В в комбинации с противогрибковыми антибиотиками (нистатином или амфотерицином В).
- абсорбирующиеся препараты, например ко-тримоксазол или фторхинолоны в монотерапии
- комбинации абсорбирующихся и не абсорбирующихся препаратов (ко-тримоксазол и полимиксин В).
Подобные комбинации сочетают местное и системное действия. Применение ко-тримоксазола получило распространение также в связи с его способностью предотвращать инфекции, вызываемые пневмоцистами и активностью против широкого спектра патогенов, вызывающих респираторные инфекции, включая пневмококки и гемофилюс. Кроме того, он обладает активностью в отношении золотистого стафилококка и грамотрицательных бактерий кишечника. Плацебо контролируемые исследования, проводимые на небольшом количестве пациентов, свидетельствовали о преимуществе ко-тримоксазола при селективной профилактике. К недостаткам относили риск развития резистентности и отсутствие активности в отношении синегнойной палочки, что требовало его комбинации с колистином. Применение ко-тримоксазола у 2-5% пациентов осложняется кожными реакциями, что может встречаться чаще при применении цитозара. Кроме того, ко-тримоксазол может задерживать восстановление гемопоэза у пациентов после трансплантации костного мозга.
Введение в клиническую практику новых фторхинолонов, таких как ципрофлоксацин, норфлоксацин, офлоксацин и пефлоксацин, еще более расширили группу препаратов, используемых для профилактики. Это объясняется лучшей переносимостью этих препаратов и отсутствием отрицательного влияния на гемопоэз. Из этой группы препаратов наибольшее распространение получили ципрофлоксацин и офлоксацин благодаря наиболее выраженной антисинегнойной активности. Спектр активности этих фторхинолонов включает возбудителей большинства инфекций (грамотрицательные бактерии, золотистый стафилококк, многие из коагулазонегативных стафилококков). Зеленящие стрептококки и энтерококки погранично чувствительны к офлоксацину и ципрофлоксацину. Пефлоксацин и, особенно, норфлоксацин практически не активны в отношении грамположительных возбудителей.
Метаанализ 2027 случаев профилактического применения фторхинолонов у пациентов с нейтропенией показал достоверное снижение развития микробиологически документированной грамотрицательной инфекции, а также смертности от инфекционных осложнений в сравнении с группой принимавших ко-тримоксазол, не абсорбирующиеся антибиотики или плацебо. Использование фторхинолонов для профилактики встречает некоторые возражения, одним из которых является невозможность использовать в последующем эти высокоэффективные препараты для лечения тяжелых инфекций. Следует также помнить, что максимальная концентрация ципрофлоксацина и офлоксацина снижается на 40-20% при нейтропении и поражении слизистой алиментарного тракта [J. Antimicrob. Chemother. 1990, 32, 117].
Таблица 6
Режимы селективной деконтаминации
4.3.4 Специальные показания для деконтаминации
У некоторых пациентов с нейтропенией даже при проведении системной антибиотикотерапии такими препаратами широкого спектра действия, как цефтазидим (Фортум, Тазицеф) или имипенем (Тиенам), показана постоянная пероральная селективная деконтаминация. К этой группе пациентов относятся больные с колонизацией кишечника Entrobacter spp., Stenotrophomonas maltophilia.
Для микроорганизмов рода Entrobacter характерна быстрая селекция устойчивости на фоне терапии цефалоспоринами III поколения, особенно цефтазидимом, что может привести к развитию молниеносного сепсиса. При этом указанные микроорганизмы практически всегда сохраняют чувствительность к полимиксину В.
Stenotrophomonas maltophilia - микроорганизм, обладающий природной устойчивостью к карбапенемам и другим беталактамам. Применение этих препаратов создает селективные преимущества для данного вида микроорганизмов с высоким риском последующего развития тяжелой инфекции. Ко-тримоксазол является одним из немногих препаратов, активных в отношении Stenotrophomonas maltophilia.
Аналогичное преимущество у больных, получающих имипенем, может иметь Pseudomonas aeruginosa. У пациентов с колонизацией кишечника синегнойной палочкой и снижением противоинфекционных защитных механизмов часто требуется назначение полимиксина В.
Таблица 7
Специальные показания для деконтаминации у больных с нейтропенией
4.3.5 Профилактика грибковой инфекции
Обсуждая специфические методы профилактики грибковых и прочих инфекций, следует помнить о простейших правилах гигиены, позволяющих снизить вероятность их возникновения. В первую очередь это мытье рук при контакте с больными, ограничение применения антацидных средств, способствующих колонизации кишечника различными представителями рода кандида.
В связи с увеличением заболеваемости системными микозами, особенно у пациентов со сниженным иммунным ответом, широко исследуются возможности профилактики этих инфекций. С этой целью были проведены многочисленные исследования, в которых использовался нистатин, амфотерицин В (Фунгизон), миконазол, клотримазол (Канестен), кетоконазол (Низорал), флуконазол (Дифлюкан) и итраконазол (Орунгал). Большинство из этих режимов показало снижение частоты развития инвазивных инфекций, вызванных грибами рода кандида [J. Antimicrob. Chemother. 1993, 31, 973]. Частота инфекций, вызванных аспергиллами, значительно не менялась. Несколько рандомизированных контролируемых исследований по применению флуконазола показало его эффективность в профилактике инвазивного и поверхностного кандидоза. В то же время эти и другие исследования продемонстрировали изменение спектра грибковых патогенов, выделяемых у пациентов, получающих профилактику в сторону увеличения числа резистентных к флуконазолу видов (T. glabrata, C. krusei, C. parapsilosis, Aspergillus.spp.) [New Engl J Med 1991, 325, 274].
Флуконазол является лучшим препаратом для профилактики диссеминированных кандидозных инфекций у пациентов после трансплантации костного мозга [New Engl J Med 1992, 326, 845]. При этом у больных с острым лейкозом данный препарат не изменил частоту системных грибковых инфекций и не снизил смертность [Eur J Clin Microbiol Infect Dis 1994, 13, 3]. Решение о профилактическом применении флуконазола или прочих противогрибковых препаратов у пациентов, не получавших трансплантацию костного мозга, должно решаться, исходя из конкретной ситуации. Например, наличие поверхностного кандидоза при проведении химиотерапии с предполагаемым повреждением слизистой (режимы, содержащие цитозар или антрациклины) может решить вопрос в пользу проведения профилактики системного распространения инфекции. Обычно для профилактического использования применяются дозы флуконазола 150-200 мг (в некоторых исследованиях 400 мг) в сутки перорально. Доза 50 мг в сутки, по-видимому, является недостаточной, так как может способствовать селекции слабо чувствительных штаммов.
Таблица 8
Показания для противогрибковой профилактики у больных с нейтропенией
4.3.6 Противовирусная профилактика
У пациентов с поражением иммунитета возможна реактивация вируса простого герпеса с появлением характерной "лихорадки" на губах, явлений мукозита ротовой полости, эзофагита, энцефалита или пневмонита. Профилактическое назначение ацикловира перорально в дозе 200 мг 4-5 раз в день или 5 мг/кг 2 раза в день внутривенно способно успешно предотвратить эти осложнения у больных с нейтропенией после трансплантации костного мозга [Transplantation, 1987, 43, 654-8]. Эффективным также является назначение ацикловира у пациентов серопозитивных к вирусу простого герпеса в случае назначения у них химиотерапии, приводящей к выраженным мукозитам (антрациклины, амсакрин, цитозар) даже если она не вызывает глубокой нейтропении. Следует отметить, что формирование герпетических язв на слизистой рта или пищевода может служить входными воротами для кандидозной инфекции.
В отношении вируса опоясывающего герпеса активная и адекватная терапия имеет преимущество над профилактикой, так как высок риск развития резистентности возбудителей. Вирус опоясывающего герпеса в 50 - 100 раз менее чувствителен к ацикловиру чем вирус простого герпеса и введение адекватной дозы может приводить к нефротоксичности. В случае глубокого иммунодефицита (при трансплантации костного мозга) с высоким риском реактивации опоясывающего герпеса может быть рекомендована кратковременная его профилактика ацикловиром в дозе 600-800 мг 4 раза в день перорально.
В отношении инфекции цитомегаловируса наиболее эффективной профилактикой при трансплантации костного мозга и солидных органов является использование серонегативных доноров и продуктов крови. Ацикловир не обладает активностью in vitro против цитомегаловируса и мало эффективен в клинике у больных с клинически манифестированной инфекцией. Несмотря на это, отмечено значительное снижение частоты ЦМВ инфекции у реципиентов костного мозга и почки от серопозитивных доноров, получавших ацикловир в высокой дозе профилактически [JAMA 1986, 255, 387].
Ганцикловир значительно более активен против цитомегаловирусов, но этот препарат обладает выраженной токсичностью, что препятствует его рутинному использованию для профилактики. У пациентов с ВИЧ инфекцией и ретинитом, вызванным цитомегаловирусом, ганцикловир с успехом используется для поддерживающего лечения перорально в дозе 1 г 3 раза в день.
4.3.7 Химиопрофилактика кожной инфекции
Рутинная профилактика кожной инфекции применяется редко. Колонизация кожи грамотрицательными бактериями может быть значительно снижена при обработке повидоном иодида и хлоргексидином. Мазь с мупироцином (Бактробан) эффективно снижает колонизацию слизистой оболочки полости носа золотистым стафилококком.
4.3.8 Профилактика катетер-ассоциированных инфекций
Таблица 9
Активность препаратов, применяемых при профилактике инфекции у больных с нейтропенией в отношении отдельных возбудителей
Эзофагит (K20)
Эзофагит - заболевание пищевода, сопровождающееся воспалением его слизистой оболочки вследствие различных причин.
Примечание 1
В данную подрубрику включены:
1. Абсцесс пищевода.
2. Эзофагит:
- неуточненный;
- лекарственный, по сути - химический без ожога;
Следует использовать дополнительные коды V01-Y98 "Внешние причины заболеваемости и смертности", если это необходимо для определения причины эзофагита.
Примечание 2. Приведенные в данной подрубрике описания отдельных форм и этиологий эзофагита выполнены для общего представления о данном заболевании.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
При классификации эзофагита выделяют следующие виды заболевания:
А. Клинические формы эзофагита
1. Острый эзофагит – воспаление стенки пищевода, проявляющееся болями, наиболее выраженными при прохождении пищи. В основной массе случаев он протекает в сочетании с болезнями желудка (ГЭРБ) или регургитацией и поражает обычно нижнюю часть пищевода. Возникновению заболевания способствуют нарушения питания, ожоги, химические вещества, обширная инфекция, полигиповитаминоз. Продолжительность острого эзофагита - до 3 месяцев.
2. Хронический эзофагит – хроническое воспаление стенки пищевода. Заболевание может развиться при недостаточно вылеченном остром эзофагите или как первично-хронический процесс. Хронический эзофагит может также возникать при длительном приеме слишком грубой или острой пищи, крепких алкогольных напитков. Течение хронического эзофагита характеризуется периодическими обострениями и ремиссиями. При позднем начале лечения и неуклонно прогрессирующем эзофагите, могут образовываться рубцовые изменения пищевода.
По выраженности поражения стенки хронический эзофагит делят на 4 степени согласно классификации Савари и Миллера (классификация эндоскопических признаков хронического эзофагита):
- I - гиперемия без эрозивных дефектов в дистальных отделах;
- II - разрозненные мелкие эрозивные дефекты слизистой;
- III - эрозии слизистой сливаются друг с другом;
- IV - язвенное поражение слизистой, стеноз.
3. Особые формы:
3.1 Идиопатический язвенный (ульцерозный) эзофагит (имеет некоторые общие морфологические черты с неспецифическим язвенным колитом) см. K22.1 Язва пищевода.
3.2 Неспецифический регионарный стенозирующий эзофагит (гранулематоз пищевода) - особая форма хронического эзофагита, для которой характерны трансмуральное неспецифическое гранулематозное воспаление пищевода, утолщение его стенки и почти полная облитерация просвета. Поражение пищевода при этом напоминает болезнь Крона, но в отличие от последней, в клеточном составе гранулёмы отсутствуют эозинофилы и гигантские клетки. Этиология заболевания неизвестна. Заболевание развивается преимущественно у молодых лиц (до 25-30 лет) одинаково часто у женщин и мужчин. Начало заболевания постепенное.
Б. Морфологические формы эзофагита:
1. Катаральная (отечная) форма характеризуется гиперемией и отечностью слизистой оболочки пищевода, является наиболее распространенной формой эзофагита.
2. Эрозивная форма наиболее часто развивается при острых инфекционных болезнях и действии на стенку пищевода раздражающих веществ.
3. Геморрагическая форма развивается при некоторых инфекционных и вирусных болезнях (например, при сыпном эпидемическом тифе, гриппе).
4. Псевдомембранозная форма наблюдается при дифтерии, скарлатине, при данной форме фибринозный экссудат не спаян с подлежащими тканями.
5. Эксфолиативная форма наблюдается при дифтерии, скарлатине, при этой форме фибринозный экссудат прочно связан с подлежащими тканями.
6. Некротическая форма встречается при тяжелом течении таких инфекционных болезней, как корь, скарлатина, брюшной тиф и др., а также при кандидозе, агранулоцитозе , сопровождается образованием глубоких язв (см. K23.8* Поражения пищевода при других болезнях, классифицированных в других рубриках).
7. Флегмонозная форма образуется в результате внедрения в стенку пищевода инфицированного инородного тела (T18.1 Инородное тело в пищеводе) или инфекции. Процесс склонен к абсцедированию и может распространиться вдоль пищевода и в сторону средостения .
В. Этиологические формы эзофагита:
1. Поражения при ГЭРБ (наиболее частая причина) - см. Гастроэзофагеальный рефлюкс с эзофагитом (K21.0).
2. Алиментарый эзофагит - возникает вследствие злоупотребления чрезмерно горячей и острой пищей, крепкими спиртными напитками.
3. Профессиональный эзофагит - возникает в результате воздействия вредной среды (пары концентрированных кислот и едких щелочей, соли тяжелых металлов и др. во время исполнения профессиональных обязанностей).
7. Инфекционные эзофагиты (вирусные грибковые, бактериальные).
8. Поражения при приеме некоторых лекарств.
9. Радиационные (в дозе поглощенного облучения >30 Грей).
Г. По локализации процесса
По локализации и распространенности воспалительного процесса различают дистальный, проксимальный и тотальный эзофагит.
Этиология и патогенез
Основные причины
Желудочно-пищеводный рефлюкс является основной причиной возникновения эзофагита. Он приводит к повреждению слизистой пищевода вследствие воздействия кислотно-пептического фактора. Эзофагит, вызванный рефлюксом, называется рефлюкс-эзофагитом (см. "Гастроэзофагеальный рефлюкс с эзофагитом" - K21.0).
Эзофагит может быть вызван химическим ожогом щелочью или кислотой, растворителем (бензин, ацетон), сильным окислителем типа перманганата калия. Такой эзофагит обычно регистрируется у детей в результате случайной пробы, также наблюдается у взрослых после попытки суицида с применением щелочи, кислоты, растворителя или окислителя ("Химический ожог пищевода" - T28.6).
Эзофагит часто встречается у алкоголиков, в качестве повреждающего фактора выступает спирт.
Возможно развитие эзофагита как профессионального заболевания (при контакте с парами различных повреждающих веществ).
Физическое повреждение пищевода вследствие лучевой терапии, введения зонда ("Инородное тело в пищеводе" - T18.1) также может быть причиной эзофагита.
- лекарственной терапией (в 90% случаев антибиотики из группы тетрациклинов, НПВС, хинидина, фосамакса, эмперониума бромида. Важными факторами являются химическая природа лекарства, его растворимость, время контакта с слизистой оболочкой, размер, форма и покрытие таблетки, малое количество воды при глотании таблетки, существующие изменения пищевода (например, стриктуры, ахалазия);
- ингаляционным наркозом (видимо связан с рефлюксом или раздражающим действием паров анестетиков);
- аллергической патологией (с 2007 года эозинофильный эзофагит выделен в отдельное заболевание, связанное с аллергической реакцией по типу атопии, сезонными обострениями, семейной предрасположенностью. Предположительно 6 основных продуктов связаны с большинством случаев обострения - пшеница, молоко, яйца, рыба / морепродукты, бобовые / арахис, соя);
Морфологические варианты острого эзофагита:
1. Язвенный процесс характерен для поражения пищевода вирусами группы герпеса, отмечается и при туберкулезе.
3. Мембранозный эзофагит возникает при ожогах пищевода и тяжелых инфекционных заболеваниях. Пленки отторгаются болезненно, оставляя рубцовые изменения.
4. Некротический эзофагит развивается в случае поражений пищевода при сепсисе, кандидамикозе, лучевой терапии, на фоне лечения болезней крови цитостатиками. Эндоскопически выявляются некроз и изъязвления слизистой оболочки пищевода; исходом воспалительного процесса являются рубцовые образования.
5. Септический эзофагит встречается при гнойном воспалении стрептококковой этиологии, ранениях пищевода инородными телами.
Эпидемиология
Признак распространенности: Редко
Частота случаев инфекционного эзофагита, наблюдаемого у иммунокомпрометированных лиц высока, у лиц без поражения иммунитета является казуистикой или следствием другой патологии (травмы, туберкулез и т.д.).
Аллергический (эозинофильный) эзофагит регистрируется в с распространенностью 45-55 случаев на 100 000 населения в развитых странах.
Факторы и группы риска
- погрешности питания;
- употребление недостаточного количества воды при проглатывании таблеток;
- прием некоторых лекарственных препаратов;
- прием алкоголя;
- курение;
- семейная (генетическая) предрасположенность к аллергии;
- недостаточность иммунитета;
- вредная профессиональная среда.
Клиническая картина
Клинические критерии диагностики
боль при глотании, дисфагия, одинофагия, кровавая рвота, рвота кофейной гущей, мелена, саливация, боль за грудиной, боль в эпигастрии, изжога, регургитация
Cимптомы, течение
Симптомы эзофагита: затруднения и/или болезненные ощущения при глотании, изжога, боли во рту, ощущение чего-то застрявшего в горле, тошнота, рвота.
При остром эзофагите возможно повышение температуры тела, наблюдается общее недомогание, возникают неприятные ощущения по ходу пищевода во время продвижения пищи, может беспокоить жжение, иногда резкая боль в пищеводе. Больные могут жаловаться на боль в области шеи, отрыжку, нарушенное глотание, слюнотечение.
Примечание
В зависимости от этиологии эзофагита, могут появляться дополнительные признаки, связанные с непосредственной причиной заболевания. Например, пузырьковая сыпь при герпесе, молочница слизистой рта, связь с приемом определенной пищи, сезонные обострения, ассоциированная патология (астма) и прочие.
Радиационный эзофагит может возникнуть спустя значительное время после лучевой нагрузки.
Эозинофильный эзофагит не имеет четкой клинической картины и может не распознаваться длительное время.
Любые пациенты с клиникой хронического рефлюкс-эзофагита, резистентные к проводимой антирефлюксной терапии, должны рассматриваться как пациенты с вероятными редкими причинами эзофагита (все причины кроме ГЭРБ Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) - хроническое рецидивирующее заболевание, обусловленное спонтанным, регулярно повторяющимся забросом в пищевод желудочного и/или дуоденального содержимого, что приводит к поражению нижнего отдела пищевода. Часто сопровождается развитием воспаления слизистой дистального отдела пищевода - рефлюкс-эзофагитом, и/или формированием пептической язвы и пептической стриктуры пищевода, пищеводно-желудочных кровотечений и других осложнений
Подробно ).
Диагностика
Лабораторная диагностика
Обязательные исследования:
- общий анализ крови с определением ретикулоцитов, тромбоцитов;
- общий анализ мочи.
Дополнительные исследования: биохимический анализ крови (общий белок, альбумин, С-реактивный белок, сиаловые кислоты, глюкоза, АлАТ, АсАТ, билирубин, амилаза, ЩФ, мочевина, креатинин, электролиты).
Дифференциальный диагноз
Дифференциальный диагноз при эзофагите проводится в первую очередь с ГЭРБ (отсутствие эффекта от антирефлюксной терапии).
Также необходима дифференциальная диагностика с врожденными мембранами пищевода, стриктурами пищевода, неврогенной анорексией, поражениями пищевода при склеродермии, опухолями пищевода, термическими, химическими, лучевыми поражениями и т.д.
При первичном эозинофильном гастроэнтерите (Аллергический и алиментарный гастроэнтерит и колит - K52.2), наряду с эозинофильной инфильтрацией слизистой желудка и тонкой кишки, также возможны подобные изменения и в пищеводе. Помочь дифференцировать эозинофильный эзофагит от первичного эозинофильного гастроэнтерита могут отрицательные по эозинофильной инфильтрации образцы биопсии из желудка, двенадцатиперстной и толстой кишки.
Инфекционный эзофагит имеет, как правило, признаки инфекции другой локализации и сочетается с иммунодефицитом.
Читайте также:
- Примеры брахитерапии меланомы хориоидеи
- Лучевые признаки аутосомно-рецессивного поликистоза почек у плода
- Показания и методика пробы Шварца (пассаж контраста по кишке)
- Мукоэпидермальная карцинома бронха на рентгенограмме, КТ
- Регуляция сердечного выброса по кислороду. Влияние венозного притока на сократимость миокарда
