Лечение и прогноз фокально-сегментарного гломерулосклероза
Добавил пользователь Дмитрий К. Обновлено: 20.01.2026
Одним из наиболее прогностически неблагоприятных вариантов гломерулопатии является фокально-сегментарный гломерулосклероз (ФСГС), который выявляется при нефробиопсии у 5-20% больных с нефротическим синдромом (НС) и у 15% взрослых больных с хроническим гломерулонефритом. ФСГС рецидивирует в трансплантированной почке у 30-50% больных. Среди взрослых больных ФСГС преобладают мужчины. Плохой прогноз ФСГС объясняется неоднородностью заболевания и усугубляется плохим ответом на лечение. По современным данным ФСГС характеризуется склерозом мезангиальной матрицы, гиалинозом, повреждением капилляров, увеличением пенистых клеток и их адгезией между гломерулярным пучком и капсулой Боумена. В 2004 году было предложено следующие гистологические варианты ФСГС: верхушечный, перихилярный, коллабирующий, клеточный и классический. Каждый гистологический вариант ФСГС различается по этиологии, ответу на лечение и по прогнозу. Клиническая диагностика первичного ФСГС должна базироваться на исключении вторичных причин заболевания. Очаговые склеротические изменения в клубочках могут быть вызваны разными факторами и встречаться при различных состояниях, в том числе, и при уже имеющейся патологии почек. По данным международных рекомендаций при терапии ФСГС следует ориентироваться на величину суточной протеинурии. Для больных с ФСГС без выраженной протеинурии рекомендуется использование ингибиторов ангиотензинпревращающего фермента (иАПФ) или блокаторов рецепторов ангиотензина II (БРА). При ФСГС и НС наряду с иАПФ или БРА II используется иммуносупрессивная терапия. Взрослым больным глюкокортикоиды (ГК) назначаются ежедневно в один прием в дозе 1 мг/кг сутки, максимальная доза составляет 80 мг при ежедневном приеме и 120 мг при альтернирующем режиме. Резистентность к ГК констатируется при отсутствии эффекта через 16 недель. При наличии противопоказаний или непереносимости ГК используется ингибиторы кальцинейрина. Рекомендуемая начальная доза циклоспорина составляет 2мг/кг/сутки, принимается два раза в сутки с постепенным увеличением до 3,5-4 мг/кг/сутки. Длительность терапии при удовлетворительной переносимости циклоспорина составляет более шести месяцев. После достижения полной ремиссии дозу циклоспорина снижают постепенно по 0,5 мг/кг/сутки до минимально эффективной дозы (1,5-2 мг/кг/сутки) и проводят такую поддерживающую терапию в течение 1-2 лет. Возможен вариант терапии с использованием более низких доз ГК и циклоспорина, либо комбинация микофенолата мофетила с высокой дозой дексаметазона.
Ключевые слова
Об авторах
Кыргызская государственная медицинская академия имени И.К. Ахунбаева; ГОУ ВПО Кыргызско-Российский Славянский университет
Кыргызстан
Илхом Торобекович Муркамилов
ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова
Россия
Москва
Конфликт интересов: Moscow
Список литературы
1. Saleem M.A. Molecular stratification of idiopathic nephrotic syndrome. Nat Rev Nephrol. 2019; 15: 750–765. DOI:10.1038/s41581-019-0217-5
2. Чеботарева Н.В., Бобкова И.Н., Непринцева Н.В. и др. Мочевые биомаркеры повреждения подоцитов: значение для оценки течения и прогноза хронического гломерулонефрита. Терапевтический архив. 2015; 6(87): 34-39. DOI: 10.17116/terarkh201587634-39
4. Beaudreuil S., Lorenzo H.K., Elias M. et al. Optimal management of primary focal segmental glomerulosclerosis in adults. Int J Nephrol Renovasc Dis. 2017; 10: 97–107. Published 2017 May 10. DOI:10.2147/IJNRD.S126844
7. Li M., Alfieri C.M., Morello W. et al. Assessment of increased glomerular permeability associated with recurrent focal segmental glomerulosclerosis using an in vitro model of the glomerular filtration barrier. Journal of Nephrology. 2019; 1-9. DOI:10.1007/s40620-01900683-2
8. Мельник А.А. Фокально-сегментарный гломерулосклероз: генетический анализ и целевая терапия. Почки. 2018; 7(1): 35-49. DOI:10.22141/2307-1257.7.1.2018.122218.
11. Wharram B.L., Goyal M., Wiggins J.E. et al. Podocyte depletion causes glomerulosclerosis: diphtheria toxin-induced podocyte depletion in rats expressing human diphtheria toxin receptor ransgene. J Am Soc Nephrol. 2005; 16(10): 2941-52. DOI:10.1681/ASN.2005010055
12. Hildebrandt F. Genetic kidney diseases. Lancet. 2010; 10: 375(9722): 1287-1295. DOI:10.1016/S0140-6736(10)60236-X
13. Игнатова М.С., Длин В.В. Нефротический синдром: прошлое, настоящее и будущее. Рос вестн перинатол и педиатр 2017; 62:(6): 29–44. DOI:10.21508/1027–4065–2017–62–6–29–44
14. Sánchez de la Nieta M.D., Arias L.F., de la Torre M. et al. Familial focal and segmentary hyalinosis. Nefrologia. 2003;23(2):172-6. PMID: 12778884. [in Spanish]
18. Yu D., Petermann A., Kunter U. et al. Urinary podocyte loss is a more specific marker of ongoing glomerular damage than proteinuria. Journal of the American Society of Nephrology. 2005; 16: 6: 17331741. DOI:10.1681/ASN.2005020159
23. Самусева Е.С. Первичный фокальный сегментарный гломерулосклероз (ФСГС): проблемы патоморфологической диагностики. Український журнал нефрології та діалізу. 2011; 2(30): 52-60
31. De Zeeuw D., Remuzzi G., Parving H.H. et al. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL. Kidney international. 2004; 65: 6: 2309-2320. DOI:10.1111/j.1523-1755.2004.00653.x
33. Samuel S., Bitzan M., Zappitelli M. et al. Canadian Society of Nephrology Commentary on the 2012 KDIGO clinical practice guideline for glomerulonephritis: management of nephrotic syndrome in children. American Journal of Kidney Diseases. 2014; 63: 3: 354-362
34. Ныркова П.А., Савенкова Н.Д. Исследования эффективности цитостатической терапии часто рецидивирующего, гормонозависимого и со стероидной токсичностью нефротического синдрома у детей. Нефрология. 2015; 19(1): 30-40
35. Савенкова Н.Д, Папаян А.В. Нефротический синдром в практике педиатра. С-Пб., Эскулап. 1999; 256 с.
36. Macian F. NFAT proteins: key regulators of T-cell development and function. Nat Rev Immunol. 2005; 5(6): 472-484. DOI:10.1038/nri1632
37. Козловская Л.В. Хронический гломерулонефрит: аргументы в пользу применения циклоспорина.Клиническая нефрология. 2010; 3: 56-61
38. Козловская Л.В. Фокально-сегментарный гломерулосклероз: фокус на циклоспорин. Клиническая нефрология. 2010; 5: 23-28
39. Cattran D.C., Appel G.B., Hebert L.A. et al. A randomized trial of cyclosporine in patients with steroid-resistant focal segmental glomerulosclerosis. North America Nephrotic Syndrome Study Group. Kidney Int. 1999; 56(6): 2220-2226. DOI:10.1046/j.15231755.1999.00778.x.
40. Niaudet P., Habib R. Cyclosporine in the treatment of idiopathic nephrosis. J Am Soc Nephrol. 1994; 5(4): 1049-1056. PMID: 7849244
41. Chapter 6: Idiopathic focal segmental glomerulosclerosis in adults. Kidney Int Suppl. (2011); 2012 Jun; 2(2): 181-185. DOI: 10.1038/kisup.2012.19
42. Shen X., Jiang H., Ying M. et al. Calcineurin inhibitors cyclosporin A and tacrolimus protect against podocyte injury induced by puromycin aminonucleoside in rodent models. Scientific reports. 2016; 6: 32087. DOI:10.1038/srep32087
43. Klaassen I., Özgören B., Sadowski C.E. et al. Response to cyclosporine in steroid-resistant nephrotic syndrome: discontinuation is possible. Pediatric nephrology. 2015; 30: 9: 1477-1483. DOI:10.1007/s00467015-3109-3
45. Fu Y.F., Liu G.l. Mycophenolate Mofetil Therapy for children with lupus nephritis refractory to both intravenous cyclophosphomide and cyclosporine. Clin Nephrol. 2001; 55(4): 318–321. PMID: 11334319
47. Gulati S., Pokhariyal S., Sharma R.K. et al. Pulse cyclophosphamide therapy in frequently relapsing nephrotic syndrome. Nephrol Dial Transplant. 2001; 16(10): 2013–2017. PMID: 11572890
49. Kamei K., Okada M., Sato M. et al. Rituximab treatment combined with methylprednisolone pulse therapy and immunosuppressants for childhood steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2014; 29(7): 1181–1187. DOI: 10.1007/s00467-014-2765-z
50. Wang C.S., Liverman R.S., Garro R. et al. Ofatumumab for the treatment of childhood nephrotic syndrome. Pediatr Nephrol. 2017; 32(5): 835–841. DOI: 10.1007/s00467-017-3621-8
51. Ravani P., Bonanni A., Ghiggeri G.M. Randomised controlled trial comparing ofatumumab to rituximab in children with steroiddependent and calcineurin inhibitor-dependent idiopathic nephrotic syndrome: study protocol. BMJ Open. 2017; 7: e013319. DOI:10.1136/bmjopen-2016-013319
Лечение и прогноз фокально-сегментарного гломерулосклероза
Фокально-сегментарный гломерулосклероз - эпидемиология, патогенез
Фокально-сегментарный гломерулосклероз — одна из важных причин первичного нефротического синдрома. Именно он чаще других гломерулопатий у детей заканчивается терминальной почечной недостаточностью. Среди причин терминальной почечной недостаточности у детей ему принадлежит второе место после пороков развития почек и мочевых путей. При биопсии обнаруживают спадение части (отсюда — сегментарный) капиллярных петель клубочка со склерозом мезангия. Поначалу поражение захватывает не все клубочки (отсюда — фокальный), и первыми страдают юкстамедуллярные нефроны.
Часто видны атрофированные канальцы и участки интерстициального фиброза — эти находки позволяют предположить фокально-сегментарный гломерулосклероз даже без явных признаков склероза в клубочках (табл. 8.3). У детей фокально-сегментарный гломерулосклероз, как правило, проявляется нефротическим синдромом, причем в 75—80% случаев лечение глюкокортикоидами не дает эффекта. В большинстве случаев причину установить не удается (первичный, или идиопатический, фокально-сегментарный гломерулосклероз), но в то же время известен ряд факторов, действие которых может привести ко вторичному фокально-сегментарному гломерулосклерозу.
При вторичном поражении протеинурия необязательно достигает величин, характерных для нефротического синдрома. Вторичный фокально-сегментарный гломерулосклероз в таких случаях может развиться в результате компенсаторной реакции на уменьшение числа функционирующих нефронов: в сохранившихся нефронах усиливается клубочковая фильтрация за счет повышения кровотока в клубочках, возникает их гипертрофия. В итоге это приводит к склерозу оставшихся клубочков. Такое развитие событий возможно при олигомеганефронии, односторонней агенезии или резекции почки, дисплазии почек, рефлюкс-нефропатии, некрозе коркового вещества почек.
Повышенная фильтрация в отдельных нефронах может играть роль в развитии фокально-сегментарного гломерулосклероза при серповидноклеточной анемии, тяжелом ожирении, цианотических пороках сердца, артериальной гипертонии. Любое прогрессирующее поражение клубочков может привести к фокально-сегментарному гломерулосклерозу, хотя в таких случаях часто бывают и другие морфологические изменения, характерные для основного заболевания. Наконец, фокально-сегментарный гломерулосклероз может развиться при ВИЧ-нефропатии и героиновой нефропатии.
Эпидемиология фокально-сегментарного гломерулосклероза
Первичный фокально-сегментарный гломерулосклероз обычно начинается у детей 2—7 лет. Мальчики, особенно младшего возраста, болеют несколько чаще. Кроме того, заболеваемость выше среди американских негров. В последние годы заболевание стало встречаться чаще как у детей, так и у взрослых, причем это нельзя объяснить только учащением случаев ВИЧ-нефропатии. Изредка фокально-сегментарный гломерулосклероз может быть наследственным. Так, фокально-сегментарный гломерулосклероз может наблюдаться у больных с наследственным (аутосомно-рецессивным) глюкокортикоидрезистентным нефротическим синдромом (ген NPHS2, сегмент 1q25—q31). Описан наследственный (аутосомно-доминантный) фокально-сегментарный гломерулосклероз, связанный с мутациями в сегментах 11q21—q22 и 19q13.
Патогенез фокально-сегментарного гломерулосклероза
Этиология фокально-сегментарного гломерулосклероза неизвестна. Высокая частота рецидивов в пересаженной почке, часто развивающихся в первые же часы после операции, говорит о роли неких системных факторов. Природа этих факторов и причины их образования неясны. У детей, чьи матери страдали фокально-сегментарным гломерулосклерозом во время беременности, при рождении отмечается нефротический синдром, но через несколько недель он исчезает без всякого лечения. Разработаны биологические пробы, основанные на том, что плазма больных фокально-сегментарным гломерулосклерозом увеличивает проницаемость клубочкового фильтра крыс для альбумина.
В ряде работ отмечалось, что если это свойство плазмы у реципиентов почки постоянно сохраняется, то риск рецидива болезни после трансплантации почки повышен; впрочем, в некоторых других работах это не подтвердилось. Некоторые специалисты считают болезнь минимальных изменений и фокально-сегментарный гломерулосклероз вариантами одного и того же заболевания, отличающимися степенью тяжести. Стоит также отметить, что гломерулосклероз может быть не столько причиной, сколько следствием протеинурии.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фокально-сегментарный гломерулосклероз
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Фокальный сегментарный гломерулосклероз - весьма редкий вариант гломерулонефрита, наблюдается у 5-10% взрослых больных с хроническим гломерулонефритом (за последние 20 лет - у 6%).
Код по МКБ-10
Причины фокально-сегментарного гломерулосклероза
Как и при минимальных изменениях клубочков, при фокальном сегментарном гломерулосклерозе основной патологией является поражение эпителиальных клеток (подоцитов), выявляемое лишь при электронной микроскопии, и обсуждается возможная роль тех же факторов, ответственных и за сосудистую проницаемость, и за «подоцитоз». Однако при фокальном сегментарном гломерулосклерозе изменения подоцитов, которые не способны к репликации, постепенно приводят к развитию склероза. Подтверждением возможной роли циркулирующего патологического фактора может служить описание женщины со стероидрезистентным фокальным сегментарным гломерулосклерозом, которая родила двоих детей с протеинурией и гипоальбуминемией: у обоих детей протеинурия и нефротический синдром исчезли соответственно через 2 и 3 нед после рождения.
Несмотря на умеренные морфологические изменения, течение болезни прогрессирующее, полные ремиссии наблюдаются редко. Прогноз серьёзный, особенно при нефротическом синдроме; это один из наиболее неблагоприятных вариантов гломерулонефрита, довольно редко отвечающий на активную иммунодепрессивную терапию. Спонтанные ремиссии крайне редки. У взрослых 5-летняя выживаемость составляет 70-73%.
Если вообще у взрослых это весьма редкий вариант нефрита, то среди больных терминальной почечной недостаточности его доля значительно возрастает. Так, по данным USRDS (регистр больных с терминальной почечной недостаточностью в США), опубликованным в 1998 г., среди 12 970 больных с известной морфологической формой гломерулонефрита, которые получали заместительную почечную терапию в 1992-1996 гг., у 6497 (50%) был фокальный сегментарный гломерулосклероз.
Симптомы фокально-сегментарного гломерулосклероза
Симптомы фокально-сегментарного гломерулосклероза характеризуются нефротическим синдромом (67% случаев) или персистирующей протеинурией, у большинства больных сочетается с гематурией (хотя макрогематурия редка), у половины - с артериальной гипертензией.
Наблюдается у 15-20% больных с нефротическим синдромом, чаще у детей, у которых фокальный сегментарный гломерулосклероз является наиболее частой причиной стероидрезистентного нефротического синдрома.
Морфологически характеризуется сегментарным гломерулосклерозом (склерозируются отдельные сегменты клубочков) части клубочков (фокальные изменения); остальные клубочки в начале болезни интактны.
При иммуногистохимическом исследовании выявляют IgM. Нередко этот морфологический тип изменений трудно отличить от «минимальных изменений» клубочка; обсуждаются возможности перехода «минимальных изменений» в фокально-сегментарный гломерулосклероз (ФСГС). Существует мнение, разделяемое не всеми авторами, что это - разной тяжести варианты или разные стадии одного и того же заболевания, объединяемые термином «идиопатический нефротический синдром».
Где болит?
Что нужно обследовать?
Как обследовать?
Какие анализы необходимы?
К кому обратиться?
Лечение фокально-сегментарного гломерулосклероза
Больные фокальным сегментарным гломерулосклерозом без нефротического синдрома с клинической картиной латентного или гипертонического нефрита имеют сравнительно благоприятный прогноз (10-летняя почечная выживаемость >80%). Этим больным обычно активная иммунодепрессивная терапия не показана (за исключением случаев, когда нарастание активности проявляется другими признаками - остронефритическим синдромом). При фокальном сегментарном гломерулосклерозе без нефротического синдрома показаны антигипертензивные препараты, в первую очередь ингибиторы АПФ, которые обладают антипротеинурическим действием и замедляют развитие и прогрессирование хронической почечной недостаточности при этом целевой уровень АД должен составлять 120- 125/80 мм рт.ст.
У больных фокальном сегментарном гломерулосклерозе с нефротическим синдромом прогноз серьёзный: терминальная почечная недостаточность (ТПН) наступает через 6-8 лет, причём при протеинурии >14 г/24 ч - уже через 2-3 года.
Развитие ремиссии нефротического синдрома значительно улучшает прогноз. Так, среди больных, ответивших на лечение полной или частичной ремиссией, частота терминальной почечной недостаточности за 5,5 лет наблюдения составила 28% по сравнению с 60% у резистентных больных. Прогноз зависит также от стабильности ремиссии: рецидив нефротического синдрома делает прогноз таким же плохим, как у первично-резистентных больных. Однако в начале болезни нет надёжных клинических или морфологических признаков, способных предсказать результаты лечения фокально-сегментарного гломерулосклероза. Лучшим индикатором прогноза у больных фокальным сегментарным гломерулосклерозом с нефротическим синдромом является сам факт ответа на лечение фокально-сегментарного гломерулосклероза - развитие ремиссии нефротического синдрома.
Длительное время считали, что лечение фокально-сегментарного гломерулосклероза с нефротическим синдромом иммунодепрессантами бесперспективно. В настоящее время показано, что у части больных при длительном лечении может наступить полная или частичная ремиссия. Повышение частоты ремиссий связано с увеличением длительности начальной терапии глюкокортикоидами. В исследованиях, в которых удавалось достичь большой частоты ремиссий, начальную дозу преднизолона [обычно 1 мг/кгхсут), вплоть до 80 мг/сут] поддерживали в течение 2-3 мес, а затем постепенно снижали в течение последующего лечения.
Среди взрослых больных, отвечающих на лечение фокально-сегментарного гломерулосклероза глюкокортикоидами, менее чем у 1/3 полные ремиссии развиваются через 2 мес, а у большинства - через 6 мес от начала терапии. Время, необходимое до развития полной ремиссии, составляет в среднем 3-4 мес. Исходя из этого в настоящее время предлагают определять стероидную резистентность у взрослых больных с первичным фокальным сегментарным гломерулосклерозом как сохранение нефротического синдрома после 4 мес лечения преднизолоном в дозе 1 мг/кгхсут).
Кортикостероидное лечение фокально-сегментарного гломерулосклероза с первичным фокальным сегментарным гломерулосклерозом показано при наличии нефротического синдрома; относительно сохранной функции почек (креатинин не более 3 мг%); отсутствии абсолютных противопоказаний для кортикостероидной терапии.
При впервые возникшем нефротического синдрома назначают:
- преднизолон в дозе 1-1,2 мг/кгхсут) в течение 3-4 мес;
- при развитии полной или частичной ремиссии дозу снижают до 0,5 мг/кгхсут) (или 60 мг через день) и лечение фокально-сегментарного гломерулосклероза продолжается ещё 2 мес, после чего преднизолон постепенно (в течение 2 мес) отменяют;
- у больных, не ответивших на начальный курс, дозу преднизолона можно снижать быстрее - в течение 4-6 нед;
- больным старше 60 лет преднизолон назначают через день (1-2 мг/кг в течение 48 ч, максимально 120 мг в течение 48 ч) - результаты сравнимы с эффектом у молодых пациентов, получающих преднизолон каждый день. Это можно объяснить возрастным снижением клиренса кортикостероидов, что продлевает их иммунодепрессивное воздействие;
- цитостатики в сочетании с глюкокортикоидами в качестве начальной терапии не увеличивают частоту ремиссий по сравнению с одними только глюкокортикоидами. Однако в дальнейшем у больных, получавших цитостатики, наблюдается меньше рецидивов, чем у получавших только кортикостероиды (18% по сравнению с 55%), т.е. ремиссии оказываются более стабильными. Если ремиссия сохраняется более 10 лет, вероятность рецидивов мала.
Лечение рецидивов у больных, отвечающих на лечение глюкокортикоидами
Лечение фокального сегментарного гломерулосклероза, резистентного к стероидам
Это наиболее сложная проблема. Используют 2 подхода - лечение цитостатиками или циклоспорином А.
С. Ponticelli и соавт. (1993) сообщили о 50% ремиссий (21% полных и 29% частичных) при лечении циклоспорином стероидрезистентных взрослых с нефротическим синдромом и фокальным сегментарным гломерулосклерозом. Однако авторы определяли стероидную резистентность как отсутствие ответа после 6 нед лечения преднизолоном 1 мг/(кгхсут), что не соответствует современным критериям (4 мес безуспешного лечения фокально-сегментарного гломерулосклероза). После отмены лекарств частота рецидивов была высокой, однако число случаев терминальной почечной недостаточности было в 3 раза меньше, чем у больных, получавших плацебо. У части больных, у которых ремиссия поддерживалась циклоспорином длительное время (не менее года), появилась возможность медленно отменить препарат без развития рецидива.
Таким образом, хотя у больных со стероидной резистентностью ни один из подходов не обладает достаточной эффективностью, циклоспорин, видимо, имеет некоторое преимущество перед цитостатиками.
Циклоспорин у больных фокальным сегментарным гломерулосклерозом с уже имеющейся почечной недостаточностью и тубулоинтерстициальными изменениями следует применять с осторожностью. У больных, нуждающихся в продолжении лечения циклоспорином более 12 мес, необходима повторная биопсия почки для оценки степени нефротоксичности (выраженности интерстициального склероза).
Неиммунные методы лечения фокально-сегментарного гломерулосклероза
При фокальном сегментарном гломерулосклерозе наиболее эффективны ингибиторы АПФ; определённого успеха можно достичь и гиполипидемической терапией.
Таким образом, при лечении больных фокальным сегментарным гломерулосклерозом необходимо руководствоваться следующими положениями:
Хронический гломерулонефрит у детей
Хронический гломерулонефрит у детей - группа заболеваний почек с преимущественным поражением клубочков, имеющих различные этиологию, патогенез, клинико-морфологические проявления, течение и исход.
Основные клинические типы гломерулонефрита (острый, хронический и быстропрогрессирующий) - самостоятельные нозологические формы, но их характерные признаки могут встречаться и при многих системных заболеваниях.
Эпидемиология
Заболеваемость гломерулонефритом в среднем составляет 33 на 10 000 детей. Каждый год в США выявляют 2 новых больных с первичным нефротическим синдромом на 100 000 детей. В последние годы отмечают тенденцию к увеличению частоты стероид-резистентного нефротического синдрома (СРНС) у детей и взрослых преимущественно за счёт фокально-сегментарного гломерулосклероза (ФСГС).
ФСГС у детей с нефротическим синдромом выявляют в 7-10% всех почечных биопсий, произведённых в связи с протеинурией. Нефротический синдром чаще встречается в Азии, чем в Европе.
Мембранозная нефропатия - один из наиболее частых вариантов хронического гломерулонефрита у взрослых пациентов и составляет в среднем 20-40% в структуре всех гломерулонефритов. У детей мембранозная нефропатия с нефротическим синдромом встречается менее чем в 1% случаев.
МПГН достаточно редко встречается у детей - лишь в 1-3% всех биопсий.
Наиболее часто гломерулонефриты у детей выявляют в возрасте от 5 до 16 лет. Манифестация идиопатического нефротического синдрома в большинстве случаев происходит в 2-7 лет. Заболевание у мальчиков возникает в 2 раза чаще, чем у девочек.
IgA-нефропатия - одна из наиболее часто встречаемых форм первичных гломерулопатий в мире: её распространённость варьирует от 10-15% в США до 50% в Азии. IgA-нефропатию чаще выявляют у лиц мужского пола в соотношении 2:1 (в Японии) и 6:1 (в северной Европе и США). Семейные случаи наблюдают у 10-50% больных в зависимости от региона проживания.
Частота БПГН до настоящего времени не установлена, что связано с редкостью патологии, особенно у детей. Большинство исследований БПГН носят описательный характер и проведены в небольших группах пациентов.
Причины хронического гломерулонефрита
Причины хронического гломерулонефрита у детей в основном остаются невыясненными, этиологический фактор удаётся установить только в 5-10% случаев.
Иногда находят персистирование вирусов (гепатита В, С, герпеса, вируса Эпштейна-Барр). Обострение процесса может быть обусловлено перенесёнными интеркуррентными заболеваниями (ОРВИ, обострением тонзиллита, детскими инфекциями). Однако существенную роль в становлении хронического процесса играет генетически обусловленный иммунный ответ данного индивидуума на антигенное воздействие.
Прогрессирование гломерулонефрита характеризуется клеточной пролиферацией, накоплением внеклеточного матрикса с последующим склерозом и сморщиванием почек. Ведущую роль играют при этом неиммунные механизмы, такие как системная и внутриклубочковая артериальная гипертензия, длительная протеинурия, гиперлипидемия. Эти факторы приводят к стимуляции системного и местного повышения количества ангиотензина II (АТ II), который служит мощным стимулом к пролиферации мезангиальных клеток с последующим развитием фиброза и склероза.
По морфологии выделяют:
- пролиферативные ГН: мезангиопролиферативный ГН (МзПГН), мезангиокапиллярный, или мембранопролиферативный ГН (МПГН), экстракапиллярный с полулуниями (БПГН);
- непролиферативные ГН: минимальные изменения (НСМИ), мембранозный ГН, фокально-сегментарный гломерулосклероз (ФСГС).
Симптомы хронического гломерулонефрита
Хронический гломерулонефрит - заболевание, как правило, с прогрессирующим течением, приводящим к развитию хронического гломерулонефрита при большинстве морфологических вариантов уже в детском возрасте. В педиатрической нефрологии хронический гломерулонефрит занимает 2-е место в структуре причин хронической почечной недостаточности после группы врождённых и наследственных нефропатий.
Течение хронического гломерулонефрита у детей может быть рецидивирующим, персистирующим и прогрессирующим. Рецидивирующее течение характеризуется лекарственными или спонтанными ремиссиями различной продолжительности. Для персистирующего варианта характерна непрерывная активность процесса с сохранной функцией почек на ранних стадиях. Однако через несколько лет наступает исход в ХПН. При прогрессирующем течении отмечают более быстрое развитие хронического гломерулонефрита у детей - через 2-5 лет от начала заболевания. Прогноз хронического гломерулонефрита зависит от клинико-морфологического варианта и своевременной адекватной терапии.
Нефротическая форма хронического гломерулонефрита или идиопатический нефротический синдром.
Заболевают дети в возрасте от 3 до 7 лет, в анамнезе - перенесённый ранее острый первый эпизод. Последующие обострения при правильном наблюдении за больными редко сопровождаются значительными отёками. Обострение процесса обычно (60-70%) развивается после интеркуррентных заболеваний (ОРВИ, детские инфекции) или на фоне полного здоровья (30-40%). Родители отмечают небольшую пастозность век. В анализе мочи определяют повышение содержания белка. В редких случаях при плохом наблюдении формируются выраженные отёки. При лабораторных исследованиях находят все отклонения, типичные для НС.
Наиболее частый (85-90%) морфологический вариант - болезнь минимальных изменений (НСМИ). Этот термин связан с тем, что при световой микроскопии клубочки не изменены. При электронной микроскопии видно «расплавление» малых ножек подоцитов. У большинства больных этой группы отмечают высокую чувствительность к терапии глюкокортикоидами. Фокально-сегментарный гломерулосклероз (ФСГС) возникает реже (10-15%). При световой микроскопии клубочки выглядят неизменёнными или видна небольшая пролиферация мезангиальных клеток. При электронной микроскопии находят утолщение подоцитов, но характерным признаком служит наличие в части клубочков сегментарного мезангиального склероза. Также отмечается атрофия канальцевого эпителия, инфильтрация и фиброз интерстиция.
Для клинической картины заболевания при ФСГС характерно присоединение к нефротическому синдрому гипертензии и гема-турии, а также развитие гормонорезистентности. В этом случае необходимо проводить биопсию почек для уточнения морфологической картины заболевания для решения вопроса о тактике дальнейшего лечения.
Различают несколько вариантов течения хронического гломерулонефрита с нефритическим синдромом:
- часто рецидивирующее течение (не менее 4 рецидивов в год или двух рецидивов за 6 мес);
- редко рецидивирующее течение (менее двух рецидивов за 6 мес). Прогноз у большинства больных с НСМИ благоприятный.
Рецидивы НС урежаются после 5 лет от начала заболевания. Прогрессирования заболевания у основной группы с НСМИ не происходит, функция почек не нарушается. У небольшой группы может продолжаться рецидивирование обострений, как правило, проявляющееся только протеинурией. Если НС представлен морфологическим вариантом - ФСГС, прогноз неблагоприятный. Большинство больных резистентны к терапии, у них происходит постепенное снижение функций почек, прогрессирование АГ и развитие ХПН в течение от 1-20 лет.
Гематурическая форма хронического гломерулонефрита у детей
Гематурическая форма хронического гломерулонефрита характеризуется рецидивирующей изолированной (без отёков и АГ) макро- или микрогематурией в сочетании с протеинурией менее 1 г/сут или без неё, возникающей спустя 2-5 дней после острого заболевания дыхательных путей. Чаще всего в основе заболевания лежит своеобразная форма ГН, которая получила название болезнь Берже, или IgA-нефропатия. В настоящее время болезнь Берже считают одной из наиболее распространённых гематурических гломерулопатий во многих странах мира. Почти у половины детей с гемагурической формой гломерулонефрита обнаруживают болезнь Берже. Заболевание чаще встречается у мальчиков и детей старше 10 лет.
Этиологию связывают с вирусной или бактериальной инфекцией верхних дыхательных путей, а также с носительством НВ5- антигена. Однако чаще причина остаётся неустановленной.
В патогенезе гематурической формы основную роль играют иммунокомплексные механизмы. Если в состав ИК входит IgА, то такой вариант носит название IgА-нефропатия, или болезнь Берже.
Морфологически это мезангиопролиферативный гломерулонефрит, который характеризуется пролиферацией мезангиальных клеток, расширением мезангиального матрикса, отложением ИК в мезангии и субэндотелии.
Клинически выделяют следующие варианты течения:
- рецидивирующая макрогематурия, которую провоцирует ОРВИ. Длительность эпизодов макрогематурии может варьироваться от нескольких недель до нескольких лет. Между эпизодами анализы мочи могут оставаться нормальными;
- единственный эпизод макрогематурии с последующей персистенцией микрогематурии.
Течение заболевания - рецидивирующее или персистирующее с медленным прогрессированием. Прогноз ухудшается при присоединении артериальной гипертензии и нефротического синдрома.
Смешанная форма хронического гломерулонефрита
Сравнительно редкое заболевание у детей, чаще встречается у подростков. Начало заболевания связывают с предшествующей вирусной инфекцией, персистенцией вируса гепатита В. Однако в большинстве случаев причина возникновения и обострений остаётся неизвестной.
Наиболее частый морфологический вариант - мембрано-пролиферативный (мезангиокапиллярный) гломерулонефрит. Морфологическая картина характеризуется диффузной мезангиальной пролиферацией и увеличением мезангиального матрикса с его интерпозицией между базальной мембраной клубочков и эндотелиальными клетками, что приводит к утолщению и двухконтурности базальных мембран.
Симптомы хронического гломерулонефрита у детей проявляются сочетанием нефротического синдрома с гематурией и/или артериальной гипертензией. Диагноз подтверждают биопсией почек.
Течение заболевания - прогрессирующее с упорной АГ, выраженной упорной протеинурией и ранним нарушением функции почек с развитием ХПН в течение 10 лет от начала заболевания. В некоторых случаях удаётся достичь клинической ремиссии. Рецидив заболевания может развиваться даже в пересаженной почке.
Острый гломерулонефрит (нефритический синдром) - симптомы и лечение
Что такое острый гломерулонефрит (нефритический синдром)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Застело Елены Сергеевны, детского нефролога со стажем в 15 лет.
Над статьей доктора Застело Елены Сергеевны работали литературный редактор Вера Васина , научный редактор Кирилл Лелявин и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Острый гломерулонефрит (Acute glomerulonephritis) — это группа заболеваний почек, которые отличаются по своей структуре, подходам к лечению и причинам, но все они в первую очередь приводят к повреждению почечных клубочков. Клубочками, или гломерулами, называют пучки кровеносных сосудов с мелкими порами, через которые в почках фильтруется кровь.
При развитии болезни в моче внезапно появляется кровь и выявляется белок, повышается артериальное давление, возникают отёки и может временно нарушиться работа почек.
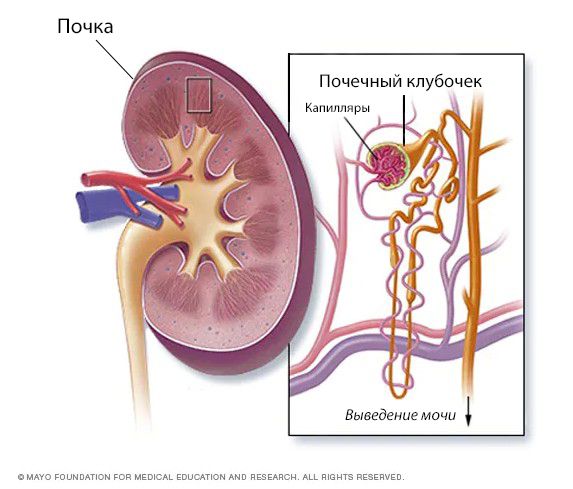
Заболевание впервые описал английский врач Р. Брайт в 1827 году. В честь него все нефриты долгое время, вплоть до 1950-х годов, назывались «болезнью Брайта». В начале XX века Ф. Фольгарт и Т. Фар создали первую классификацию гломерулонефритов, выделив острые и хронические формы болезни. Разработанная в 1951 году техника биопсии почек позволила составить алгоритмы лечения для различных видов гломерулонефрита [1] .
Распространённость
Острый гломерулонефрит встречается у пациентов всех возрастов, но выделяют два пика заболеваемости: в 5–12 лет и после 60 лет [3] [4] . Чаще гломерулонефритом болеют мужчины.
Ежегодно выявляют около 470 000 случаев острого гломерулонефрита, уровень заболеваемости колеблется от 9 до 29 случаев на 100 000 населения [3] [4] .
В России гломерулонефрит — это ведущая причина терминальной стадии хронической болезни почек. Эта болезнь несовместима с жизнью и требует дорогостоящей почечной заместительной терапии: диализа и трансплантации донорской почки [19] .
Причины острого гломерулонефрита
Острый гломерулонефрит зачастую возникает после перенесённой инфекции, вызванной бета-гемолитическим стрептококком группы А (БГСА).
К болезням почек могут приводить следующие штаммы:
- 1, 4, 12 (вызывают болезнь после фарингита);
- 2, 49, 55, 57, 60 (после кожных инфекций) [16] .
Такой гломерулонефрит называют острым постстрептококковым гломерулонефритом (ОПСГН) [2] . Риск развития ОПСГН зависит от локализации инфекции: после фарингита он возникает в 5–10 % случаев, после кожной инфекции, например стрептодермии, — в 25 % случаев [5] [6] . В последнее время ОПГСН в развитых странах встречается всё реже.
Стрептококк может также вызывать ангину, тонзиллит и скарлатину, поэтому эти заболевания часто предшествуют острому гломерулонефриту. Однако в большинстве случаев точную причину гломерулонефрита установить не удаётся: в посевах мочи и крови возбудитель отсутствует, в истории болезни нет перенесённых инфекций [1] [3] [11] [15] .
Помимо стрептококка, к развитию острого гломерулонефрита могут приводить:
- токсические факторы — отравление свинцом и ртутью, употребление органических растворителей и алкоголя, приём некоторых лекарств (Амикацина, рентгеноконтрастных препаратов);
- другие инфекции — бактерии (стафилококк, энтерококк, диплококк, бледная трепонема и др.), вирусы (цитомегаловирус, вирусы простого герпеса, гепатита В, Эпштейна — Барр, коронавирус).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острого гломерулонефрита
Острый гломерулонефрит может около трёх недель протекать без симптомов [2] [4] [10] . Затем развивается характерный острый нефритический синдром, включающий основные проявления болезни:
- отёки;
- гематурию (кровь в моче);
- гипертонию [12][15] .
Отёки возникают у 80–90 % пациентов [16] . Появление отёков при остром гломерулонефрите вызвано задержкой натрия и замедленной фильтрацией крови в клубочках [16] . У детей отёки распространяются по всему телу, у взрослых, как правило, отекают только ноги и лицо. В 10–50 % случаев отёки сопровождаются тупыми болями в пояснице, которые возникают из-за воспаления и растяжения капсулы почки.
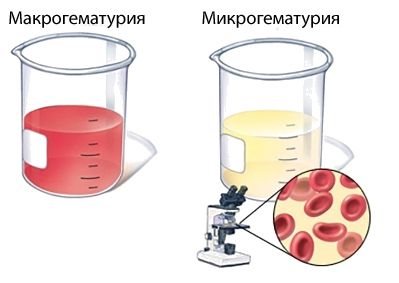
Моча приобретает красный оттенок и становится цвета «мясных помоев» у 30–50 % больных [16] . Видимое окрашивание мочи сгустками крови называют макрогематурией. У остальных пациентов развивается микрогематурия — в моче присутствует небольшое количество эритроцитов, но кровь в моче не видна. Гематурия — это самое типичное проявления болезни, она может быть единственным симптомом гломерулонефрита и сохраняться в течение нескольких месяцев после перенесённого заболевания.
Гипертония развивается у 50–90 % пациентов, из них более чем у 75 % больных давление сильно повышено [16] [19] . Гипертония может протекать бессимптомно или проявляться головными болями. Основные причины высокого давления при остром гломерулонефрите — это увеличение объёма циркулирующей крови, связанное с задержкой жидкости и натрия, а также повышение сердечного выброса и периферического сосудистого сопротивления.
С первых дней болезни уменьшается объём выделяемой мочи (диурез). При лечении он восстанавливается через 4–7 дней, после чего исчезают отёки и нормализуется артериальное давление (гипертония обычно наиболее выражена в разгар заболевания [16] ). Однако ещё в течение полугода отдельные симптомы могут сохраняться.
Острый постстрептококковый гломерулонефрит может протекать в двух формах:
- циклически — типичный вариант;
- ациклически — только с одним симптомом, атипичный вариант.
Циклическое течение
Болезнь начинается остро: состояние резко ухудшается, появляется выраженная слабость, тошнота, рвота и повышается температура.
Затем развивается нефритический синдром:
- с почечными симптомами — уменьшается объём выделенной мочи, в ней появляется кровь, белок и цилиндрические тельца;
- с внепочечными симптомами — болит голова, живот или поясница, возникает слабость, астения, снижается или пропадает аппетит.
Пациент, как правило, вспоминает, что этим симптомам предшествовала ангина, тонзиллит, скарлатина или другая бактериальная инфекция. Скрытый период после ангины и обострения хронического тонзиллита составляет 2–4 недели, после стрептодермии — 8–12 недель.
Ациклическое течение
Снижается диурез, появляется гематурия, но внепочечные симптомы не возникают, поэтому заболевание обычно переносится легче. Предугадать, как будет развиваться гломерулонефрит, невозможно — течение болезни зависит от состояния иммунной системы.
Патогенез острого гломерулонефрита
Известно, что гломерулонефрит развивается под действием бактериальных и токсических факторов, однако патогенез заболевания до конца не изучен. Выделяют три основных механизма развития болезни: иммунный, гемодинамический и метаболический. Наибольшее значение имеет первый фактор [16] [18] [19] [21] .
К иммунным механизмам развития гломерулонефрита относятся:
- образование иммунных комплексов в клубочках;
- захват клубочками циркулирующих иммунных комплексов;
- перекрёстная реакция между антигенами;
- прямая активации системы комплемента антигенами в клубочках [7][8][9] .
Рассмотрим эти механизмы более подробно на примере острого постстрептококкового гломерулонефрита (ОПСГН). Антиген нефритогенного, т. е. опасного для почек штамма, откладывается в клубочках, что запускает иммунные реакции.
Иммунная система состоит из гуморального и клеточного иммунитета. Клетки гуморального иммунитета — это B-лимфоциты, которые первыми встречают антигены. К антигенам относятся, например, вещества, которые содержатся в микроорганизмах или выделяются ими. Эти вещества организм рассматривает как чужеродные или потенциально опасные и начинает вырабатывать против них антитела. При остром гломерулонефрите клетки гуморального иммунитета вырабатывают нефритогенные антистрептококковые антитела. Эти антитела связываются с антигенами и образуются иммунные комплексы.
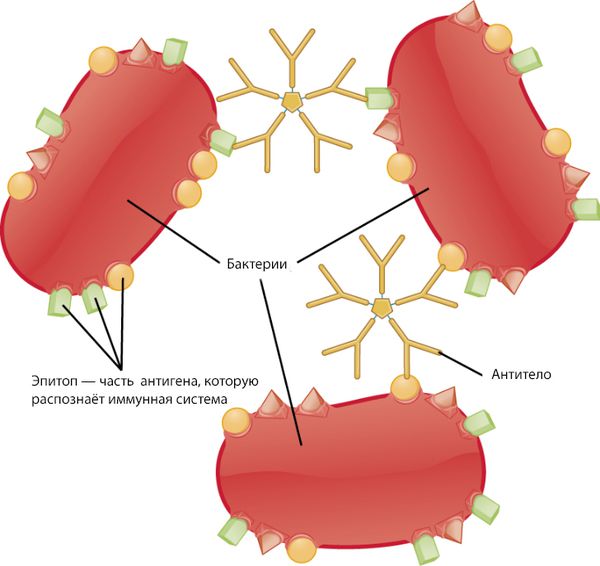
Затем активируется клеточный иммунитет. Его агенты — это макрофаги и Т-лимфоциты: Т-хелперы, Т-киллеры и Т-супрессоры [10] . При этом запускается система комплимента по классическому типу, из-за чего вырабатываются дополнительные медиаторы воспаления и привлекаются провоспалительные клетки. Система комплемента — это комплекс белков, которые защищают организм от действия чужеродных агентов. Из-за активации этой системы почечные клубочки начинают разрушаться [7] .
Повреждённые клетки вырабатывают провоспалительные цитокины: IL-1, IL-6, TNF-a, из-за чего клубочки пропитываются лейкоцитами и моноцитами, а макрофаги вызывают отёк тканей.
Стрептококковые М-белки и пирогенные экзотоксины (токсины, которые вызывают повышение температуры) выступают в качестве суперантигенов, т. е. могут массово активировать Т-лимфоциты, вырабатывающие провоспалительные цитокины. В активный период гломерулонефрита образуются специфические антитела и криоглобулины, что приводит к аутоиммунному воспалению [11] .
Согласно последним исследованиям, гломерулонефрит развивается из-за генетических нарушений Т-клеточного звена иммунитета [19] .
Классификация и стадии развития острого гломерулонефрита
По характеру течения гломерулонефрит бывает:
- острым;
- подострым (с бурным, часто злокачественным течением и развитием острой почечной недостаточности); .
По этиологическому фактору:
- Инфекционный — бактериальный, вирусный и паразитарный.
- Токсический — вызванный действием органических растворителей, лекарств, алкоголя, свинца и ртути.
- Гломерулонефриты при системных заболеваниях:
- Люпус-нефрит — осложнение системной красной волчанки.
- IgA-нефропатия — вид гломерулонефрита, который может длительно проявляться только микрогематурией, артериальное давление при этом не повышается. Макрогематурия развивается при присоединении респираторной инфекции или воспалении других слизистых оболочек.
- Пурпура Шенлейна — Геноха — воспаление мелких сосудов, проявляется геморрагической сыпью, артритом и болью в животе.
По морфологической картине:
- минимальные изменения;
- фокальный сегментарный гломерулосклероз;
- мембранозный гломерулонефрит (нефропатия);
- мезангиопролиферативный гломерулонефрит (IgA-нефропатия);
- мембранопролиферативный гломерулонефрит;
- полулунный гломерулонефрит;
- фибропластический гломерулонефрит (диффузный склероз) [4][10] .
Морфологические данные выявляются при биопсии почек. Их интерпретацией занимаются морфолог и клиницист.
Осложнения острого гломерулонефрита
Заболевание опасно следующими осложнениями:
- Острое почечное повреждение, острая или хроническая почечная недостаточность.
- Острая сердечная недостаточность — нарушается ритм сердца, его способность сокращаться и расслабляться, меняется степень напряжения сердечной мышцы перед и во время сокращения (преднагрузка и постнагрузка). Может возникать как у людей, страдающих болезнями сердца, так и у здоровых пациентов. Осложнение опасно для жизни и требует срочного лечения [13] .
- Энцефалопатия — накопление в головном мозге токсических органических кислот. Сопровождается неврологическими симптомами, уменьшить которые можно при помощи гемодиализа или перитонеального диализа. К ранним признакам уремической энцефалопатии относятся снижение внимания, быстрая утомляемость и апатия. В дальнейшем эти симптомы усиливаются, ухудшается память, возникает дезориентация в пространстве и неустойчивость настроения, нарушается режим сна и бодрствования [16][18] . — может возникать при беременности.
Без своевременной диагностики и лечения острого гломерулонефрита пациент может погибнуть [15] .
Диагностика острого гломерулонефрита
При подозрении на острый гломерулонефрит проводится лабораторная и инструментальная диагностика.
Лабораторная диагностика
- Общий анализ мочи. Для гломерулонефрита характерны:
- Гематурия (наличие крови в моче) — обязательный симптом для постановки диагноза «острый гломерулонефрит». Микрогематурия может сохраняться в течение многих месяцев после перенесённого заболевания.
- Протеинурия (наличие белка в моче) — чаще всего при заболевании возникает протеинурия лёгкой степени тяжести.
- Лейкоцитурия (более шести лейкоцитов в поле зрения) — встречается примерно у половины пациентов, присутствует в течение 10–14 дней [16] .
- Цилиндрурия — в моче выявляются эритроцитарные, гранулярные и лейкоцитарные цилиндры.
- Общий анализ крови — повышается уровень лейкоцитов, нейтрофилов и эозинофилов, наблюдается сдвиг лейкоцитарной формулы влево, увеличивается СОЭ и уменьшается концентрация гемоглобина.
- Биохимия крови — при гломерулонефрите повышен уровень креатинина и мочевины, снижается скорость клубочковой фильтрации (СКФ), т. е. нарушается работа почек. В большинстве случаев эти изменения необратимы, некоторым больным может потребоваться диализная терапия.
- Серологическое исследование крови на антистрептолизин-О — при остром постстрептококковом гломерулонефрите повышен уровень антистрептококковых антител.
- Коагулограмма — при болезни сокращается протромбиновое время, повышается протромбиновый индекс, снижается содержание антитромбина III и угнетается фибринолитическая активность, т. е. способность крови растворять тромбы.
Инструментальная диагностика
- Ультразвуковая диагностика почек — оцениваются размеры почек, структурные нарушения, наличие пороков и аномалий развития. Исследование проводится для дифференциальной диагностики с другими болезнями почек.
- Биопсия почек — показана в тех случаях, когда назначенная терапия оказалась неэффективной. С помощью биопсии можно уточнить тип гломерулонефрита, определить прогноз и тактику лечения [15] . Показания к биопсии: отягощённая наследственность по заболеваниям почек, нетипичные симптомы, высокая концентрация белка в моче и прогрессирующее снижение СКФ.
Основным критерием диагностики гломерулонефритов является морфологическая картина (т. е. состояние клеток и тканей почечных клубочков), так как она индивидуальна для каждого типа заболевания [16] [18] [19] [20] .
Дифференциальная диагностика острого и хронического гломерулонефритов
Лечение острого гломерулонефрита
При лечении острого гломерулонефрита применяют немедикаментозную, антибактериальную, симптоматическую и иммуносупрессивную терапию. В тяжёлых случаях может потребоваться заместительная терапия.
Лечение может проходить как амбулаторно, так и в больнице.
Показания к госпитализации:
- возраст до 18 лет;
- нарушение работы почек (как с уменьшением диуреза, так и без этого симптома);
- сохраняющаяся или нарастающая гипертония;
- признаки острой сердечной недостаточности;
- нефротический синдром.
Немедикаментозная терапия
- При тяжёлом течении болезни показаны покой и постельный режим. К признакам тяжёлого течения относятся кровь в моче, заметная визуально, отёки по всему телу и симптомы сердечной недостаточности.
- Следует потреблять до 1–2 г соли в сутки. Если появились отёки, особенно если они нарастают, нужно сократить потребление соли до 0,2–0,3 г в сутки [16] .
- При снижении функции почек рекомендуется есть менее 0,5 г/кг белка в сутки. Его количество нужно сократить за счёт животных белков, сохранив при этом калорийность рациона и содержание витаминов [15] .
- В острый период болезни следует меньше пить, необходимый объём жидкости рассчитывают с учётом диуреза за предыдущий день + 300 мл.
Диета и постельный режим помогают жидкости не задерживаться в организме. Питание и режим можно скорректировать после того, как исчезнут отёки и давление придёт в норму [16] .
Антибактериальная терапия
Всем пациентам с подтверждённой стрептококковой инфекцией (положительные результаты посевов с кожи, зева и высокие титры антистрептококковых антител в крови) рекомендуется проводить антибактериальную терапию. Её назначают с учётом чувствительности возбудителя. Наиболее часто применяются препараты пенициллинового ряда. Макролиды II и III поколений являются препаратами второй линии терапии [16] .
Симптоматическая терапия
Чтобы уменьшить отёки и предотвратить связанные с ними осложнения, назначаются мочегонные средства (диуретики) [16] . Для снижения артериального давления применяются блокаторы медленных кальциевых каналов. При выраженных изменениях со стороны крови, например повышенной свёртываемости, врач может назначить антикоагулянты. Продолжительность терапии зависит от различных факторов: тяжести заболевания, длительности почечных изменений по данным анализов, возраста и т. д.
Иммуносупрессивная терапия
При быстром развитии заболевания, сильных отёках и артериальном давлении выше 130/90 мм рт. ст. назначаются глюкокортикостероиды.
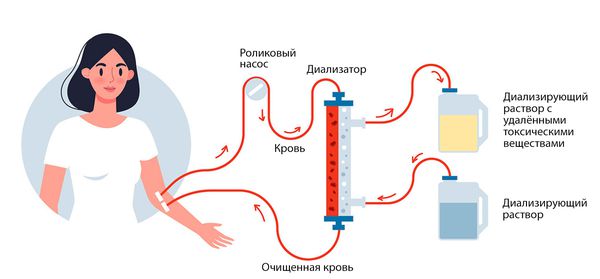
Заместительная почечная терапия
Заместительная терапия показана при развитии почечной недостаточности [15] .
Основные методы заместительной терапии:
- гемодиализ;
- перитонеальный диализ;
- трансплантация почки.
Прогноз. Профилактика
Прогноз в большинстве случаев благоприятный [7] . Как правило, отёки уменьшаются в течение 10 дней, уровень креатинина в сыворотке нормализуется за 3–4 недели [16] .
Среди детей осложнения встречаются редко. У пожилых пациентов может развиться острая сердечная и почечная недостаточность [14] . Тяжёлая почечная недостаточность возникает менее чем у 1 % больных [16] [18] .
Большинство пациентов полностью выздоравливают в течение 1–2 лет. В это период нужно соблюдать диету, терапия показана только при ухудшении клинических и лабораторных показателей.
Критический период после перенесённого острого гломерулонефрита составляет 1,5–2 месяца. В это время часто возникают рецидивы. Если симптомы сохраняются более полугода, такое течение называется затяжным. Симптомы, которые не проходят более года, указывают на развитие хронического гломерулонефрита.
Профилактика острого гломерулонефрита
Чтобы предотвратить развитие гломерулонефрита, нужно своевременно выявлять и лечить хронические заболевания. Для этого рекомендуется раз в год проходить осмотр у стоматолога, оториноларинголога и гинеколога.
Читайте также:
