Лечение криптококкового менингита. Лечение нейросифилиса при отсутствии иммунодефицита.
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Лечение криптококкового менингита. Лечение нейросифилиса при отсутствии иммунодефицита.
Диагностика криптококкового менингита основана на обнаружении характерных изменений в ЦСЖ — лимфоцитарного плеоцитоза, снижения концентрации глюкозы, а также выявлении криптококкового антигена в ЦСЖ.
Терапевтическая тактика при криптококковом менингите. Стандартным средством для лечения криптококкоза является амфотерицин В, который назначается самостоятельно (у больных СПИДом) или в комбинации с флуцитозином для пациентов без иммунодефицита. Амфотерицин В используется в дозе 0,3 мг/кг/сут. внутривенно (общая доза должна составлять не менее 1 — 1,5 г). Флуцитозин назначается внутрь в дозе 150 мг/кг/сут., разделенной на 4 приема. Лечение рекомендовано продолжать не менее 6 недель.
Побочные эффекты лечения криптококкового менингита. При лечении амфотерицином В нередко наблюдается нарушение функции почек. Это осложнение встречается у 80% больных, принимающих препарат. Частота его снижается при использовании комбинированного лечения амфотерицином В и флуцитозином. Исследование функции почек должно проводиться не реже, чем 2—3 раза в неделю в течение первого месяца лечения и один раз в неделю на протяжении оставшегося срока терапии.
Необходимо контролировать показатели креатинина в сыворотке, азота мочевины крови, калия в сыворотке, натрия и магния, бикарбоната и гемоглобина. При тщательном наблюдении за динамикой показателей натрия в сыворотке обычно удается предотвратить развитие патологии почек у больных, принимающих амфотерицин В.
Флуцитозин обычно хорошо переносится больными. Однако в отдельных случаях могут наблюдаться побочные эффекты, а именно подавление костномозгового кроветворения с анемией, лейкопенией и/или тромбоцитопенией. Эти гематологические изменения чаще всего встречаются у пациентов с концентрацией препарата в сыворотке более 100 мкг/мл. Поэтому следует тщательно следить за данным показателем и придерживаться концентрации флуцитозина в сыворотке менее 100 мкг/мл. Рекомендуемая доза флуцитозина 150 мг/кг/сут. может оказаться слишком высокой для некоторых больных.
В таком случае ее снижают до 75—100 мг/кг/сут. К побочным эффектам лечения флуцитозином относятся желудочно-кишечные расстройства, в том числе тошнота, рвота, диарея и выраженный энтероколит. Иногда развивается токсический гепатит.
Лечение нейросифилиса при отсутствии иммунодефицита.
Нейросифилис у больных без иммунодефицита протекает в одной из следующих клинических форм: (1) бессимптомный нейросифилис; (2) сифилитический менингит; (3) менинговаскулярный сифилис; (4) прогрессирующий паралич (dementia paralitica); (5) спинная сухотка. Диагноз нейросифилиса основан на специфических изменениях в ЦСЖ. Отмечается умеренный мононуклеарный плеоцитоз, умеренное повышение концентрации белка и положительная нетрепонемная реакция ЦСЖ на сифилис (VDRL — Venerial Disease Research Laboratory).
Отрицательные результаты последнего теста, тем не менее, не позволяют исключить нейросифилис. Известно, что реакция негативна у 30-57% больных нейросифилисом.
Терапевтическая тактика при нейросифилисе. Рекомендуется лечение пенициллином G в дозе 12-24 млн ЕД/сут. внутривенно (вводить по 2-4 млн ЕД каждые 4 ч) в течение 10-14 дней. Альтернативным препаратом является прокаин-пенициллин, назначаемый внутримышечно в дозе 2,4 млн ЕД/сут. и пробенецид внутрь в дозе 500 мг 4 раза в сутки. Оба средства применяются в течение 10—14 дней.
Прогноз нейросифилиса. Признаком эффективности лечения является снижение титра антител в тесте VDRL в сыворотке. Такие диагностические методы, как флуоресцентный тест абсорбции трепонемных антител (FTA-ABS) и тест микрогемагглютинации Т. Pallidum могут сохраняться позитивными в течение всей жизни больного. После окончания лечения число лейкоцитов в ЦСЖ должно быть в пределах нормы спустя 6 месяцев. Если этого не произошло, то показано проведение полного повторного курса лечения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Нейросифилис
Нейросифилис — инфекционное поражение центральной нервной системы, обусловленное проникновением в нее возбудителей сифилиса. Может возникнуть в любой период сифилиса. Нейросифилис проявляется симптомами менингита, менинговаскулярной патологии, менингомиелита, поражения задних канатиков и корешков спинного мозга, прогрессивного паралича или очагового поражения головного мозга в связи с образованием в нем сифилитической гуммы. Диагностика нейросифилиса основана на клинической картине, данных неврологического и офтальмологического обследования, МРТ и КТ головного мозга, положительных серологических реакциях на сифилис и результатах исследования ликвора. Лечение нейросифилиса проводится внутривенно большими дозами препаратов пенициллина.
Общие сведения
Еще несколько десятилетий назад нейросифилис был весьма распространенным осложнением сифилиса. Однако массовые обследования пациентов на сифилис, своевременное выявление и лечение инфицированных лиц привели к тому, что современная венерология все реже сталкивается с такой формой заболевания как нейросифилис, несмотря на то, что заболеваемость сифилисом неуклонно растет. Многие авторы считают также, что снижение случаев нейросифилиса связано с изменением патогенных характеристик его возбудителя — бледной трепонемы — в том числе и со снижением ее нейротропности.

Классификация нейросифилиса
Латентный нейросифилис не имеет никаких клинических проявлений, но при исследовании цереброспинальной жидкости пациента выявляются патологические изменения.
Ранний нейросифилис развивается на фоне первичного или вторичного сифилиса, в основном в первые 2 года заболевания. Но может возникнуть в течение 5-ти лет от времени заражения. Протекает с поражением преимущественно сосудов и оболочек мозга. К проявлениям раннего нейросифилиса относят острый сифилитический менингит, менинговаскулярный нейросифилис и сифилитический менингомиелит.
Поздний нейросифилис возникает не ранее чем через 7-8 лет от момента заражения и соответствует периоду третичного сифилиса. Характеризуется воспалительно-дистрофическим поражением паренхимы мозга: нервных клеток и волокон, глии. К поздним формам нейросифилиса относят спинную сухотку, прогрессивный паралич и сифилитическую гумму мозга.
Симптомы нейросифилиса
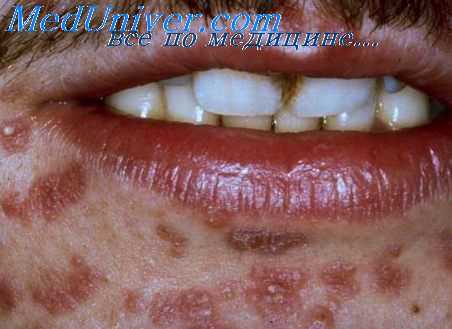
Острый сифилитический менингит характеризуется симптомами острого менингита: сильная головная боль, шум в ушах, тошнота и рвота не зависимо от приема пищи, головокружение. Часто протекает без подъема температуры тела. Отмечаются положительные менингиальные симптомы: ригидность мышц затылка, нижний симптом Брудзинского и симптомы Кернига. Возможно повышение внутричерепного давления. Нейросифилис в виде острого менингита развивается чаще всего в первые несколько лет заболевания сифилисом, в период его рецидива. Он может сопровождаться кожными высыпаниями или являться единственным проявлением рецидива вторичного сифилиса.
Менинговаскулярный нейросифилис развивается при сифилитическом поражении сосудов мозга по типу эндартериита. Проявляется острым нарушением кровообращения головного в виде ишемического или геморрагического инсульта, за несколько недель до которого пациента начинают беспокоить головные боли, нарушения сна, головокружения, появляются изменения личности. Возможно течение менинговаскулярного нейросифилиса с нарушением спинномозгового кровообращения и развитием нижнего парапареза, расстройств чувствительности и нарушений со стороны тазовых органов.
Сифилитический менингомиелит протекает с поражением оболочек и вещества спинного мозга. Имеет место медленно нарастающий спастический нижний парапарез, сопровождающийся выпадением глубокой чувствительности и дисфункцией тазовых органов.
Спинная сухотка возникает вследствие сифилитического воспалительного поражения и дегенерации задних корешков и канатиков спинного мозга. Эта форма нейросифилиса появляется в среднем через 20 лет от момента заражения. Характеризуется радикулитом с выраженным болевым синдромом, выпадением глубоких рефлексов и глубоких видов чувствительности, сенситивной атаксией, нейро-трофическими нарушениями. При нейросифилисе в форме спинной сухотки возможно развитие импотенции. Наблюдаются нейрогенные трофические язвы на ногах и артропатии. Характерен синдром Аргайла-Робертсона — неправильной формы суженные зрачки, не реагирующие на свет. Вышеуказанные симптомы могут сохраняться и после проведения специфической терапии нейросифилиса.
Прогрессивный паралич может появиться у пациентов с 10-20-летней давностью заболевания. Этот вариант нейросифилиса связан с непосредственным проникновением бледных трепонем в клетки головного мозга с последующим их разрушением. Проявляется постепенно усиливающимися изменениями личности, ухудшением памяти, нарушением мышления вплоть до возникновения деменции. Нередко наблюдаются психические отклонения по типу депрессивных или маниакальных состояний, галлюцинаторного синдрома, бредовых идей. Нейросифилис в виде прогрессивного паралича может сопровождаться эпилептическими приступами, дизартрией, нарушением тазовых функций, интенционным тремором, снижением мышечной силы и тонуса. Возможно сочетание с проявлениями спинной сухотки. Как правило, пациенты с подобными симптомами нейросифилиса погибают в течение нескольких лет.
Сифилитическая гумма локализуется чаще всего в основании головного мозга, что приводит к сдавлению корешков черепно-мозговых нервов с развитием пареза глазодвигательных нервов, атрофии зрительных нервов, тугоухости и пр. По мере роста гуммы в размерах увеличивается внутричерепное давление и нарастают признаки сдавления вещества мозга. Реже гумма при нейросифилисе располагается в спинном мозге, приводя к развитию нижнего парапареза и дисфункции тазовых органов.
Диагностика нейросифилиса
Установление диагноза нейросифилиса производится с учетом 3 основных критериев: клинической картины, положительных результатов исследований на сифилис и выявленных изменений в цереброспинальной жидкости. Правильная оценка клиники нейросифилиса возможна только после проведения неврологом полного неврологического обследования пациента. Важную дополнительную информацию для диагностики нейросифилиса дает исследование зрения и осмотр глазного дна, которые проводит окулист.
Лабораторные исследования на сифилис применяются комплексно и, при необходимости, многократно. К ним относятся RPR-тест, РИФ, РИБТ, обнаружение бледной трепонемы с содержимом кожных элементов (если таковые имеются). При отсутствии симптомов сдавления мозга пациенту с нейросифилисом проводится люмбальная пункция. Исследование цереброспинальной жидкости при нейросифилисе обнаруживает бледные трепонемы, повышенное содержание белка, воспалительный цитоз свыше 20 мкл. Проведение РИФ с ликвором, как правило, дает положительный результат.
МРТ головного мозга и КТ головного мозга (или спинного мозга) при нейросифилисе обнаруживают в основном неспецифические патологические изменения в виде утолщения мозговых оболочек, гидроцефалии, атрофии вещества мозга, инфарктов. С их помощью можно выявить локализацию гуммы и дифференцировать нейросифилис от других, сходных по клинике, заболеваний.
Дифференциальный диагноз нейросифилиса проводится с менингитами другого генеза, васкулитами, бруцеллезом, саркоидозом, боррелиозом, опухолями головного и спинного мозга и др.
Лечение нейросифилиса
Терапию нейросифилиса проводят в стационарных условиях внутривенным введением больших доз препаратов пенициллина в течение 2 недель. Внутримышечная пенициллинотерапия не обеспечивает достаточную концентрацию антибиотика в цереброспинальной жидкости. Поэтому при невозможности внутривенной терапии внутримышечное введение пенициллинов сочетают с приемом пробеницида, который тормозит выведение пенициллина почками. У пациентов с нейросифилисом, страдающих аллергией на пенициллин, применяют цефтриаксон.
В первые сутки лечения нейросифилиса может произойти временное усугубление неврологической симптоматики, сопровождающееся подъемом температуры тела, интенсивной головной болью, тахикардией, артериальной гипотензией, артралгиями. В таких случаях пенициллинотерапию нейросифилиса дополняют назначением противовоспалительных и кортикостероидных лекарственных препаратов.
Эффективность лечения оценивают по регрессу симптоматики нейросифилиса и улучшению показателей цереброспинальной жидкости. Контроль излеченности пациентов с нейросифилисом проводят в течение 2-х лет путем исследования цереброспинальной жидкости каждые полгода. Появление новых неврологических симптомов или нарастание старых, а также сохраняющийся цитоз в ликворе являются показаниями для повторного курса лечения нейросифилиса.
Криптококковый менингит
Криптококковый менингит — это воспалительное поражение мозговых оболочек криптококком. Клинически проявляется симптомами менингита, гидроцефалии. При распространении процесса на церебральную ткань присоединяются очаговые расстройства. Диагностика проводится по результатам люмбальной пункции, церебральной КТ, МРТ, микробиологических и серологических анализов, иммунограммы. Терапия осуществляется антимикотическими фармпрепаратами, симптоматическими средствами. Необходимо лечение основного заболевания и дезинтоксикационная терапия, при гидроцефалии — обеспечение адекватного оттока ликвора.
МКБ-10

Криптококковый менингит является одним из этиологических вариантов воспаления оболочек органов ЦНС. Распространен среди лиц со значительным сниженным клеточно-опосредованным иммунитетом. 80-95% заболевших составляют пациенты, страдающие СПИДом. Криптококковый менингит выступает основной причиной летальных исходов в данной группе. В странах Африки число смертей достигает 500-600 тыс. в год. Последние 30 лет характеризуются тенденцией к существенному увеличению заболеваемости, что объясняется мировым ростом распространенности ВИЧ.
Причины
Основными патогенами, инициирующими криптококковый менингит, считаются Cryptococcus neoformans и Cryptococcus gattii. В инкапсулированной форме они передаются воздушно-капельным путем с частицами пыли. Экологическим резервуаром обоих подтипов является птичий помет, разлагающееся органические вещества, и почва.
Криптококки относятся к сапрофитным грибам и при нормальном функционировании иммунной системы не вызывают заболевания. Оппортунистическая инфекция развивается при иммунодефиците, сопровождающемся снижением числа Т-хелперов (CD4) менее 100 в 1 мл (норма 600-1200). Факторами риска возникновения менингита выступают иммунодефицитные состояния с нарушением Т-клеточного иммунитета:
- СПИД. Вирус иммунодефицита человека оказывает цитолитическое действие на Т-хелперы, значительно понижая их численность.
- Иммунодефициты.Первичные иммунодефицитные состояния с поражением клеточного звена манифестируют в раннем детском возрасте. Включают синдром ДиДжорджи, комбинированную иммунную недостаточность.
- Ятрогенное снижение иммунокомпетентности. Искусственная иммуносупрессия необходима при трансплантации органов. К снижению иммунитета приводит терапия цитостатическими препаратами, проводимая при онкопатологии, аутоиммунных заболеваниях.
Патогенез
У иммунокомпетентных лиц проникновение криптококковой инфекции не вызывает патологических изменений, поскольку распространение грибов по организму пресекается нормально функционирующей иммунной системой. При иммуносупрессии с поражением клеточного компонента Т-лимфоциты не распознают патоген, не препятствуют его проникновению в кровь.
С током крови криптококки проникают в ЦНС, проходят гематоэнцефалический барьер и попадают в мозговые оболочки. Персистируя и размножаясь в церебральных оболочках, криптококки вызывают их повреждение с развитием воспалительной реакции, нарушением циркуляции церебро-спинальной жидкости.
Морфологически воспаление приводит к утолщению оболочек. Макроскопически отмечается их помутнение, петехиальные кровоизлияния. Поверхность становиться бугристой. При распространении воспалительных изменений на церебральное вещество развивается сопутствующий энцефалит.

Симптомы криптококкового менингита
При развитии менингоэнцефалита к клинической картине менингита добавляется очаговая симптоматика в виде парезов, параличей, сенсорных нарушений. Нарастающая гидроцефалия характеризуется усилением цефалгии, учащением рвоты, признаками зрительной и слуховой дисфункции. Возможна дискоординация при ходьбе.
Осложнения
Диагностика
В неврологическом статусе выявляются признаки повышенного внутричерепного давления. Ригидность затылочных мышц и другие менингеальные симптомы определяются только у 20% больных. Заподозрить криптококковую этиологию заболевания врачу-неврологу позволяет наличие в анамнезе пациента иммунодефицитной патологии. Подтверждение клинического диагноза возможно после проведения следующих исследований:
- Цереброспинальная пункция. Истечение ликвора под повышенным давлением свидетельствует о гидроцефалии. Микроскопическое исследование ликвора выявляет лимфоцитарный плеоцетоз и признаки воспаления. У 10-15% пациентов изменения не обнаруживаются.
- Микробиологическое исследование ликвора. Идентификация возбудителя традиционно проводится с помощью световой микроскопии после окрашивания тушью, но этот метод не всегда чувствителен. Посев ликвора на среду Сабуро позволяет выделить крептококки, определить их чувствительность к фармпрепаратам.
- Серологические исследования. Обнаружение криптококкового антигена осуществляется с помощью теста латекс-агглютинации или иммуноанализа. Чувствительность исследований 85-90%.
- Иммунограмма. Падение количества Т-хелперов до 100 клеток на мл (норма 600-1200) свидетельствует в пользу криптококковой этиологии менингита.
- Нейровизуализация. Проводится для исключения прочей интракраниальной патологии. Является типичной для грибкового менингита. КТ мозга выявляет усиление церебральных оболочек, агрегаты криптококков, гидроцефалию. Церебральная МРТ более информативна в плане выявления криптококком, локализующихся в оболочках, мозговом веществе, базальных ганглиях. Для больных СПИДом характерны атрофические признаки церебральной коры.
Дифференциальная диагностика
Криптококковый менингит не имеет специфичных клинических проявлений. Его следует дифференцировать от менингитов другого генеза: бактериальных, вирусных, онкогенных. Бактериальный менингит характеризуется фебрильной температурой, интоксикацией, выраженными менингеальными знаками. Новообразования оболочек и подлежащего мозгового вещества хорошо визуализируются на томограммах. В дифференциальный диагноз следует включать хронический или подострый менингоэнцефалит.

Лечение криптококкового менингита
Медикаментозная терапия
Базовая терапия осуществляется противогрибковыми лекарственными средствами. Последние клинические исследования в области неврологии показали рост эффективности лечения при применении комбинации двух препаратов. Показателем успешности проводимой терапии является скорость элиминации грибков из цереброспинальной жидкости. Параллельно проводится симптоматическая терапия, антиретровирусное лечение, дезинтоксикационные мероприятия. В комплексной фармакотерапии криптококкового менингита применяются:
- Противогрибковые средства. Лечение проводится в 3 фазы. Индукция осуществляется внутривенным введением сочетания двух антимикотиков в течение 2 недель. Возможно пероральное использование второго препарата. Фаза консолидации длится 8 недель, осуществляется перорально. Затем применяется поддерживающая терапия. Дозы препаратов во всех фазах рассчитываются врачом индивидуально соответственно тяжести процесса. С целью снижения нефротоксичного действия рекомендованы липосомальные формы антигрибковых средств.
- Дезинтоксикация. Направлена на нивелирование токсического побочного действия антимикотиков. Проводится внутривенными капельными вливаниями электролитных растворов.
- Антиретровирусная терапия. Необходима пациентам со СПИД. Осуществляется современными ингибиторами протеазы, обратной транскриптазы, интегразы.
Медикаментозное лечение гидроцефалии у больных криптококковым менингитом неэффективна. Снижение внутричерепного давления осуществляется регулярными лечебными спиномозговыми пункциями. Возможна установка временного катетера для дренирования или проведение операции вентрикуло-перитонеального шунтирования.
Экспериментальное лечение
В настоящее время изучаются варианты иммунотерапии криптококковой инфекции. Наиболее перспективным считается терапия моноклональными антителами к полисахаридам криптококковой капсулы. Данные препараты продемонстрировали эффективность на животных моделях. Проведен первый этап клинических исследований действия антикриптококковых антител у пациентов, выздоравливающих от ВИЧ-ассоциированного менингита.
Прогноз и профилактика
Исход заболевания определяется тяжестью поражения, своевременностью и адекватностью проводимой антимикотической терапии. Комбинированная методика в фазу индукции позволила снизить смертность до 9,4%. В странах с низким социальным уровнем смертность достигает 40%, что связано с поздним началом терапии, монотерапией.
Смертность от ВИЧ-ассоциированного криптококкового менингита остается высокой (10–30 %) даже в развитых странах. Пациенты, которые выживают в течение первых 6 месяцев, имеют последующую 5-летнюю выживаемость 88%. Поддерживающая терапия позволяет предупредить рецидив менингита. Профилактика заключается в избегании мест с куриным пометом. Больным СПИД рекомендована профилактическая противогрибковая терапия.
1. Криптококковый менингит у вич-инфицированныхПожидаева, Е. А.// XXIV Региональная конференция молодых ученых и исследователей Волгоградской области. - 2019.
2. Определение криптококкового антигена в комплексной диагностике криптококкового менингита у иммунокомпроментированных пациентов в санкт-петербурге/ Игнатьева С. М. и др.// Успехи медицинской микологии. – 2014. – 13.
3. Случай успешного лечения криптококкового менингоэнцефалита у пациента с хроническим лимфоцитарным лейкозом/ Хостелиди С. Н. и др.//Проблемы медицинской микологии. – 2013. - 15(4).
4. Cryptococcal meningitis: epidemiology and therapeutic options/ Sloan D.J., Parris V.// Clin Epidemiol. - 2014. - 13(6).
Асептический менингит. Криптококковая инфекция. Лечение криптококковой инфекции.
Асептический менингит, как правило, развивается в момент сероконверсии ВИЧ, т. е. при появлении в крови больного специфических антител к вирусу. Клиническими признаками данной патологии являются головные боли, лихорадка, менингеальные знаки и в некоторых случаях — поражение черепных нервов, спутанность сознания и сонливость. Асептический менингит обычно носит самоограничивающийся характер и не требует никакого другого лечения, кроме анальгетиков. Хронический субклинический асептический менигит нередко наблюдается у больных ВИЧ. Отмечается умеренное повышение уровня белка в ЦСЖ, умеренный лифоцитарный плеоцитоз, повышение индекса иммуноглобулинов и иногда — олигоклональные антитела.
Важно дифференцировать это состояние от нейросифилиса или другой оппортунистической инфекции. При нарастании иммунодефицита плеоцитоз обычно исчезает. Больным с выраженным иммунодефицитом при развитии асептического менингита необходимо провести тщательное обследование на оппортунистическую инфекцию.
Криптококковая инфекция
1. Течение криптококковой инфекции. Cryptococcus neoformans — это самый частый возбудитель менингита у больных СПИДом — он обнаруживается примерно в 10% случаев. Кроме поражения нервной системы нередко наблюдается криптококковое поражение легких, костного мозга, печени и кожи. Локализованные очаги криптококкового поражения — криптококкомы — расположены в паренхиме мозга. Грибок попадает в организм человека с вдыхаемым воздухом и проникает в ЦНС гематогенным путем. Клинические симптомы поражения становятся очевидными при нарастании иммунодефицита.
2. Клиническая картина криптококковой инфекции. Чаще всего встречается криптококковый менингит, единственными признаками которого могут быть головная боль и лихорадка. Менингеальные знаки положительны менее чем у половины больных. Может также отмечаться поражение черепных нервов и у некоторых больных — нарушения со стороны желудочно-кишечного тракта. При вовлечении в процесс паренхимы мозга появляются припадки и очаговые симптомы. Поражение вещества мозга иногда встречается изолированно, без оболочечного процесса.
3. Диагностика криптококковой инфекции. Нейровизуализационное обследование не всегда выявляет патологию. У больных с менингитом может наблюдаться накопление контраста в мозговых оболочках. Криптококкомы могут накапливать и не накапливать контраст. Кисты, образующиеся в пространствах Вирхова-Робина на уровне базальных ганглиев и в других отделах не накапливают контраст. Плеоцитоз в ЦСЖ выявляется не всегда. Снижение концентрации глюкозы и умеренное повышение уровня белка в ЦСЖ — неспецифические изменения и наблюдаются не во всех случаях. Обычно наблюдается повышение титра криптококкового антигена в сыворотке крови, а также положительна культура криптококка. Эти тесты, как правило, негативны при изолированных очагах в паренхиме мозга. Для подтверждения диагноза необходима биопсия очагов в веществе мозга.
4. Лечение криптококковой инфекции
- Начальная терапия. Лечение криптококкового менингита рекомендуется начать с амфотерицина В в дозе 0,6—1,0 мг/кг/сут. одновременно с флуцитозином в дозе 25,0—37,5 мг/кг 4 раза в сутки у больных с нормальной функцией почек. В некоторых случаях ограничиваются терапией одним амфотерицином В. Альтернативным методом лечения является терапия флуконазолом в дозе 200 мг 2 раза в сутки. Этот препарат не менее эффективно подавляет клинические признаки заболевания, но санация цереброспинальной жидкости происходит медленнее. Данный метод рекомендован больным без нарушения интеллекта и с титрами криптококкового антигена менее 1:1000. Лечение амфотерицином В продолжают до достижения общей дозы 1 г, затем переходят на флуконазол в дозе 200 мг внутрь 2 раза в сутки, в течение 10 недель. После санации ЦСЖ переходят на поддерживающий режим терапии.
- Вспомогательная терапия. Пациентам со значительным повышением уровня внутричерепного давления назначается ацетазоламид в дозе 250 мг 4 раза в сутки и/или дренаж ЦСЖ посредством многократных ЛП или установки шунта.
- После достижения санации ЦСЖ больному показана пожизненная поддерживающая терапия флуконазолом в дозе 200 мг/сут.
- Лечение амфотерицином В часто сопровождается побочными эффектами. Лихорадка й озноб подавляются ибупрофеном, аспирином или гидрокортизоном в низких дозах. После инфузионного введения амфотерицина у пациентов часто развивается тошнота, рвота, учащение дыхания и артериальная гипотензия. Препарат оказывает токсическое воздействие на почки. При появлении признаков почечной недостаточности необходимо снизить дозу препарата и количество вводимой жидкости. Возможна боль в месте введения лекарства, боли в суставах и мышцах. Могут наблюдаться флебит, нарушение электролитного баланса с гипокальциемией, гипо- и гиперкалиемией и гипомагниемией. Описаны токсические поражения печени, тромбоцитопения, лейкопения и гранулоцитопения, а также нарушения свертываемости крови, припадки, снижение слуха, энцефалопатия, нейропатия и анафилактические реакции.
5. Ожидаемый результат лечения криптококковой инфекции. Смертность вследствие криптококкового менингита у больных СПИДом составляет 10-25%. Плохими прогностическими признаками являются психические нарушения, титры криптококкового антигена выше 1:1024, наличие очагов криптококковой инфекции за пределами ЦНС, повышение внутричерепного давления и гипонатриемия. После окончания основного лечения необходимо исследовать ЦСЖ. При положительной культуре криптококков терапия должна быть продолжена флуконазолом в высоких дозах. Уровень криптококкового антиггена к в сыворотке не может служить достоверным показателем эффективности лечения.
6. Профилактика криптококковой инфекции. Исследования показали, что риск развития криптококкового менингита несколько ниже у больных СПИДом, принимающих флуконазол в дозе 100-200 мг/сут.
- Вернуться в оглавление раздела "Неврология."
НейроСПИД
Неврологические проявления ВИЧ-инфекции (нейроСПИД) — обобщенное клиническое понятие, включающее многообразные первичные и вторичные синдромы и заболевания нервной системы, обусловленные ВИЧ. Проявлениями нейроСПИДа могут выступать менингоэнцефалит, полиневропатия, энцефало- и миелопатия, оппортунистические нейроинфекции, опухоли ЦНС, церебральные сосудистые нарушения и т. п. Диагностируется нейроСПИД при сопоставлении результатов анализов на ВИЧ, данных неврологического осмотра, нейропсихологического тестирования, ликворологических и томографических исследований, ЭФИ нервно-мышечного аппарата. Лечение нейроСПИДа осуществляется в рамках терапии ВИЧ-инфекции с назначением специфической и симптоматической терапии имеющихся неврологических проявлений.
Общеизвестно, что при развитии СПИДа патологические изменения в той или иной степени затрагивают практически все жизненно важные органы и системы. В связи с этим СПИД признан мультидисциплинарной патологией. Однако основной «удар» приходится на иммунную и нервную системы. Клинические неврологические проявления ВИЧ-инфекции наблюдаются у 30-40% пациентов со СПИДом, а на аутопсии те или иные изменения в нервной системе выявляются в 90-100% случаев. По различным данным, от 20% до 30% случаев СПИДа манифестируют различными неврологическими симптомами. При этом нейроСПИД имеет весьма вариабельные клинические проявления, что существенно затрудняет его диагностику специалистами в области неврологии, особенно в случаях, когда неврологические расстройства являются первым проявлением заболевания. Если нейроСПИД возникает при установленном диагнозе ВИЧ-инфекции, его диагностика зачастую осложняется тем, что пациенты предпочитают скрывать свой ВИЧ-статус.
Причины возникновения нейроСПИДа
Несмотря на общепризнанность нейротропности ВИЧ, конкретные патогенетические механизмы его воздействия на нервную систему (НС) до конца не ясны. Предполагается, что нейроСПИД обусловлен как прямым, так опосредованным воздействием вируса на НС. Прямое влияние связывают с тропностью ВИЧ к CD4-рецепторам, которые имеются не только в мембране лимфоцитов, но и в глиальных клетках мозговой ткани.
Проникновение вируса через гематоэнцефалический барьер (ГЭБ) объясняют повышением проницаемости последнего на фоне вирусной инфекции и наличием в клетках эндотелия ГЭБ тех же CD4-рецепторов. Согласно другой гипотезе, вирус может переноситься в мозговые ткани вместе с макрофагами, которые беспрепятственно проходят ГЭБ. Известно, что при нейроСПИДе поражаются только глиальные клетки; нейроны, не имеющие CD4-рецепторов, остаются интактны. Однако, поскольку клетки глии выполняют роль «обслуживания» нейронов, при их поражении нормальное функционирование последних также нарушается.
Опосредованное воздействие ВИЧ реализуется несколькими путями. Во-первых, это развитие оппортунистических инфекций и опухолевых процессов за счет резкого снижения иммунного статуса организма. Во-вторых, предполагают наличие аутоиммунных механизмов (например, в развитии асептического менингита и полиневропатии при нейроСПИДе), связанных с синтезом антител к нервным клеткам, имеющим встроенный ВИЧ-антиген. Существует также гипотеза о нейротоксическом действии продуцируемых ВИЧ химических веществ. Кроме того, развитие нейроСПИДа возможно вследствие повреждения эндотелия мозговых сосудов провоспалительными цитокинами, приводящего к расстройству микроциркуляции и гипоксии, обуславливающей гибель нейронов.
Следует отметить, что отсутствие полной ясности в этиопатогенезе ВИЧ-инфекции и нейроСПИДа в частности, наличие существенного количества ложноположительных реакций на ВИЧ при его лабораторной диагностике, а также сложности с выделением вируса привели к появлению среди медиков и специалистов в области иммунологии лиц, считающих неправомочным само понятие ВИЧ-инфекция. При этом сторонники ВИЧ-отрицания признают существование синдрома иммунодефицита как такового, но опасаются, что с введением понятий ВИЧ-инфекция и нейроСПИД под эти диагнозы массово попадают пациенты с различными другими заболеваниями.
Классификация
В соответствии с прямым или опосредованным воздействием ВИЧ на нервную систему принято различать первичный и вторичный нейроСПИД. К базовым клиническим формам, которые включает первичный нейроСПИД, относят: острый асептический менингит, ВИЧ-энцефалопатию (СПИД-деменцию), ВИЧ-миелопатию (вакуолярную миелопатию), васкулярный нейроСПИД, поражения периферической НС (дистальная симметричная невропатия, синдром Гийена-Барре, множественная мононевропатия, хроническая воспалительная демиелинизирующая полинейропатия, синдром конского хвоста), поражение мышц (миопатии).
Вторичный нейроСПИД включает оппортунистические нейроинфекции и опухоли. Первые отличаются большим многообразием: церебральный токсоплазмоз, криптококковый менингит, герпесвирусная нейроинфекция (опоясывающий герпес, цитомегаловирусный и герпесвирусный энцефалиты, цитомегаловирусная полирадикулопатия, герпесвирусный миелит и ганглионевриты), прогрессирующая мультифокальная лейкоэнцефалопатия, туберкулезные поражения НС, нейросифилис. Наиболее часто встречающимися опухолями центральной НС при нейроСПИДе являются: первичная лимфома головного мозга, лимфома Беркитта, глионейробластома, диссеминированная саркома Капоши.
Симптомы нейроСПИДа
Первичный нейроСПИД зачастую имеет бессимптомное субклиническое течение. В 10-20% случаев неврологические симптомы дебютируют в первые 2-6 недель от заражения ВИЧ (период сероконверсии). В этот период на фоне фебрилитета, лимфаденопатии и кожных высыпаний у части пациентов манифестируют признаки асептического менингита и острой радикулоневропатии. Другие клинические формы первичного нейроСПИДа (ВИЧ-энцефалопатия, ВИЧ-миелопатия) возникают преимущественно в развернутой стадии ВИЧ-инфекции на фоне системных проявлений и выраженной иммуносупрессии. Вторичный нейроСПИД развивается в фазе симптомной хронической ВИЧ-инфекции (стадия вторичных заболеваний), которая наступает в период от 2 до 15 лет с момента первых клинических проявлений. Отдельные неврологические симптомы (головная боль, полиневропатия, нарушения сна, астения, депрессия, миопатия) могут быть вызваны токсичной антиретровирусной терапией.
Острая радикулоневропатия связана с острой воспалительной демиелинизацией корешков спинномозговых и черепных нервов. Характерны вялый тетрапарез, полиневритический тип нарушений чувствительности, корешковый синдром, поражение лицевого (реже глазодвигательного) нервов, бульбарные расстройства. Фаза нарастания симптомов может длиться от нескольких дней до месяца, затем после 2-4 недель стабильного состояния начинается регресс симптоматики. У 70% пациентов с этой формой нейроСПИДа отмечается полное восстановление, у 15% - выраженные остаточные парезы.
ВИЧ-энцефалопатия является самым частым проявлением первичного нейроСПИДа. Включает когнитивные, поведенческие и двигательные расстройства. Последние бывают представлены мозжечковой атаксией, тремором, пирамидной недостаточностью, вторичным паркинсонизмом, гиперкинезами. Отдельные симптомы и умеренный когнитивный дефицит отмечаются примерно у 75% пациентов со СПИДом. У 3-5% больных энцефалопатия выступает начальным синдромом нейроСПИДа. Морфологическим субстратом является мультифокальный гигантоклеточный энцефалит с поражением преимущественно лобных и височных долей, подкорковых структур, моста и мозжечка.
ВИЧ-миелопатия проявляется нижним спастическим парапарезом и тазовыми расстройствами. Отличается медленным течением и вариативностью тяжести клинических симптомов от легкого пареза до грубой плегии с недержанием мочи и кала. Это проявление нейроСПИДа отмечается у 20% пациентов с ВИЧ. Морфологически выявляется вакуолизация белого спинномозгового вещества, наиболее выраженная в грудных сегментах. Однако на МРТ позвоночника изменения зачастую не фиксируются.
Васкулярный нейроСПИД обусловлен васкулитом церебральных сосудов и зачастую приводит к развитию ишемического инсульта, отличительной чертой которого является волнообразное течение и частая трансформация в геморрагический инсульт. Характерны предшествующие инсульту ТИА, а также повторные инсульты, вследствие мультифокального поражения сосудов.
Диагностика нейроСПИДа
Учитывая частую встречаемость нейроСПИДа, консультация невролога рекомендована всем больным ВИЧ-инфекцией. В связи с тем, что первыми симптомами ВИЧ-энцефалопатии зачастую выступают когнитивные нарушения, исследование неврологического статуса целесообразно дополнять нейропсихологическим обследованием. Среди практических неврологов должна существовать определенная настороженность в отношении впервые обратившихся пациентов из групп риска, поскольку неврологические проявления у них могут являться симптомами первичного нейроСПИДа. В таких случаях следует обращать внимание на наличие у больного признаков иммуносупрессии и системных симптомов (снижения массы тела, лимфаденопатии, выпадения волос и т. п.).
Наряду с обязательными в диагностике ВИЧ-инфекции исследованиями крови путем ИФА, иммуноблоттинга и определения вирусной нагрузки при помощи ПЦР, в диагностике нейроСПИДа широко используются электрофизиологические, томографические и ликворологические методы. При необходимости проводятся консультации психиатра, нейрохирурга и др. специалистов. Диагностика и анализ результатов лечения поражений периферической НС при нейроСПИДе осуществляются преимущественно с помощью ЭФИ нервно-мышечной системы (ЭМГ, ЭНМГ, исследование ВП).
С целью диагностики поражений центральной НС при нейроСПИДе, для анализа их течения и эффективности проводимой терапии широко используются методы компьютерной томографии и магнитно-резонансной томографии. КТ головного мозга особенно информативна в диагностике вторичных объемных процессов церебральной локализации. МРТ головного мозга более эффективно визуализирует диффузные и мелкоочаговые изменения (участки атрофии и демиелинизации), расположенные в глубинных отделах мозга патологические очаги. Однако результаты аутопсии показывают, что современные методы нейровизуализации способны отображать не все морфологические изменения, происходящие в мозговой ткани при нейроСПИДе.
Немаловажное значение в диагностике нейроСПИДа имеет исследование цереброспинальной жидкости, полученной при люмбальной пункции. У серопозитивных пациентов даже при отсутствии неврологической симптоматики в ликворе зачастую наблюдается умеренный лимфоцитоз, повышение уровня белка и снижение концентрации глюкозы. При наличии неврологических проявлении эти изменения, наряду со снижением уровня CD4-лимфоцитов, говорят о возможном развитии нейроСПИДа. Иммунологические исследования ликвора, как правило, выявляют повышенное содержание IgG.
Лечение нейроСПИДа
Основу терапии и профилактики развития нейроСПИДа составляет лечение ВИЧ-инфекции. Эффективная антиретровирусная терапия (АРТ) фармпрепаратами, способными проходить через ГЭБ, позволяет блокировать репликацию ВИЧ, остановить нарастание иммунодефицита и таким образом уменьшить тяжесть клинических проявлений нейроСПИДа, снизить риск возникновения оппортунистических нейроинфекций и повысить эффективность их терапии. К наиболее апробированным средствам, применяемым при нейроСПИДе, относятся зидовудин, ставудин, абакавир. Учитывая токсичность большинства антиретровирусных препаратов, АРТ назначается по индивидуально подобранной схеме только при наличии показаний и с согласия пациента.
Параллельно с АРТ осуществляется специфическая и симптоматическая терапия возникшей клинической формы нейроСПИДа. Так, при ВИЧ-энцефалопатии применяют холина альфосцерат и мягкие ноотропы (мебикар, цитиколин, пирацетам, фенибут), при инсульте — антикоагулянты и пентоксифиллин, при полиневропатии — цитиколин, комбинированные препараты витаминов группы В, при острых психических нарушениях — антипсихотические средства (клозапин). При поражениях периферической НС отмечена эффективность плазмафереза. В лечении миопатий используют плазмаферез и кортикостероидную терапию.
При оппортунистических нейроинфекциях применяют этиотропные препараты: при криптококовых менингитах — фторцитозин с амфотерицином, токсоплазменных энцефалитах — кларитромицин, азитромицин, спирамицин, при герпетических поражениях — ацикловир, валацикловир, ганцикловир, абакавир, саквинавир. Лечение опухолей, возникающих как проявление вторичного нейроСПИДа, может потребовать хирургического вмешательства. Вопрос о необходимости операции рассматривается совместно с нейрохирургом.
Читайте также:
