Лечение мегалобластической анемии - препараты
Добавил пользователь Владимир З. Обновлено: 23.01.2026
Диагностика мегалобластической анемии - анализы
В большинстве случаев обследование больных начинается на фазе уже развитой мегалобластической анемии. Схематично оно развертывается в следующей последовательности: выявление анемии, определение ее мегалобластического характера, диагностирование дефицита витамина В12 или фолиевой кислоты (или исключение такой возможности), уточнение патофизиологического механизма недостаточности, установление нозологической единицы, в которой развился дефицит (возможно и условий, способствующих его развитию).
Отмеченная последовательность находится в обратном порядке по сравнению с последовательностью нарушений во времени; при этом, в создании дефицита названных двух витаминов различаются следующие три фазы: биохимическая (когда количество витаминов сокращается в среде организма), гематологическая (при которой возникает мегалобластоз) и клиническая (с уже определившейся анемией).
В ряде случаев причиной, вызывающей диагностическое исследование, является не анемия, а иные проявления (например, невропатия, расстройства пищеварения, мегалобластические изменения без анемии и пр.) или патологические состояния, потенциально могущие обусловить развитие соответствующих дефицитов (беременность, гемолитическая анемия, алкоголизм и пр.). Такое мероприятие проводится именно в целях своевременного выявления анемии. Вот почему приведенная выше схема исследований может измениться коренным образом.
В нижеследующем приводятся некоторые правила, которыми следует руководствоваться на различных этапах диагностического процесса.
Диагностирование мегалобластоза в принципе не сложное дело, когда заболевание предоставляется в уже полностью развитой форме. При этом учитываются костномозговые и периферические морфологические изменения с наличием признаков неэффективности эритропоэза (ранее описанных). Для постановки раннего диагноза представляют значение «незначительные» мегалобластические изменения (Hansen), которые заключаются в наличии промежуточных мегалобластов, гигантских гранулоцитов (более 5%, а возможно и 20% всех костномозговых клеток) и гиперсегментированных гранулоцитов в крови (подозрительное число 3 и 4-дольчатых клеток).
В отношении промежуточных мегалобластов необходимо учитывать артефакты, связанные с приготовлением мазка (даже и отдельные частные особенности). Гигантские миелоидные клетки развиваются при беременности, железодефицитной анемии, отдельных инфекционно-токсических состояниях и хронических заболеваниях почек, в то время как гиперсегментирование наблюдается также в качестве врожденного дефекта.
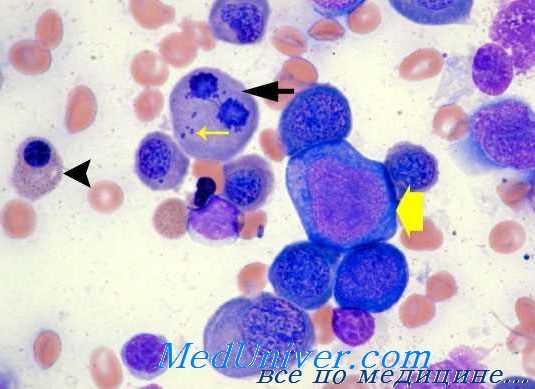
При полностью сложившегося мегалобластоза основными задачами дифференциальной диагностики являются отождествление «резкой задержки деления » (в связи с истощением запаса фолиевокислых солей или их метаболическим блокированием) при различных хронических гемолитических анемиях, также мегалобластоза — в случаях неподдающейся лечению анемии и эритремического миелоза (синдром di Guglielmo), когда, помимо обычно положительной реакции ШИК существует, в принципе, явное преобладание мегалобластических а диспластических сдвигов.
Диагностирование этиопатогенетической категории состоит, по существу, в отождествлении дефицита витамина В12 или фолиевой кислоты, критерии которого уже рассматривались. Определение витаминемии составляет наиболее точный способ, делающий возможным выявление дефицита даже на скрытой стадии; в клинике применяются также метаболические тесты.
Определение витамина В12 (в принципе в сыворотке) выявляет его понижение до менее 150 пг/мл («предел тревоги») или 100 пг/мл (явный дефицит), а иногда (при болезни Бирмера) до 20 пг/мл. «Искусственное» повышение его показателя наблюдается после инъецирования В12 при заболеваниях печени, особенно при хроническом гемобластном лейкозе. вот почему некоторые авторы отдают предпочтение определению этого витамина в эри троцитах (норма 100—300 нг/мл) (Kelly и Herbert).
Определение фолиевокислых солей в сыворотке указывает на раннее сокращение при фолиевом дефиците (до менее 3 нг/мл), равно как и при инфекциях, новообразованиях, железодефицитной анемии и пр.; неспецифический рост отмечается нередко при дефиците В12. С учетом этого предпочтительно проводить определение в цельной крови (при дефиците до 50 нг/мл; мегалобластоз появляеткх при менее 20—15 нг/мл).
Выделение с мочой метилмалоновой кислоты при дефиците В12 увеличивается до нескольких десятков мг/сутки (иногда резко, в частности в формах с невропатией), также при нарушении метаболизма пропионовой кислоты. Положительная реакция FIGlu отмечается не только у больных с фолиевым дефицитом, но также у страдающих болезнью Бирмера, заболеваниями печени, часто у беременных и пр. В процессе диагностирования использование терапевтического теста с введением физиологических доз витамина В12 (парентерально 1—5 мкг/сутки) или фолиевой кислоты (перорально 50—100 мкг/сутки) и дальнейшим наблюдением реакции ретикулоцитов — лишь в редких случаях оказывается необходимым.
В таком случае предполагается наличие выраженной анемии, что требует питания без соответствующих витаминов. Инфекции и прочие факторы могут обусловить неправильные результаты теста.
Патофизиологическое и этиологическое диагностирование проводится по данным анамнеза, клинического обследования и требуемых при этом лабораторных исследований. Так, при дифференцальной диагностике дефицита отмеченных двух витаминов анамнез, в котором значатся хроническая неполноценность питания (нередко в сочетании с алкоголизмом), повторная беременность, заболевания кишечника с преобладающим поражением тощей кишки, как и вообще желудочнокишечные расстройства с неполноценным поглощением подсказывают, в первую очередь, наличие фолиевого дефицита, в то время как иссчение желудка или подвздошной кишки и признаки нервного расстройства — говорят о наличии дефицита витамина В12.
Клиническое обследование часто усматривает в дефиците В12 признак поражения задних и боковых канатиков, в то время как симптоматология возможной невропатии алкоголиков у больного с фолиевой недостаточностью — иная. Среди лабораторных данных выявление желудочной ахилии составляет весьма важный признак, указывающий на наличие болезни Бирмера, однако, в отдельных случаях для уточнения дополнительно проводится реакция Шиллинга (например, у леченных больных).
В целях уточнения патофизиологического механизма и этиологии основного заболевания, его осложнений и сопутствующих болезней, в зависимости от случая, можно также прибегнуть к использовании ряда простых или специальных тестов, относящихся к различным медицинским специальностям.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение мегалобластической анемии - препараты
Лечение железодефицитной анемии. Сколько принимать препараты железа?
Терапия недостатка железа преследует следующие две цели: в первую очередь выявление и устранение причины, вызвавшей нарушение равновесия железа, а во вторую — предоставить организму необходимое количество железа, восстанавливающего нормальный уровень гемоглобина в сосудистой крови и тканевого железа, также ввести в запасы некоторое количество железа, подлежащее мобилизации при необходимости.
Недостаток железа всегда носит вторичный характер и составляет признак какой-то иной болезни. Все усилия следует направлять на выявление причинного заболевания. В противном случае его дальнейшее влияние делает малоэффективной железотерапию; более того, назначение железа может улучшить признаки анемии, в то время как новообразование в кишечнике может протекать бессимптомно, тем самым вызывая просрочку момента хирургического вмешательства.
При методическом «плановом» проведении исследований причин, этиологический фактор выявим у 85—90% больных. Часть остальных 10—15% находится на межприступной стадии после временного заболевания (например, кровоточивости в связи с язвой желудка). Лишь у единичных больных первичная причина остается невыявленной, даже после повторных исследований.
Железотерапия составляет характерный способ лечения при недостатке железа. Желательно начать лечение по возможности раньше, после определения путей, препарата и дозы. В отдельных случаях назначение железа составляет последнее испытание в процессе постановки диагноза недостатка железа.
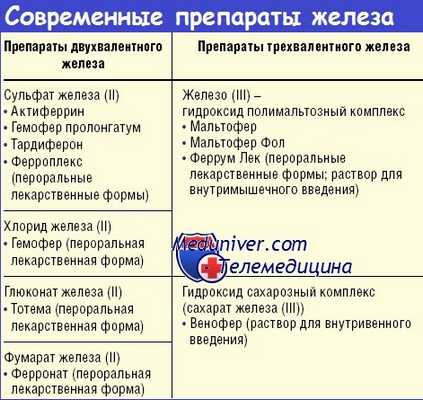
Пероральная терапия располагает рядом препаратов. Все они представляются в виде сочетания двувалентного железа с сульфатом, фумаратом, глютаматом, сукцинатом, глюконатом, лактатом и прочими радикалами. В обиходе препараты предоставляются в виде таблеток, драже, сиропа и капель. Независимо от препарата, терапевтическая доза выражается количеством элементного железа.
Так, «глубифер» — препарат местного производства — расчитан на 100 железистого глютамата и 22—23 мг элементного железа на драже. Оптимальная терапевтическая доза для взрослого равна примерно 150—200 мг железа в сутки за 3—4 приема.
Доза железа назначить индивидуально, в зависимости от интенсивности его недостатка и переносимости больным данного препарата. При умеренном недостатке железа и малой переносимости предпочтительно назначать 80—100 мг элементного железа в сутки. В таких условиях признаки анемии исчезают медленнее, но сотрудничество с больным — надежнее.
Детям назначаются преимущественно сироп или капли. Оптимальная доза равняется 1,5—2,0 мг железа на кг веса тела.
Предельно высокое поглощение железа осуществляется на голодный желудок, однако при этом отмечаются признаки раздражения желудка. Прием медикамента во время или после еды сокращает на половину поглощение железа, но переносимость его пищеварительным трактом хороша. В связи с этим следует отдавать предпочтение приему препаратов во время еды.
Поглощение прямопропорционально количеству вводимого внутрь железа. При необходимости назначать крупные дозы; их распределение на 4 приема более эффективно (Dameshekn Baldini). Сочетание аскорбиновой кислоты (200 мг/30 мг железа) усиливает поглощение кишечником но, вместе с тем, обостряет вторичные эффекты. Сукциновая кислота лишена вторичных явлений, но увеличивает стоимость лечения.
Отмечаем, что железо, находящееся в растворимых кишечником препаратах, поглощается в меньшей мере по причине щелочного рН кишок.
Независимо от применяемого препарата пероральная железотерапия продолжается по меньшей мере 6 месяцев после исчезновения анемии. Таким образом восстанавливается запас железа и ведется борьба с возвратным течением болезни.
Парентеральная терапия железом показана лишь в нескольких случаях:
а) непереносимость препарата пероральным путем, даже малыми дозами и после замены медикамента;
б) отсутствие сотрудничества со стороны больного;
в) непрерывная или прерывистая потеря крови в большем количестве, чем может возместить пероральная железотерапия;
г) наличие болезней пищеварительного тракта, в том числе язвенного колита, которые усугубляются после железотерапии;
д) неполноценное поглощение кишечником;
е) необходимость создания запаса железа у больного, который не может продолжать пероральную терапию после ремиссии анемии.
Наиболее ходкий препарат с железом, в условиях пероральной терапии, это «железодекстран», вводимый внутримышечно или внутривенно. Количество «железодекстрана» назначается из расчета веса тела и показателя гемоглобина данного больного. Полезной для этого формулой представляется (McGibbon и Mollin): инъецируемое железо (мг) = (15—Гб больного г/100 мл) х вес тела х 3.
Расчитанное по этой формуле количество покрывает потребность железа в целях восстановления гемоглобина. К этому следует добавить 1 г железа для запаса.
Перед началом лечения проводится испытание чувствительности больного путем внутримышечного инъецирования 0,5 мл (25 мг железа), которые отбираются из ампулы, содержащей 2 мл препарата. Отсутствие какой-либо реакции говорит о возможности ежедневного введения 2 мл препарата (100 мг железа), при этом иглу вводить глубоко в мышечную толщу.
Рассасывание вводимого внутримышечно железа быстрее вначале (50% в первые 3 дня), затем процесс протекает медленнее. Так, спустя месяц, у места инъекции отмечается наличие еще примерно 25% общего количества железа (Бутояну). Поступающий в кровообращение комплекс железодекстран захватывают макрофаги костного мозга, селезенки и печени.
В дальнейшем железо постепенно поступает в кровь, связывается с трансферином и направляется к эритробластам. Часть откладываемого в макрофагах железа долгое время сохраняется в них.
Внутривенное введение комплекса железодекстран делать очень медленно — 5 мин. на дозу 5—10 мл. Испытание гиперчувствительности обязательное. Предпочтительно назначать перфузию 5% раствора (об./об.) железодекстрана в физиологическом растворе. Скорость вливания 10— 15 капель в минуту, в течение первых 5 мин., затем 45—60 капель в мин. Преимущество метода заключается в возможности вливания крупных доз, вплоть до разового использования общей расчитанной дозы.
При внутривенном введении железодекстран исчезает из кровообращения за несколько дней, поскольку его перехватывают макрофаги. Поскольку внутривенный путь представляется более опасным, он используется лишь в случае необходимости введения крупных доз, как, например, при непрерывном кровотечении.
Другой терапевтический препарат, содержащий железо, это комплекс гидрат окиси железа — карбогидрат. К румынским препаратам этой группы относятся полимальтозное железо, содержащее 100 мг элементного железа на 2 мл раствора, применяемое внутримышечно и железо с сахаром, с одинаковым количеством элементного железа на 5 мл раствора, используемое внутривенно. Комплекс гидрат окиси железа — карбогидрат отличается высоким молекулярным весом, причина по которой, после инъецирования, разделяет общую с железодекстраном судьбу.
Вторичные явления после парентерального применения препаратов с железом следующие:
а) местного характера — болевое ощущение у места инъекции, флебит после внутривенного введения;
б) общего характера — головные боли, краснота, лихорадочное состояние, крапивница, тошнота, рвота, боли в суставах, спазм бронхов, лимфаденопатия.
Обычно эти реакции маловажны и отмечаются у 1—2% больных. Тем не менее наблюдались анафилактические реакции, иногда с летальным исходом. Вот почему первые уколы следует проводить под наблюдением врача и располагать средствами оживления.
Результаты железотерапии оцениваются по улучшению субеъктивной, гематологической и тканевой симптоматологии. Утомляемость это первый исчезающий признак. На 5—10 день лечения наступает ретикулоцитный приступ. Уровень ретикулоцитоза составляет примерно 5—20%, причем его выраженность прямо пропорциональна интенсивности анемии. Наиболее верным признаком эффективности лечения является 50% рост показателя гемоглобина спустя 3—4 недели и полное устранение анемии спустя 2 месяца.
Что касается эпителиальных поражений, следует отметить, что атрофия сосочков языка регрессирует за 3 месяца, а ложкообразные когти за 3—6 месяцев заменяются нормально растущими ногтями на ранее вырожденных участках.
Ахлоргидрия обратима лишь у молодых. Более устойчиво к лечению расстройство глотания, при котором необходимо проводить расширения верхнего участка пищевода.
Неэффективность железотерапии объясняется несколькими причинами. На первом месте находится точность диагноза железодефицитной анемии. Если при проверке он оказывается правильным проводятся, исследования для выявления сопутствующей болезни, в частности инфекции и хронического воспаления. Не следует опускать и наличие кишечных заболеваний с сопутствующей им неполноценность поглощения, однако переоценка этого фактора не целесообразна. Безрезультатность лечения может быть отнесена также за счет препарата, точнее его вида (кишечнорастворимые таблетки) или недостаточной дозы.
В конечном итоге, следует заручиться сотрудничеством больного. Не забывать и то, что пероральное введение препарата и его небольшая стоимость не привлекают особый интерес больного.
Мегалобластная анемия
Одной из форм малокровия является мегалобластная. Еще она известна как В12-фолиеводефицитная анемия. Эта патология развивается на фоне нарушения процесса кроветворения из-за атипичного изменения синтеза в РНК и ДНК клетках. Также этот недуг сопровождается образованием в костном мозге большого числа видоизмененных предшественников эритроцитов — мегалобластов. Распространенность В12-фолиеводефицитной анемии составляет приблизительно 10 % от всех случаев этого заболевания. Диагностируется недуг у лиц всех возрастов и половой принадлежности. Однако в большей степени мегалобластная анемия поражает пожилых людей. Это заболевание требует незамедлительно обращения к квалифицированному специалисту.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обратиться к профильному специалисту.

Симптомы мегалобластной анемии
Клиническая картина недуга достаточно специфична. Одним из самых типичных признаков заболевания считается микроцитоз. Это патологическое состояние характеризуется увеличением среднего эритроцитарного объема более, чем 100 куб. мкм. Уровень лейкоцитов и тромбоцитов тоже находится ниже допустимого уровня. Симптомы мегалобластной анемии связаны с кислородным голоданием организма, они представляют собой такие проявления:
- постоянное ощущение общей слабости в теле;
- систематические приступы миалгии;
- подавленное состояние и отсутствие настроения;
- одышка даже при незначительных физических нагрузках;
- отечность конечностей;
- чувство дискомфорта во всем теле;
- отсутствие аппетита.
Часто заболевание сопровождается нарушением вкуса и снижением чувствительности языка. Также пациенты с мегалобластной анемией жалуются на расстройства стула, приступы тошноты и рвоты. Кроме того, эта форма малокровия негативно сказывается на состоянии нервной системы. Это проявляется в онемении рук и ног.

Причины
Чаще всего мегалобластная анемия развивается в результате нехватки в организме витамина В12 и фолиевой кислоты. Среди наиболее распространенных причин, провоцирующих этот дефицит медики выделяют:
- патологии желудочно-кишечного тракта;
- алкоголизм;
- нарушения усвоения пищи;
- употребление наркотических препаратов;
- кишечный гельминтоз.
Кроме того, мегалобластная анемия и ее симптомы могут появиться у лиц, увлекающихся вегетарианством. Несбалансированное питание, состоящее из одной только пищи растительного происхождения, тоже считается одной из наиболее распространенных причин возникновения анемии. Также нехватка фолиевой кислоты часто диагностируется у женщин, вынашивающих ребенка.
Отдельно стоит сказать, что мегалобластная анемия часто возникает после употребления определенных лекарственных препаратов. К таковым относятся:
- антиметаболиты;
- противовирусные препараты;
- противосудорожные средства;
- противотуберкулезные препараты.
На развитие заболевания влияет частота приема, дозировка и индивидуальная переносимость составляющих лекарственного средства.
К какому врачу обратиться?
Анемия
Анемия — патологическое состояние, которое проявляется снижением концентрации гемоглобина и гематокрита. Параллельно падает количество эритроцитов. Женщины страдают от этой проблемы чаще. Примерно 90 % случаев малокровия связаны с нехваткой железа. Реже анемия обусловливается хроническими заболеваниями, иными факторами. Патология может иметь сложный патогенез. Лечение при малокровии комплексное, требующее контроля специалиста. Без своевременного вмешательства врача анемия способна прогрессировать вплоть до тяжелого состояния, приводя к потере сознания, отсутствию рефлексов в конечностях.
Симптомы анемии (признаки)
Клиническая картина при патологии во многом зависит от степени снижения гемоглобина. Общие характерные проявления малокровия:
- головокружение;
- постоянная слабость;
- бледность кожи, нередко с умеренной желтизной;
- шум в ушах;
- покалывание в руках и ногах;
- учащенное сердцебиение;
- склонность к обморокам.
У пациентов появляются некоторые изменения в поведении: желание есть мел, вдыхать ранее неприятные запахи. Пожилые люди с ИБС отмечают участившиеся приступы стенокардии даже после легкой физической нагрузки.
На первичном этапе развития анемия протекает без клинических признаков. Умеренная ее степень характеризуется сниженной концентрацией внимания, общим недомоганием, бледностью слизистых оболочек, ногтей. Если анемия продолжает развиваться, то симптомы тяжелой степени становятся выраженными. Среди них:
- аритмия;
- одышка при отсутствии тяжелых нагрузок;
- головные боли;
- плохой сон;
- частые простуды;
- истончение ногтей;
- снижение аппетита.
Затем наступает анемическая прекома. Ей свойственны:
- одышка даже без легких нагрузок;
- синюшность кожи и слизистой;
- крайняя сонливость;
- изменения психики, например, депрессивные состояния, галлюцинации.
Анемия в наиболее тяжелом своем проявлении приводит к низкому АД, рвоте, частому поверхностному дыханию. Вместе с этим пациент теряет сознание, у него наблюдается непроизвольное мочеиспускание. Еще один симптом 5-ой стадии анемии — отсутствие рефлексов, лечение в таком случае усложняется. У пациента нет реакции в ответ на раздражение, например, при неврологическом осмотре.
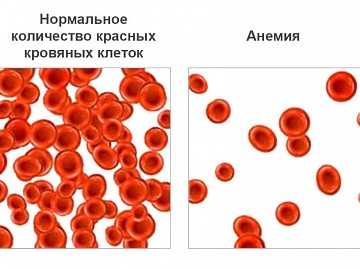
Патологическое состояние может вызываться острой потерей крови. Следующий фактор — нарушение выработки красных кровяных телец. Следствием этого процесса являются анемии:
- апластические;
- мегалобластные;
- железодефицитные;
- сидеробластные;
- хронических заболеваний.
Третий фактор — активное разрушение эритроцитов. На его фоне отмечаются гемолитические анемии.
Часто выявляют малокровие, которое связано с недостаточным количеством железа. Сразу после рождения нехватка этого элемента наблюдается у детей:
- недоношенных, с малым весом;
- рожденных женщинами с аналогичным диагнозом;
- из многоплодной беременности;
- матери которых страдали от кровотечения в последний триместр беременности или в процессе родов.
Недостаточное количество железа бывает связано с алиментарными факторами. Среди них:
- употребление исключительно растительных продуктов;
- скудная диета с чрезмерным количеством углеводов и жиров;
- патологии ЖКТ, препятствующие всасыванию;
- нарушения транспорта железа.
Анемия нередко развивается на фоне онкологического поражения желудка, хронического панкреатита. Возможно прогрессирование малокровия из-за удаления части кишечника, желудка. Определенную опасность представляют:
Есть риск появления малокровия на фоне паразитарного поражения организма, сильных глистных инвазий. Анемия разной степени тяжести связана и с кровопотерями. Они происходят как во внешней, так и во внутренней среде.
Лечение диагноза анемия учитывает непосредственно симптомы нездорового состояния, а также уровень гемоглобина. Поскольку клинические признаки малокровия не всегда тождественны тяжести анемии по лабораторным критериям, то крайне необходимо участие опытного врача в определении наиболее эффективной и безопасной терапевтической схемы. Занимается диагностикой и лечением таких пациентов:
На первичном приеме доктор подробно расспрашивает пациента об особенностях работы, жизни, наличии хронических патологий. Врачу важно знать:
- как давно появились первые признаки анемии;
- есть ли у близких родственников малокровие;
- сидит ли пациент на диете, каков его рацион;
- были ли хирургические вмешательства в области ЖКТ;
- принимает ли пациент какие-либо лекарственные препараты.
Поскольку анемия имеет различные причины, то важно выявить основной фактор, приведший к малокровию. От его специфики во многом зависит предстоящая терапия.
Методы лечения
Каждый тип малокровия диктует назначение конкретных фармакологических средств. Железодефицитная анемия предполагает:
- устранение фактора;
- диетическое питание с оптимальным включением железа;
- продолжительный прием препаратов Fe;
- переливание эритроцитарной массы;
- применение парентеральных препаратов при наличии показаний.
В12-дефицитная анемия эффективно купируется диетой. Может понадобиться заместительная терапия. Тот же принцип показан при фолиеводефицитной анемии. Если малокровие развилось на фоне хронических заболеваний, то пациенту необходимо:
- избавиться от основной патологии;
- пройти курс рекомбинантного эритропоэтина;
- восполнить недостаток фолиевой кислоты.
Приобретенная гемолитическая анемия требует приема глюкокортикостероидов. Если результат недостаточный, проводят спленэктомию. После удаления селезенки нужны иммунодепрессанты, антилимфоцитарный глобулин. По показаниям назначают плазмаферез.
В каждом из вышеперечисленных случаев необходимо исключить физическое и эмоциональное перенапряжение. Важно полноценно отдыхать, питаться согласно рекомендациям врача.
Диагностика
Для подтверждения патологического состояния сдают ОАК. Стоимость общего анализа крови в пределах 500-1200 р, точность около 80 %. Лабораторное исследование определит количество:
- эритроцитов;
- ретикулоцитов;
- гемоглобина;
- гематокрита.
Анализ покажет средний объем эритроцитов, ширину их распределения. Также важны показатели количества лейкоцитов и тромбоцитов, средняя концентрация и содержание гемоглобина в эритроците.
К другим способам прибегают для детального определения вида малокровия. Уточнение железодефицитной анемии предполагает выявление уровня железа в крови, обнаружение насыщенных и ненасыщенных трансферринов, ферритина. По некоторым показаниям прибегают к аспирационной биопсии костного мозга.
B12-дефицитная анемия крови определяется уровнем этого витамина. Если по какой-то причине проведение анализа невозможно, или положительная реакция на лечение отсутствует на протяжении 5-8 дней, то могут назначить аспирационную биопсию.
Фолиеводефицитная анемия диагностируется путем определения витамина B9 в крови, эритроцитах. При хронических болезнях малокровие определяют путем выявления:
- уровня железа в крови;
- степени насыщения трансферрина;
- общей железосвязывающей способности.
Помимо анализов крови, необходима диагностика основой болезни, провоцирующей анемию. Если под подозрением приобретенная гемолитическая форма малокровия, то важно:
- определить содержание свободного и связанного билирубина в сыворотке крови, урине;
- провести прямую пробу Кумбса;
- определить осмотическую стойкость эритроцитов.
Профилактика
Первичные меры подразумевают предупреждение хронических заболеваний, в особенности ЖКТ. Следует своевременно купировать проблемы с желудком, толстой и тонкой кишкой. Предупреждение болезней заключается в:
- правильном и систематическом питании;
- отказе от острых, жирных продуктов;
- употреблении тщательно обработанной зелени, фруктов и овощей.
Пациентам с генетической предрасположенностью к анемии необходимо регулярно наблюдаться у врача, чтобы вовремя предупредить ухудшение состояния. Есть риск развития малокровия у лиц, принимающих противосудорожные медикаменты, а также у беременных. Систематическая сдачи крови на анализ позволит обнаружить снижение уровня гемоглобина еще до явных проявлений патологии.
Меню при заболевании
Параллельно с медикаментозным анемия предполагает диетическое лечение. В ежедневный рацион вводят оптимальное количество полноценных белков. Они способствуют выработке эритроцитов и гемоглобина. Рекомендованная суточная доза — 130-150 г.
Следует умеренно ограничить жир. За день можно съедать не больше 70-80 г. В противном случае есть риск патологических изменений тканей печени, костного мозга. Преобладать должны легкоусвояемые жиры, например, молочные. Допускается небольшое количество растительного масла.
Количество углеводов составляет 400-500 г на взрослого. Важно получать их из продуктов здорового питания. Основные принципы рациона:
- оптимальное количество витаминов B и C;
- поддержание баланса микроэлементов, необходимых для активного кроветворения;
- употребление продуктов с липотропными свойствами.
Пациентам показано дробное питание. Оптимальными считаются около 6 приемов пищи в сутки. Основа рациона:
- гречка и овсянка;
- говядина, индюшатина;
- сырая и прошедшая тепловую обработку растительная пища.
Также необходимы перепелиные или куриные яйца, печень, выпечка из цельнозерновой муки, домашний творог, нежирная рыба, дикий рис.
Гемолитическая анемия
Под гемолитической анемией понимают специфические болезни крови. Им свойственно сокращение цикла жизни красных кровяных телец. Наблюдается активное разрушение эритроцитов, тогда как новые не успевают образовываться в необходимом объеме. Уровень гемоглобина при этом остается нормальным. Гемолитические анемии бывают врожденными и приобретенными. В первом случае причиной отклонения являются генетически детерминированные изменения. Самыми распространенными их формами называют серповидную анемию и талассемию. Заболевания же приобретенные обусловлены выработкой антител к эритроцитам или же влиянием негативных факторов.
Симптомы
Главный признак подобных состояний — желтушный окрас кожи и слизистой. Это связано с выбросом большого количества билирубина при разрушении эритроцитов. Остальные общие признаки анемии:
- потемнение каловых масс и урины;
- озноб;
- рост в размерах селезенки и печени.
Если гемолитическая анемия спровоцирована отравлением организма химическими веществами, то в первое время присутствуют головная боль и разбитость. Затем пациент отмечает:
- тошноту;
- лихорадку;
- болезненные ощущения в правом подреберье;
- пурпурную мочу.
Если больному не оказывается корректная медицинская помощь, то через несколько суток развиваются желтуха и почечная недостаточность.
Что касается тяжелой наследственной мишеневидноклеточной анемии (талассемии), то ее признаки следующие:
- узкие глазные щели;
- недоразвитость в умственном или физическом плане;
- патологически измененные кости черепа, скелета;
- зеленоватый окрас кожи.
Гемолитическая анемия новорожденного характеризуется асцитом, отечностью. Параллельно с этим отмечается резкий и тонкий крик ребенка. Клинически определяется высокое содержание незрелых эритроцитов.
Заболеванию, диагностируемому у старших пациентов, свойственна закупорка мелких сосудов склеивающимися эритроцитами. Нередко наблюдаются длительно незаживающие трофические язвы.
Характер симптомов, тяжесть проявлений гемолитической анемии во многом зависят от формы. Приобретенное острое состояние вызывает внезапные приступы слабости, одышку после умеренных физических нагрузок, аритмию. Довольно быстро увеличиваются селезенка и печень. Хроническая форма протекает не так выраженно, все симптомы появляются по нарастающей на протяжении длительного периода.

Причины болезни
Врожденная гемолитическая анемия обусловливается передачей аномального гена по наследству от одного или каждого из родителей. Вторая причина проблемы —внезапная мутация генов в процессе внутриутробного развития. Пациенты с гомозиготной анемией (аномалия в каждой хромосоме одной пары) редко живут долго, умирая в детском или подростковом возрасте.
Гемолитические приобретенные болезни провоцируются множеством причин. Среди них:
- повышенная чувствительность к медикаментам;
- продолжительное воздействие химических веществ;
- отравление ядами;
- ожоговая интоксикация;
- ряд паразитарных инвазий;
- бактериальные инфекции.
Существуют и иммунные причины, приводящие к гемолитической анемии. Это:
- дефицит витамина E;
- продуцирование антител к эритроцитам на фоне рака крови, лимфатической ткани, при других сбоях функционирования иммунитета;
- механическое повреждение красных кровяных телец, в том числе искусственными клапанами;
- несовместимость групп при переливании крови.
Какой врач лечит гемолитическую анемию?
Абсолютно каждый вид из группы данных заболеваний должен контролироваться врачом. Пациенту при первых же признаках анемии или подозрении на нее следует обратиться к такому врачу как:
Может понадобиться консультация терапевта, эндокринолога, иммунолога. На приеме специалист:
- анализирует жалобы пациента и анамнез заболевания;
- проводит визуальный осмотр;
- измеряет АД, прослушивает работу сердечной мышцы;
- направляет на клинический анализ крови;
- назначает УЗИ внутренних органов.
Важно при гемолитической анемии вовремя распознать симптомы и назначить лечение конкретной формы заболевания. Для уточнения диагноза прибегают к дополнительным мерам:
- определению уровня билирубина в урине;
- исследованию геометрии красных кровяных телец;
- пробе Кумбса;
- забору костного мозга на биопсию.
Эффективные методы лечения
Все способы купирования проявлений и избавления от гемолитической анемии определяются видом заболевания. Исходя из этого применяют:
- противомалярийные препараты;
- дезинтоксикационную терапию;
- кортикостероиды;
- хирургические методы (удаление селезенки).
Многократные и острые приступы гемолитической анемии требуют переливаний крови. Крайне важна тщательный контроль биоматериала.
Избавиться от проявлений наследственных заболеваний крови позволяет преимущественно спленэктомия. Консервативные методы на время облегчают состояние пациента, не обеспечивают защиту от рецидивов. Операцию проводят в период «затишья». Осложнения после вмешательства наблюдаются нечасто. Впоследствии нужно будет более тщательно следить за иммунитетом.
Талассемия, серповидноклеточная анемия поддаются лечению благодаря переливанию эритроцитарной массы, искусственных заменителей крови. Пациенту необходимо избегать нахождения в способствующих гипоксии условиях: недостаточное содержание кислорода, разреженный воздух.
Что если не лечить?
Даже 1 степень анемии у беременных без корректировки может привести к негативным последствиям для матери и ребенка. Есть риск:
- инфекции мочевых путей;
- гипостенурии;
- гематурии;
- раннего родоразрешения.
Тяжелая анемия существенно повышает возможность самопроизвольного аборта. Беременные с заболеваниями крови должны динамически наблюдаться у гинеколога и гематолога. Если проблема выявлена у ребенка, то без грамотного лечения наблюдается отставание в физическом развитии. Отсутствие аппетита, недостаток полезных веществ в организме приводят к низкому иммунитету и частым болезням.
Если анемия продолжает прогрессировать, грамотное лечение отсутствует, то возможно развитие:
- ишемии паренхимы, некроза тканей селезенки;
- сердечно-сосудистой недостаточности;
- острой почечной недостаточности;
- ДВС-синдрома;
- гемолитической комы.
Крайне опасен ДВС-синдром, способный развиться у разновозрастных пациентов. Кровь внутри сосудов свертывается, процесс сопровождается кровотечениями. Страдают органы, полости, слизистые оболочки и кожа. Предупредить необратимые и фатальные изменения позволяет только экстренная интенсивная терапия. Не менее опасны острые недостаточности, грозящие смертельным исходом.
Профилактика
Предупредить анемию получается далеко не всегда, но для ряда разновидностей существуют профилактические меры. Необходимо:
- определить резус-фактор на этапе планирования семьи;
- семьям с наследственными гемолитическими анемиями консультироваться у генетика;
- укреплять иммунитет;
- вести здоровый образ жизни.
Люди с предрасположенностью к анемии должны ежедневно следить за своим питанием. В основу рациона рекомендуется заложить продукты со сложными углеводами, аминокислотами, а также белки. В профилактических и лечебных целях составляют меню с акцентом на:
- говядину, индюшатину;
- бобовые;
- овощи;
- гречневую и овсяную крупу;
- сливочное, оливковое масло.
Салаты из овощей с зеленью, зерновые завтраки обеспечивают достаточное количество фолиевой кислоты. Регулярное употребление натурального меда способствует усвоению железа. Достаточно 1-2 ст. л. в сутки.
И профилактика, и лечение разнообразных симптомов гемолитической анемии требуют тщательного соблюдения особого режима питания. Важно отказаться от частого употребления острой, чрезмерно жирной и соленой пищи. Необходимо максимально сокращать содержание консервантов, усилителей вкуса.
Помимо контролируемого питания, в профилактических целях рекомендуют ежедневно прибегать к умеренным физическим нагрузкам. Это может быть плавание, йога, ЛФК, другие виды спорта. Их выбор определяется выносливостью и общим состоянием организма пациента. В качестве предупреждения анемии по назначению врача принимают препараты железа. Делать это нужно только после консультации с доктором, самолечение недопустимо.
Читайте также:
