Мегалобастическая анемия - морфология, причины
Добавил пользователь Валентин П. Обновлено: 30.01.2026
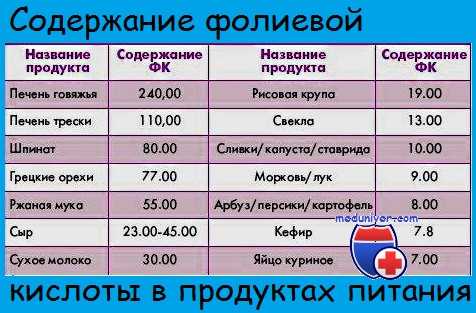
Мегалобластическая анемия за счет высокого расхода фолиевой кислоты
Мегалобластическая анемия за счет высокого расхода фолиевокислых солей развивается при беременности и некоторых патологических состояниях.
Мегалобластическая анемия беременных. Фолиевый дефицит у беременных составляет проблему большого практического интереса если учесть частоту этого явления, порой весьма тяжелые последствия для организма матери, а возможно и в отношении течения беременности. В настоящее время доказана ведущая роль фолиевого дефицита в развитии мегалобластической анемии беременных (дефицит витамина В12 практически не принимается в расчет).
В комплексном патогенезе мегалобластической анемии беременных значительная роль выпадает не только на долю количественного недостатка фолиевокислых солей (уже существующий до наступления беременности и усугубляющийся переносом к плоду), но также на нарушение их расхода в связи с гуморальными изменениями при беременности и ее осложнениями (в частности инфекционного характера).
Небольшой запас фолиевокислых солей (рассматриваемый как обязательное условие) является результатом недостаточного подвоза с пищей (при тяжелых экономических условиях) и ряда прежних случаев беременности (прямо пропорционален их числу и ритму последовательности) (Hibbard); возможного наличия какого-либо гемолитического заболевания или кровоточивости — действующих одинаково. Перенос к плоду материнской фолиевокислой соли (процесс мобилизации запаса и его преимущественного направления по определенным метаболическим системам — управляется ферментами) обеспечивает необходимое ему количество, даже в случае выраженной недостаточности у матери.
К осложнениям беременности, определяющим нарушение расхода фолиевокислых солей, относятся также инфекции (в частности почечно-лоханочные), которые способствуют развитию мегалобластической анемии (в отдельных случаях даже без зараженного количественного дефицита); сидеропения обусловливает незначительные мегалобластическио изменения, на которые можно оказать положительное воздействие назначением железа (Chanarin и сотр.).
В некоторых случаях фолиевый дефицит беременных приводит к нарушению развития организма и придатков плода (Hibabrd), в результате чего (в зависимости от даты наступления и степени дефицита) наблюдаются аборт, дефекты плода или плаценты (статистика установила 2—4-кратную и более частоту фолиевого дефицита при подобных случаях, по сравнению с контрольной группой).
Клиническая и гематологическая картины мегалобластической анемии беременных носит менее индивидуальный характер, чем болезнь Бирмера, по причине частого сочетания с иными патологическими состояниями (железодефицит, инфекция и пр.). В принципе мегалобластическая анемия развивается у беременных в возрасте до 35 лет, причем чаще в четырехнедельный интервал до и после родов (Giles). По частоте признаков на первом месте находятся недостаток аппетита и воспаление слизистой оболочки рта, следуют лихорадочное состояние, слабовыраженные отеки, иоджелтушное состояние, реже прощупываемая селезенка (в 1/3 случаев), иногда увеличенная печень.
Нередко почечно-лоханочная инфекция (даже бессимптомная) предшествует развитию тяжелой анемии, причем в отдельных случаях последняя развивается и при токсикозе беременных. Гематологически определяются макроцитоз и анизоцитов эритроцитов, однако, вообще, менее выраженно, чем при болезни Бирмера. В случае железодефицита преобладают гипохромные эритроциты (при нормальном или даже заниженном РОЭ). В костном мозге мегалобластическое преобразование эритроидного ряда бывает менее выраженно (иногда преобладают «железодефицитные» эритробласты), в то время как гиперплазия, в принципе, умеренная. В случае сопутствующей инфекции может преобладать гранулоцитный ряд с выраженными мегалобластическими изменениями, на периферии обнаруживается лейкоцитоз, при этом гиперсегментирование гранулоцитов составляет один из наиболее ранних и постоянных признаков. Отмечается и некоторая степень тромбоцитопении.
В порядке биологических проб определение фолиевокислой соли в эритроцитах отражает наиболее ярко степень фолиевого дефицита, при этом показатель развивающейся мегалобластической анемии, в принципе, меньше 50 нг/млЭ, а понижение фолиевокислой соли в сыворотке до 1,5 нг/мл — обычное явление к концу беременности. Реакция FI Glu также мало специфична во время беременности. Вообще показатель билирубина в сыворотке высокий, отмечается наличие кислотности желудочного сока.
Течение — особо тяжелое в прошлом, значительно улучшилось в настоящее время, в связи с назначением фолиевой кислоты одновременно с лечением осложнений. Профилактическое назначение беременным фолиевой кислоты значительно понижает коэффициент заболевания.
Прочие мегалобластические анемии за счет высокого расхода фолиевокислых солей
При высокой активности костного мозга всегда наблюдается высокий расход фолиевокислых солей. Мегалобластическое преобразование выявлено в разнообразных видах гемолитической анемии, в том числе, наследственном сфероцитозе, талассемии, ночной пароксизмальной гемоглобинурии и пр. При этом изменения колеблятся от незначительной мегалобластической морфологии, до полного преобразования с абсолютным прекращением деления, что отражается в сокращении числа ретикулоцитов, быстрого понижения показателя гемоглобина и билирубинемии (это положение следует отличать — по картине костного мозга — от «апластических приступов », возникающих при тех же заболеваниях).
В тех случаях когда больной является новым пациентом для врача, различие от мегалобластической анемии становится нелегкой задачей. Лечение фолиевой кислотой может потребовать дозы, значительно большие физиологической. Профилактику фолиевой кислотой следует рассматривать как мероприятие, которое необходимо систематически включать в схему лечения подобных заболеваний.
Высокий расход фолиевокислых солей наблюдается и при иных анемиях с высоким показателем эффективного (например, после кровотечения) или неэффективного (при железодефицитной, разных видов неподдающихся лечению и прочих анемиях) эритропоэза, иногда без взаимосвязи между количеством фолиевокислых солей в крови и степенью мегалобластических изменении, что, в подобных случаях, наводит на мысль о влиянии каких-то нарушений использования.
При хроническом эксфолиативиом дерматите (когда шелушением удаляются 5—10 мгк фолиевокислых солей в сутки) у значительной части больных наблюдаются признаки фолиевого дефицита (Knowles и сотр.), следовательно назначение фолиевой кислоты — обоснованное мероприятие (особенно в случаях, леченных метотрексатом).
Что касается новообразований, значительный расход фолиевокислых солей отмечается при хронических миелопролиферативных заболеваниях и острых лейкемиях, что обусловливает мегалобластические изменения за счет фолиевого дефицита (за исключением специфической терапии противофолиевыми, противопуриновыми и пр. средствами). При раке признаки фолиевой недостаточности находятся в зависимости от распространения злокачественного процесса, причем, в случае метастазирования, показатель фолиевокислой соли в сыворотке уменьшается у 85% больных (однако, в отдельных случаях с печеночным проявлением этот показатель высокий, видимо за счет удаления фолиевокислой соли из разрушенных гепатоцитов) (Magnus).
По наблюдениям, мегалобластические изменения встречаются чаще при раковом заболевании с метастазом в костный мозг (Williams и сотр.). Фолиевую недостаточность при раке обусловливают и другие факторы, такие как, ограничение питания, расстройства пищеварения, печеночная недостаточность, нарушения расхода за счет продуктов клеточного распада, инфекции и пр.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мегалобастическая анемия - морфология, причины
Мегалобластическая анемия - это патологическое состояние, заключающееся в общем клеточном расстройстве, в основе которого лежит нарушение клеточного деления за счет заниженного синтеза нуклеиновых кислот, что, в большинстве случаев, является результатом недостаточности витамина В12 или фолиевой кислоты. В гематологическом плане это заболевание характеризуется мегалобластическим преобразованием и неэффективностью миелопоэза.
Мегалобластическая анемия коренным образом отличается от гипохромной анемии, при которой нарушение касается клеточного созревания (за счет неполноценности синтезирования гемоглобина), равно как и от апластической анемии, при которой нарушается дифференциация «клеток-штамм» в кровяные клетки.
Мегалобластоз — патофизиологические рамки, морфология
Основным нарушением, обусловливающим мегалобластическую морфологию является недостаточное синтезирование ДНК (биохимическими механизмами, описанными далее). Результаты этого дефицита следующие:
а) Увеличивается межмитотическая фаза, во время которой продолжается синтез РНК и белков. Это объясняет утрату количественного равновесия между ДНК и РНК, что, в морфологическом плане проявляется изменением отношения ядро-цитоплазма в пользу последней.
б) Кровяные клетки не подвергаются нормальному числу делений (в основном это касается последних трех делений эритробластического ряда) (Weicker, Rohr), при этом ядро остается большим и выглядит как «молодое », в то время как в цитоплазме развивается характеристика зрелой клетки (асинхронизм созревания ядра и цитоплазмы).
Нарушение механизма деления ядра проявляется атипическими митозами (многополюсными, с тонкими хромосомами, под острым углом и неоднородно распределенными), тенденцией к почкованию ядра и чрезмерным сегментированием (в гранулоцитном и мегакариоцитном рядах), аспектами кариорексиса и ядерных остатков (в эритроидном ряде); при этом наличие полиплоидных клеток (4n, 8n или даже более, с единым или множественным ядром) отражают тяжелый дефицит.
в) Отмеченное мегалобластическое расстройство обусловливает усиленное внутрикостномозговое разрушение этих клеток, пропорционально степени дефицита (неэффективность кроветворения, отражающаяся в высоком уровне лактикодегидрогеназы и билирубина, и ростом «ранней фракции» последней). Показатель разрушения находящихся в кровообращении элементов также высок, а средняя продолжительность жизни эритроцитов равняется 1/2—1/3 нормы.
г) Последствием неполноценного кроветворения является анемия, которая (под стимулирующим влиянием эритропоэтина) способствует развитию эритробластической гиперплазии (при изменении отношения Э:Г, росте клеточной костаномозговой массы и гематопоэтической преобразовании жирного костного мозга), что усиливает дефицит фолиевой кислоты или витамина В12 (за счет увеличенного расхода) и замыкает порочный круг усугублением мегалобластоза и анемии.
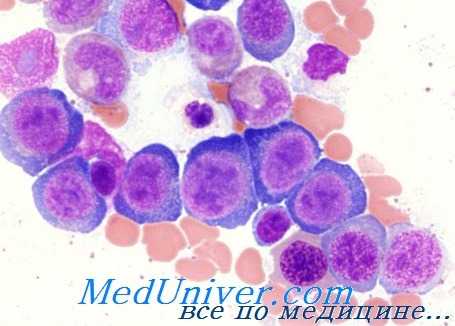
В основе количественных и качественных изменений остальных двух костномозговых рядов находятся те же нарушения, которые поражают и эритробластный ряд. Неэффективный грапулоцитопоэз поддерживается не только морфологическими альтерационными изменениями, но также повышением уровня мурамидазы в сыворотке (Perillie).
Неэффективность мегакариопоэза, отмечаемая при мегалобластной анемии, которую подсказывал контраст между ростом общей массы мегакариоцитов костного мозга и периферической тромбоцитопзнией, была подтверждена работами Harker и Finch, установивших среднюю выработку, на ядерную единицу, шести тромбоцитов вместо сорока (норма). Рост разрушения гранулоцитов и тромбоцитов на периферии — возможно путем увеличенной секвестрации селезенкой — может способствовать, в различной степени, развивающейся при этом цитопении.
Подобные клеточные альтерационные изменения наблюдаются и в других клеточных системах, в основном у тех, характерной чертой которых составляет коэффициент быстрого деления, в том числе эпителий пищеварительного тракта (в отдельных случаях и клетки зародыша, плодных придатков). В этом следует искать объяснение некоторых клинических признаков или осложнений (глоссит, затруднения пищеварения, расстройство поглощения, перинатальные осложнения и пр.).
Общим диагностическим элементом мегалобластных анемий является определение мегалобластной морфологии всех кровяных клеток костного мозга и периферической крови.
Термином мегалобласт определяются предшественники эритроцитов. В принципе мегалобласт крупнее соответствующего нормального эритробласта с измененным отношением ядро-цитоплазма в пользу последней. Ядро промегалобласта (диаметром 20—30 u) объемистое, нередко расположено эксцентрично, хроматинная структура в виде жемчужин, содержит несколько крупных ядрышек синеватой окраски; цитоплазма синего цвета, наиболее ясная зона расположена вокруг ядра, причем может сохраниться и на последующих стадиях.
На стадии базофильного мегалобласта ядро уменьшается, отсутствуют ядрышка, хроматинная структура более плотная, однако не наблюдаются характерные для базофильного нормобласта скопления, базофильность цитоплазмы станитовся более резкой. На стадии полихроматофильного мегалобласта отражен наиболее ярко асинхронизм созревания между ядром (еще крупным, с едва начинающим организоваться в виде блоков хроматинном) и цитоплазмой (растянутой, полихроматофильной, нередко с наличием телец Жолли). Диаметр оксифильного мегалобласта колеблется от 10 до 18 u, его цитоплазма полностью оксифильная и хроматинная структура ядра еще выявима.
Мегалоцит характеризуется более крупными размерами (от 12 до 14 u), отсутствием ясной центральной зоны (большей толщиной) и часто чуть овальной формой.
Происходящие в гранулоцитном ряде мегалобластические изменения отражаются в увеличенном, в принципе, размере клетки и обильности цитоплазмы. Эти признаки проявляются более четко в гигантских метамиелоцитах, имеющих крупное ядро, весьма скудную хроматинную структуру, не соответствующей форме ядра, при этом цитоплазма продолжает оставаться базофильной. Наблюдается тенденция к гиперсегментированию в результате чего образуется форма гиперсегментированных гранулоцитов (6, 8, 10 и более сегментов), хроматинная структура которых, однако, менее плотная (в отдельных случаях сегментирование частичное, в виде надреза).
Изменения мегакариоцитов менее четкие, в некоторых случаях их размеры отклоняются от нормы, зернистость недостаточная. Хроматинная структура менее плотная, естественная тенденция к сегментированию ядра усиливается, появляются отделившиеся сегменты или сегменты в виде «виноградной грозди» или «взрывных» мегакариоцитов. Тромбоциты крупнее (макро- или даже мегатромбоциты) с лучше выраженной структурой, чем нормальная.
Что касается этиопатогенеза мегалобластической анемии отмечаем, что значительные достижения последних двух десятилетий в изучении этого заболевания привели к выделению следующих трех основных категорий, из них первые две включают случаи, обусловливаемые недостатком витамина В12 и фолиевой кислоты (с возможным их сочетанием при определенных обстоятельствах), а третья — более редкие случаи этого заболевания, независимые от первых двух недостатков, вызываемые известными или еще неизвестными причинами.
Мегалобластная анемия
Одной из форм малокровия является мегалобластная. Еще она известна как В12-фолиеводефицитная анемия. Эта патология развивается на фоне нарушения процесса кроветворения из-за атипичного изменения синтеза в РНК и ДНК клетках. Также этот недуг сопровождается образованием в костном мозге большого числа видоизмененных предшественников эритроцитов — мегалобластов. Распространенность В12-фолиеводефицитной анемии составляет приблизительно 10 % от всех случаев этого заболевания. Диагностируется недуг у лиц всех возрастов и половой принадлежности. Однако в большей степени мегалобластная анемия поражает пожилых людей. Это заболевание требует незамедлительно обращения к квалифицированному специалисту.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обратиться к профильному специалисту.

Симптомы мегалобластной анемии
Клиническая картина недуга достаточно специфична. Одним из самых типичных признаков заболевания считается микроцитоз. Это патологическое состояние характеризуется увеличением среднего эритроцитарного объема более, чем 100 куб. мкм. Уровень лейкоцитов и тромбоцитов тоже находится ниже допустимого уровня. Симптомы мегалобластной анемии связаны с кислородным голоданием организма, они представляют собой такие проявления:
- постоянное ощущение общей слабости в теле;
- систематические приступы миалгии;
- подавленное состояние и отсутствие настроения;
- одышка даже при незначительных физических нагрузках;
- отечность конечностей;
- чувство дискомфорта во всем теле;
- отсутствие аппетита.
Часто заболевание сопровождается нарушением вкуса и снижением чувствительности языка. Также пациенты с мегалобластной анемией жалуются на расстройства стула, приступы тошноты и рвоты. Кроме того, эта форма малокровия негативно сказывается на состоянии нервной системы. Это проявляется в онемении рук и ног.

Причины
Чаще всего мегалобластная анемия развивается в результате нехватки в организме витамина В12 и фолиевой кислоты. Среди наиболее распространенных причин, провоцирующих этот дефицит медики выделяют:
- патологии желудочно-кишечного тракта;
- алкоголизм;
- нарушения усвоения пищи;
- употребление наркотических препаратов;
- кишечный гельминтоз.
Кроме того, мегалобластная анемия и ее симптомы могут появиться у лиц, увлекающихся вегетарианством. Несбалансированное питание, состоящее из одной только пищи растительного происхождения, тоже считается одной из наиболее распространенных причин возникновения анемии. Также нехватка фолиевой кислоты часто диагностируется у женщин, вынашивающих ребенка.
Отдельно стоит сказать, что мегалобластная анемия часто возникает после употребления определенных лекарственных препаратов. К таковым относятся:
- антиметаболиты;
- противовирусные препараты;
- противосудорожные средства;
- противотуберкулезные препараты.
На развитие заболевания влияет частота приема, дозировка и индивидуальная переносимость составляющих лекарственного средства.
К какому врачу обратиться?
Мегалобластная анемия: причины, развитие и виды, симптомы, лечение
Мегалобластная анемия (МА) или как её также принято называть – пернициозная анемия (хотя такое название подразумевает дефицит исключительно витамина B12) – патология, отнесенная к группе приобретенных и/или передаваемых по наследству гематологических заболеваний, возникающих на почве нарушения синтеза рибонуклеиновой (РНК) или дезоксирибонуклеиновой кислоты (ДНК).

Для мегалобластных анемий весьма характерным признаком является изменение клеток эритроидного ряда: размера (большой), дифференцировки ядра и цитоплазмы (асинхронная), размещения хроматина в ядре (не свойственное нормальным клеткам).
Мегалобластная анемия – типичные представители
Болезнь формируется по причине недостатка отдельных витаминов (в частности, B12 и B9). Это происходит потому, что синтез ДНК зависим от количества данных веществ в организме. Кроме этого, выработку дезоксирибонуклеиновой кислоты могут расстроить отдельные (редкие) наследственные аномалии ферментов, принимающих участие в биохимических процессах, влияющих на продукцию ДНК.

Типичными представителями этой гематологической патологии являются:
- B12-дефицитная анемия (болезнь Аддисона-Бирмера, пернициозная анемия, злокачественное малокровие) – самая частая форма. Она обусловлена недостатком цианокобаламина, может быть приобретенной по причине заболеваний верхнего отдела кишечника (тонкая кишка) либо передаваемой по наследству и зависимой от продукции и выделения внутреннего фактора (ВФ), либо от всасывания в кишечнике и отсутствия транспортного протеина, который переносит цианокобаламин (транскобаламин). Наследственная анемия становится заметной уже у детей младшего возраста;
- Фолиеводефицитная анемия (недостаток витамина B9) – наблюдается намного реже, нежели дефицит витамина B12, к тому же, изолированный дефицит фолиевой кислоты не ведет к столь серьезным последствиям, которые развиваются в отсутствие цианокобаламина;
- Сочетанный вариант – B12-фолиеводефицитная анемия. Комбинированная форма, обусловленная недостатком витаминов B12 и B9, встречается довольно редко и, как правило, возникает по причине нарушения всасывания данных веществ в кишечнике.
Почему так важно поступление достаточного количества цианокобаламина и фолиевой кислоты в организм человека? Все дело в том, что они принимают участие и играют не последнюю роль в транспортировке лабильных метильных групп метионина, в которых нуждается «строительство» ДНК. Как только уровень В12 снижается или он исчезает, эта реакция резко идет на спад, что сильно сказывается на созревании ядра. При сохраненной функции цитоплазмы, ядро делиться «не спешит» – этот процесс сильно запаздывает (происходит то, что называют «асинхронной дифференцировкой ядра и цитоплазмы»). В таких условиях сама клетка «пускается в рост» и приобретает огромные размеры.
Что дает старт болезни
Очевидно, что основным виновником развития патологии признается нарушение всасывания упомянутых выше витаминов в кишечнике. Какие предпосылки могут способствовать подобным нарушениям?
Гематологи обычно ссылаются на три основные причины:
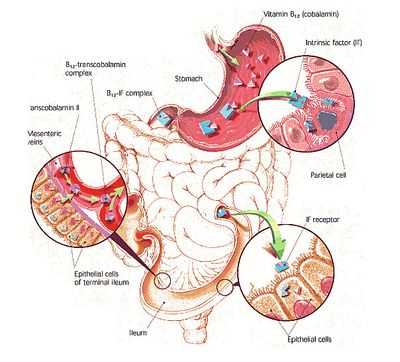
- Отсутствие гликопротеина, называемого внутренним фактором (ВФ), и вырабатываемого специальными клетками тела и фундального отдела желудка. Неимение ВФ становится результатом аутоиммунного атрофического гастрита, в условиях которого начинают появляться «блокирующие» антитела (они не позволяют ВФ и цианокобакламину вступать во взаимодействие), а также антитела «связывающие» (эти АТ соединяются с внутренним фактором или с готовым блоком «ВФ + В12», инактивируя его);
- Заболевания тонкого кишечника (средней и нижней трети), где, собственно, и осуществляется всасывание цианокобаламина (гранулематозный энтерит – болезнь Крона, целиакия – непереносимость глютена, удаление большого участка тонкой кишки, новообразования);
- Появление конкурентов, «присваивающих» витамин В12, который был предназначен для всасывания. Например, конкурентами нормального всасывания может выступать широкий лентец либо бактерии, усиленно размножающиеся и забирающие питательные вещества при синдроме слепой кишечной петли (стаз тонкой кишки, застойная кишечная петля).
Таким образом, каждая из перечисленных причин способна нарушить процесс всасывания важных для организма элементов и запустить механизм развития мегалобластной анемии. Следует заметить, что, недополучая витамин B12, организм активно накапливает вредные жирные кислоты, которые несколько позже становятся причиной формирования неврологической симптоматики (нарушается образование миелина нервной ткани), которая весьма характерна для данной патологии. Кстати, фолиевой кислоты это не касается, поскольку она не участвует в распаде жирных кислот, а, стало быть, не заставляет страдать нервную систему.
Симптомы болезни
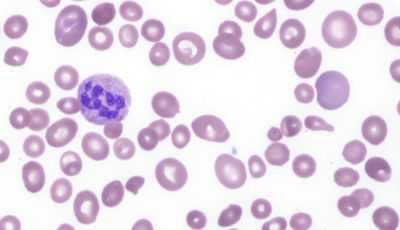
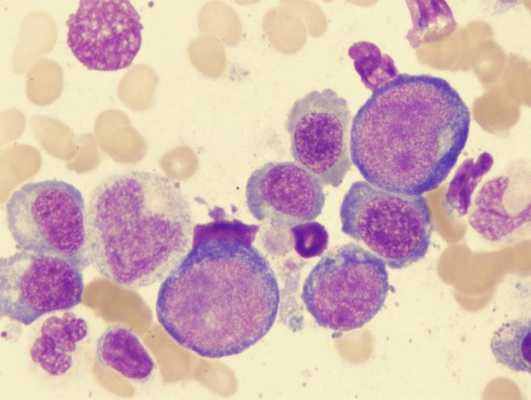
картина крови при мегалобластной анемии
Любая болезнь у разных людей может проявлять себя по-разному, однако в отношении мегалобластной анемии можно выделить ведущую триаду симптомов, которые будут иметь место практически у всех больных:
- Отсутствующее в норме мегалобластное кроветворение в костном мозге, дает значительные изменения в периферической крови. Анализ показывает:
мегалобласты и другие изменения в крови
- малокровие (анемия) – уменьшение количества красных клеток крови – эритроцитов и снижение уровня красного пигмента крови – гемоглобина;
- гиперхромию (насыщенная окраска увеличенных в размерах эритроцитов);
- пойкилоцитоз (изменение формы красных клеток крови);
- анизоцитоз: макроцитоз (клетки большого размера) и в большей степени – мегалоцитоз (размер красных кровяных телец может превышать 8, а то и 12 микрон);
- мегакариоцитоз – появление гигантских клеток костного мозга, имеющих большое ядро;
- нормобластоз – присутствие в мазках крови ядерных форм клеток эритроидного (красного) ряда (как известно, эритроциты, циркулирующие в периферической крови, ядра не имеют);
- в красных клетках крови замечаются остатки ядерной субстанции (включения в виде телец Жолли либо колец Кобота);
- в анализе крови также может быть снижено количество других форменных элементов: тромбоцитов, нейтрофилов, моноцитов.
- Клинически, а также при инструментальном обследовании, явно прослеживаются признаки поражения ЖКТ:
- теряется аппетит, снижается вес;
- атрофируется слизистая желудка;
- соляная кислота в желудочном соке полностью исчезает (ахлоргидрия), поскольку, вследствие атрофии слизистой, обкладочные клетки отмирают и перестают ее продуцировать (кислотность желудочного сока – 0).
- По причине недостатка цианокобаламина в течение длительного времени начинает испытывать страдания нервная система, что проявляется формированием фуникулярного миелоза (комбинированного склероза). Клинически – наблюдаются симптомы поражения спинного мозга:
- парестезии;
- нарушение чувствительности;
- парезы и параличи;
- выраженная мышечная слабость
Очевидно, что данная гематологическая патология, сопровождаемая непомерным увеличением красных клеток крови и изменением в их ядре, при прогрессировании и отсутствии адекватной терапии может сделать человека полным инвалидом. Нарушения образования миелина при дефиците В12 приводят к весьма серьезным последствиям: со временем теряется не только поверхностная, но и глубокая мышечная чувствительность, «отказывают ноги» (паралич нижних конечностей), органы таза перестают нормально функционировать (недержание мочи и кала, импотенция и т. д.). Не зря за пернициозной анемией сохранилось определение – «злокачественная».
Лечение и рекомендации на всю жизнь
Лечение мегалобластной анемии заключается в назначении ударных доз цианокобаламина в первые три дня (до 1000 γ в сутки), особенно, если появились признаки дегенеративных изменений спинного мозга (двигательные и чувствительные расстройства), затем дозу снижают до 400 – 500 γ каждый день до того, пока уровень гемоглобина не придет в норму. В среднем курс лечения продолжается месяц – полтора.
Фолиевую кислоту, как правило, одновременно не назначают, даже если имеет место ее дефицит при недостатке витамина B12 (применение фолиевой кислоты возможно только при изолированном варианте – фолиеводефицитной анемии, с которой, кстати, бороться намного легче и проще, нежели с недостатком кобаламина). Насколько эффективно назначенное лечение – покажет анализ, произведенный через 5-7 дней от начала терапии (увеличение количества молодых форм эритроцитов – ретикулоцитоз, является положительным признаком). Если же успеха от лечебных мероприятий не наблюдается, то необходимость продолжать диагностический поиск остается.
Следующим этапом лечения мегалобластной анемии является закрепляющая терапии, суть которой состоит в еженедельном введении 400 – 500 γ цианокобаламина в течение двух месяцев.
Переливание крови (эритроцитарной массы) назначается только в случаях, если значения гемоглобина падают ниже 50 г/л.
При выписке на домашний режим больной от врача получает рекомендации, касающиеся профилактики обострений болезни:
- Лечение хронических заболеваний, которые стали причиной формирования этой патологии;
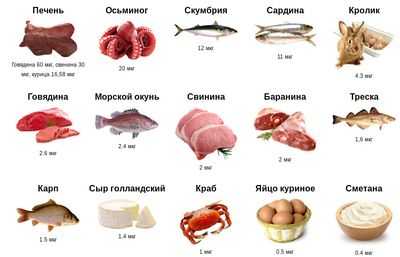
- Коррекция диеты (отмена вегетарианства, насыщение рациона мясными продуктами, листовыми овощами и фруктами, содержащими данные вещества);
- Отмена лекарственных средств, признанных «виновниками» нарушения синтеза ДНК;
- Профилактические курсы витамина B12 (8 – 10 инъекций 1 раз в 6 месяцев на протяжении нескольких лет или всей оставшейся жизни, если причину заболевания никаким способом устранить невозможно).
Рисунок: продукты питания для профилактики дефицита витамина B12
Диагностика
Заподозрить мегалобластную анемию получается уже при первом общем анализе крови (ОАК). Поскольку даже самые современные («навороченные») анализаторы не способны уловить те морфологические изменения в эритроцитах (см. выше), которые свойственны данной патологии, то исследование не должно доверяться исключительно аппарату, пусть и самому «умному». Хотя и он, наверняка, обнаружит некоторые сдвиги в ОАК. Обычно любая, уважающая себя лаборатория, придерживается «золотых стандартов» и мазок в обязательном порядке просматривается врачом под микроскопом. Однако болезнь не принадлежит к случайным находкам, поэтому первичная диагностика опирается на жалобы пациента и клинические симптомы:
- Слабость, усталость, снижение общей физической активности и трудоспособности;
- Эпизодически наступающая темнота в глазах;
- Снижение уровня АД (гипотония);
- Частые головокружения и головные боли;
- Учащенное сердцебиение;
- Признаки изменения слизистой полости рта по типу глоссита;
- Возможно увеличение размеров селезенки (спленомегалия) и печени (гепатомегалия);
- Отеки ног;
- Склонность к поносам, хотя запоры также не исключены, то есть, эти неприятные состояния могут чередоваться между собой;
- Потеря аппетита, вкусовые нарушения, отсюда – снижение массы тела.
Далее последует более углубленная диагностика:
- Биохимический анализ крови (БАК) – он покажет повышение не конъюгированного (не связанного) билирубина, а также, скорее всего, изменение показателей сывороточного железа и значений лактатдегидрогеназы – ЛДГ;
- ФГДС (фиброгастродуоденоскопия), которая позволит определить состояние слизистой желудка (признаки атрофии);
- Пункция спинного мозга, поскольку лабораторные признаки похожи на таковые при гемолитической и апластической анемии;
- Дифференциальная диагностика – уточнение формы мегалобластной анемии (B12-дефицитная, недостаток фолиевой кислоты или комбинированный вариант).
Своевременная диагностика мегалобластной анемии очень важна для здоровья пациента, ведь опоздание или диагностическая ошибка (к счастью, она случается крайне редко) может привести к развитию анемической комы. Клиника ее довольно тяжела: больной не приходит в сознание, тяжело дышит, его пульс заметно учащен, артериальное давление снижено, кожные покровы отдают лимонным оттенком (при пернициозной анемии возможен усиленный гемолиз кровяных телец), возможно появление тонических и клонических судорог. Больной может погибнуть…
Есть ли особенности у детей?
У детей мегалобластная анемия в наибольшей степени носит наследственный характер и имеет несколько форм:
- Расстройство всасывания цианокобаламина может быть обусловлено поражением эпителиального слоя тонкой кишки и отсутствием тетрагидрофолата в клетках, который является активной формой витамина B9 (при этом, содержание внутреннего фактора остается в норме);
- Мегалобластная анемия, вызванная наследственной недостаточностью внутреннего фактора, характеризуется уменьшением (иногда значительным) выделения ВФ обкладочными клетками слизистой желудка (тип наследования – аутосомно-рецессивный);
- Дефицит переносящего В12 белка – транскобаламина (аутосомно-рецессивное наследование) абсолютно не виден при исследовании плазмы крови (значения кобаламина остаются в пределах нормы), зато в тканях – глубочайший дефицит (для В12 нет «транспортного средства», чтобы проникнуть в ткани);
- Очень редкая форма, которая наблюдается у детей, достигших подросткового возраста – ювенильная пернициозная анемия.
У детей с наследственной формой симптомы (отказ от еды, рвота, сухость и шелушение кожных покровов, признаки атрофического глоссита, частые пневмонии) проявляются уже на первом втором, реже на третьем, году жизни.

Диагностика болезни преимущественно основывается на морфологическом исследовании периферической крови и костного мозга, где обнаруживаются признаки мегалобластного кроветворения.
Лечение, в принципе, как и у взрослых: симптоматическое и назначение цианокобаламина по схеме.
Кроме этого существует ряд очень редких врожденных заболеваний, для которых характерно нарушение выработки дезоксирибонуклеиновой кислоты, а в качестве главного симптома выступает мегалобластная анемия. Вот, к примеру, некоторые из них:
- Оротовая ацидурия – нарушение обмена пиримидинов;
- Тиамин-зависимая МА, природа которой так и остается невыясненной, хотя известно, что наследование идет по аутосомно-рецессивному пути;
- Врожденная мальабсорбция фолатов (аутосомно-рецессивный тип наследования) – расстройство всасывания фолатов в кишечном тракте и переноса их из кишечника в кровеносное русло и из кровотока через гематоэнцефалический барьер;
- Наследуемые по аутосомно-рецессивному типу врожденные расстройства обмена фолатов (например, недостаток активности фермента ДГФР – дигидрофолатредуктазы);
- Синдром Лиш-Найана (патологический ген находится в Х-хромосоме).
Некоторые из этих болезней задерживают умственное и физическое развитие, дают богатую неврологическую симптоматику. Практически все эти врожденные аномалии в каждом конкретном случае требуют своего отдельного лечения, поскольку витамин B12 оказывается просто неэффективным.
Микроцитарная анемия
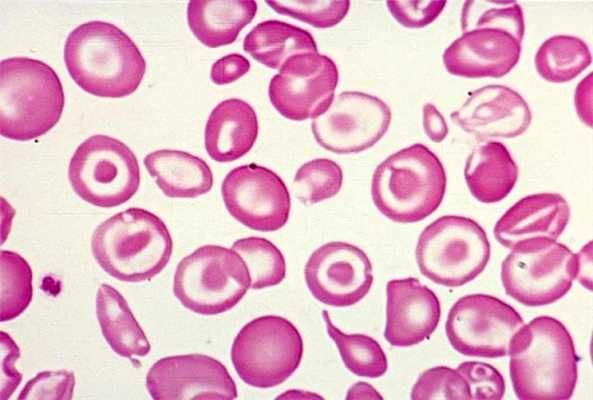
Чтобы синтезировать гемоглобин, человеку необходимо железо. Если его не хватает, организм не получает необходимого количества кислорода. Дефицит может возникать по разным причинам. В основном из-за недостаточного количество железа в пище, его плохого усвоения в организме, а также кровопотерь. Итак, недостаток железа приводит к снижению уровня гемоглобина, что в свою очередь ведет к малокровию, по-другому железодефицитной или микроцитарной анемии. Такой вид является самым распространенным. К тому же он чаще наблюдается среди женщин — около 20 % не обладают необходимым количеством железа в организме.
Макроцитарная анемия
Анемия бывает разной. Если после анализа у обследуемого в показателях указан диаметр меньше 8 микрон, то это признак микроцитарного малокровия, если же он превышает этот показатель, тогда анемии присваивается тип — макроцитарная. Оба вида возникают из-за нарушения свойств крови — понижения уровня концентрации гемоглобина. В свою очередь, такая анемия бывает гемолитической и фолиево-дефицитной. Для гемолитической характерна потеря эритроцитов (красных кровяных телец) в результате их ускоренного разрушения. Фолиево-дефицитная анемия обусловлена нехваткой фолиевой кислоты, которая вызывает замедление процесса созревания эритроцитов в костном мозге.
Симптомы
К сожалению, сегодня до одной трети всего взрослого населения страдают таким синдромом, как микроцитарная гипохромная анемия. При этом налицо у заболевших общая слабость в организме. Снижается работоспособность, человек постоянно чувствует себя уставшим, страдает рассеянным вниманием и сонливостью. Меняются предпочтения в еде. Происходит потеря аппетита. При прогрессировании могут возникнуть нарушения обоняния и вкуса. У взрослых, особенно у пожилых людей, недостаток гемоглобина ведет к тому, что кровь перестает насыщаться кислородом, и возникает тяжелая форма анемии. Появляются:
- одышка;
- сбой сердечного ритма;
- обмороки.
Внешние проявления при макроцитарном синдроме в основном затрагивают кожные покровы. Они начинают желтеть. При этом губы приобретают бледный цвет, ногти становятся светлее. Могут возникать:
- частые боли в области живота;
- жжение языка;
- увеличение размеров печени и селезенки.
Схожими симптомами с микроцитарной станут недомогание, слабость, учащенный пульс, нарушение сна, а также другие расстройства вегетативной системы.

Причины данных анемий
Недостаток железа либо нарушение его всасывания — залог получения такого диагноза, как микроцитарная гипохромная анемия. Дефицит поступления этого элемента с пищей вкупе с его потерей во время кровотечений (например, менструационных, маточных либо желудочно-кишечных) повышает риск возникновения этого синдрома. Особенно нуждаются в железе:
- дети грудного и подросткового возраста;
- беременные;
- пациенты с глистной инвазией;
- больные опухолевыми заболеваниями.
Макроцитарная анемия, в свою очередь, возникает вследствие дефицита витаминов группы В (в основном В12) и фолиевой кислоты. Такой недуг — результат неправильного образа жизни, в частности проблем с печенью из-за чрезмерного употребления алкоголя или агрессивных медикаментов. Она также наблюдается у беременных и больных онкологическими заболеваниями. Может возникнуть у людей с проблемами в функционировании щитовидной железы и у пациентов с дисфункцией стволовых клеток костного мозга.
При появлении симптомов и подозрении на наличие анемии необходимо записаться на прием к такому врачу как:
Читайте также:
