Механизм полимеризации актина в актиновые филаменты
Добавил пользователь Morpheus Обновлено: 21.01.2026
Видео: Актин: характеристика, строение, волокна, функции
Содержание:
В актин это цитозольный белок, образующий микрофиламенты. У эукариот актин - один из самых распространенных белков. Например, он составляет 10% от общего веса белка в мышечных клетках; и от 1 до 5% белка в немышечных клетках.
Этот белок вместе с промежуточными филаментами и микротрубочками образует цитоскелет, основной функцией которого является подвижность клетки, поддержание формы клетки, деление клеток и перемещение органелл у растений, грибов и животных.
Изоформы актинового цитоскелета выполняют различные функции, такие как: регулирование развития активного напряжения в гладких мышцах, клеточный цикл, развитие эмбриона, развитие тканей и заживление ран.
С эволюционной точки зрения актин является высококонсервативным белком. Гомология последовательностей у разных видов составляет около 90%. У одноклеточных организмов один ген кодирует изоформу актина. В то время как в многоклеточных организмах разные гены кодируют несколько изоформ актина.
Актин вместе с миозином были решающими структурами в эволюционной эволюции эукариотических организмов и в их диверсификации, поскольку они позволяли движение в отсутствие других структур, таких как жгутики и реснички.
Структура: актиновые нити
Актин представляет собой глобулярный одноцепочечный полипептидный белок. В мышцах актин имеет молекулярную массу примерно 42 кДа.
Этот белок имеет два домена. У каждого есть два поддомена и промежуток между доменами. АТФ - Mg +2 присоединяется к нижней части расщелины. Амино- и карбоксильные терминалы встречаются в субдомене 1.
Актин G и актин F
Есть две основные формы актина: мономер актина, называемый G-актином; и нитевидный полимер, состоящий из мономеров G-актина, называемый F-актином.Филаменты актина, наблюдаемые с помощью электронной микроскопии, имеют узкие и широкие области, соответственно 7 нм и 9 нм в диаметре.
Вдоль филамента мономеры актина образуют плотно упакованную двойную спираль. Повторяющаяся единица вдоль филамента состоит из 13 спиралей и 28 мономеров актина и находится на расстоянии 72 нм.
Актиновая нить имеет два конца. Один образован щелью, которая связывает ATP-Mg +2 , который расположен в одном направлении во всех актиновых мономерах филамента, называется (-) концом; а другая крайность противоположна, называемая (+) крайностью. Следовательно, актиновая нить имеет полярность.
Эти компоненты часто называют микрофиламентами, поскольку они представляют собой компоненты цитоскелета с наименьшим диаметром.
Где мы находим актин?
Актин - чрезвычайно распространенный белок в эукариотических организмах. Из всех клеточных белков актин составляет около 5-10% - в зависимости от типа клетки. В печени, например, в каждой из составляющих ее клеток содержится почти 5-10 клеток. 8 молекулы актина.
характеристики
Две формы актина, мономер и филамент, постоянно находятся в динамическом балансе между полимеризацией и деполимеризацией. В целом, это явление можно выделить три основных характеристики:
1) Актиновые нити характерны для строения мышечной ткани и цитоскелета эукариотических клеток.
2) Полимеризация и деполимеризация - это динамический процесс, который регулируется. Где полимеризация или агрегация мономеров актина G - ATP - Mg +2 это происходит на обоих концах. Произойдет ли этот процесс, зависит от условий окружающей среды и регуляторных белков.
3) Образование пучков и сеток, составляющих актиновый цитоскелет, придает силу подвижности клеток. Это зависит от белков, которые участвуют в образовании поперечных связей.
Сокращение мышц
Функциональной и структурной единицей скелетных мышц является саркомер, который имеет два типа волокон: тонкие волокна, образованные актином, и толстые волокна, образованные миозином. Обе нити расположены поочередно, точно геометрически. Они позволяют мышцам сокращаться.
Тонкие нити прикреплены к участкам, называемым дисками Z. Эта область состоит из сети волокон, в которых находится белок CapZ и к которым прикреплены (+) концы актиновых нитей. Этот якорь предотвращает деполимеризацию (+) конца.
С другой стороны, тропомодулин находится на (-) концах актиновых филаментов и защищает их от деполимеризации. В дополнение к актину тонкие филаменты содержат тропомиозин и тропонин, которые контролируют взаимодействия актомиозина.
Как происходит сокращение мышц?
Во время сокращения мышц толстые нити совершают вращательные движения, вытягивая тонкие нити к середине саркомера. Это вызывает скольжение грубых и тонких волокон.
Таким образом, длина толстых и тонких нитей остается постоянной, но перекрытие между обеими нитями увеличивается. Длина саркомера уменьшается из-за прикрепления тонких нитей к Z-дискам.
Как остановить сокращение мышц?
АТФ - это энергетическая валюта клетки. Поэтому он почти всегда присутствует в живых мышечных тканях.Принимая во внимание вышесказанное, должны быть механизмы, позволяющие расслабить мышцу и прекратить сокращение.
Два белка, называемые тропомиозином и тропонином, играют фундаментальную роль в этом явлении. Они работают вместе, чтобы блокировать сайты связывания миозина (тем самым предотвращая его связывание с актином). В результате мышца расслабляется.
И наоборот, когда животное умирает, оно испытывает явление, известное как трупное окоченение. За это упрочнение тушки отвечает блокирование взаимодействия между миозином и актином вскоре после смерти животного.
Одним из следствий этого явления является потребность в АТФ для высвобождения двух белковых молекул. Логично, что в мертвых тканях АТФ недоступен, и его высвобождение не может произойти.
Другие виды движения
Тот же механизм, который мы описываем (позже мы углубимся в механизм, лежащий в основе движения), не ограничивается мышечными сокращениями у животных. Он отвечает за амебоидные движения, которые мы наблюдаем у амеб и некоторых колониальных форм.
Точно так же движение цитоплазмы, которое мы наблюдаем у водорослей и наземных растений, осуществляется аналогичными механизмами.
Регулирование полимеризации и деполимеризации актиновых филаментов
Сокращение гладкой мышечной ткани и клеток приводит к увеличению F-актина и уменьшению G-актина.Полимеризация актина происходит в три стадии: 1) зародышеобразование, медленная стадия; 2) удлинение, быстрый шаг; и 3) устойчивое состояние. Скорость полимеризации равна скорости деполимеризации.
Актиновая нить растет быстрее на (+) конце, чем на (-). Скорость удлинения пропорциональна концентрации мономеров актина, находящихся в равновесии с актиновыми филаментами, называемой критической концентрацией (Cc).
Cc для (+) конца составляет 0,1 мкМ, а для (-) конца составляет 0,8 мкМ. Это означает, что для полимеризации (+) конца требуется в 8 раз меньшая концентрация мономеров актина.
Полимеризация актина в основном регулируется тимозином бета4 (ТВ4). Этот белок связывает G-актин и удерживает его, предотвращая его полимеризацию. Профилин же стимулирует полимеризацию актина. Профилин связывается с мономерами актина, облегчая полимеризацию на (+) конце за счет диссоциации комплекса актин-ТВ4.
Другие факторы, такие как увеличение количества ионов (Na + , К + или Mg +2 ) способствуют образованию волокон.
Формирование актинового цитоскелета
Формирование актинового цитоскелета требует создания поперечных связей между актиновыми филаментами. Эти связи образованы белками, выдающимися характеристиками которых являются: они имеют актин-связывающие домены; многие имеют домены, гомологичные кальпонину; и каждый тип белка экспрессируется в определенном типе клетки.
В филоподиях и стрессовых волокнах поперечные связи между актиновыми филаментами осуществляются фасциной и филамином. Эти белки, соответственно, заставляют актиновые филаменты располагаться параллельно или иметь разные углы. Таким образом, актиновые филаменты определяют форму клетки.
Область клетки с наибольшим количеством актиновых филаментов расположена рядом с плазматической мембраной. Эта область называется корой. Кортикальный цитоскелет организован по-разному, в зависимости от типа клетки, и связан с плазматической мембраной через связывающие белки.
Некоторые из наиболее описанных цитоскелетов - это мышечные клетки, тромбоциты, эпителиальные клетки и эритроциты. Например, в мышечных клетках белок, связывающий дистрофин, связывает актиновые филаменты с целостным гликопротеиновым комплексом на мембране. Этот комплекс связывается с белками внеклеточного матрикса.
Модель действия актин-миозинового взаимодействия
Исследователи под руководством Раймента предложили четырехступенчатую модель для объяснения взаимодействия актина и миозина. Первый шаг происходит при связывании АТФ с головками миозина. Это связывание вызывает конформационное изменение белка, высвобождая его из актина в тонком филаменте.
Затем АТФ гидролизуется до АДФ с высвобождением неорганического фосфата. Молекула миозина присоединяется к новой субъединице актина, создавая высокоэнергетическое состояние.
Выделение неорганического фосфата вызывает изменение миозина, возвращение к исходной конформации и движение мелких нитей относительно толстых нитей. Это движение вызывает движение двух концов саркомера, сближая их.
Последний шаг включает выпуск ADP. На этом этапе головка миозина свободна и может связываться с новой молекулой АТФ.
Движение клеток за счет полимеризации актина
Ползучая подвижность - это тип подвижности клеток. Шагами этого типа подвижности являются: проекция оси лидера адгезии к субстрату; адгезия к основанию; задний втягивание; и отторжение.
Проекция лидерной оси требует участия белков, которые участвуют в полимеризации и деполимеризации актиновых филаментов. Ведущая ось находится в коре клеток, называемой ламеллиподиумом. Шаги проецирования оси:
- Активация рецепторов внеклеточным сигналом.
- Образование активных GTPases и 4,5-бисфосфатфосфоинозитола (PIP2).
- Активация белков WASp / Scar и Arp2 / 3, которые связываются с мономерами актина с образованием ответвлений в актиновых филаментах.
- Быстрый рост актиновых филаментов ветви, украшенных миозином. Мембрана выдвигается вперед.
- Завершение удлинения, производимого белками оболочки.
- Гидролиз АТФ, связанного с актином в старых филаментах.
- Деполимеризация актин-АДФ из филаментов, вызванная АДФ / кофилином.
- Обмен АДФ на АТФ, катализируемый профилином, генерирующий актин Г-АТФ, готовый начать удлинение ответвлений.
Заболевания, связанные с актином
Мышечная дистрофия
Мышечная дистрофия - дегенеративное заболевание скелетных мышц. Он рецессивно наследуется и связан с хромосомой X. В основном он поражает мужчин с высокой частотой в популяции (один на каждые 3500 мужчин). Матери этих мужчин гетерозиготны, бессимптомны и могут не иметь семейного анамнеза.
Есть две формы мышечной дистрофии, Дюшенна и Беккера, и обе они вызваны дефектами гена дистрофина. Эти дефекты состоят из делеций, которые удаляют аксоны.
Дистрофин - это белок (427 кДа), который образует поперечные связи между актиновыми филаментами. Он имеет актин-связывающий домен на N-конце и мембранно-связывающий домен на C-конце. Между обоими доменами находится третий трубчатый домен, состоящий из 24 тандемных повторов.
В мышечном кортикальном ретикулуме дистрофин участвует в связывании актиновых филаментов с плазматической мембраной через гликопротеиновый комплекс. Этот комплекс также связывается с белками внеклеточного матрикса.
У пациентов с дефицитом функционального дистрофина с мышечной дистрофией Дюшенна кортикальный цитоскелет не поддерживает плазматическую мембрану. Следовательно, плазматическая мембрана повреждается стрессом от повторяющихся мышечных сокращений.
Механизм полимеризации актина в актиновые филаменты
Биологическая подвижность и полимеризация актина (Клячко Н.Л. , 2000), БИОЛОГИЯ
Дана новая информация о механизме полимеризации актина, лежащей в основе многих проявлений биологической подвижности. Рассмотрен путь передачи внеклеточного сигнала на полимеризующийся актин, включающий G-белки, WASP и Arp2/3-комплекс. Приведены примеры эксплуатации подвижными патогенными бактериями механизма полимеризации актина в клетках хозяина.
И ПОЛИМЕРИЗАЦИЯ АКТИНА
Институт физиологии растений им. К.А. Тимирязева Российской академии наук, Москва
Полимеризация актина важна для многих процессов в клетке, она подвержена строгой пространственной и временной регуляции. Актиновые микрофиламенты вместе с микротрубочками и промежуточными филаментами образуют динамичную сеть в цитоплазме клеток, так называемый цитоскелет, который не только определяет форму клетки и пространственную организацию ее компонентов, но и лежит в основе разнообразных типов внутриклеточной и клеточной подвижности.
Из статей, опубликованных ранее в "Соросовском Образовательном Журнале", можно узнать об общей организации цитоскелета, его составе, основных формах движения клеток животных и работе молекулярных моторов, то есть молекул, умеющих превращать химическую энергию гидролиза АТФ в механическую работу при сокращении мышц, перемещении органелл и т.п. 3. Одним из примеров такого моторного белка, участвующего в движении по нитям полимерного актина, является миозин. Взаимодействие актина и миозина приводит к сокращению мышц. Оно также лежит в основе перемещения органелл и молекул вдоль нитей актина, который в данном случае играет роль рельсов для перемещения, в то время как моторный белок служит паровозом.
Однако некоторые формы движения осуществляются без участия специализированных моторов: они основаны на процессе полимеризации актина. Само по себе быстрое удлинение нитей актина приводит к возникновению движущей силы в направлении роста этих нитей. Быстрая полимеризация актина происходит, например, при перемещении клеток фибробластов и некоторых низших грибов с помощью специализированных выростов - псевдоподий в сторону привлекательного для них сигнала или в направлении от отталкивающего сигнала (положительный и отрицательный таксис).
До недавнего времени механизм быстрой локальной полимеризации актина в клетках оставался неясным. Еще не так давно Ю.М. Васильев писал о полимеризации актина в местах выбрасывания псевдоподий подвижными клетками животных: "Вероятно, под мембраной в этих местах концентрируются какие-то белки, вызывающие полимеризацию новых микрофиламентов, но пока природу этих белков мы еще точно не знаем" [1, с. 39]. В последние годы сделано несколько открытий, позволивших узнать больше о таких белках и заполнить брешь в цепи событий, происходящих на пути от внеклеточного сигнала до конечного результата, а именно движения. Описанию этих новых фактов и посвящена данная статья.
НОВОЕ О ПОЛИМЕРИЗАЦИИ АКТИНА
Актин: мономеры и полимеры
Актин присутствует в клетке как в форме мономерного белка с молекулярным весом 42 кД, так и в виде длинных нитей и их пучков, связанных с другими элементами цитоскелета и мембранами. Мономеры актина имеют грушевидную форму, и при их полимеризации возникает спирально закрученная полярная нить с различающимися концами: заостренным (минус) и оперенным (плюс) концом (рис. 1). Такие названия появились в связи с тем, что при взаимодействии актиновых нитей с фрагментами молекулы моторного белка миозина образуется комплекс, имеющий под электронным микроскопом стреловидную форму. При этом острие стрелы указывает на заостренный конец, а ее оперение обращено в сторону противоположного конца филамента.
Полимеризация актина происходит в две стадии. Первая стадия носит название "нуклеация", то есть создание ядра (nucleus) или затравки из первых трех мономеров актина. Димер (комплекс двух мономеров) является нестабильной структурой и легко разрушается. Именно нуклеация определяет общую скорость полимеризации. Вторая стадия, удлинение нити, протекает легче, с большей скоростью.
В пробирке мономерный актин может присоединяться и диссоциировать с обоих концов нити, но присоединение происходит быстрее к плюс-концу. Процесс непрерывного присоединения мономеров к оперенному (плюс) концу и их диссоциации с заостренного (минус) конца, то есть непрерывный круговорот мономеров (от англ. treadmilling - бесконечная, монотонная механическая работа) (см. рис. 1).
В живой клетке процесс полимеризации актина может быть не похож на treadmilling, то есть на круговорот мономеров в пробирке, поскольку полярные концы актинового филамента могут быть несвободными. В клетке присутствуют десятки так называемых актинсвязывающихся белков, которые сильно влияют на процесс полимеризации актина. Некоторые из них могут блокировать активно растущий оперенный плюс-конец, так называемые кэп-белки (от англ. cap - шапочка), прекращая таким образом полимеризацию уже существующих нитей и освобождая мономерный актин для построения новых нитей. Другие белки могут разрезать нити актина, формируя тем самым новые фрагменты с заостренными и оперенными концами. Существуют белки, связывающие мономеры актина и таким образом делающие их недоступными для полимеризации (например, профилин), белки, деполимеризующие актин, и т.п.
Актин - крайне консервативный белок, состоящий практически из одинаковых аминокислот у всех исследованных организмов. Однако помимо такого консервативного классического актина в клетках имеется много так называемых актиноподобных белков (actin-related proteins, Аrp), гомология которых с актином составляет всего от 30 до 60%. Различают несколько подсемейств таких белков: Аrp1, Аrp2, Аrp3 и др. Области гомологии этих белков с актином расположены главным образом в центральной части белковой глобулы. Поэтому долгое время считали, что эти белки неспособны к полимеризации, а также и совместной полимеризации с актином. Однако в последнее время становится ясно, что такое утверждение не вполне верно. Так, было обнаружено, что Аrp1 (центрактин) может полимеризоваться вместе с актином в составе так называемого динактинового комплекса, участвующего в перемещении органелл по микротрубочкам. Аrp2 и Аrp3 поодиночке действительно не взаимодействуют с актином. Однако недавно было показано, что эти два белка входят в состав так называемого Arp2/3-комплекса, содержащего помимо Аrp2 и Аrp3 белков еще пять или шесть (в зависимости от организма) субъединиц, не имеющих гомологии ни с одним из белков в компьютерных базах данных (рис. 2, а). Этот сложно устроенный комплекс был впервые выделен из амебы Acanthamoeba castellanii. Впоследствии было показано, что Arp2/3-комплекс очень консервативен и присутствует у всех исследованных эукариотных организмов от дрожжей до человека (для растений таких данных пока нет). В живых клетках этот комплекс накапливается в местах, где происходит быстрая полимеризация актина, например в разного рода псевдоподиях, в кортикальном слое цитоплазмы у дрожжей, в хвосте подвижных патогенных бактерий.
Оказалось, что Arp2/3-комплекс имеет повышенное сродство к минус-концам актиновых филаментов, а именно гетеродимер Arp2-Arp3 может служить матрицей, на которой происходит образование новых актиновых нитей (нуклеация) (рис. 2, а). Кроме того, комплекс может присоединяться к боковым сторонам нитей и таким образом обеспечивать их ветвление (рис. 2, б ). Интересно, что боковые нити актина отходят от основной нити строго под углом 70?, образуя жесткую сеть. Быстро растущие плюс-концы нитей актина обращены в сторону периферии клеток, например к мембране псевдоподия (рис. 2, б ). При этом создается движущая сила, толкающая мембрану вперед, в направлении перемещения клетки.
Концентрация Arp2/3-комплекса в клетках в 40-100 раз меньше, чем концентрация мономеров актина, но она достаточно велика, чтобы заблокировать все заостренные концы нитей, например у Acanthamoeba. Это, конечно, не означает, что treadmilling (круговорот мономеров) актина никогда не происходит в живых клетках. Напомним, во-первых, что комплекс характерен не для всех субпопуляций актина, и, во-вторых, возможно, что при определенных физиологических условиях он может диссоциировать от актиновых полимеров.
Сродство Arp2/3-комплекса к актину не слишком велико, и он ускоряет полимеризацию актина всего в 2-3 раза. Оказывается, для более эффективного функционирования сам комплекс должен быть активирован. Роль активаторов комплекса играют другие белки.
Движение патогенной бактерии Listeria
Первый белок, играющий роль активатора Arp2/3-комплекса, был обнаружен у патогенной бактерии Listeria monocytogenes, которая может вызывать опасные для жизни человека заболевания, такие, как энцефалит. Эта бактерия способна с большой скоростью перемещаться в цитоплазме клеток хозяина. Однако она не имеет жгутиков, и в ее клетке, как и у других прокариот, нет собственного актинового цитоскелета. Эта бактерия-паразит приспособилась использовать для перемещения актин эукариотной клетки, в которой она живет. L. monocytogenes научилась быстро полимеризовать актин хозяина вблизи одного из своих полюсов. В результате в ее кильватере образуется "хвост кометы" из непрерывно полимеризующегося актина, что и создает движущуюся силу для перемещения бактерии (рис. 3, вставка).
Оказалось, что на поверхности этой бактерии вблизи одного из ее полюсов имеется белок ActA, который умеет присоединять и активировать Arp2/3-комплекс и как следствие - во много раз ускорять полимеризацию актина. Пространственно процесс ограничен областью вблизи поверхности бактерии. Это достигается совместным действием многих актинсвязывающих белков, которые блокируют концы растущих филаментов актина, обеспечивают их ветвление, деполимеризацию и т.д. Растущие нити актина, по-видимому, направлены быстро растущими оперенными плюс-концами в сторону движения бактерии (точно так же, как это происходит при образовании псевдоподий в клетках эукариот) и толкают бактерию вперед.
Недавно M.-F. Carlier и ее сотрудники воссоздали процесс движения бактерии в системе in vitro, состоящей только из очищенных цитоскелетных белков. Ученые также определили степень необходимости каждого из белков - участников этого процесса. Помимо актина для моделирования процесса движения оказались необходимы всего три компонента: Arp2/3-комплекс, актиндеполимеризующий фактор и кэп-белки. Еще три белка были полезны, но необязательны для поддержания движения. Скорость движения бактерий составила 2-4 мкм/мин, то есть была не намного меньше, чем в клеточных экстрактах.
Таким образом, на предметном стекле был воспроизведен процесс движения патогенной бактерии Listeria и изучен его молекулярный механизм. Показано, что бактерия использует для передвижения полимеризацию актина цитоплазмы клетки-хозяина, активируя его с помощью собственного мембранного белка ActA.
РЕГУЛЯЦИЯ ПОЛИМЕРИЗАЦИИ АКТИНА
В КЛЕТКАХ ЭУКАРИОТ
Если полимеризация актина вблизи поверхности патогенной бактерии происходит конститутивно (без внешнего сигнала), то в подвижных клетках эукариот (например, в псевдоподиях фибробластов) или в зонах внутриклеточной подвижности, основанной на полимеризации актина, перестройка актинового цитоскелета обычно происходит в ответ на внеклеточный сигнал (свет, химический стимул). Уже давно известны начальные и конечные звенья в передаче этого сигнала. Внеклеточный сигнал воспринимается мембранным рецепторным белком и затем передается на так называемые G-белки, небольшие белки, способные связывать ГТФ, изменять свою конформацию и благодаря этому передавать сигналы на другую белковую молекулу. Гидролиз ГТФ до ГДФ G-белком возвращает его в неактивную конформацию. Некоторые такие G-белки (Rho, Rac и Cdc42) в итоге передают сигнал на актиновый цитоскелет, что приводит к быстрой полимеризации актина в зонах образования ламеллоподий и филоподий (разные типы псевдоподий) или волокон натяжения, пересекающих клетку пучков актиновых нитей. Промежуточные звенья в этой системе передачи сигнала до недавнего времени не были выяснены. Теперь стало очевидным, что полимеризации актина предшествует взаимодействие его мономеров с Arp2/3-комплексом, который затем должен быть активирован какими-то белками по аналогии с ActA-белком Listeria. Начались поиски таких белков в клетках животных и дрожжей, которые вскоре увенчались успехом. Было найдено несколько гомологичных белков. Первый из открытых белков получил название WASP, поскольку был найден у больных Wiscott-Aldrich-синдромом - наследуемой болезнью человека. Для этих белков характерно сложное доменное строение: они содержат домены связывания с белками и другими регуляторными молекулами (рис. 4, а). Показано, что эти белки, в частности, могут связывать Arp2/3-комплекс, мономерный актин, профилин, G-белки, сигнальную молекулу - фосфатидилинозитол-4,5-бисфосфат. Функциональное назначение разных доменов различно. Так, на С-конце WASP-белка рядом расположены домены связывания мономерного актина и Arp2/3-комплекса. Это обеспечивает их пространственное сближение и может облегчать процесс полимеризации актина. На N-конце WASP-белка расположены домены связывания G-белков и других сигнальных молекул. Благодаря этому WASP и его аналоги могут служить посредниками при действии многих факторов и участвовать в передаче сигнала (на участке между G-белками и Arp2/3-комплексом), активирующего полимеризацию актина.
Сами белки семейства WASP, по-видимому, в свою очередь, нуждаются в активации. Так, было показано, что С-концевые фрагменты этих белков более активны в стимуляции полимеризации актина, чем целые белки. Это может означать, что белки из семейства WASP могут существовать в клетке в неактивной конформации (рис. 4, б ) и только взаимодействие сигнальных молекул (G-белки, фосфоинозитолфосфатиды) с N-концевой частью этих белков переводит их в активную конформацию.
Итак, WASP-белки и Arp2/3-комплекс составляют те центральные звенья в цепи передачи внеклеточного сигнала, вызывающего полимеризацию актина, которые до недавнего времени были белыми пятнами в наших знаниях (рис. 5). Любопытно, что, если патогенная бактерия Listeria, о которой шла речь выше, сама синтезирует мембранный белок ActA (гомолог WASP), активирующий Arp2/3-комплекс эукариотной клетки, другая патогенная бактерия, возбудитель дизентерии Shigella flexneri, продвинулась еще дальше в степени эксплуатации механизма полимеризации актина клетки хозяина: ее мембрана содержит белок, который умеет присоединять WASP-белок хозяина (а не имитировать его активность), вклиниваясь в сигнальную цепь хозяина и активируя Arp2/3-комплекс с помощью Cdc42 (G-белок). Более того, если покрыть WASP-белком микроскопические стеклянные бусинки, то они тоже сумеют собирать актин вблизи своей поверхности и перемещаться в клеточных экстрактах без участия каких-либо моторных белков, только благодаря полимеризации актина.
Для выполнения актиновым цитоскелетом множества функций в клетке необходимо, чтобы сборка и организация актиновых нитей происходили в нужное время и в нужном месте. В последние десять лет шли интенсивные исследования с использованием генетических, биохимических и цитологических подходов для выяснения путей передачи внеклеточного сигнала к местам активной полимеризации актина. За это время был открыт Arp2/3-комплекс, служащий матрицей для нуклеации нитей актина и обнаружено несколько белков, регулирующих его активность. В последние годы было предпринято много усилий, чтобы понять механизм, с помощью которого G-белки семейства Rho регулируют состояние актинового цитоскелета, и практически заполнена брешь в цепи передачи внеклеточного сигнала на цитоскелет с участием G-белков. Важные для расшифровки этого пути передачи сигнала уроки были извлечены из изучения подвижности патогенных бактерий внутри эукариотической клетки и воспроизведения этого движения в модельных системах. Очевидно, что новые детали пространственной и временной регуляции сборки и организации актинового цитоскелета будут выяснены в последующие годы.
1. Васильев Ю.М. Клетка как архитектурное чудо. 1. Живые нити // Соросовский Образовательный Журнал. 1996. ╧ 2. С. 36-43.
2. Васильев Ю.М. Клетка как архитектурное чудо. 2. Цитоскелет способный чувствовать и помнить // Там же. ╧ 4. С. 4-10.
3. Тихонов А.Н. Молекулярные моторы. 2. Молекулярные основы биологической подвижности // Там же. 1999. ╧ 6. С. 17-24.
4. Welch M.D. The World According to Arp: Regulation of Actin Nucleation by the Arp2/3 Complex // Trends Cell Biol. 1999. Vol. 9. P. 423-427.
5. Machesky L.M., Cooper J.A. Bare Bones of the Cytoskeleton // Nature. 1999. Vol. 401. P. 542-543.
Рецензент статьи О.Н. Кулаева
Нелла Леопольдовна Клячко, доктор биологических наук, ведущий научный сотрудник Института физиологии растений им. К.А. Тимирязева РАН. Область научных интересов - пространственная организация белоксинтезирующего аппарата и его взаимодействие с цитоскелетом растительной клетки. Автор более 80 научных публикаций.
мономер G-актин (глобулярный актин)- ассиметричный
(42кДа) состоит из двух доменов, по мере повышения ионной
силы агрегирует в скрученный в спираль полимер F-актин (фибриллярный
актин).
G-актин имеет участки связывания двухвалентных катионов
и нуклеотидов в физиологических условиях занятые Mg 2+
и ATP.
Полимеризация G-актина в F-актин
F-актин обладает полярностью (+) и (-) имеющих
различные свойства.
Молекула G-актина несет прочно связанную АТФ, который при
переходе в F-актин медленно гидролизуется до АДФ – проявляет
свойства АТФ-азы Полимеризация сопровождается гидролизом
АТФ, что не необходимо т.к. полимеризация идет и в присутствии
негидролизуемых аналогов АТФ
Полимеризация состоит из нескольких процессов: нуклеация,
элонгация, диссоциация,
фрагментация, стыковка.
Эти процессы протекают одновременно.
Нуклеация – соединение трех G-актинов –
инициация полимеризации.
Элонгация - наращивание цепи актина путем
присоединения G-актина к (+)-концу F-актина.
Диссоциация - укорачивание цепи. Деполимеризация
актина имеет одинаковую скорость с обоих концов
Фрагментация - в результате теплового движения
F-актин может фрагментироваться.
Стыковка - отдельные фрагменты могут соединяться
друг с другом конец в конец.
При конценрации G>F – одновременно происходит полимеризация
(+) и (–) конца.
Если G (–)-конца – тредмиллинг – движение F-актина
за счет одновременного наращивания (+)-конца и диссоциации
(-)-конца. При G ~ F – динамическое равновесие - происходит
полимеризация (+) и деполимеризация (–)-конца с затратой
энергии ATP G-актин связ с ATP и полимеризуясь гидролизует
ATP.при критических конц G-актина (+) конец удлиняется,
а (-) – укорачивается
Актиновые микрофиламенты
F-актин – фибриллярный, длина оборота спирали 37
нм, d=6-8нм.
Актинсвязывающие белки
Более 50 белков в цитоплазме связываются с актином выполняя
различные функции: регулируют объем G-актинового пула (профилин),
влияют на скорость полимеризации (виллин), стабилизируют
концы нитей (фрагин, а-актинин), сшивают филаменты др с
др или с др компонентами (виллин, α-актин, спектрин,
MARCKS, фимбрин), разрушают двойную спираль F-актина (гельзолин).
Активность этих белков регулируется Ca 2+ и протеинкиназами.
Имеется пять мест действия белков: с мономером
актина, с (+)-концом (оперенный), с (-)-концом (заостренный),
с боковой поверхностью. Актин-связывающие белки могут быть
чувствительны или нечувствительны к Ca 2+
1. Белки связывающиеся c мономером актина - подавляют нуклеацию
(профилин, фрагментин - чувствительны к Ca 2+ ).
Профилин с мономером способны надстраивать F-актин, а фрагментин
нет, блокируя и нуклеацию и элонгацию. Не чувствительные
к Ca 2+ ДНКазаI и белок связывающийся с витамином
D - функционируют вне клетки.
2. Кепирующие(+)-конец может быть блокирован кепирующими
белками - блокирование элонгации и стыковки, способствуют
нуклеации - появление укороченных филаментов (гельзолин,
виллин, фрагмин)
3. (-)-конец - инициирование нуклеации, подавление стыковки
и элонгации - увеличение числа и уменьшение длины фрагментов.
Акументин в макрофагах, бревин - сывороточный белок вызывает
быстрое снижение вязкости раствора F-актина. Оба белка не
чувствительны к Ca 2+
4. Не сшивающие - боковое связывание может как стабилизировать
так и дестабилизировать F-актин Тропомиозин (Ca-независим)
стабилизирует, северин, виллин (Ca-зависим) - связываясь
с F-актином разрезают его.
5. Сшивающие F-актин между собой с образованием геля. Такие
белки индуцируют нуклеацию. Такие белки димерны или имеют
два актин-связывающих домена. α-актин тромбоцитов,
виллин, фимбрин, актиногелин из макрофагов (Ca-независим).
кэпирующие белки - закрывают концы актиновых
филаментов, предотвращая полимеризацию-деполимеризацию,
способствуют прикреплению филамента к мембране.
фаллоидин – яд бледной поганки, связывается
с (-)-концом и ингибирует деполяризацию.
цитохалазин – токсин плесневых грибов присоединяется
к (+) концу, блокируя полимеризацию.
кэпирующие-фрагментирующие белки - фрагментируют
F-актин, вызывая переход геля в золь (гельзолин 90kD активируясь
Ca2+ 10-6M разрывает F-актин и связывается с его концами).
белки связывающие F-актин
| белок | M, kD | рис. | локализация и действие на F-актин |
| фасцин | 55 | филлоподии, ламелоподии, стресс-фибриллы, микроворсинки, акросома | |
| тропомиозин | 2x35 | стабилизирует F-актин, предотвращая фрагментацию | |
| миозин | 2x260 | скольжение нитей | |
| минимиозин | 150 | движение пузырьков | |
| профилин | 15 | запасение G-актина | |
| скруин | 102 | акросома | |
| вилин | 92 | микроворсинки | |
| дематин | 48 | кортикальная сеть эритроцитов | |
| фимбрин | 68 | адгезион. контакты, микроворсинки связ в пучки | |
| актинин | 2x102 | адгез контакты, микроворсинки связ в пучки | |
| спектрин | 2x265+2x260 | кортик сеть эритроц прикрепление к ПМ | |
| дистрофин | 427 | корт.сеть мыш волокон | |
| ABP120 | 92 | псевдоподии | |
| филамин | 2x280 | псевдоподии, стрессфибриллы сшивает в сети |
Структуры образуемые актином
Клеточный кортекс – сеть из актиновых филаментов
под плазматической мембраной.
Стресс-фибриллы - образуются, когда у клетки есть
возможность прикрепиться к субстрату
• В присутствии физиологических концентраций моновалентных и двухвалентных катионов мономерный актин полимеризуется, образуя филаменты
• Актиновые филаменты структурно поляризованы и два их конца неидентичны
В присутствии моновалентных и двухвалентных канонов во внутриклеточной концентрации, мономерный актин полимеризуется с образованием филаментов, диаметр которых составляет 8 нм. Полимеризация носит обратимый характер, и мономеры постоянно добавляются к концу филамента и отщепляются от него. Процесс сборки и разборки обусловливает подвижность клеток, в основе которой лежит процесс полимеризации актина.
Как показано на рисунке ниже, мономеры полимеризуются, ориентируясь «голова к хвосту», и, таким образом, все субъединицы в филаменте имеют одинаковую ориентацию. Актиновый филамент напоминает двойную нитку бус, закрученную вправо, как показано на рисунке ниже. Это было обнаружено с помощью электронной микроскопии.
Поскольку структура мономеров полярна, филамент также полярен, т. е. два его конца различны. Они называются оперенный и заостренный концы. Полярность филамента играет роль в двухстороннем транспорте и в поляризации клеток.
Конец актинового филамента, который заканчивается субдоменами 1 и 3, представляет собой оперенный конец, а заканчивающийся субдоменами 2 и 4 — заостренный. Эти названия происходят от внешнего вида актиновых филаментов, связанных с миозином. Поскольку актиновые фила-менты спирализованы и поляризованы, в электронном микроскопе миозиновые белки напоминают оперение стрелы. Оперенные и заостренные актиновые филаменты также обозначают как плюс (+) и минус (-) концы соответственно, что согласуется с номенклатурой, принятой для обозначения соответствующих концов микротрубочек.
Каждая актиновая субъединица в составе филамента контактирует с четырьмя соседними субъединицами: одна с каждой стороны той же цепи (продольные контакты) и две на противоположной цепи (латеральные контакты). Эти контакты делают актиновые филаменты очень прочными. Они устойчивы к температурным изменениям и могут расти, достигая длины порядка тысяч субъединиц. Филаменты прочны, но ломаются при резком изгибе. Хотя короткие филаменты ( < 5 мкм) не изогнуты, длинные (>15 мкм) часто искривлены.
Кадры анимации, иллюстрирующие последовательную сборку актиновых мономеров в актиновый филамент. Актиновые мономеры собираются «голова к хвосту»,
образуя двунитевые поляризованные филаменты. (Слева) Фотография актинового филамента, сделанная с помощью электронного микроскопа.
(В середине) Модель актинового филамента, построенная на основании трехмерной реконструкции электронных микрофотографий.
(Справа) Атомные структуры актиновых мономеров расположены на фоне трехмерной модели и иллюстрируют размещение субъединиц в одной цепи актинового филамента.
• Полимеризация актина de novo представляет собой многоступенчатый процесс, включающий инициацию и элонгацию
• Скорость полимеризации мономера на двух концах филамента различается
• Оперенный конец актинового филамента растет быстрее
Клетки движутся, выдвигая вперед передний край и подтягивая хвостовой отдел. Передние выросты могут представлять собой ламеллоподии или филоподии. Ламеллоподии представляют собой тонкие плоские выросты, окруженные мембраной, содержащие разветвленную сеть актиновых филаментов. Напротив, филоподии выглядят как щупальцы, окруженные мембраной и содержащие пучки актиновых филаментов, расположенных параллельно друг другу. Рост филоподии и ламеллоподии происходит за счет полимеризации актина. Этот процесс мы обсудим здесь подробно.
Полимеризация мономеров актина при образовании филаментов представляет собой многоступенчатый процесс. Его можно изучать in vitro, используя очищенный мономерный актин в растворе с низкой ионной силой. Полимеризация инициируется увеличением концентрации соли до физиологического уровня. Процесс спонтанной полимеризации in vitro можно подразделить на три фазы — нуклеация, элонгация, и равновесное состояние.
В фазе нуклеации образуется актиновый олигомер, по свойствам близкий к филаменту. Этот олигомер служит ядром (нуклеусом) для последущей полимеризации актина. Нуклеус представляет собой тример, который является наименьшей единицей, контактирующей с филаментом в продольном и латеральном направлениях. Таким образом, нуклеация происходит в два этапа: образование димера из двух мономеров с последующим присоединением третьей субъединицы. При этом получается тример. Актиновые димеры и тримеры неустойчивы (Kd ~ 100 мкМ-1 мМ) и существуют в очень низких концентрациях. Таким образом, в результате нуклеации при спонтанной полимеризации возникает лаг-период. Лаг-период может отсутствовать, если уже готовы ядра, из которых могут образоваться мономеры (например, если присутствуют преформированные филаменты). В клетке сборка филаментов инициируется белками, связывающимися с актином.
В фазе элонгации происходит быстрый рост филаментов в продольном направлении. Актиновые филаменты растут с концов, а не с боков. Поэтому филаменты различны по длине, но все обладают одинаковой толщиной. По мере полимеризации субъединиц и снижения концентрации свободного мономера, фаза элонгации замедляется.
Когда процесс полимеризации находится в стационарном состоянии, то рост филаментов не происходит. Однако наблюдается медленный постоянный обмен между актиновыми субъединицами, находящимися на концах филаментов и в пуле мономеров. Концентрация свободных актиновых мономеров, характерная для стационарного состояния, называется критической концентрацией (Сс).
Этим термином также обозначают концентрацию актиновых субъединиц, которая необходима для образования филаментов (Сс для сборки актина). Когда общая концентрация мономерного актина превышает критическую, происходит образование филаментов. Напротив, если общая концентрация актина ниже критической, он существует только в мономерной форме. При определенном составе раствора критическая концентрация представляет собой постоянную величину, однако она зависит от присутствия регуляторных белков, которые связываются с актиновы-ми мономерами и филаментами.
При концентрации мономеров выше критической происходит элонгация филаментов, скорость которой линейно зависит от концентрации мономеров в растворе. Скорость элонгации индивидуального филамента представляет собой произведение константы скорости добавления мономеров (kon; ед мкМ-1 с-1) и их концентрации. Скорость деполимеризации (koff; ед с-1) не зависит от концентрации мономерного актина. Когда концентрация мономерного актина равняется критической, то скорость элонгации и деполимеризации становится одинаковой, и роста филамента не происходит:
(kon)*(Cc) = koff.
После преобразования получаем:
Cc = koff / kon.
В состоянии равновесия константа диссоциации Kd равняется koff/kon. Поэтому критическая концентрация равняется равновесной константе диссоциации для связывания мономерного актина с концом филамента:
Cc = Kd
Скорость включения мономера в концы филамента неодинакова. Значения констант скорости элонгации kon и koff (и их отношения, т. е. критической концентрации) зависят от природы нуклеотида, связанного с актином (этот вопрос подробно рассматривается в следующем разделе). В присутствии АТФ мономерный актин связывается с оперенным концом филамента примерно в десять раз быстрее, чем с заостренным концом. Это подтверждается соответствующим экспериментом. В этом эксперименте для нуклеации полимеризации актина использовали короткие актиновые филаменты с присоединенным к ним миозином. На фотографии, сделанной в электронном микроскопе после элонгации филамента, видно, что на оперенном конце полимеризовалось гораздо больше актина, чем на заостренном. Поэтому оперенный конец часто обозначают как быстрорастущий (плюс-конец), а заостренный как медленнорастущий (минус-конец) конец филамента.
Процесс сборки актиновых филаментов, начиная с раствора мономеров, можно подразделить на следующие фазы: нуклеация, элонгация и состояние равновесия.
Фазу нуклеации можно обойти, добавив небольшое количество преформированных филаментов (ядер). По данным исследований in vitro, сборка акти-новых филаментов начинается,
когда исходная концентрация актиновых мономеров превышает критическую концентрацию, Сс. По данным экспериментов in vitro, скорость элонгации линейно зависит от концентрации актиновых мономеров. Результаты эксперимента, демонстрирующего, что полимеризация актина, главным образом, происходит на оперенном конце филамента.
Для нуклеации процесса элонгации использовали филамент, связанный с актином.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Подвижность является фундаментальным и необходимым свойством всех эукариотических клеток
• Актиновые филаменты образуют много различных клеточных струтур
• Белки, связанные с актиновым цитоскелетом, способны развивать усилия, обеспечивающие подвижность клеток
• Актиновый цитоскелет представляет собой динамическую структуру и перестраивается в ответ на сигналы, поступающие из клетки или из окружающей среды
• При полимеризации актина генерируются усилия, которые вызывают удлинение клеточных выростов и обеспечивают подвижность некоторых органелл
Внутренний цитоскелет, состоящий из микротрубочек, актиновых филаментов (также называемых микрофиламентами) и промежуточных филаментов, обеспечивает клетке механическую прочность и помогает ей поддерживать определенную форму.
Наряду с этим, цитоскелет представляет собой опорную структуру, позволяющую клетке осуществлять контроль за передвижением, изменением формы и перестройкой внутренних элементов. Движения, которые совершаются при участии цитоскелета, обеспечивают клеточную подвижность.
Для осуществления многих клеточных функций необходимо согласованное действие двух или трех структур цитоскелета, состоящих из филаментов. Однако актиновые филаменты играют ведущую роль в реализации многих клеточных функций, например в цитокинезе, фагоцитозе и мышечном сокращении.
Белок актин полимеризуется с образованием длинных фибриллярных филаментов, диаметр которых достигает 8 нм. Эти филаменты могут сшиваться другими белками, образуя разнообразные клеточные структуры. На рисунке ниже представлены некоторые структуры, основным компонентом которых служит актиновый цитоскелет.
К их числу относятся кишечные микроворсинки, стереоцилии сенсорного эпителия, стресс-фибриллы прикрепленных клеток, конус роста нейронов, выросты (ламеллоподии и филоподии) на границе подвижных клеток, и тонкие филаменты клеток мышц. Почти все структуры, построенные на основе актина, являются динамичными и способны к перестройке в ответ на внутренние или внешние сигналы.
Актиновый цитоскелет генерирует силу и осуществляет движение клеток двумя путями: за счет полимеризации актиновых мономеров в филаменты и взаимодействия с миозиновыми моторами. Последние связываются с актиновыми филаментами латерально и генерируют усилия и движение за счет энергии гидролиза АТФ.
При этом движение может совершаться по отношению к актиновому филаменту, как, например, при мышечном сокращении и транспорте везикул. Например, сила, которая генерируется за счет полимеризации актина, используется для выталкивания вперед плазматической мембраны при движении клетки. Во многих процессах, например при мышечном сокращении, актин и миозин функционируют совместно.
В дальнейших статьях мы рассмотрим механизм подвижности клеток эукариот, связанный с актомиозиновым комплексом. Многие закономерности подвижности клеток удалось выяснить при проведении биохимических экспериментов с использованием очищенных белков и клеточных компонентов. На основании этих экспериментов можно смоделировать более сложные движения клеток.
Поэтому в первую очередь мы охарактеризуем молекулярные свойства актинового цитоскелета (строение, сборку и разборку филаментов и белков, регулирующих динамику актина в клетке). Затем мы обсудим актин и связанные с ним белки в связи с их функционированием в клетке. Актиновый цитоскелет играет критическую роль почти в каждом клеточном процессе; в дальнейших статьях мы рассмотрим двигательную активность, связанную со сборкой актиновых филаментов, а также с сокращением актомиозинового комплекса, и вопросы транспорта с его участием. Мы также приводим ссылки на другие статьи на сайте, в которых обсуждается значимость актинового цитоскелета в жизнедеятельности клетки и его динамика.
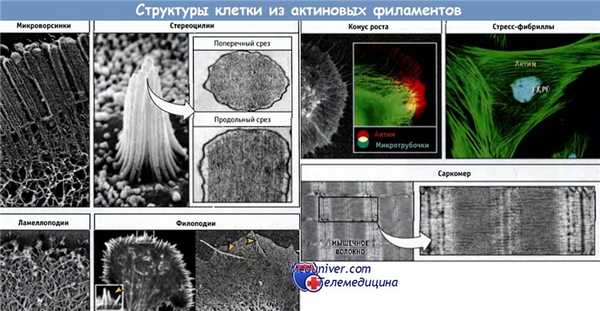
Актиновые филаменты образуют кишечные микроворсинки, стереоцилии внутреннего уха,
ламеллоподии, филоподии, конус роста нейронов, стресс-фибриллы и саркомеры.
Читайте также:
- Псевдоэпителиоматозная гиперплазия и кератоакантома конъюнктивы: признаки, гистология, лечение, прогноз
- Киста Бейкера (подколенная киста): атлас фотографий
- Показания для резекции кисты общего желчного протока
- Возраст как показание к пренатальному кариотипированию.
- Преимущества протеза на аттачменах. Недостатки конструкции протеза на ZL-аттачменах
