Микроокружение создаваемое стромальными механоцитами. Специфичность стромальных механоцитов
Добавил пользователь Дмитрий К. Обновлено: 31.01.2026
Фибробласты — наиболее многочисленная и функционально значимая группа клеток в рыхлой волокнистой соединительной ткани.
- 1) синтез компонентов межклеточного вещества: фибриллярных белков (коллаген, эластин) и гликозамипогликанов;
- 2) разрушение коллагена с помощью коллагеназы, что препятствует преждевременному склерозированию ткани;
- 3) регуляция деятельности других клеток соединительной ткани.
В эмбриогенезе фибробласт образуется из стволовой мезенхимной клетки. В постпаталыюм онтогенезе предшественником фибробласта может быть адвентициальная клетка.
В процессе дифферепцировки образуется дифферон фибробластов'. стволовые, полустволовые, малоспециализироваппые (юные), дифференцированные фибробласты (зрелые, активно функционирующие), фиброциты. Фиброциты — дефинитивные, стареющие формы клеток. Синтез коллагена и других веществ у этих клеток резко снижен, они не способны к делению, как и зрелые фибробласты (см. рис. 14.1).Фиброциты гибнут путем апоптоза.
Фибробласты отростчатые, веретеповидпые клетки больших размеров (40 мкм и более). Крупное, светлое, овальной формы ядро располагается в центре, содержит эухроматин, 1—2 ядрышка. В центральной части клетки цитоплазма (эндоплазма) окрашивается более базофилыю. Электронно-микроскопически в эндоплазме выявляются хорошо развитая гранулярная цитоплазматическая сеть, свободные рибосомы, митохондрии, пластинчатый комплекс, лизосомы. В периферической зоне цитоплазмы (эктоплазме) содержатся многочисленные микрофиламенты и микротрубочки (см. рис. 14.1, 14.2, а). Фибробласт обладает подвижностью, способностью изменять свою форму, прикрепляться к другим клеткам и компонентам межклеточного вещества.
Среди фибробластов па основе продолжительности жизни и источника происхождения различают две субпопуляции. Корот- коживущие фибробласты развиваются из стволовых кроветворных клеток и участвуют в процессах воспаления, заживления ран. Дол-
![Клетки соединительной ткани 17]](/pimg3/mikrookruzhenie-sozdavaemoe-stromalnimi-CFFFF.png)
Рис. 14.2. Клетки соединительной ткани 17]: а — фибробласт; б — макрофаг; в — тучная клетка; г — плазмоцит; 1 — ядро; 2 — грЭПС; 3 — митохондрии; 4 — комплекс Гольджи; 5 — коллагеновые волокна; 6 — псевдоподии; 7 — гетерофагосома; 8 — первичная лизосома; 9 —
гоживущие фибробласты происходят из стволовых стромальных (мезенхимных) клеток, обладают преимущественно механическими функциями.
Выделяют специализированные фибробласты — миофибро- бласты и фиброкласты.
Миофибробласты по строению занимают промежуточное положение между зрелым фибробластом и гладким миоцитом. От зрелых фибробластов отличаются гипертрофированным сократительным аппаратом (актиновыс микрофиламенты), что делает их похожими на миоциты. Миофибробласты активизируются при заживлении ран: образуют коллаген, который заполняет поврежденные участки, сокращаясь, сближают края раны. В матке количество этих клеток увеличивается при развитии беременности.
Фиброкласты разрушают межклеточное вещество, относятся к дифферону фибробластов. Отличаются от последних большим содержанием гидролитических ферментов. Эти клетки принимают участие в перестройке и инволюции межклеточного вещества при его избыточном образовании, в частности в матке после родов, в рубцах после регенерации.
Адипоциты (жировые клетки) повсеместно распространены в рыхлой волокнистой соединительной ткани преимущественно вокруг сосудов, чаще всего группами. Образуются из малодифференцированных (юных) фибробластов, накапливая в цитоплазме липидные включения в виде одной большой капли. Ткань, в которой адипоциты преобладают, являясь структурно и функционально ведущим компонентом, называют жировой и относят к соединительным тканям со специальными свойствами.
Адвентициальные клетки — малоспециализированные клетки, располагающиеся вдоль кровеносных сосудов. Они имеют уплощенную форму, овальное ядро и небольшое количество орга- нелл. В процессе дифференцировки могут превращаться в клетки соединительной ткани: фибробласты, миофибробласты, адипоциты.
Перициты — звездчатые клетки, плотно окружающие капилляры и посткапиллярные венулы. Клетки локализуются между листками базальной мембраны капилляра, контактируют с эндотелиальными клетками. Они могут синтезировать компоненты базальной мембраны, контролировать пролиферацию эндотелиальных клеток, дифференцироваться в гладкие миоциты в условиях заживления ран. В цитоплазме клеток хорошо развиты элементы цитоскслета, что обеспечивает способность клеток к сокращению, при этом регулируется просвет гемокапилляра.
Клетки нейрального происхождения — пигментоциты имеют короткие отростки, в цитоплазме содержится пигмент меланин в виде гранул или меланосом. Этих клеток много в родимых пятнах, в соединительной ткани людей черной и желтой расы.
Микроокружение создаваемое стромальными механоцитами. Специфичность стромальных механоцитов
Роль А-клеток в переработке антигена. Морфология А-клеток
Наименее правдоподобно, что роль А-клеток сводится к переработке фагоцитируемого ими антигена, созданию суперантигена. Этому противоречит, в частности, то обстоятельство, что блокада фагоцитарной активности макрофагов не угнетает функции А-клеток.
Во многих случаях А-клетки способствуют выживанию лимфоидных клеток в культурах, реализации между ними клеточных контактов и тем стимулируют их пролиферацию. Эта активность А-клсток приводит к поликлональной, а не избирательной стимуляции иммунокомпетентных клеток.
А-клетки, как предполагается, могут фокусировать на своей поверхности антигены, введенные в культуру, и таким образом облегчить их восприятие Т-клеткам, а также специфическую кооперацию последних с соответствующими В-клетками. Несмотря на отсутствие иммонокомпетенции у А-клеток (А-клетки от толерантных и иммунных доноров проявляют такую же активность, как от нормальных доноров), такого рода подготовка антигена может приводить уже не к поликлональнои стимуляции, а к активации именно тех клеток, которые компетентны к присутствующим в культурах антигенам.
Не исключено, что А-клетки, подготавливая антиген и участвуя в клеточных кооперациях, регулируют соотношение Т-хелперных и Т-супрессорных клеток в культурах или регулируют качество того сигнала, который антиген вызывает в иммунокомпетентных клетках, подобно тому, как это наблюдается при индукции в популяциях лимфоидных клеток синтеза ДНК при разных концентрациях конко-навалина A (McClain, Edelman, 1976).
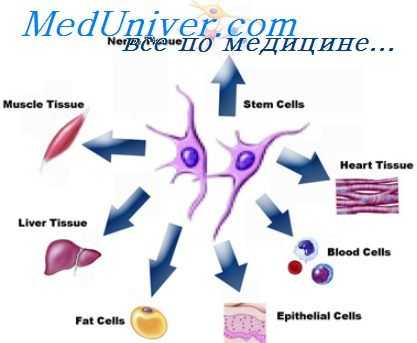
Генетический анализ взаимодействия А-клеток и лимфоцитов в ходе антигениндуцированной пролиферации сенсибилизированных лимфоцитов in vitro выявил необходимость совпадения макрофагов и Т-клеток по генам гистосовместимости. То же справедливо и для взаимодействия макрафгов с Т-клет ками in vivo (Biller e. a., 1976). Участие А-клеток необходимо для образования Т-хелнерных клеток при индукции антителообразования и на растворимые, и на корпускулярные антигены.
Однако в первом случае требуется совпадение макрофагов и Т-клеток по генам Н-2-комплекса (в особенности I-A-района, в котором находится и часть Ir-генов), тогда как во втором достаточно присутствия и аллогенных А-клеток. Следует предполагать, что взаимодействие А- и Т-клеток осуществляется с участием рецепторов, кодируемых генами гистосовместимости, создающими разнокачественность своего и чужого, и что продукты этих генов близки или во всяком случае эволюционно родственны продуктам V-генов, ответственных за иммунологическую разнока-чественность иммуноглобулинов и клеточных рецепторов.
Вопрос о морфологической принадлежности клеток, с которыми связана активность популяции А-клеток, до сих пор не решен. Эта популяция в высокой степени гетерогенна и по способности фиксировать антигены, и по морфологии и происхождению входящих в ее состав клеток.
Как уже указывалось, лишь незначительная часть клеток А-популяции является функционально активной при взаимодействии с неприлипающими клетками, число таких функционально активных клеток составляет от 1 до 10 на 10 000 прилипающих клеток, причем их распределение во фракциях клеток селезенки, разделенных в градиенте концентраций бычьего сывороточного альбумина, не соответствует распределению макрофагальных фагоцитирующих элементов. Наиболее существенным доводом в пользу макрофагальной природы А-клеток считается их инактивация антимакрофагальной сывороткой.
Однако такие сыворотки готовятся иммунизацией не чистыми макрофагами, а всеми прилипающими клетками, т. е. А-клетками. Поэтому инактивация этими сыворотками функции А-клеток не может считаться доказательством того, что А-клетки являются именно макрофагами. Все это лишает убедительности соображения о том, что функции А-клеток обеспечиваются просто клетками с высокой фагоцитарной активностью, т. е. макрофагами, хотя они действительно являются преобладающей формой в А-популяции. Следует, очевидно, искать среди А-клеток действительно активные, но уникальные субпопуляции.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Функции стромальных механоцитов. Роль стромальных механоцитов
Разобранные примеры показывают, что ответственными за микроокружение, действующее в лимфоидных органах и обеспечивающее протекание на их территориях дифференцировки иммунокомпетентных клеток, являются стромальные механоциты. Структура популяции стромальных механоцитов (т. е. клеток, ответственных за микроокружение) и лимфоидных клеток, обитающих в этом микроокружении, во многих отношениях различна. Во-первых, у них существенно разный жизненный цикл и темп обновления.
В состоянии равновесия стромальные механоциты находятся практически вне митотического цикла. Они если и обновляются, то крайне медленно, хотя большинство из них (а возможно, даже они все) способны к пролиферации. Наоборот, большинство лимфоидных клеток активно пролифернрует, так что зрелые неделящиеся клетки быстро обновляются за счет специальных клеток-предшественников. Во-вторых, в противоположность лимфоидным и кроветворным клеткам стромальные механоциты — это местные, нерепопулирующие клетки, закрепленные за каждым кроветворным органом.
Тем интереснее третье различие, касающееся стабильности дифферениировок. Для иммунокомпетентных клеток является правилом выраженная гетерогенность (одна клетка — одно по специфичности антитело, один класс иммуноглобулина, определенный по специфичности рецептор). Эти дифференцировочные особенности, отражающие активность генов, ответственных за иммунологическую компетентность, не только закреплены за клеткой, но, как правило, передаются вертикально, не изменяясь в пределах клона иммунокомпетентных клеток, происходящих от детерминированного предшественника.
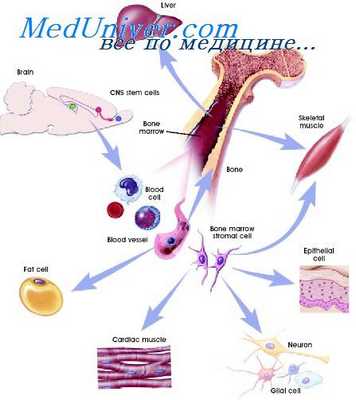
У механоцитов стромы дело может обстоять иначе. Хотя прямые данные на этот счет пока отсутствуют, два обстоятельства указывают на такую возможность. Механоциты одного кроветворного органа, например, селезенки, могут давать начало образованию стромальных механоцитов другого, например костного мозга,, создавая при этом вместо селезеночного костномозговое микроокружение. А если для оценки активности дифференцировочных генов, характерных для механоцитов, использовать тип синтезируемого ими коллагена, то окажется, что индивидуальный фибробласт может переходить с синтеза одного типа коллагена на синтез другого, что в одном фибробласте одновременно могут синтезироваться коллагены двух разных типов (Gay е. а., 1976), что клонированные культуры механоци-тов могут переходить с синтеза одного тина коллагена на синтез другого (Маупе е. а., 1976).
Создается в связи с этим впечатление, что постоянная перестройка клеточного состава органов иммунитета, которая лежит в основе адаптации организма к меняющемуся антигенному фону, обеспечивается процессами селекции на уровне быстро пролиферирую-щих и репопулирующих из одного органа в другой иммунокомпетентных предшественников и более редко происходящими и медленно протекающими перестройками стромы, идущими без обязательной смены клеток, т. е. путем переключения их функций.
Интенсивные миграции кроветворных и лимфоидных клеток, репопуляция их предшественников хорошо согласуются с закрепленностью стромальных механоцитов в пределах органа — иначе различия между разными кроветворными органами утрачивались бы. Предстоит еще объяснить, в чем состоят преимущества органной специализации внутри кроветворной и лимфоидной системы или, другими словами, причины очевидной территориальной несовместимости определенных, часто завершающих этапов дифференцировки лимфоидных клеток-предшественников.
Она проявляется в том, что для созревания одни предшественники мигрируют в специальные органы (например, в тимус или фабрициеву сумку), куда доступ предшественников других типов (например, В-клеток в тимус и Т-клеток в фабрициеву сумку) «запрещен». Эта органная расчлененность является поздним приобретением в эволюции позвоночных: у низших, несмотря на появление тимуса нет еще четкого деления на кроветворные и лимфоидные органы. Можно ожидать, что органная специализация микроокружения как-то связана с совершенствованием иммунологических функций, в основе которых лежит регуляция поэтапной экспрессии генов, обеспечивающих иммунологическую активность.
Функции А-клеток. Механизмы участия А-клеток в иммунитете
Кроме А-клеток селезенки, способность взаимодействовать с неприлипающими клетками при синтезе антител имеют клетки перитонеального экссудата, а также радиорезистентные клетки лимфоузлов, но не тимуса и костного мозга. Морфологический анализ показывает, что главным клеточным компонентом популяции А-клеток являются макрофаги (80—90%). Используя лимитирующие разведения, удалось убедиться, что популяция А-клеток неоднородна, активными в смысле кооперации с неприлипающими клетками являются лишь 10-3—10-4 клеток из всех А-клеток.
Пока не вполне ясно, нужен ли непосредственный контакт А-клеток с неприлипающими клетками или А-клетки выделяют активирующий фактор в среду. Есть данные, что отделение А-клеток миллнпорным фильтром снимает их активность (Unanue, 1972) и, наоборот, что среда из культур А-клеток обладает активностью (Moller е. а., 1976). Показано (Calderon е. а., 1975), что среда из культур макрофагов содержит вещество, чувствительное к пепсину и хемотриисину с молекулярным весом 15000—21000, которое стимулирует образование IgM- и IgG-антител в культурах, увеличивает синтез ДНК тимоцитами.
Морфологическим субстратом взаимодействия А-клеток с неприлипающими клетками служат, очевидно, клеточные скопления, обычно образующиеся в суспензионных культурах и состоящие из единичных макрофагов, окруженных лимфоидными и плазматическими клетками. Манипуляции, предотвращающие образование таких скоплений, приводят к резкому снижению иммунного ответа. Ультраструктурный анализ скоплений выявил тесные межклеточные контакты лимфоцитов друг с другом и с макрофагами, что может указывать на наличие специфических микроусловий, обеспечивающих взаимодействие Т- и В-лимфоцитов с А-клетками и антигеном (Unanue, 1972). Антигензависимое прилипание лимфоцитов к макрофагам удается воспроизвести in vitro.
Является ли А-зависимым антителообразование ко всем антигенам, остается не вполне ясным. Существуют данные, что на поверхности А-клеток создается упорядоченная структура повторяющихся антигенных детерминант, необходимая для вовлечения в иммунный ответ лимфоидных клеток, и что Т-независимые антигены с повторяющимися детерминантами (такие, как полимеризоваииый флагеллин из Salmonella adelaidae) не нуждаются в помощи А-клеток.
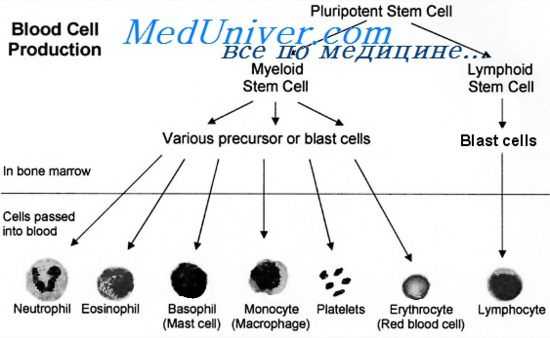
Впрочем, есть данные, что культуральная среда из-под А-клеток так же активно действует на антителообразование, как и сами А-клетки, и что ответ на Т-независимые антигены также требует участия А-клеток.
Индукция in vitro реакций замедленной повышенной чувствительности, за которую ответственны Т-лимфоциты, также нуждается в участии А-клеток. Такие звенья этой реакции, как антигензависимая пролиферация сенсибилизированных лимфоцитов (Unanue, 1972; Rosenthal, Shevach, 1973; Schilling e. a., 1976), а также бласттрансформация в смешанных культурах лимфоидных клеток и образование лимфоцитов с цитотоксическими свойствами, являются А-зависимыми. Неоднократно была продемонстрирована необходимость присутствия А-клеток для пролиферации лимфоцитов тимусного происхождения в ответ на специфические для Т-клеток митогены.
Основным звеном в кооперации А-клеток и неприлипающих клеток следует считать взаимодействие А-клеток с тимуспроизводными лимфоцитами. Вопрос о возможности замены прилипающих клеток в культурах in vitro различными веществами (например, липополисахарид из Escherichia coli или 2-меркаптоэтанол), по-видимому, решается отрицательно, хотя в таких культурах эффект от удаления А-клеток и понижается (Bevan е. а., 1974).
Несмотря на обширный экспериментальный материал, который уже накоплен, конкретные функции А-клеток в иммунологических реакциях in vitro остаются неясными. Дело осложняется тем, что в разных реакциях и при различных системах культивирования эти функции могут не совпадать. При антнтелообразовании на разные антигены, при реакциях замедленной повышенной чувствительности и при действии митогенов, а также при использовании разных клеточных популяций (в том числе при разной плотности клеток в культурах) регулирующая роль А-клеток может зависеть от разных причин.
Казалось бы, напрашивается предположение, что микроокружение, создаваемое стромальными механоцитами, существенно для прохождения только антигеннезависимых стадий развития клеток-предшественников, тогда как кооперации разных субпопуляций Т- и В-клеток между собой и с макрофагами обеспечивают прохождение антигензависимых этапов дифференцировки иммунокомпетентных клеток. Но это, видимо, не так.
Наряду с макрофагами стромальные механоциты играют, очевидно, существенную роль и в создании микроокружения для прохождения антигензависимых стадий дифференцировки. Вопрос о способности стромальных механоцитов распознавать антигены, о наличии у них соответствующих рецепторов собственного производства или присоединенных из окружающей среды остается открытым. Однако существуют веские указания на то, что стромальные механоциты оказывают выраженное влияние на антигензависимые стадии дифференцировки иммунокомпетентных клеток, в частности при антителообразовании.
Действительно, дифференцировка синтезирующих антитела плазматических клеток на стадии плазмобластов и на стадии зрелых плазматических клеток происходит внутри лимфоузлов на разных внутриорганных структурах (вторичных фолликулах и мякотных шнурах) и требует миграции клеток на новое микроокружение. Удалось также прямо показать, что костномозговые фибробласты оказывают резкое угнетающее, а тимические — резкое стимулирующее действие на образование антителопродуцирующих клеток в культурах селезеночных клеток в присутствии антигена.

Эти эффекты еще более усиливаются в культурах селезеночных клеток, лишенных собственных А-клеток. Поэтому более правдоподобным представляется, что микроокружение, создаваемое стромальными мехаиоцитами, существенно для прохождения как антигеннезависимой, так и антигензависимой стадий развития иммунокомпетентных клеток. Что же касается коопераций между самими иммунокомпетентными клетками и макрофагами, то она, очевидно, обеспечивает один из ключевых моментов в этом развитии —селекцию коммитированных предшественников, вступающих в пролиферацию и дифференцировку. По и в этом процессе стромальное микроокружение, очевидно, играет свою роль.
Органная специфичность стромальных механоцитов в смысле их функций микроокружения не вызывает в настоящее время сомнений. Более интересный и сложный вопрос заключается в том, насколько стромальные механоциты гетерогенны в пределах одного лимфоидного органа. В простейшей форме этот вопрос может быть поставлен так: существует ли столько же разных типов стромальных механоцитов, сколько имеется типов микроокружения в лимфоидных органах — специальных механоцитов, свойственных мозговому и корковому слою лимфоузлов и тимуса, тимусзависимым и тимуснезависимым зонам вторичных лимфоидных органов и т. д.?
Ответа на этот вопрос пока нет, так же как и сведений о том, каковы механизмы с помощью которых стромальные механоциты осуществляют свое воздействие на лимфоидные клетки.
Читайте также:
- Раннее выявление фенилкетонурии. Скрининг населения на фенилкетонурию.
- Лечение молекулярных рецидивов острого промиелоцитарного лейкоза (ОПЛ)
- Микроуровень нейроциркуляторной дистонии. Органно-тканевой уровень нейроциркуляторной дистонии
- Рентгенограмма, МРТ, ПЭТ костного мозга при метастазах
- Отравление веществами для наращивания мышечной массы - анаболиками
