Монотерапия эпилепсии. Политерапия эпилепсии. Побочные эффекты антиэпилептических препаратов.
Добавил пользователь Владимир З. Обновлено: 10.01.2026
Несмотря на значительные успехи, достигнутые в медикаментозном лечении эпилепсии, до сих пор остаются пациенты с эпилепсией, которым требуется назначение не одного, а двух (очень редко - трех) антиэпилептических препаратов. Конечно, «золотым стандартом» лечения пациента с эпилепсией является ведение его на одном антиэпилептическом препарате (АЭП), так называемая монотерапия. При впервые выявленной эпилепсии применение первой монотерапии антиэпилептическим препаратом позволяет достичь ремиссии примерно у 60% всех пациентов с эпилепсией. Если мы убедились в неэффективности первого антиэпилептического препарата, то стандартным решением является переход к альтернативной антиконвульсантной монотерапии. Альтернативная антиконвульсантная монотерапия заключается в применении противосудорожного препарата второй очереди выбора в максимально переносимой пациентом дозировке. К сожалению, если первая монотерапия не была эффективной, то возможность достижения ремиссии при применении альтернативной монотерапии имеется только у 10% пациентов. Переход на альтернативную монотерапию должен быть постепенным. Когда достигнуты средние терапевтические дозировки второго антиконвульсанта, можно начинать постепенное снижение дозировок первого антиконвульсанта. Всегда при переходе на альтернативную монотерапию есть некоторый период, когда реально существует политерапия (комбинация двух препаратов), и мы тестируем ее эффективность. Мы стремимся к тому, чтобы второй антиконвульсант полностью вытеснил первый. Но довольно распространенной является следующая терапевтическая ситуация: достижение терапевтического эффекта на комбинации двух препаратов. Решение в данной ситуации принимается индивидуально, возможен и переход на один препарат, и сохранение комбинации двух препаратов, если они хорошо переносятся.
Если не эффективны две последующие монотерапии, то применяется рациональная политерапия. Рациональная политерапия заключается в применении нескольких антиконвульсантов (чаще всего двух) с учетом их фармакодинамических взаимодействий. В политерапии применяются, как правило, препараты широкого спектра действия.
Таким образом, неврологу или психиатру довольно часто приходится задумываться о том, какой именно АЭП он назначит пациенту при отсутствии эффекта от первой монотерапии. Причем значительная часть пациентов с эпилепсией (25-30%) будут вынуждены достаточно длительно принимать одновременно два АЭП.
Считается, что в основу политерапии должны быть положены следующие рациональные принципы:
- преимуществами обладают комбинации антиконвульсантов с различными механизмами действия;
- доза первого из назначенных препаратов должна быть адаптирована с учетом возможных лекарственных взаимодействий при комбинации со вторым препаратом;
- взаимодействия ферментоиндуцирующих препаратов (карбамазепин, фенитоин, фенобарбитал) с точки зрения влияния на концентрацию в крови, в значительной степени непредсказуемы;
- следует избегать сочетания антиконвульсантов с выраженным седативным эффектом.
В последние несколько лет в нашей практике все чаще для альтернативной монотерапии или политерапии эпилепсии у детей применяется новый антиэпилептический препарат леветирацетам (торговое название - Кеппра. Производитель - ЮСБ С.А., Бельгия). Следует сразу сказать о довольно сложном вопросе возрастных ограничений в применении данного препарата. В международной практике леветирацетам разрешен к применению в качестве средства дополнительной терапии при лечении парциальных эпилептических припадков с вторичной генерализацией или без нее у взрослых и детей 4-х лет и старше; в качестве средства монотерапии препарат разрешен для применения в Европе с 16 лет. В России оба эти показания к применению пока находятся в процессе регистрации, и формально мы можем применять этот препарат только после 16 лет. Но, учитывая большой международный опыт применения, хорошую переносимость и высокую эффективность препарата, в Отделе психоневрологии и эпилептологии МНИИ педиатрии в течение нескольких лет препарат назначается детям с эпилепсией моложе 16 лет. Как правило, это пациенты, у которых первая монотерапия оказалась неэффективной или плохо переносимой. Обязательным условием назначения препарата является информирование родителей пациента о «временных» (связанных с особенностями регистрации препарата в России) возрастных ограничениях.
Мы не случайно отдаем предпочтение этому препарату перед другими «новыми» антиэпилептическими препаратами. Ниже приводятся причины, по которым уже в течение нескольких лет мы с энтузиазмом используем Кеппру в лечении эпилепсии у детей.
- Кеппра обладает широким спектром терапевтической активности и может применяться практически при всех фокальных или генерализованных (как идиопатических, так и симптоматических) эпилептических синдромах [1]. По широте спектра терапевтической активности уступает только вальпроату, так как не оказалась столь же эффективной при абсансах [2]. Доказана эффективность Кеппры в лечении миоклоний и генерализованных тонико-клонических приступов [2]. Поэтому препарат с успехом применяется за рубежом в качестве монотерапии для лечения юношеской миоклонической эпилепсии [3]. При фокальной эпилепсии Кеппра по эффективности сравнима с карбамазепином [4]. Кеппра достаточно активно используется в лечении энцефалопатии, таких как инфантильные спазмы, синдром Леннокса-Гасто, электрический эпилептический статус в фазу медленного сна и др. 5. Доказана эффективность применения Кеппры в лечении прогрессирующих миоклонус-эпилепсий, в частности, при болезни Унферрихта-Лундборга [1]. С другой стороны, Кеппра может быть успешно применена не только при тяжелых эпилептических синдромах, но и при доброкачественной фокальной эпилепсии с центро-темпоральными спайками в качестве первой монотерапии и в политерапии при резистентном ее течении [8].
Кеппра эффективна в лечении эпилепсии, резистентной по отношению к другим АЭП. Существуют многочисленные открытые и двойные слепые исследования, доказывающие эффективность препарата в лечении резистентной фокальной эпилепсии у детей 10. Сошлемся лишь на одно из них, проведенное Franzoni Е. et al. в 2006 году [13]. В этом исследовании, приближенном к клинической практике, у пациентов, получавших Кеппру в суточной дозе от 8,3 до 56,6 мг на кг веса, уровень ремиссий по эпилептическим приступам составил 24,4%. У 11% отмечалось уменьшение частоты приступов на 50 % и больше. Некоторые пациенты были переведены на монотерапию Кеппрой после достижения ремиссии. Естественно, что в двойных слепых исследованиях уровень ремиссий ниже, чем в тех, которые максимально приближены к клинической практике. Так, исследование Glauser Т. et al. (2006) продемонстрировало, что уровень ремиссий при резистентной парциальной эпилепсии у детей при добавлении в терапию Кеппры, составил 7% (1% при добавлении плацебо). У 40,6% пациентов число приступов сократилось на 50 и более процентов при добавлении Кеппры (при добавлении плацебо - соответственно у 19,6%) [12].
Кеппра может быть эффективна там, где не работают другие АЭП за счет присущего ей уникального механизма действия. Уникальный механизм действия Кеппры заключается в том, что она связывается с гликопротеином SV2A синаптических везикул (этот белок необходим для нормальной нейротрансмиссии), регулируя выброс нейротрансмиттеров и снижая эпилептическую активность нейрона [1]. Кроме того, у Кеппры доказаны и другие дополнительные механизмы действия. К ним относятся усиление ГАМК- и глицинергического торможения и стабилизация мембраны нейронов, блокирование эпилептических разрядов, вызванных активацией NMDA-рецепоров, торможение высоковольтных Са 2+ и К + каналов (подавление пароксизмальных поляризационных сдвигов), блокирование эпилептической генной экспрессии в нейронах (антиэпилептогенный эффект на генном уровне) и ограничение эксайтотоксического действия активации NMDA-рецепторов (нейропротективный эффект).
Еще одна причина эффективности Кеппры в преодолении резистентности эпилепсии может заключаться в базисных механизмах формирования резистентности. В настоящее время одной из популярных гипотез формирования резистентности эпилепсии является гипотеза нарушения функционирования транспортных систем, обеспечивающих перенос и всасывание препаратов в стенке кишечника и перенос их через гематоэнцефалический барьер (так называемая «множественная лекарственная резистентность»). Белки-переносчики аффинны к многим антиэпилептическим препаратам, они «связывают» эти препараты и не пропускают их дальше. В экспериментальных исследованиях показано, что Р-гликопротеин и другие белки-переносчики имеют аффинность к фенитоину, фенобарбиталу, карбамазепину, вальпроату, окскарбазепину, ламотриджину, топирамату. Кеппра оказалась первым антиэпилептическим препаратом, который не являлся субстратом для белков-переносчиков [14].
Может быть, именно в силу всего вышеперечисленного выдающийся английский эпилептолог С.Р. Раnayiotopoulos считает Кеппру препаратом первой очереди выбора в лечении резистентных фокальных эпилепсии [1]. - Кеппра хорошо комбинируется с другими АЭП. Большой проблемой рациональной политерапии являются фармакокинетические взаимодействия препаратов. Хорошо известно, что некоторые АЭП (карбамазепин, фенобарбитал, фенитоин) являются довольно мощными индукторами ферментов печени. Если мы к таким ферментоиндуцирующим АЭП добавим другой препарат, то при хроническом совместном применении концентрация второго препарата будет снижаться, причем иногда довольно значительно. Классическими примерами такого взаимодействия является совместное применение карбамазепина и топирамата (первый может вызывать снижение концентрации второго примерно в два раза). То же самое относится и к комбинации карбамазепина и вальпроата (концентрация вальпроата может значительно уменьшаться). Иногда возникает и обратная ситуация, например, при совместном применении вальпроата и ламотриджина. Вальпроат ингибирует метаболизм ламотриджина и повышает его концентрацию в крови, именно поэтому у детей до 12 лет показано применение половинных суточных дозировок ламотриджина в данной комбинации. Колебания концентрации АЭП в сыворотке крови как в сторону повышения концентрации, так и в сторону ее снижения опасны для пациента с эпилепсией. Снижение концентрации может обусловливать низкий эффект антиэпилептической терапии, повышение - приводить к развитию побочных эффектов.
В отличие от некоторых других АЭП Кеппра не влияет на концентрацию других препаратов. И добавление к Кеппре других АЭП не вызывает клинически значимых колебаний концентрации препарата в крови [15]. Данная положительная фармакокинетическая характеристика связана с тем, что метаболизм Кеппры не зависит от печеночного цитохрома Р450. Таким образом, с Кеппрой возможно комбинировать любые антиэпилептические препараты. Эти же особенности метаболизма Кеппры приводят к тому, что она не влияет на концентрацию дигоксина и варфарина и не снижает активность антибиотиков при совместном применении у пациента [15]. - Кеппра оказывает быстрый, а иногда и очень быстрый терапевтический эффект. Это антиэпилептический препарат с быстрым темпом введения. Известно, что стартовая доза Кеппры по 500 мг два раза в сутки эффективна уже в первый день приема у большинства взрослых пациентов [16]. Рекомендуемый режим дозирования и титрования дозы Кеппры у детей несколько отличается от такового у взрослых. Так, если ребенок весит от 20 до 40 кг, то одномоментно назначается Кеппра по 250 мг 2 раза в сутки, затем в течение 3-4-й недели - по 500 мг 2 раза в сутки и если необходимо - далее по 750 мг 2 раза в сутки. Уже на первой терапевтической дозе 500 мг мы часто видим клинический эффект в виде уменьшения частоты приступов, то есть стартовая доза препарата может оказаться терапевтической. У детей весом от 40 до 60 кг Кеппра назначается сразу по 500 мг 2 раза в сутки, затем две недели по 1000 мг 2 раза в сутки. Конечно, точная доза определяется конкретной клинической ситуацией и колеблется от 20 до 60 мг на кг веса в сутки. На основании нашего клинического опыта мы можем подтвердить распространенную точку зрения, что Кеппра часто начинает действовать с первого дня лечения. Наверное, излишне доказывать, какие преимущества предоставляет и пациенту и врачу такой быстрый терапевтический эффект.
- Кеппра - один из наиболее хорошо переносимых антиэпилептических препаратов. Как правило, частота побочных эффектов при применении Кеппры незначительно превышает таковую при применении плацебо [16]. За достаточно длительный период применения в лечении эпилепсии не описаны жизнеугрожающие побочные эффекты. При применении Кеппры могут отмечаться такие побочные эффекты, как сонливость, астения, тошнота, головная боль (они носят дозозависимый и обратимый характер). Zaccara G. et al. в 2006 г. провели оценку результатов двойных слепых исследований, которая позволила сравнить переносимость новых антиэпилептических препаратов (были обобщены данные 31 исследования). Сравнивалась частота 4-х побочных эффектов: сонливости, тремора, негативного влияния на познавательные функции и вестибулоцеребеллярных нарушений при применении у пациентов с эпилепсией леветирацетама (Кеппры), окскарбазепина и топирамата. Реже всего (с частотой чуть более 5%) эти побочные эффекты отмечались при приеме Кеппры. Только достаточно высокие суточные дозы Кеппры (2000 мг и более) более часто сопровождались развитием побочных эффектов со стороны центральной нервной системы [18].
Необходимо также отметить чрезвычайно важное свойство леветирацетама длительно сохранять свою эффективность. По данным ряда авторов, показатель удержания на Кеппре спустя более чем 12 месяцев терапии резистентных форм эпилепсии составил 49%, что сопоставимо и даже выше, чем у других современных АЭП [10,21].
Чрезвычайно привлекательными и значимыми для практического врача являются два аспекта хорошей переносимости Кеппры: она не нарушает функции печени и не оказывает негативного влияния на когнитивные функции пациентов с эпилепсией (в частности, на память и внимание). Так, исследование Mari F. et аl. (2006) по применению Кеппры у пациентов с эпилепсией и заболеваниями печени (гепатит С и острый токсический гепатит) показало как высокую эффективность препарата в отношении эпилептических приступов, так и улучшение состояния функции печени у пациентов. Больные переводились на монотерапию Кеппрой с других АЭП, суточная доза Кеппры колебалась от 1000 до 3000 мг.
Данная статья больше посвящена применению Кеппры в комбинированной терапии резистентной эпилепсии. Конечно, Кеппра представляется очень перспективным АЭП, который может широко использоваться и в монотерапии эпилепсии. Поэтому мы с нетерпением ждем регистрации данного показания в России и снятия возрастных ограничений по применению этого препарата.
Монотерапия эпилепсии. Политерапия эпилепсии. Побочные эффекты антиэпилептических препаратов.
Привыкание при эпилепсии. Рефрактерность эпилепсии к терапии. Лечение эпилептического статуса.
Вопрос о прекращении антиэпилептического лечения решается индивидуально. Основным критерием является клиника — полное отсутствие припадков, ЭЭГ имеет только вспомогательное значение. Однако добиваться прекращения всех видов эпилептических припадков «любой ценой» вряд ли правильно, учитывая неблагоприятное действие высоких доз АЭП на организм, в особенности при полипрагмазии. Поэтому, если сохраняются редкие ночные судорожные приступы или внешне малозаметные бессудорожные приступы бодрствования, можно ограничиться поддерживающей антиэпилептической терапией. В ряде случаев даже при прекращении припадков эпилептическая дизритмия может оставаться на всю жизнь.
В большинстве случаев причины рефрактерности припадков к антиэпилептической терапии следующие: неправильный диагноз (у больного припадки не эпилептические, а иного характера), неэффективность АЭП вследствие неправильного подбора препарата или неадекватности дозы (недостаточная или чрезмерная), отсутствие терапевтической концентрации АЭП в крови несмотря на прием адекватной дозы, нарушения предписаний врача (депривация сна, алкоголизация, пропуск приема препарата), непереносимость АЭП.
Эпилептический статус — жизнеугрожающее состояние, требующее ургентной терапии. Следует различать судорожные формы эпилептического статуса фокальных и генерализованных припадков и бессудорожные — статус абсансов и сложных парциальных эпилептических припадков. Именно судорожные формы представляют непосредственную угрозу для жизни больного. Эпилептический статус может быть проявлением не только эпилепсии как таковой, но и острых церебральных поражений, например ОНМК, менингита, энцефалита и др. Поэтому параллельно с неотложной терапией эпилептического статуса проводится экстренное обследование больных. Основные терапевтические мероприятия направлены на устранение судорожных припадков и их последствий — расстройств дыхания, гемодинамики и гемостаза.
На догоспитальном этапе требуется немедленная ревизия полости рта с целью профилактики или устранения уже имеющихся дыхательных расстройств — удаление инородных предметов (протезов и др.). рвотных масс, устранение западения языка и введение воздуховода.

Для устранения судорожного синдрома больному внутривенно медленно вводится диазепам (седуксен, сибазон, реланиум) в дозе 0,25 мг/кг массы, максимальная доза одноразового введения 20 мг. Медленное введение необходимо для профилактики остановки дыхания (дети, пожилые люди). Недостатком препарата является кратковременность его действия, так как период полужизни равен всего лишь 15 мин. У детей наиболее безопасным и не менее действенным является ректальное введение диазепама. За рубежом, где имеются растворимые формы фенитоина, лечение дополняется одновременным его введением в дозе 15—20 мг/кг массы также внутривенно ка-пельно в течение 30 мин под контролем ЭКГ (замедление пульса, изменение ритма сердца). В случае появления аритмии или даже удлинения интервала P—Q на ЭКГ, введение фенитоина следует немедленно прекратить. Фе-нитоин действует медленно, но зато длительно. Большим преимуществом этого препарата является то, что он не оказывает угнетающего влияния на сознание, что делает его применение в качестве монотерапии эпилептического статуса абсолютно выигрышным у больных в коматозном состоянии, при симптоматическом эпилептическом статусе, в частности при тяжелой ЧМТ, где контроль уровня сознания является крайне важным.
Поскольку на российском рынке растворимая форма фенитонина отсутствует, в некупирующихся случаях, как показывает наш опыт, можно применять отечественный препарат дифенин через назогастральныи зонд в желудок до 10 таблеток! Однако при этом крайне желательно мо-ниторирование его уровня в сыворотке крови.
В последнее время за рубежом для лечения эпилептического статуса на первое место выходит другое производное бензодиазепина — лоразепам, имеющий в 10-15 раз большую длительность действия по сравнению с диазепамом. Вводится внутривенно капельно в дозе 0,1 мг/кг массы со скоростью 2 мг/мин.
Барбитураты, в частности фенобарбитал, имеют преимущество в двух случаях: при эпилептическом статусе неонатальных припадков и там, где эпилептический статус вызван острой отменой ранее получаемого больным фенобарбитала. Доза 20 мг/кг в минуту и более, максимальная скорость введения 100 мг/мин. Фенобарбитал может быть применен и в других случаях эпилептического статуса при отсутствии эффекта от препаратов первой очереди выбора.
Основные стратегические положения терапии эпилепсии — своевременное начало, комплексность, непрерывность, длительность, преемственность. Тактика лечения — максимальная его индивидуализация.
Эпилепсия — всегда драматическое событие для самого больного и его семьи. Психологи считают, что наиболее тяжело переносится отсутствие прогноза. Больной эпилепсией постоянно находится в ожидании припадка. Это порождает тревогу, беспокойство, депрессию, страх. К этому прибавляются определенные ограничения в укладе жизни (нельзя водить машину, принимать алкоголь, нарушать режим сна — бодрствования), часто создается необходимость перемены работы или угроза полной ее потери и т. д. Вследствие названных причин у больных эпилепсией снижается качество жизни.
Основная стратегическая цель и критерий эффективности лечения эпилепсии — улучшение качества жизни больного.
Успех лечения эпилепсии возможен только при заинтересованном партнерстве врач — больной и врач — семья больного. Необходимо максимально успокоить больного и его близких, убедить их в том, что при правильном систематическом длительном лечении в сочетании с соблюдением соответствующего режима (об ограничениях в образе жизни было сказано выше) имеются реальные шансы на успех. Категорически запрещается резкая отмена и даже пропуск приема антиэпилептических препаратов (АЭП). Отмена или замена их производится только врачом, причем постепенно и, как правило, отмена не менее чем через три года от последнего припадка с учетом данных ЭЭГ.
Следует иметь в виду неблагоприятное влияние многолетнего применения антиэпилептических препаратов на организм, в частности на память, внимание, темп мышления и т.д., поэтому спешить с назначением АЭП не следует. Так, при реактивных припадках следует рекомендовать категорически избегать провоцирующих факторов либо максимально нивелировать их. Например: немедленно ввести антипиретики детям, склонным к фебрильным судорогам при малейшем повышении температуры; исключить недосыпание и тем более работу в ночную смену при приступах, провоцируемых недостаточностью сна, и т. д. При некоторых непровоцируемых приступах также иногда целесообразно не спешить с назначением АЭП, например при редких эпилептических припадках сна, при доброкачественной форме юношеской миоклонической эпилепсии, в случаях редких бессудорожных припадков.
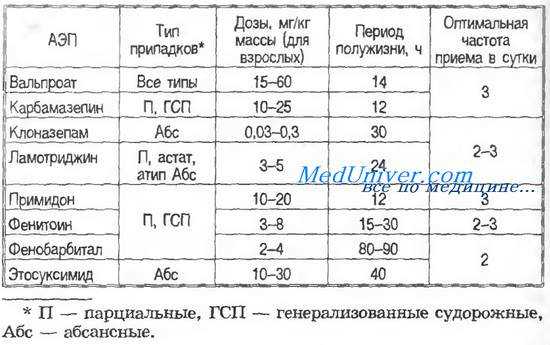
Терапевтические дозы и фармакологические характеристики основных антиэпилептических препаратов - АЭП
При выборе АЭП на первый план выступают форма эпилепсии и тип эпилептического припадка. АЭП имеют различные механизмы воздействия, которые в конечном счете:
1) способствуют поляризации клеточных мембран эпилептических нейронов (блокирование втока Na+ в клетку или выхода из нее К+);
2) нормализуют трансмиттерный баланс в глутаматергической и ГАМКергической системах.
При симптоматической или криптогенной эпилепсии со сложными и простыми парциальными припадками равноэффективны фенобарбитал, фенитоин (дифенин), карбамазепин (финлепсин, тегретол, тимонил), вальпро-ат (депакин, конвулекс, ацедипрол), ламотриджин (ла-миткал). Однако фенобарбитал обладает выраженным угнетающим действием (у детей часто, наоборот, вызывает гиперактивное состояние). Фенитоин имеет узкую терапевтическую широту и нелинейную фармакинетику, токсичен. Ламотриджин дорог. Поэтому фактически средствами первой очереди выбора являются вальпроаты и карбамазепин.
То же можно сказать о вторично генерализованных припадках, однако при наличии в ЭЭГ помимо очаговых эпилептических проявлений также генерализованных синхронных симметричных пик-волновых разрядов средством первой очереди выбора может стать вальпроат. Последний безусловно является абсолютно предпочтительным при идиопатической эпилепсии с первично генерализованными припадками, как судорожными, так и аб-сансами. При абсансах средством второй очереди выбора являются сукцинимиды — этосуксимид (суксилеп, пик-нолепсин, заронтин). Возможна их комбинация с валь-проатами. При судорожных припадках, развивающихся на фоне интоксикации, в частности эклампсии, а также при нефрите у детей прежде всего показано применение солей магния — обычно сульфата магния внутривенно. При всех видах припадков может быть показан в качестве дополнительного средства, особенно у детей, диа-карб, который помимо своих дегидратационных свойств обладает также истинной противоэпилептической активностью. Среди производных бензодназепина имеется ряд препаратов, в той или иной мере обладающих противо-эпилептическим эффектом. Это диазепам (седуксен, сибазон, реланиум), который применим главным образом при эпилептическом статусе; клоназепам, подавляющий ми-оклонические и некоторые другие эпилептические приступы; нитразепам, назначаемый при некоторых видах детской эпилепсии (детский спазм, синдром Леннокса — Гасто). Вигабатрин и габапентин не метаболизируются в печени, в связи с чем могут назначаться при ее заболеваниях; практически не взаимодействуют с другими АЭП. Получен обнадеживающий результат применения вигабатрина при наиболее трудной форме эпилепсии — синдроме Леннокса — Гасто. Имеются также АЭП с медленным контролируемым освобождением, которые при одно-, двукратном приеме способны обеспечить более стабильную концентрацию их в крови, а следовательно, обладают лучшим эффектом и меньшей токсичностью. К ним относится тегретол CR, финлепсинретард и депакин-хроно.
В последнее время на лекарственном рынке появился ряд новых АЭП — окскарбазепин (по сравнению с карба-мазепином обладает более стабильной концентрацией действующего вещества в крови и меньшей токсичностью), ламотриджин (ламиктал), упомянутые выше вигабатрин, габапентин, а также клобазам и др. Эти препараты могут быть эффективными главным образом при простых, сложных и вторично генерализованных припадках. Ламотриджин, по имеющимся данным, эффективно действует при наиболее трудно купируемых приступах у детей — атипичных (сложных) абсансах, атонических припадках и, как показано в последнее время, при первично генерализованных судорожных приступах.
Тактика лечения эпилепсии — максимальная индивидуализация в зависимости от ряда факторов: типа припадков и формы эпилепсии, возраста больных (у детей дозы АЭП на килограмм массы тела больше, у пожилых — меньше); приуроченности припадков к циклу сон — бодрствование (при припадках сна большая часть суточной дозы АЭП дается на ночь; часто больные получают корректоры сна, например феназепам, аллопу-ринол и др.); физического состояния больного и др. Большую проблему представляют больные с сопутствующими заболеваниями печени, поскольку АЭП обладают гепатотоксичностью. В настоящее время эта проблема упрощается в связи с появлением АЭП, не метаболизирующихся в печени (вигабатрин, габапентин). В таблице приведены дозы и характеристики основных АЭП.
Препараты с большим периодом полужизни (фенобарбитал, этосуксимид, клоназепам) при необходимости назначают 1 раз в сутки, однако резкое возрастание пика концентрации после однократного приема суточной дозы увеличивает амплитуду колебаний концентрации в крови, риск и степень проявления интоксикации.
В настоящее время повсеместно признана тактика лечения эпилепсии одним препаратом — монотерапия. В случае неудачи препарат заменяется на лекарство следующей очереди выбора. Если это не помогает, может быть применена политерапия. Однако, к сожалению, во многих случаях при неудаче монотерапии оказывается неэффективной и политерапия. Есть формы эпилепсии, при которых показана стартовая политерапия. Так, при младенческом спазме — АКТГ или его аналоги (синактен) либо глюкокортикоиды плюс базовые АЭП (вальпроат прежде всего), при синдроме Леннокса — Гасто — базовые АЭП плюс ламотриджин и др.
Следует иметь в виду, что некоторые антиэпилептические препараты, подавляя припадки одного типа, могут увеличивать и даже вызывать припадки другого типа. Вследствие этого возникают определенные противопоказания для их назначения. У карбамазепина и фенитона это абсансы и миоклонии, у ламотриджина — миоклонии, у фенобарбитала — абсансы. Пожалуй, единственным препаратом, который может быть применен при любых видах припадков, т.е. не имеющим противопоказаний по типу припадков, является вальпроат. Наиболее эффективна его пролонгированная форма — депакин-хроно.

Побочные эффекты при применении антиэпилептических препаратов — частое явление. Правда, мониторирование антиэпилептических препаратов в крови позволяет во многих случаях избежать их или свести к минимуму. При постепенном наращивании доз они также выражены меньше. Большинство побочных симптомов являются до-зозависимыми. Наиболее характерны для применения барбитуратов и бензодиазепинов признаки седации — вялость, сонливость, снижение трудоспособности и др.; для карбамазепина — головокружение, головная боль, атаксия, нистагм; для валыгроата, этосуксимида, нередко примидона — желудочно-кишечные расстройства (тошнота, боли в эпигастрии, диарея, запор), а для вальпро-ата еще и увеличение массы тела, тремор, выпадение волос; для фенитоина — головокружение, неустойчивость походки, атаксия, нистагм, гиперплазия десен.
Другой ряд нежелательных явлений при применении антиэпилептических препаратов не имеет дозозависимого фактора, а бывает следствием гиперчувствительности к соответствующим препаратам, что может иметь место как при первых приемах лекарств, так и на том или ином этапе хронического применения. Данные симптомы с полным основанием следует отнести к осложнениям лечения, поэтому требуется отмена соответствующего препарата. Так, гепатотоксич-ность АЭП, максимально выраженная у валыгроата, может вызвать токсический гепатит, что помимо желтухи проявляется также сыпью, лихорадкой, лимфоаденопатией, эозинофилией.
Другое осложнение терапии антиэпилептическими препаратами — гематологические нарушения, а именно апластическая и мегалопластическая анемия (чаще при приеме фенитоина и карбамазепина). К осложнениям со стороны нервной системы, вызываемым фенитоином, прежде всего следует отнести мозжечковые расстройства. Достаточно редко могут возникать иммунные нарушения. Во всех этих случаях соответствующий препарат следует отменять.
Тактика ведения и дополнительные возможности терапии больных эпилепсией
Рецензенты:
профессор, д.м.н. И.Д. Стулин (Заведующий кафедрой неврологии лечебного факультета МГМСУ)
профессор, д.м.н. М.А. Лобов (Руководитель отдела детской неврологии МОНИКИ им. М.Ф. Владимирского)
Пособие предназначено для практических врачей - неврологов, эпилептологов
Пособие выполнено по договору № 011/122/050 с Министерством Здравоохранения и социального развития РФ
Данное пособие содержит описание современных представлений о классификации эпилепсии, тактике врача при подборе противоэпилептических препаратов, механизмах действия антиконвульсантов, возможностях комбинированной терапии, а также роли немедикаментозных методов в комплексной терапии эпилепсий.
ВВЕДЕНИЕ
ЭПИЛЕПСИИ - хронические заболевания головного мозга, характеризующиеся повторными непровоцируемыми приступами нарушений двигательных, чувствительных, вегетативных, мыслительных и психических функций, возникающих вследствие чрезмерных нейронных разрядов.
Бурное развитие нейрофармакологии, синтез новых высокоэффективных антиконвульсантов, кардинальный пересмотр многих принципов лечения эпилепсий, позволило отнести их в настоящее время к курабельным заболеваниям [А.С. Петрухин, 1998]. Между тем сохраняются значительные трудности при лечении эпилепсий, а эффективность терапии не превышает 70-75% во всем мире. В связи с этим все большее значение на современном этапе при лечении придается комплексной терапии с использованием новых медикаментозных средств, а также нетрадиционным методам воздействия. Современный подход к проблеме эпилепсии предусматривает решение широкого круга вопросов, основным из которых является достижение максимального терапевтического эффекта. Вместе с тем, эффективное лечение не должно являться конечным этапом оказания помощи больным эпилепсией. В первую очередь рассматриваются вопросы социальной адаптации, тактики ведения и вопросы качества жизни больных эпилепсией.
Как указывает Комитет экспертов ВОЗ (1995), более 75% из 40 миллионов больных эпилепсией не получают адекватного лечения [M.S. Yerby, 2000].
Согласно классификации (Приложение 1), все эпилептические припадки подразделяются по характеру на парциальные (фокальные или локально обусловленные) и генерализованные. При парциальных эпилептических припадках начальные клинические и электроэнцефалографические проявления свидетельствуют о вовлечении в эпилептический процесс одной области одного полушария головного мозга. Среди парциальных эпилептических припадков выделяют простые, протекающие при сохранном сознании, и сложные парциальные припадки, характеризующиеся нарушением сознания. Генерализованные эпилептические припадки, при которых начальные клинические и ЭЭГ-характеристики свидетельствуют о вовлечении в эпилептический процесс обоих полушарий мозга.
В свою очередь, эпилепсии подразделяются на идиопатические, симптоматические и криптогенные (Приложение 1).
Современный уровень знаний об этиологии и патогенезе заболевания, а также классификация эпилепсий и эпилептических синдромов способствует стандартизации терминологии, унификации диагноза эпилепсий, определяет тактику ведения пациентов и предполагаемый прогноз, с учетом нозологической формы.
В данном пособии представлены некоторые аспекты тактики ведения больных и дополнительные возможности медикаментозной и немедикаментозной терапии эпилепсий, в том числе описана методика комплексной патогенетической терапии эпилепсии с использованием сочетания антиконвульсантов (депакина и карбамазепина) и антиоксиданта (мексидола).
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДА
ПОКАЗАНИЯ.
В настоящее время считается целесообразным начинать терапию противоэпилептическими препаратами при наличии в анамнезе двух и более неспровоцированных эпилептических припадков.
Показаниями для назначения депакина являются все формы эпилепсий.
Показаниями для применения мексидола являются когнитивные расстройства различного генеза, вегетативно-сосудистые расстройства, острая интоксикация антипсихотическими средствами и др.
ПРОТИВОПОКАЗАНИЯ.
Противопоказания к назначению антиконвульсантов разнятся в зависимости от выбранного препарата.
Противопоказаниями к применению депакина являются: гиперчувствительность, нарушение функции печени и/или почек, гепатит в т. ч. в семейном анамнезе, геморрагический диатез, беременность (I триместр), кормление грудью.
Противопоказания к использованию мексидола: гиперчувствительность, острые нарушения функции печени и почек, беременность, кормление грудью.
МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
В лечении эпилепсий применяются, главным образом, противоэпилептические средства, терапия которыми проводится непрерывно в течение нескольких лет, а иногда и всей жизни больного [В.А. Карлов,1996].
Механизм действия противосудорожных средств, предотвращающих распространение возбуждения нейронов, не до конца установлен. Противосудорожные средства делятся на препараты со стабилизирующим эффектом на возбудимые мембраны клеток и препараты, изменяющие функциональную активность нейронов, что сопровождается ингибирующим воздействием на распространение судорожной активности путем блокады синаптической передачи.
Из нейромедиаторов, изменяющихся под влиянием противосудорожных средств, основным является нейромедиатор ингибиторного типа - гамма-аминомасляная кислота (ГАМК). Бензодиазепины и барбитураты повышают функцию ГАМК путем взаимодействия с ГАМК-рецепторами на уровне ГАМК-бензодиазепинового комплекса с рецептором. Вальпроаты повышают содержание ГАМК, путем увеличения синтеза ГАМК и/или ее высвобождения.
При тщательном подборе дозы возможно эффективное лечение эпилепсии с использованием одного антиконвульсанта. Второй препарат назначают только в том случае, если эффективность первого недостаточна, несмотря на необходимую концентрацию его в крови, либо, если первый из выбранных препаратов вызывает непереносимые побочные эффекты. Терапевтическая широта действия у всех противосудорожных препаратов небольшая, поэтому важен тщательный индивидуальный подбор дозы для обеспечения максимальной терапевтической эффективности при минимальных побочных реакциях. С целью подбора индивидуальных терапевтических доз по возможности следует определять концентрацию препарата в плазме или сыворотке крови.
В связи с удобством применения предпочтение отдается препаратам, которые принимаются 1-2 раза в сутки. Однако это не всегда возможно, так как побочные эффекты проявляются при максимальной концентрации препарата в крови, которая создается после однократного приема большой дозы. К дозозависимым побочным эффектам противосудорожных средств относятся: общее седативное действие, нистагм, атаксия, а также психические изменения, такие как флюктуация сознания, потеря памяти и депрессия. Кроме того, противосудорожные средства могут вызывать некоторые изменения настроения и поведения. В этой связи большинство противосудорожных средств предпочтительно принимать 2 раза в день.
Фармакотерапию следует начинать с препарата первой очереди выбора, которая зависит от формы эпилепсии и типа припадка (таблица 1).
Таблица 1. Препараты выбора в зависимости от типа припадка
| Тип припадка | Препараты 1 ряда | Препараты 2 ряда |
| Парциальные: | ||
| Простые | Карбамазепин | Ламотриджин |
| Сложные | Вальпроат, Фенитоин | Клобазам |
| Вторично- генерализованные | Вальпроаты Топирамат | Ацетазоламид Фенобарбитал |
| Генерализованные: | ||
| Тонико-клонические | Вальпроаты | Ламотриджин |
| Тонические | Карбамазепин | |
| Клонические | Топирамат Фенитоин | Клобазам Фенобарбитал |
| Типичные абсансы | ||
| Атипичные абсансы | Вальпроаты | Ацетазоламид |
| Атонические | Этосуксимид | Клоназепам Клобазам |
| Тонические | Фенобарбитал | |
| Миоклонические | Вальпроат | Фенобарбитал Ацетазоламид Клоназепам |
При генерализованных эпилепсиях препаратом выбора являются препараты вальпроевой кислоты (депакин, конвулекс, конвульсофин) (таблица 2). При парциальных эпилепсиях препаратами выбора являются карбамазепины и вальпроаты (таблица 3).
Таблица 2. Торговые названия, международные наименования и номера государственной регистрации препаратов
Таблица 3. Препараты выбора при парциальной эпилепсии
| Действующее вещество | Препарат | Суточная доза для взрослых | Показания | Побочные эффекты |
| Карбамазепин | Тегретол Финлепсин Тимонил Стазепин | 400-1200 мг за 1-3 приема | Очаговые и генерализованные приступы. Не эффективны при абсансах | Сонливость, тошнота, диплопия, пошатывание |
| Фенитоин | Дифенин Дилантин Гидантоин Фенидан | 150-300 мг за 1-2 приема | Очаговые и генерализованные приступы. Не эффективны при абсансах | Сонливость, нарушение координации и речи. Набухание десен, оволосение, угревая сыпь |
| Производные вальпроевой кислоты | Депакин Конвулекс Орфирил Эргенил | 600-1800 мг за 1-3 приема | Очаговые и генерализованные приступы, а также абсансы | Редко сонливость, тремор, прожорливость Выпадение волос, запоры |
| Ламотриджин | Ламиктал | 200-400 мг за 2 приема | Очаговые и вторично-генерализованные приступы | Головокружение, сыпь |
| Топирамат | Топамакс | 200-400 мг за 2 приёма | Очаговые и генерализованные приступы | Снижение веса, редко нефролитиаз |
При неэффективности терапии препаратами первого выбора, назначенными в эффективных дозах, к терапии следует присоединять препараты следующей очереди выбора.
Препараты последнего поколения
Наиболее широко применяемыми из новых антиконвульсантов в России являются ламотриджин (ламиктал, ламитор), топирамат (топамакс), габапентин (нейронтин) и леветирацетам (кеппра) (таблица 2).
Еще одним из перспективных направлений в комплексном лечении эпилепсии является применение блокаторов кальциевых каналов, однако, данная проблема требует дальнейшего изучения.
Тактика применения препаратов при парциальной эпилепсии
1. Назначение адекватной для данных типов припадков и синдромов парциальной эпилепсии терапии одним (монотерапия) из препаратов 1-го ряда; лечение начинают с небольшой дозы(1/8 - 1/4) и постепенно увеличивают ее до прекращения припадков или появления признаков передозировки.
2. При недостаточном эффекте уточняют форму эпилепсии и тип приступа, проверяют регулярность приема препарата, рассчитывают достижение максимально переносимой дозы с учетом массы тела.
3. Как правило, у 70% больных правильно подобранная монотерапия, обеспечивает адекватный контроль припадков.
4. При применении большинства традиционных препаратов желательно оценивать их концентрацию в крови, а при применении фенитоина - обязательно.
5. Препараты выбора при парциальных припадках (без вторичной генерализации или вторично-генерализованных) - вальпроевая кислота и ее производные, карбамазепин, топирамат.
6. В целом при парциальных припадках ряд препаратов (вальпроевая кислота и ее производные, карбамазепин, фенитоин, фенобарбитал) обладают достаточной эффективностью, однако фенобарбитал и фенитоин не являются препаратами выбора вследствие побочных явлений.
8. Из перечисленных новых препаратов наиболее сильное противоэпилептическое действие (критерий эффективности - доля больных 50% с уменьшением частоты припадков) в режиме дополнительной терапии при парциальной эпилепсии имеют топирамат и леветирацетам.
9. Только при неэффективности правильно подобранной монотерапии возможна политерапия.
10. Политерапия целесообразна после не менее чем двух последовательных попыток применения препаратов в режиме монотерапии. При плохой переносимости первого назначенного в режиме монотерапии препарата вторая монотерапия обязательна.
11. В то же время, при хорошей переносимости и неэффективности терапевтических доз первого адекватно назначенного в режиме монотерапии препарата возможен переход на комбинированную терапию (два препарата).
12. Длительное лечение двумя препаратами осуществляют исключительно при невозможности адекватной монотерапии. Лечение тремя препаратами целесообразно только при неэффективности терапии двумя адекватными препаратами.
13. Резкая отмена противоэпилептических препаратов угрожает жизни пациентов.
14. Частота приема ПЭП обычно определяется их периодом полувыведения.
15. Следует стремиться к минимально возможной при лечении конкретным препаратом частоте приема (не более 2-3 раз в день).
16. Целесообразно применение пролонгированных форм ПЭП, вследствие стабильной концентрации в плазме крови или препаратов с 1 -2 кратным применением.
17. Время приема препарата определяется как особенностями заболевания (временем развития припадков и т.д.), так и характеристиками препарата (в том числе, побочными эффектами).
18. Однако во избежание резких колебаний концентрации препарата в крови может быть предпочтительнее двукратный его прием.
19. У пожилых пациентов метаболизм ряда ПЭП снижен. В сравнении с пациентами молодого возраста, аналогичные дозы ПЭП создают более высокую их концентрацию в крови у пожилых. Это обусловливает необходимость начала лечения пожилых пациентов с малых доз препарата и тщательного их титрования. Начальная доза ПЭП у пожилых пациентов должна быть на 30-50% меньше.
20. В лечении парциальной эпилепсии у пожилых необходимо учитывать заболевания, вызвавшие эпилепсию, сопутствующую патологию, взаимодействие ПЭП с другими средствами, принимаемыми больным вследствие соматических расстройств, возможную гипоальбуминемию и возрастные особенности абсорбции лекарств.
21. Следует учитывать возможность взаимодействия ПЭП и других параллельно принимаемых препаратов.
22. Не следует назначать фенобарбитал из-за седативного влияния и индукции ферментов печени.
Показано, что при назначении большинства противоэпилептических препаратов их побочным эффектом является повышение щелочной фосфатазы и развитие остеопороза. Для предотвращения этого явления больным эпилепсией показано назначение витамина D. Фолиевая кислота применяется для снижения риска тератогенеза.
Читайте также:
