Нарушение зрения при расстройстве обмена гликопротеинов
Добавил пользователь Валентин П. Обновлено: 29.01.2026
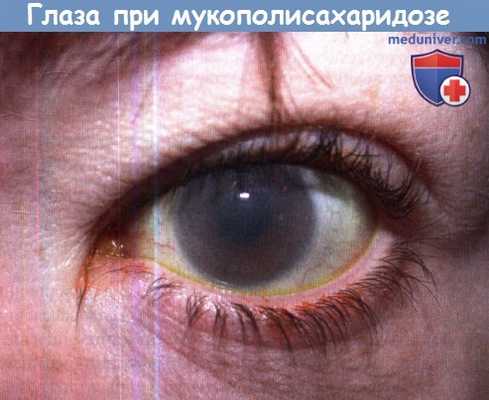
Нарушение зрения при мукополисахаридозе
Мукополисахаридозы — гетерогенная группа расстройств, развивающихся вследствие накопления гликозаминогликанов в тканях глаза и других органов. Описан широкий спектр фенотипов с различными скелетными, сердечными, дыхательными, желудочно-кишечными и неврологическими проявлениями.
Мукополисахаридозы классифицируются в зависимости от фенотипа, их причиной являются мутации генов различных лизосомальных ферментов. Все они наследуются по аутосомно-рецессивному механизму, за исключением мукополисахаридоза II типа (Hunter), наследуемого по Х-сцепленному механизму.
Ранняя трансплантация стволовых гемопоэтических клеток и фермент-заместительная терапия значительно улучшают прогноз у многих пациентов с мукополисахаридозами. Часто развиваются нарушения зрения, они могут быть вызваны помутнением роговицы, нейрооптикопатией, ретинопатией или иметь кортикальную природу.
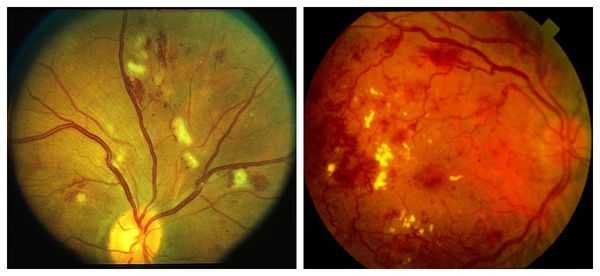
а) Помутнение роговицы при мукополисахаридозе. Помутнение роговицы — характерный признак некоторых типов мукополисахаридоза (I типа Hurler, Hurler/Scheie и Scheie; IV типа Morquio; VI типа Maroteaux-Lamy и VII типа Sly); развиваясь на ранних стадиях, она способствует уточнению диагноза. Отложения гликозаминогликанов в строме роговицы вызывает прогрессирующее диффузное помутнение роговицы, которое описывают как «матовое стекло».
Помутнение роговицы менее выражено при более легком фенотипе мукополисахаридоза I типа Scheie, и вообще не характерно для мукополисахаридоза III типа Sanfillipo. У больных мукополисахаридозом развиваются грубые черты лица и псевдоэкзофтальм, который может сопровождаться обнажением роговицы и последующей неоваскуляризацией.
Легкое помутнение роговицы может протекать бессимптомно, но с прогрессированием изменений развивается светобоязнь и ухудшается зрение. Отложение гликозаминогликанов может вызывать утолщение и нарушение гистерезиса роговицы, вследствие этого снижается точность измерений внутриглазного давления.
При тяжелых помутнениях роговицы и ухудшении зрения может помочь трансплантация роговицы (сквозная кератопластика или глубокая послойная кератопластика), повторного помутнения лоскута при периоде наблюдения до 11 лет не наблюдалось. Однако при оценке потенциального эффекта трансплантации роговицы необходимо учитывать сопутствующие ретинопатию, поражение зрительного нерва и кортикальные нарушения зрения, а также высокий риск анестезии у пациентов с мукополисахаридозом.
Помутнение роговицы у пациента с мукополисахаридозом I типа (Hurler).
б) Дальнозоркость и косоглазие при мукополисахаридозе. У большинства пациентов с мукополисахаридозом отмечается дальнозоркость вследствие изменения роговичной рефракции и уменьшения передне-заднего размера глаза. Часто развиваются косоглазие и амблиопия.
в) Ретинопатия при мукополисахаридозе. Прогрессирующая ретинопатия развивается при мукополисахаридозе I, II, III типов, но не характерна для VI типа. У пациента может присутствовать ночная слепота и нарушения периферического зрения, но эти изменения могут оставаться незамеченными на фоне снижения остроты зрения вследствие помутнения роговицы.
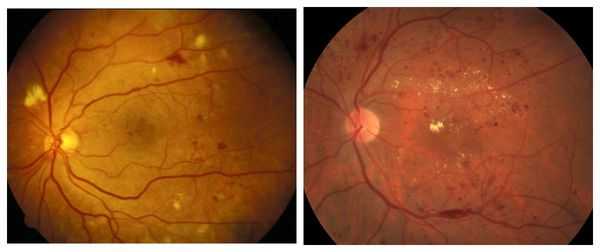
г) Отек и атрофия диска зрительного нерва. Часто у пациентов с мукополисахаридозом зрительный нерв выглядит «толстым». В ганглиозных клетках и в окружающей склере формируются отложения гликозаминогликанов, вызывающие увеличение размеров нерва и утолщение склеры. Развивающееся вследствие этого сдавление зрительного нерва может приводить к его атрофии. Вдобавок у пациентов с мукополисахаридозом может повышаться внутричерепное давление; развивающееся в результате действия всех этих факторов поражение зрительного нерва может приводить к тяжелому ухудшению зрения.
При оценке динамики функций зрительного нерва и планировании трансплантации роговицы информативным методом является исследование зрительных вызванных потенциалов.

а - Псевдоэкзофтальм вследствие мелких глазниц у 17-летнего пациента с мукополисахаридозом VI типа.
б - Грубые черты лица у 16-летнего пациента с мукополисахаридозом II типа.
д) Глаукома. Глаукома при мукополисахаридозе может развиваться вследствие скопления гликозаминогликанов в переднем отрезке, что вызывает сужение угла передней камеры, и в ячейках трабекулярной сеточки, что приводит к обструкции оттока водянистой влаги и развитию открытоугольной глаукомы. Глаукома описана при мукополисахаридозе I, II и VI типов. Диагностика глаукомы и соответствующее обследование пациентов с мукополисахаридозом затруднены вследствие неточности измерений внутриглазного давления, помутнения роговицы, препятствующего осмотру угла передней камеры и диска зрительного нерва, и наличия сопутствующей патологии ДЗН.
При мукополисахаридозе IV типа развиваются точечные помутнения хрусталика.
е) Системные изменения при мукополисахаридозе. Мукополисахаридоз может проявляться в младенческом возрасте рецидивирующими инфекциями уха, паховыми или пупочными грыжами или скелетными аномалиями, например кифосколиозом. Другие системные проявления включают в себя обструктивное апноэ во сне, отложения на клапанах сердца и инфильтрацию сердечной мышцы, сдавление спинного мозга и боли и скованность вследствие дисплазий скелета. При мукополисахаридозе I типа наблюдается отставание в развитии и нарушения интеллекта; при мукополисахаридозе III типа рано развиваются нарушения поведения, причиной которых являются отложения гликозаминогликанов в ЦНС.
Лечение осуществляется разными специалистами под общим руководством педиатра с участием кардиолога, анестезиолога, ортопеда, ЛОРа, нейрохирурга, физиотерапевта, аудиолога, логопеда и офтальмолога. Дети с диагнозом мукополисахаридоза должны регулярно обследоваться детским офтальмологом.
Анестезия должна проводиться в стационаре специалистом, имеющим опыт ведения пациентов с мукополисахаридозами. Детей с мукополисахаридозом трудно интубировать из-за отложений мукополисахаридов вокруг воздухоносных путей и легко повреждаемого спинного мозга.
ж) Прогноз и лечение мукополисахаридоза. Прогноз при мукополисахаридозе вариабелен и зависит от фенотипа; некоторые дети умирают в первое десятилетие жизни, другие доживают до пятого или шестого десятилетия. Системный прогноз у пациентов с мукополисахаридозом I и VI типов улучшается при выполнении ранней трансплантации подходящего костного мозга или клеток крови пуповины. Фермент-заместительная терапия при мукополисахаридозе I типа (ларонидаза), II типа (элапраза) и VI типа (галсульфаза) облегчает системные проявления и может проводиться перед ранней трансплантацией костного мозга.
Офтальмологические изменения при мукополисахаридозе VI типа можно стабилизировать при помощи фермент-заместительной терапии.
Кифосколиоз при мукополисахаридозе I типа. Изменения пигментного эпителия сетчатки у пациента с мукополисахаридозом I типа.
Несмотря на минимальные помутнения роговицы острота зрения составляла 6/60. (А, Б) «Толстые» диски зрительного нерва у 14-летнего пациента с мукополисахаридозом II типа.
(В, Г) Ультразвуковое исследование зрительных нервов того же пациента, что и на рисунках (А) и (Б),
определяется утолщение склеры и увеличение диаметра зрительного нерва (предоставлено Vishwanath, MREH).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нарушение зрения при расстройстве обмена гликопротеинов
а) Нарушение зрения при α-маннозидозе (недостаточности α-маннозидазы). При а-маннозидозе наблюдаются немного грубые черты ли-ца, аномалии скелета, ухудшение обучаемости различной степени выраженности и глухота. Офтальмологические нарушения включают в себя катаракту и косоглазие. Выявляются задние кортикальные помутнения хрусталика в сочетании с множественными отдельными прозрачными круглыми вакуолями в разных слоях хрусталика, лучше всего видимыми при осмотре на щелевой лампе в отраженном свете.
б) Нарушение зрения при фукозидозе. Фукозидоз — прогрессирующее нейродегенеративное заболевание, характеризуемое судорожными припадками, несколько грубыми чертами лица, скелетной дисплазией и развитием ангиокератом. У больных детей наблюдается извитость сосудов сетчатки и конъюнктивы. Могут развиваться макулопатия типа «бычьего глаза» и центральные «дольчатые» помутнения роговицы.
в) Нарушение зрения при сиалидозе (муколипидозе I типа). Причиной сиалидоза является недостаточность a-N-аце-тил-нейраминидазы; у больных с мочой выделяется сиалилолигосахарид.
Сиалидоз I типа «синдром вишневой косточки — миоклонуса» манифестирует в старшем детском возрасте ухудшением зрения на фоне развития «вишневой косточки», миоклонической эпилепсией и атаксией. Сиалидоз 2 типа дебютирует раньше и характеризуется грубыми чертами лица, задержкой развития, гепатомегалией и множественным дизостозом.
Вместе с симптомом «вишневой косточки» у больных сиалидозом могут выявляться точечные помутнения хрусталика, атрофия зрительного нерва, помутнения роговицы и дефекты поля зрения.
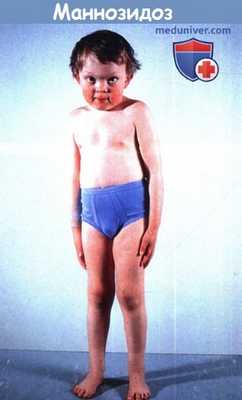
Ребенок с маннозидозом, отмечаются несколько грубые черты.
С возрастом черты лица становятся более грубыми.
г) Нарушение зрения при болезни накопления сиаловой кислоты. Заболевание развивается вследствие блока транспорта сиаловой кислоты из лизосом в результате мутации гена SLC17A5, кодирующего лизосомальный протеин сиалин. Тяжесть заболевания варьирует от болезни накопления сиаловой кислоты младенцев, характеризующейся грубыми чертами лица и бледностью кожных покровов, тяжелой задержкой развития, гепатоспленомегалией и кардиомегалией, при которой смерть наступает в младшем детском возрасте, до болезни Salla, сопровождающейся медленно прогрессирующей умственной отсталостью, атаксией, спастичностью и эпилепсией.
При болезни накопления сиаловой кислоты у детей может наблюдаться альбиноидное глазное дно. При болезни Salla могут развиваться косоглазие, нистагм и атрофия зрительного нерва.
д) Нарушение зрения при муколипидозе. Муколипидоз (mucolipidosis — ML) II и III типов — аутосомно-рецессивные заболевания, причиной которых является недостаточность N-ацетил-гликозамин-1-фосфотрансферазы, фосфорилирующей остатки углеводов N-связанных гликопротеинов.
Муколипидоз II типа или «I-клеточная» болезнь манифестирует в раннем возрасте и характеризуется неврологической деградацией, контрактурами суставов, грубыми чертами лица и кифосколиозом. Смерть наступает в детском возрасте. Отмечается дегенерация сетчатки и помутнение роговицы.
Муколипидоз III типа характеризуется более легким течением, прогрессирует медленно, больные достигают взрослого возраста. Изменения глаз включают в себя помутнение роговицы, дальнозоркий астигматизм, отек диска зрительного нерва, извитость сосудов сетчатки и макулопатию. Электроретинограмма нормальная.
Муколипидоз IV типа — аутосомно-рецессивное заболевание, развивающееся вследствие мутации гена MCOLN1, кодирующего муколипин-1. Заболевание встречается среди евреев-ашкеназов. Клинические проявления включают в себя прогрессирующую умственную отсталость и гипотонию. У пациентов с муколипидозом IV типа наблюдается «затуманивание» эпителия роговицы, ретинопатия и бледность диска зрительного нерва, истончение сосудов и изменения ПЭС в сочетании с электронегативной ЭРГ.
Другие офтальмологические изменения включают в себя косоглазие, эрозию роговицы и эпизодические боли, катаракту и птоз. Описаны легкие фенотипы, характеризующиеся лишь поражением глаз — помутнением роговицы и ретинопатией.
Муколипидоз III типа: характерные черты лица;
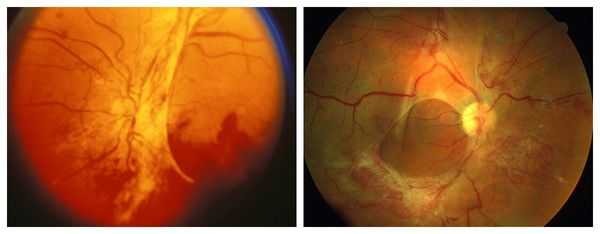
контрактуры суставов не позволяют пациенту полностью поднять руки. Симптом «вишневой косточки» у больного сиалидозом 1 типа. (А, Б) Кифосколиоз и поражение суставов у больного сиалидозом 2 типа.
(В) Симптом «вишневой косточки» у того же пациента.
Изображение глазного дна под флером из-за помутнения роговицы.
Диабетическая ретинопатия - симптомы и лечение
Что такое диабетическая ретинопатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Перовой Татьяны Юрьевны, офтальмолога со стажем в 8 лет.
Над статьей доктора Перовой Татьяны Юрьевны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
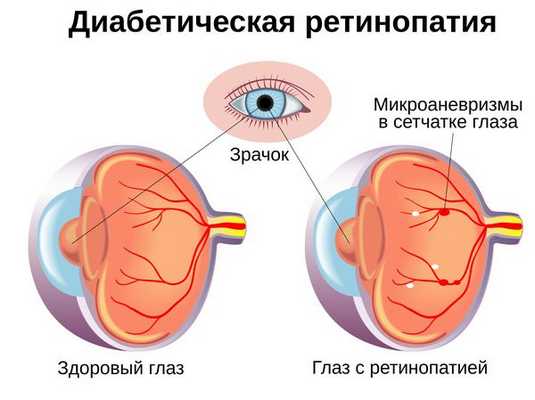
Диабетическая ретинопатия (Diabetic retinopathy) — это наиболее тяжёлое осложнение сахарного диабета первого и второго типа , которое связано с поражением сосудов сетчатки глаза. Чаще всего оно приводит к снижению зрения и слепоте [1] .
У диабетиков первого типа ретинопатия возникает в более раннем возрасте, у больных вторым типом диабета — на поздних сроках заболевания. Спрогнозировать время появления ретинопатии сложно, так как у каждого пациента оно индивидуально, но чаще всего при диабете второго типа ретинопатия развивается на 3-5 году болезни.
По данным Сент-Винсентской декларации 1992 года, которая была посвящена исследованию эпидемиологии диабетической ретинопатии при сахарном диабете первого типа, она возникает в 90 % случаев, при сахарном диабете второго типа — в 38,9 % [15] .
Проблемы сахарного диабета сегодня выходят на первое место во всём мире. Этим заболеванием страдают примерно 5 % населения Земли всех национальностей и возрастов. В России число больных превышает 8 млн, причём ежегодно их число увеличивается на 5-7 % [15] .
К факторам риска, которые приводят к ухудшению сахарного диабета, можно отнести:
- уровень глюкозы крови (показатели гипергликемии); ;
- хроническую почечную недостаточность ; ;
- молодой возраст;
- период беременности;
- генетическую предрасположенность (наследственность);
- вредные привычки ( курение ).
Но в первую очередь частота развития диабетической ретинопатии связана со стажем заболевания:
- при стаже сахарного диабета до 5 лет ретинопатия возникает в 9-17 % случаев;
- от 5 лет до 10 лет — в 44-80 % случаев;
- от 15 лет — в 87-99 % случаев [15] .
Во время беременности риск появления ретинопатии отсутствует, так как срок гестационного диабета очень короткий, чтобы позволить ретинопатии развиться. Если же диабетическая ретинопатия развилась ещё до зачатия, то беременность может усугубить течение болезни [16] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы диабетической ретинопатии
Внешне диабетическая ретинопатия никак себя не проявляет. Она начинает прогрессировать безболезненно и малосимптомно — в этом и есть её главное коварство. Только с течением времени проявляется первый признак заболевания — ухудшение чёткости зрения, из-за чего ретинопатию чаще всего выявляют уже на пролиферативной, т. е. самой поздней стадии болезни. Но при этом стоит помнить, что даже при запущенном заболевании зрение может оставаться в пределах нормы [16] .
Когда отёк затрагивает центр сетчатки, пациент ощущает нечёткость зрения, ему становится трудно читать, писать, набирать текст, работать с мелкими деталями на близком расстоянии. При кровоизлияниях возникают плавающие серые или чёрные плотные пятна, которые движутся вместе с глазом, ощущение пелены или паутины перед глазами. Эти симптомы появляются из-за поражения сосудов на глазном дне.

Когда после лечения кровоизлияния рассасываются, пятна исчезают. Однако симптомы могут возникнуть вновь при нестабильном уровне глюкозы или скачке артериального давления. Поэтому пациент должен держать под контролем эти показатели и при появлении признаков болезни обратиться на приём к окулисту [2] .
Патогенез диабетической ретинопатии
Сахарный диабет — это заболевание, при котором в организме возникает нехватка инсулина из-за невосприимчивости к нему тканей . Данное состояние в первую очередь влияет на внутренний слой сосудистых стенок — эндотелий. Он выполняет множество важных функций: участвует в процессе обмена веществ, обеспечивает непроницаемость сосудистой стенки, текучесть и свёртывание крови, появление новых сосудов и пр.
Изменения эндотелия на фоне сахарного диабета происходят из-за каскада нарушений, спровоцированных длительной гипергликемией — высоким уровнем глюкозы в крови. В избыточной концентрации глюкоза быстро вступает в химические реакции, которые пагубно воздействуют на клетки, ткани и органы. Такой длительный процесс называется глюкозотоксичностью [3] .
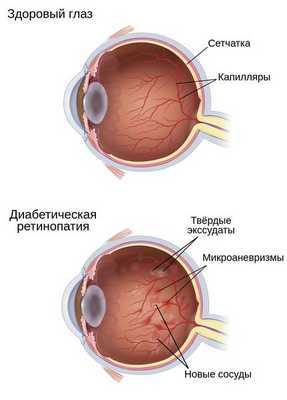
Гипергликемия и глюкозотоксичность со временем приводят к гибели клеток в сосудах — перицитов, которые контролируют обмен жидкости, сужая и расширяя капилляры. После их разрушения проницаемость кровеносных сосудов сетчатки повышается, они становятся тоньше и растягиваются в связи с давлением скапливающейся жидкости под слоями сетчатки. Это приводит к образованию микроаневризм — небольших локальных расширений капилляров сетчатки, которые способствуют развитию ишемии (снижению кровоснабжения сетчатки) и появлению новых сосудов и тканей на глазном дне.
Таким образом, в развитии диабетической ретинопатии и её прогрессировании наиболее важное значение имеют два основных патогенетических механизма:
- Нарушение внутреннего барьера, который составляет эндотелий капилляров сетчатки. Из-за повышенной проницаемости стенок сосудов появляются отёки, твёрдые экссудаты (скопления жидкости) и кровоизлияния на глазном дне.
- Образование микротромбов и закупорка сосудов сетчатки. По этим причинам нарушается обмен веществ между кровью и тканью через стенки капилляров, появляются зоны ишемии и гипоксии сетчатки. Всё это, в свою очередь, приводит к появлению новых кровеносных сосудов на глазном дне.
Классификация и стадии развития диабетической ретинопатии
Согласно общепринятой классификации E. Kohner и M. Porta [14] , в зависимости от патологических изменений выделяют три стадии диабетической ретинопатии:
- I стадия — непролиферативная;
- II стадия — препролиферативная;
- III стадия — пролиферативная.
Непролиферативную стадию диабетической ретинопатии ещё называют фоновой [16] . Её обычно диагностируют у диабетиков с большим стажем заболевания (от 10 до 13 лет). Она сопровождается закупоркой сосудов (чаще артерий) и повышением проницаемости капилляров (микрососудистой антипатией). В сетчатке образуются мелкие аневризмы (локальные расширения сосудов), отёки, экссудат и точечные кровоизлияния в центре или глубоких тканях сетчатки. Экссудат может быть мягким или твёрдым, белым или желтоватым, с чёткими или смазанными границами. Чаще всего он располагается в центре сетчатки и свидетельствует о наличии хронического отёка [16] . Качество зрения при этом не страдает.
Препролиферативная стадия сопровождается аномалиями сосудов, появлением экссудата различной консистенции, а также больших ретинальных кровоизлияниями. Она отличается тем, что:
- количество признаков, имеющихся на первой стадии, увеличивается;
- появляются субретинальные и преретинальные кровоизлияния;
- возникает гемофтальм — кровоизлияние в стекловидное тело;
- появляется макулопатия — поражение центральной зоны сетчатки;
- в макулярной зоне образуются участки ишемии и экссудации.
На препролиферативной стадии требуется тщательное обследование, чтобы обнаружить ишемические поражения сетчатки. Их наличие будет указывать на прогрессирование болезни и скорый переход к более тяжёлой стадии диабетической ретинопатии.
Пролиферативная стадия развивается при закупорке капилляров. Она приводит нарушению кровоснабжения в отдельных зонах сетчатки. Отличается появлением новых кровеносных сосудов в сетчатке или на диске зрительного нерва, обширными кровоизлияниями, наличием фиброзных спаек и плёнок.
Также существует классификация тяжести диабетической ретинопатии . Она чётко отражает стадии прогрессирования и распространённость болезни. Согласно ней, выделяют четыре степени тяжести:
- I степень — изменения только в зоне одной сосудистой аркады;
- II степень — фиброзные изменения диска зрительного нерва;
- III степень — наличие изменений I и II степени;
- IV степень — распространённые фиброзные поражения всего глазного дна [11] .
Осложнения диабетической ретинопатии
Диабетическая ретинопатия приводит к возникновению следующих осложнений:
- — потеря прозрачности хрусталика из-за образования плотных непрозрачных структур в его содержимом. Вследствие помутнения он не пропускает достаточное количество света, и человек перестаёт видеть отчётливую картинку. Из-за мутности хрусталика зрение становится как бы "затуманенным", очертания объектов — нечёткими и размытыми.
- Вторичная глаукома — повышение внутриглазного давления и поражение зрительного нерва, развивающееся на фоне другого заболевания — катаракты, кератита, травмы глаза, тромбоза вен сетчатки и др. При этом наблюдается прогрессирующее снижение остроты зрения и болевой синдром.
- Гемофтальм — кровоизлияние в полость стекловидного тела. Кровь так же, как и помутневший хрусталик, мешает попаданию света на сетчатку, из-за чего снижается чёткость зрения.
- Ретиношизис — расслоение сетчатки из-за нарушения кровообращения. Возникает чаще всего при сосудистых заболеваниях глаз, воспалительных процессах (хронических формах увеита, иридоциклита), онкологических заболеваниях сосудистой оболочки, в результате воздействия некоторых лекарств.
- Отслойка сетчатки — отделение сетчатки от сосудистой оболочки глаза. При этом возникает резкое снижение зрения, появляется пелена, "занавеска" перед глазом, сужаются поля зрения, появляются мушки, искры, молнии.
- Слепота . Она является необратимой и становится причиной инвалидизации.
Все эти состояния приводят к постоянному контролю со стороны эндокринолога, офтальмолога, терапевта и невропатолога. А такие осложнения, как катаракта, вторичная глаукома, гемофтальм и отслойка сетчатки, требуют проведения операции [12] .
Диагностика диабетической ретинопатии
Диагноз диабетической ретинопатии выставляется на основании нескольких составляющих: анамнеза, результатов офтальмологического обследования и особенностей клинической картины глазного дна.
Для первичного обследования (скринига) проводятся определённые виды исследований:
- визометрия — проверка остроты зрения;
- периметрия — оценка состояния периферического зрения;
- биомикроскопия — изучение переднего отрезка глаза (роговицы, передней камеры, хрусталика, конъюнктивы и век);
- офтальмоскопия под мидриазом — осмотр глазного дна через расширенный зрачок с использованием линзы Гольдмана;
- контактная тонометрия — измерение внутриглазного давления тонометром Маклакова.
Данные обследования должны проходить все пациенты с сахарным диабетом любого типа минимум раз в год, а беременные пациентки — раз в триместр. Это позволит вовремя выявить ретинопатию и не допустить развитие осложнений [16] .
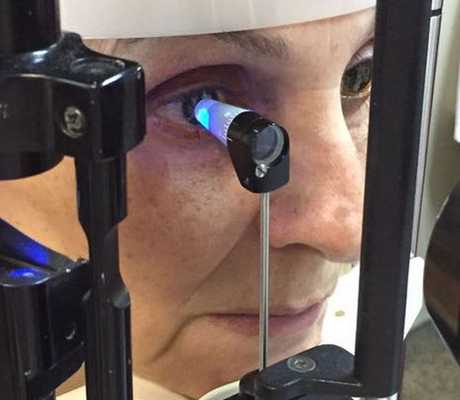
Для отслеживания динамики изменений на сетчатке выполняется фотографирование глазного дня с помощью фундус-камеры. Иначе её называют ретинальной камерой. Она также помогает определить степень диабетической ретинопатии [16] .
При наличии помутнений хрусталика и стекловидного тела показано проведение УЗИ глаза , чтобы оценить состояние этих структур. Для выявления признаков глаукомы выполняется гониоскопия , которая позволяет осмотреть переднюю камеру глаза.
Наиболее информативным методом визуализации сосудов сетчатки является флуоресцентная ангиография . Она помогает оценить состояние капилляров и качество кровообращения, благодаря чему можно обнаружить начальные проявления диабетической ретинопатии, а также закупорку капилляров, зоны ишемии сетчатки и образование новых сосудов. Эти данные позволяют определить степень тяжести диабетической ретинопатии и определиться с тактикой лечения [16] .
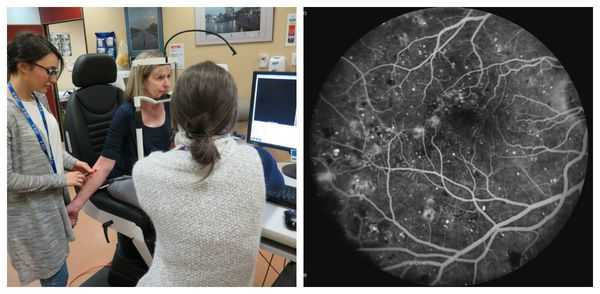
Совместно с ангиографией проводят оптическую когерентную и лазерную сканирующую томографию сетчатки [13] . Эти исследования предназначены для оценки выраженности макулярного отека и эффективности проводимого лечения [16] .
Лечение диабетической ретинопатии
Диабетическая ретинопатия при тяжёлой форме сахарного диабета неизбежно возникает и прогрессирует. Поэтому основная цель лечения ретинопатии заключается в том, чтобы как можно дольше избегать осложнений сахарного диабета и замедлить переход начальных проявлений ретинопатии к более серьёзным (пролиферативным) изменениям, которые приводят к значительному снижению зрения и инвалидизации [8] .
Независимо от стадии диабетической ретинопатии необходимо провести соответствующее лечение основного заболевания, нормализовать артериальное давление и липидный обмен. Поэтому лечением ретинопатии занимаются сразу несколько специалистов: эндокринолог, офтальмолог, невролог и терапевт [9] .
Медикаментозное лечение диабетической ретинопатии включает использование нескольких лекарственных групп:
- препараты, воздействующие на артериальную гипертензию, диабетическую нефропатию и ретинопатию;
- ангиоретинопротекторы и антиоксиданты, укрепляющие сосудистую стенку и иммунитет, препятствующие образованию микротромбов;
- препараты, улучшающие микроциркуляцию крови, её вязкость и текучесть;
- гиполипидемические препараты, нормализующие липидный обмен в организме;
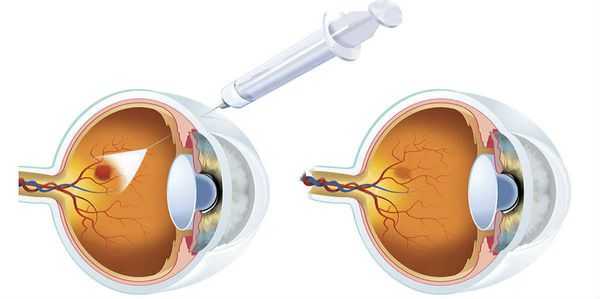
- глюкокортикоиды, которые вводят в стекловидное тело для устранения отёка;
- ингибиторы VEGF, которые также вводят в стекловидное тело, чтобы не допустить или приостановить образование новых сосудов (например, афлиберцепт, ранибизумаб, бевацизумаб ) [16] .
При развитии третьей стадии диабетической ретинопатии, угрожающей жизни пациента, терапевтические возможности очень ограничены. В таких случаях может потребоваться лазерная коагуляция сетчатки . Показаниями к её выполнению служат:
- экссудативная (отёчная) макулопатия;
- ишемия сетчатки;
- появление новых сосудов на сетчатке или передней поверхности радужной оболочки;
- прогрессирование патологических изменений на глазном дне через 3-6 месяцев после компенсации сахарного диабета.
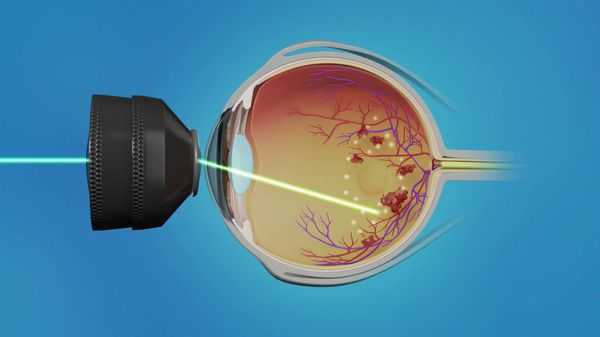
На данный момент существует три основных метода лазерной фотокоагуляции:
- Фокальная лазеркоагуляция (ФЛК) — нанесение коагулянта (вещества, "склеивающего" сетчатку с сосудистой оболочкой) на участки просачивания красителя (флуоресцеина), расположения микроаневризм, кровоизлияний и твёрдых экссудатов. Чаще применяется при макулярном отёке с повышенной проницаемостью сосудов.
- Барьерная лазеркоагуляция — нанесение коагулянтов на околомакулярную зону в несколько рядов. Чаще применяется при первой стадии диабетической ретинопатии в сочетании с макулярным отёком.
- Панретинальная лазеркоагуляция (ПРЛК) — нанесение коагулянтов на все зоны сетчатки, избегая макулярной области. Чаще применяется при второй стадии диабетической ретинопатии с обширными зонами ишемии. Правильно выполненная ПРЛК на ранних стадиях пролиферации является достаточно эффективным методом лечения диабетической ретинопатии.
В далеко зашедших случаях показано хирургическое вмешательство , а именно субтотальная витрэктомия (почти полное удаление стекловидного тела) с удалением задней пограничной мембраны, которая прикреплена по окружности диска зрительного нерва [6] .
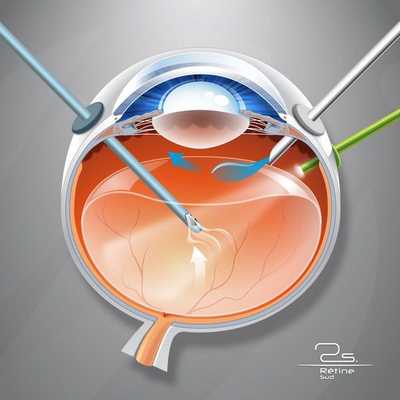
Показаниями для витрэктомии служат:
- витреальное кровоизлияние (постоянно кровоточащие сосуды);
- наличие спаек;
- отслойка сетчатки.
Для многих пациентов с тяжёлым течением диабетической ретинопатии витрэктомия является единственным вариантом сохранения зрения.
Прогноз. Профилактика
Во многом прогноз зависит от стадии диабетической ретинопатии и степени тяжести сахарного диабета. Наиболее неблагополучный вариант будущего возможен при пролиферативной стадии заболевания, так как на этом этапе возникают различные осложнения, которые приводят к значительной потере остроты зрения и слепоте.
Для сохранения зрения пациенту с сахарным диабетом крайне важно следить за основным заболеванием и артериальной гипертензией, строго следовать всем назначениям эндокринолога и терапевта, постоянно наблюдаться у офтальмолога. Если внезапно стала снижаться острота зрения или появились другие жалобы на состояние глаз, то необходимо незамедлительно обратиться к специалисту [10] .
Эндокринная офтальмопатия - симптомы и лечение
Что такое эндокринная офтальмопатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сивова А. А., эндокринолога со стажем в 13 лет.
Над статьей доктора Сивова А. А. работали литературный редактор Вера Васина , научный редактор Сергей Цыганок и шеф-редактор Маргарита Тихонова
Эндокринная офтальмопатия (Endocrine ophthalmopathy) — это хроническое прогрессирующее аутоиммунное заболевание глаз. Чаще всего оно развивается из-за нарушений в работе щитовидной железы и проявляется воспалением тканей глаза, отёком, покраснением, выпячиванием глазного яблока и нарушением зрения.
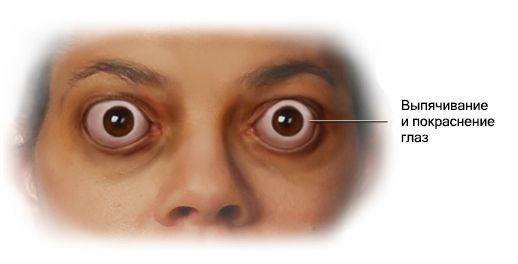
Эндокринную офтальмопатию ещё называют офтальмопатией Грейвса, тиреотоксическим или эндокринным экзофтальмом, инфильтративной, тиреоидной, эутиреоидной, дистиреоидной и аутоиммунной офтальмопатией.
Распространённость
Эндокринная офтальмопатия может развиться в любом возрасте, но чаще всего её выявляют:
- у женщин — в 40–44 и 60–64 года;
- у мужчин — в 45–49 и 65–69 лет.
Женщины болеют чаще, чем мужчины: ежегодно эндокринную офтальмопатию диагностируют у 16 женщин и у 2,9 мужчин на 100 000 населения [3] [6] .
Причины эндокринной офтальмопатии
В 80 % случаев заболевание развивается из-за болезни Грейвса (диффузного зоба), в 10 % — из-за аутоиммунного тиреоидита, и ещё в 10 % — на фоне нормального уровня гормонов и без аутоиммунной патологии (эутиреоидная болезнь Грейвса) [5] .
Факторы риска развития эндокринной офтальмопатии:
- — повышает риск развития тяжёлой эндокринной офтальмопатии, снижает эффективность лечения; и гипертиреоз;
- лечение гипертиреоза радиоактивным йодом — приблизительно у 15 % пациентов после такой терапии возникает или прогрессирует эндокринная офтальмопатия, но развитие болезни можно предотвратить, принимая курс глюкокортикостероидов [6] ;
- генетическая предрасположенность — обнаружены гены, связанные с развитием эндокринной офтальмопатии.
Симптомы эндокринной офтальмопатии
Обычно первыми жалобами при эндокринной офтальмопатии становятся чувство давления и ощущение песка в глазах, светобоязнь, иногда слезотечение или сухость глаз [11] . Пациентов может беспокоить двоение в глазах и ощущение пелены. Симптомы могут возникать спонтанно.
Характерные внешние признаки болезни — это отёк век и расширенные глазные щели (глаза «навыкат»).
Часто офтальмопатия развивается одновременно с тиреотоксикозом, поэтому часть симптомов связана с нарушением работы щитовидной железы. У пациентов дрожат руки и веки, возникают частые сердцебиения, вплоть до нарушения ритма (экстрасистолия, трепетание, фибрилляция предсердий и желудочков), снижается вес, часто меняется настроение, выпадают волосы и повышается потливость [11] .
Патогенез эндокринной офтальмопатии
До конца непонятно, какой именно фактор запускает развитие эндокринной офтальмопатии. Известно только, что в тканях щитовидной железы и глазницы есть одинаковые антигены, поэтому антитела при токсическом зобе (болезни Грейвса) атакуют не только щитовидную железу, но и глазницу.
Антиген — это любое вещество, которое организм воспринимает как потенциально опасное и против которого запускает иммунный ответ, т. е. вырабатывает антитела. В норме этот механизм защищает нас, например от вирусов и бактерий, но при аутоиммунных заболеваниях организм начинает разрушать собственные ткани.
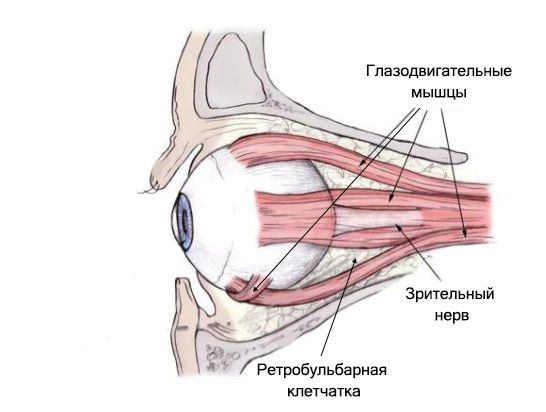
При эндокринной офтальмопатии обнаруживаются антитела к глазодвигательным мышцам, фибробластам и орбитальной клетчатке. Антитела к глазодвигательным мышцам есть не у всех пациентов, антитела к орбитальной клетчатке встречаются в 100 % случаев [11] .
Выделяют две фазы эндокринной офтальмопатии:
1. Активное воспаление. Ретробульбарная клетчатка воспаляется, её объём увеличивается, из-за чего выпячивается глаз (возникает экзофтальм) и может быть сдавлен зрительный нерв. Одновременно идёт воспаление в глазодвигательных мышцах. Оно протекает неравномерно, что может привести к двоению в глазах (диплопии), а иногда к стойкому косоглазию.
2. Неактивная фаза. На фоне лечения тиреотоксикоза воспаление уменьшается. Лёгкие формы офтальмопатии могут пройти без дополнительного вмешательства, при тяжёлых — понадобится специфическая терапия. Если тиреотоксикоз не лечить, то офтальмопатия не пройдёт, даже при лёгком течении.
Классификация и стадии развития эндокринной офтальмопатии
Клиническая картина эндокринной офтальмопатии разнообразна, поэтому единая классификация не разработана.
Формы эндокринной офтальмопатии
В российских рекомендациях выделяют три формы заболевания:
- Тиреотоксический экзофтальм — всегда сопровождается избытком тиреоидных гормонов, ткани орбиты обычно не поражены, зрение не ухудшается, но возникает синдром сухого глаза. Состояние улучшается после специального лечения и нормализации работы щитовидной железы.
- Отёчный экзофтальм — самая распространённая форма эндокринной офтальмопатии [8] . В зависимости от локализации выделяют три варианта:
- липогенный — поражена преимущественно клетчатка глазницы;
- миогенный — патологический процесс в основном протекает в глазодвигательных мышцах;
- смешанный вариант — одинаково страдают глазодвигательные мышцы и клетчатка.
- Эндокринная миопатия — может развиться самостоятельно или стать исходом отёчной формы. Чаще возникает при пониженном или нормальном уровне тиреоидных гормонов, более распространена среди мужчин [8] . Обычно поражены оба глаза, болезнь протекает достаточно быстро: уже через 3–4 месяца от начала заболевания развивается фиброз.
Стадии эндокринной офтальмопатии
Согласно классификации, рекомендуемой Европейской группой по офтальмопатии Грейвса (EUGOGO), выделяют три степени тяжести эндокринной офтальмопатии:
- Лёгкая — качество жизни снижено незначительно, смещение века (ретракция) < 2 мм, мягкие ткани орбиты изменены слабо, экзофтальм < 3 мм, диплопия отсутствует совсем или быстро проходит.
- Средняя — ретракция ≥ 2 мм, мягкие ткани орбиты изменены умерено, есть экзофтальм, непостоянная или постоянная диплопия, но риска потерять зрение ещё нет.
- Тяжёлая — оптическая нейропатия и/или повреждение роговицы, спонтанный вывих/подвывих глаза, пациент может потерять зрение и нуждается в экстренном лечении [11] .
Степень тяжести определяется по результатам осмотра офтальмолога.
Активность офтальмопатии — это показатель, который указывает на выраженность воспалительного процесса. Она не учитывается при определении стадии болезни, но важна для выбора методов лечения. Её определяют по шкале клинической активности (CAS) на основе семи основных и трёх дополнительных критериев, выделяя неактивную и активную эндокринную форму [11] .
- Спонтанная ретробульбарная боль (за глазным яблоком).
- Покраснение век.
- Боль при движении глаз.
- Отёк век.
- Воспаление и покраснение конъюнктивы (инъекция).
- Покраснение и отёк слёзного мясца и полулунной складки.
- Отёк конъюнктивы (хемоз).
Дополнительные критерии можно определить, только регулярно посещая окулиста. К ним относятся:
- Увеличение экзофтальма больше чем на 2 мм за последние 2 месяца.
- Уменьшение подвижности глаза больше чем на 8° в любом направлении за последние 2 месяца.
- Ухудшение зрения больше чем на 1/10 остроты зрения за последние 2 месяца.
Эндокринная офтальмопатия считается активной при наличии трёх и более критериев, неактивной — при 1–2 критериях [5] .
Осложнения эндокринной офтальмопатии
Основные осложнения эндокринной офтальмопатии:
- поражение роговицы, вплоть до изъязвления — развивается из-за экзофтальма, при котором глазное яблоко сильно смещается вперёд и не получается полностью закрыть глаз;
- необратимое снижение зрения, иногда до полной потери — возникает при отёчной форме из-за повреждения зрительного нерва и/или роговицы (оптическая нейропатия и/или кератопатия); — в основном развивается при поражении глазодвигательных мышц [7] .
Диагностика эндокринной офтальмопатии
Диагностические исследования при эндокринной офтальмопатии очень важны: от их результатов зависит тактика лечения.
Сбор анамнеза
Для установления диагноза необходимо тщательно собрать анамнез. Важны не только симптомы, но и данные обследований щитовидной железы, информация о предшествующих болезнях и травмах. Также нужно выяснить, есть ли нехарактерные для эндокринной офтальмопатии жалобы.
Осмотр
Во время офтальмологического осмотра обязательно определяют объём движения, расположение и подвижность глаз, измеряют ширину глазных щелей, исследуют остроту зрения и выявляют специфические для эндокринной офтальмопатии симптомы.
Также проводится экзофтальмометрия, которая позволяет определить степень смещения глазного яблока и наличие экзофтальма, но этого обследования не достаточно, чтобы поставить диагноз. Ещё может выполняться тонометрия, биомикроскопия, определение полей зрения, исследование цветного зрения и офтальмоскопия.
Лабораторная диагностика
Эндокринная офтальмопатия часто сопровождается заболеваниями щитовидной железы, поэтому необходимо проверить уровень гормонов: ТТГ, свободных Т3 и Т4.
Инструментальная диагностика
К инструментальным методам диагностики эндокринной офтальмопатии относятся:
- оптическая когерентная томография;
- компьютерная периметрия;
- цветовое допплеровское картирование (ЦДК), энергетическое картирование (ЭК) и импульсная допплерография для исследования кровотока в сосудах орбиты и глаза;
- компьютерная томография орбит в двух проекциях [11] .
Оптическая когерентная томография (ОКТ) — это новый вид обследования, с помощью которого можно получить изображения внутренних структур глаза в высоком разрешении. ОКТ позволяет детально рассмотреть все структуры глаза, оценить состояние глазного дна и глазного нерва, наличие макулярных отёков, определить отслойку сетчатки и микроаневризмы. Обследование безопасно, его можно проводить достаточно часто, чтобы отслеживать результаты лечения.
Компьютерная периметрия — это офтальмологическое исследование на приборе периметре. После обследования в специальной программе создаётся карта с границами полей зрения и отметками абсолютных и относительных «слепых пятен», если они есть. С помощью этого метода можно подробно изучить поля зрения при заболеваниях сетчатки или зрительного нерва.
Цветовое допплеровское картирование (ЦДК), энергетическое картирование (ЭК) и импульсная допплерография — это ультразвуковые методы, которые позволяют оценить нарушения кровотока. Его ухудшение может говорить о развитии ишемии в сетчатке глаза и оптической нейропатии. Также эти методы позволяют оценить, насколько высок риск, что при офтальмопатиии возникнет вторичная открытоугольная глаукома.
Компьютерная томография орбит — как правило, дополнительный метод исследования, который позволяет объективно оценить состояние глазницы и провести дифференциальную диагностику с другими патологиями. Также с помощью этого метода можно выявить толщину и плотность глазодвигательных мышц, что позволяет определить их поражение.
Дифференциальная диагностика
Экзофтальм при эндокринной офтальмопатии следует отличать от псевдоэкзофтальма при высокой степени близорукости, орбитальном целлюлите (флегмоне глазницы), опухолях (гемангиомах и саркомах орбиты, менингиомах и др.) [3] .
Лечение эндокринной офтальмопатии
Выбор методов лечения зависит от степени тяжести и активности офтальмопатии [5] .
Все методы лечения, приведённые в таблице, достаточно безопасны и эффективны. Их часто комбинируют, у каждого из них свои показания и недостатки. Например, основной недостаток терапии глюкокортикостероидами — это относительно частые рецидивы после прекращения лечения. Лучевая терапия при офтальмопатии помогает только в 60 % случаев, но при сочетании с глюкокортикостероидами эффективность достигает 95 % [1] .
При хирургическом лечении офтальмопатии необходимо соблюдать определённый порядок процедур:
- декомпрессия орбиты;
- операция на глазодвигательных мышцах;
- вмешательство на веках (одновременно или с последующей блефаропластикой).
Хирургическое лечение проводят через шесть месяцев после того, как состояние стабилизировалось. Однако в тяжёлых случаях, чтобы предотвратить слепоту из-за сдавления зрительного нерва, операция может быть проведена экстренно.
Орбитальная декомпрессия — это удаление части кости из глазницы, чтобы открыть одну или несколько пазух и освободить место для опухшей ткани. В результате глаз возвращается на место и освобождается сжатый зрительный нерв, который мог стать причиной серьёзных проблем со зрением.
Своевременно начатое лечение — основной фактор, который влияет на прогноз заболевания. Если офтальмопатия выявлена на ранних стадиях и выбрана правильная тактика лечения, то можно достичь ремиссии и предотвратить развитие осложнений. Примерно у 1/3 пациентов состояние улучшается, у 2/3 — стабилизируется, но в 5–10 % случаев заболевание может прогрессировать несмотря на лечение.
Пациентам с эндокринной офтальмопатией необходимо встать на диспансерный учёт к эндокринологу и офтальмологу. Через полгода после терапии следует пройти контрольное обследование у офтальмолога. Также потребуется регулярно наблюдаться у эндокринолога и при необходимости лечить основное заболевание. Частота посещения эндокринолога зависит от длительности заболевания и состояния щитовидной железы. В начале болезни доктора нужно посещать каждую неделю, затем раз в две недели, потом каждый месяц, а позже раз в квартал. Длительность наблюдения до отмены лечения обычно составляет 1,5–2 года.
При неактивной эндокринной офтальмопатии посещать офтальмолога нужно раз в 2–3 месяца, при активной офтальмопатии — раз в месяц в течение первого года и раз в шесть месяцев спустя год после лечения. Длительность наблюдения зависит от состояния глаз и щитовидной железы [11] .
Профилактика эндокринной офтальмопатии
Для профилактики нужно скорректировать факторы риска:
- бросить курить;
- при тиреотоксикозе принимать тиреостатики для восстановления нормального уровня гормонов, при рецидиве проводится радикальное лечение;
- при гипотиреозе показана заместительная гормональная терапия;
- при лечении радиоактивным йодом нужно профилактически принимать глюкокортикостероиды.
Воздействие на факторы риска — это первичная профилактика. Вторичная профилактика офтальмопатии — это раннее выявление заболевания, что осложняется отсутствием маркеров, по которым можно предположить развитие офтальмопатии. Пациентам с болезнью Грейвса нужно регулярно проходить осмотры у офтальмолога, даже если нет симптомов. Это поможет выявить заболевание на ранней стадии.
Для эндокринной офтальмопатии есть ещё третичная профилактика, которая позволит предотвратить прогрессирование заболевания. Для этого при выявлении офтальмопатии нужно бросить курить и следовать лечению, назначенному офтальмологом согласно современным рекомендациям.
Метаболический синдром - симптомы и лечение
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышева Андрея Владимировича, кардиолога со стажем в 33 года.
Над статьей доктора Чернышева Андрея Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
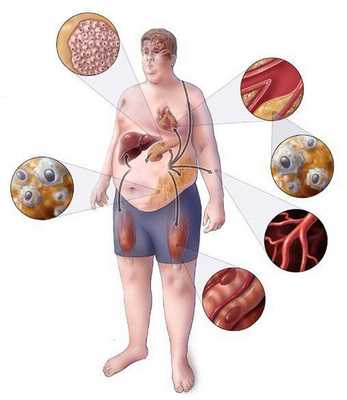
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
Важную роль играет распределение жировой ткани. Различают два типа ожирения:
- гиноидный (по типу «груша»), когда избыточная жировая ткань распределяется преимущественно на бёдрах и ягодицах;
- андроидный (по типу «яблоко»; абдоминальное ожирение), с преимущественной локализацией жира в области верхней половины тела (живот, грудь, плечи, спина).

Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Ещё один важный компонент метаболического синдрома — артериальная гипертензия, которая может носить вторичный характер. Нормальным считается систолическое артериальное давление (САД) 120-129 мм рт.ст и диастолическое артериальное давление (ДАД) 80-84 мм рт.ст. САД
- 1 ст. – САД 140-159, ДАД 90-99;
- 2 ст. - САД 160-179, ДАД 100-109;
- 3 ст. - САД ≥180, ДАД ≥110.
Повышение артериального давления характеризуется повышением риска сердечно-сосудистых событий.
Для метаболического синдрома характерны также изменения липидного обмена, которые классифицированы в таблице ниже (в ммоль/л).
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий. [17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП 3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – 11,1. [8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение < 0,33). [12]
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность [14] , рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия) [15] , психотерапевтических методик и обучающих программ. [13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии. [10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности [1] . Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут). [11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.). [9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46% [6] .
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
Читайте также:
