Нарушения гликолитического пути
Добавил пользователь Alex Обновлено: 16.01.2026
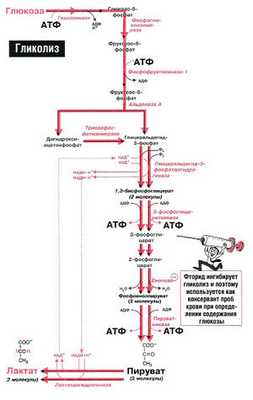
Гликолиз – процесс распада одной молекулы глюкозы с выделением энергии, достаточной для "зарядки" двух молекул АТФ, протекает в саркоплазме под воздействием 10 специальных ферментов.
Гликолиз может протекать без потребления кислорода (такие процессы называются анаэробными) и с потреблением кислорода (аэробный гликолиз) способен быстро восстанавливать запасы АТФ в мышце.
При занятиях бодибилдингом и высокоинтенсивных упражнениях происходит анаэробный гликолиз, с образованием молочной кислоты.
Во время динамических нагрузок, таких как бег, плавание и т.п., происходит аэробный гликолиз.
Аэробный гликолиз происходит в митохондриях под воздействием специальных ферментов и требует затрат кислорода, а соответственно и времени на его доставку. Окисление происходит в несколько этапов, сначала идет гликолиз, но образовавшиеся в ходе промежуточного этапа этой реакции две молекулы пирувата не преобразуются в молекулы молочной кислоты, а проникают в митохондрии, где окисляются в цикле Кребса до углекислого газа СО2 и воды Н2О и дают энергию для производства еще 38 молекул АТФ. Суммарное уравнение реакции окисления глюкозы выглядит так:
Распад глюкозы по аэробному пути (аэробный гликолиз) дает энергию для восстановления 38 молекул АТФ. Аэробное окисление в 19 раз эффективнее анаэробного гликолиза.
Подробное описание в статье: Энергообеспечение мышечной деятельности
Эритроциты транспортируют большое количество кислорода, которым снабжают все органы человека. По иронии судьбы сами они не могут использовать этот кислород. Источником энергии для эритроцитов служит глюкоза, при окислении которой в ходе анаэробного гликолиза в эритроцитах образуется АТФ (рис. 18.1). Аэробное окисление глюкозы в эритроцитах невозможно, так как в них отсутствуют митохондрии и вместе с ними все ферменты цикла Кребса. Кроме того, в них отсутствуют также ферменты, необходимые для окисления жирных кислот и использования кетоновых тел.
Функция эритроцитов — транспорт кислорода ко всем органам и тканям организма. Гемоглобин эритроцитов прочно связывается с кислородом, образуя оксигемоглобин. Однако в периферических тканях эритроциты должны отдать этот кислород другим клеткам. Это осуществляется благодаря явлению, известному под названием эффекта Бора. Эффект Бора создается благодаря двум факторам: протонам и 2,3-бисфосфоглицерату (рис. 18.2).
- Протоны вытесняют кислород из оксигемоглобина
Работающим мышцам необходим АТФ, и поэтому в них интенсивно функционирует цикл Кребса. В цикле Кребса образуется диоксид углерода, который проникает в эритроциты и реагирует с водой, образуя угольную кислоту (эту реакцию катализирует карбоангидраза). Угольная кислота самопроизвольно диссоциирует, образуя бикарбонат и протон, что приводит к местному возрастанию концентрации протонов (Н+), т.е. понижению pH. Протоны высвобождают кислород из гемоглобина, и кислород диффундирует из эритроцитов в периферические ткани. Здесь он связывается с миоглобином и переносит кислород в дыхательную цепь, где он используется для синтеза АТФ путем окислительного фосфорилирования.
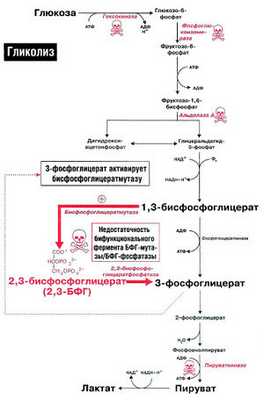
- Высвобождение кислорода в периферических тканях: 2,3-бисфосфоглицерат (2,3-БФГ) стабилизирует структуру дезоксигемоглобина. Помимо протонов, в создании эффекта Бора принимает участие 2,3-бисфосфоглицерат (2.3-БФГ) (рис. 18.2). В медицинской литературе распространено и другое название этого вещества — 2,3-дифосфоглицерат (2,3-ДФГ). 2.3-БФГ образуется в анаэробных условиях в эритроцитах. Процесс образования 2,3-БФГ происходит в дополнительной реакции гликолиза, получившей название
2,3-БФГ-шунта (шунт Рапопорта-Люберинга) (рис. 18.2). В периферических тканях молекула 2,3-БФГ связывается с дезоксигемоглобином и стабилизирует его структуру, не позволяя ему захватывать кислород от соседней молекулы оксигемоглобина.
- Связывание гемоглобина с кислородом в легких. Эритроциты переносят дезоксигемоглобин и связанный с ним СО2 в легкие. Поскольку в легких имеет место высокое парциальное давление кислорода, он вытесняет С02 из гемоглобина, и С02 выходит из легких при выдохе. Кислород связывается с гемоглобином, образуя оксигемоглобин, 2,3-БФГ вытесняется, и эритроциты переносят к периферическим тканям следующую порцию кислорода.
Гемоглобин — тетрамер. состоящий из двух альфа-цепей и двух бета-цепей. Фетальный гемоглобин имеет иное строение: он состоит из двух а-цепей и двух у-цепей. По сравнению с нормальным гемоглобином взрослого человека, фетальный гемоглобин имеет более низкое сродство к 2,3-БФГ. Это значит, что сродство к кислороду у фетального гемоглобина выше, чем у гемоглобина материнского организма. Благодаря этому происходит транспорт кислорода от материнского организма к азолу.
Предположим, что некий житель низин решил провести отпуск в горах. В первые дни отпуска даже незначительные физические нагрузки вызовут у него усталость и одышку. Но за несколько дней произойдет адаптация к высокогорью — в эритроцитах повысится концентрация 2,3-БФГ. Благодаря этому ткани станут получать кислород в достаточном количестве. несмотря на то что его концентрация в разреженном горном воздухе невысока. Повышение концентрации 2,3-БФГ — ответная реакция организма на недостаток кислорода
У курящих лиц концентрация 2,3-БФГ в эритроцитах выше, чем у некурящих. Так организм компенсирует сниженное вследствие постоянного воздействия угарного газа обеспечение тканей кислородом. Компенсаторное повышение уровня 2.3- БФГ также часто наблюдается у больных хроническими анемиями, обструктивной болезнью легких, при врожденных пороках сердца и муковисцидозе.
В редких случаях из-за врожденной недостаточности гликолитических ферментов в эритроцитах развивается наследственная несфероцитарная гемолитическая анемия. Это заболевание может быть весьма тяжелым, поскольку в эритроцитах гликолиз — единственный путь синтеза и АТФ и 2.3-БФГ.
Нарушения гликолитического ферментативного аппарата могут по-разному сказываться на метаболизме 2.3-БФГ (рис. 18.2). Если нарушение расположено проксимально по отношению к 2.3-БФГ-шунту (например, при недостаточности гексокиназы, фосфоглюкоизомеразы или альдолазы А), уровень 2,3-БФГ будет снижен, так как будет снижена интенсивность синтеза его предшественников. Если же нарушение расположено после 2.3-БФГ-шунта (например, недостаточность пируваткиназы). концентрация 2.3-БФГ в эритроцитах будет повышена.
Кроме того, у ряда больных была обнаружена недостаточность бифункционального фермента шунта — БФГ-мутазы/2,3-БФГ-фосфагазы. У таких больных концентрация 2.3- БФГ была низкой.
Чтобы учащийся не путал разные термины, необходимо разобраться в номенклатуре альдолаз. Альдолаза (полное название — фруктозо-1,6-бисфосфат-атьдолаза) по официальной номенклатуре называется D-глицеральдегид-З-фосфатлиазой (КФ 4.1.2.13). Она выполняет три функции:
- катализирует реакцию конденсации дигидрокснацетон-фосфата и глицеральдегид-З-фосфата. Продукт этой реакции — фруктозо-1,6-бисфосфат;
- катализирует расщепление фруктозо-1,6-бисфосфата на лигилроксиацетонфосфат и минеральдегид-3-фосфат;
- катализирует расщепление других, структурно близких фосфатов сахаров. Так. альдолаза катализирует расщепление фруктозо-1-фосфата на дигидроксиацетонфосфат и глицеральдегид (примечание: раньше фермент, выполняющий эту функцию, называли кетозо-1-фосфат-альдолазой. КФ 4.1.2.7).
У животных обнаружены три формы альдолазы.
Альдолаза А. Содержится в эритроцитах и мышцах. При наследственной гемолитической анемии в крови содержится дефектная форма альдолазы А.
Альдолаза В. Недостаточность альдолазы В приводит к наследственной непереносимости фруктозы. Альдолаза В присутствует в печени, почках и тонком кишечнике.
Альдолаза С. Содержится в головном мозге.
Два способа оценки аэробных возможностей организма (прямая оценка показателя максимального устойчивого состояния по лактату и косвенная оценка аэробно-анаэробного перехода) основаны на классической теории активации гликолиза, предложенной А. Хиллом. В основу этой теории легла гипотеза о том, что активация гликолиза в мышечном волокне запускается при снижении аэробного ресинтеза АТФ. Основной причиной снижения аэробного ресинтеза АТФ должно быть неадекватное снабжение клетки кислородом, т.е. фактически снижение внутриклеточного парциального давления кислорода до критического уровня (0,1—0,5 мм рт. ст.), ниже которого нормальное функционирование митохондрий невозможно. Прямо проверить данное предположение оказалось методически достаточно сложно.
Относительно недавно появились исследования, в которых in situ было измерено внутримышечное парциальное давление кислорода, связанного с миоглобином, во время максимального теста с возрастающей нагрузкой в т. gracilis у собаки методом криомикроспектроскопии. Среднее парциальное давление кислорода, связанного с миоглобином, при работе на уровне МПК значительно выше критического и составляет 5,5 мм рт. ст., при этом не удается обнаружить связь между ПК мышцей или средним парциальным давлением кислорода в волокне и концентрацией лактата в мышце или суммарным выходом лактата из мышцы.
Сходные результаты получены при измерении внутримышечного парциального давления кислорода во время максимального теста с повышающейся нагрузкой (50-100% от пикового ПК) у тренированных велосипедистов в условиях in vivo при разгибании ноги в коленном суставе. Исследователи получили достаточно неожиданный результат. Оказалось, что парциальное давление кислорода в миоглобине не изменяется на протяжении всего теста с возрастающей нагрузкой (50—100% от пикового ПК) вплоть до отказа от работы. Среднее парциальное давление кислорода, связанного с миоглобином, составляет 3,1 мм рт. ст. Любопытно, при работе в гипоксических условиях (F,02—0,12) парциальное давление кислорода, связанного с миоглобином, оказывается достоверно ниже, чем в нормоксии и составляет 2,1 мм рт. ст. Оно также не изменяется во всем диапазоне нагрузок (50~100% от пикового ПК). При этом потребление кислорода тканями рабочей ноги, измеренное с помощью прямого метода (по Фику), линейно растет вплоть до отказа от работы, как в гипоксических, так и в нормоксических условиях.
Таким образом, даже при гипоксии во время максимальной нагрузки парциальное давление кислорода в миоглобине не падает ниже критического уровня. Однако при этом наблюдается увеличение скорости суммарного выхода лактата из рабочей мышцы, измеренное с помощью прямого метода. Причем работа в условиях гипоксии приводила к значительно более интенсивному выходу лактата (относительно нормированной мощности работы), чем работа в нормоксических условиях. На основании этих данных можно сделать вывод о том, что парциальное напряжение кислорода в активной мышечной клетке не является ключевым фактором, активирующим гликолиз. В то же время опыты с гипоксией дают основание полагать, что парциальное давление кислорода в цитоплазме может модулировать активность гликолиза. Увеличение суммарного выхода лактата из мышцы, как в условиях нормоксии, так и в условиях гипоксии, регулируется, главным образом, активацией симпато-адреналовой системы. Это подтверждается сходной динамикой концентрации адреналина в артериальной крови и суммарного выхода лактата из рабочей мышцы. Влияние симпато-адреналовой системы на гликолиз подтверждается и рядом других работ, в которых исследовали изменения концентрации катехоламинов во время нагрузки, а также опытами с применением бета-блокаторов.
Среди других возможных кандидатов на роль активаторов гликолиза выделяют: АДФ, АМФ, неорганический фосфат, отношение креатин/фосфокреатин и цитоплазматический окислительно-востановительный потенциал (НАДН+/НАД+).
Суммируя результаты описанных исследований, можно сказать, что парциальное давление кислорода в цитоплазме мышечной клетки не опускается до критичного уровня даже при работе максимальной аэробной мощности. Это означает, что активность гликолиза в мышечном волокне во время работы не зависит от скорости аэробного ресинтеза АТФ или, по крайней мере, зависит не только от нее.
Главные метаболические пути глюкозы и их нарушение
Основной путь обмена глюкозы — гликолиз. В печени главная цель гликолиза — продукция пирувата, который превращается в ацетил-КоА, субстрат биосинтеза жирных кислот. В остальных органах и тканях гликолиз генерирует энергию благодаря тому, что в аэробных условиях пируват превращается в ацетил-КоА, окисление которого в митохондриях до Н20 и С02 сопряжено с синтезом АТФ.
В анаэробных условиях (эритроциты, белые мышцы — в них нет митохондрий) гликолиз является конечным процессом, а конечным продуктом — лактат. Превращение одной молекулы глюкозы в пируват или лактат ведет к образованию двух молекул АТФ. При дефиците кислорода преобладает анаэробный гликолиз с развитием гиперлакта- цидемии. Это наблюдается при снижении р02 (высотная болезнь), значительном уменьшении дыхательной поверхности легких (пневмония, отек легких, ателектаз), анемии, недостаточности кровообращения, ингибировании ферментов цикла Кребса (интоксикации, инфекции, авитаминозы). Накопление лактата снижает pH крови, что отражается на коллоидном состоянии белков и находит отражение в увеличении СОЭ. Определенная часть лактата, образующегося главным образом в мышцах и поступающего в кровь, ресинтезируется в печени в глюкозу и гликоген.
Метаболизм глюкозы начинается с необратимой гексокиназной или глюкокиназной реакции, в которой катализируется перенос фосфатной группы АТФ на глюкозу с образованием глюкозо-6-фосфата. Гек- сокиназа локализована в цитоплазматической мембране, цитоплазме и частично связана с митохондриями. В головном мозге активность этой фракции может достигать 50% суммарной активности фермента. Наиболее высокая активность гексокиназы отмечается в головном мозге и сердце.
Гексокиназная реакция служит не только пусковой, но и главной лимитирующей реакцией среди других реакций гликолиза. Гексокиназа обладает наименьшей активностью по сравнению с другими гликоли- тическими ферментами; эта реакция первично контролирует скорость всего гликолитического потока и сопрягает его отдельные реакции.
Гексокиназа представлена четырьмя изоферментами. Гексокиназа IV (глюкокиназа) содержится только в печени и поджелудочной железе. Глюкокиназа не ингибируется глюкозо-6-фосфатом, что и обеспечивает беспрепятственный синтез гликогена в печени при высокой концентрации глюкозы в воротной вене после еды. Роль панкреатической гексокиназы заключается в обеспечении адекватного метаболического сигнала к секреции инсулина в условиях избыточного содержания глюкозы в организме. Гексокиназа и глюкокиназа активируются глюкозой и АТФ, а глюкозо-6-фосфат как продукт реакции ингибирует только гек- сокиназу путем связывания с регуляторным центром. Избыток глюкозы снимает глюкозо-6-фосфатный блок, а неорганический фосфат препятствует активации процесса инактивации гексокиназы. Инсулин можно лишь условно отнести к активаторам гексокиназы и глюкокиназы, так как его действие проявляется только в присутствии глюкозы.
Ингибиторами гексокиназы и глюкокиназы служат АДФ, ацетил- КоА, глицеральдегид, фосфоенолпируват, цАМФ, глюкагон, адреналин, СТГ, АКТГ. Гексокиназа резко ингибируется при голодании и сахарном диабете.
Если гексокиназная реакция запускает гликолиз, то фосфофруктоки- наза является главным регулятором скорости гликолиза. Фосфофрукто- киназную реакцию активируют цАМФ, фруктозо-6-фосфат, фруктозо- 1,6-дифосфат, АМФ, АДФ и Фне0рг Максимальная скорость этой реакции отмечается при дефиците в клетке АТФ, но основным регулятором этого фермента является АМФ.
Пируваткиназа катализирует следующий этап расщепления глюкозы — перенос остатка фосфорной кислоты на АДФ с образованием АТФ и пирувата. Для функционирования этого фермента необходимы ионы магния и калия; последний в 10 раз повышает сродство фосфоенолпиру- вата к пируваткиназе. Ингибируют этот фермент АТФ и ионы кальция.
Включение глюкозы в пентозофосфатный цикл не играет роли в продукции энергии, но генерирует пентозофосфаты для синтеза РНК и ДНК и восстановительные эквиваленты для синтеза жирных кислот, который требует более НАДФ. Н, чем НАД. Н. Каждая молекула глюкозо-6- фосфата, превращаясь в рибулозо-5-фосфат, продуцирует две молекулы НАДФ. Н. Из рибулозо-5-фосфата образуется рибозо-5-фосфат — предшественник ДНК и РНК.
Пируват, образовавшийся в гликолизе, с помощью специфических переносчиков транспортируется в митохондрии, подвергается там действию пируватдегидрогеназы и дальнейшему окислению в цикле Кребса. Таким образом, пируватдегидрогеназная реакция соединяет происходящий в цитоплазме гликолиз с митохондриальными процессами окисления в цикле Кребса. Активируют этот фермент интермедиаты гликолиза и пируват, а ингибируют прямые продукты реакции: ацетил-КоА и НАДФ. Н, а также АТФ, как конечный продукт цикла Кребса.
Пируват — это главный продукт гликолиза. Он может обмениваться различными путями, приводящими к образованию глюкозы, липидов, белков и продукции энергии. Две молекулы пирувата в аэробных условиях продуцируют 30 молекул АТФ в дополнение к 6—8 молекулам АТФ, генерируемым в процессе гликолиза с учетом митохондриального окисления гликолитического НАДФ. Н.
Продукция АТФ в процессе окисления пирувата — основной источник энергии для таких тканей, как головной мозг, сердце, красные скелетные мышцы и в меньшей степени для коркового слоя почек. В эритроцитах, мозговом слое почек и белых скелетных мышцах, где нет митохондрий или их очень мало, пируват прямо восстанавливается в лактат, который диффундирует затем в венозную систему и транспортируется в печень и другие ткани для дальнейшего метаболизма.
Для непрерывного функционирования гликолиза и цикла Кребса глюкоза должна постоянно поставляться тканям организма. Это достигается жестко регламентированным уровнем гликемии. Постоянный уровень гликемии достигается за счет гидролиза глюкозо-6-фосфата, который образуется главным образом в печени в процессе гликогено- лиза или глюконеогенеза. Перенос глюкозы из внеклеточной среды в клетки осуществляется путем пассивного транспорта или облегченной диффузии с помощью локализованных в мембране переносчиков. Например, в эритроцитах таким переносчиком глюкозы служит белок с молекулярной массой 55 кД и относительно высоким содержанием липидов и углеводов.
В жировой ткани транспорт глюкозы связан с двумя гликопротеинами с молекулярной массой 78 и 94 кД. В головном мозге и сетчатке, кроме мембранных переносчиков, существует система специфических переносчиков глюкозы через гематоэнцефалический барьер. И этот транспорт лимитирует утилизацию глюкозы клетками, так как в отсутствие инсулина поток переносимой глюкозы всегда меньше скорости фосфорилирования глюкозы. Равновесие между скоростью транспорта и фосфорилированием глюкозы наступает только при больших концентрациях глюкозы (22—30 ммоль/л).
В мышечной и некоторых других тканях транспорт глюкозы усиливают гипоксия, ингибиторы энергетического обмена, салицилаты, трипсин, фосфолипиды, физические нагрузки. При гипоксии утилизация глюкозы усиливается за счет повышения транспорта и фосфорилирования глюкозы. Тормозят транспорт глюкозы Na+, полиеновые антибиотики, фосфолипиды. Таким образом, многие факторы подобно инсулину обладают стимулирующим действием на транспорт глюкозы через цитоплазматические мембраны. Ионы калия блокируют перенос глюкозы и ингибируют гликогенез и стимулируют гликолиз.
Гликолиз
Антигипоксанты и антиоксиданты в кардиологической практике
Для цитирования: Шилов А.М. Антигипоксанты и антиоксиданты в кардиологической практике. РМЖ. 2004;2:112.
ММА имени И.М. Сеченова
К лючевая роль тромбоза артерий сердца в формировании острого коронарного синдрома, вплоть до развития острого инфаркта миокарда (ОИМ), в настоящее время постулирована. На смену традиционно сложившейся консервативной терапии коронарной патологии, направленной на предотвращение осложнений: опасных нарушений ритма, острой сердечной недостаточности (ОСН), ограничение зоны повреждения миокарда (путем усиления коллатерального кровотока), в клиническую практику внедрены радикальные методы лечения – реканализация ветвей коронарных артерий путем как фармакологического воздействия (тромболитические средства), так и инвазивного вмешательства – чрескожная транслюминальная балонная или лазерная ангиопластика с установкой стента(ов) или без нее.
Накопленный клинический и экспериментальный опыт указывают, что восстановление коронарного кровотока – «обоюдоострый меч», т.е. в 30% и более развивается «синдром реперфузии», манифестирующий дополнительным повреждением миокарда, вследствие неспособности энергетической системы кардиомиоцита утилизировать «нахлынувшее» поступление кислорода. В результате этого увеличивается образование свободно–радикальных, активных форм кислорода (АК), способствующих повреждению липидов мембран – перекисное окисление липидов (ПОЛ), дополнительному повреждению функционально важных белков, в частности, цитохромной дыхательной цепи и миоглобина, нуклеиновых кислот и других структур кардиомиоцитов [1,7,11]. Такова упрощенная модель постперфузионного метаболического круга развития и прогрессирования ишемического повреждения миокарда. В связи с этим в настоящее время разработаны и активно внедряются в клиническую практику фармакологические препараты противоишемической (антигипоксанты) и антиоксидной (антиоксиданты) защиты миокарда [4,8,10,12,13].
Антигипоксанты – препараты, способствующие улучшению утилизации организмом кислорода и снижению потребности в нем органов и тканей, суммарно повышающие устойчивость к гипоксии. В настоящее время наиболее изучена антигипоксическая и антиоксидантная роль Актовегина (Nycomed) в клинической практике лечения различных ургентных состояний ССС.
Актовегин – высокоочищенный гемодиализат, получаемый методом ультрафильтрации из крови телят, содержащий аминокислоты, олигопептиды, нуклеозиды, промежуточные продукты углеводного и жирового обмена (олигосахариды, гликолипиды), электролиты (Mg, Na, Ca, P, K), микроэлементы (Si, Cu).
Основой фармакологического действия Актовегина является улучшение транспорта, утилизации глюкозы и поглощения кислорода:
– повышается обмен высокоэнергетических фосфатов (АТФ);
– активируются ферменты окислительного фосфорилирования (пируват– и сукцинатдегидрогеназы, цитохром С–оксидаза);
– повышается активность щелочной фосфатазы, ускоряется синтез углеводов и белков;
– увеличивается приток ионов К + в клетку, что сопровождается активацией калий–зависимых ферментов (каталаз, сахараз, глюкозидаз);
– ускоряется распад продуктов анаэробного гликолиза (лактата, b -гидроксибутирата).
Активные компоненты, входящие в состав Актовегина, оказывают инсулиноподобное действие. Олигосахариды Актовегина активируют транспорт глюкозы внутрь клетки, минуя рецепторы инсулина. Одновременно Актовегин модулирует активность внутриклеточных носителей глюкозы, что сопровождается интенсификацией липолиза. Что чрезвычайно важно – действие Актовегина инсулинонезависимое и сохраняется у пациентов с инсулинозависимым сахарным диабетом, способствует замедлению прогрессирования диабетической ангиопатии и восстановлению капиллярной сети за счет новообразования сосудов [2,9].
Улучшение микроциркуляции, которое наблюдается под действием Актовегина, видимо, связано с улучшением аэробного обмена сосудистого эндотелия, способствующего высвобождению простациклина и оксида азота (биологических вазодилататоров). Вазодилатация и снижение периферического сосудистого сопротивления являются вторичными по отношению к активации кислородного метаболизма сосудистой стенки.
Таким образом, антигипоксическое действие Актовегина суммируется через улучшение утилизации глюкозы, усвоение кислорода и снижение потребления миокардом кислорода в результате уменьшения периферического сопротивления.
Антиоксидантное действие Актовегина обусловлено наличием в этом препарате высокой супероксиддисмутазной активности, подтвержденной атомно–эмиссионной спектрометрией, наличием препаратов магния и микроэлементов, входящих в простетическую группу супероксиддисмутазы. Магний – обязательный участник синтеза клеточных пептидов, он входит в состав 13 металлопротеинов, более 300 ферментов, в том числе в состав глутатионсинтетазы, осуществляющей превращение глутамата в глутамин [9].
Накопленный клинический опыт отделений интенсивной терапии позволяет рекомендовать введение высоких доз Актовегина: от 800–1200 мг до 2–4 г. Внутривенное введение Актовегина целесообразно:
– для профилактики синдрома реперфузии у больных ОИМ, после проведения тромболитической терапии или балонной ангиопластики;
– больным при лечении различных видов шока;
– больным, переносящим остановку кровообращения и асфиксию;
– больным с тяжелой сердечной недостаточностью;
– больным с метаболическим синдромом Х.
Антиоксиданты – блокируют активацию свободнорадикальных процессов (образование АК) и перекисного окисления липидов (ПОЛ) клеточных мембран, имеющих место при развитии ОИМ, ишемического и геморрагического инсультов, острых нарушений регионального и общего кровообращения. Их действие реализуется через восстановление свободных радикалов в стабильную молекулярную форму, не способную участвовать в цепи аутоокисления. Антиоксиданты либо непосредственно связывают свободные радикалы (прямые антиоксиданты), либо стимулируют антиоксидантную систему тканей (непрямые антиоксиданты).
Энергостим – комбинированный препарат содержащий никотинамидадениндинуклеотид (НАД), цитохром С и инозин в соотношении: 0,5, 10 и 80 мг соответственно.
При ОИМ нарушения в системе энергетического обеспечения происходят в результате потери кардиомиоцитом НАД – кофермента дегидрогеназы гликолиза и цикла Кребса, цитохрома С – фермента цепи переноса электронов, с которым в митохондриях (Мх) сопряжен синтез АТФ через окислительное фосфорилирование. В свою очередь, выход цитохрома С из Мх ведет не только к развитию энергодефицита, но и способствует образованию свободных радикалов и прогрессированию оксидативного стресса, заканчивающихся гибелью клеток по механизму апоптоза. После внутривенного введения экзогенный НАД, проникая через сарколемму и мембраны Мх, ликвидирует дефицит цитозольного НАД, восстанавливает активность НАД–зависимых дегидрогеназ, участвующих в синтезе АТФ гликолитическим путем, способствует интенсификации транспорта цитозольного протона и электронов в дыхательной цепи Мх. В свою очередь, экзогенный цитохром С в Мх нормализует перенос электронов и протонов к цитохромоксидазе, что суммарно стимулирует АТФ–синтезирующую функцию окислительного фосфорилирования Мх. Однако ликвидация дефицита НАД и цитохрома С не нормализует полностью «конвейер» синтеза АТФ кардиомиоцита, так как не оказывает существенного влияния на содержание отдельных компонентов адениловых нуклеотидов, участвующих в дыхательной цепи клеток. Восстановление общего содержания адениловых нуклеотидов имеет место при введении инозина – метаболита, стимулирующего синтез адениловых нуклеотидов. Одновременно инозин усиливает коронарный кровоток, способствует доставке и утилизации кислорода в области микроциркуляции.
Таким образом, целесообразно комбинированное введение НАД, цитохрома С и инозина для эффективного воздействия на метаболические процессы в кардиомиоцитах, подвергнутых ишемическому стрессу.
Энергостим по механизму фармакологического воздействия на клеточный метаболизм имеет комбинированное влияние на органы и ткани: антоксидантное и антигипоксическое. За счет композитного состава Энергостим, по данным различных авторов, по эффективности лечения ИМ в составе традиционного лечения во много раз превосходит действие других признанных в мире антигипоксантов: в 2–2,5 раза оксибутират лития, рибоксин (инозин) и амитазол, в 3–4 раза – карнитин (милдронат), пирацетам, олифен и солкосерил, в 5–6 раз – цитохром С, асписол, убихинон и триметазидин [1,11]. Рекомендуемые дозы Энергостима в комплексной терапии ИМ: 110 мг (1 флакон) в 100 мл 5% глюкозы 2–3 раза в день в течение 4–5 дней. Все изложенное выше позволяет считать Энергостим препаратом выбора в комплексной терапии ИМ, для профилактики осложнений, являющихся следствием метаболических нарушений в кардиомиоцитах [1,3].
Коэнзим Q10 – витаминоподобное вещество, впервые было выделено в 1957 г. из митохондрий бычьего сердца американским ученым Ф. Крейном. К. Фолкерс в 1958 г. определил его структуру. Вторым официальным названием коэнзима Q10 является убихинон (вездесущий хинон), так как он содержится в различных концентрациях практически во всех тканях животного происхождения. В 60–х годах была показана роль Q10, как электронного переносчика в дыхательной цепи Мх. В 1978 г. П. Митчел предложил схему, объясняющую участие коэнзима Q10 как в электронном транспорте в митохондриях, так и в сопряжении процессов электронного транспорта и окислительного фосфорилирования, за что получил Нобелевскую премию [8].
Коэнзим Q10 эффективно защищает липиды биологических мембран и липопротеидные частицы крови (фосфолипиды – «мембранный клей») от разрушительных процессов перекисного окисления, предохраняет ДНК и белки организма от окислительной модификации в результате накопления активных форм кислорода (АК). Коэнзим Q10 синтезируется в организме из аминокислоты – тирозин при участии витаминов группы В и С, фолиевой и пантотеновой кислот, ряда микроэлементов. С возрастом биосинтез коэнзима Q10 прогрессивно снижается, а его расход при физических, эмоциональных нагрузках, в патогенезе различных заболеваний и окислительном стрессе возрастает [5].
Более чем 20–летний опыт клинических исследований применения коэнзима Q10 у тысяч больных убедительно доказывают роль его дефицита в патологии ССС, что не удивительно, так как именно в клетках сердечной мышцы наиболее велики энергетические потребности. Защитная роль коэнзима Q10 обусловлена его участием в процессах энергетического метаболизма кардиомиоцита и антиоксидантными свойствами. Уникальность обсуждаемого препарата – в его регенеративной способности под действием ферментных систем организма. Это отличает коэнзим Q10 от других антиоксидантов, которые, выполняя свою функцию, необратимо окисляются сами, требуя дополнительного введения [6].
Первый положительный клинический опыт в кардиологии по применению коэнзима Q10 был получен при лечении больных с дилатационной кардиомиопатией и пролапсом митрального клапана: были получены убедительные данные в улучшении диастолической функции миокарда. Диастолическая функция кардиомиоцита – энергоемкий процесс и при различных патологических состояниях ССС потребляет до 50% и более всей энергии, содержащейся в АТФ, синтезируемого в клетке, что определяет ее сильную зависимость от уровня коэнзима Q10.
Клинические исследования последних десятилетий показали терапевтическую эффективность коэнзима Q10 в комплексном лечении ИБС, артериальной гипертонии, атеросклероза и синдрома хронической усталости. Накопленный клинический опыт позволяет рекомендовать применение Q10 не только в качестве эффективного препарата в комплексной терапии СС заболеваний, но и как средство их профилактики.
Профилактическая доза Q10 для взрослых – 15 мг/сутки, лечебные дозы 30–150 мг/сутки, а в случаях интенсивной терапии – до 300–500 мг/сутки. Следует принять во внимание, что высокие лечебные дозы при оральном приеме коэнзима Q10 связаны с трудностью усвоения жирорастворимых веществ, поэтому в настоящее время для улучшения биодоступности создана водорастворимая форма убихинона.
Экспериментальные исследования показали профилактический и лечебный эффект коэнзима Q10 при реперфузионном синдроме, документируемые сохранением субклеточных структур кардиомиоцитов, подвергнутых ишемическому стрессу, и функции окислительного фосфорилирования Мх [5,6].
Клинический опыт применения коэнзима Q10 пока ограничен лечением детей с хроническими тахиаритмиями, синдромом удлиненного интервала QT, кардиомиопатиями, синдромом слабости синусового узла [14].
Таким образом, четкое представление о патофизиологических механизмах повреждения клеток тканей и органов, подвергнутых ишемическому стрессу, в основе которых лежат метаболические нарушения – перекисное окисление липидов, имеющих место при различных СС заболеваниях, диктуют необходимость включения антиоксидантов и антигипоксантов в комплексную терапию ургентных состояний.
1. Андриадзе Н.А., Сукоян Г.В., Отаришвили Н.О и др. Антигипоксант прямого действия энергостим в лечении ОИМ. Росс. Мед. Вести,2001,№2, 31–42.
2. Бояринов А.П., Пенкнович А.А., Мухина Н.В. Метаболические эффекты нейротропного действия актовегина в условиях гипоксии. Актовегин. Новые аспекты клинического применения. М., 2002, 10–14.
3. Джанашия П.Х., Проценко Е.А., Сороколетов С.М. Энергостим в лечении хронических форм ИБС. Росс. Кард. Ж., 1988,№5, 14–19.
4. Закирова А.Н. Корреляционные связи перикисного окисления липидов, антиоксидантной защиты и микрореологических нарушений в развитии ИБС. Тер.архив, 1966,№3, 37–40.
5. Капелько В.И., Рууге Э.К. Исследование действия коэнзима Q10 (убихинона) при ишемии и реперфузии сердца. Применение антиоксидантного препарата кудесан (коэнзим Q 10 с витамином Е) в кардиологии. М., 2002. 8–14.
6. Капелько В.И., Рууге Э.К. Исследования действия Кудесана при повреждении сердечной мышцы, вызванной стрессом. Применение антиоксидантного препарата кудесан (коэнзим Q10 c витамином Е) в кардиологии. М., 2002, 15–22.
7. Коган А.Х., Кудрин А.Н., Кактурский Л.В. и др. Свободнорадикальные перикисные механизмы патогенеза ишемии и ИМ и их фармакологическая регуляция. Патофизиология, 1992, №2, 5–15.
8. Коровина Н.А., Рууге Э.К. Использование коэнзима Q10 в профилактике и лечении. Применение антиоксидантного препарата кудесан (коэнзим Q10 с витамином Е) в кардиологии. М.,2002, 3–7.
9. Нордвик Б. Механизм действия и клиническое применение препарата актовегина. Актовегин. Новые аспекты клинического применения. М., 2002, 18–24.
10. Румянцева С.А. Фармакологическая характеристика и механизм действия актовегина. Актовегин. Новые аспекты клинического применения . М.,2002, 3–9.
11. Слепнева Л.В. Алексеева Н.И., Кривцова И.М. Острая ишемия органов и ранние постишемические расстройства. М., 1978, 468–469.
12. Смирнов А.В., Криворучка Б.И. Антигипоксанты в неотложной медицине. Анест. И реаниматол., 1998, №2, 50–57.
13. Шабалин А.В., Никитин Ю.П. Защита кардиомиоцита. Современное состояние и перспективы. Кардиология, 1999, №3, 4–10.
14. Школьникова М.А. Отчет Ассоциации детских кардиологов России по применению Кудесана. Применение антиоксидантного препарата кудесан (коэнзим Q10 с витамином Е) в кардиологии. М., 2002, 23.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Молекулярная регуляция метаболизма и клеточного цикла
Лактат с точки зрения классической биохимии является продуктом гликолиза – метаболического пути, состоящего из 10 стадий, катализируемых ферментами, находящимися в цитозоле клеток, где происходит окисление глюкозы без потребления кислорода, т. е. в анаэробных условиях. На последнем этапе гликолиза пируват восстанавливается до лактата с помощью фермента лактатдегидрогеназы (ЛДГ), а кофермент никотинамидадениндинуклеотид (NADH+H + ) окисляется до NAD + . При этом происходит выделение 2 молей аденозинтрифосфорной кислоты (АТФ), которая является основным источником энергии и используется клетками как топливо. В аэробных условиях пируват диффундирует в митохондрии клетки и через цикл Кребса продуцирует дополнительно 36 молей АТФ. В клетках, которые не содержат митохондрий (например, эритроциты), пируват под действием ЛДГ превращается в лактат, который перемещается из клеток и транспортируется в другие ткани (Рис.1). Около половины образовавшегося лактата конвертируется в глюкозу (глюконеогенез), а половина окисляется до пирувата и далее метаболизируется по пути аэробного гликолиза. Обмен лактата и глюкозы между мышцами и печенью известен как цикл Кори или глюкозо-лактатный цикл.
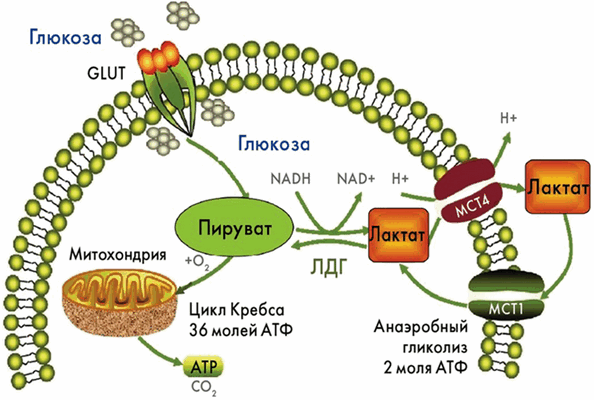
Рис. 1 Метаболизм глюкозы до лактата. GLUT – транспортер глюкозы, MCT - монокарбоксилатный транспортер.
Еще несколько десятилетий назад о лактате говорили, как о продукте незавершенного катаболизма при недостатке О2, «метаболите усталости» и «тупиковом» метаболите, сегодня же лактат воспринимается не только как участник важнейших метаболических путей, но и как сигнальная молекула. В некоторых источниках он даже получил название «лактормона» за свои способности вызывать адаптивные перестройки метаболизма в организме [1] .
Сегодня известно, что образование лактата непрерывно происходит в аэробных условиях [G.A.Brooks, 2018] [2] .
Согласно современным представлениям, лактат выполняет по крайней мере три важнейшие функции (Рис. 2):
· служит источником энергии;
· является субстратом глюконеогенеза;
· служит сигнальной молекулой.
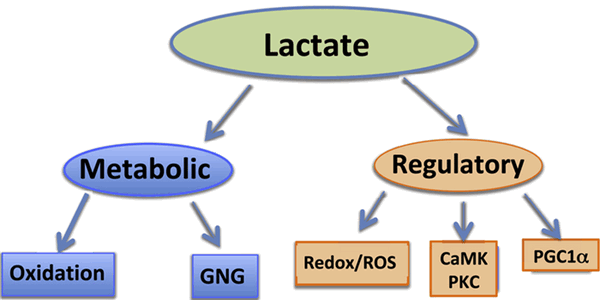
Рис. 2 Современные представления о функциях лактата.
Содержание лактата в крови отражает равновесие между его образованием, утилизацией и выведением. В норме концентрация этого аниона в венозной крови в спокойном состоянии не превышает 2 ммоль/л. Лактат образуется мышцами (25%), кожей (25%), головным мозгом (25%), кишечником (10%) и клетками крови (20%), в основном эритроцитами, поскольку в них не содержатся митохондрии.
Общее количество синтезированного лактата в сутки составляет порядка 1500 ммоль. Клиренс этого соединения осуществляется печенью (60%), почками (30%) и некоторыми другими органами, например, сердечной и скелетной мышечной тканями. До достижения порога переполнения в проксимальных почечных канальцах происходит реабсорбция лактата, в виду того, что он является важным энергетическим субстратом. По достижении порога концентрации 5-6 ммоль/л, лактат начинает экскретироваться с мочой [3] . Поэтому любые нарушения функции печени и почек приводят к изменению клиренса лактата.
Смене концепции понимания роли лактата способствовал ряд работ, посвященных изучению внутри- и межклеточных систем переноса этого соединения.
Лактат переносится через плазматическую мембрану при помощи монокарбоксилатных транспортеров (MCTs), которые относятся к генному семейству SLC16, в котором на сегодняшний день насчитывается 14 членов.
Данные белки представляют собой мембранные белки с 12 трансмембранными доменами, внутриклеточными N и C терминальными концами и большой цитозольной петлей между трансмембранными доменами 6 и 7.
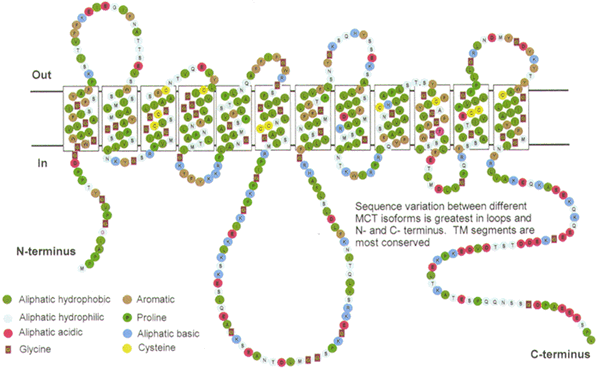
Рис. 3 Строение монокарбоксилатных транспортеров (MCTs).
Из всего семейства данных белков наиболее хорошо изучены представители MCT 1-4. MCT 1, преобладающая изоформа в большинстве тканей, тогда как в других клетках, таких как белые мышцы, MCT 4 является основным транспортером.
Различные изоформы этих белков-переносчиков отличаются сродством к субстратам (лактат, пируват, ацетоацетат, β-гидроксибутират), и имеют специфичное представительство в клетках и тканях.
MCT-1 экспрессируется в равной степени всеми тканями организма и обладает умеренным сродством к своим субстратам (Km lactate=3,5-10 мМ). Цикл переноса лактата этим транспортером включает следующие стадии:
· конформационные перестройки, во время которых лактат и H + проходят через внутриклеточный и внеклеточный сайты связывания,
· отсоединение лактата и затем отсоединение H +.
За одну секунду возможно осуществление порядка 12 таких циклов.
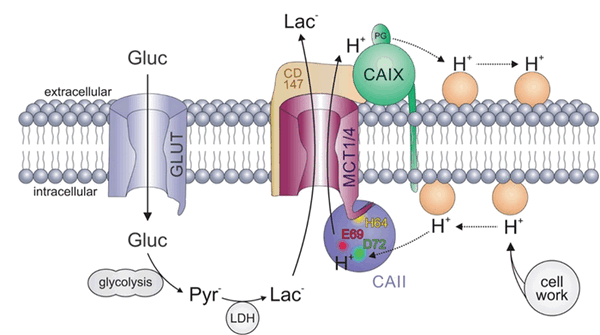
Рис. 4 Транспорт лактата и протонов водорода через мембрану.
MCT2 – высоко аффинный транспортер (Km lactate=0,5 мМ), экспрессируется в тканях, активно использующих лактат в качестве энергетического субстрата: головной мозг, сердце, почки, печень, красные мышечные волокна поперечно-полосатой мышечной ткани. Основная функция данного транспортера – импорт лактата внутрь клетки.
Переносчик MCT3 мало изучен (Km lactate=6,0 mM).
MCT4 проявляет слабое сродство к субстрату (Km lactate=22,0 mM), экспрессируется в тканях с высоким уровнем гликолитических процессов (белые мышечные волокна поперечно-полосатой мышечной ткани, лейкоциты, астроциты) и выполняет, главным образом, функцию выделения лактата из клетки. Основным регуляторным механизмом, идентифицированным для экспрессии MCT 4, является гипоксия, и это согласуется с предполагаемой ролью этой изоформы в экспорте молочной кислоты, полученной в результате гликолиза.
Были определены и выделены два якорных белка, входящих в состав этих транспортеров: базиджин (CD147, basigin), необходимый для поддержания потока веществ через плазматическую мембрану и регуляции челночной активности в белковых транспортерах MCT 1,3,4 и эмбиджин (embigin), играющий важную роль в регуляции экспрессии MCT2 [4] .
Трансмембранный гликопротеин CD147 обладает широким диапазоном функций в здоровых тканях человека и при многих заболеваниях, в том числе при канцерогенезе. Показано, что этот белок играет ключевую роль в пролиферации, миграции и инвазивности опухолевых клеток, что может отражать его участие в активации внеклеточных металлопротеиназ.
Интересно, что CD147 также был вовлечен в сигнальные пути при воспалении и в качестве рецептора для вирусов, в том числе для ВИЧ. Неизвестно, связаны ли эти взаимодействия с изменениями активности MCT 1.
Существование изоформ MCT почти во всех тканях позволяет, образовавшиеся в одной ткани лактат, пируват и кетоновые тела, использовать в другой.
Поглощение лактата митохондриями и пируват-лактатный обмен в пероксисомах являются примерами внутриклеточных лактатных челноков. Митохондриальный транспортер лактат-пируват работает в сочетании с митохондриальной лактатдегидрогеназой, которая позволяет лактату окисляться в активно дышащих клетках (Рис.5). Монокарбоксилатные транспортеры переносят и пируват, и лактат, однако из-за высокой концентрации лактата, он будет основной монокарбоновой кислотой, транспортируемой к митохондрии, где МСТ1 перенесет ее через внутримитохондриальную мембрану. MCT1 вставлен во внутреннюю мембрану митохондрий, где тесно связан с CD147, c цитохромоксидазой и с митохондриальной ЛДГ (mLDH). Митохондриальная ЛДГ (mLDH) сосредоточена на наружной стороне внутренней мембраны митохондрий и ассоциирована с цитохромсоксидазой (COX).
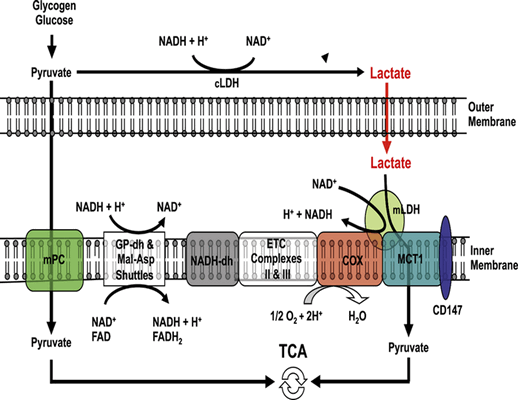
Рис. 5 Схема, демонстрирующая предполагаемый комплекс окисления лактата митохондрий.
Изоферменты лактатдегидрогеназы ( LDH ) зависят от типа ткани: LDH -1 был преобладающей формой в митохондриях миокарда, LDH-5 был преобладающим в митохондриях печени. Очевидно, что различие в изоферментах зависит от дальнейшего превращения лактата: в печени он используется для глюконеогенеза, тогда как в миокарде это будет окисление.
После окисления лактата до пирувата он подвергается окислительному декарбоксилированию, с образованием ацетил КоА, который может участвовать в цикле трикарбоновых кислот и окислительном фосфорилировании. Потребление лактата составляет 10-15% метаболизма сердечной мышцы в покое и до 30% во время физической нагрузки средней интенсивности.
Взаимное преобразование лактата и пирувата между клеточными компартментами играет ключевую роль в энергетическом метаболизме клетки.
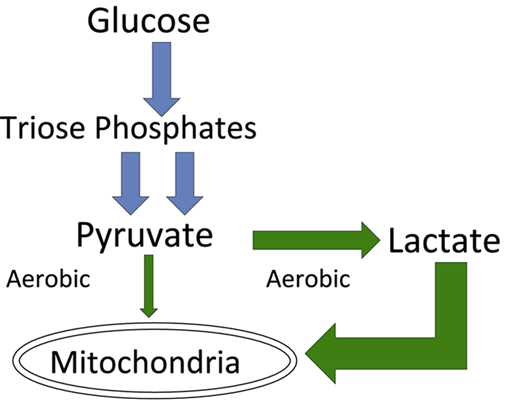
Рис. 6 Лактатный челнок
Движение молочной кислоты между клетками и межклеточным веществом происходит благодаря существованию механизма межклеточного лактатного шунта.
В дополнение к циклу Кори молочнокислая гипотеза шаттла предлагает дополнительные функции лактата во многих тканях.
Следует иметь в виду, что глюконеогенез возможен только в печени, почках и эпителии кишечника, имеющих соответствующие ферменты, все другие ткани используют лактат как источник энергии даже при достаточном поступлении кислорода. Данный метаболит окисляется везде, где есть митохондрии. При этом молочная кислота выступает в качестве энергетического субстрата, прежде всего, для сердечной мышцы. Лактат любимый субстрат сердца. Переход миокарда с главных энергетических субстратов к лактату может сохранить или даже улучшить функционирование сердечной мышцы. Таким образом, усиленное образование молочной кислоты можно рассматривать как адаптивное явление, нацеленное на противодействие энергетическому кризису, а все клетки можно разделить на лактат продуцирующие и лактат потребляющие.
Примером такого сотрудничества являются клетки мозга. Метаболизм в мозге считается практически полностью окислительным. Однако, клетки мозга разнообразны по своему строению, и можно ожидать наличие разных метаболических систем в этих клетках. Так, один из современных взглядов на проблему заключается в том, что нейроны почти полностью окислительные в плане метаболизма, а глиальные клетки, в особенности астроциты и олигодендроциты, метаболизируют глюкозу преимущественно гликолитическими путями – значит, они производят лактат и пируват из глюкозы. Кроме того, астроциты экспрессируют MCT4, функция которого - экспорт лактата, полученного в результате гликолиза. С другой стороны, нейроны экспрессируют MCT2, транспортер с высоким сродством к лактату. Эти данные предполагают, что астроциты производят лактат, который используется нейронами в качестве топлива. Исследования показали, что в состоянии покоя в головном мозге примерно 10% энергии обеспечивается лактатом, при концентрации его в плазме крови около 1 ммоль/л. Однако, вклад лактата существенно увеличивается, когда его концентрация в плазме крови возрастает, например, при интенсивной физической нагрузке. При этом лактат может быть важным субстратом, обеспечивая до 60% энергетической потребности головного мозга при базальном уровне лактата в плазме 5,0 ммоль/л
Почему астроциты производят лактат? Одной из гипотез является фосфорилирование фермента пируватдегидрогеназы, который из-за этого теряет свою активность, а клетки начинают использовать путь аэробного гликолиза. Вторая гипотеза основывается на различии в строении митохондриального комплекса: в астроцитах этот комплекс не сопряжён с дыхательной цепью, что ведёт к низкой дыхательной активности митохондрий. Таким образом, лактат обеспечивает мозгу альтернативный источник питания, когда глюкозы не хватает.
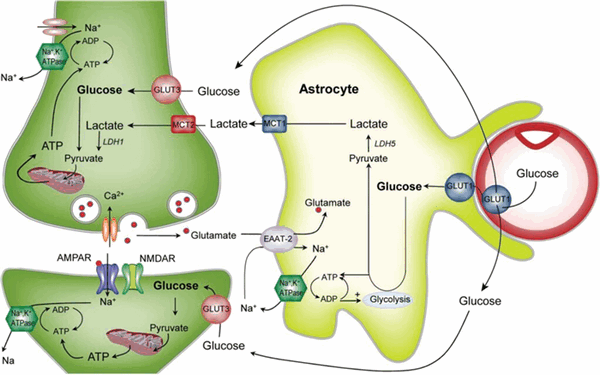
Рис. 7 Компартментализация метаболизма в нейронах и глии.
Другим примером симбиоза являются раковые клетки.
Раковые клетки существенно отличаются от нормальных клеток по интенсивности основных метаболических процессов. Аэробный гликолиз, о котором 90 лет назад впервые сообщил известный биохимик Отто Варбург, представляет собой наиболее яркую метаболическую черту раковых клеток.
Имеются также данные о перемещении лактата в некоторых опухолях, где гипоксический центр опухоли является гликолитическим и продуцирует молочную кислоту, которая экспортируется MCT 4 и поглощается периферическими опухолевыми клетками, которые являются более окислительными и экспрессируют MCT 1.
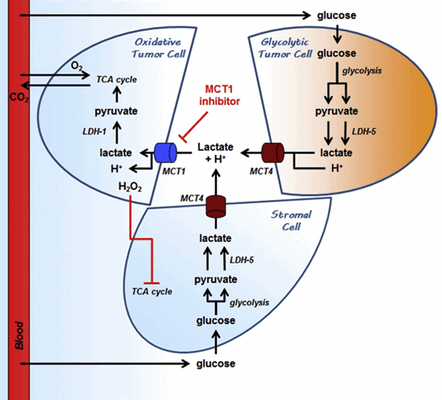
Рис.8 Межклеточный лактатный челнок в раковых клетках.
На рисунке изображен кровеносный сосуд, питающий опухоль, доставляющий глюкозу и кислород к раковым клеткам. Окислительная раковая клетка представлена рядом с кровеносным сосудом, гипоксические раковые клетки - удаленно, а клетка-хозяин - внизу. С метаболической точки зрения у гипоксической раковой клетки нет другого выбора, кроме как выполнять анаэробный гликолиз, чтобы выжить, что подразумевает доступ к большому количеству глюкозы. Для сравнения, окислительная раковая клетка может использовать несколько различных вариантов топлива. Когда близлежащие гликолитические клетки вырабатывают лактат окислительные клетки используют его в качестве топлива.
Как отмечалось выше, гликолитические клетки экспрессируют в основном MCT 4, функция которого выведение лактата из клетки, тогда как окислительные клетки экспрессируют в основном MCT 1 (вместе с MCT 2 у некоторых видов), которые отвечают за транспорт лактата внутрь клетки.
Это увеличивает доступность глюкозы для гликолитической раковой клетки.
Окислительная раковая клетка может получить дополнительный лактат, вынуждая клетку-хозяина принять гликолитический метаболизм. Когда лактат недоступен или, когда МСТ ингибированы, окислительная раковая клетка переключается на метаболизм, основанный на глюкозе, тем самым лишая другие клетки этого важного ресурса, что в конечном итоге убивает гипоксическую раковую клетку. Таким образом, ингибиторы MCT1 и MCT4 могут разрушать как метаболический симбиоз, так и комменсализм, основанный на обмене лактата при раке.
Другими важными чертами изменения метаболизма в раковых клетках является активное использование глутамина и синтез высших жирных кислот. Хотя эти метаболические различия между нормальными и раковыми клетками и не абсолютны, они могут служить биохимической основой для разработки новых противоопухолевых лекарственных средств. Ингибирование гликолиза, вмешательство в метаболизм глутамина и процесс синтеза жирных кислот это три возможных подхода в противоопухолевой терапии.
Развитие терапии рака является актуальной задачей современной науки. Растущее знание о метаболизме раковых клеток дает новые интересные подсказки относительно метаболического таргетирования лечения и поиска новых препаратов, ингибирующих рост рака.
Читайте также:
- Гипотензия при острой сердечной недостаточности. Перегрузка объемом при сердечной недостаточности
- Психофармакотерапия - принципы, побочные эффекты
- Моторная денервация нижнечелюстного нерва - лучевая диагностика
- Симптомы и признаки рака (злокачественных новообразований)
- Рентгенографические плотности органов грудной клетки
