Наследственные атрофии зрительного нерва при неврологических и системных болезнях
Добавил пользователь Евгений Кузнецов Обновлено: 16.01.2026
Наследственные атрофии зрительного нерва при неврологических и системных болезнях
а) Аутосомно-доминантная атрофия зрительного нерва и сенсоневральная тугоухость. Описано несколько семей с аутосомно-доминантной атрофией зрительного нерва, сочетающейся с глухотой. Во многих из этих семей не наблюдается других системных или неврологических аномалий. В некоторых, но не во всех этих семьях было выявлено носительство мутаций гена ОРА1, которые в других семьях вызывают изолированную нейрооптикопатию. В одной итальянской семье был идентифицирован новый локус хромосомы 16 (16q21-q22), обозначенный ОРА8, предварительные исследования указывают на то, что в патогенезе также может играть роль митохондриальная дисфункция.
В голландской семье, наследующей доминантную атрофию зрительного нерва и глухоту, мутации ОРА1 были исключены, но была выявлена ранее неизвестная миссенс-мутация гена WFS1 хромосомы 4 (4р16.1), в локусе, мутации которого обычно вызывают аутосомно-рецессивный DIDMOAD-синдром, он же синдром Wolfram, характеризующийся синдромальной нейрооптикопатией, сахарным диабетом, несахарным диабетом и тугоухостью. Аналогично в другой семье, наследующей доминантную атрофию зрительного нерва с тугоухостью и нарушением регуляции глюкозы, при анализе мутаций были исключены мутации генов ОРА1, ОРАЗ, ОРА4 и ОРА5, но была выявлена новая миссенс-мутация гена WFS1 (синдрома Wolfram).
В других семьях доминантной атрофии зрительного нерва и глухоте сопутствовали атаксия, слабость конечностей или полинейропатия. Может встречаться тяжелое ухудшение слуха при рождении и задержка речевого развития, или же умеренная медленно прогрессирующая тугоухость. Была предложена аббревиатура CAPOS (cerebellar ataxia, areflexia, pes cavus, optic atrophy, sensorineural deafness — мозжечковая атаксия, арефлексия, полая стопа, сенсоневральная тугоухость), но данная нозология все еще генетически не определена. Возможно, во многих из этих семей наследуемые сложные синдромы являются формами «доминантной атрофии зрительного нерва плюс», вызванной мутациями OРА1, но ясно, что синдромальное сочетание доминантной атрофии зрительного нерва и тугоухости является генетически гетерогенной группой состояний.
б) Аутосомно-доминантная атрофия зрительного нерва, глухота, офтальмоплегия и миопатия. Сочетание аутосомно-доминантной атрофии зрительного нерва, глухоты, птоза, офтальмоплегии, дистаксии и миопатии должно вызывать подозрение о наличии «доминантной атрофии зрительного нерва плюс» и является показанием для анализа на мутации гена ОРА1 хромосомы 3. Ухудшение зрения обычно начинается в первом десятилетии жизни и прогрессирует до значений от 20/30 до 20/400, главным образом вследствие нейрооптикопатии, но также могут выявляться аномалии на электроретинограмме. Сенсоневральная тугоухость манифестирует в первом или втором десятилетии жизни и прогрессирует.
Офтальмоплегия и миопатия развиваются в среднем возрасте. Эта патология представляет собой митохондриальное заболевание, развивающееся вследствие ядерных генетических аномалий.
в) Аутосомно-доминантная атрофия зрительного нерва с рано развивающейся катарактой. В двух семьях из Франции наблюдалось наследуемое по аутосомно-доминантному типу сочетание атрофии зрительного нерва и рано развивающейся катаракты. Мутации гена ОРА1 были исключены, но были выявлены патогенные мутации гена ОРАЗ хромосомы 19 (19q13.2-q13.3), локус этих мутаций обычно вызывает синдром Costeff, синдромальную нейрооптикопатию, наследуемую по аутосомно-рецессивному типу. При скрининговых исследованиях на мутации ОРА3 по поводу моносимптомных доминантных атрофий зрительного нерва в различных семьях не удалось выявить какие-либо патогенные варианты ОРАЗ; вероятно, мутации ОРАЗ, вызывающие доминантную атрофию зрительного нерва, встречаются крайне редко.
г) Аутосомно-рецессивная атрофия зрительного нерва в сочетании с прогрессирующей нейродегенерацией и 3-метилглютакониковой ацидурией III типа (синдром Costeff). При этом аутосомно-рецессивном синдроме, чаще всего встречающемся в еврейских семьях Ирака, тяжелая атрофия зрительного нерва сопутствует экстрапирамидным расстройствам, когнитивным нарушениям, повышению в моче уровня 3-метилглютакониковой кислоты и повышению в плазме уровней 3-метилглютаровой кислоты. Вызывающий заболевание ген был локализован на хромосоме 19 (19q13.2—q13.3) и получил название ОРА3.
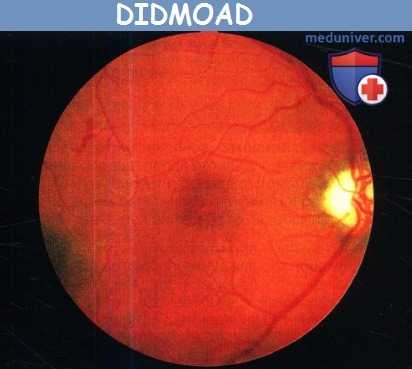
DIDMOAD. Диск зрительного нерва атрофичен,
видны ретинальные кровоизлияния, вызванные сахарным диабетом.
д) Аутосомно-рецессивная атрофия зрительного нерва в сочетании с ювенильным сахарным диабетом, несахарным диабетом и тугоухостью (синдром Wolfram). Этот синдром включает в себя ювенильный сахарный диабет и прогрессирующее ухудшение зрения на фоне атрофии зрительного нерва, почти всегда сопровождающихся несахарным диабетом, нейросенсорной тугоухостью или и тем, и другим (вследствие чего был предложен эпоним DIDMOAD — diabetes insipidus, diabetes mellitus, optic atrophy, deafness, т. e. несахарный диабет, сахарный диабет, атрофия зрительного нерва, глухота).
Сахарный диабет развивается в течение первого или второго десятилетия жизни и обычно предшествует развитию атрофии зрительного нерва. Однако у нескольких пациентов атрофия зрительного нерва и ухудшение зрения являлись первыми проявлениями синдрома. На ранних стадиях заболевания острота зрения может оставаться нормальной, несмотря на легкую дисхроматопсию и атрофию зрительного нерва. На поздних стадиях развивается тяжелое ухудшение зрения. При периметрии выявляются генерализованное сужение и центральные скотомы поля зрения. Всегда развивается тяжелая атрофия зрительного нерва, может наблюдаться маленькая или средних размеров экскавация ДЗН. И ухудшение слуха, и несахарный диабет дебютируют в первом или во втором десятилетии жизни и могут протекать в очень тяжелой форме. У половины пациентов присутствует атония мочевыводящих путей, сопровождающаяся рецидивирующими инфекциями мочевых путей, нейрогенным недержанием и даже смертельными осложнениями.
Другие системные и неврологические нарушения включают в себя атаксию, осевую ригидность, судороги, стартл-миоклонус, тремор, нарушение моторики желудочно-кишечного тракта, нарушение вестибулярных функций, центральное апноэ, нейрогенный коллапс верхних дыхательных путей, птоз, катаракту, пигментную ретинопатию, ирит, снижение слезопродукции, зрачки Adie, офтальмоплегию, недостаточность конвергенции, паралич вертикального взора, нистагм, умственную отсталость, психиатрические нарушения, маленький рост, первичную гонадную атрофию, другие эндокринные аномалии, аносмию, мегалобластную и сидеробластную анемию, аномалии при электроретинографии и повышение содержания белка в цереброспинальной жидкости. При лучевых исследованиях и на вскрытии у некоторых пациентов выявляются обширные атрофические изменения и мальформации развития коры, что указывает на диффузное нейродегенеративное расстройство с преимущественным поражением среднего мозга и моста. Если синдром сопровождается анемией, терапия тиамином может облегчить анемию и снизить потребность в инсулине.
В нескольких семьях методом анализа сцепления удалось локализовать ген синдрома Wolfram на хромосоме 4 (4р16.1), который был обозначен как WFS1; были описаны точечные мутации и делеции этого гена. Продукт данного гена — вольфрамин — белок эндоплазматического ретикулума, участвующий в регуляции уровня внутриклеточного кальция. Идентифицирован второй вызывающий синдром Wolfram ген, локализованный на другом плече хромосомы 4 (4q22-24), он получил обозначение CISD2. У больных наблюдается повышенная кровоточивость и пептические язвы. Нокаут гена CISD2 у мышей вызывает развитие Wolfram-подобного синдрома, сопровождающегося преждевременным старением вследствие поражения митохондрий. В общем, многие из сопутствующих аномалий, описанных при синдроме Wolfram, обычно встречаются у пациентов с предположительно митохондриальной патологией, особенно у больных с синдромами хронической прогрессирующей наружной офтальмоплегии.
На основании этих данных было высказано предположение, что фенотип Wolfram, возможно, представляет собой не специфическую аномалию, а является проявлением различных патогенных ядерных или митохондриальных генетических дефектов, в конечном итоге запускающих общий механизм митохондриальной дисфункции. К тому же большинство случаев синдрома Wolfram классифицировались как спорадические или наследуемые по рецессивному типу, последний вывод делался на основании экспрессии синдрома у сиблингов (что, как сейчас известно, также соответствует и материнскому типу наследования).
е) Спастическая параплегия, атрофия зрительного нерва и нейропатия (синдром SPOAN — spastic paraplegia, optic atrophy, neuropathy). Аутосомно-рецессивное нейродегенеративное заболевание было описано клинически как сочетание непрогрессирующей врожденной атрофии зрительного нерва, дебютирующей в младенческом возрасте спастической параплегии, дебютирующего в детстве прогрессирующего поражения двигательных и чувствительных аксонов, дебютирующей в третьем десятилетии жизни дизартрией, выраженных слуховых стартл-реакций, прогрессирующих контрактур суставов и деформации позвоночника. Выявлено сцепление с хромосомой 11q13, но патогенный ген все еще не установлен.
ж) Врожденная мозжечковая атаксия, умственная отсталость, атрофия зрительного нерва и аномалии кожи (congenital cerebellar ataxia, mental retardation, optic atrophy, skin abnormalities— CAMOS). Непрогрессирующая аутосомно-рецессивная врожденная атаксия в сочетании с атрофией зрительного нерва, тяжелой умственной отсталостью и аномалиями строения кожи; заболевание сцеплено с локусом хромосомы 15 (15q24-q26), но патогенный ген все еще не выявлен.
з) Глухота, дистония и нейрооптикопатия (deafness, dystonia, optic neuropathy—DDON, синдром Mohr-Tranebjaerg). Это Х-сцепленное заболевание манифестирует в старшем детском возрасте сенсоневральной тугоухостью, дистонией и атаксией, после чего в возрасте около двадцати лет наблюдается атрофия зрительного нерва, а до пятидесяти лет развиваются снижение интеллекта и психиатрические нарушения. Прогноз для зрения неблагоприятный, большинство пациентов слепнут в возрасте около сорока лет. Причиной заболевания являются мутации гена TIMM8АХ-хромосомы (Xq22), продукт гена локализуется в межмембранном пространстве митохондрий. Было выявлено нарушение биохимических процессов в митохондриях.
и) Осложненная наследственная инфантильная атрофия зрительного нерва (синдром Behr). Описание синдрома Behr включает в себя манифестирующую в детстве атрофию зрительного нерва, в сочетании с различными нарушениями пирамидного тракта, атаксией, умственной отсталостью, недержанием мочи и полой стопой. Синдром обычно наследуется по аутосомно-рецессивному типу, поражаются представители обоего пола. Ухудшение зрения, от умеренного до тяжелого, обычно развивается в возрасте младше десяти лет, часто сопровождается нистагмом. В большинстве случаев по прошествии периода детства патология не прогрессирует. При лучевых исследованиях выявляются диффузные симметричные изменения белого вещества. У некоторых пациентов с синдромом Behr клиническая картина может напоминать проявления наследственной атаксии. Вероятно, синдром Behr является гетерогенным заболеванием, развивающимся вследствие различных этиологических, в том числе генетических, факторов.
к) Прогрессирующая энцефалопатия с отеком, гипсаритмия и атрофия зрительного нерва (синдром РЕНО — progressive encephalopathy with edema, hypsarrhythmia, optic atrophy). Описаны прогрессирующая энцефалопатия, манифестирующая в первые полгода жизни, вслед за которой развиваются тяжелая гипотония, судороги с гипсаритмией, тяжелая умственная отсталость, гиперрефлексия, транзиторный или персистирующий отек лица и тела, атрофия зрительного нерва. Последняя обычно выявляется на первом или втором году жизни, часто наблюдается нистагм. Дефект метаболизма еще не установлен; вероятно, заболевание наследуется по аутосо-мно-рецессивному типу. Данную патологию можно считать формой синдрома Behr, который, вероятно, представляет собой гетерогенную группу заболеваний.
л) Нейрооптикопатия как проявление наследственных дегенеративных заболеваний или патологии развития. Нейрооптикопатия может сопутствовать различным наследственным дегенеративным заболеваниям или системным нарушениям развития. В таблице ниже перечислены основные проявления наиболее часто встречающихся из них.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Наследственная нейрооптикопатия Leber (Leber’s hereditary optic neuropathy, LHON)
Наследственная нейрооптикопатия Leber (Leber’s hereditary optic neuropathy, LHON) — одно из первых заболеваний, для которых была установлена этиологическая связь со специфическими дефектами мтДНКЛ. Минимальная моментальная распространенность составляет 1 на 31000 на Северо-Западе Англии, 1 на 39000 в Нидерландах и 1 на 50000 в Финляндии. Возраст дебюта заболевания обычно составляет от 15 до 35 лет, но может варьировать от одного года до 87 лет. Наследственная нейрооптикопатия Leber поражает преимущественно мужчин, что не характерно для митохондриального типа наследования.
У 25-50% мужчин и 5-10% женщин — носителей наследственной нейрооптикопатии Leber в течение жизни развивается ухудшение зрения. Отмечается двустороннее безболезненное обычно внезапное ухудшение центрального зрения. Примерно в 50% случаев наблюдается последовательное ухудшение зрения обоих глаз, поражение второго глаза развивается в течение нескольких недель или месяцев после поражения первого. В течение года неизбежно поражаются оба глаза. Зрение каждого глаза ухудшается в течение нескольких недель или месяцев, острота зрения обычно снижается до значений 20/200 или ниже. Рано развиваются тяжелые нарушения цветового зрения; при периметрии как правило выявляются центральные или центроцекальные дефекты. Аномалии глазного дна выявляются как у самих больных наследственной нейрооптикопатией Leber, так и у их здоровых родственников по материнской линии.
Наблюдаются гиперемия диска зрительного нерва, расширение и извитость сосудов, кровоизлияния, окружающие диск телеангиэктатические микроангиопатии или отек слоя нервных волокон (псевдозастой); эти изменения особенно выражены в острую фазу ухудшения зрения. Со временем единственной аномалией, выявляемой на глазном дне, остается атрофия зрительного нерва и дефекты слоя нервных волокон, особенно в зоне папилломакулярного пучка. Может встречаться неглаукоматозная экскавация ДЗН и сужение артерий. У большинства пациентов с наследственной нейрооптикопатией Leber ухудшение зрения является единственным проявлением болезни. В некоторых семьях у больных наблюдались сопутствующие нарушения сердечной проводимости, особенно часто — синдромы преждевременного возбуждения. У нескольких пациентов были описаны небольшие неврологические нарушения и скелетные аномалии, наподобие наблюдающихся при рассеянном склерозе.
Клиническое значение дополнительных методов исследования при наследственной нейрооптикопатии Leber ограничено. Флюоресцентная ангиография может помочь отдифференцировать изменения диска зрительного нерва при наследственной нейрооптикопатии Leber от истинного отека ДЗН. При электрокардиографии могут выявляться нарушения проводимости сердца. При оптической когерентной томографии на начальных стадиях заболевания выявляется утолщение перипапиллярного слоя нервных волокон, после чего, по мере развития атрофии зрительного нерва, наблюдается его истончение. При ухудшении зрения регистрируются ожидаемо аномальные зрительные вызванные потенциалы. При стандартной электроретинографии при стимуляции вспышкой, электроэнцефалографии, исследовании спинномозговой жидкости, КТ и МРТ головного мозга обычно не выявляется аномалий. Изредка при МРТ у больных с наследственной нейрооптикопатией Leber выявляется резкое увеличения контрастности передних отделов зрительного пути, а в поздние фазы в режиме Т2 — яркие изменения.
У нескольких пациентов с наследственной нейрооптикопатией Leber при магнитной резонансной спектроскопии с фосфором-31 были выявлены признаки нарушения митохондриального метаболизма мышц конечностей и затылочных долей. У тех же пациентов с наследственной нейрооптикопатией Leber при анализе крови выявлена недостаточность комплекса I дыхательной цепи.
Наследственная нейрооптикопатия Leber передается по материнской линии; было выяснено, что причиной заболевания являются точечные мутации митохондриальной ДНК. Три точечные мутации митохондриальной ДНК, известные как «основные мутации наследственной нейрооптикопатии Leber», вызывают примерно 90% случаев этого заболевания во всем мире. Они локализуются в нуклеотидных позициях 11778 (69% случаев), 3460 (13% случаев) и 14484 (14% случаев).
Описаны другие точечные мутации, которые чаще встречаются у больных наследственной нейрооптикопатией Leber, чем в контрольных группах, но выводы о значении этих «второстепенных» мутаций в развитии заболевания следует делать с осторожностью. Некоторые из этих мутаций и в самом деле могут являться основными мутациями, но каждая из них была обнаружена лишь в нескольких семьях по всему миру. Роль других мутаций в патогенезе заболевания остается неясной. Скрининг на предмет наследственной нейрооптикопатии Leber пациентам с ухудшением зрения должен начинаться с поиска трех основных мутаций. Отрицательные результаты анализов на основные мутации и сохраняющиеся сильные подозрения, возможно, являются показанием к исследованию на предмет наличия других связанных с наследственной нейрооптикопатией Leber мутаций митохондриальной ДНК, особенно тех, которые, как считается, вызывают заболевание в нескольких семьях. Или же, поскольку большинство этих «второстепенных» мутаций митохондриальной ДНК локализуются в кодирующих субъединицы комплекса I генах, может быть выполнено полное секвенирование комплекса I, возможно, начиная с так называемой «горячей точки» — гена ND6. Наконец, выполнимо секвенирование всего митохондриального генома, хотя этот анализ трудоемок.
Эти исследования следует выполнять только при наличии стойких подозрений, результаты должны интерпретироваться специалистом, разбирающимся в тонкостях митохондриальной генетики.
Среди пациентов с наследственной нейрооптикопатией Leber, вызванной основными мутациями, наблюдаются очень сходные клинические фенотипы. Единственным существенным различием является более благоприятный прогноз для зрения у пациентов с мутацией 14484. Почти у 70% пациентов с мутацией 14484 отмечается некоторое улучшение зрительных функций, по сравнению со всего лишь 5% пациентов с мутацией 11778. Возможно, у пациентов с мутацией 3460 шансы на восстановление зрения выше, чем при наличии мутации 11778, но для обоснованного анализа количество пациентов слишком мало. У пациентов с дебютом ухудшения зрения в возрасте младше двадцати, а особенно — младше десяти лет, прогноз для зрения гораздо более благоприятный.
Однако нельзя объяснить экспрессию заболевания только генетическими дефектами. Наличие мутации митохондриальной ДНК обязательно, но не достаточно для фенотипической экспрессии. Одним из факторов экспрессии может являться гетероплазмия (наличие одновременно мутантных и нормальных митохондриальных ДНК). В семьях с гетероплазмией у индивидов с большим количеством мутантной митохондриальной ДНК, вероятно, более высокий риск ухудшения зрения. Однако у многих пациентов со 100% мутантной мтДНК зрение так никогда и не ухудшается. Взаимодействие генетических (митохондриальных или ядерных) факторов и окружающей среды осложняет определение роли отдельных мутаций мтДНК в патогенезе заболевания. На экспрессию заболевания, вероятно, влияют и другие факторы митохондриальной или ядерной ДНК, в том числе сцепленные с Х-хромосомой, что объясняет экспрессию заболевания преимущественно у мужчин. Высказывались предположения о различных факторах среды, провоцирующих ухудшение зрения у пациентов с наследственной нейрооптикопатией Leber.
Системные заболевания, недостаточность питания, медикаменты и токсические воздействия, вызывающие нарушения выработки энергии митохондриями, могут оказаться губительными для индивидов, генетически предрасположенных к недостаточности энергопродукции митохондриями. Курение, вероятно, из-за своего пагубного воздействия на функцию митохондрий, связано с более выраженной экспрессией ухудшения зрения среди носителей основных мутаций наследственной нейрооптикопатии Leber; аналогичная связь установлена только для тяжелого алкоголизма.
Патофизиология наследственной нейрооптикопатии Leber остается неизвестной. Может иметь место аномальное окислительное фосфорилирование и недостаточная продукция АТФ, напрямую или опосредованно связанные с выработкой свободных радикалов, что приводит к необратимому повреждению ганглиозных клеток и их аксонов. Почему эти нарушения приводят к селективному повреждению зрительного нерва, остается неясным. При гистохимических исследованиях зрительного нерва животных была выявлена высокая дыхательная активность митохондрий безмиелиновых волокон преламинарной части зрительного нерва, что свидетельствует о высокой потребности в функционирующих митохондриях в этой зоне. Большой интерес представляет собой недавно открытая на модели грызунов генетическая индукция недостаточности комплекса I; при этом гистологические признаки дегенерации зрительного нерва аналогичны наблюдаемым у пациентов с наследственной нейрооптикопатией Leber. Дальнейшее развитие моделирования митохондриальных болезней на животных поможет лучше изучить патогенез митохондриальных болезней человека.
Методы лечения, применяемые при наследственной нейрооптикопатии Leber, включают в себя терапию коэнзимом Q10, идебеноном, L-карнитином, сукцинатом, дихлороацетатом, витамином К1, витамином КЗ, витамином С, тиамином, витамином В2 и витамином Е. По результатам рандомизированного контролируемого исследования применения идебенона для лечения наследственной нейрооптикопатии Leber у пациентов с ухудшением зрения в течение пяти лет при различных зрительных функциях двух глаз (т.е. тех пациентов, у которых заболевание манифестировало недавно), исход для зрения на фоне лечения может быть лучше. Однако из-за необратимых повреждений маловероятно, что при атрофии зрительного нерва какая-либо терапия будет иметь выраженный эффект. Общая рекомендация — избегать приема веществ, вызывающих нарушение митохондриальной энергопродукции, однако эффективность этих мер не доказана.
Но мы все же рекомендуем пациентам с наследственной нейрооптикопатией Leber и их родственникам по материнской линии, входящим в группу риска, избегать табакокурения, употребления содержащих цианиды продуктов, чрезмерного употребления алкоголя и внешних токсических воздействий. Симптоматическое лечение заключается в применении кардиостимуляторов у пациентов с сердечными блокадами или тяжелыми нарушениями сердечной проводимости, а также в помощи слабовидящим при тяжелом снижении зрительных функций. По мере изучения специфических генетических и биохимических аномалий, вероятно, будут разработаны новые методы лечения, направленные на замещение или создание путей обхода генетических и метаболических дефектов у больных и их находящихся в группе риска родственников. Возможно, перспективный метод генной терапии, известный под названием аллотипической экспрессии, в будущем будет играть роль при лечении наследственной нейрооптикопатии Leber и других митохондриальных болезней, а пока не следует недооценивать важность информированного генетического консультирования членов семьи при материнском типе наследования.
Наследственная нейрооптикопатия Leber.
(А) Глазное дно левого глаза в период ухудшения зрения; отмечается легкая гиперемия диска зрительного нерва и перипапиллярные телеангиэктазии.
(Б) При периметрии по Goldmann выявляется центральная скотома левого глаза.
(В) Бледный диск зрительного нерва с экскавацией через пять месяцев после ухудшения зрения у пациента с наследственной нейрооптикопатией Leber. Митохондриальный геном, показаны точечные мутации, связанные с наследственной нейрооптикопатией Leber.
Более 90% всех случаев наследственной нейрооптикопатии Leber вызываются одной из трех основных мутаций, отмеченных внутри генома (кольца); другие мутации отмечены снаружи от генома.
Последние значительно различаются по встречаемости, степени эволюционного консерватизма измененной кодируемой аминокислоты и встречаемости в контрольной группе.
Мутации, отмеченные символом * также, возможно, могут быть отнесены к основным, но каждая из них во всем мире выявлена только в одной или в единичных семьях.
Мутации, отмеченные символом ** — основные мутации, вызывающие наследственную нейрооптикопатию Leber и дистонию.
Доминантная, рецессивная и Х-сцепленная атрофии зрительного нерва (наследственные нейрооптикопатии)
Наследственные нейрооптикопатии — группа заболеваний, при которых дисфункции зрительного нерва имеют наследственные причины, выявленные на основании семейного наследования или генетического анализа. Клиническая вариабельность одного заболевания как внутри-, так и межсемейная, часто затрудняет распознавание и классификацию этой патологии.
Наследственные нейрооптикопатии часто классифицируются по типу наследования; чаще всего это аутосомно-доминантный, аутосомно-рецессивный и материнский (наследование через митохондриальную ДНК (мтДНК, mtDNA)). Наследуемые по одному типу нейрооптикопатии не обязательно вызываются одним генетическим дефектом. Аналогично, различные генетические дефекты могут являться причиной идентичных или схожих фенотипов — одни из которых передаются по общему типу наследования, другие — нет. И наоборот, один генетический дефект может вызывать развитие различных клинических проявлений, хотя тип наследования должен совпадать.
Также зачастую причиной единичного случая является предполагаемый или подтвержденный генетический дефект, что делает невозможным классификацию на основании типа наследования.
Наследственные нейрооптикопатии обычно манифестируют симметричным двусторонним безболезненным снижением центрального зрения. Многие заболеваний этой группы характеризуются поражением папилломакулярного нервного пучка, что вызывает развитие центральных или центроцекальных скотом. Точная локализация первичного дефекта структур ганглиозных клеток и их аксонов и патофизиологические механизмы поражения зрительного нерва остаются неизвестными, но в большинстве, если не во всех, случаях наследственных нейрооптикопатий центральную роль в патогенезе играет митохондриальная дисфункция. Поражение зрительного нерва обычно персистирует и может прогрессировать. На момент развитии атрофии уже имеется обширное поражение зрительного нерва.
При некоторых наследственных нейрооптикопатиях наблюдается изолированная дисфункция зрительного нерва. При других поражение зрительного нерва всегда сопровождается различными неврологическими и системными аномалиями, некоторые наследственные заболевания, например мультисистемные дегенерации, характеризуются первичными неврологическими или системными нарушениями и могут сопровождаться и атрофией зрительного нерва. В настоящей главе наследственные нейрооптикопатии разделены на три основных группы:
1. Заболевания, преимущественно не сопровождающиеся неврологическими или системными проявлениями.
2. Заболевания, часто сопутствующие неврологическим или системным проявлениям.
3. Состояния, при которых нейрооптикопатия обычно диагностируется как вторичное поражение на фоне общего заболевания.
По мере открытия других специфических генетических дефектов, вероятно, будут изменяться и наши представления о фенотипах и классификации заболеваний этой группы.
а) Доминантная атрофия зрительного нерва. Аутосомно-доминантная («типа Kjer») атрофия зрительного нерва (dominant optic atrophy — DOA) — наиболее часто встречающаяся аутосомная наследственная нейрооптикопатия, встречаемость заболевания в северо-восточной части Англии оценивается в 1 на 35000 человек и достигает 1 на 12000 в Дании.
Такие случаи обычно свидетельствуют о незамеченном дебюте заболевания в детстве, легкой степени зрительной дисфункции, отсутствии ночной слепоты и медленном прогрессировании. Снижение остроты зрения обычно одинаково невелико на обоих глазах. Острота зрения больных варьирует от 20/20 до 20/800, всего лишь около 15% пациентов имеют остроту зрения 20/200 или ниже. Снижение остроты зрения до движения руки или световосприятия встречается крайне редко. Отмечается выраженная межсемейная и внутрисемейная вариабельность тяжести нарушения зрительных функций.
Хотя и не так быстро развивающиеся и не настолько тяжелые, как при наследственной нейрооптикопатии Leber, нарушения зрения при доминантной атрофии зрительного нерва примерно в 50% случаев не позволяют больным управлять механическим транспортным средством. Классическим для больных доминантной атрофией зрительного нерва является нарушение восприятия синего — желтого цветов, но чаще всего наблюдается смешанное нарушение цветовосприятия. При периметрии пациентов с доминантной атрофией зрительного нерва характерно наличие центральных, парацентральных или центроцекальных скотом. Двустороннее снижение чувствительности может симулировать сдавление хиазмы. Атрофия зрительного нерва у пациентов с наследуемой по доминантному типу нейрооптикопатией может протекать незаметно, проявляться лишь побледнением височной половины ДЗН или же вызывать изменения всего диска. Наиболее характерным симптомом является выраженная треугольная экскавация височной половины диска зрительного нерва; иногда таким больным ставится ошибочный диагноз глаукомы.
Незаметное прогрессирующее ухудшение зрительных функций происходит приблизительно у 50-75% пациентов.
Но ни продукты этих генов, ни их функции описаны не были. Интересно, что при анализе сцепления была выявлена связь глаукомы нормального давления с полиморфизмом гена OPAL.
Классическая картина доминантной атрофии зрительного нерва включает в себя только атрофию зрительного нерва и не сопровождается другими неврологическими или системными нарушениями. Однако давно было известно, что в некоторых семьях у некоторых родственников развивалась классическая картина доминантной атрофии зрительного нерва, а у других больных членов семьи наблюдались другие клинические проявления, такие как сенсоневральная тугоухость и даже хроническая прогрессирующая наружная офтальмоплегия, атаксия, миопатия, периферическая нейропатия и, редко, фенотип, соответствующий наследственной спастической параплегии.
Большинство таких семей генетически не отличаются от семей, наследующих моносимптомную доминантную атрофию зрительного нерва, и в самом деле, было доказано, что генетическим дефектом, вызывающим многие из этих синдромальных форм доминантной атрофии зрительного нерва, так называемую «доминантную атрофию зрительного нерва плюс», являются мутации гена OPAL. У таких пациентов грубое нарушение функции протеина ОРА1 может вызывать аберрантную репликацию и обширные делеции митохондриальной ДНК, и, таким образом, вызывать развитие более тяжелого фенотипа митохондриального заболевания. Поскольку эти наблюдения последних лет указывают на общий механизм развития дисфункции митохондрий при наследственных нейрооптикопатиях, они также делают неактуальным классическое разделение несиндромальных и синдромальных форм наследственной нейрооптикопатии.
б) Аутосомно-рецессивная атрофия зрительного нерва. Эта форма атрофии зрительного нерва манифестирует при рождении или развивается в раннем возрасте, диагноз обычно ставится в возрасте младше 3-4 лет. Считается, что заболевание наследуется по аутосомно-рецессивному типу, родители пациентов часто являются близкими родственниками. Снижение остроты зрения тяжелое, может развиваться слепота с сенсорным нистагмом. При периметрии определяется сужение полей зрения различной степени, часто выявляются парацентральные скотомы.
Диски зрительных нервов полностью атрофичны, часто формируется тотальная экскавация. По результатам одной офтальмоскопии трудно отдифференцировать это заболевание от инфантильной дегенерации сетчатки, поэтому большое значение для диагностики приобретает электроретинография.
В одной семье французского происхождения, где имелись близкородственные браки, изолированная рецессивная атрофия зрительного нерва была связана с дефектом хромосомы 8 (8q21-q22), патогенный ген был обозначен как ОРА6, хотя продукт гена и его функции еще предстоит определить. В нескольких семьях из Северной Африки с близкородственными браками, наследующих аутосомно-рецессивную атрофию зрительного нерва, изолированную и сопровождающуюся легкой (часто бессимптомной) сенсоневральной тугоухостью, был выявлен дефект гена хромосомы 11, обозначенного ОРА7 (11q14.1—q21), кодирующего трансмембранный белок митохондрий.
в) Х-сцепленная атрофия зрительного нерва. Семейства с подтвержденным сцепленным с полом наследованием атрофии зрительного нерва встречаются крайне редко, особенно редко — наследующие первичную моносимптомную атрофию зрительного нерва. В двух семьях была выявлена сцепленность с одним и тем же локусом Х-хромосомы (Xp11.4-Хр11.2),патогенный ген получил название ОРА2, хотя продукт гена и его функцию еще предстоит установить. В других семьях с предположительно Х-сцепленным типом наследования атрофия зрительного нерва чаще сопровождается другой неврологической и системной патологией.
Доминантная атрофия зрительного нерва.
(А) При офтальмоскопии на обоих глазах наблюдаются побледнение височной половины диска зрительного нерва (ДЗН), обширная экскавация.
(Б) При периметрии по Goldmann определяются двусторонние центроцекальные скотомы (снижение чувствительности). (В) Глазное дно практически здоровой матери того же пациента. Обратите внимание на побледнение височной части обоих дисков зрительного нерва.
Неврит зрительного нерва - симптомы и лечение
Что такое неврит зрительного нерва? Причины возникновения, диагностику и методы лечения разберем в статье доктора Зубковой Екатерины Андреевны, офтальмолога со стажем в 12 лет.
Над статьей доктора Зубковой Екатерины Андреевны работали литературный редактор Вера Васина , научный редактор Сергей Цыганок и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Неврит зрительного нерва (Optic neuritis) — это воспаление зрительного нерва. При заболевании резко снижается зрение, сужается его поле и нарушается восприятие цветов. Перед глазами появляются пятна и мерцания, в глазничной области возникает боль, которая усиливается при движениях глаза [2] .
Среди всех глазных болезней поражения зрительного нерва встречаются в 3,2 % случаев [6] .
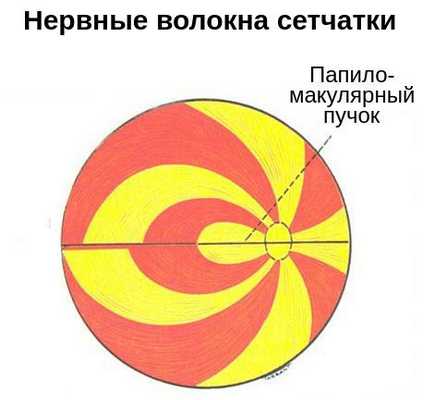
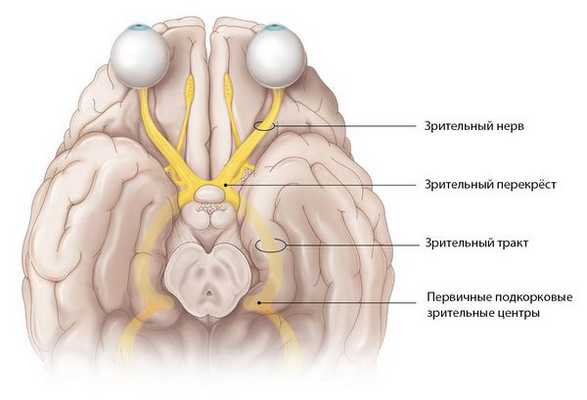
Зрительный нерв — это нетипичный черепно-мозговой нерв, который содержит около 1 млн нервных волокон. Он представляет собой белое вещество головного мозга, вынесенное на периферию. Его длина составляет 35–55 мм [1] . По нему зрительная информация, воспринятая клетками сетчатки, передаётся в головной мозг.
Отростки нервных клеток собираются со всей сетчатки и образуют диск зрительного нерва. Затем они направляются к головному мозгу, перекрещиваются с нервными волокнами второго глаза и формируют зрительный перекрёст. От него начинается зрительный тракт, который заканчивается в первичных подкорковых зрительных центрах.
Зрительный нерв подразделяется на несколько частей:
- внутриглазная часть и головка зрительного нерва;
- ретробульбарная часть (за глазом), или орбитальная;
- внутриканальцевая;
- внутричерепная.
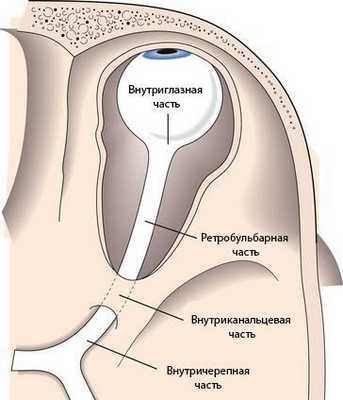
Длина внутриглазной части зрительного нерва составляет 25–35 мм. В горизонтальной плоскости нерв S-образно изгибается, благодаря чему при движениях глазного яблока он не натягивается.
К внутриглазной части относится диск зрительного нерва. В нём соединяются оптические волокна сетчатки, а из центра выходят сосуды: узкие светло-красные артерии и более тёмные толстые вены.
Ретробульбарная или орбитальная часть — это участок зрительного нерва длиной 25–35 мм. Начинается от области, где нерв выходит из глазного яблока, и продолжается до входа в зрительный канал.
Внутриканальцевая часть зрительного нерва заключена в зрительный канал. Её длина составляет около 6 мм, нерв здесь фиксирован к стенке канала.
Внутричерепная часть зрительного нерва переходит в перекрёст зрительных нервов. Длина этого участка в среднем составляет 10 мм. Внутричерепной отдел особо уязвим при патологиях прилежащих структур, например аденоме гипофиза или аневризме. При таких нарушениях зрительный перекрёст может сдавливаться, из-за чего сужаются поля зрения и атрофируется зрительный нерв. Если повреждается сосуд зрительного нерва, то пациент перестаёт видеть одним глазом [2] . Также встречается гемианопсия — слепота обоих глаз в половине поля зрения.
При неврите воспаляются ствол и оболочки зрительного нерва в различных его отделах. Если процесс распространяется на диск зрительного нерва, то такое воспаление называют внутриглазным невритом или папиллитом. Когда процесс протекает за глазом, то это ретробульбарный неврит зрительного нерва [3] .
Причины неврита зрительного нерва
Точную причину заболевания выяснить удаётся не всегда, но чаще всего к воспалению зрительного нерва приводят:
- — это самая распространённая причина неврита зрительного нерва;
- другие аутоиммунные заболевания, такие как синдром Шегрена, системная красная волчанка;
- нейромиелит зрительного нерва — демиелинизирующее заболевание, которое поражает преимущественно глаза и спинной мозг;
- демиелинизирующие заболевания, связанные с сывороточными иммуноглобулинами G к миелин-олигодендроцитарному гликопротеину (MOG-IgG) — например, острый рассеянный энцефаломиелит ;
- гранулематозные болезни — саркоидоз, гранулематоз с полиангиитом[13] ;
- воспалительные заболевания головного мозга — энцефалит, арахноидит, менингит , абсцесс мозга и др.;
- острые и хронические общие инфекции — туберкулёз, болезнь Лайма, сифилис, бруцеллёз, тиф, рожа, грипп, оспа и др.;
- воспалительные заболевания глаз и орбиты;
- интоксикации свинцом или метиловым спиртом, у детей возможна глистная интоксикация;
- проникающие ранения глаза и орбиты;
- черепно-мозговые травмы.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы неврита зрительного нерва
Основные жалобы пациентов при неврите:
- резко снижается зрение и сужаются его поля;
- нарушается способность воспринимать цвета и различать тона;
- перед глазами постоянно или периодически появляются пятна или мерцания;
- в глазничной области возникает боль, которая усиливается при движениях глаза [2] ;
- нарушается зрачковая реакция на поражённом глазу.
Внутриглазной неврит (папиллит) — это воспаление внутриглазной части зрительного нерва. Заболевание, как правило, начинается остро: зрение ухудшается за пару часов (чаще всего одного глаза), реже за нескольких суток. Потеря зрения сопровождается умеренной головной болью и болью при движении глаз, но этих симптомов может и не быть. Обычно зрение перестаёт ухудшаться через 7–10 дней, а через 2–3 недели восстанавливается. Но если пациент не выздоравливает, то длительный отёк приводит к атрофии нервных волокон и потере зрения [4] .
Папиллит — это самый распространённый вид неврита у детей, но может встречаться и у взрослых [7] .
Ретробульбарный неврит — это воспаление участка зрительного нерва, расположенного между глазным яблоком и зрительным перекрёстом.
Чаще всего ретробульбарный неврит развивается при демиелинизирующих заболеваниях, в 80 % случаев он является первым признаком рассеянного склероза. Но может возникать при инфекционных заболеваниях и отравлениях, например метиловым спиртом.
Ретробульбарный неврит может протекать в острой форме (чаще при инфекциях) и в хронической (при отравлениях токсинами). Одностороннее поражение обычно протекает в острой форме, двустороннее — в хронической. При надавливании на глаз и его движениях 90 % пациентов чувствуют боль за глазным яблоком. Часто нарушается цветовое зрение и быстро возникает цветовое утомление, т. е. чувствительность глаза к цветам снижается, оттенки быстро тускнеют. Сильно падает острота зрения: пациент перестаёт различать предметы и видит только свет. В поле зрения появляются скотомы различных размеров — участки полного или частичного выпадения зрения, которые не связаны с периферическими границами.

При аксиальном неврите возникает центральная скотома размером 2–10 ° и более. Она может объединяться с частичными выпадениями полей зрения, которые примыкают к точке фиксации взора. Также в поле зрения могут возникать периферические дефекты.
При периферической форме неврита поле зрения имеет концентрический характер, т. е. сужается по всему периметру.
При трансверсальной форме неврита зрение снижается очень сильно, вплоть до слепоты. Скотомы сливаются с периферическими выпадениями поля зрения. Характерная особенность такого неврита — отсутствие изменений при смотре глазного дна в начале заболевания [4] .
Патогенез неврита зрительного нерва
Зрительный нерв состоит из миллиона нервных волокон. Снаружи они покрыты специальным веществом — миелином, который облегчает проведение нервного импульса к мозгу. Наиболее частой причиной неврита являются демиелинизирующие заболевания, при которых зрительный нерв разрушается клетками иммунной системы.
Иммунитет уничтожает вирусы и бактерии, которые вызывают инфекционные болезни. При аутоиммунных заболеваниях наша иммунная система принимает собственные ткани организма за чужеродные и разрушает их. При неврите иммунная система атакует миелиновую оболочку, которая покрывает зрительный нерв.

Острый неврит зрительного нерва может развиться из-за вирусной инфекции, которой пациент болел несколько лет назад или больше. До конца неизвестно, что именно в таких случаях приводит к поражению зрительного нерва. Вероятно, заболевание развивается у людей с определённым типом иммунной системы.
Воспаление при неврите протекает на стволе и оболочках зрительного нерва и ощущается пациентом как дискомфорт, особенно при движениях глаз. Из-за воспаления возникает отёк и инфильтрация — накопление в тканях клеточных элементов и жидкости. В результате этого зрительные волокна сдавливаются, их клетки разрушаются и зрение ухудшается.
Когда воспаление проходит, часть нервных волокон восстанавливается, поэтому зрение улучшается. Если болезнь протекает тяжело, то нервные волокна распадаются, зрительный нерв атрофируется и зрение утрачивается необратимо [4] . В редких случаях в патологический процесс может вовлекаться зрительный нерв другого глаза, место перекрёста зрительных нервов или другие ткани мозга [5] .
Классификация и стадии развития неврита зрительного нерва
Код неврита зрительного нерва по МКБ-10 (Международной классификации болезней): H46.
Выделяют следующие виды неврита:
- внутриглазной неврит (папиллит) — это воспаление диска зрительного нерва;
- ретробульбарный неврит — это воспаление зрительного нерва на участке между глазным яблоком и перекрёстом .
В зависимости от того, где расположено воспаление, выделяют три формы ретробульбарного неврита:
- трансверсальный неврит — поражены все группы волокон зрительного нерва;
- периферический — страдают волокна нервного ствола, воспаление обычно начинается в мягкой мозговой оболочке и переходит на периферические волокна;
- аксиальный — воспаление осевого пучка зрительного нерва [4] .
Осложнения неврита зрительного нерва
Заболевания, связанные с воспалением нервной системы, могут вызвать необратимые изменения в организме. Чем дольше продолжается воспалительный процесс, тем они тяжелее.
Возможные осложнения при неврите зрительного нерва: атрофия тканей, ухудшение зрения или его полная потеря. У многих пациентов через некоторое время зрение полностью восстанавливается. Но при тяжёлом течении миелиновая оболочка разрушается, что приводит к необратимой потере зрения [2] [3] .
Диагностика неврита зрительного нерва
Сбор анамнеза
Диагностика начинается с опроса пациентов. К типичным жалобам относятся:
- перед глазом появился « туман » , « пятно » или « сетка » , которые со временем темнеют;
- зрение ухудшалось постепенно, чаще за 1–3 дня, реже в течение недели;
- выпадают отдельные участки поля зрения, или ограничено периферическое зрение;
- ухудшилось восприятие цветов;
- появилась боль при движениях глаз, что характерно для периферической формы ретробульбарного неврита.
Врач уточняет у пациента:
- поражены оба глаза или только один;
- когда появились симптомы и сколько длятся;
- признаки болезни возникли впервые или появляются периодически;
- имеются ли общие или локальные заболевания.
Внешний осмотр и пальпация
При наружном осмотре зачастую изменения не выявляются. При ретробульбарном неврите глазное яблоко может быть смещено вперёд, движения глаза ограничены и вызывают боль.
Инструментальные методы исследования
- Определение остроты зрения: центральное зрение не нарушается при периферической форме ретробульбарного неврита, но резко ухудшается при аксиальной. При трансверсальной форме зрение снижается до сотых долей, т. е. от 0,09 и меньше, вплоть до слепоты.
- Исследование цветоощущения проводится по полихроматическимтаблицам Рабкина , на которых изображены фигуры, цифры или буквы. Они составлены из кружков одного тона, но разной насыщенности и располагаются на фоне, состоящем из кругов других близких цветов.

- Биомикроскопия — осмотр переднего отрезка глаза. Проводится, чтобы исключить патологию этого участка.
- Измерение внутриглазного давления — оно повышается при заболеваниях, которые могут послужить причиной неврита, или при сопутствующей глаукоме .
- Офтальмоскопия под мидриазом — осмотр глазного дна, перед которым в глаза закапывают специальные капли, расширяющие зрачки. Обследование проводится в зелёном свете, чтобы точнее выявить отёк диска зрительного нерва и кровоизлияния на нём. В начале болезни изменений может не быть, первые признаки появятся только через несколько недель. Время их появления зависит от удалённости инфекционного очага и воспаления глазного яблока. В этот период врачу следует быть особенно внимательным, чтобы избежать ошибочного диагноза, так изменений на диске зрительного нерва нет. Как и в норме, диск имеет форму правильного круга диаметром 1,5–2 мм, цвет бледно-розовый, границы в норме чётко очерчены. Только спустя время, когда воспаление достигнет глазного яблока и распространится по нервному волокну, можно заметить покраснение диска, его границы становятся размытыми, диаметр сосудов изменяется, появляются кровоизлияния [8] .
- Исследование зрачковой реакции на свет.
- Компьютерное исследование полей зрения по 120 точкам.
- Исследование полей зрения методом кинетической периметрии.
Дополнительные методы диагностики для уточнения диагноза
- электрофизиологические методы — исследование зрительных вызванных потенциалов (позволяет понять , как головной мозг реагирует на различные зрительные стимулы ) и порога электрической чувствительности сетчатки ( чем больше площадь дефектов поля зрения, тем ниже электрическая возбудимость сетчатки);

- УЗИ глаз;
- когерентная томография зрительного нерва;
- МРТ орбиты и головного мозга;
- флюоресцентная ангиография сетчатки.
Лабораторные исследования
Гистологические, иммунологические и биохимические методы позволяют уточнить диагноз при туберкулёзе, ревматоидном артрите , сифилисе и других заболеваниях. К таким анализам также относятся тест на ВИЧ, анализ на ревматоидный фактор и др. [4] [8]
Лечение неврита зрительного нерва
Если диагноз подтверждён, то пациента срочно госпитализируют. Лечение консервативное, его цель — подавить инфекции, уменьшить воспалительный отёк и аллергические реакции, улучшить обмен веществ в тканях центральной нервной системы.
Для лечения неврита применяются:
- Антибиотики широкого спектра действия. Их назначают, если причиной неврита являются бактериальные инфекции.
- Глюкокортикоиды уменьшают аллергические реакции, воспаление, отёк и усиливают иммунный ответ клеток. Может применяться Дексаметазон, но важно знать, что местное применение глюкокортикоидов без внутривенного и перорального введения не работает [11] . При неврите, который вызван аутоиммунными заболеваниями, применяют метод пульс-терапии: внутривенно каждые 6 часов в течение 3–5 дней вводят большие дозы Метилпреднизолона. Затем глюкокортикоиды применяют внутрь в дозе 1 мг/кг. В РФ доза глюкокортикоидов, применяемых перорально, часто занижена, в результате побочных эффектов больше, чем пользы. Вместе с глюкокортикоидами назначаются ингибиторы протонной помпы.
Хорошие результаты показывает лечение внутривенным иммуноглобулином (IVIg) и плазмаферез (PLEX), но широко эти методы пока не применяются [14] .
В РФ иногда назначают противоаллергические препараты, мочегонные средства, физиотерапию и нестероидные противовоспалительные препараты (НПВС), но в зарубежных руководствах таких рекомендаций нет. Более того, описаны случаи, когда приём НПВС становился причиной неврита зрительного нерва [12] .
Одновременно с лечением неврита выясняют его причины. После уточнения диагноза проводится специфическое лечение основного заболевания, например операция при синусите, специфическая терапия туберкулёза или противовирусная терапия герпеса [9] .
Прогноз. Профилактика
При инфекционно-токсическом неврите зрительного нерва прогноз благоприятный: в 75–90 % случаев зрение полностью восстанавливается [4] .
При воспалении диска зрительного нерва (папиллите) пациент нетрудоспособен примерно 15–28 дней. При правильном лечении зрение значительно или полностью восстанавливается.
Прогноз хуже при неврите, вызванном аутоиммунными болезнями, а также коллагенозами, саркоидозом, специфическими инфекциями и демиелинизирующими заболеваниями. Зрительные нарушения прогрессируют в течение 7–10 дней. Зрение редко восстанавливается полностью, часто случаются рецидивы, может частично атрофироваться зрительный нерв.
Профилактика неврита зрительного нерва
Чтобы избежать воспаления зрительного нерва, нужно предупреждать и вовремя лечить инфекционные заболевания. При хронических болезнях необходимо регулярно посещать офтальмолога, невролога, отоларинголога, терапевта и других профильных врачей [2] [4] .
Читайте также:
