Нечувствительность к гливеку хронического миелолейкоза. Причины резистентности
Добавил пользователь Владимир З. Обновлено: 20.01.2026
Гливек (Glivec, Gleevec) в лечении хронического миелолейкоза (ХМЛ) - схема терапии, эффективность
С начала 1990 г., когда в результате разностороннего изучения патогенеза хронического миелоидного лейкоза (ХМЛ) стало очевидным, что обусловленная t(9;22)(q34;q11) активация ABL-тирозинкиназы является пусковым механизмом развития болезни, стали разрабатывать препарат, обладающий ингибирующим тирозинкиназу эффектом.
В результате многолетней работы Brian Druker из Dana Farber Cancer Institute в Бостоне (США) создан препарат STI 571 (signal trunsduction inhibitor), получивший название «Гливек» (Glivec, Gleevec), или «Иматиниба мезилат» (imatinib mesylate). Появление препарата направленного патогенетического действия ознаменовало начало новой эры в терапии ХМЛ.
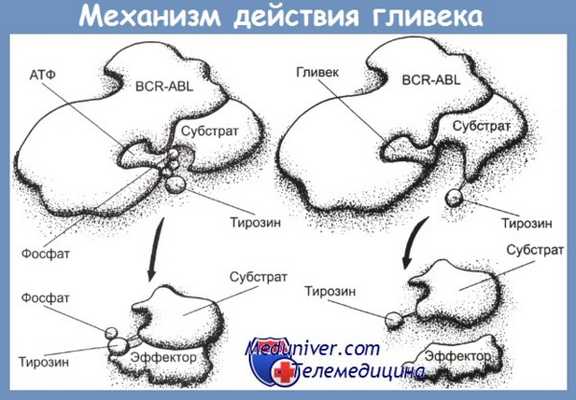
Гливек является производным 2-фениламинопиримидина (CH2SО3H). Исследования в культуре клеток больных ХМЛ показали, что гливек подавляет рост Ph-позитивных клеток, почти не действуя на Ph-негативные клетки. Механизм блокирующего активность ABL-тирозинкиназы действия гливека связан с встраиванием молекулы препарата в то место в молекуле ABL-тирозинкиназы — АТФ-карман, куда обычно встраивается АТФ.
С помощью рентгеновской кристаллографии доказано, что гливек встраивается в этот карман вместо АТФ, препятствуя тем самым фосфорилированию тирозина. Это приводит к блоку сигнала пролиферации в BCR-ABL-позитивных клетках, в результате чего они подвергаются апоптозу. В культуре клеток К562 показано очень быстрое действие гливека: фосфорилирование прекращается уже через 1 мин после введения гливека, подавление пролиферации и апоптоз — после 16—20 ч инкубации. В то же время исследования на больных показали необходимость значительно более продолжительного воздействия гливека: подавление фосфорилирования достигалось лишь через 3—4 дня.
Гливек принимают внутрь. Биодоступность гливека при пероральном приеме составляет более 97 %, она не зависит от возраста и приема пищи. Фармакологические исследования не обнаружили влияния массы тела на концентрацию гливека в плазме, поэтому препарат дозируется независимо от этого показателя. Для гливека характерна быстрая всасываемость с максимумом концентрации в плазме через 1—2 ч после приема. Время полувыведения препарата составляет от 18 до 22 ч, что позволяет принимать его один раз в день.
Примерно 96 % препарата связывается с белками плазмы, особенно с альбумином и гликопротеинами и в очень незначительной степени — с липопротеинами. Более 80 % гливека и его метаболитов выводится в течение 7 дней после приема однократной дозы. Препарат выводится главным образом (68 %) через кишечник, и только около 13% — почками.
По всей вероятности, гливек не проникает через гематоэнцефалический барьер. В опытах на животных показано, что даже при назначении очень высоких доз гливека, в результате чего концентрация в плазме в 10 раз превышает терапевтическую, в цереброспинальной жидкости она в 3 раза ниже терапевтической и в 155 раз ниже, чем в плазме.
В отечественных исследованиях получены столь же высокие результаты. По данным Гематологического научного центра РАМН, полный гематологический ответ при лечении гливеком получен у 96 % больных в хронической стадии хронического миелоидного лейкоза, ранее лечившихся ИНФ-а в комплексе с Ara-C, у 43 % больных — большой цитогенетический ответ, при этом в течение 18 мес лечения частота полной цитогенетической ремиссии увеличилась с 16 до 37 %.
Даже в фазе акселерации через 6 мес лечения у 30 % больных получен большой цитогенетический ответ, а при продолжении лечения до 18 и 24 мес — у 45 и 51 % соответственно при 39 % полного цитогенетического ответа.
Ухудшение гематологических или цитогенетических показателей за время лечения наблюдали у 10,3 % больных, получавших ИФН-а + Ara-C, и лишь у 1,4 % леченных гливеком, переход в стадию акселерации или развитие бластного криза — у 4,7 и 1,1 % соответственно. Немаловажной оказалась и разница в переносимости терапии: перевести в противоположную группу из-за непереносимости лечения пришлось 19 % больных из группы леченных ИФН-а + + Ara-C и лишь менее 1 % больных, получавших гливек.
В 2003 г. были опубликованы результаты этого исследования после 19 мес лечения. Полная гематологическая ремиссия достигнута у 97 % получавших гливек и 69 % леченных ИФН-а + Ara-C. Большой цитогенетический ответ достигнут и сохранился в течение всего срока наблюдения у 87 % больных, получавших гливек, и лишь у 35 % леченных комбинацией ИФН-а и Ara-C, a полная цитогенетическая ремиссия — соответственно у 76 и 14 %. Результаты этого исследования показывают, что при терапии гливеком, проводимой с самого начала заболевания, большинство больных хроническим миелоидным лейкозом имеют шанс прожить 10 лет.
Числовая сравнительная оценка качества жизни показала статистически достоверный более высокий уровень в группе получавших гливек. Более того, в группе больных, вначале получавших комбинацию ИФН-а и Ara-C, a затем переведенных на лечение гливеком, общая оценка качества жизни за время наблюдения оказалась выше, чем у больных, продолживших терапию ИФН-а + Ara-С.
Анализ течения болезни у 553 больных, с самого начала получавших гливек, провели после 2 лет терапии. Данные анализа показали следующее: полная гематологическая ремиссия сохранилась у 95 % больных, большой цитогенетический ответ констатирован к концу срока наблюдения у 88 %, полная цитогенетическая ремиссия — у 79 %, не было перехода в более продвинутую стадию у 96 %, выживаемость также составила 96 %. В зависимости от прогностического индекса по Socal оказалось, что полная цитогенетическая ремиссия достигнута и сохранялась в течение анализируемого срока у 84 % больных группы низкого риска прогрессирования, у 77 % группы промежуточного и у 62 % больных группы высокого риска. Течение заболевания без признаков прогрессирования отмечено соответственно у 95, 89 и 85 % больных. Ни при каком лечении до появления гливека не было подобных результатов.
Недавно подведенные итоги 5-летних наблюдений за больными, вошедшими в это исследование, показали, что терапия гливеком принципиально изменила течение хронического миелоидного лейкоза. Через 5 лет после начала терапии гливеком ранее не леченных больных ХМЛ в хронической стадии полная гематологическая ремиссия сохранялась у 97 % больных, большой цитогенетический ответ наблюдали у 88 %, полная цитогенетическая ремиссия была у 82 %. Общая 5-летняя выживаемость составила 90 %, у 93 % больных сохранялась хроническая стадия заболевания.
Менее чем у 1 % больных ежегодно наблюдалось прогрессирование в стадию акселерации или развитие бластного криза. Не отмечали прогрессирования болезни у 96 % больных, у которых в течение первых 12 мес лечения была достигнута молекулярная ремиссия (уменьшение транскрипта BCR/ABL более чем на 3 log; 3 log — это в 1000 раз), и у 81 % больных, у которых наблюдалась полная цитогенетическая ремиссия, но не было достигнуто молекулярной ремиссии. Как известно, при терапии миелосаном, начиная со второго года наблюдения, переход в стадию акселерации или развитие бластного криза ежегодно наблюдали у 15—20 % больных.
В 2004 г. опубликованы результаты лечения гливеком 235 больных в стадии акселерации и 260 больных в стадии бластного криза. Больные получали 600 мг препарата ежедневно. Через 36 мес от начала лечения были живы 55 % больных, начавших лечение в стадии акселерации и 14 % в стадии бластного криза. Выживаемость строго коррелировала с достижением большого цитогенетического ответа: 3-летняя выживаемость больных в стадии акселерации при достижении такого ответа в течение первых 3 мес лечения составила 85 % и 52 % больных без большого цитогенетического ответа.
Результаты лечения больных в поздней хронической стадии при лечебных дозах препарата 400—600 мг/сут были еще лучше: большой цитогенетический ответ получен у 65% больных, полный — у 52%. У 82 % больных большой цитогенетический ответ сохранялся в течение 3 лет.
Живы в течение 3 лет 88 % больных этой группы, причем у 80 % из них без признаков прогрессирования болезни.
Наилучшая выживаемость достигается у больных, у которых большой цитогенетический ответ в хронической стадии или любой цитогенетический ответ в стадии акселерации получен в течение первых 3 мес терапии. В стадии акселерации получение цитогенетического ответа после 3 мес лечения гливеком оказалось даже более значимым прогностическим фактором, чем наличие клональной эволюции. При получении даже минимального цитогенетического ответа в течение первых 3 мес у 83 % больных позже достигается большой цитогенетический ответ, при этом у 54 % — полная цитогенетическая ремиссия.
Если минимальный цитогенетический ответ получен в течение 6—12 мес терапии, то частота большого цитогенетического ответа и полной цитогенетиче-ской ремиссии в дальнейшем составляли соответственно 68 и 35 %. В тех случаях, когда в течение первых 3 мес лечения не наблюдали даже минимального цитогенетического ответа, только у 12 % больных можно было ожидать его достижения в дальнейшем, а при отсутствии цитогенетического ответа в первые 6 мес — только у 4 % больных. При неполучении цитогенетического ответа в течение 12 мес лечения возможность его достижения в дальнейшем равна 0.
Исследование экспрессии 380 генов у ранее не леченных больных, получавших гливек в течение 12 мес, позволило выявить 18 генов, по уровню экспрессии которых различались больные с молекулярной ремиссией к этому времени и те, у кого молекулярного ответа получено не было. Оказалось, что у резистентных к гливеку в 1,9—7,5 раза более выражена экспрессия генов, участвующих в передаче пролиферативного сигнала, процессах апоптоза, клеточной адгезии и регуляции клеточного цикла.
Накопление опыта в лечении гливеком показало, что стабильная гематологическая и цитогенетическая ремиссия сохраняется в тех случаях, когда удается добиться уменьшения количества BCR-ABL-позитивных клеток не менее чем на 3 логарифма (3 log). Уменьшение на 3 log и более количества определяемого транскрипта BCR-ABL (по соотношению BCR-ABL/BCR) рассматривается как большая молекулярная ремиссия. Анализ данных, полученных после 30 мес лечения, показал отсутствие про-грессирования заболевания у всех (100%) больных, у которых в течение первые 12 мес лечения достигнута редукция патологического клона на 3 log или более, и у 93 % больных с редукцией этого клона менее чем на 3 log. Течение болезни без прогрессирования в период, равный 30 мес, наблюдали у 82 % больных, у которых не было получено полной цитогенетической ремиссии в первые 12 мес лечения.
Показано, что при назначении гливека по 600—800 мг/сут и одновременном проведении двух 7-дневных курсов терапии цитозин-арабинозидом по 200 мг/м2 в сутки через 18 мес лечения у 51 % больных была достигнута редукция опухолевого клона более чем 3 log, а у 28 % — более чем на 4,5 log. Из 127 больных, получивших такое лечение, через 18 мес были живы 99 % и 94 % не имели признаков прогрессирования болезни. Лишь у 30 больных не была достигнута большая молекулярная ремиссия (не удалось уменьшить количество BCR-ABL-позитивных клеток на 3 log и более). У двух из них обнаружены мутации в ABL-тирозинкиназном домене белка BCR-ABL. Эти данные подтверждены в кооперированном исследовании из Италии, в котором участвовало 23 центра.
Больным, которые по своим клинико-гематологическим показателям относились к группе промежуточного прогноза по системе Socal, в качестве первоначального лечения назначали 800 мг гливека в сутки. Через 6 мес лечения полная гематологическая ремиссия достигнута у 98 %, полная цитогенетическая — у 87 % больных. После 12 мес лечения полная цитогенетическая ремиссия констатирована у 94 % больных, большая молекулярная ремиссия (уменьшение транскрипта BCL/ABL более чем на 3 log) — у 56 %.
Гливек большинством больных переносится очень хорошо. Наиболее частые проявления негематологической токсичности (тошнота, рвота, диарея, головные боли, мышечные судороги, отеки) возникают у 30—50 % больных, но только у 1—2 % их выраженность превышает I—II степень по шкале ВОЗ и требует временной отмены препарата.
Обычно суточную дозу гливека 400 мг назначают однократно натощак или через 1,5—2 ч после завтрака. Однако у ряда больных при приеме препарата натощак может наблюдаться нерезко выраженная тошнота. В таких случаях рекомендуется принимать препарат вместе с пищей, а если тошнота сохраняется и после этого, разделить дозу препарата на 2 приема.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нечувствительность к гливеку хронического миелолейкоза. Причины резистентности
С появлением в лечении больных хроническим миелолейкозом гливека достигнуты огромные успехи, однако проблему лечения этого заболевания нельзя считать решенной. К настоящему времени более 20 000 больных в различных стадиях хрронического миелолейкоза получили лечение гливеком. Накопленный опыт показал, что, несмотря на констатацию полной цитогенетической ремиссии, очень часто, а возможно никогда, не достигается полная эрадикация патологического клона. A. Hochhaus и соавт. неоднократно на протяжении 15 мес с помощью РВ-ПЦР обследовали 55 больных с полной гематологической и цитогенетической ремиссией, продолжавших ежедневно получать гливек в полной дозе. Все эти больные оставались BCR-ABL-позитивными. Аналогичные результаты получены австралийской группой. С помощью количественной полимеразной цепной реакции на протяжении 18 мес обследовали 55 больных, из них 28 больных получали гливек, 27— ИФН-а и Ara-C.
Полная цитогенетическая ремиссия получена у 21 больного в группе леченных гливеком и лишь у 11 получавших ИФН-а и Ara-C. Уровень транскрипта BCR-ABL был достоверно ниже после лечения гливеком, но лишь у 2 больных его не удалось обнаружить. Сохранение резидуального BCR-ABL-позитивного клона у больных с полной цитогенетической ремиссией после терапии гливеком подтверждено рядом работ, хотя всегда обнаруживается восстановление поликлонального гемопоэза и значительное уменьшение величины лейкемического клона, при этом достоверно большее, чем у больных с полной цитогенетической ремиссией после терапии ИФН-а.
Исследование причин сохранения BCR-ABL-позитивного клона показало, что существуют различные механизмы, определяющие нечувствительность лейкемических клеток к гливеку. Оказалось, что покоящиеся предшественники гемопоэза нечувствительны к гливеку in vitro. Это согласуется с недавно опубликованными данными о том, что при сохранении полной цитогенетической ремиссии и продолжении при этом лечения гливеком в течение 2 лет у всех больных, обследованных с помощью высокочувствительной техники (real-time quantitative PCR и nested PCR assay), удалось обнаружить сохранение BCR-ABL-позитивных CD34+-клеток. На основании результатов использования современной техники определения резидуального клона BCR-ABL-позитивных клеток предлагается даже исключить термин «полная молекулярная ремиссия» для ХМЛ, а говорить о «неопределяемом в данный период времени транскрипте».
Число BCR-ABL-позитивных CD34+-клеток в культуре клеток от больных хроническим миелолейкозом уменьшается при лечении гливеком, и это уменьшение имеет дозозависимый характер.
Наиболее частыми причинами нечувствительности части BCR-ABL-позитивных клеток к гливеку являются повышенная экспрессия гена BCR-ABL в результате его амплификации и точечные мутации в киназном домене ABL-тирозинкиназы, препятствующие ее связи с гливеком. Амплификация гена BCR-ABL с образованием множества копий и увеличением экспрессии его транскрипта в 10—15 раз встречается примерно у 18—20 % больных, с самого начала резистентных к гливеку, или при появлении BCR-ABL-позитивных клеток после полной цитогенетической ремиссии. Иногда при этом обнаруживаются добавочные аберрантные Ph-хромосомы.
При точечных мутациях в результате замены одного нуклеотида происходит замена одной аминокислоты на другую в АТФ (и гливек)-связывающем участке ABL-тирозинкиназы. Это ведет к изменению пространственной структуры тирозинкиназы и невозможности связывания гливека. Первой из описанных и наиболее частой из точечных мутаций является замена цитидина на тимин в позиции 315 молекулы тирозинкиназы. В результате этой замены треонин превращается в изолейцин. ABL-тирозин-киназа связывается с гливеком через водородную связь, для осуществления связи необходим атом кислорода, обычно доставляемый треонином.
В изолейцине атома кислорода нет, поэтому связь ABL-тирозинкиназы с гливеком оказывается невозможной. В культуре клеток, полученных от больных хроническим миелоидным лейкозом, более чем 20-кратное повышение концентрации гливека по сравнению с той, которая подавляет активность ABL-тирозинкиназы дикого типа, не снижало активности ABL-тирозинкиназы с заменой треонина на изолейцин в АТФ-связывающем домене. У 60 % больных, резистентных к гливеку, обнаруживают точечные мутации в одном из трех важнейших районов BCR-ABL-тирозинкиназы: в терминальном, содержащем аминокислоты, которые формируют петлю из нуклеотидов для связывания АТФ; каталитическом домене, куда непосредственно встраивается гливек, и в терминальном карбоксильном участке, непосредственно контролирующем активность каталитических процессов в клетке.
Замена треонина на изолейцин встречается примерно у трети больных с данным механизмом резистентности, однако описано около 30 других мутаций (например, замена треонина на гистидин или глутамина на лизин или валин), наличие которых также обусловливает резистентность к гливеку.
Эти мутации у большинства больных до лечения гливеком не определяются или определяются в очень небольшом количестве клеток. Очевидно, терапия способствует отбору клеток с мутациями, имевшихся до лечения или появившихся в период его. Это показывает, что нерационально применять сниженные дозы препарата, лучше делать перерывы, тем более что уже описано восстановление утраченной чувствительности к гливеку в некоторых случаях после перерыва в терапии.
Не все мутации в молекуле BCR-ABL-тирозинкиназы приводят к потере чувствительности к гливеку. Мутации в позициях 315, 253, 255 и 351 молекулы тирозинкиназы оказываются критическими и всегда сопровождаются потерей чувствительности к гливеку, поскольку располагаются в районе связывания с АТФ и, следовательно, с гливеком. В то же время ряд других мутаций, располагающихся вблизи района связывания, снижают чувствительность к гливеку, но это снижение можно преодолеть, увеличивая дозу препарата.
Иногда при лечении гливеком со временем появляются добавочные хромосомные изменения. Они могут стать причиной включения иных, независимых от активности тирозинкиназы механизмов клеточной пролиферации или уменьшения апоптоза, например в связи с выключением генов-супрессоров (снижение активности гена ТР53 при изменении длинного плеча хромосомы 17). Описано развитие резистентности к гливеку в результате появления аберрантного белка bcr-abl, обусловленного включением в ген BCR-ABL добавочного, «вставного», домена другого гена.
С помощью олигонуклеотидных микрочипов выявлена и другая возможная причина резистентности или слабой чувствительности к гливеку. Изучение экспрессии более 12 000 генов у 53 больных позволило выделить набор из 31 гена, экспрессия любого из них сочеталась с отсутствием полной цитогенетической ремиссии. Часть этих генов связана с адгезией, пролиферацией и апоптозом. Возможно, в таких случаях активируются другие пути клеточной пролиферации, чем обычные при хроническом миелоидном лейкозе (ХМЛ), независимые от активности ABL-тирозинкиназы.
Наконец, исследован еще один механизм возможной резистентности к гливеку, главным образом в стадии акселерации и бластного криза. Показано, что в острой фазе хронического миелоидного лейкоза (ХМЛ) в плазме появляется а,-кислый гликопротеин (AGP), который легко связывается с гливеком, препятствуя его связи с ABL-тирозинкиназой.
В снижении чувствительности к гливеку может иметь значение повышение экспрессии гена множественной лекарственной устойчивости MDR1. Известно, что гливек связывается с продуцируемым этим геном Р-гликопротеином (Pgp) — белком, выполняющим в клетке функцию выведения проникших через мембрану чужеродных веществ, в том числе лекарственных средств. Показано, что клетки больных хроническим миелоидным лейкозом (ХМЛ), экспрессирующие ген MDR1 в культуре, нечувствительны к гливеку и концентрация гливека в таких клетках в 3—24 раза меньшая, чем в клетках, не экспрессирующих MDR1. Неясно, во всех ли случаях сохранения BCR-ABL-позитивных клеток неизбежен рецидив заболевания.
Обнаружение таких клеток у здоровых лиц в значительно большем числе случаев, чем частота заболеваемости хроническим миелоидным лейкозом (ХМЛ), показывает, что возможно длительное существование этих клеток без клинического развития болезни. Возможность длительного персистирования патологического клона без клинической манифестации рецидива наблюдали у больных ОМЛ с t(8;21), у которых клон клеток с этой транслокацией определялся после 10 лет полной клинико-гематологической ремиссии. Известно, что в периоде полной клинико-гематологической и цитогенетической ремиссии в организме больного может сохраняться различное количество лейкемических клеток, в том числе достаточно большое — до 1010. Очевидно, длительность безрецидивного периода должна зависеть как от числа сохранившихся патологических клеток, так и от их способности пролиферировать и подвергаться апоптозу.
Побочные эффекты и осложнения лечения гливеком (Glivec, Gleevec)
Одним из серьезных побочных явлений лечения гливеком, возникающих у 1—2 % больных, являются отеки, чаще всего небольшие и ограниченные периорбитальными областями, но иногда значительные, сопровождающиеся плевральным или перикардиальным выпотом. С учетом этого при отмечаемой больным быстрой прибавке массы тела или наличии видимых отеков необходимо провести тщательное обследование его и назначить диуретики, а при значительных отеках — временно отменить препарат.
Метаболизм гливека осуществляется преимущественно в печени. В связи с этим при нарушении функции печени возможно повышение концентрации гливека в крови. Кроме того, следует иметь в виду, что метаболизм происходит с участием группы ферментов CYP3A4/5, относящихся к системе цитохрома Р-450. Некоторые лекарственные препараты, которые больной вынужден принимать одновременно с гливеком по различным причинам, повышают активность указанных ферментов и поэтому могут ускорять метаболизм гливека, снижая тем самым его концентрацию в крови, а следовательно, и эффективность.
Снижение концентрации гливека в плазме в результате стимуляции указанных печеночных ферментов происходит при приеме глюкокортикоидов, пирамидона, рифампицина, фенобарбитала. Ингибируют указанные печеночные ферменты и тем самым могут вызвать повышение концентрации гливека в плазме с увеличением его токсичности итраконазол и кетоконазол, циклоспорин, эритромицин, ранитидин, верапамил. При лечении гливеком не следует употреблять парацетамол, хотя эта рекомендация основана на единичном случае развития печеночной недостаточности при совместном применении гливека и больших доз парацетамола.
Повышение уровня билирубина и трансаминаз наблюдается редко, однако в течение 1-го месяца терапии следует производить биохимический анализ крови каждые 2 нед, а в последующем при нормальных показателях — каждый месяц. Отмена препарата необходима при 4—5-кратном повышении показателей. Менее чем у 1 % больных приходится отменять препарат из-за гепатотоксичности.
Очень редко наблюдается индивидуальная непереносимость препарата. Описано развитие локальных некрозов печеночной ткани после 11 дней приема гливека по 400 мг/сут и тяжелого дескваматозного поражения кожи и слизистых оболочек после 17 дней приема гливека по 800 мг в день. В обоих случаях отмена препарата привела к быстрой регрессии всех симптомов.
Иногда при приеме гливека появляются судороги в кистях рук, стопах, голенях или бедрах. Причина этого явления неизвестна, так как уровень кальция и магния в сыворотке крови при этом обычно не изменяется. Тем не менее применение препаратов кальция и магния, как правило, приводит к исчезновению этого симптома.
У 20—40 % больных в первый месяц приема гливека появляются боли в костях или суставах. Причина этого также неизвестна. При резко выраженных болях можно назначить нестероидные противовоспалительные препараты. В большинстве случаев через 1—2 мес эти явления самостоятельно проходят.
Редко появляется кожная сыпь, обычно исчезающая после приема антигистаминных препаратов. У больных с высоким содержанием базофилов в крови иногда появляются уртикарные высыпания, вызванные высвобождением гистамина из разрушающихся базофилов.
У некоторых больных отмечается диарея, обычно нерезко выраженная и прекращающаяся при использовании препаратов, снижающих моторику кишечника.
Многие больные при лечении гливеком отмечают прибавку массы тела, которую они, как правило, связывают с улучшением самочувствия и повышением аппетита.
В опытах на мышах выявлен тератогенный эффект гливека, поэтому его не следует принимать при беременности. В этих же опытах была показана активная экскреция препарата с молоком, что исключает грудное вскармливание ребенка при лечении матери гливеком.
Имеются данные о беременностях и родах как у женщин, принимавших гливек длительное время (до 1,5 года), так и у женщин, чьи мужья принимали гливек. Части женщин произведено медицинское прерывание беременности, у некоторых возникли спонтанные аборты, несколько родили здоровых детей.
Гематологическая токсичность редко бывает причиной отмены препарата. Тем не менее перерывы в лечении из-за гематологической токсичности III—IV степени по шкале ВОЗ (нейтрофилов менее 1•109/л и менее 0,5•109/л соответственно, тромбоцитов менее 50•109/л и менее 10•109/л соответственно) приходится делать у 25—30 % больных. Миелосупрессия в первую очередь связана с подавлением препаратом пролиферации клеток-носителей гена BCR-ABL. Однако гливек является ингибитором и других протеинкиназ, в частности киназы c-kit — рецептора фактора стволовых клеток (SCF).
Показано, что гливек подавляет активность киназы c-kit при концентрациях, необходимых для подавления BCR-ABL-позитивных клеток, поэтому частично может быть подавлена пролиферация и здоровых стволовых кроветворных клеток. Это же, по всей вероятности, является причиной частого появления признаков дисплазии различных ростков гемопоэза при лечении гливеком.
Миелосупрессия чаще наблюдается в продвинутых стадиях болезни. Если нейтропения или тромбоцитопения развивается у больного в стадии акселерации либо бластного криза при отсутствии инфекционных или геморрагических осложнений, препарат обычно не отменяют и проводят мероприятия по коррекции показателей (введение колониестимулирующих факторов, переливание тромбоцитов). При возникновении миелосупрессии у больного в хронической стадии делают короткие перерывы в лечении.
Обычно лечение гливеком возобновляют как только уровень гранулоцитов достигает 1,5•109/л и тромбоцитов — 75•109/л. Следует иметь в виду, что в этой группе больных цитогенетические ремиссии достигаются реже и позже, чем в группе больных, которым препарат не пришлось отменять. При повторном развитии миелосупрессии приходится вновь делать короткие перерывы. Некоторые авторы в этих случаях рекомендуют снизить ежедневную дозу гливека до 300 мг, однако это может способствовать развитию резистентности к препарату.
В настоящее время предложена прогностическая модель, учитывающая 2 фактора: снижение уровня гранулоцитов ниже 1•109/л и обнаружение более 65 % Ph-позитивных клеток после 3 мес терапии. К группе низкого риска прогрессирования заболевания отнесены больные, у которых отсутствуют оба фактора (не было в течение первых 3 мес лечения снижения содержания гранулоцитов ниже 1•109/л и к концу 3-го месяца лечения обнаруживалось менее 65 % Ph-позитивных клеток).
В группу промежуточного риска входят больные, у которых имеется один из двух показателей, в группу высокого риска прогрессирования — больные, у которых обнаружены оба неблагоприятных показателя. Показана высокодостоверная разница как в прогрессировании, так и в выживаемости в течение 2 лет наблюдения между больными трех прогностических групп: отсутствие признаков прогрессирования наблюдали у 100 % больных группы низкого риска, у 66 % группы промежуточного и лишь у 15 % больных высокого риска, выживаемость на этот период составила соответственно 100, 82 и 40 %.
Снижение уровня гемоглобина до 80—100 г/л наблюдается нередко. При плохой переносимости анемии или более низких показателях рекомендуется не отменять гливек, а производить гемотрансфузии эритроцитов.
При восстановлении нормального гемопоэза в результате терапии все показатели постепенно нормализуются.
Хронический миелолейкоз
Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
Общие сведения
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
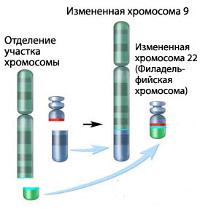
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
- При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния.
- Во второй фазе хронического миелолейкоза – фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения.
- Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
- Монохимиотерапию. При повышении уровня лейкоцитов используют бусульфан. После нормализации лабораторных показателей и уменьшения селезенки пациентам с хроническим миелолейкозом назначают поддерживающую терапию или курсовое лечение бусульфаном. При бластных кризах осуществляют лечение гидроксикарбамидом.
- Радиотерапию. Облучение обычно используют при лейкоцитозе в сочетании со спленомегалией. При снижении уровня лейкоцитов делают паузу продолжительностью не менее месяца, а затем переходят на поддерживающую терапию бусульфаном. Радиотерапию также назначают при хлоромах.
- Полихимиотерапию. В прогрессирующей фазе хронического миелолейкоза возможно использование одного химиопрепарата или полихимиотерапии. Применяют митобронитол, гексафосфамид или хлорэтиламиноурацил. Как и в хронической фазе, проводят интенсивную терапию до стабилизации лабораторных показателей, в последующем переходят на поддерживающие дозы. Курсы полиохимиотерапии при хроническом миелолейкозе повторяют 3-4 раза в год.
- Гемокоррекцию. При неэффективности терапии используют лейкоцитаферез. При выраженной тромбоцитопении, анемии выполняют переливания тромбоконцентрата и эритроцитарной массы.
- ТКМ.Пересадку костного мозга проводят в первой фазе хронического миелолейкоза. Продолжительной ремиссии удается достичь у 70% пациентов.
- Удаление селезенки. При наличии показаний осуществляют спленэктомию. Экстренная спленэктомия показана при разрыве или угрозе разрыва селезенки, плановая – при гемолитических кризах, «блуждающей» селезенке, рецидивирующих периспленитах и резко выраженной спленомегалии, сопровождающейся нарушением функций органов брюшной полости.
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100x10 9 /л, тромбоцитопению менее 150x10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Хронический лейкоз
Хронический лейкоз – это первичное опухолевое заболевание системы кроветворения, субстратом которого выступают зрелые и созревающие клетки миелоидного или лимфоидного ряда. Различные формы хронического лейкоза протекают с преобладанием интоксикационного (слабость, артралгии, оссалгии, анорексия, похудание), тромбогеморрагического (кровоточивость, тромбозы различной локализации), лимфопролиферативного синдромов (увеличение лимфоузов, спленомегалия и др.). Решающее значение в диагностике хронического лейкоза принадлежит исследованию ОАК, биоптатов костного мозга и лимфоузлов. Лечение хронических лейкозов проводится методами химиотерапии, лучевой терапии, иммунотерапии, возможна трансплантация костного мозга.
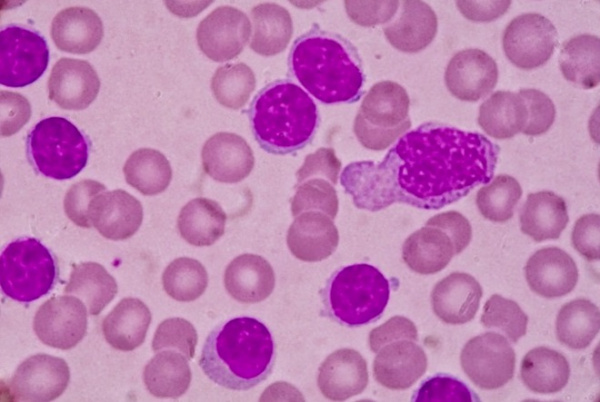
Хронический лейкоз – хронические лимфопролиферативные и миелопролиферативные заболевания, характеризующиеся избыточным увеличением количества кроветворных клеток, сохраняющих способность к дифференцировке. В отличие от острых лейкозов, при которых происходит пролиферация низкодифференцированных гемопоэтических клеток, при хронических лейкозах опухолевый субстрат представлен созревающими или зрелыми клетками. Для всех типов хронических лейкозов характерна длительная стадия доброкачественной моноклоновой опухоли.
Хронические лейкозы поражают преимущественно взрослых в возрасте 40-50 лет; мужчины болеют чаще. На долю хронического лимфоидного лейкоза приходится около 30% случаев, хронического миелоидного лейкоза - 20% всех форм лейкемии. Хронический лимфолейкоз в гематологии диагностируется в 2 раза чаще, чем хронический миелолейкоз. Лейкозы у детей протекают в хроническом варианте крайне редко - в 1-2% случаев.
Истинные причины, приводящие к развитию хронического лейкоза, неизвестны. В настоящее время наибольшее признание получила вирусно-генетическая теория гемобластозов. Согласно данной гипотезе, некоторые виды вирусов (в числе которых – вирус Эбштейна-Барр, ретровирусы и др.) способны проникать в незрелые кроветворные клетки и вызывать их беспрепятственное деление.
Не подвергается сомнению и роль наследственности в происхождении лейкозов, поскольку доподлинно известно, что заболевание нередко носит семейный характер. Кроме этого, хронический миелолейкоз в 95% случаев ассоциирован с аномалией 22-й хромосомы (филадельфийской или Рh-хромосомы), фрагмент длинного плеча которой транслоцирован на 9-ю хромосому.
Факторы риска
Наиболее значимыми предрасполагающими факторами к различным видам и формам хронических лейкозов выступают воздействия на организм:
- высоких доз радиации;
- рентгеновского облучения;
- производственных химических вредностей (лаков, красок и др.);
- лекарственных препаратов (солей золота, антибиотиков, цитостатиков);
- длительный стаж курения.
Риск развития хронического лимфоцитарного лейкоза повышается при длительном контакте с гербицидами и пестицидами, а хронического миелоидного лейкоза – при радиационном облучении.
В патогенезе хронического лимфолейкоза значимая роль принадлежит иммунологическим механизмам – об этом свидетельствует его частое сочетание с аутоиммунной гемолитической анемией и тромбоцитопенией, коллагенозами. Вместе с тем, у большинства больных хроническими лейкозами причинно значимых факторов выявить не удается.
Классификация
В зависимости от происхождения и клеточного субстрата опухоли хронические лейкозы делятся на:
- Лимфоцитарные: хронический лимфолейкоз, болезнь Сезари (лимфоматоз кожи), волосатоклеточный лейкоз, парапротеинемические гемобластозы (миеломная болезнь, макроглобулинемия Вальденстрема, болезни легких цепей, болезни тяжелых цепей).
- Миелоцитарные (гранулоцитарные): хронический миелолейкоз, эритремия, истинная полицитемия, хронический эритромиелоз и др.
- Моноцитарные: хронический моноцитарный лейкоз и гистиоцитозы.
В своем развитии опухолевый процесс при хроническом лейкозе проходит две стадии: моноклоновую (доброкачественную) и поликлоновую (злокачественную). Течение хронического лейкоза условно подразделяется на 3 стадии: начальную, развернутую и терминальную.

Симптомы хронического лейкоза
Хронический миелоидный лейкоз
В начальном периоде хронического миелолейкоза клинические проявления отсутствуют или неспецифичны, гематологические изменения выявляются случайно при исследовании крови. В доклиническом периоде возможно нарастание слабости, адинамии, потливости, субфебрилитета, болей в левом подреберье.
Переход хронического миелоидного лейкоза в развернутую стадию знаменуется прогрессирующей гиперплазией селезенки и печени, анорексией, похуданием, выраженными болями в костях и артралгиями. Характерно образование лейкемических инфильтратов на коже, слизистых полости рта (лейкемический периодонтит), ЖКТ. Геморрагический синдром проявляется гематурией, меноррагией, метроррагией, кровотечениями после экстракции зубов, кровавыми поносами. В случае присоединения вторичной инфекции (пневмонии, туберкулеза, сепсиса и др.) температурная кривая приобретает гектический характер.
Терминальная стадия хронического миелоидного лейкоза протекает с резким обострением всех симптомов и выраженной интоксикацией. В этот период может развиваться плохо поддающееся терапии и угрожающее жизни состояние – бластный криз, когда из-за резкого увеличения количества бластных клеток течение заболевания становится похожим на острый лейкоз. Для бластного криза характерна агрессивная симптоматика: лейкемиды кожи, тяжелые кровотечения, вторичные инфекции, высокая температура, возможен разрыв селезенки.
Хронический лимфолейкоз
Долгое время единственным признаком хронического лимфолейкоза может быть лимфоцитоз до 40-50%, незначительное увеличение одной-двух групп лимфоузлов. В развернутый период лимфаденит принимает генерализованную форму: увеличиваются не только периферические, но и медиастинальные, мезентериальные, забрюшинные узлы. Возникает сплено- и гепатомегалия; возможно сдавление холедоха увеличенными лимфатическими узлами с развитием желтухи, а также верхней полой вены с развитием отеков шеи, лица, рук (синдром ВПВ). Беспокоят упорные оссалгии, кожный зуд, рецидивирующие инфекции.
Тяжесть общего состояния больных хроническим лимфоидным лейкозом обусловлена прогрессированием интоксикации (слабость, потливость, лихорадка, анорексия) и анемического синдрома (головокружение, одышка, сердцебиение, обморочные состояния).
Терминальная стадия хронического лимфоидного лейкоза характеризуется присоединением геморрагического и иммунодефицитного синдромов. В этот период развивается тяжелая интоксикация, возникают кровоизлияния под кожу и слизистые, носовые, десневые, маточные кровотечения.
Осложнения
Иммунодефицит, обусловленный неспособностью функционально незрелых лейкоцитов выполнять свои защитные функции, проявляется синдромом инфекционных осложнений. У больных хроническим лимфолейкозом часты легочные инфекции (бронхиты, бактериальные пневмонии, туберкулезные плевриты), грибковые поражения кожи и слизистых, абсцессы и флегмоны мягких тканей, пиелонефриты, герпетическая инфекция, сепсис.
Нарастают дистрофические изменения внутренних органов, кахексия, почечная недостаточность. Летальный исход при хроническом лимфоидном лейкозе наступает от тяжелых инфекционно-септических осложнений, кровотечений, анемии, истощения. Возможна трансформация хронического лимфолейкоза в острый лейкоз или лимфосаркому (неходжкинскую лимфому).
Предполагаемый диагноз устанавливается на основании анализа гемограммы, с результатами которой пациент должен быть немедленно направлен к врачу-гематологу. Для подтверждения диагноза проводится:
- Общий анализ крови. Типичные для хронического миелоидного лейкоза изменения включают: анемию, присутствие единичных миелобластов и гранулоцитов на разной стадии дифференцировки; в период бластного криза количество бластных клеток увеличивается более чем на 20%. При хроническом лимфолейкозе определяющими гематологическими признаками выступают выраженный лейкоцитоз и лимфоцитоз, наличие лимфобластов и клеток Боткина-Гумпрехта.
- Пункции и биопсии. С целью определения морфологии опухолевого субстрата показано выполнение стернальной пункции, трепанобиопсии, биопсии лимфоузлов. В пунктате костного мозга при хроническом миелолейкозе увеличено количество миелокариоцитов за счет незрелых клеток гранулоцитарного ряда; в трепанобиоптате определяется замещение жировой ткани миелоидной. При хроническом лимфоидном лейкозе миелограмма характеризуется резким усилением лимфоцитарной метаплазии.
- Инструментальные исследования. Для оценки выраженности лимфопролиферативного синдрома применяются УЗИ лимфатических узлов, селезенки, рентгенография грудной клетки, лимфосцинтиграфия, МСКТ брюшной полости и ряд других.
Лечение хронического лейкоза
На ранней доклинической стадии лечение неэффективно, поэтому больные подлежат динамическому наблюдению. Общережимные мероприятия предполагают исключение физических перегрузок, стрессов, инсоляции, электропроцедур и теплолечения; полноценное витаминизированное питание, длительные прогулки на свежем воздухе.
В развернутом периоде миелолейкоза назначается химиотерапевтическое лечение (бусульфан, митобронитол, гидроксимочевина и др.), при выраженной спленомегалии проводится облучение селезенки. Подобная тактика, хоть и не приводит к полному излечению, но существенно тормозит прогрессирование болезни и позволяет отсрочить наступление бластного криза. Кроме медикаментозной терапии, при хроническом миелоцитарном лейкозе используются процедуры лейкафереза. В ряде случаев излечение достигается с помощью трансплантации костного мозга.
При переходе хронического миелолейкоза в терминальную стадию назначается высокодозная полихимиотерапия. В среднем после установления диагноза больные хроническим миелолейкозом живут 3-5 лет, в отдельных случаях – 10-15 лет. Также проводится цитостатическая терапия (хлорбутин, циклофосфамид), иногда в сочетании со стероидной терапией, облучением лимфоузлов, селезенки, кожи. При значительном увеличении селезенки выполняется спленэктомия. Применяется трансплантация стволовых клеток, однако ее эффективность еще требует подтверждения.

Продолжительность жизни больных хроническим лимфоидным лейкозом может составлять от 2-3 лет (при тяжелых, неуклонно прогрессирующих формах) до 20-25 лет (при относительно благоприятном течении).
Читайте также:
- Показания, подготовка к артроскопическому релизу и удлинению латерального удерживателя надколенника
- Лучевая диагностика фарфорового желчного пузыря
- КТ при остеоме височно-нижнечелюстного сустава (ВНЧС)
- Диагностика мешотчатой аневризмы по КТ, МРТ, ангиограмме
- Борозды и шероховатости ногтей при наследственных болезнях
