Немедикаментозная профилактика тромбоэмболии у онкологических больных
Добавил пользователь Евгений Кузнецов Обновлено: 10.01.2026
Венозные тромбоэмболические осложнения повышают риск летального исхода у онкологических пациентов. В последнее время специалисты отдают предпочтение пероральным антикоагулянтам, позволяющим снизить риск кровотечений и частоту рецидивов тромбозов.
Помимо угрозы для жизни, которую представляют любые злокачественные новообразования сами по себе, онкологического заболевания значительно повышают риск возникновения венозных тромбозов, также приводящих к летальным исходам. Так, сегодня нередко встречается ситуации, когда пациенты боятся трагического исхода по причине своего основного онкологического заболевания, тогда как сопоставимый риск жизни у пациентов с раком несут тромбоэмболические осложнения.
Именно теме венозной тромбоэмболии у пациентов с злокачественными новообразованиям посвятил свою лекцию в рамках онлайн школы флебологии «Актуальные вопросы флебологии» 10 апреля Леонтьев Станислав Геннадьевич, д.м.н., главный научный сотрудник отдела фундаментальных и прикладных исследований в хирургии НИИ клинической хирургии РНИМУ им. Н.И. Пирогова, ГКБ № 1 им. Н.И. Пирогова, Москва.
Станислав Геннадьевич обратил внимание слушателей на то, что особенностью канцерассоциированных венозных осложнений являются мигрирующие, распространенные тромбозы поверхностных и глубоких вен, которые плохо поддаются лечению и имеют тенденцию к частому рецидивированию. Венозные тромбоэмболические осложнения (ВТЭО) – наиболее частое осложнение у онкологических пациентов и вторая наиболее распространенная причина смерти у пациентов с активным раком.
До 40% всех ВТЭО наблюдаются более чем через 21 день после операции по поводу рака, что, по мнению доктора Леонтьева, является побудительным мотивом назначения длительной послеоперационной антикоагулянтной терапии. Он также подчеркнул, что по данным исследований, у онкобольных намного выше частота фатальной ТЭЛА и фатального кровотечения, чем у пациентов без злокачественного процесса (2,6% против 1,4%, и 1% против 0,3%, соответственно).
На примере клинического случая 55-летней пациентки Станислав Геннадьевич разобрал основные ошибки в диагностике и ведении больных с тромбоэмболическими осложнениями у пациентов с раком, и подробнее остановился на вопросах современного подхода к терапии ВТЭО.
Долгое время различные клинические рекомендации указывали в качестве приоритетной терапии низкомолекулярные гепарины (НМГ). Для начального лечения в течение первого месяца предпочтительно использование терапевтических доз НМГ. Затем, для продленной терапии, по меньшей мере, в течение 3 месяцев, рекомендуются промежуточные дозы (50-75% лечебной), также допускается применение антагонистов витамина K с целевыми значениями МНО от 2 до 3. В последнее время в клинических рекомендациях все большая роль отдается пероральным антикоагулянтам (ПОАК).
Последние исследования ПОАК, а в частности, апиксабана (Эликвис), показали, что по своей эффективности и безопасности отдельные препараты этой группы сопоставимы со стандартной терапией ВТЭО (эноксапарин/варфарин). Эликвис, мощный прямой ингибитор FXa, в исследовании реальной клинической практики продемонстрировал лучшую эффективность по сравнению с варфарином и НМГ по предотвращению рецидива ВТЭО у пациентов с активным раком, а также показал снижение риска большого кровотечения на 31% и клинически значимых небольших кровотечений на 19% по сравнению с НМГ у той же группы пациентов.
Доктор Леонтьев привел примеры клинических исследований, свидетельствующих о том, что апиксабан может быть удобным вариантом лечения пациентов с ВТЭО на фоне рака.
Одно из таких испытаний, ADAM VTE Trial, было посвящено изучению эффективности и безопасности апиксабана исключительно у онкологических пациентов, в том числе получавших химиотерапию. Препаратом сравнения в этом исследовании выступал дальтепарин, рекомендуемый сегодня в качестве приоритетного средства из группы НМГ для онкобольных. Применение апиксабана у онкобольных в рамках данной работы не привело к развитию больших кровотечений (0 случаев против 1,4% на фоне приема дальтепарина), и частота рецидивов венозных тромбоэмболических осложнений, по сравнению с группой дальтепарина, была также значительно меньше (0,7% против 6,3%). Летальных исходов по причине тромбоэмболических осложнений в обеих группах не было.
Еще одно сравнение эффективности и безопасности апиксабана и дальтепарина (в стандартной дозировке 200 мг/кг массы тела в течение суток) было проведено в масштабном исследовании CARAVAGGIO (n=1155). В результате было выявлено недостоверное, но снижение частоты рецидивов венозного тромбоза в группе апиксабана (5,6% пациентов против 7,9%). Во время лечения апиксабаном не наблюдалось увеличения риска больших кровотечений, в том числе желудочно-кишечных, по сравнению с дальтепарином, что позволило авторам работы прийти к выводу, что апиксабан не уступал в эффективности и безопасности подкожному дальтепарину для лечения ВТЭО, связанных с раком.
Доктор Леонтьев отметил, что с 2018 года новые пероральные антикоагулянты активно занимают свое место в многочисленных западных рекомендациях (ASCO, SSC, NCCN). Совсем свежее руководство Американской Ассоциации гематологов (2021) для краткосрочного (в первые 3-6 месяцев) лечения больных с активным раком советуют применять не НМГ, а ПОАК, и, в частности, апиксабан. Рекомендации европейского общества сосудистых хирургов 2021 года также прописывают ПОАК и, в частности, апиксабан как средство лечения пациентов с венозным тромбозом и онкологией. Важно, однако, что ПОАК у больных с раком ЖКТ следует назначать с осторожностью из-за повышенного риска желудочно-кишечных кровотечений.
В заключение Станислав Геннадьевич обратил внимание слушателей на необходимость длительного применения антикоагулянтов у больных с канцерассоциированными тромбозами. Если тромбоз развился на момент излечения больного, антикоагулянты следует назначать на срок не менее 6 месяцев, тогда как при активном раке пациент должен находиться на профилактической антикоагулянтной терапии постоянно, до момента излечения.
Copyright 2021 Пфайзер Россия. Все права защищены. Информация предназначена только для специалистов здравоохранения Российской Федерации.
Немедикаментозная профилактика тромбоэмболии у онкологических больных
Факторы риска тромбоэмболических осложнений при раке
Венозные тромбоэмболические осложнения могут предшествовать диагнозу злокачественной опухоли женских половых органов или быть результатом противоопухолевого лечения, особенно хирургического и химиотерапевтического.
Большинство женщин со злокачественными новообразованиями половых органов имеют несколько факторов риска, которые увеличивают вероятность венозной тромбоэмболии (ВТЭ) во время терапии.
Причины венозной тромбоэмболии (ВТЭ) были впервые описаны Вирховым в 1858 г., к ним относятся повышенная свертываемость крови, замедление венозного кровотока и повреждение эндотелия. Кроме повышенного риска венозной тромбоэмболии (ВТЭ) вследствие злокачественного новообразования имеются и другие факторы риска, которые включают пожилой возраст пациентки, обширное оперативное вмешательство, принадлежность не к белой расе, тромбоз глубоких вен (ТГВ) или тромбоэмболия легочной артерии (ТЭЛА) в анамнезе, отек нижних конечностей или варикозное расширение вен, ожирение (избыточная масса тела), использование ранее ЛТ, а также повышенная свертываемость крови: фактор V Лейден, беременность и применение пероральных контрацептивов, эстрогенов или тамоксифена.
Интраоперационными факторами, связанными с послеоперационным тромбозом глубоких вен (ТГВ), служат увеличение времени анестезии, повышенная кровопотеря и необходимость в трансфузии во время операции. Важно установить эти факторы риска, чтобы обеспечить соответствующую профилактику венозного тромбоза. Основные принципы определения степени риска ВТЭ представлены в таблице ниже.

*Факторы риска: злокачественное новообразование, пожилой возраст, обширные хирургические вмешательства, ожирение, варикозное расширение вен, наличие ТГВ или ТЭЛА в анамнезе, современные гормональные препараты, использование тамоксифена или пероральных контрацептивов, тромбофилия.
Методы профилактики тромбоэмболических осложнений при раке
Тромбоз глубоких вен (ТГВ) и тромбоэмболия легочной артерии (ТЭЛА), хотя и предотвратимы, считаются тяжелыми осложнениями у женщин со злокачественными новообразованиями половых органов, особенно у перенесших операцию. Проблема профилактики ВТЭ очень важна для онкогинекологов, т. к. 40 % всех летальных исходов после хирургических вмешательств непосредственно связаны с ТЭЛА, что представляется самой частой причиной смерти после операции у больных РЭ или РШМ.
Профилактические мероприятия значительно снижают частоту тромбоза глубоких вен (ТГВ) у женщин со злокачественными опухолями половых органов. В некоторых исследованиях, включавших достаточное количество больных, показано снижение частоты фатальной ТЭЛА.
Метод профилактики должен быть эффективным, без значительных побочных эффектов, быть удобным для больной и медицинского персонала, быть приемлемым для большинства больных и дешевым.
Доступные профилактические методы можно разделить на лекарственные средства, которые снижают повышенную свертываемость крови, и механические методы, которые уменьшают застой в сосудах и могут усилить фибринолиз. Ключом к успешному использованию профилактических методов служит понимание того, что женщины со злокачественным новообразованием половых органов относятся к группе высокого риска и для достижения максимального успеха необходимы более интенсивные профилактические мероприятия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Низкие дозы гепарина в профилактике тромбоэмболии у онкологических больных
Наиболее изученный из всех профилактических методов по предотвращению тромбоза глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА) — п/к введение низких доз гепарина (НДГ). Более 25 контролируемых исследований продемонстрировали, что гепарин, введенный п/к за 2 ч до операции и каждые 8—12 ч после нее, эффективно снижает вероятность ТГВ.
Эффективность низких доз гепарина (НДГ) для предотвращения фатальной ТЭЛА была установлена в рандомизированном контролируемом многоцентровом международном исследовании, которое показало статистически значимое снижение послеоперационной смертности от ТЭЛА у больных, получавших НДГ каждые 8 ч после операции. Изучение эффективности применения НДГ после операций по поводу доброкачественных опухолей половых органов подтвердило статистически значимое снижение частоты ТГВ.
Однако в рандомизированном клиническом исследовании было обнаружено, что у больных со злокачественными новообразованиями половых органов режим введения низких доз гепарина (НДГ) по 5000 ЕД каждые 12 ч оказался неэффективным.
В более позднем клиническом исследовании была проведена оценка в 2 раза более интенсивного гепаринового режима у больных со злокачественными опухолями половых органов и высоким риском тромбоэмболических осложнений. Гепарин вводили или по 5000 ЕД п/к за 2 ч до и каждые 8 ч после операции, или по 5000 ЕД п/к каждые 8 ч до операции (как минимум 3 раза) и каждые 8 ч после нес. Оба этих профилактических режима в значительной степени снижали вероятность ТГВ после операции у больных со злокачественными новообразованиями половых органов.
Можно заключить, что для обеспечения эффективной профилактики у женщин после операции по поводу злокачественных опухолей половых органов необходимо введение 5000 ЕД низких доз гепарина (НДГ) каждые 8 ч.
Хотя полагают, что низкие дозы гепарина (НДГ) не оказывают никакого значительного влияния на коагуляцию, в большинстве крупных исследованиях отмечалось увеличение частоты кровотечений, причем особенно высока вероятность раневой гематомы. Было обнаружено, что тромбоцитопения, связанная с использованием НДГ, выявлена у 6 % прооперированных больных.
Если пациентке продолжают вводить низкие дозы гепарина (НДГ) более 4 дней, целесообразно определить содержание тромбоцитов, чтобы оценить вероятность гепарин-индуцированной тромбоцитопении.
Низкомолекулярные гепарины в профилактике тромбоэмболии у онкологических больных
Низкомолекулярные гепарины (НМГ) представляют собой фрагменты гепарина, молекулярная масса которых варьирует от 4500 до 6500 Да. По сравнению с нефракционированным гепарином (НФГ) НМГ обладают большей антикоагулянтной и меньшей антитромбиновой активностью, что приводит к меньшему воздействию на активированное частичное тромбопластиновое время (АЧТВ), а следовательно, к меньшему количеству осложнений, связанных с кровотечением. Увеличение периода полувыведения НМГ позволяет вводить их 1 раз в сутки, что очень удобно.
В рандомизированных контролируемых клинических исследованиях сравнивали эффекты НМГ с НФГ у прооперированных больных по поводу злокачественных опухолей половых органов. Во всех исследованиях обнаружили одинаковую частоту ТГВ. Осложнения, связанные с кровотечениями, были сходны при применении НФГ и НМГ. При метаанализе 32 клинических испытаний было обнаружено, что ежедневное введение НДГ так же эффективно, как и введение НФГ для профилактики ТГВ после операции, причем каких-либо различий в частоте кровотечений не наблюдалось.
Основываясь на рандомизированных клинических исследованиях при других онкологических заболеваниях, предположили, что для оптимальной профилактики необходим более интенсивный режим НМГ. Наконец, профилактика в течение 2 нед. после операции приводила к улучшению результатов. Поскольку в настоящее время данный метод не считается стандартом лечения,длительная профилактика гепарином должна применяться только у больных с чрезвычайно высоким риском тромбоэмболических осложнений.
Было продемонстрировано развитие застоя (стаза) в венах нижних конечностей во время операции; продолжительность этого состояния после операции различна. Застой в венах задней части голени на протяжении операции, повышение свертываемости крови, индуцированное злокачественным новообразованием и хирургическим вмешательством, служат первичными факторами, способствующими развитию острого послеоперационного тромбоза глубоких вен (ТГВ).
Проспективные исследования послеоперационного тромбоза вен показали, что в венах задней части голени чаще всего возникает тромб, причем большинство тромбов образуется в течение 24 ч после хирургического вмешательства.
Для уменьшения застоя в венах нижних конечностей всем больным после операции рекомендуют сокращать время пребывания в больнице до операции и как можно раньше начинать активную ходьбу после операции. Приподнимание ножного конца кровати, расположение задней части голени выше уровня сердца обеспечивают дренаж вен и снижают риск застоя в будущем.
Чулки с градуированной компрессией (ЧГК) для профилактики тромбоэмболии
Контролируемые исследования эффективности использования чулков с градуированной компрессией (ЧГК) ограничены, но при тщательном подборе компрессионные чулки оказывают умеренное действие. Плохо подобранные чулки могут быть опасными для некоторых больных, у которых развивается эффект жгута в колене или в средней части бедра.
Различия анатомии не позволяют идеально подобрать всем пациенткам чулки подходящего размера. Простота в использовании эластичных чулок и отсутствие значительных побочных эффектов, вероятно, считаются основными причинами включения их в стандартную послеоперационную профилактику ТГВ.

а - чулки с градуированной компрессией (ЧГК)
б - внешняя пневматическая компрессия
Внешняя пневматическая компрессия для профилактики тромбоэмболии
Большинство источников литературы описывает снижение послеоперационного венозного стаза при интермиттирующей внешней компрессии нижних конечностей пневматическими манжетками, расположенными вокруг задней части голени или всей ноги, во время операции и в послеоперационный период. Существуют различные приборы для внешней пневматической компрессии (ВПК) и различный дизайн манжеток, но превосходство одной системы над другой не доказано.
Компрессия задней поверхности голени во время или после операции по поводу злокачественных новообразований, так же как и низкие дозы гепарина (НДГ), значительно снижает частоту тромбоза глубоких вен (ТГВ). Кроме увеличения скорости венозного потока и пульсирующего опорожнения вен задней части голени ВПК, по-видимому, также увеличивает эндогенный фибролизис, который вызывает лизис самых ранних тромбов до того, как они станут клинически значимыми.
Продолжительность послеоперационной внешней пневматической компрессии (ВПК) различна в разных клинических исследованиях. Внешняя пневматическая компрессия (ВПК) может быть эффективна при использовании в операционной и на протяжении первых 24 ч после операции у больных с удовлетворительным состоянием, которые начинают передвигаться в первый же день после операции.
Доказано, что внешняя пневматическая компрессия (ВПК) у больных, подвергшихся обширной операции по поводу злокачественных новообразований половых органов, позволяет снизить вероятность осложнений, связанных с ВТЭ, примерно в 3 раза. Однако это возможно лишь в том случае, если компрессию задней части голени применили во время операции и в течение первых 5 дней после хирургического вмешательства. У больных со злокачественными новообразованиями половых органов риск ВТЭ сохраняется более длительное время, чем у прооперированных больных по другому поводу, и вследствие этого, вероятно, более успешной будет длительная ВПК.
Внешняя пневматическая компрессия (ВПК) нижних конечностей не имеет никаких побочных эффектов и более выгодна по стоимости по сравнению с фармакологическими методами профилактики. Конечно, соблюдение рекомендаций врача по использованию компрессии нижних конечностей при постельном режиме крайне важно, поэтому для достижения максимального успеха и пациентка, и медицинский персонал должны быть обучены соответствующему лечебному режиму.
Мы собрали сведения о факторах риска, связанных с недостатками внешней пневматической компрессии (ВПК), используемой для профилактики тромбоза глубоких вен (ТГВ), в ретроспективном анализе 1862 больных, прооперированных по поводу злокачественных новообразований половых органов, которым после операции была выполнена интермиттирующая пневматическая компрессия в Университете Duke в период 1992—1997 гг. Факт предшествующей ВТЭ, диагноз злокачественной опухоли и возраст более 60 лет были факторами, связанными с развитием ТГВ, несмотря на профилактическое использование ВПК (р < 0,05).
У больных, имеющих два или более факторов риска, существует 16-кратное увеличение частоты тромбоза глубоких вен (ТГВ) после операции, несмотря на профилактические мероприятия (р < 0,05). Для больных с высоким риском тромбоэмболических осложнений показаны комбинированные методы профилактики.
Немедикаментозные способы профилактики ВТЭО включают раннюю активизацию больных после перенесенной операции и применение градуированного компрессионного лечебного трикотажа. Длительное время для компрессионной терапии использовались эластичные бинты, применение которых имеет ряд технологических неудобств. В современной терапии хронических заболеваний вен чаще применяется специальный компрессионный трикотаж, обладающий свойством физиологически распределенной градуированной компрессии. Действие компрессионного трикотажа основано на том, что эластическая компрессия создает дополнительный каркас для больных вен, предотвращая их растяжение, ускоряет ток венозной крови, предохраняя от образования тромбов 19. Несмотря на это, в клинической практике повсеместно распространено применение эластичных бинтов, которые не в полной мере соответствуют целям тромбопрофилактики.
В нашей клинике компрессионный трикотаж применяется с 2010 г., ранее использовалось эластическое бинтование. Нами было проанализировано влияние данного изолированного фактора на развитие ВТЭО применительно к онкоурологической практике.
Цель проведенного исследования - улучшение результатов лечения больных злокачественными образованиями мочеполовой системы за счет снижения тромбоэмболических осложнений путем комплексной тромбопрофилактики с использованием компрессионного трикотажа.
В задачи исследования входило сравнение эффективности алгоритма тромбопрофилактики с использованием компрессионного трикотажа и применения эластичных бинтов; внедрение использования компрессионного трикотажа в алгоритм комплексной тромбопрофилактики онкоурологических больных; оценка частоты тромботических осложнений у данной категории больных.
Исследование проводили на базе НИИ урологии. Пациенты были разделены на две группы. 1-я группа (группа исследования) проспективная, в нее вошли пациенты, оперированные в период с апреля 2010 г. по апрель 2011 г. по поводу онкоурологических заболеваний. В данную группу входили пациенты, которым во время оперативного вмешательства и в послеоперационном периоде в комплексе профилактики тромбоэмболических осложнений применяли чулки VENOTEKS HOSPITAL ANTIEMBOLISM. Чулки представляют собой изделия из компрессионного трикотажа белого цвета без носочной части с силиконовым фиксатором, состоят из нейлона (90%) и лайкры (10%). Имеют 4 размера. Максимальное давление создается на лодыжке и плавно уменьшается к бедру: лодыжка 100%, середина икры 80%, колено 50-60%, бедро 20-30%.
Во 2-й группе больных (группа сравнения, ретроспективная), аналогичных по количеству, половозрастному составу и виду оперативных вмешательств, которым выполнены оперативные вмешательства в 2009 г., в качестве сравнения проведен ретроспективный анализ тромбоэмболических осложнений. В этой группе использовали эластическое бинтование ног. В остальном протокол ведения в плане профилактики тромбоэмболических осложнений (сроки введения и дозы низко-молекулярных гепаринов, сроки активизации), а также методики оперативных вмешательств были сходны с исследуемой группой.
В исследование включали пациентов обоего пола в возрасте от 18 до 80 лет, которым выполнено оперативное вмешательство по поводу злокачественных новообразований. Критериями исключения из исследования являлись сердечно-легочная недостаточность, язвы неварикозной этиологии, нарушения артериального кровообращения нижних конечностей (облитерирующий атеросклероз и артериосклероз, диабетическая ангиопатия - при снижении АД

Программа обследования и лечения пациентов предусматривала несколько этапов. До оперативного лечения оценивали анамнез: сроки основного заболевания, перенесенные и сопутствующие заболевания сердечно-сосудистой системы, венозной системы, проводимая терапия. Риск развития венозных тромбозов и ТЭЛА при хирургических вмешательствах определяли по классификации, предложенной C. Samama и M. Samama в 1999 г. (в модификации), приведенной в Российском консенсусе 2000 г. и изложенной в методической разработке А.В. Вардянян и соавт., 2009 г. [18]. Материал представлен в табл. 1.
Возможность наличия тромбофилии оценивали по следующим критериям [19]:
- тромботическая наследственность (наличие тромбозов у ближайших родственников);
- тромбозы, возникающие во время ситуаций, легко переносимых здоровыми людьми: длительные поездки, прием противозачаточных средств, беременность и т.д.;
- тромбозы, возникающие в молодом возрасте (
- сочетание артериальных и венозных тромбозов;
- сочетание тромбозов с гибелью плода;
- тромбозы необычной локализации (вен мозга, мезентериальных вен);
- тромбозы поверхностных вен;
- некрозы кожи, вызванные приемом кумаринов.
При наличии патологических изменений венозной системы оценивали выраженность клинической симптоматики (классификация СЕАР) и субъективной симптоматики. Проводили лабораторные исследования гемостаза: протромбиновое время, международное нормализованное отношение (МНО), протромбиновый индекс (в %), АЧТВ (в с), фибриноген по Клаусу (в г/л), тромбиновое время (в с), показатели уровня D-димера фибрина. В 1-й день после оперативного лечения (1 визит) проводили повторное клиническое обследование, контроль тромбоэмболических осложнений, контроль нежелательных явлений. На 7-й день после оперативного лечения выполняли контрольное исследование (как клиническое, так и лабораторное).
Оценку клинической эффективности и переносимости компрессионных чулок VENOTEKS HOSPITAL ANTIEMBOLISM проводили на основании контроля тромбоэмболических осложнений, удобства и комфортности применения, контроля нежелательных явлений (аллергических реакций).
Основным критерием оценки безопасности служило отсутствие нежелательных явлений (аллергических реакций) в процессе исследования, связанных с применением компрессионных изделий.
В исследуемую группу были включены 605 человек, в контрольную - 403 (табл. 2 и 3).
Риск развития венозных тромбоэмболических осложнений при перечисленных оперативных вмешательствах мы расценивали в большинстве наблюдений как высокий. Это было связано с тем, что наличие злокачественного новообразования у пациента, в соответствии с Российским консенсусом определяет риск развития ВТЭО при хирургическом вмешательстве как высокий даже без учета дополнительных факторов. Как дополнительные факторы риска развития ВТЭО нами учитывались виды анестезиологического пособия при оперативных вмешательствах, возраст пациентов, анамнестические данные, наличие сопутствующих заболеваний, а также проводимая химиотерапия, влияющие на эндотелий сосудистой стенки и на развитие тромбогенных факторов.
Средний возраст пациентов составил 59,8±10,5 года. Средняя масса тела - 83,0±16,3 кг. 21,9% пациентов получали низкомолекулярные гепарины (НМГ): 10,2% - препарат эноксапарин, 11,7% - фраксипарин. Такой относительно небольшой процент пациентов, получавших НМГ, объясняется большой удельной долей эндоскопических вмешательств, при которых НМГ не показаны. Этим же было обусловлено назначение 35% пациентов гемостатической терапии препаратом дицинон.
Клиническая симптоматика, связанная с венами нижней конечности, полностью отсутствовала только в 16% наблюдений. У этих больных при последующем осмотре не отмечено ухудшения. В 56% наблюдений имели место телеангиоэктазии или ретикулярные варикозные вены, в ходе лечения не было нарастания симптоматики.
У 22% пациентов до операции отмечалась более выраженная симптоматика - наличие варикозного расширения вен больше 3 мм. На этапе V-2 ухудшения симптоматики также не выявлено.

У 6% больных наблюдавшиеся венозные отеки нижних конечностей также не усугублялись благодаря проводимой терапии (табл. 4).
Таким образом, терапию в части влияния на клиническую симптоматику можно считать эффективной.
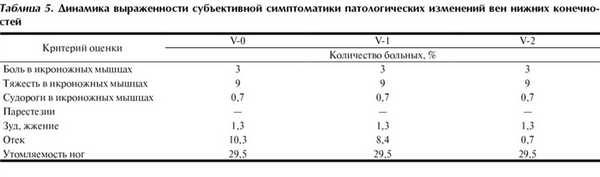
Наиболее частым субъективным симптомом со стороны вен нижних конечностей было наличие утомляемости ног (табл. 5). Важно отметить, что эти жалобы присутствовали до лечения и усугубления симптоматики на фоне оперативного вмешательства и в послеоперационный период не отмечались.

У пациентов отмечались неблагоприятные факторы - злокачественные новообразования, операция, постельный режим, однако противотромботическая терапия была эффективной, осложнений не наблюдалось (табл. 6).
Учитывая, что в нашем исследовании не встречалось тромбозов и тромбоэмболий легочной артерии, применение компрессионного трикотажа расценивалось как эффективное. Кожные аллергические реакции отсутствовали во всех наблюдениях. Ни в одном наблюдении не было индивидуальной непереносимости, которая потребовала бы прекращения ношения компрессионного трикотажа. Большинство больных оценивали ношение трикотажа VENOTEKS HOSPITAL ANTIEMBOLISM как комфортное. Проблемы возникали у 11% пациентов при первом надевании чулок, что объяснялось отсутствием соответствующих навыков и общей стрессовой ситуацией перед операцией. Использование чулок удобно в эксплуатации. Нареканий, жалоб не отмечалось ни в одном наблюдении.
В контрольной группе в 2 наблюдениях имела место ТЭЛА со смертельным исходом: мужчина 59 лет с диагнозом рак единственной левой почки Т1NxM0, состояние после резекции единственной почки; мужчина 63 лет с диагнозом рак простаты Т2NxM0, состояние после экстраперитонескопической радикальной простатэктомии. Также в 4 наблюдениях отмечалась тромбоэмболия мелких ветвей легочной артерии без смертельного исхода.
Только повлияв на такой фактор, как компрессионная терапия, с помощью применения компрессионных чулок вместо эластического бинтования удалось достоверно снизить частоту тромбоэмболических осложнений.
Таким образом, включение компрессионного трикотажа VENOTEKS HOSPITAL ANTIEMBOLISM в алгоритм комплексной тромбопрофилактики у онкоурологических больных позволило достоверно снизить частоту тромбоэмболических осложнений по сравнению с использованием эластического бинтования. Использование компрессионного трикотажа хорошо переносится больными, не вызывает субъективного дискомфорта, безопасно и удобно в клиническом применении. У больных онкоурологическими заболеваниями применение компрессионного трикотажа более эффективно по сравнению с эластическим бинтованием.
С нашей точки зрения, внедрение в клиническую практику компрессионного противоэмболического трикотажа для профилактики тромбоэмболических осложнений при проведении оперативных вмешательств является обязательным не только в онкоурологии, но и в других областях медицины.
Читайте также:
- Патогенез (биохимические основы) болезни Гентингтона. Молекулярная генетика
- Регуляция сердечного выброса. Механизм Франка-Старлинга
- Гистологическое строение болезни педжета. Лечение болезни Педжета.
- Инфекции, вызываемые Haemophilus
- Коррекция нарушений липидного обмена. Антиагреганты при стенокардии.
