Обзор лимфомы
Добавил пользователь Евгений Кузнецов Обновлено: 24.01.2026
Лимфома Ходжкина — это онкологическое заболевание, характеризующееся диссеминированным или локализированным стремительным размножением клеток лимфоретикулярной системы. В медицинской практике эта патология получила название лимфогранулематоза (ЛГМ).
В международной классификации болезней эта патология имеет коды по МКБ-10 С81-С81.9. В группу риска его развития входят люди от 15 до 35 лет. Следующий пик приходится на тех, кто перешагнул 50-летний возрастной рубеж. ЛГМ — это заболевание, которое ранее считалось неизлечимым, но сейчас при своевременном выявлении и начале терапии может быть устранено полностью.
Что это такое лимфома Ходжкина
В организме человека в результате деления клеток ежеминутно из-за неправильного взаимодействия нуклеозидов в молекулах ДНК формируются потенциально раковые клетки. В норме имеющиеся мутации делают их нежизнеспособными, что запускает процесс их отмирания, поэтому дальнейшее деление пораженной клетки не происходит и злокачественное образование не формируется.

Болезнь Ходжкина, или лимфогранулематоз, подтверждается, когда выявляются особые переродившиеся клетки Рид-Березовского-Штернберга. Изначально лишь в 1 лимфатическом узле начинает формироваться рак, онкология в этом случае носит локальный характер. Этот вариант патологии, в отличие от неходжкинской лимфомы, встречается реже. Происходит активация защитных механизмов организма и в пораженную область перемещается большое количество лейкоцитов. Это приводит к формированию плотного покрова вокруг опухолей и зарастанию их фиброзными тяжами.
Такие образования в пораженном лимфоузле формируют крупные гранулемы. Воспалительный процесс, который сопровождается появлением опухолей, приводит к тому, что лимфоузел стремительно увеличивается в размерах.
По мере прогрессирования заболевания метастазы опухоли приобретают способность распространяться.
Учитывая, что все лимфатические узлы располагаются возле жизненно важных органов, метастазы быстро распространяются на них. Это приводит к появлению множества вторичных гранулем не только в лимфатической системе, но и других тканях. Анализ крови при лимфоме Ходжкина позволяет выявить лимфоцитоз уже на ранних этапах развития патологии.
Причины и симптомы
Этиология появления этого патологического состояния еще не уточнена в полной мере. Исследователи выделяют несколько возможных причин возникновения такого типа онкологии, как болезнь Ходжкина. Особо выделяются вирусная, наследственная и иммунные теории появления этой патологии. Наиболее часто болезнь Ходжкина возникает у людей, перенесших в острой форме заражение вирусом Эпштейна-Барр и инфекционным мононуклеозом, ретровирусом и ВИЧ.
Согласно иммунологической теории возникновения этого патологического состояния, отмечается вероятность трансплацентарного переноса материнских лимфоцитов, которые в организме плода в дальнейшем запускают иммунопатологическую реакцию. Это наиболее вероятная причина развития лимфомы Ходжкина у детей и подростков.
Учитывая высокую частоту выявления случаев болезни Ходжкина у кровных родственников, выделяется его семейная форма. Уже выявлены гены, которые запускают процесс злокачественного перерождения тканей лимфатической системы.
Кроме того, велика вероятность развития этого патологического состояния при спонтанной мутации. К факторам, которые могли бы спровоцировать появление болезни Ходжкина, не обусловленного наследственной предрасположенностью, особенностями иммунной системы и вирусной нагрузкой, относятся:
- влияние ионизирующего излучения;
- отравление токсическими веществами;
- прием некоторых лекарственных препаратов;
- употребление пищи, богатой консервантами и канцерогенами.
У мужчин, которые работают на вредном производстве, в экологически неблагоприятных зонах и живут в крупных индустриальных городах, наиболее часто диагностируется болезнь Ходжкина неуточненная. Для того чтобы определить патологию, нередко достаточно оценки показателей, полученных при выполнении анализа крови на лимфогранулематоз. Вне зависимости от формы и вида течения патологического процесса у пациентов, страдающих болезнью Ходжкина, наблюдается появление следующих характерных симптомов:
- периодическая лихорадка до 39°C;
- общая слабость;
- снижение аппетита;
- кожный зуд;
- ночная потливость;
- потеря массы тела.
Степень выраженности этих симптомов во многом зависит от стадии развития злокачественной опухоли такого типа. По мере усугубления патологического процесса могут появляться интенсивные боли в лимфоузлах, ломота в костях и суставах, признаки дисфункции пораженных вторичными опухолями органов.
Существует несколько подходов классификации онкологии этого типа. В первую очередь болезнь Ходжкина подразделяют на локальный вид, сопровождающийся поражением одного или нескольких лимфатических узлов, а кроме того, генерализованный, при котором наблюдается гиперплазия, т. е. разрастание тканей в отдаленных органах, в том числе печени, селезенке, желудке, коже и легких.
В зависимости от скорости нарастания патологического процесса лимфогранулематоз может быть:
- острым, т. е. развивающимся в течение нескольких месяцев от начальной до терминальной степени;
- хроническим, для которого свойственно затяжное многолетнее течение, с чередованием периодов обострений и ремиссий.
Классическая лимфома Ходжкина подразделяется на 4 гистологических вида.
Самой редко встречающейся является гистологическая форма, сопровождающаяся лимфоидным истощением. В зависимости от морфологических особенностей данный вид болезни приводит к появлению многочисленных переродившихся клеток и интенсивному замещению здоровых тканей фиброзом.
Немного чаще встречается вариант патологии, характеризующийся лимфоидным преобладанием. В этом случае выявляется относительно небольшое количество клеток Рид-Березовского-Штейнберга и повышенное содержание B-лимфоцитов. Кроме того, могут присутствовать признаки сетчатого склероза.
Примерно в 25% случаев выявляется смешанно-клеточный вариант лимфомы. Этот гистологический вид патологии характеризуется появлением умеренного количества клеток Рид-Березовского-Штейнбега, но при этом инфильтрат является смешанным. Самый распространенный гистологический вид лимфомы Ходжкина — нодулярный склероз. На его долю приходится более 67% диагностированных случаев этой патологии.
Эта опухоль сопровождается появлением плотной оболочки из фиброзной ткани вокруг сформированных узелков из тканей Ходжкина
Для определения степени прогрессирования патологического процесса нередко используется классификация лимфомы Ходжкина по системе TNM, где буквы:
- Т — степень распространения имеющейся первичной опухоли;
- N — присутствие метастазов в расположенных рядом лимфоузлах и степень их выраженности;
- M — наличие отдаленных метастазов.
Эта классификация позволяет максимально уточнить распространенность онкологии.
Стадии
Согласно классификации TNM, выделяются 4 стадии лимфомы Ходжкина. Каждая имеет свои особенности. Первую стадию патологического процесса принято подразделять на подстадии I и IE. В этот период первичная опухоль прощупывается в 1 лимфатическом узле, вилочковой железе или селезенке. Несмотря на то, что при исследованиях уже могут быть выявлены признаки онкологии, болевых ощущений и проявлений общей интоксикации еще не наблюдаются
Течение 2 стадии патологического процесса подразделяется на подстадии II и IIE. При подстадии II перерожденные клетки обнаруживаются в 2 лимфоузлах и более, но с одной стороны диафрагмы. При подстадии IIЕ атипичные клетки выявляются в 1 или более лимфатических узлах, а также близлежащих органах или тканях. При 2 стадии высоки шансы на полное излечение при отсутствии факторов риска, к которым относятся:
- появление опухоли в груди до 10 см;
- сформированное образование в лимфатическом узле;
- критическое увеличение скорости оседания эритроцитов;
- более 3 пораженных лимфоузлов;
- развитие выраженных признаков общей интоксикации.
Болезнь Ходжкина 3 стадии подразделяется на 3 подстадии. Для этого периода развития патологического процесса характерно поражение лимфатической системы и располагающихся рядом с узлами тканей и органов с обеих сторон диафрагмы. Имеются яркие признаки поражения селезенки и общей интоксикации организма.
Лимфома Ходжкина 4 стадии характеризуется началом метастазирования не только в близлежащие к лимфоузлам органы, но и отдаленные. На стадии патологического процесса атипичные клетки обнаруживаются в цереброспинальной жидкости, печени, костном мозге, легких и т.д.
Диагностика заболевания
Особую роль в постановке диагноза играют инструментальные методы диагностики. Для определения распространения патологии при лимфоме Ходжкина нередко выполняется снимок — рентген грудной клетки. Это позволяет выявить увеличенные лимфоузлы. При диагностике этой патологии у беременных данный метод диагностики не используется, так как это может нанести вред развивающемуся плоду.
Для уточнения морфологического строения опухолей назначается биопсия, лапароскопия или торакоскопия для забора тканей для дальнейшего гистологического исследования. Может быть показана спленэктомия, т. е. операция по удалению селезенки. Чтобы диагностировать лимфому Ходжкина и степень распространения патологического процесса, назначается проведение таких исследований, как:
- УЗИ;
- компьютерная томография;
- пункция костного мозга;
- сцинтиграфия скелета;
- радионуклидное сканирование;
- контрастная ангиография;
- лимфосцинтиграфия;
- МРТ.
Необходимо дифференцировать лимфогранулематоз от лимфаденитов, развивающихся при токсоплазмозе, туберкулезе, бруцеллезе, ангине, краснухе, гриппе, сепсисе и СПИДе. Кроме того, необходимо исключить метастазы других видов рака, неходжкинские лимфомы и саркоидоз.
Лечение
После того как будет подтвержден диагноз лимфомы Ходжкина, назначается комплексная терапия. Для устранения патологии применяется медикаментозная, хирургическая и радиотерапия. Сочетание средств лечения позволяет добиться полной ремиссии. В редких случаях при поражении тканей костного мозга назначается его трансплантация. Это метод нередко используется при лечении детей, страдающих болезнью Ходжкина.
Лучевая терапия
Радиотерапия является ведущим методом лечения болезни Ходжкина, так как клетки Рид-Березовского-Штернберга чрезвычайно чувствительны к воздействию гамма-лучей, поэтому быстро отмирают при таком воздействии. Существует несколько видов лучевой терапии. Наиболее часто при лечении болезни Ходжкина используется радикальное мантиевидное облучение.
Курс начинают вне зависимости от того, на какой стадии была выявлена патология. При 1 и 2 стадиях заболевания этого достаточно для достижения выраженной ремиссии. При 4 стадии болезни Ходжкина целесообразно дополнять лучевую терапию медикаментозной. Операции используются в качестве полиативного метода терапии и служат для улучшения общего состояния.
Химиотерапия
Главной целью этого метода болезни Ходжкина является остановка деления опухолевых клеток. Химиотерапия может эффективно применяться на всех стадиях патологического процесса, но используется в сочетании с радиотерапией. Продолжительность курса химиотерапии при лимфоме составляет от 14 до 30 дней. Для устранения этого патологического состояния нередко применяются:
- Адриамицин.
- Блеомицин.
- Винбластин.
- Дакарбазин.
- Этопозид.
- Циклофосфан.
- Винкристин.
- Прокарбазин.
- Преднизолон.
- Цисплатин.
- Цитарабин
- Дексаметазон.
В большинстве случаев для купирования проявлений болезни Ходжкина используется комбинация этих препаратов.
Народные методы
Различные травы и составы из природных компонентов могут быть использованы только в качестве дополнения к традиционным методам терапии. Улучшить состояние при болезни Ходжкина может настойка из аконита.
Для ее приготовления нужно 50 г порошка корня этого растения залить ½ л водки. Настаивать средство нужно на протяжении 2 недель. Готовую настойку следует принимать по нарастающему методу, начиная с 1 капли 3 раза в день. Постепенно нужно довести дозировку до 10 капель 3 раза в день. После этого дозу следует постепенно снижать.
Настойку нужно запивать большим количеством воды.
Кроме того, для лечения болезни Ходжкина рекомендуется принимать спиртовую настойку конского каштана. Для приготовления этого средства нужно примерно 40 г растительного сырья залить ½ л водки и настаивать 2 недели. Принимать средство необходимо по 25 капель в сутки. Настойку нужно запивать большим количеством воды.
Питание
Специальная диета при лимфоме Ходжкина позволяет улучшить общее состояние, особенно после проведенной химиотерапии. В рацион при болезни Ходжкина обязательно нужно вводить молочные продукты. Кроме того, улучшить работу кишечника и ускорить вывод токсинов может употребление свежих и термически обработанных овощей и фруктов. При лечении лимфомы предпочтение следует отдавать нежирным сортам рыбы и мяса. Из рациона необходимо исключить фастфуд и полуфабрикаты, газированные напитки и алкоголь, жареное, жирное, соленое и сладкое.
Прогноз
Сколько живут пациенты с лимфомой Ходжкина, зависит от того, на какой стадии патологического процесса было начато лечение. При направленной терапии 1 стадии лимфомы прогноз благоприятный. В 95% случае удается достигнуть полной ремиссии. Лечение можно проводить и щадящими методами для достижения выраженного результата.
Прогноз 2 стадии лимфомы Ходжкина относительно благоприятен. В этом случае 5-летняя выживаемость наблюдается у 90% больных, прошедших комплексную терапию. При 3 степени патологического процесса в ремиссию лимфому удается ввести более чем на 5 лет лишь у 65% пациентов. Менее благоприятным прогнозом отличается лимфогранулематоз 4 стадии. Лишь у 45% пациентов наблюдается 5-летняя выживаемость.
Осложнения
Лимфома Ходжкина и неходжкинская форма опасны своими осложнениями. Увеличение пораженных лимфатических узлов может стать причиной сдавливания окружающих тканей. При поражении узлов в области шеи возникает нарушение работы связок. Кроме того, нередко пациенты испытывают трудности с глотанием. Из-за распространения метастаз может развиваться:
- отек легких;
- сердечная недостаточность;
- дисфункция печени;
- отказ почек.
Поражение тканей кишечника нередко приводит к перфорации и развитию перитонита. При разрастании опухоли в спинном мозге может развиться поперечный паралич. Поражение метастазами органов половой системы нередко становится причиной бесплодия. При остром течении заболевания возможен летальный исход из-за полиорганной недостаточности.
Рецидив
Хроническая или рецидивирующая форма проявляется выраженным обострением при нарушении режима поддерживающей терапии. Кроме того, спровоцировать рецидив могут повышенные физические нагрузки и беременность.
Обострение лимфомы Ходжкина нередко возникает на фоне сильнейших эмоциональных переживаний. Для снижения риска развития рецидивов пациентам необходимо наблюдаться у онколога или гематолога. Раннее выявление обострения позволяет более легкими методами подавить развивающийся онкологический процесс.
Реабилитация
Лучевая и химиотерапия, применяющиеся при лечении болезни Ходжкина, негативным образом отражаются на общем состоянии здоровья человека. Период реабилитации крайне важен, так как если восстановление пройдет эффективно, снизится риск рецидива болезни. На протяжении не менее 6 месяцев после завершения терапии необходимо придерживаться щадящей диеты.
Обязательно нужно нормализовать режим работы и отдыха, уделяя ночному сну не менее 9 часов. Кроме того, для восстановления здоровья пациентам рекомендуется выполнять специальную гимнастику. Большую пользу может принести курс массажа и посещение бассейна. В восстановительный период рекомендуется санаторно-курортное лечение.
Диффузная В-крупноклеточная лимфома
Диффузная В крупноклеточная лимфома (ДВКЛ) — это группа опухолей лимфатической системы, в основе которой лежит трансформация В-лимфоцитов в злокачественные клетки.
Причины возникновения и группы риска
Причиной возникновения ДВКЛ является изменение В-лимфоцитов, т. е. нарушение структуры ДНК. Из-за этого клетки начинают бесконтрольно расти и размножаться, рассеиваясь по всему организму и поражая различные органы и системы. Почему возникают эти мутации, достоверно не установлено. Более того, есть много людей, у которых обнаруживаются характерные генетические поломки, но нет лимфомы. Данный вопрос продолжает изучаться.
В настоящее время принято говорить о факторах риска, которые повышают вероятность развития данного заболевания:
- Врожденные и приобретенные иммунодефициты: синдром Вискотта-Олдрича, Луи-Бара, СПИД, необходимость лечения, которое снижает иммунитет: цитостатики, иммуносупрессоры при трансплантации органов и др.
- Вирусные инфекции: ВИЧ, гепатит С, Т-лимфотропный вирус.
- Аутоиммунные заболевания: ревматоидный артрит, волчанка и др.
- Токсическое воздействие инсектицидов, гербицидов, бензола.
- Лечение посредством цитостатической и лучевой терапии.
Симптомы диффузной крупноклеточной В лимфомы
Крупноклеточная лимфома может проявляться множеством симптомов, но все их многообразие можно уложить в три синдрома:
- Увеличение лимфатических узлов — лимфаденопатия. Чаще всего, лимфома манифестирует безболезненным увеличением лимфатических узлов, которые можно обнаружить визуально или при пальпации. Но бывает так, что поражаются узлы, недоступные для осмотра и пальпации (например, в грудной или брюшной полости), тогда этого признака сразу может и не быть.
- Симптомы интоксикации: повышение температуры, не связанное с инфекцией, сильная потливость, потеря веса. Комбинацию этих признаков называют В-симптоматикой. Ее наличие имеет значение при определении стадии заболевания.
- Симптомы, которые развиваются, когда крупноклеточная лимфома переходит на другие органы и системы. Это могут быть боли в груди и кашель, боли в животе и нарушение стула. При поражении ЦНС развиваются головные боли, нарушение зрения и рвота. Из-за разрушения костного мозга снижается иммунитет, развивается анемия и склонность к опасным кровотечениям.
Классификация, формы и стадии диффузной лимфомы
Современная классификация крупноклеточной лимфомы базируется на клинических данных и степени распространенности опухолевого процесса.
Классификация Ann Arbor:
- 1 стадия. Поражение ограничено одной лимфатической зоной или одним экстралимфатическим органом или одним сегментом экстралимфатической ткани.
- 2 стадия. Поражено две и более зоны лимфатических узлов по одну сторону диафрагмы. При поражении внелимфатических органов или тканей обнаруживаются метастазы в регионарные лимфатические узлы.
- 3 стадия. Имеются единичные очаги поражения по обе стороны диафрагмы.
- 4 стадия. Имеются множественные очаги поражения экстралимфатических органов, либо ограниченное поражение экстралимфатических органов с отдаленными метастазами, либо поражение печени и костного мозга.

Классификация Ann Arbor дополняется модификацией Cotswold:
- А — нет В-симптомов.
- В — есть хотя бы один из В-симптомов.
- Е — есть локализованные экстранодальные очаги.
- S — лимфома поразила селезенку.
- X — имеется массивное опухолевое тканей и внутренних органов.
Диагностика диффузной крупноклеточной лимфомы
Диагноз неходжкинская лимфома выставляется на основании гистологического и иммуногистохимического исследования опухолевой ткани. Для того чтобы получить материал, проводят инцизионную или эксцизионную биопсию лимфатических узлов. Помимо этого, выполняют молекулярно-генетические и иммунофенотипические исследования, которые позволят определить вид опухоли, наличие тех или иных генетических изменений и подобрать оптимальный метод лечения.
Для определения стадии лимфомы проводят следующие исследования:
- Трепанобиопсия костного мозга.
- Методы лучевой диагностики — УЗИ, КТ, ПЭТ-КТ, МРТ.
- Также назначается ряд лабораторных анализов — развернутый анализ крови, определение маркеров парентеральных гепатитов, анализ на ВИЧ, биохимические исследования и др.
Лечение диффузной В-крупноклеточной лимфомы
Лечение диффузной лимфомы определяется исходя из следующих данных:
- Риски рецидива согласно IPI.
- Возраст пациента.
- Его состояние (сможет ли больной перенести высокодозную полихимиотерапию).
В качестве основных методов лечения крупноклеточной лимфомы применяется химиотерапия и в некоторых случаях облучение. Перед началом терапии фертильных пациентов обсуждается вопрос о криоконсервации гамет (половых клеток), поскольку лечение может вызвать бесплодие.

Главным критерием подбора терапии является международный прогностический индекс IPI, который включает следующие аспекты:
- Возраст. Младше 60 лет — 0 баллов, старше — 1 балл.
- Состояние пациента по ECOG (активность больного и способность к самообслуживанию). 1-2 балла по ECOG это 0 по IPI, и 3-4 балла по ECOG — это 1 балл по IPI.
- Уровень ЛДГ. В норме — 0 баллов по IPI, повышен — 1 балл.
- Стадия лимфомы. 1-2 — 0 баллов, 3-4 — 1 балл.
- Наличие более 1 экстранодальной зоны поражения. Нет — 0, да — 1.
Интерпретация IPI следующая:
- 0-1 балл — лимфома низкого риска.
- 2 балла — лимфома промежуточно низкого риска.
- 3 балла — лимфома промежуточно высокого риска.
- 4-5 баллов — лимфома высокого риска.
Пациенты из группы низкого и промежуточно-низкого риска начинают свое лечение с 6 циклов иммунохимиотерапии по протоколу R-CHOP-21. Эта схема, помимо цитостатиков, предполагает применение иммунотерапевтического препарата ритуксимаба. Такая схема позволяет добиться пятилетней выживаемости у 80% больных. Для пациентов с 3-4 стадией заболевания, лечение дополняется лучевой терапией на зоны массивного и экстранодального опухолевого поражения.

Лечение пациентов из групп промежуточно-высокого и высокого риска подбирается индивидуально с учетом возраста и состояния больного по шкале ECOG. Молодым пациентам с хорошим соматическим состоянием назначаются более агрессивные схемы лечения, предполагающие проведение высокодозной химиотерапии с трансплантацией гемопоэтических стволовых клеток (ГСК). При высоких рисках поражения нервной системы проводится несколько циклов интратекальной химиотерапии, когда препараты вводят в спинномозговой канал. Пожилым и слабым пациентам подбираются более щадящие схемы. Оценка эффективности лечения производится в середине циклов химиотерапии и после их окончания.
Восстановление после лечения крупноклеточной неходжкинской лимфомы
В целом, после того как у пациента диагностировали ремиссию, он должен регулярно наблюдаться у онколога. Сначала раз в три месяца, потом раз в полгода, а потом ежегодно. Если через пять лет после достижения ремиссии, у пациента нет признаков заболевания, его считают выздоровевшим и снимают с учета.
Рецидивы крупноклеточной лимфомы
При лечении диффузной В-крупноклеточной лимфомы долгосрочной ремиссии удается достичь в 70-80 % случаев, но у ряда пациентов возникает рецидив. Лечение рецидивов проводится по следующей схеме:
- Химиотерапия второй линии. Она должна подавить опухолевый рост, в то же время не нанося ущерба гемопоэтическим стволовым клеткам.
- Сбор ГСК.
- Высокодозная химиотерапия. Используются высокие дозы цитостатиков, которые уничтожают самые стойкие опухолевые клетки, но они же губят и кроветворение, поэтому чтобы его восстановить проводят следующий этап.
- Трансплантация гемопоэтических стволовых клеток, которая призвана восстановить кроветворение.
У пациентов из групп высокого риска, которые уже прошли аутологичную трансплантацию, и получили рецидив диффузной лимфомы, проводят аллогенную трансплантацию, т. е. используют стволовые клетки доноров. В этих случаях также есть шансы на полную ремиссию, но они не превышают 50%.
Осложнения диффузной В крупноклеточной лимфомы
Химиотерапия и лучевая терапия диффузной крупноклеточной лимфомы пагубно влияют не только на злокачественную опухоль, но и на все быстро делящиеся клетки. Это кроветворные клетки, эпителий кожи и слизистых оболочек и др. Поэтому в процессе лечения и восстановления большое внимание уделяется профилактике осложнений. В первую очередь, это борьба с инфекциями (бактериальными, вирусными, грибковыми), нарушением кровесвертывающей системы и работы пищеварительного тракта.
Помимо этого, в долгосрочной перспективе есть риск развития следующих осложнений:
- Возникновение других злокачественных опухолей: рак легкого, молочной железы, желудка, а также лейкозов и других видов лимфом. Наибольшие риски отмечаются в первые десятилетия после прекращения лечения.
- Кардиоваскулярные осложнения: нарушение работы миокарда, быстрый атеросклероз кровеносных сосудов, повреждение клапанов сердца и др.
- Поражение легких: пульмониты, пневмосклероз и пневмофиброз.
- Осложнение со стороны эндокринной системы: гипотиреоз, бесплодие, нарушение сперматогенеза.
Прогноз и профилактика крупноклеточной лимфомы
Прогноз течения диффузной В крупноклеточной лимфомы зависит от показателя IPI. Чем больше баллов, тем хуже прогноз. Для больных, имеющих 4-5 баллов (высокий риск), пятилетняя выживаемость колеблется в пределах 31%. При низких рисках пятилетняя выживаемость составляет около 91%.
Что касается специфической профилактики, то ее на сегодняшний день не существует, а все рекомендации для минимизации риска заболевания сводятся к ведению здорового образа жизни и правильному питанию.
Лимфома 4 стадии
Лимфомы — это группа злокачественных заболеваний лимфоидной ткани, которые первично возникают вне костного мозга. Ранее данную группу заболеваний делили на неходжкинские лимфомы и лимфому Ходжкина. Однако с 2008 года классификация была пересмотрена и с тех пор данная нозология делится на 4 больших раздела:
- Опухоли, исходящие из зрелых В-клеток.
- Опухоли, исходящие из Т-клеток и NK-клеток (натуральных киллеров).
- Опухоли из гистиоцитов и дендритных клеток.
- Лимфомы Ходжкина.
Тем не менее, термин неходжкинские лимфомы продолжает использоваться как пациентами, так и многими врачами.
Стадирование лимфом происходит с использованием классификации Ann Arbor в модификации Cotswold. 4 стадия является последней и самой тяжелой. Она выставляется при наличии следующих критериев:
- Множественное поражение, как минимум одного экстралимфатического органа, вне зависимости от поражения лимфоузлов.
- Поражение экстралимфатического органа при наличии пораженных отдаленных лимфоузлов.
- Наличие поражения печени и/или костного мозга (лейкемизация).
Диагностика
При первичном обследовании, установленный диагноз лимфопролиферативного заболевания должен содержать следующую информацию:
- Диагноз опухоли, сформулированный согласно с действующей классификацией Всемирной организации здравоохранения.
- Стадия заболевания (распространенность опухолевого процесса).
- Общее состояние пациента.
Согласно современному алгоритму диагностики, для постановки диагноза лимфома, пациенту должно быть проведено:
- Полноценное клиническое обследование: КТ (шеи, грудной клетки, брюшной полости, органов малого таза), УЗИ (периферических лимфоузлов, органов малого таза и брюшной полости, забрюшинного пространства). Как правило, данные методы используются вместе, однако предпочтение чаще отдается компьютерной томографии. Кроме того, зачастую для постановки диагноза выполняется ПЭТ-КТ с фтордезоксиглюкозой и МРТ.
- Общий анализ крови с подсчетом лейкоцитарной формулы и проведением иммунофенотипирования методом проточной цитометрии.
- Морфологическое заключение. Является ключевым методом, позволяющим доказать наличие злокачественного новообразования и установить его морфологическую принадлежность. При определении типа лимфомы, недостаточно сделать стандартную гистологию. Важнейшее значение имеет иммуногистохимическое исследование, а также в некоторых случаях молекулярно-генетическое тестирование.

Определение размеров лимфоузлов является ключевым фактором, определяющим их поражение. Считается, что размеры шейных лимфоузлов не должны превышать 30 мм, средостения — 25 мм, подключичных — 6 мм, а паховые — не более 40 мм. Кроме того, пораженные лимфоузлы, как правило, имеют круглую форму.
Для оценки распространенности процесса и исключения лейкемизации (поражения костного мозга), которая отмечается на 4 стадии лимфомы, проводится гистологическое исследование трепанобиоптата костного мозга.
Симптомы
В связи с тем, что заболевание может поражать любую часть организма, лимфома на 4 стадии имеет крайне разнообразные клинические проявления. Наиболее часто отмечаются:
- Беспричинное повышение температуры тела.
- Необъяснимое снижение массы тела.
- Клиника острого живота.
- Тошнота и рвота.
- Желудочно-кишечное кровотечение.
- Кишечная непроходимость.
- Увеличение живота.
- Затруднение дыхания и глотания.
- Потеря голоса.
- Изнуряющий кашель.
- Увеличение сосудистого рисунка шеи и лица.
- Возможно поражение ЦНС с судорогами и потерей сознания.
- Появление выпота в брюшной или плевральной полости.
- Спленомегалия (увеличение селезенки).
Современное лечение 4 стадии лимфомы в некоторых случаях оставляет шансы на полное излечение. В связи с этим, с пациентами детородного возраста, как правило, обсуждается вопрос криоконсервации спермы либо яйцеклеток перед началом химиотерапии и лучевой терапии.

Поскольку лимфомы — это группа крайне гетерогенных заболеваний, то тактика их лечения будет определяться гистологической формой новообразования, степенью дифференцировки и другими критериями. Оценка эффективности лечения проводится после нескольких циклов полихимиотерапии, после завершения химиотерапевтического этапа, а также после всей программы лечения.
Лечение лимфомы Ходжкина
В связи с наличием альтернативных терапевтических схем, эффективных при лечении лимфогранулематоза, предпочтение тому или иному протоколу отдается с учетом клинической ситуации.
У пациентов старше 60 лет применяется схема, включающая 6-8 курсов ABVD (доксорубицин, блеомицин, винбластин, дакарбазин). После этого следует лучевая терапия в суммарной очаговой дозе 30-36 Грей на опухолевые очаги, превышающие 2.5 см.
У молодых пациентов при лечении лимфомы Ходжкина 4 стадии предпочтение отдается более интенсивным протоколам — BEACOPP эскалированный или BEACOPP 14 (этопозид, доксорубицин, циклофосфамид, винкристин, блеомицин, прокарбазин, преднизолон, Г-КСФ) с последующим облучением крупных очагов (более 2.5 см) и применением колониестимулирующих факторов. Лимфома Ходжкина у детей лечится по стандартному протоколу Euro-Net-C1 с последующим облучением или без него.
Лечение неходжкинских лимфом
В связи с тем, что данная группа заболеваний включает множество гистологических вариантов, существуют различные протоколы, применяющиеся для лечения 4 стадии лимфом:
- R-CHOP (ритуксимаб, доксорубицин, циклофосфамид, винкристин, преднизолон).
- R-CVP (ритуксимаб, циклофосфамид, винкристин, преднизолон).
- R-FCM (ритуксимаб, флударабин, митоксантрон, циклофосфамид).
- RB (ритуксимаб, бендамустин).
- R-CEPP (ритуксимаб, циклофосфамид, этопозид, прокарбазин, преднизолон).
- R-CEOP (ритуксимаб, циклофосфамид, этопозид, винкристин, преднизолон).
- R-CNOP (ритуксимаб, циклофосфамид, митоксантрон, винкристин, преднизолон).
Подобных протоколов для лечения лимфом на 4 стадии существует гораздо больше. Предпочтение в пользу той или иной схемы отдается врачом с учетом клинических особенностей и гистологического варианта опухоли.
Возможно также применение лучевой терапии в суммарной очаговой дозе до 40 Гр в зависимости от состояния пациента. Хирургическое лечение чаще носит паллиативный характер и выполняется по жизненным показаниям.
При наступлении ремиссии, контрольные осмотры пациенты проходят каждые 3 месяца в течение первых 2 лет, далее каждые полгода в течение последующих 3 лет и затем 1 раз в год.
Прогноз при 4 стадии лимфомы
При лимфоме Ходжкина использование современных лечебных схем, даже на 4 стадии заболевания, в большинстве случаев позволяет достичь ремиссии. Ее продолжительность зависит от многих факторов, в том числе от состояния пациента и распространенности опухолевого процесса до начала лечения.
Если говорить о неходжкинских лимфомах, стоит отметить, что для большинства пациентов с 4 стадией, радикального лечения не существует. Тем не менее, в части случаев вопрос ставится именно о полном излечении.
Подобная гетерогенность связана с наличием как крайне высокоагрессивных форм, которые практически не отвечают на терапию, так и заболеваний, хорошо поддающихся лечению, которые в процессе лечения могут трансформироваться в более злокачественные.
Перспективы лечения лимфом 4 стадии связаны, прежде всего, с развитием молекулярно-биологического тестирования и появлением новых молекулярных мишеней для таргетных препаратов.
От поцелуя до лимфомы один вирус

Обзор
Автор
Редактор
Статья на конкурс «био/мол/текст»: За последние три десятилетия становится все очевиднее, что некоторые вирусы играют ключевую роль в развитии человеческих злокачественных новообразований. В последние годы наблюдается рост числа больных, страдающих хроническими рецидивирующими герпесвирусными инфекциями. По данным различных авторов, в настоящее время до 80-90% населения земного шара инфицировано вирусом Эпштейна-Барр (ВЭБ). С этим вирусом связывают возникновение африканской лимфомы Беркитта (ЛБ), недифференцированного рака носоглотки (нРНГ), В-клеточных лимфом у больных с иммунодефицитами различного происхождения. Эпидемиологическое значение ВЭБ определяется широкой циркуляцией вируса среди населения. Актуальность проблемы обусловлена высокой степенью поражения людей во всем мире, часто латентным течением болезни и пожизненной персистенцией вируса. По данным ВОЗ, заболевания, обусловленные герпесвирусной инфекцией, занимают второе место после гриппа среди всех инфекционных патологий.
Обратите внимание!
Эта работа опубликована в номинации «лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Исследования в области происхождения злокачественных опухолей, ежегодно уносящих миллионы человеческих жизней, ведутся с XIX века. Работая в области молекулярной вирусологии, Вармус совместно с Дж. М. Бишопом в исследованиях 1970-х гг. сделали открытие, которое по-новому осветило долго остававшуюся дискуссионной проблему этиологии опухолей у человека и животных. Согласно полученным результатам, неконтролируемый рост клеток, образующих опухоль, вызывается не только проникающим в клетку извне онковирусом, но и внутренними процессами в самой клетке. Вармус доказал, что нормальные гены роста клетки вследствие случайных спонтанных мутаций под воздействием химических канцерогенов или, порой, процесса старения могут изменять свою молекулярную структуру и таким образом превращаться в протовирусы онкогенной природы. За открытие клеточного происхождения онкогенных протовирусов Вармус совместно с Дж. М. Бишопом в 1989 г. были удостоены Нобелевской премии по физиологии и медицине [1].
Также в начале 1970-х годов немецкий исследователь Харальд цур Хаузен [2] успешно использовал для идентификации вирусов новую в то время технику гибридизации in situ. Учёные давно предполагали, что рак шейки матки и другие генитальные разновидности рака вызываются каким-то вирусом, передающимся половым путём, — например, вирусом герпеса. Однако с герпесом у Хаузена ничего не получилось: ДНК вируса герпеса в образце опухоли шейки матки обнаружить не удалось. Поэтому он предположил, что рак шейки матки обусловлен не вирусом герпеса, а другим агентом — вирусом папилломы человека. Предположение неожиданное, поскольку вирус папилломы считался в то время довольно безобидным. Цур Хаузен также высказал соображение, что ДНК вируса папилломы встраивается в геном клетки «хозяина», то есть опухолевые клетки хранят генетическую информацию вируса. Причём вирус папилломы не воспроизводит в клетке свои копии, как это обычно происходит при вирусной инфекции, а как бы «спит» внутри инфицированных клеток. Впоследствии ему и его коллегам в 1983 году удалось подтвердить эту гипотезу и установить, что большинство случаев рака шейки матки вызваны одним из двух типов этих вирусов: ВПЧ-16 и ВПЧ-18. Зараженные такими вирусами клетки с довольно большой вероятностью рано или поздно становятся раковыми, и из них развивается злокачественная опухоль. В 2008 году Харальд цур Хаузен признан лауреатом Нобелевской премии по физиологии и медицине «за открытие вируса папилломы человека как причины рака шейки матки» [3]. Харальд цур Хаузен также занимался изучением ВЭБ и пытался найти взаимосвязь вируса с другими заболеваниями. В итоге ему это удалось: он доказал, что ВЭБ способствует возникновению лимфомы Беркитта [4, 5].
Один из самых распространённых вирусов в человеческой популяции — вирус Эпштейна-Барр (рис. 1) — был открыт и описан в 1964 году двумя английскими вирусологами: Майклом Эпштейном и Ивонной Барр. Вирус Эпштейна-Барр (ВЭБ) — член семейства герпесвирусов [6, 7]. В инфицированных клетках вирусная ДНК, как правило, не встроена в клеточный геном, а находится в ядре в виде замкнутого кольца (эписомы). Биологическое значение интеграции ВЭБ в геном клетки остается неясным. Высказываются предположения, что эписомная ДНК необходима для реализации полноценной репликации ВЭБ, завершающейся формированием вирусных частиц [8].
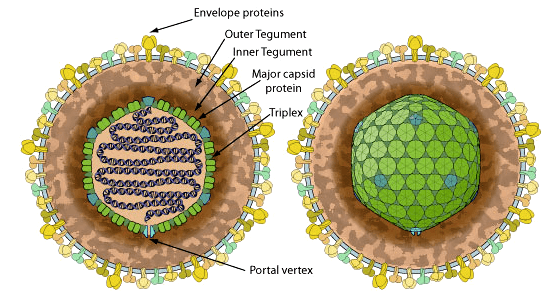
В отличие от многих других герпесвирусов, вирус Эпштейна-Барр поражает в первую очередь эпителиальные клетки ротовой полости, глотки, миндалин. Здесь он размножается наиболее активно, и поэтому главным путём заражения вирусом являются поцелуи (вот и приехали). Наибольшее количество вирусных частиц находится в клетках эпителия около слюнных желез, и со слюной выделяется большое количество их. Не удивительно, что инфекционный мононуклеоз — самое распространённое заболевание, вызываемое вирусом Эпштейна-Барр, — называют ещё болезнью поцелуев [9].
После первой встречи человека с ВЭБ вирус в незначительном количестве сохраняется в организме хозяина в течение всей жизни. Однако если любой элемент иммунного ответа нарушен, даже незначительное количество ВЭБ-инфицированных клеток может преумножиться колоссально [12].
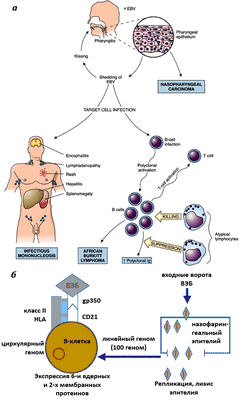
Инфицированные В-клетки могут значительное время находиться в миндалинах, что позволяет вирусу выделяться во внешнюю среду со слюной. С зараженными клетками ВЭБ распространяется по другим органам. В пораженных вирусом клетках возможно два вида развития: литический, приводящий к разрушению клетки-хозяина, и латентный (клетка заражена, но ничего не выдает нахождения вируса), когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах, эпителии носоглотки и слюнных железах. Кроме того, он способен проникать и в другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов (рис. 2а, 2б) [13].
Злокачественные лимфомы (например, увеличение лимфоузлов), согласно данным Международного агентства по изучению рака, составляют 3–4% среди всех регистрируемых в мире злокачественных новообразований [14]. Лимфомы делят на две основные группы: лимфома Ходжкина (20–30 % всех лимфом) и неходжкинские лимфомы (около 70%) [14, 15].
Лимфома Ходжкина (ЛХ) — самостоятельное заболевание, при котором характерные измененные (раковые) клетки, известные как клетки Ходжкина и Рид—Штернберга, рассеяны среди окружающих воспалительных клеток и составляют лишь около 2% объема опухолевой массы [16]. После первичного заражения вирус долгое время находится в В-клетках памяти в «покойном» состоянии на протяжении всей жизни хозяина. У здоровых лиц, зараженных ВЭБ, ингибирующее воздействие на размножение вируса оказывает врожденный (доставшийся от папы с мамой) иммунитет хозяина [17]. Следовательно, повышенный риск заболеть ЛХ у больных с иммунодефицитом может быть объяснен потерей иммунного контроля над вирусной инфекцией.
Неходжикинские лимфомы — это совокупность новообразований, в возникновении которых принимают участие различные агенты [18]. Первая группа — это вирусы, трансформирующие лимфоциты и другие клетки (ВЭБ, HHV-8). Вторая группа представлена факторами различной природы, вызывающими иммунодефицитные состояния. К таким факторам в первую очередь относится ВИЧ (вирус иммунодефицита человека), вызывающий у инфицированного лица подавление иммунитета в результате истощения пула Т-лимфоцитов CD4+ и возникновение СПИДа. В третью группу входят некоторые инфекции, (например, H. pylori), которые увеличивают риск возникновения лимфом на фоне вызываемой ими хронической стимуляции иммунной системы и постоянной активации лимфоцитов [17].
Исследования последних лет свидетельствуют о том, что в патогенезе ВЭБ-ассоциированных патологий чрезвычайно важную роль играет вредный LMP1 — латентный мембранный белок 1, кодируемый одноименным геном (LMP1). Он обладает свойствами онкобелка и функционирует как постоянно активный псевдорецептор. Он способен изменять В-лимфоциты человека [19].
Существует гипотеза о том, что этот ген вирус «украл» у клеток человека в процессе эволюции. Кроме того, высказывается предположение о возможной роли этого белка в развитии аутоиммунных заболеваний [20].
Есть предположение, что аминокислотные замены, накапливающиеся в LMP1, по-видимому, также вносят свой вклад в возникновение опухолей. Механизм этого процесса окончательно не установлен, но предполагается, что усиленный трансформирующий эффект мутированных LMP1 может представлять важную составляющую этого процесса. При этом показано, что различия в последовательности гена LMP1 могут определять агрессивный географически локализованный генотип ВЭБ [21].
Из известных механизмов действия LMP-2 (второй из братьев семейства LMP), расположенного на противоположном конце линейного генома, упоминается лишь способность этих белков совместно повышать сигнальную трансдукцию в ВЭБ (+) клетках [19].
По данным Харальда цур Хаузена, связь между вирусом и раковым заболеванием считается установленной при определении следующих критериев:
- эпидемиологические доказательства того, что вирусная инфекция является фактором риска для развития специфической опухоли;
- присутствие и сохранение генома вируса в клетках опухоли;
- стимуляция пролиферации клеток после введения генома (или его части) вируса в ткани культуры клеток;
- демонстрация того, что геном возбудителя индуцирует пролиферацию и злокачественный фенотип опухоли [19].
Несмотря на более чем 45-летний период изучения биологических свойств этого вируса, ВЭБ до сих пор остается вирусом-загадкой. С одной стороны, это убиквитарный вирус, практически тотально инфицирующий население Земли. С другой — он доказанный или предполагаемый этиологический агент для целого ряда доброкачественных и злокачественных новообразований лимфоидного, эпителиального и мезенхимального происхождения. Наиболее убедительным аргументом в пользу канцерогенности ВЭБ является обнаружение в злокачественных клетках вызываемых им опухолей генетической информации вируса в виде клональных экстрахромосомных эписом. Клональность вируса предполагает развитие событий, согласно которым опухоль возникает из единственной инфицированной ВЭБ клетки, чья успешная дальнейшая селекция может быть стимулирована экспрессией одного или нескольких вирусных генов. Высказанное предположение поддерживается способностью ВЭБ «обессмертить» («иммортализовать») В-лимфоциты человека in vitro и легкостью спонтанного установления ВЭБ-содержащих лимфобластоидных клеточных линий (ЛКЛ) из образцов крови и лимфоидной ткани лиц, инфицированных вирусом, особенно в случаях иммуносупрессии хозяина.
Однако канцерогенность ВЭБ далеко не однозначна. Несмотря на то, что кодируемые вирусом продукты способны вызывать пролиферацию инфицированных клеток, ведущую к возникновению лимфом у больных с иммунодефицитом, эти клинически агрессивные опухоли довольно часто поликлональны и подвергаются регрессии при восстановлении иммунного ответа на ВЭБ. Такие опухоли как лимфома Беркитта (ЛБ) и лимфома Ходжкина (ЛХ) встречаются не только в ВЭБ-ассоциированных, но и в ВЭБ-неассоциированных вариантах, что говорит о том, что патогенез этих новообразований связан не только с ВЭБ. Кроме того, злокачественные клетки больных ЛБ и ЛХ отличаются фенотипически от клеток ЛКЛ, полученных под воздействием ВЭБ in vitro, и не экспрессируют ряд белков, необходимых для трансформирующего роста. Эти находки позволяют предположить, что опухолевые клетки могут возникать и под воздействием факторов невирусного происхождения, а также зависеть от различных усиливающих рост клеток стимулов [17].
Лабораторная диагностика ВЭБ-инфекции базируется на цитологическом исследовании крови или костного мозга, серологических исследованиях и ПЦР. С помощью метода ПЦР можно определить ДНК вируса в плазме до клинических проявлений болезни, а репликация вируса в организме является показанием к противовирусной терапии и критерием эффективности проведенного лечения. Материалом для исследования служат слюна или рото- и носоглоточная слизь, соскоб эпителиальных клеток урогенитального тракта, кровь, спинномозговая жидкость, ткани опухоли и костный мозг. Как у больных ВЭБ, так и у носителей может быть получен положительный результат в ПЦР. Поэтому для их дифференцировки проводится количественный ПЦР-анализ для определения количества копий вирусного генома. У маленьких детей (до 1–3-х лет) по причине недостаточно сформированного иммунитета диагностика по антителам затруднительна, поэтому в данной группе пациентов в помощь приходит именно ПЦР. Однако в силу того, что ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов (до 30%), связанный именно с отсутствием репликации в момент исследования. При этом важно сопоставление результатов клинических, серологических и молекулярных обследований в определении ВЭБ-инфекции, как причины имеющегося заболевания [1].
Специфическая профилактика (вакцинация) против ВЭБ не разработана, но проводятся клинические испытания. Основной проблемой при разработке вакцины является большое отличие в белковом составе вируса на разных фазах его существования. Впрочем, в настоящее время разрабатывается вакцина, которая содержит рекомбинантный поверхностный антиген gp350. После вакцинации первичная инфекция протекает субклинически, но собственно инфицирование человека не предупреждается. Кроме того, вырабатывающиеся нейтрализующие антитела не влияют на течение различных форм латентной инфекции, в том числе опухолей. Профилактические меры сводятся к укреплению иммунитета, закаливанию детей, мерам предосторожности при появлении больного в окружении, соблюдение правил личной гигиены.
Заключение
Широкое распространение ВЭБ с выраженным трансформирующим потенциалом среди населения планеты и редкого возникновения в инфицированной популяции связанных с этим вирусом опухолей с преимущественной их локализацией в определенных географических регионах позволяет сделать важный вывод. Подобно большинству опухолей иной вирусной природы, в патогенезе ВЭБ-ассоциированных новообразований важную роль играют дополнительные факторы, и одного ВЭБ недостаточно для возникновения опухоли. ВЭБ лишь инициирует пролиферацию инфицированных им клеток, а последующие события влияют на гистопатологический спектр возникающих неоплазий. Одним из важнейших факторов, в значительной степени определяющих возникновение ВЭБ-ассоциированных опухолей, служит выраженная иммуносупрессия (врожденная, ятрогенная или индуцированная любой вирусной инфекцией, и в первую очередь ВИЧ), приводящая к утрате функции иммунного распознавания клеток, инфицированных ВЭБ.
Таким образом, несмотря на многолетнее изучение связи ВЭБ с опухолями человека, вопрос о роли вируса в их возникновении до конца не изучен. Раскрытие механизма злокачественной трансформации вирусом, персистирующим в латентном состоянии более чем у 90% населения планеты, — задача чрезвычайно сложная. Однако технические достижения последних лет, существенно повысившие специфичность исследований, позволяют надеяться, что детали ВЭБ-ассоциированного канцерогенеза будут выяснены.
Прогноз жизни для людей с неходжкинской лимфомой
Одним из серьезных онкологических заболеваний является неходжкинская лимфома, прогноз для жизни при котором составляется с учетом многих факторов. В процессе протекания болезни поражаются лимфатические узлы по всему организму. В медицинской практике различают множество разновидностей данной болезни. Другими словами, это группа родственных заболеваний, объединяющая недуги с идентичными признаками и похожим характером протекания.
Особенности неходжкинской лимфомы
В какой бы форме ни протекала лимфома, болезнь представляет серьезную опасность для жизни, так как ее особенностью является быстрое прогрессирование и наличие большого количества метастазов. Этому заболеванию подвержены лица всех возрастов, но чаще всего патология диагностируется у людей, переступивших сорокалетний рубеж. Стоит заметить, что в молодом возрасте рак прогрессирует быстрее, вызывая развитие тяжелых осложнений в виде новых заболеваний, которые нередко заканчиваются летальным исходом.
Начало болезни характеризуется развитием разрушительного процесса лимфатической системы. Она отвечает за:
- очищение лимфы;
- образование лимфоцитов (белых кровяных телец);
- работу селезенки;
- функционирование сосудистой системы, включая железы и лимфатические узлы.
В зависимости от разновидности, неходжкинская лимфома может проявляться В-клетками или Т-клетками.
Раковые клетки формируются в лимфоузлах и быстро размножаются, в результате чего и происходит формирование опухолей.
Данное раковое заболевание относится к группе неопластических патологий, прогноз выживаемости которого варьируется от 1 года до 10 лет. Этот срок находится в прямой зависимости от субтипа лимфомы.
Причины возникновения неходжинской лимфомы
Причины возникновения нехожинской лимфомы до сих пор являются предметом исследования. Известно лишь то, что данный тип онкологии начинается с мутации лимфоцитов крови, которые перерождаются в злокачественные клетки. Одновременно происходит их изменение на генетическом уровне.
Факторами риска, способствующими развитию опухоли, могут быть:
- наследственная предрасположенность;
- неблагоприятная экологическая обстановка;
- профессиональная деятельность, связанная с химическим производством;
- тяжелые заболевания вирусной этиологии (СПИД, гепатит С и т.д.);
- болезни инфекционного характера (Helicobacter pylori и др.);
- операции по пересадке органов;
- химиотерапия и облучение, проведенные при лечении другого ракового заболевания;
- ожирение.
К особой группе риска относят людей с врожденным иммунодефицитом и заболеваниями аутоиммунного характера, такими как различные виды артритов, воспаление щитовидной железы, синдром Шегрена.
Неходжкинская лимфома изначально поражает лимфатическую систему, постепенно захватывая другие органы: селезенку, щитовидную железу, область миндалин и тонкую кишку. Характерным для данного заболевания является как локализация пораженных лимфоцитов в одном месте, так и распространение по всему организму.
Возникновение неходжкинской лимфомы у детей обусловлено воздействием сразу нескольких факторов:
- врожденной патологией иммунной системы (синдром Вискотта-Олдрича);
- воздействием ионизирующего облучения;
- наличием ВИЧ-инфекции;
- вирусными заболеваниями (инфекция Эпштейна-Барра);
- частым контактированием с химическими реактивам, медпрепаратами и канцерогенами.
Формы развития лимфомы и их классификация по месту локализации
В онкологии существует две формы лимфомы:
Агрессивная острая форма заболевания скоротечна и быстро прогрессирует. В случае возникновения такой патологии больной обычно умирает очень быстро.
Индолентная (лимфоплазмоцитарная) лимфома характеризуется вялым течением, шансы на выздоровление довольно велики, однако при частых рецидивах возможен летальный исход. Лимфома в такой форме может перетекать в диффузную, что существенно усугубляет ситуацию. Прогноз для здоровья и жизни онкобольного в этом случае неблагоприятный.
По локализации выделяют следующие виды неходжинских лимфом:
- нодальные опухоли, для которых характерным является поражение лимфатических узлов;
- экстранодальные, при которых раковые опухоли могут возникать в любом месте организма.
При составлении прогноза учитываются результаты цитологического анализа, который позволяет определить, какие образовались опухоли, — крупно- или мелкоклеточные.
От каких факторов зависит выживаемость при лимфоме
В соответствии с международным индексом, разработанным с целью составления предварительных прогнозов выживаемости при быстрорастущей лимфоме, выделяют 5 основных факторов, от которых зависит данный показатель:
- возрастная категория;
- стадия болезни;
- наличие сопутствующих патологий лимфатической системы;
- общее состояние здоровья пациента и индивидуальные особенности его организма;
- результаты анализов крови на уровень ЛГД.
Благоприятный прогноз имеют пациенты:
- в возрасте до 60 лет;
- при первой и второй стадии развития лимфомы;
- при отсутствии метастазирования за пределами лимфоузлов или наличии метастазов только на одном участке;
- нормальные показатели анализа ЛДГ;
- при сохранении всех функций организма.
Если показатели не соответствуют указанным и имеют тенденцию к ухудшению, то прогноз для жизни пациентов неблагоприятный.
Согласно исследованиям, которые велись в данном направлении, 75% людей в низкой группе риска могут прожить минимум 5 лет. Выживаемость пациентов из высокой группы риска равна примерно 30%.
За последние 10 лет в области онкологии были разработаны и внедрены новые методы лечения, усовершенствованы методы терапии злокачественных опухолей и предотвращения распространения метастазов. Данная тенденция положительно сказалась на возможности продления жизни онкобольных в обеих группах риска. Было отмечено, что в результате применения инновационных методов лечения большинство пациентов из высокой группы риска смогли прожить около 4 лет.
Прогноз выживаемости на разных стадиях развития неходжкинской лимфомы
Основанием для составления прогноза выживаемости больного и разработки схемы лечения является определение стадии заболевания. В онкологии выделяют 4 стадии неходжинской лимфомы:
- Первая стадия характеризуется развитием новообразований в группе лимфатических узлов. Процесс сопровождается локальным воспалением. При этом может иметь место поверхностное поражение жизненно важных органов. Диагностика усложняется отсутствием выраженной симптоматики, при которой клиническая картина болезни остается неясной.
- Вторая стадия характеризуется увеличением опухолей и односторонним поражением лимфоузлов. У больного отмечается ухудшение состояния и общая слабость. При протекании заболевания в В-клеточной форме ставится вопрос о хирургическом вмешательстве.
- Третья стадия характеризуется распространением лимфомы на диафрагмальную область, грудную клетку и органы брюшной полости. Поражаются несколько групп односторонних лимфоузлов и мягкие ткани.
- Четвертая стадия характерна развитием необратимых процессов. Поражаются лимфоузлы по всему огранизму. В процесс вовлекается головной и спинной мозг, внутренние органы, нервная и костная системы. Ситуация имеет самый неблагоприятный прогноз.
Сложно точно сказать, сколько живут при диагностировании неходжкинской лимфомы. На первых двух стадиях при проведении качественного лечения процент выживаемости достаточно высокий. Значение в этом случае имеет общая клиническая картина недуга и самочувствие больного. В случае протекания болезни по типу А признаки лимфомы могут себя никак не проявлять. Если заболевание протекает по типу В, то в большинстве случаев отмечается интоксикация организма, сопровождающаяся повышением температуры тела и быстрым снижением веса.
Благоприятный прогноз возможен и на поздних стадиях лимфомы, особенно при рецидиве не ранее чем через 2 года. Если же рецидивирующий процесс возобновляется в течение 10 — 11 месяцев, то риск смертельного исхода возрастает.
Роль гистологии при составлении прогноза на выживаемость
Гистологический анализ (патоморфологическое исследование) позволяет определить степень заболевания и шансы на выздоровление. Из-за бессимптомного протекания неходжкинской лимфомы пациенты, как правило, обращаются за помощью слишком поздно, когда констатируется последняя стадия заболевания.
При терминальной стадии рака, когда процесс разрастания опухолевых клеток становится неконтролируемым, прогноз выживаемости очень низкий.
Образования лимфоцитарного характера, сопровождающиеся поражением костного мозга, чаще всего возникают у пожилых людей. При четвертой стадии шансов на выживание у больных практически нет.
От того, насколько правильно будет проведено лечение неходжкинской лимфомы, во многом зависит продолжительность жизни пациента. К сожалению, дать стопроцентную гарантию излечения и составить точный прогноз не в состоянии ни один врач. Не ответят доктора и на вопрос, сколько человек может прожить после хирургической операции, так как опухоль может повести себя по-разному, особенно если в организме остались метастазы. Однако шансы на достижение стойкой ремиссии при ранней диагностике и лечении намного выше.
Читайте также:
