Ограниченный плацентарный мозаицизм. Особенности
Добавил пользователь Alex Обновлено: 30.01.2026
В самом начале должны открыть правду - в медицине НИЧЕГО не бывает на 100%. Априори ни один метод диагностики и скрининга патологий плода не превышает точность 99.9999% Потому что медицина, генетика, биология, биоинформатика и прочие науки постоянно развиваются, всегда появляются новые теории и методы, что оставляет ученым всегда право на ошибку. В структуре хромосомной патологии человека 45% случаев относятся к анеуплоидиям половых хромосом, а 25% приходится на группу аутосомных трисомий, самыми частыми из которых являются трисомии по хромосомам 21, 18, 13 [1].
Клиническая картина хромосомных патологий:
- врожденные пороки развития,
- малые аномальные развития,
- умственная отсталость;
- неврологическая,
- психиатрическая,
- гематологическая патология,
- нарушения слуха,
- зрения.
Хромосомные аномалии одна из самых актуальных проблем здравоохранения, по данным ВОЗ:
- 0,8% всех новорождённых,
- 40% новорожденных с множественными пороками развития,
- 15% детей с умственной отсталостью,
- 7% случаев мертворождений,
- ХА причина 70% случаев инвалидности у детей,
- нет лечения социальная дезадаптация
По состоянию на 2021 год в России применяется несколько методов определения генетических патологий плода:
Ранний пренатальный скрининг
Инвазивная диагностика
Неинвазивное пренатальное тестирование
Ранний пренатальный скрининг
Или по другому комбинированный скрининг I триместра. В России широкое применение РПС по международному стандарту было инициировано Минздравсоцразвития России только в 2009 г. с поэтапным внедрением нового алгоритма диагностики хромосомных патологий плода в субъектах страны в период с 2010 по 2014 [1].
Данный вид диагностики был разработан фондом медицины плода (FMF) и подразумевает под собой проведение ультразвукового исследования и анализа сывороточных маркеров материнской крови (бетта-ХГЧ и PAPP-A). Расчет риска, с учетом индивидуальных особенностей беременной (возраст матери и срок беременности) происходит с помощью унифицированной программы “Astraia” (Астрайя).
Каждая беременная женщина, которая встает на учет знает, что данный вид скрининга предстоит ей в период с 11 до 14 недель. По результатам скрининга женщина может получить как низкий риск рождения ребенка с патологией, так и высокий (граница 1:100).
Какова же точность скрининга I триместра, который проводят каждой беременной женщине в России:
Данные: Анализ результатов раннего пренатального скрининга в Российской Федерации АУДИТ – 2019. Информационно-справочные материалы. Письмо МЗРФ № 15-4/2963-07 от 11.10.2019 [2]
Стоит отметить что 20% детей рожденных с синдромом Дауна (с трисомией 21) были рождены в группе низкого риска. [3]
Также сравнительный анализ показал, что комбинированный скрининг эффективнее исследования только биохимических или ультразвуковых маркеров (87% вместо 71%) [4].
Инвазивная пренатальная диагностика
Данный вид диагностики включает в себя процедуру забора разного вида биоматериала (в зависимости от срока беременности) из полости матки с помощью пункции под контролем УЗИ. Среди беременных процедуру часто называют “прокол”, длительность процедуры (подготовки и самой пункции) от 5 до 7 минут.
У инвазивной пренатальной диагностики есть свои ограничения и риски осложнений [5]:
- Самопроизвольное прерывание беременности (выкидыш): после амниоцентеза - 0,81%; после биопсии ворсин хориона – 2,18%
- Внутриутробное инфицирование 0,001%
- У носителей хронических вирусных гепатитов, ВИЧ-инфекции, при острых инфекционных процессах – риск высокий.
- Наличие абсолютных противопоказаний к процедуре: истмико-цервикальная недостаточность, угроза прерывания (наличие кровотечения)
- Избыток подкожно-жировой клетчатки, возможные технические трудности при проведении процедуры
- Беременной с резус-отрицательным фактором необходим контроль уровня антител перед процедурой, при их отсутствии — введение антирезусного иммуноглобулина после процедуры.
Несмотря на ограничения, противопоказания и возможные риски инвазивная пренатальная диагностика является признанным методом в России. В случае выявления высокого риска хромосомных аномалий, пациентке рекомендуется проведение инвазивного обследования (плацентоцентез, амниоцентез, кордоцентез) [6].
Точность инвазивной диагностики свыше 99%.
Однако есть ограничение метода, связанное с редким явлением плацентарного мозаицизма: в 1-2% биопсии ворсин хориона (плацентозентезе) [5]. Это два или более клона клеток с разным хромосомным набором. Может быть ложный результат диагностики или выявление мозаицизма. При этом мозаицизм у плода выявляется в 30-40% случаев.
При амниоцентезе может быть ложный результат в случае тканевого мозаицизма у плода. В амниотической жидкости представлены не все клеточные линии плода: только клетки кожи, ЖКТ, мочевого пузыря и легких.
Неинвазивная пренатальная диагностика
Неинвазивный пренатальный тест (НИПТ) - это скрининговый метод. Сегодня в России проводят около 30-40 тысяч НИПТ в год, всего НИПТ сделали от 4 до 6 млн женщин (по состоянию на 2017 год) [1].
Само исследование представляет собой технологически сложный и затратный по времени процесс, включающий такие этапы как:
- взятие образца крови у пациента и получение плазмы,
- выделение ДНК и пробоподготовка,
- секвенирование,
- биоинформатические анализ,
- подготовка заключения.
Точность НИПТ
Авторы исследований отмечают, что скрининг на трисомию 21 (синдром Дауна) с помощью анализа фетальной внеклеточной ДНК в материнской крови превосходит все другие традиционные методы скрининга с более высокой чувствительностью и более низким процентом ложноположительных результатов [8].
Доля ложноположительных результатов исследований по пяти хромосомам оценивается от 0,1 до 0,9% [7].
У данного метода тоже есть ограничения и противопоказания:
- Синдром исчезающего близнеца
- Хромосомные аномалии или хромосомный мозаицизм у матери
- Не проводится ранее 10-ти недель беременности
- Для беременностей двойней не проводится тест на анеуплоидии половых хромосом
- Не проводится для беременности тройней и большим количеством плодов
- Не предназначен и клинически не подтвержден для определения мозаицизма, частичной трисомии или транслокаций, а также для выявления хромосомной патологии по незаявленным хромосомам
- Опухоли у женщины на данный момент или в прошлом, трансплантация органов или костного мозга, стволовых клеток в прошлом (в этих случаях повышен риск ложного результата тест).
ООО "Медикал Геномикс" ИНН: 6952037742 Лицензия № ЛО-69-01-002086 от 06.10.2017
Юр. адрес: г. Тверь, ул. Желябова, 48
ООО "Лаб-Трейдинг", ИНН: 6950225035
Юр. адрес: г. Тверь, ул. 1-Я За Линией Октябрьской Ж/Д, 2, оф. 22
«Обращаем ваше внимание на то, что вся информация (включая цены) на этом интернет-сайте носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ.»
Ограниченный плацентарный мозаицизм. Особенности
Псевдомозаицизм. Мозаицизм хромосом, ограниченный плацентой.
Под псевдомозаицизмом понимают мозаицизм, который не отражает истинной хромосомной конституции индивидуума и обусловлен наличием отдельных клеток с хромосомным набором, отличающимся от кариотипа основной клеточной популяции. При этом хромосомную аномалию может иметь единичная клетка (одноклеточный псевдомозаицизм) или различные хромосомные аномалии могут встречаться в нескольких клетках (многоклеточный псевдомозаицизм).
На препаратах из культивированных клеток, фиксированных методом in situ, псевдомозаицизм регистрируется, если аномальный кариотип демонстрирует клетка на одном участке колонии, либо все метафазные пластинки одной колонии, либо несколько колоний. При flask-методе псевдомозаицизмом обозначают наличие многочисленных клеток с однотипной хромосомной аномалией в пределах одного флакона.
Частота псевдомозаицизма, по суммарным данным разных лабораторий, варьирует в пределах 0,6-1,0%.
Мозаицизм, ограниченный плацентой
Как уже отмечалось выше, ПД хромосомных аномалий проводится по клеткам либо плода, либо провизорных органов. Для интерпретации результатов ПД особенности происхождения анализируемого материала могут иметь принципиальное значение. Так, цитотрофобласт хориона, будучи производным трофэктодермы, атакже мезодермальная строма ворсин хориона/плаценты обособляются от внутренней клеточной массы на стадии бластоцисты, т.е. имеютэк-страэмбриональное происхождение. Амнион, формирующийся из первичной эктодермы, является эмбриональной структурой. Эмбриональное происхождение имеют все эпителиальные клетки АЖ, а также лимфоциты пуповинной крови.
На постимплантационных стадиях развития человека хромосомный набор в клетках плодных оболочек, как правило, соответствует кариотипу плода. Однако в некоторых случаях возможна дискордантность кариотипов в клетках экстраэмбриональных тканей и плода. При этом несоответствие хромосомных наборов может быть полным или иметь мозаичную форму. Клеточные линии с аномальным кариотипом могут быть локализованы в тканях как внезародышевых оболочек, так и плода. Присутствие аномального клеточного клона в тканях плода при его наличии в плаценте (т.е. истинный или генерализованный мозаицизм) подтверждается в 10% случаев плацентарного мозаицизма, или составляет 0,1% от всех развивающихся беременностей. По обобщенным результатам ПД, случаи мозаичной анеуплоидии в тканях плода, имеющего нормальный кариотип в клетках провизорных органов, единичны. Приблизительно в 2% случаев прогрессирующих беременностей цитогенетические аномалии, чаще мозаичные трисомии, ограничены плацентой.
Классификация типов ограниченного плацентой мозаицизма приведена в табл. Предполагается, что плацентарный мозаицизм является неблагоприятным фактором для развития плода. Риск внутриутробной задержки развития плода, самопроизвольного выкидыша, антенатальной гибели или преждевременных родов характерен для случаев плацентарного мозаицизма с достаточно высокой долей анеуплоидных клеток в цитотрофобласте, в экстраэмбриональной мезодерме или сразу во всех тканях плаценты (типы 1, 2 и 3 плацентарного мозаицизма соответственно). Однако различные подходы к оценке акушерско-клинических проявлений плацентарного мозаицизма не позволяют в настоящее время считать его влияние на развитие плода абсолютно доказанным.
Очевидно, что принципиально вопрос о типе мозаицизма может быть решен только в случае параллельного анализа цитотрофобласта и мезодермы, т.е. комбинировании прямого метода приготовления препаратов с культивированием образцов хориона или плаценты. Необходимыми этапами диагностики в случаях мозаицизма должны быть также установление происхождения трисомной линии (стадия и механизм возникновения), а также исключение однородительскойдисомии. Эти исследования особенно важны, когда в мозаицизм вовлечены хромосомы, для которых установлен феномен хромосомного импринтинта.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Современный уровень ультразвуковой техники позволяет получать материал плодного яйца с целью пренатальной диагностики на любых сроках беременности (см. главу 9). В настоящее время распространенными являются трансабдоминальные способы получения материала — аспирация ворсин хориона (плаценты), амниоцентез и кордоцентез. Для цитогенетического анализа в I триместре беременности используют препараты из клеток ворсинчатого хориона, во II и III триместрах материалом для исследования служат клетки плаценты, амниотической жидкости и лимфоциты крови плода (см. главу 9).
Особенности происхождения анализируемого материала, а также методы приготовления хромосомных препаратов имеют принципиальное значение для интерпретации результатов пренатальной диагностики. Напомним, что цитотрофобласт хориона, будучи производным трофэктодермы, а также мезодермальная строма ворсин хориона/пла- центы обособляются от внутренней клеточной массы на стадии бластоцисты, т. е. имеют экстраэмбриональное происхождение (см. главу 1). Амнион, формирующийся из первичной эктодермы, а также все эпителиальные клетки амниотической жидкости и лимфоциты пуповинной крови являются эмбриональными структурами. Анализ хромосом в амниоцитах и лимфоцитах плода возможен лишь после культивирования клеток, тогда как митотически делящиеся клетки хориона (плаценты) могут быть получены на «прямых» препаратах, либо после культивирования. При этом «прямой» метод основан на анализе спонтанно делящихся клеток Лангханса (цитотрофобласта), а источником делящихся клеток в культуре хориона являются мезенхимальные клетки стромы ворсин.
Хромосомный мозаицизм, обнаруженный при анализе препаратов, приготовленных любым из перечисленных методов, может оказаться истинным или ограниченным клетками исследуемой ткани. Основной проблемой диагностики с использованием препаратов культивированных клеток является артефактный мозаицизм, т. е. мозаицизм, не отражающий хромосомную конституцию плода. Вероятность диагностических ошибок, вызванных контаминацией образца клетками материнского происхождения и их способностью к клонообразованию, составляет 0,16 % при культивировании клеток амниотической жидкости и 0,4 % при культивировании клеток хориона [749]. Способность к митотическим делениям и темпы пролиферации клеток разного происхождения и с разным кариотипом в условиях in vitro могут существенно варьировать [96]. Псевдомозаицизм, обусловленный особенностями роста клеток в культуре, возникает с частотой 0,6-1,0 %. Псевдомозаицизм может относиться к одному их следующих трех типов: а) часть колонии клеток имеет аномальный кариотип; б) одна и та же хромосомная аномалия представлена во всех клетках одной колонии; в) клетки двух и более колоний в одном культуральном флаконе имеют хромосомную аномалию [749]. Очевидно, что соотношения диплоидных и анеуплоидных клеток в культурах могут значительно отличаться от реально существующих in vivo. Поэтому нам представляется, что доля анеуплоидных клеток, определенная на «прямых» препаратах, более объективно отражает частоту аномальной сегрегации хромосом in vivo. Более того, на «прямых» препаратах из отдельных ворсинок можно выяснить степень распространенности анеуплоид- ной линии, т. е. определить, ограничена она клетками одной ворсины, или представлена в разных ворсинах. При этом, однако, невозможно определить жизнеспособность анеуплоидных клеток, а локализацию анеуплоидных клеток в пределах всей плаценты можно установить лишь при исследовании последа. В специальных исследованиях с использованием метода FISH было доказано, что степень анеуплоидии в разных участках плаценты может заметно различаться [308, 844]. При анализе «прямых» хромосомных препаратов, а также полученных после культивирования, мозаицизм может остаться нераспознанным, так как аспирируется локальный участок хориона, который необязательно содержит клетки обоих клонов. Следовательно, при диагностике с использованием в качестве материала клеток плодных оболочек возможны как ложноположительные, так и ложноотрицательные результаты.
Как уже отмечалось, хромосомный мозаицизм, выявленный в тканях плаценты, как правило, представляет собой ограниченный плацентарный мозаицизм, который лишь в 10 % случаев соответствует истинному кариотипу эмбриона. Несоответствие между кариотипами хориона и плода может быть заподозрено в случаях обнаружения летальных и сублетальных хромосомных аномалий в биоптатах хориона или плаценты, полученных от плода без пороков развития. Вероятность ошибочного диагноза при использовании биоптатов хориона (плаценты) существенно снижается при сочетании «прямого» метода с анализом культивированных клеток.
Однако во всех случаях мозаичного кариотипа в плаценте для установления его типа необходим анализ хромосомного набора самого плода, для чего производится цитогенетическое исследование лимфоцитов пуповинной крови, либо клеток амниотической жидкости. Таким образом, окончательный диагноз ограниченного плацентарного мозаицизма устанавливается только после получения информации о кариотипе в клетках самого плода.
Особенности течения и исхода беременности при хромосомном мозаицизме, ограниченном плацентой

Исследовано течение беременности и ее исходы у 12 пациенток с ограниченным плацентарным мозаицизмом. Среди них у 5 беременных отмечался повышенный уровень сывороточного ХГЧ (>2 МоМ). В группе беременных с плацентарным мозаицизмом обнаружено достоверное повышение сосудистой резистентности в маточных артериях при сроках беременности 20 и 36 недель.
В одной трети случаев беременность завершилась преждевременно, в четверти случаев установлена гипотрофия плода. Практически во всех плацентах обнаружены морфологические признаки нарушения созревания ворсин и плацентарной недостаточности. Полученные результаты отражают возможное негативное влияние хромосомного мозаицизма в плаценте на течение и исход беременности.
Ключевые слова
Полный текст
В настоящее время одной из серьезных проблем пренатальной диагностики хромосомных заболеваний является хромосомный мозаицизм. Под хромосомным мозаицизмом понимают наличие в тканях индивидуума, произошедшего из одной зиготы, двух или более клеточных линий с различным кариотипом [8]. При этом клетки с нормальным и аномальным кариотипами могут наблюдаться во всех тканях организма (генерализованный, истинный мозаицизм), или ограничиваться какими-либо тканями (ограниченный мозаицизм). Как правило, хромосомный набор, выявляемый у плода, представлен и в плаценте. Однако, при цитогенетическом исследовании клеток ворсин хориона, полученных при хорионбиопсии, приблизительно в 2% случаев встречаются хромосомные аномалии, наиболее часто трисомии, ограниченные плацентой [9].
Данные литературы о влиянии плацентарного мозаицизма на течение и исход беременности неоднозначны. Предполагается, что некоторые осложнения и неблагоприятные исходы беременности могут быть связаны с наличием ограниченного плацентарного мозаицизма. По данным Johnson at. al. (1990), общие потери плодов при беременностях с ограниченным плацентой хромосомным мозаицизмом достигают 16,7% по сравнению с 2,3% в общей популяции [7]. Около 2% беременностей, развивающихся при наличии мозаицизма в плаценте, завершаются спонтанными абортами до 28 недель [11]. Высокая частота плацентарного мозаицизма наблюдается в последах спонтанных абортусов, погибших плодов [8] и плодов с синдромом задержки развития (СЗРП) [16]. В исследовании, проведенном Leshot N.J., Schuring- Blom G.H. (1996), было выявлено, что при наличии хромосомного мозаицизма в плаценте в 12,3% случаев наблюдался синдром задержки развития плода [11]. Предполагается, что патологические исходы беременности чаще встречаются при наличии ограниченного плацентой мозаицизма по хромосомам 9,16,22, для которых наиболее характерно мейотическое происхождение мозаицизма [13].
Наряду с этим, было продемонстрировано [14], что большая часть беременностей, сочетающихся с плацентарным мозаицизмом, протекает без осложнений и завершается рождением здоровых детей, не отличающихся по гестационному возрасту, весу и оценке по шкале АПГАР при рождении от детей контрольной группы. Не выявлено связи между наличием плацентарного мозаицизма по трисомии 8,12, половым хромосомам и акушерскими осложнениями [6, 15, 17].
Целью настоящего исследования является анализ течения беременности и ее исходов при наличии ограниченного плацентой хромосомного мозаицизма, выявленного в результате цитогенетической пренатальной диагностики.
Материалы и методы
Под наблюдением находилось 12 беременных с ограниченным плацентарным мозаицизмом, выявленным в результате инвазивной пренатальной диагностики в НИИАГ им. Д. О. Отта.
Показания к пренатальному кариотипированию и структура, выявленной в результате
генетического исследования патологии хориона, и данные биохимического исследования маркерных сывороточных белков, представлены в таблице 1.
Таблица 1. Результаты биохимических и цитогенетических исследований в группе беременных при наличии ограниченного плацентарного мозаицизма
Показания для пренатального кариотипирования
Срок беремен- ности, нед.
Результаты биохимического скрининга
Кариотип клеток хориона
Доля аномальных клеток в препарате, %
45, XY, -14, -21, +t(14; 21)[3]/ 46 XY [17]
Рождение ребенка с болезнью
Дауна в анамнезе
48, ХХ, +С, +18[1]/47, XX, +С[3]/ 46, ХХ [21]
47, XY, +mar[2]/ 46, XY [11]
Рождение ребенка с МВПР в анамнезе
* Номера пациентов в тексте и таблицах соответствуют таковым в данной таблице. МВПР — множественные врожденные пороки развития.
Возраст беременных находился в пределах от 22 до 44 лет, при этом большинство женщин (7) было старше 35 лет.
Данная беременность была первой у одной женщины. 7 женщин были повторнородящими, предшествующие роды у них протекали без осложнений. Самопроизвольные аборты в анамнезе были у 4, медицинские аборты — у 6 женщин. У 7 пациенток наблюдались гинекологические заболевания, в числе которых — миома матки (у 3), хронический аднексит (у 3) и эрозия шейки матки (у 2). Четыре пациентки перенесли до беременности генитальные инфекции (микоплазмоз, уреаплазмоз, хламидиоз), по поводу которых все получали лечение. Во время данной беременности в 2 случаях проводилась антибактериальная терапия в связи с выявленным уреаплазмозом (№3,10).
С помощью ультразвукового диагностического прибора ALOKA- SSD2000, начиная с 20 недель беременности, с интервалом в 4 недели всем беременным производили ультразвуковое исследование, при котором измеряли основные фетометрические параметры (бипариетальный размер, окружности головки и животика, длина бедренной кости), исключали пороки развития плода. В эти же
сроки беременности выполняли допплерометрические исследования кровотока в артерии пуповины, средней мозговой артерии плода и в маточных артериях. При оценке кривых скоростей кровотока (КСК) вычисляли систоло-диастолическое отношение (СДО), индекс пульсации (ИП) и индекс резистентности (ИР). Полученные данные сопоставлялись с нормативными таблицами [1, 2].
Уровни АФП и ХГ в сыворотке крови беременных определяли в сроки 15-19 недель иммуноферментным методом. Полученные концентрации белков пересчитывали относительно средних норм для каждого срока беременности по специальным нормативным таблицам и выражали в МоМ (multiply of median). Повышенными считали уровни АФП и ХГЧ более 2,0 МоМ.
Для оценки соответствия весоростовых показателей новорожденных сроку гестации пользовались центильными таблицами (Дементьева Г. М.,1981, Полачек К.,1986). Массу тела новорожденного ниже 25,10 и 5 процентили для соответствующего срока беременности и расценивали как гипотрофию плода соответственно I, II и III степени.
Гистологическое исследование плацент выполнено в лаборатории патоморфологии НИИАГ им. Д. О. Отта. При микроскопическом исследовании изучали состояние пуповины, децидуальной и хориальной пластинок, экстраплацентарных оболочек, ворсин всех калибров и межворсинчатого пространства. Оценивали зрелость ворсин хориона и наличие морфологических признаков хронической плацентарной недостаточности [4].
Результаты и обсуждение
Настоящая беременность у всех наблюдаемых наступила спонтанно. Ранний токсикоз от
мечен у 2 пациенток (№ 3,6). Одна беременная перенесла в первом триместре беременности ОРВИ с повышением температуры тела (№2). Стационарное лечение в связи с угрозой прерывания беременности в первом триместре наблюдалось в пяти случаях.
Средний уровень АФП составил 1,33+0,56 МоМ, ХГЧ- 2,49±1,41 МоМ. Согласно данным литературы, повышенный (>2 МоМ) уровень ХГЧ в сыворотке крови отмечается примерно в половине случаев (54%) беременностей с ограниченным плацентарным мозаицизмом [12]. Известно, что при некоторых хромосомных аномалиях, в частности, при болезни Дауна, у плода уровень материнского сывороточного ХГЧ повышен, что связывают с недостаточной зрелостью трофобласта, который синтезирует повышенное количество гормона [10]. Можно предположить, что при мозаичном варианте анеуплоидии общая продукция ХГЧ изменяется за счет его повышенной продукции в аномальных областях плаценты.
При оценке КСК в артерии пуповины на протяжении второй половины беременности, средние значения показателей сосудистой резистентности (ИП и СДО) в исследуемой группе не имели достоверных различий с таковыми-среди женщин с физиологически протекавшей беременностью [1], тогда как в маточных артериях данные показатели были достоверно выше среди беременных с плацентарным мозаицизмом при сроках беременности 20 и 36 недель (рис. 1).
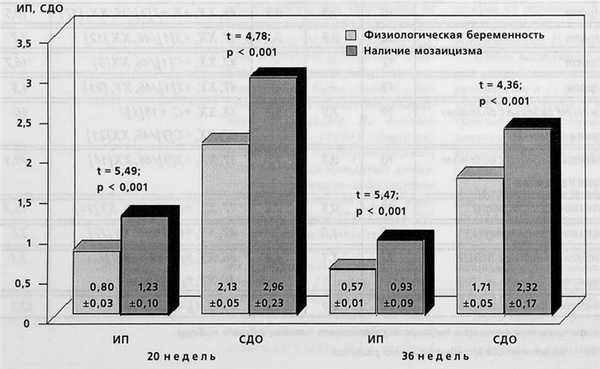
Рис. 1. Показатели сосудистой резистентности в маточных артериях у беременных при наличии ограниченного плацентарного мозаицизма и при физиологической беременности
Согласно исследованиям, опубликованным в литературе, выявление повышения сосудистой резистентности в маточных артериях в 20-24 недели беременности позволяет прогнозировать такие акушерские осложнения, как гестоз и СЗРП [2]. В нашем исследовании при изучении КСК в маточных артериях при сроке беременности 20 недель, значение ИР превысило границы нормы для данного срока (более 95 процентили) у 7 пациенток (№ 1,2,3,5,8,10,11). УЗ из них повышенная сосудистая резистентность в маточных артериях сохранялась на про-, тяжении всей второй половины беременности (№2,8,10). Токсикоз второй половины беременности отмечался в 4 случаях: в одном случае выявлены отеки беременных (№ 8), в двух — нефропатия-І (№ 5,11) и в одном — нефропатия-II (№ 10). У 2 пациенток произошли преждевременные роды (№ 1,10) и у одной из них (№10) наблюдалась гипотрофия новорожденного.
Известно, что основным патофизиологическим механизмом развития гемодинамических нарушений в маточных артериях при беременности является неполная инвазия трофобласта в спиральные артерии, что приводит к повышению сосудистой резистентности в бассейне этих артерий [2]. Физиологические преобразования спиральных артерий происходят на протяжении первого и второго триместров беременности и сопровождаются трофобластической инвазией сначала в децидуальные, а затем, и в миометралъные сегменты. Можно предположить, что наличие на данных этапах аномальных клеточных клонов, способно нарушитъ инвазивную способность трофобласта.
Осложнения беременности и ее исход у женщин при различных типах хромосомного мозаицизма в плаценте представлены в таблице 2. Различные формы гестоза были диагностированы у 7 беременных: в 3 случаях — отеки беременных (№ 7,8,12), в 2 — нефропатия-І (№5,11) и в 1 случае — нефропатия-II (№ 10). Признаки угрожающего прерывания беременности во второй ее половине наблюдались в 6 случаях (№ 1,4,6,9,10,11).
В одном случае у повторнородящей 39 лет с неотягощенным акушерско-гинекологическим анамнезом, в плаценте которой была выявлена мозаичная форма трисомии 7 (№ 6), произошел самопроизвольный выкидыш при сроке беременности 26 недель. Отсутствие у данной пациентки других вероятных этиологических факторов, приводящих к прерыванию беременности, позволяет предположитъ участие плацентарного мозаицизма в патогенезе невынашивания.
Таблица 2. Акушерские осложнения беременности и ее исходы у пациенток с различными типами плацентарного мозаицизма
Угроза прерывания беременности
Поздний самопроизвольный аборт
У трех повторнобеременных первородящих женщин (№ 1,9, 10, не имевших экстрагениталъ- ной патологии, беременности завершились преждевременными родами при сроках беременности 36- 37 недель. В одном случае (№ 1) у беременной 40 лет в анамнезе были самопроизвольные выкидыши ранних сроков. В другом случае (№ 9) у беременной был выявлен уреаплазмоз, что не позволяет исключитъ участие инфекционного агента в преждевременном прерывании беременности. В третьем случае у беременной 26 лет с неотягощенным акушерско-гинекологическим анамнезом преждевременные роды произошли на фоне тяжелой формы гестоза (нефропатии II), сочетающегося с гипотрофией плода. В остальных случаях беременность завершилась срочными родами.
Масса доношенных детей при рождении составила в среднем 3528,75±398,75г (от 2800 до 4350 г), рост — 51,2±1,8 см (от 48 до 53 см). Среди недоношенных детей средняя масса при рождении составила 2606,67±137,78 г, рост — 45,7±1,1 см. Гипотрофия новорожденного I степени установлена в 3 случаях (№ 7,9,10).
Во всех исследованных плацентах было выявлено нарушение нормальной гистологической структуры и морфологические признаки плацентарной недостаточности. В 7 из 8 случаев обнаружены выраженные признаки нарушения дифференцировки и созревания ворсин хориона по типу промежуточных незрелых ворсин (№ 1,7,9), или диссоциированное созревание (№4,8,10,12). Считается, что персистенция промежуточных незрелых ворсин при сохранении их морфофункциональной активности возникает при раннем антенатальном повреждении, в период от 8 до 18 недель гестации [3]. При этом основным патогенетическим механизмом нарушения является недостаточная повторная инвазия трофобласта в миометральные сегменты спиральных артерий.
Предполагается, что при наличии мозаицизма в плаценте исход беременности зависит от многих факторов, в том числе, от того, какая хромосома вовлечена в данный процесс, а также от происхождения мозаицизма (митотическое или мейотическое), степени выраженности анеуплоидии и наличия однородительской дисомии [17].
По результатам наших исследований, наиболее часто в мозаицизм были вовлечены хромосомы 3,7,11 и X. По данным других авторов плацентарный мозаицизм наиболее характерен для хромосом 2,7,9,15,16,22 [9]. Данные разногласия могут объясняться различием используемых методов цитогенетической диагностики, применяемых в разных странах, и наличием связи анеуплоидии по определенным хромосомам с определенными тканями. Так, для анеуплоидии по хромосоме 2 наиболее характерна локализация в клетках мезенхимы, а по хромосоме 3 — в цитотрофобласте [17]. Ввиду того, что при использовании метода анализа «прямых» хромосомных препаратов оценивается кариотип цитотрофобласта, выявление мозаицизма, характерного для мезенхимальных клеток, не представляется возможным. Отсутствие случаев с мозаичной трисомией 16 в нашем исследовании может быть связано с тем, что в наше исследование были включены женщины с прогрессирующей беременностью, тогда как трисомия 16 наиболее часто выявляется при ранних спонтанных абортах [5].
Частота неблагоприятных исходов беременности зависит от распространенности анеуплоидной линии в плаценте, однако, прогностическое значение степени анеуплоидии считается низкой [17]. Доля анеуплоидии в цитогенетических препаратах в нашем исследовании составила от 3,1% до 39,1%. Нам не удалось выявить зависимости между степенью анеуплоидии и наличием осложнений беременности. Так, в случае самопроизвольного позднего аборта, доля анеуплоидных клеток составила 4,5%, в случаях с гипотрофией плода — от 3,6 до 15,3%. Максимальное содержание аномальных клеток в препарате (39,1%) было обнаружено при беременности с мозаичной трисомией 3, завершившейся неосложненными срочными родами (№8). Однако, поскольку мы исследовали только трофобласт, нами не были учтены анеуплоидные клоны, возможно существующие в мезенхиме ворсин, что может исказить реальную степень анеуплоидии.
Предполагается, что исход беременности определяется хромосомой, вовлеченной в плацентарный мозаицизм. Отдельные хромосомы (2,16,22), вероятно, содержащие гены, отвечающие за факторы роста или функции плаценты, при наличии анеуплоидии могут в большей мере нарушать нормальное течение беременности [17]. По данным литературы, трисомия 7 достаточно часто обнаруживается в трофобласте, однако, ее присутствие, как правило, не оказывает существенного повреждающего влияния на рост и развитие плода [13]. В нашем исследовании в 4 случаях имел место дисбаланс хромосомы 7: в одном из них произошел поздний самопроизвольный аборт (№ 6), в другом — преждевременные роды и в 2 случаях (№ 3,11) беременность завершилась рождением доношенных детей, соответствующих сроку гестации по весоростовым показателям.
Определенное влияние на функции плаценты и состояние плода может оказывать происхождение мозаицизма. Аномальные исходы беременности, включая СЗРП, в большей степени связаны с мейотическим происхождением анеуплоидии, при этом механизм возникновения мозаицизма зависит от вовлеченной в данный процесс хромосомы [13]. Так, соматическое (постмейотическое) происхождение трисомии наиболее характерно для хромосом 2,7,8,10 и 12, тогда как мейотическое — для трисомий 9,16 и 22 [13]. К сожалению, в исследованных нами случаях происхождение анеуплоидии не было установлено.
Медико-генетический анализ изученных нами случаев позволяет проследить характер основных акушерских осложнений при наличии ограниченного плацентой хромосомного мозаицизма. Так, у большинства пациенток наблюдались признаки угрожающего прерывания беременности на различных ее сроках, а также проявления плацентарной недостаточности, в отдельных случаях декомпенсированной, подтвержденной морфологически и приводящей к гипотрофии плода и новорожденного.
Таким образом, есть все основания рассматривать ограниченный плацентой хромосомный мозаицизм как фактор риска по возникновению акушерской и перинатальной патологии. Очевидна необходимость дальнейшего углубленного исследования данной проблемы с привлечением комплекса молекулярных, цитогенетических, биохимических и клинических методов с целью изучения роли индивидуальных хромосом и типа происхождения ограниченного плацентарного мозаицизма в нормальном и патологическом эмбриогенезе человека.
Читайте также:
- Особенности фибробронхоскопического осмотра.
- Гормональная регуляция сперматогенеза. Лютропин аденогипофиза. Стероидогенный эффект лютропина. Ингибин. Активин. Функция эстрогенов.
- Изменения ЭКГ. Нарушения распространения возбуждения.
- Диагностика токсического и метаболического поражения головного мозга
- Признаки травмы коллатеральной связки пальцев кисти
