Омфалоцеле и гастрошизис. Развитие амниотической и хориальной оболочек
Добавил пользователь Евгений Кузнецов Обновлено: 16.01.2026
Ретрохориальная гематома. УЗИ диагностика ретрохориальной гематомы
Визуализация в полости матки структур в виде мембран, располагающихся параллельно контуру плодного яйца, может отмечаться при обследовании пациенток с кровяными выделения из половых путей или быть случайной находкой. Известно, что до 16 нед беременности, когда две плодные оболочки (хориальная и амниотическая) должны соединиться между собой, обнаружение тонкой мембраны еще отдельно расположенной амниотической оболочки, является нормальным явлением.
В конце первого триместра и в начале второго у пациенток с кровотечением из половых путей нередко выявляются области отслойки хориона с формированием гематом. Данные гипоэхогенные области могут простираться до внутреннего зева, позволяя скапливающейся крови вытекать из полости матки. Мембрана, расположенная над поверхностью области отслойки плодного яйца, обычно имеет несколько большую толщину, по сравнению с еще свободной амниотичекой оболочкой, которая, кроме того, имеет тенденцию располагаться более центрально в полости плодного яйца, а не прилежит к какой-либо из его сторон.
Обычно у пациенток с ретрохориальными гематомами имеются указания в анамнезе на эпизоды кровяных выделений из половых путей, и в случае если отслойка не распространяется на область прикрепления плаценты к стенке матки, гематомы постепенно уменьшаются в размерах по мере прогрессирования беременности. Тот факт, что отслойка хориона/плаценты имеет связь с кровяными выделениями из половых путей в сроки от 10 до 20 нед беременности, стал очевидным по мере более широкого внедрения эхографического метода обследования пациенток.
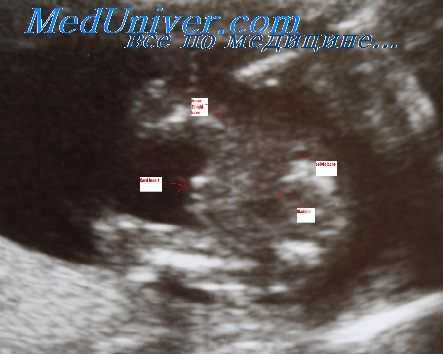
Прогноз в отношении дальнейшего развития беременности в таких случаях зависит как от абсолютных размеров гематомы, так и от ее размеров относительно величины имеющегося в полости матки плодного яйца. У пациенток с небольшими гематомами имеются все шансы на благоприятный исход, в отличие от тех, у кого объем гематомы составляет более 60 см3 или более 40% от объема плодного яйца, даже с учетом того, что при первичном эхо графическом обследовании удается зарегистрировать наличие сердцебиений у плода.
Возможно, прогноз также зависит от того, скапливается ли кровь в полости матки или изливается в виде кровяных выделений. Очевидно, что если имеет место вторая ситуация, истинный размер отслойки плодного яйца при эхографии в некоторых случаях установить не удается.
Иногда в первом триместре беременности могут возникать сложности дифференцирования с помощью эхографии ретрохориальной гематомы от замершего плодного яйца при беременности двойней. Для «пустого» плодного яйца или плодного яйца с погибшим эмбрионом характерна более округлая форма, в отличие от гематомы, которая по виду напоминает полумесяц.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Омфалоцеле и гастрошизис. Развитие амниотической и хориальной оболочек
Омфалоцеле и гастрошизис отмечаются при аномалиях передней брюшной стенки плода. При омфалоцеле имеется срединно расположенный дефект пупочного кольца с выпячиванием через него в основание пуповины таких внутренних органов, как кишечник и печень. При ультразвуковом исследовании оно выглядит как образование, прилежащее к передней брюшной стенке плода и окруженное мембраной, к верхнему полюсу которого прикреплена пуповина.
Омфалоцеле часто сочетается с другими аномалиями (желудочно-кишечного тракта, сердца, почек). Было выявлено, что имеется различный по степени риск наличия анеуплоидии в зависимости от размеров омфалоцеле, когда оно небольшое и содержит только петли кишечника, по сравнению с большим, в котором помимо этого обнаруживаются части печени.
При гастрошизисе наблюдается выпадение в окружающую амниотическую жидкость петель кишечника и других органов брюшной полости через дефект передней стенки, который локализуется в правой параумбиликальной области. Пуповина нормально прикрепляется слева от имеющегося дефекта, поэтому при эхографии гастрошизис имеет вид образования неоднородной структуры, которое располагается непосредственно рядом с областью прикрепления пупочного канатика.
Выпавшие петли кишечника не прикрыты никакими оболочками и погружены в амниотическую жидкость. Более детально эти вопросы рассматриваются в наших дальшейших статьях, посвященной ультразвуковой диагностике пороков желудочно-кишечного тракта.
Последние исследования позволили предположить, что плоды с недостаточной спирализацией сосудов пуповины имеют более высокий риск аномалий кариотипа и другой патологии по сравнению с контрольной группой. Для оценки степени спирализации сосудов может использоваться цветовая допплерография, с помощью которой легко определяется количество оборотов артерий вокруг вены пуповины на единицу ее длины.
Развитие амниотической и хориальной оболочек
Дифференцировка клеток трофобласта от эмбриобласта происходит приблизительно на 5 день после зачатия. Впоследствии трофобласт дифференцируется на цитотрофобласт, представленный клетками, содержащими ядро, и симпластотрофобласт, представленный многоядерной структурой. Симпластотрофобласт секретирует хорионический гонадотропин (ХГ) и отвечает за протеолитическую активность инвазии в децидуальную оболочку.
Хорион, образующийся путем слияния трофобласта и экстраэмбриональной мезенихимы, формирует ворсинки, которые представляют собой основные функциональные элементы плаценты. При атрофии ворсинок в области соприкосновения с decidua capsulars образуется гладкий хорион, который затем становится хориальной оболочкой.
Оставшиеся ворсинки составляют ветвистый хорион, который затем формирует плодовую часть плаценты. Материнская часть плаценты образуется из decidua basalis. В первом триместре беременности ворсинчатый хорион, который указывает на место формирования будущей плаценты, при эхографии визуализируется в виде области утолщения гиперэхогенной ткани, окружающей плодное яйцо. Хориальная оболочка является мембраной, которая окружает плодовместилище, выстилая изнутри плодовую поверхность плаценты и плотно прикрепляясь к ней.
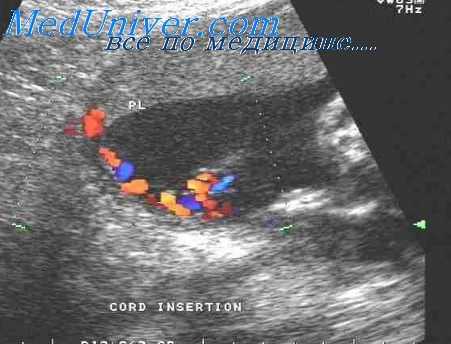
Данное свойство (плотность ее сращения с поверхностью плаценты) оказывается полезным при проведении биопсии ворсин хориона.
Бластоциста имплантируется в децидуализированный эндометрий приблизительно через неделю после оплодотворения яйцеклетки. Затем слой клеток разделяется, образуя экстрацеломическую оболочку и первичный желточный мешок. Одновременно формируется амниотическая полость. Эмбриональный диск располагается между желточным мешком и формирующейся амниотической полостью, поэтому при сканировании в режиме «реального времени» можно визуализировать сокращения сердца, когда сам эмбрион еще не виден. С развитием вторичного желточного мешка, первичный атрофируется. Желточный мешок и амниотическая полость располагаются по разные стороны относительно эмбриона. По мере увеличения амниотической полости эмбрион и брюшной стебелек оказываются заключены в нее. В конечном счете оболочки смыкаются (вент-ральнее относительно эмбриона) на стороне расположения желточного мешка, который при этом остается эстраамниально.
Первичный и затем вторичный желточный мешок формируется со стороны эмбриона, обращенной к ворсинчатому хориону, и прилежит к стенке плодного яйца в той области, где формируется брюшной стебелек и впоследствии образуется пуповина. Амниотическая полость формируется вблизи дорсальной поверхности эмбриона и затем полностью выполняет полость экстраэмбрионального целома.
По мере увеличения амниотической полости амниотические оболочки, расправляясь, постепенно окружают плод и пуповину. Вторичный желточный мешок, оставшийся экстраамниально, постепенно прижимается амниотической оболочкой к поверхности хориальной оболочки, и, наконец, подвергается инволюции к 12 нед беременности.
Амниотическая полость постепенно увеличивается в объеме, полностью выполняя хориальную полость (или, иначе, экстрамбрионального целома) к 12-14 нед. Спавшееся пространство экзоцеломиче-ской полости может сохраняться еще в течение нескольких недель. Полная адгезия амниотической оболочки к хориальной происходите 15-16 нед.
Поэтому выполнение амниоцентеза в сроки с 12 по 15 нед может оказаться технически сложным именно вследствие еще остутствующего плотного соединения оболочек между собой. В этих случаях кончик иглы оказывается не в состоянии проткнуть амниотическую оболочку, которая прогибается перед ним, что не позволяет проникнуть игле в амниотическую полость и получить образец жидкости для исследования.
Повышение разрешающей способности ультразвукового оборудования, которое стало доступным благодаря применению высокочастотных трансвагинальных датчиков и их свойству фокусировки в ближнем поле, значительно повысили наши возможности визуализации основных эхографических маркеров нормального развития маточной беременности на ранних сроках.
Первым из них является визуализация плодного яйца в виде гипоэхогенного округлого образования диаметром 2-3 мм в толще децидуализированного эндометрия. Такая картина может выявляться уже начиная с 5 нед 4 дней, считая с первого дня последней нормальной менстуации. Следующим маркером, который обнаруживается при нормальном развитии в 5-5,5 нед беременности, является вторичный желточный мешок. Тонкая мембрана амниотической оболочки выявляется при ультразвуковом исследовании с 7 до 16 нед. При этом эмбрион/плод определяется в амниотической полости, а желточный мешок располагается экстраамниально.
Единственная артерия пуповины. УЗИ диагностика единственной артерии пуповины
Хотя нормальная по строению пуповина имеет две артерии, в 1% наблюдений при одноплодной беременности, в 5% - при многоплодной, а также в 2,5% при выкидышах выявляется только одна артерия пуповины. При этом имеется закладка второй артерии, которая бывает атрезирована. Атрезия левой артерии пуповины чаще сочтается с наличием аномалий у плода по сравнению с атрезией правой (Н. Finberg, собственные наблюдения 1999).
К. Bernischke и S.G. Driscoll первыми описали взаимосвязь между данной патологией и нарушениями развития плода, выявив увеличение частоты пороков мочеполовой системы в этих случаях. Недавние исследования показали, что в каждом третьем случае при наличии единственной артерии пуповины наблюдаются структурные аномалии плода, в особенности патология развития сердечно-сосудистой системы.
Повышение частоты встречаемости единственной артерии пуповины было отмечено при беременностях, которые в последующем заканчивались выкидышами в связи с трисомией 21, а также у беременных, страдающих сахарным диабетом, и темнокожих пациенток. Важно отметить, что только в 7% наблюдений при ультразвуковом исследовании не выявляются какие-либо аномалии развития плодов и единственная артерия пуповины является изолированным пороком. Таким образом, при выявлении данного нарушения развития пуповины следует помнить о вероятности наличия у плода хромосомных аномалий.
При единственной артерии пуповины было выявлено четырехкратное повышение частоты перинатальной смертности. Большинство таких случаев прежде всего связано с тяжелыми пороками развития, характерных для этого состояния, однако причины других пока остаются не известны. Так, по данным L. A. Froehlich и Т. Fujihura, частота смертности составила 14%, однако у детей, преживших период раннего детства, тяжелые аномалии развития встречались не чаще, чем у детей из контрольной группы.
В отличие от предыдущих авторов Е.М. Bryan и H.G. Kohler, проследив за развитием 98 детей, в последующем дополнительно выявили аномалии еще у 10 пациентов.
Впервые при ультразвуком исследовании пренатальной диагноз единственной артерии пуповины двум плодам на сроках 34 и 36 нед беременности установили M.N. Jassani и J.R. Brennan. Первый плод в последующем погиб внутриутробно, у второго наблюдался умеренно выраженный гидронефроз левой почки. В исследовании, которое описывало 30 наблюдений с единственной артерией пуповины, у 15 плодов были выявлены аномалии развития, из них 12 были тяжелыми, которые включали в себя пороки сердца, черепа, скелета и диафрагмы. В другой работе (118 наблюдений) у 3% плодов аномалии были обнаружены после родов.
У остальных 84% пороки были правильно диагностированы антенатально при ультразвуковом исследовании, при этом ложно-отрицательный результат составил 7%.
По данным J. Chow et al., наиболее часто с единственной артерией пуповины сочетались пороки сердца (51%) и желудочно-кишечного тракта (38%). Таким образом, при обнаружении этого состояния важно полностью представлять весь спектр возможных сочетаний данной патологии с другими аномалиями развития.
Подводя итог, можно сделать следующие выводы.
1. Отмечается сильная корреляционная связь между наличием единственной артерии пуповины и аномалиями развития различных органов и систем плода.
2. Если помимо единственной артерии пуповины у плода обнаруживаются другие пороки развития, имеется высокий риск наличия у него хромосомной патологии. В связи с этим в таких случаях рекомендуется проведение амнио- или кордоцентеза.
3. У плодов, имеющих изолированную аномалию в виде единственной артерии пуповины при отсутствии других признаков нарушения развития, также имеется риск анеуплоидии (хотя и небольшой). Поэтому в таких случаях для принятия решения о необходимости проведения кариотипирования следует учитывать результаты других методов клинической оценки.
Омфалоцеле
Омфалоцеле – врожденная аномалия передней брюшной стенки, при которой органы брюшной полости выходят за ее пределы в составе грыжевого мешка. Клинически патология проявляется эвентрацией петель кишечника, желудка, печени и других органов, прикрытых висцеральной брюшиной, через грыжевые ворота в участке пупочного кольца. Антенатальная диагностика включает в себя УЗИ ОБП, определение уровня α-фетопротеина, амниоцентез с дальнейшим кариотипированием. Лечение хирургическое, предусматривает радикальное или поэтапное погружение содержимого грыжевого пешка обратно в брюшную полость с последующей пластикой передней брюшной стенки.
Общие сведения
Омфалоцеле (эмбриональная грыжа, грыжа пупочного канатика) – аномалия развития, при которой происходит выпячивание органов брюшной полости, укрытых висцеральной брюшиной, сквозь переднюю брюшную стенку. Впервые данную патологию описал французский хирург А. Паре в 1634 году. В среднем заболеваемость составляет порядка 2,2:10000 новорожденных. Точную частоту, с которой встречается омфалоцеле, установить невозможно, поскольку в большинстве случаев такие беременности прерываются. У мальчиков данная патология возникает в 1,5 раза чаще, чем у девочек. Наибольшая склонность наблюдается у представителей европеоидной расы – 85% от всех случаев омфалоцеле. Для представителей негроидной расы этот показатель составляет 13%, монголоидной – 2%. Примерно 55% случаев патологии диагностируется при беременности у женщин в возрасте старше 35 лет. Общая летальность зависит от сопутствующих расстройств и колеблется от 9 до 60% новорожденных. При изолированной форме и адекватном лечении прогноз для жизни и здоровья ребенка благоприятный.
Причины омфалоцеле
Омфалоцеле – это гетерогенное заболевание, при котором нарушается процесс внутриутробного вправления физиологической пупочной грыжи. Патогенетически это может быть результатом пороков развития пупочного кольца и передней брюшной стенки, генетических аномалий, неполного погружения органов обратно в брюшную полость или дефектов строения кишечника.
При внутриутробном развитии кишечника плода, а именно – в процессе его трансформации от первичной кишечной трубки до зрелых петель происходит его физиологической разворот. Данный процесс начинается с 5 недели беременности. От этого момента и до 10 недели кишечник сильно увеличивается в объеме, из-за чего не помешается в брюшной полости. Петли давят на брюшную стенку, формируя физиологическую пупочную грыжу. К концу 10 недели абдоминальная полость стремительно прибавляет в объеме, на фоне чего происходит самостоятельное вправление эвентрации. Если данный механизм нарушается силу различных патологических изменений, возникает омфалоцеле.
Способствовать возникновению данной патологии могут вредные привычки матери (алкоголь, курение, наркотики), нерациональный прием медикаментов, беременность после 35 лет, при которой растет риск хромосомных аномалий – синдромов Патау, Эдвардса. Довольно часто омфалоцеле выступает в роли одного из симптомов таких патологий, как синдром Беквита-Видемана, пентада Кантрелла, синдром амниотических тяжей, порок развития стебля тела, OEIS комплекса. Крайне редко удается установить наследственную склонность, что свидетельствует о возможной генетической предрасположенности.
Классификация и симптомы омфалоцеле
В педиатрии в зависимости от размера дефекта и его содержания выделяют следующие формы омфалоцеле:
- Малая. Диаметр – до 5 см. Наиболее распространенная форма. Содержит 1-2 кишечные петли. В основном выступает в роли проявлений хромосомных аномалий.
- Средняя. Размер дефекта пупочного кольца – от 5 до 10 см. В составе грыжевого мешка содержатся 2-4 кишечные петли.
- Большая. Дефект передней брюшной стенки составляет более 10 см. Помимо петель кишечника через него выходит часть печени, желудок и другие органы.
По наличию сопутствующих патологий выделяют:
- Изолированное омфалоцеле. Грыжа пупочного канатика – единственная развившаяся внутриутробная патология.
- Сочетанная форма. Помимо дефекта пупочного кольца у ребенка присутствуют хромосомные мутации (25-35%), пороки развития сердечно-сосудистой (15-50%) и мочеполовой систем (до 15%). Характерны грыжи пищеводного отверстия диафрагмы и дисплазии тазобедренных суставов, другие скелетные аномалии.
Омфалоцеле является врожденной патологией, которая диагностируется еще в антенатальном периоде. После родов общее состояние ребенка зависит от сопутствующих заболеваний и срока гестации. При омфалоцеле характерны преждевременные роды, масса тела ребенка 1500г и меньше. Объективные признаки визуализируются уже с момента рождения. Определяется дефект передней брюшной стенки, который локализирован по срединной линии на уровне пупочного кольца. В этом месте находится образование, представленное петлями тонкого и толстого кишечника, возможно – желудком и печенью, покрытыми висцеральными листком брюшины. В 10-20% наблюдается анте- или интранатальный разрыв грыжевого мешка. Пуповина также входит в состав омфалоцеле. Абдоминальные мышцы развиты нормально. Другие возможные пороки развития зависят от сопутствующих патологий и могут включать в себя деформации позвоночного столба и конечностей, макроглоссию, макросомию, атрезию ануса и т. д.
Диагностика омфалоцеле
В современных условиях наличие омфалоцеле определяется еще в I триместре беременности благодаря инструментальным и лабораторным методам исследования. Ведущую роль играет УЗ-диагностика. В зависимости от аппарата установить наличие данной патологии можно уже на 11-14 неделе. Основной признак – эвентрация петель кишечника, печени, желудка за пределы брюшной полости в участке крепления пуповины к брюшной стенке. Все вышедшие органы покрыты мембраной, состоящей из брюшины, вартонового студня и амниотической оболочки. Наличие данной мембраны важно для проведения дифференциальной диагностики с гастрошизисом. При внутриутробном разрыве грыжевого мешка петли кишечника прикрывает только амнион. Также на потенциальное развитие омфалоцеле может указывать размер ворот физиологической грыжи, составляющий свыше 7 мм в диаметре. УЗИ позволяет выявить другие проявления присутствующих генетических патологий. Повторные исследования проводятся каждые 2-3 недели, т. к. возможно самостоятельно закрытие дефекта в более поздние сроки.
Лабораторная диагностика омфалоцеле осуществляется при помощи биохимического исследования крови с измерением уровня α-фетопротеина. При врожденных пороках развития этот показатель будет значительно выше нормы для имеющегося срока беременности. Для подтверждения генетических аномалий показано проведение амниоцентеза с дальнейшим кариотипированием.
Лечение омфалоцеле
При антенатальной постановке диагноза омфалоцеле роды проводятся в специализированном перинатальном центре в условиях развернутой операционной. При малых и средних размерах дефекта пупочного кольца и отсутствии угрожающих жизни матери и ребенка состояний родоразрешение может осуществляться через естественные родовые пути. Во всех других ситуациях показано кесарево сечение в связи с большим риском интранатального разрыва грыжевого мешка. Дальнейшая терапевтическая тактика зависит общего состояния ребенка, размеров пупочной грыжи и сопутствующих патологий.
Консервативная терапия используется при невозможности провести хирургическое вмешательство. Как правило, она применяется при больших формах омфалоцеле и комбинации с множественными тяжелыми аномалиями развития. Лечение заключается в формировании плотной корки и рубца, что трансформирует данную патологию в массивную вентральную грыжу, которую в дальнейшем оперируют. С этой целью применяют дубящие средства (5% перманганат калия, нитрат серебра), которые наносят на вертикально зафиксированный за пуповину грыжевой мешок 2-3 раза в день. Консервативное лечение используется крайне редко, т. к. при нем имеется большая вероятность инфицирования и сепсиса, риск разрыва оболочек, массивной спаечной болезни в дальнейшем. Предпочтение отдается раннему оперативному вмешательству.
Хирургическая тактика при омфалоцеле напрямую зависит от размеров дефекта брюшной стенки, операции могут проводиться в один или несколько этапов. Начинают такое лечение на протяжении первых 1-2 дней жизни ребенка. При одномоментном вмешательстве выполняется погружение содержимого грыжевого мешка в абдоминальную полость и послойное зашивание брюшной стенки с ее пластикой и формированием пупка. Такая тактика – метод выбора, при омфалоцеле малых и средних размеров с минимальной торакоабдоминальной диспропорцией. В других случаях прибегают к поэтапному лечению. Первый этап – подшивание силиконового мешка с силопластиковым покрытием и помещением в него содержимого грыжевого мешка. По мере постепенного погружения органов в абдоминальную полость данный мешок перевязывают, уменьшая его в объеме. На 5-15 день выполняется второй этап – удаление мешка и формирование минимальной вентральной грыжи посредством ушивания дефекта. В возрасте 5-7 месяцев эта грыжа удаляется, после чего осуществляется полноценная пластика брюшной стенки.
После первого этапа или одноэтапной операции ребенок помещается в кувез для поддержания температурного режима, применяются обезболивающие, антибиотики широкого спектра действия. Режим питания парентеральный. При необходимости выполняется декомпрессия желудка через назо- или орогастральный зонд, проводится инфузионная терапия и ИВЛ. После проведенного лечения следует длительный реабилитационный период, в течение которого осуществляется коррекция всех послеоперационных осложнений.
Прогноз и профилактика омфалоцеле
В целом прогноз для детей с омфалоцеле сомнительный. Исход зависит от срока гестации, сопутствующих хромосомных аномалий и анатомических пороков развития, диаметра дефекта пупочного кольца, объема и содержания грыжевого мешка, результатов проведенного лечения. Как правило, при адекватной терапии и отсутствии сопутствующих патологий, несовместимых с жизнью, вероятность благоприятного исхода достаточно велика. При изолированной форме омфалоцеле малого размера, несмотря возможные отдаленные осложнения хирургического лечения (ГЭРБ, спаечная болезнь, пупочная грыжа), дальнейший рост и развитие ребенка не будут отличаться от возрастной нормы. На протяжении всего периода реабилитации показано диспансерное наблюдение у лечащего педиатра, хирурга и семейного врача.
Профилактика заключается в медико-генетическом консультировании семейных пар, планировании беременности, полном отказе матери от вредных привычек. С целью ранней диагностики омфалоцеле необходимо регулярно посещать женскую консультацию и проходить соответствующие обследования: УЗИ и измерение α-фетопротеина крови.
Амниотический тяж ( Амниотические сращения , Синдром амниотических перетяжек , Тяжи Симонара )
Амниотические тяжи – это волокнистые соединительнотканные нити, происходящие из амниотической оболочки и натянутые между стенками матки. Возникают в результате небольших повреждений амниона на ранних сроках беременности, нарушений плодово-плацентарного кровотока и внутриутробных инфекций. Как правило, амниотические тяжи протекают благоприятно и не представляют угрозы для развития плода. В отдельных случаях могут сдавливать и перетягивать плод и пуповину, становясь причиной пороков развития. Диагноз устанавливается на основании данных инструментальных исследований. При угрозе фатального сдавления пуповины или жизненно важных органов осуществляют внутриутробное удаление тяжа. В остальных случаях лечение не требуется.
МКБ-10
Амниотические тяжи (амниотические сращения, тяжи Симонара, синдром амниотических перетяжек) – волокнистые нити, состоящие из соединительной ткани. Являются дупликатурой амниотической оболочки, натянутой между стенками матки. По различным данным, выявляются в 0,12 – 0,015 случаев успешно доношенной беременности. Предположительно являются причиной 178:10000 случаев выкидышей. Амниотические тяжи диагностируются не ранее 12 недель гестации, в 80% случаев никак не влияют на течение беременности и не вызывают пороков развития плода.
В 70% случаев тяжи не обнаруживаются при проведении повторных инструментальных исследований, что обусловлено их разрывом или сдавливанием. В отдельных случаях сохраняющиеся амниотические тяжи могут становиться причиной появления амниотических перетяжек, вызывать гипоксию плода, деформации и врожденные ампутации конечностей. Диагностику и лечение амниотических тяжей осуществляют специалисты в области акушерства и гинекологии. Лечением последствий внутриутробной гипоксии и пороков развития, обусловленных данной патологией, занимаются неврологи, ортопеды, хирурги, офтальмологи и другие специалисты.
Причины
Причины развития амниотических перетяжек пока точно не установлены. Существует несколько теорий, объясняющих возникновение этой патологии. Последователи первой теории считают, что амниотические тяжи образуются при микроповреждениях амниона на 4-18 неделях гестации. Соединительнотканные нити, отделившиеся от плодного пузыря и свободно плавающие в околоплодной жидкости, могут опутывать пуповину или различные части плода. В последующем размер плода увеличивается, а размер амниотических тяжей не меняется, и это становится причиной сдавления различных частей тела плода.
Сторонники второй теории предполагают, что причиной возникновения амниотических тяжей являются сосудистые нарушения. Последователи третьей теории указывают на возможную связь между синдромом амниотических перетяжек и внутриматочными инфекциями.
В числе дополнительных предрасполагающих факторов развития амниотических тяжей называют:
- маловодие,
- эндометрит,
- истмико-цервикальную недостаточность,
- пороки развития половых органов матери,
- инвазивные исследования во время беременности;
- тератогенное действие некоторых лекарственных препаратов.
Существует также генетическая теория возникновения амниотических тяжей, однако, большинство современных специалистов не разделяют эту гипотезу, указывая на отсутствие свидетельств наследования данной патологии. Гинекологи говорят, что вероятность возникновения амниотических тяжей никак не коррелирует с возрастом беременной женщины, количеством предыдущих родов, наличием амниотических сращений во время предыдущих беременностей и существованием аналогичной патологии как по материнской, так и по отцовской линии.
Осложнения амниотических тяжей
Из-за сдавления периферических нервов при амниотических тяжах могут развиваться парезы и параличи, сопровождающиеся мышечной атрофией. В тяжелых случаях из-за грубых нарушений кровотока дистальная часть конечности некротизируется и либо отторгается во внутриутробном периоде, либо требует ампутации после рождения. При отторжении во внутриутробном периоде омертвевшая часть конечности отделяется от плода и свободно плавает в амниотической жидкости.
Кроме того, амниотические тяжи в области конечностей могут становиться причиной синдактилий, косорукости, ложных суставов, контрактур суставов, деформаций ногтей, нарушений формы и размера конечностей. Установлена связь между амниотическими тяжами и врожденной косолапостью. Синдром амниотических перетяжек выявляется у каждого третьего ребенка с данной патологией. Причиной развития косолапости предположительно становится ограничение подвижности конечности из-за ее фиксации перетяжкой и сдавливание ножки стенкой матки.
В 12% случаев амниотические тяжи вызывают деформации лица и черепа. Возможны деформации носа, незаращение верхней губы и нёба, косоглазие, увеличение расстояния между глазами, опущение века, недоразвитие глазного яблока, уменьшение размеров глазного яблока, колобома радужки, метаплазия роговицы, обструкция слезных желез или нарушение процесса кальцификации черепа. При расположении амниотических тяжей в области туловища может развиться гастрошизис (расщелина в передней стенке живота, через которую выпадают внутренние органы) и омфалоцеле (грыжа пупочного канатика). Возможно сдавление пуповины, сопровождающееся гипоксией плода. Считается также, что при наличии амниотических тяжей повышается вероятность преждевременных родов.
Диагностика
Диагноз амниотические тяжи выставляют по результатам УЗИ. Перетяжки можно увидеть не ранее 12 недели беременности (иногда позже). В ряде случаев соединительнотканные нити слишком тонкие и не обнаруживаются в процессе ультразвукового сканирования. В подобных случаях диагноз «амниотические тяжи» устанавливают по косвенным признакам – деформации конечности, увеличению дистального отдела конечности из-за отека и т. д. Возможна гипердиагностика.
Для уточнения диагноза, оценки серьезности угрозы для плода и определения тактики лечения пациенток с подозрением на амниотические тяжи направляют на дополнительные исследования: эхокардиографию плода, МРТ и 3D УЗИ. В большинстве случаев амниотические перетяжки не влекут за собой последствий для развития плода и не нарушают течение беременности. В 70-80% случаев тяжи самостоятельно разрываются, сдавливаются или рассасываются и не выявляются при проведении повторного УЗИ.
Лечение
Лечение обычно не требуется. Врачи осуществляют наблюдение, периодически назначают повторные инструментальные исследования. При появлении угрозы для жизни плода (сдавливании пуповины или жизненно важных органов) проводят хирургические вмешательства по внутриутробному рассечению амниотических тяжей. Такие операции появились совсем недавно и пока являются скорее экспериментальным, чем стандартным способом лечения амниотических тяжей, однако, описаны случаи их удачного завершения.
Тактика лечения ребенка с врожденными пороками развития, обусловленными наличием амниотических тяжей, определяется индивидуально. При глубоких вдавлениях в области конечностей, препятствующих нормальному крово- и лифотоку, осуществляют иссечение плотной рубцовой ткани в течение первого года жизни. При синдактилии выполняют разделение пальцев, при косолапости и косорукости проводят консервативное и оперативное лечение. При ампутациях вследствие амниотических тяжей осуществляют протезирование конечностей.
При расщеплении неба и верхней губы обычно требуется несколько хирургических вмешательств (от 2 до 7 в зависимости от тяжести патологии). Операции выполняют поэтапно, возраст проведения хейлопластики и уранопластики также определяют индивидуально, однако все специалисты считают, что лечение и реабилитацию при данной патологии необходимо завершить до достижения шестилетнего возраста. Детей с патологией глаз, развившейся в результате амниотических тяжей, направляют к офтальмологу, в зависимости от характера порока может потребоваться как консервативная терапия, так и оперативное лечение. При гастрошизисе и омфалоцеле показаны хирургические вмешательства.
1. Синдром амниотических перетяжек: этиология, клиника, диагностика/ Вахарловский В.Г., Корюков А.А., Беляк Н.В., Шихмагомедов А.А.// Журнал акушерства и женских болезней. - 2005.
2. Случай амниотических перетяжек у новорождённого ребёнка (синдром Симонарта)/ Лебеденко А.А., Афонин А. А., Козырева Т.Б., Монат Л.И.// Медицинский вестник Юга России. - 2019.
3. Врожденные пороки развития плода: клинический случаи из практики/ Тортаева Г. С, Шакирова А. К.// Клиническая медицина Казахстана. - 2017.
Читайте также:
- Показания, противопоказания для профилактики венозной тромбоэмболии (ТГВ, ТЭЛА)
- Варикоз глазницы: признаки, гистология, лечение, прогноз
- Определение локализации абсцесса мозга. Топическая диагностика отогенного абсцесса мозга
- КТ, МРТ, ангиография при асимметрии крыловидного венозного сплетения
- Диагностика актиномикоза. Микробиологическая диагностика актиномикоза. Выявление актиномицетов. Лечение актиномикоза.
