Операция при повреждении чревного ствола. Тактика
Добавил пользователь Валентин П. Обновлено: 28.01.2026
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, 117997, Москва, Россия
Детская городская клиническая больница №13 им. Н.Ф. Филатова, Москва
Кафедра детской хирургии Российского государственного медицинского университета
ГБУЗ «Детская городская клиническая больница №13 им. Н.Ф. Филатова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Детская областная клиническая больница», Тверь, Россия
Кафедра детской хирургии ГБОУ ВПО «Российский научно-исследовательский медицинский университет им. Н.И. Пирогова» Минздрава РФ, Москва, Россия
Лапароскопическая декомпрессия чревного ствола при компрессионном стенозе у детей
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2017;(10): 44‑51
Цель исследования — выбор оптимального метода хирургического лечения детей с компрессионным стенозом чревного ствола (КСЧС). Материал и методы. С 2013 по 2016 г. в ДГКБ №13 им. Н.Ф. Филатова находились на лечении 4 пациента в возрасте 14 (n=2) и 17 (n=2) лет. Всем пациентам диагноз поставлен на основании данных анамнеза, жалоб, результатов УЗИ в режиме импульсно-волновой допплерографии, МСКТ с внутривенным усилением и ангиографии. После комплексного обследования в 3 наблюдениях была выполнена операция декомпрессии чревного ствола лапароскопическим способом. Во всех наблюдениях основной причиной КСЧС явилось его сдавление срединной дугообразной связкой диафрагмы и нейрофиброзной тканью чревного сплетения. Результаты. Все больные после операции лапароскопической декомпрессии чревного ствола были выписаны в удовлетворительном состоянии. Интра- и послеоперационных осложнений, а также случаев конверсии не было. Средняя длительность операции составила 65 мин. Во всех наблюдениях послеоперационный период протекал без осложнений и в среднем составил 4 койко-дня. Двум пациентам проведено контрольное обследование в позднем послеоперационном периоде: УЗИ в режиме импульсно-волнового допплера, МСКТ с внутривенным усилением и ангиография. Клинически в обоих наблюдениях отмечалось уменьшение интенсивности, частоты и продолжительности болевого синдрома. Вывод. Приведенные клинические примеры показывают ряд проблем в диагностике и лечении при КСЧС, обусловленных редкостью заболевания, особенно в детском возрасте. Тем не менее сочетание клинических проявлений, в первую очередь абдоминальной ишемии, и подтвержденного инструментальными методами исследования стеноза чревного ствола является показанием к оперативному лечению.
Компрессионный стеноз чревного ствола (КСЧС), вызванный сдавлением последнего срединной дугообразной связкой диафрагмы, ее ножками и нейрофиброзной тканью чревного сплетения, был впервые описан P. Harjola в 1963 г. J. Dunbar в 1965 г. впервые представил свои результаты хирургического лечения пациентов со стенозом чревного ствола (синдром Данбара) [1, 2].
По данным разных авторов, частота синдрома компрессии чревного ствола (ЧС) в популяции составляет 0,4%, хотя случайно выявленные гемодинамически значимые и асимптомные наблюдения составляют 2,4—8% [3—5].
Основным клиническим признаком КСЧС является боль в животе, отмечающаяся у 100% больных. Наиболее часто возникновение или усиление боли связано с приемом пищи. Эквивалентом болевых ощущений считается чувство тяжести и распирания в надчревной области. Помимо этих жалоб, у пациентов с КСЧС могут наблюдаться отрыжка, изжога, тошнота, рвота и дисфункция кишечника. Важными объективными симптомами при КСЧС являются болезненность при пальпации живота и систолический шум в эпигастральной области.
Выполнение мультиспиральной компьютерной томографии (МСКТ) с 3D-реконструкцией, ультразвукового исследования (УЗИ) в режиме импульсно-волновой допплерографии и ангиографии позволяет выявить КСЧС и определить показания к хирургическому лечению [6].
С момента первого описания синдром представлялся спорным диагнозом, основанным на вариабельных результатах обследования и их различной патофизиологической интерпретации. Некоторые авторы считали КСЧС более частой причиной хронической ишемии органов пищеварения, в то время как его существование другими авторами вообще оспаривалось [7—12]. Внедрение в практику КТ-ангиографии с 3D-реконструкцией, УЗИ с допплерографией и лапароскопии способствовало возобновлению интереса к синдрому. В статье представлен наш первый опыт выполнения лапароскопической декомпрессии ЧС при его стенозе у детей.
Материал и методы
С 2013 по 2016 г. в нашей клинике находились на лечении 4 пациента в возрасте 14 (n=2) и 17 (n=2) лет. Всем пациентам диагноз поставлен на основании данных анамнеза, жалоб и результатов УЗИ в режиме импульсно-волновой допплерографии, МСКТ с внутривенным усилением и ангиографии.
У 2 пациентов 17 и 14 лет КСЧС заподозрен на основании жалоб на боли в животе и данных УЗИ брюшной полости. При дальнейшем обследовании (выполнение МСКТ с внутривенным усилением и ангиографии) этот диагноз был подтвержден.
У больного 14 лет сужение ЧС выявлено случайно при обследовании по поводу желудочно-пищеводного рефлюкса, хронической дуоденальной непроходимости.
У подростка 17 лет диагноз КСЧС поставлен во время осложненного течения послеоперационного периода после торакопластики Насса по поводу воронкообразной деформации грудной клетки. На 2-е сутки после операции развилась клиническая картина перфоративной язвы двенадцатиперстной кишки, в связи с чем были выполнены лапаротомия, резекция желудка, ваготомия, сформирован гастроэнтероанастомоз на отключенной по Ру петле. При выполнении ангиографии и МСКТ выявлен стеноз ЧС, по поводу чего было предложено хирургическое вмешательство, от которого родители пациента воздержались.
При УЗИ в В-режиме из стандартного эпигастрального доступа изучали ультразвуковую анатомию ЧС и прилегающего к нему сегмента брюшной аорты. Определяли диаметр ЧС, правильность его хода, наличие участков сужения и постстенотического расширения. В режиме цветового допплеровского картирования оценивали признаки дезорганизации потока и их локализацию. При выполнении УЗИ в режиме импульсно-волновой допплерографии регистрировали количественные характеристики — пиковую систолическую скорость (VPS), конечную диастолическую скорость (VED), индекс резистентности (IR). В наших наблюдениях мы оценивали в основном пиковую систолическую скорость — VPS (табл. 1).

Таблица 1. Данные УЗИ у пациентов с КСЧС
Во всех наблюдениях выполнена МСКТ брюшной полости с внутривенным усилением («Визипак»), при которой был подтвержден диагноз КСЧС (рис. 1). Наиболее показательна информация, полученная в сагиттальных срезах.
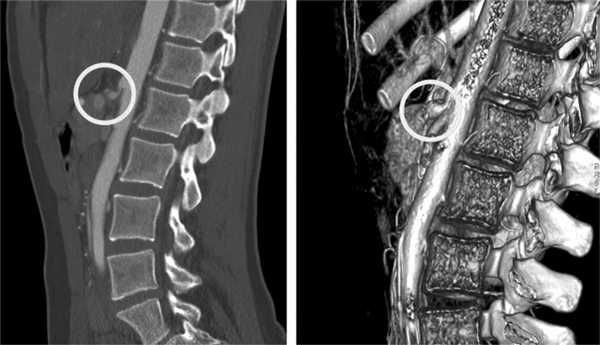
Рис. 1. Мультиспиральная компьютерная томограмма с внутривенным усилением и 3D-реконструкция при КСЧС. Маркером отмечен участок сужения чревного ствола с зоной постстенотического расширения.
При анализе данных МСКТ изучали анатомию ЧС и его основных ветвей, особенности их строения, определяли зону локального сужения и постстенотического расширения. Полученные данные уточняли при 3D-реконструкции.
Ангиография является наиболее инвазивным и в то же время наиболее информативным в настоящее время методом, позволяющим подтвердить диагноз КСЧС, оценить степень и протяженность сужения ЧС и определить показания к хирургическому лечению. При ангиографии после пункции и катетеризации правой бедренной артерии всем больным выполняли целиакографию в прямой и боковой проекциях и аортографию. При этом изучали ангиоархитектонику ЧС и его ветвей, особенности строения и отхождения от аорты с измерением диаметра аорты, диаметра и протяженности стенозированного участка ЧС и диаметра постстенотического участка (рис. 2).
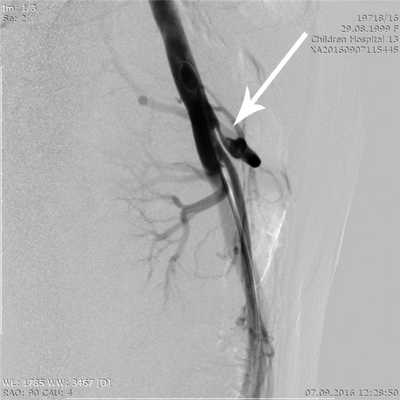
Рис. 2. Ангиограмма (целиакограмма) в боковой проекции. Стрелкой указано сужение устья чревного ствола более 80%.
После комплексного обследования в 3 наблюдениях (1 больной не был оперирован) была выполнена операция декомпрессии ЧС лапароскопическим способом. При этом использовали 5 троакаров. Первый троакар диаметром 10 мм устанавливали для оптики, остальные троакары диаметром 5 мм — для манипуляторов и коагулятора (рис. 3).
Рис. 3. Фотография расположения троакаров при лапароскопической декомпрессии чревного ствола.
После создания карбоксиперитонеума 12 мм рт.ст. осуществляли доступ к чревному стволу и его ветвям через печеночно-желудочную связку. Операция заключалась в полном освобождении ЧС, а также его ветвей от сдавления путем рассечения, а иногда путем иссечения сдавливающих его тканей: срединной дугообразной связки диафрагмы, внутренних ее ножек и нейрофиброзной ткани чревного сплетения (рис. 4).
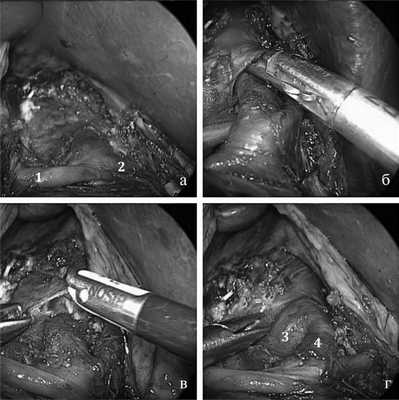
Рис. 4. Эндофотография основных этапов лапароскопической декомпрессии чревного ствола. а — вид после мобилизации общей печеночной артерии (1) и левой желудочной артерии (2); б — мобилизация срединной дугообразной связки; в — рассечение срединной дугообразной связки; г — вид после декомпрессии чревного ствола: аорта (3), чревный ствол (4).
По данным интраоперационной ревизии было установлено, что срединная дугообразная связка диафрагмы в сочетании с нейрофиброзной тканью чревного сплетения являлась основной причиной компрессионного стеноза ЧС во всех наблюдениях.
Результаты
Все больные после операции были выписаны в удовлетворительном состоянии. Интра- и послеоперационных осложнений не было. Случаев конверсии также не было. Основные показатели представлены в табл. 2.

Таблица 2. Послеоперационные данные больных с КСЧС
Средняя длительность операции лапароскопической декомпрессии составила 65 мин. Во всех наблюдениях послеоперационный период протекал без осложнений и в среднем составил 4 койко-дня. Всем пациентам в послеоперационном периоде назначали обезболивание, симптоматическую терапию и выполняли контрольное УЗИ брюшной полости.
Двум пациентам проведено контрольное обследование в позднем послеоперационном периоде: УЗИ в режиме импульсно-волновой допплерографии, МСКТ с внутривенным усилением (рис. 5) и ангиография (рис. 6). Клинически в обоих наблюдениях отмечалось уменьшение интенсивности, частоты и продолжительности болевого синдрома.
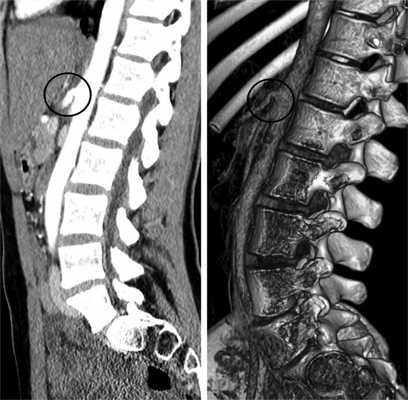
Рис. 5. Мультиспиральная компьютерная томограмма с внутривенным усилением и 3D-реконструкция после операции.
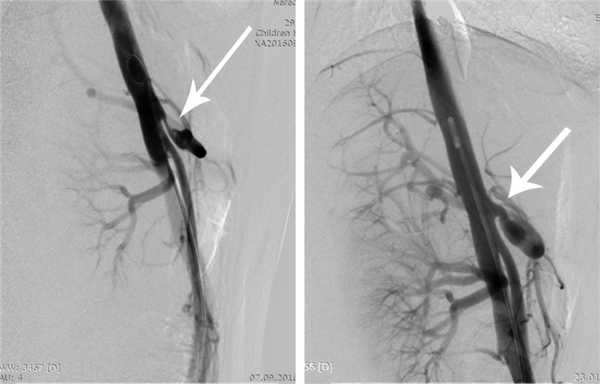
Рис. 6. Ангиограмма (целиакограмма) в боковой проекции до (а) и после (б) операции.
Вопросы этиологии, патогенеза и выбора метода лечения при КСЧС остаются во многом нерешенными до сих пор. Асимптомное течение стеноза ЧС [13, 14] отмечается значительно чаще, чем симптомные проявления, а сам диагноз КСЧС во многих наблюдениях является диагнозом исключения [12, 15].
На ранних этапах заболевания неспецифичность клинической картины зачастую приводит к тому, что пациентов долгое время обследуют у разных специалистов по поводу заболеваний органов брюшной полости. В процессе исключения заболеваний органов брюшной полости зачастую выполняют ряд исследований, включающих ФЭГДС, исследование моторики желудочно-кишечного тракта, КТ брюшной полости, диагностическую лапароскопию/лапаротомию без установления диагноза. В некоторых исследованиях авторы публикуют данные о наличии психических расстройств в 10—15% наблюдений [16, 17].
Подтверждение диагноза КСЧС лучевыми методами диагностики является обязательным. «Золотым стандартом» в диагностике синдрома считалась аортоартериография с выполнением аортограмм в боковой проекции до внедрения КТ-ангиографии, 3D-реконструкции и МР-ангиографии. При ангиографии и селективной артериографии в боковой проекции оценивается изображение деформации ЧС, вызванной срединной дугообразной связкой, а также определяются постстенотическое расширение, наличие коллатерального кровоснабжения и аневризмы панкреатодуоденальной артерии [18, 19]. При этом оценивается проходимость верхней брыжеечной артерии и почечных артерий.
При УЗИ для диагностики стеноза ЧС многие авторы используют критерии, предложенные G. Moneta и соавт. [20]. Согласно их данным, повышение пиковой систолической скорости кровотока в ЧС выше 200 см/с свидетельствует о стенозе 70% и более с чувствительностью 75% и специфичностью 89%. Признаками гемодинамически значимого стеноза считаются снижение пиковой систолической скорости, уменьшение индексов периферического сопротивления и увеличение времени акселерации (постстенотическая кривая типа parvus tardus) в селезеночной артерии.
Некоторые авторы разработали альтернативные методы исследований для оценки окклюзии ЧС и определения признаков ишемии органов пищеварения. P. Mensink и соавт. [21] обследовали 320 пациентов с симптомами хронической ишемии органов пищеварения, используя при этом наряду с селективной ангиографией ЧС желудочную нагрузочную тонометрию. Желудочная тонометрия — это функциональный диагностический тест, при котором измеряются значения уровня pCO2 в желудке и артериальной крови до, во время и после нагрузки. Положительным тест считается при значении градиента pCO2 в желудке и артериальной крови более 0,8 кПа после нагрузки и уровень лактата в артериальной крови менее 8 ммоль/л.
Показаниями к оперативному лечению обычно считают наличие симптомов абдоминальной ишемии, доказанной критической компрессии ЧС и неэффективность консервативной терапии. При выраженной клинической картине и критическом стенозе ЧС показания к операции следует ставить сразу же, поскольку консервативное лечение дает нестойкий результат.
Различные эндоваскулярные процедуры и ангиопластика со стентированием ЧС или без него оцениваются как противоречивые и в совокупности с отсутствием значительного количества наблюдений и отдаленных результатов не позволяют рассматривать этот метод в качестве выбора [31].
Сложной является проблема рецидива заболевания. Дуплексное сканирование в сочетании с МСКТ позволяет успешно решить вопрос верификации стеноза, однако выявление причины рестеноза и выбор лечебной тактики не столь очевидны. Эндоваскулярное лечение может рассматриваться как эффективный и безопасный метод при рестенозах ЧС после декомпрессии и даже аллопротезирования.
Таким образом, приведенные клинические примеры показывают ряд проблем в диагностике и лечении при компрессионном стенозе чревного ствола, обусловленных редкостью заболевания, особенно в детском возрасте. Тем не менее сочетание клинических проявлений, в первую очередь абдоминальной ишемии, и подтвержденного стеноза чревного ствола является показанием к оперативному лечению. Хотя лапароскопический метод оптимален при декомпрессии чревного ствола, выбор метода вмешательства — открытой, лапароскопической или эндоваскулярной операции — зависит от целого ряда обстоятельств и на сегодняшний день должен рассматриваться индивидуально.
Ангиопластика и стентирование чревного ствола и брыжеечных артерий
Ангиопластика и стентирование чревного ствола и брыжеечных артерий применяется для лечения синдрома хронического нарушения кишечного кровообращения (angina abdomenalis) или при экстренной операции по поводу острого нарушения кровообращения кишечника (мезентериального тромбоза).
Нарушения кишечного кровообращения достаточно редко диагностируются без прицельного акцента на определенных жалобах и часто устанавливаются опытным клиницистом только после исключения других причин болей в животе.
Раньше при выявлении сужений чревного ствола или брыжеечных артерий хирурги придерживались консервативной выжидательной тактики, так как открытые операции на этих артериях очень сложны и тяжело переносятся пациентами. Сейчас, благодаря развитию эндоваскулярных технологий, стало возможно малотравматичное устранение проблем с висцеральными артериями.
Преимущества лечения в ИСЦ
При патологии чревного ствола и верхней брыжеечной артерии наши рентгенхирурги могут выполнить ангиопластику и стентирование сужений этих значимых артерий. Чаще всего используется доступ через плечевую или лучевую артерию.
При наличии тромбоза мезентериальной артерии или чревного ствола в нашей клинике выполняются операции тромбэктомии с помощью специального зонда Rotarex или селективный тромболизис. После восстановления кровотока мы выполняем ангиопластику и стентирование.
Показания и противопоказания к методу лечения
Показания:
Стеноз чревного ствола более 60% с синдромом хронической абдоминальной ишемии
Стеноз верхней брыжеечной артерии более 60% (симптомы сосудистой недостаточности кишечника не являются обязательным показанием, достаточно факта стеноза)
Этап эндоваскулярного лечения острой мезентериальной непроходимости (мезентериальный тромбоз)
Противопоказания:
- Аллергия на йод
- Аневризма торакоабдоминальной аорты (без операции по поводу аневризмы)
- Стадия некроза кишки при мезентериальном тромбозе
Подготовка к лечению
Стандартное обследование перед операцией:
- Клинические анализы крови и мочи, биохимический анализ крови.
- Коагулограмма, агрегация тромбоцитов
- Гастроскопия (исследование желудка)
- Рентгенография легких
- ЭКГ
- ЭХО кардиография
- УЗИ органов брюшной полости, аорты и артерий конечностей
- Мультиспиральная компьютерная томография с контрастом аорты и ее ветвей
Перед операцией необходимо воздерживаться от приема пищи за 8 часов и жидкости за 2 часа. Других мероприятий по подготовке не требуется.
Как проходит метод лечения
Операция проводится под местной анестезией в области доступа. Возможно доступ будет на бедре или в области локтевого сгиба. Операционное поле обрабатывается антисептиком и закрывается стерильными простынями.
Хирург выполняет местную анестезию места прокола, после чего проводится пункция артерии специальной иглой и установка короткой трубочки - интрадюссера.
Через интрадюссер проводится вся дальнейшая работа с сосудами. Специальный проводник заводится в брюшную аорту, затем по нему проводится катетер, через который выполняется контрастное исследование чревного ствола и брыжеечной артерии. Этот этап называется селективной ангиографией. Она является окончательным методом диагностики. Если сужения артерий подтверждаются, то проводник заводится ниже места сужения. По проводнику проводится баллон со стентом. Раскрытием этого баллона устраняется сужение артерии, а стент укрепляет артериальную стенку.
После имплантации стента обязательно проводится контрольная ангиография, чтобы исключить возможные осложнения. Катетер и интродюссер извлекаются из места доступа, а кровотечение останавливается прижатием или с использованием специального сшивающего устройства "Ангиосил".
Возможные осложнения при лечении
Осложнения самой операции:
- Разрыв суженной артерии с кровотечением - требует экстренной открытой операции или установки специального покрытого стента (стент-графта). К счастью, встречается очень редко.
- Тромбоз реконструированной артерии - редкое осложнение, встречается при повышенной свертываемости крови. Если проводится предоперационная подготовка с использованием антитромбоцитарной подготовки, то риск минимальный. Если тромбоз наблюдается во время вмешательства, то выполняется тромбэктомия или тромболизис (введение препаратов рассасывающих тромб). Если признаки нарушения кишечного кровообращения наблюдаются после операции, то пациент повторно берется в операционную и проводится удаление тромбов с помощью ротарекса или специальных аспирационных катетеров.
Осложнения сосудистого доступа:
- Гематома в области пункции
- Тромбоз артерии в области пункции
- Повреждение нервов в области пункции
Эти осложнения встречаются крайне редко и легко устраняются при своевременном выявлении.
Прогноз после метода лечения
Успешное выполнение по показаниям ангиопластики и стентирования чревного ствола и брыжеечной артерии приводит к полному избавлению пациентов от имевшихся ранее жалоб.
По нашей практике улучшение общего состояние и прекращение ишемических болей отмечено у всех пациентов после вмешательства.
За время наблюдения этот эффект сохранялся.
Программа наблюдения после метода лечения
Наблюдение за результатами ангиопластики и стентирования висцеральных артерий осуществляется с помощью УЗИ контроля через 3 месяца, а затем ежегодно.
Через год после вмешательства желательно выполнить мультиспиральную компьютерную томографию с контрастированием брюшной аорты и ее ветвей.
После лечения пациенту назначаются антитромботические препараты. Чаще всего это аспирин и клопидогрель (плавикс). Прием этих препаратов нужно осуществлять постоянно, обязательно ставя в известность врачей перед выполнением каких-либо других вмешательств.
Заболевания
Ангиопластика и стентирование чревного ствола и брыжеечной артерии является эффективным методом улучшения кишечного кровообращения и устранения рисков развития острой мезентериальной непроходимости. Операция проводится без разрезов под рентгенконтролем и имеет минимальный риск осложений, позволяя значительно улучшить качество жизни пациентов.
Операция при повреждении чревного ствола. Тактика
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ
ФГБУ «Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского» Минздрава России, Москва, Россия
Хирургическое лечение экстравазальной компрессии чревного ствола
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2017;(12): 85‑89
Синдром компрессии чревного ствола (СКЧС) — это редкое заболевание, обусловленное экстравазальным сдавлением чревного ствола срединной дугообразной связкой диафрагмы. Такое заболевание является одной из причин хронической абдоминальной ишемии [1, 2]. В основе СКЧС лежит нарушение взаимоотношений анатомических структур. В 1965 г. американский врач J. Dunbar [3] впервые описал этот синдром, который в последующем стал называться его именем [3]. В норме чревный ствол отходит от аорты ниже поясничной части диафрагмы, что исключает его компрессию. В случае высокого отхождения этого сосуда от брюшной аорты или низкого расположения поясничной части диафрагмы, или сочетания этих анатомических отклонений в процессе онтогенеза формируется компрессия чревного ствола. На основании клинико-генеалогического исследования группа ученых под руководством Л.В. Поташова установила, что анатомический вариант строения, при котором возможно развитие данного синдрома, имеет врожденный характер и передается по аутосомно-доминантному типу наследования [4]. По мнению А.В. Покровского, при экстравазальной компрессии чревного ствола «постоянная травма артерии приводит к ее рубцовому стенозу», что обусловливает неуклонно прогрессирующее течение процесса. Механизм происхождения боли в животе схож с таковыми при стенокардии напряжения и связан с недостатком притока крови к активно функционирующим органам брюшной полости вследствие нарушения кровотока по чревному стволу [1].
При СКЧС имеются сложности как для диагностики, так и для лечения. Сложность заключается в том, что наличие экстравазальной компрессии, выявленной по данным инструментальных методов исследования, зачастую не соответствует клинической картине и жалобам пациентов. По данным литературы, у 10—24% населения в той или иной степени имеется сдавление чревного ствола срединной дугообразной связкой диафрагмы [5, 6]. У большинства этих людей нет никаких клинических проявлений этого состояния, так как вследствие длительного врожденного характера таких изменений кровообращение компенсировано за счет коллатерального кровотока. Лишь у 1% больных наблюдается клиническая симптоматика [5]. Причины, по которым у одних пациентов кровообращение в бассейне чревного ствола полностью компенсируется за счет коллатерального кровотока, а у других развивается ишемия, до конца не изучены. Возможно, у пациентов молодого возраста клиническая симптоматика проявляется вследствие завершения формирования мышечно-сухожильного каркаса диафрагмы, происходящего к 20—25 годам [7]. У пациентов пожилого возраста блок коллатерального кровотока с высокой долей вероятности может быть следствием атеросклеротического поражения в бассейне верхней брыжеечной артерии [1].
Чревный ствол, верхняя и нижняя брыжеечные артерии соединяются между собой врожденными коллатеральными анастомозами, образуя единый сосудистый путь кровотока, по которому в зависимости от этапа пищеварения и потребностей в кровоснабжении конкретного органа кровь может двигаться как в каудальном, так и в краниальном направлении [1, 8]. За счет этого обеднение кровотока при СКЧС зачастую достигает пика после приема пищи и провоцируется снижением кровотока и последующей ишемией [1]. При ишемии в первую очередь страдают ткани слизистой оболочки желудочно-кишечного тракта, что приводит к органическим и морфологическим изменениям органов в виде дистрофии, атрофии, эрозий и изъязвлений [9].
По мнению некоторых авторов, природа абдоминальных болей при СКЧС может иметь нейрогенный характер. Так, еще в 1963 г. P. Harjola [10] сообщил о нарушении проходимости чревного ствола, вызванном его сдавлением нейроганглионарной тканью чревного сплетения и сопровождающемся клинической картиной angina abdominalis. Сторонники этой теории считают, что механическое раздражение ткани чревного сплетения вследствие ее сдавления между чревным стволом и срединной дугообразной связкой диафрагмы, усиливающееся в процессе пищеварения за счет увеличения артериальной пульсации (так называемый «водяной молоток»), является причиной эпигастральной боли у пациентов [4]. Однако уверенной доказательной базы у этой теории нет. Также существует мнение, что ишемическая боль при этом заболевании связана с нейрогенным спазмом периферических артерий [1, 4].
Таким образом, патофизиологические аспекты данного заболевания до сих пор вызывают множество вопросов. В связи с этим и по техническим аспектам оперативного вмешательства у разных авторов имеются разногласия. Так, некоторые авторы считают необходимым иссечение нервных ганглиев в процессе декомпрессии чревного ствола. S. Thoolen и соавт. [11] отмечают, что в развитии клинических проявлений, свойственных синдрому Данбара, большую роль играет нейрогенный фактор. Авторы обращают внимание на то, что купирование проявлений СКЧС может быть достигнуто скорее иссечением чревных ганглиев, чем восстановлением кровотока по магистральному сосуду. До сих пор единодушия в этом вопросе не достигнуто. На данный момент нет четких представлений о том, в каком объеме необходимо удалять нервные ганглии и даже нужно ли их удалять вообще [4, 11].
Ключевым вопросом при наличии СКЧС является определение показаний к оперативному вмешательству. Выявление пациентов, у которых именно компрессия чревного ствола обусловливает клинические признаки заболевания — непростая задача. Так, для постановки диагноза необходимо наличие соответствующей клинической картины в сочетании с характерными изменениями по данным инструментальных методов исследования (УЗДС, КТ-ангиографии). Согласно руководству по лечению и диагностике заболеваний периферических сосудов Европейского общества кардиологов, первоначальным диагностическим тестом должна быть УЗДС брюшной аорты, чревного ствола и верхней брыжеечной артерии. Важнейшим методом диагностики СКЧС является КТ-ангиография. Катетерная рентгеноконтрастная ангиография применяется исключительно для эндоваскулярной ангиопластики и стентирования [12].
Симптоматика может быть разнообразной: хроническая абдоминальная боль, возникающая или усиливающаяся после приема пищи, в некоторых наблюдениях сопровождающаяся диспепсическими явлениями (тошнотой, рвотой, метеоризмом, диареей, потерей в массе тела), нейровегетативными расстройствами (сердцебиением, потоотделением), депрессивным астеноипохондрическим синдромом. Очень часто при экстравазальной компрессии чревного ствола клиническая симптоматика не связана с хронической абдоминальной ишемией, а обусловлена другими, ранее не диагностированными заболеваниями (хроническим панкреатитом, язвой, гастритом, опухолью желудочно-кишечного тракта и т. д.).
Важным этапом в дифференциальной диагностике СКЧС является исключение у пациентов, имеющих по данным инструментальных методов исследования экстравазальное сдавление чревного ствола, заболеваний психиатрического профиля. Так, в Орловском государственном медицинском университете в ходе предоперационной подготовки были обследованы 74 пациента с наличием СКЧС, из них у 47 (63,5±4,9%) диагностированы различные психические расстройства (астенодепрессивный, астенический, ипохондрический, тревожно-депрессивный синдромы, эпилепсия) [13].
Таким образом, на основании всего изложенного выше можно сформулировать клиническое определение СКЧС следующим образом: экстравазальная компрессия чревного ствола, подтвержденная инструментальными методами исследования, сопровождающаяся клинической симптоматикой абдоминальной ишемии, которую нельзя связать с каким-либо другим заболеванием.
Существуют ультразвуковые критерии экстравазальной компрессии чревного ствола: его углообразная деформация в краниальном направлении при исследовании в В-режиме с элайзинг-эффектом в режиме цветового допплеровского картирования, увеличение пиковой систолической скорости кровотока в чревном стволе в фазе глубокого выдоха не менее чем на 80% по сравнению с фазой глубокого вдоха, а также снижение пиковой систолической скорости кровотока, индексов периферического сопротивления и «удлинение акселерации» в селезеночной артерии [14, 15]. При артериальных стенозах, как правило, принято считать уменьшение просвета сосуда менее чем на 50% гемодинамически незначимым. Стеноз более 50% по диаметру расценивают как гемодинамически значимый [14]. Однако при повышении системного артериального давления, особенно пульсового, признаки локальной гемодинамической значимости поражения сосуда могут проявляться и при меньшей степени стеноза.
По мнению А.И. Канаева [16], компрессию чревного ствола можно считать гемодинамически значимой при степени сужения просвета сосуда более 50%, пиковой систолической скорости кровотока более 2 м/c и градиенте артериального давления в чревном стволе более 15 мм рт.ст. на максимальном выдохе. Для обнаружения СКЧС рекомендуется выполнять УЗДС на выдохе, вдохе, а также в вертикальном положении тела и при этом учитывать полученные результаты исследования как диагностически значимые в оценке стеноза и расстройств регионарной гемодинамики в чревном стволе [4].
Неоднозначен вопрос корреляции гемодинамической значимости экстравазальной компрессии чревного ствола по данным инструментальных методов исследования и клинических проявлений СКЧС. Нередко клиническая симптоматика при наличии гемодинамически значимой компрессии чревного ствола отсутствует, в то время как при гемодинамически незначимых изменениях кровотока может наблюдаться клиническая картина СКЧС.
При выполнении КТ-ангиографии характерным для экстравазальной компрессии чревного ствола является симптом «рыболовного крючка», что позволяет провести дифференциальную диагностику с другой причиной стеноза чревного ствола — атеросклеротическим поражением [6].
Чрезвычайно важным остается и вопрос оценки результатов лечения пациентов. Существует мнение, что с учетом врожденного характера СКЧС оперировать таких пациентов нецелесообразно [17]. Однако имеющийся опыт лечения демонстрирует, что эффективность оперативного вмешательства у пациентов с клинической картиной СКЧС в сочетании с гемодинамически значимым стенозом достаточно высока. Так, по данным ретроспективного анализа, проведенного в одной из клиник Орла, из 261 пациента, перенесшего открытую декомпрессию чревного ствола, отличные результаты оперативного лечения наблюдаются у 2/3, хорошие (значительное улучшение) — еще у 1/5. Эти результаты оставались стабильными в течение длительного периода наблюдения [13]. В настоящее время в научном сообществе превалирует мнение, что показанием к хирургическому лечению таких пациентов является гемодинамически значимый стеноз чревного ствола по данным инструментальных методов исследования в сочетании с клинической картиной хронической абдоминальной ишемии [18].
В свою очередь в пользу хирургической тактики свидетельствует исследование группы ученых Католического университета г. Лилль под руководством E. Ducasse, в котором указано на то, что у 80% пациентов с компрессией чревного ствола обнаруживается аневризматическая трансформация артерий бассейна брюшного отдела аорты. При этом поражались преимущественно артерии системы панкреатодуоденальной аркады, желудочно-сальниковая артерия и чревный ствол; развитие осложнений, связанных с наличием аневризм, отмечалось в 3—18% наблюдений. Опасность заключается в том, что подобное состояние протекает бессимптомно вплоть до разрыва аневризмы с соответствующим риском летального исхода [19].
Многие годы при выявлении нарушений кровотока по чревному стволу методом выбора была коррекция этого состояния путем рассечения срединной дугообразной связки диафрагмы с использованием верхнесрединной лапаротомии или даже торакофренолюмботомии, что сопровождалось непростым течением послеоперационного периода из-за травматичности доступа. По мнению ряда авторов, проведение декомпрессии чревного ствола с использованием верхнесрединной лапаротомии является наиболее надежным и относительно мало травматичным методом [4]. Послеоперационная летальность при этом менее 1% [1]. Также открытый доступ позволяет провести тщательную ревизию органов брюшной полости и в случае необходимости выполнить симультанную операцию [20].
В России первая такая операция была проведена в 2005 г. в Институте хирургии им. А.В. Вишневского, к настоящему времени выполнено 40 лапароскопических декомпрессий чревного ствола.
N. Jaik и соавт. [24] описали первый опыт выполнения робот-ассистированной декомпрессии чревного ствола, с тех пор было опубликовано 9 работ. В результатах говорится об одном случае конверсии в открытый доступ из-за повреждения аорты. По данным S. Thoolen и соавт. [11], преимуществами применения роботических технологий при синдроме сдавления чревного ствола являются повышение «ловкости» оперирования и наличие трехмерного изображения, что, как представляется авторам, существенно улучшает условия работы в области чревного ствола, особенно при имеющихся фиброзных сращениях и трудно различимых структурах, находящихся на передней стенке магистральных сосудов.
После накопления в течение 20 лет ошибок и неудач при изолированных эндоваскулярных вмешательствах в 1980 г. впервые были опубликованы результаты успешного применения гибридного доступа с использованием хирургического и эндоваскулярного методов для лечения пациентов с синдромом хронической абдоминальной ишемии [25]. По данным L. Reiley и соавт. [26], пациенты, которым выполнена только декомпрессия чревного ствола, чаще были склонны к рецидиву боли (44%), чем больные, которым дополнительно проводили эндоваскулярный этап реваскуляризации методом стентирования.
Баллонная дилатация и стентирование в качестве единственного метода лечения не рекомендуются при СКЧС, так как срединная дугообразная связка, являясь чрезвычайно плотной анатомической структурой, препятствует адекватной дилатации чревного ствола [20]. Согласно данным литературы, изолированное использование эндоваскулярных методов лечения при СКЧС даже с применением стентирования сопряжено с высокой частотой неудач [27]. Использование эндоваскулярных стентов с целью дилатации чревного ствола, по мнению ряда хирургов, не оправдано, так как в некоторых наблюдениях стенты ломаются при дыхании. Несмотря на это, в некоторых ситуациях эндоваскулярные вмешательства могут быть очень эффективны, например при аневризме висцеральных артерий. Это осложнение чаще развивается в системе гастродуоденальной аркады («малой дуги Риолана»), также может появляться в чревном стволе в виде постстенотической дилатации и в желудочно-сальниковой артерии, причиной ее развития является повышение коллатерального кровотока на фоне СКЧС [27].
Одним из обсуждаемых является вопрос о необходимости выполнения интраоперационного ультразвукового контроля. Так, ряд хирургов не выполняют этот этап операции в связи с тем, что не имеют в своем арсенале соответствующей аппаратуры и не владеют данной методикой. Хирурги, владеющие данной методикой, считают интраоперационное УЗИ необходимым для обеспечения благоприятного технического и клинического результата декомпрессии [1, 21]. Интраоперационный ультразвуковой контроль позволяет быстрее выйти на чревный ствол, что особенно актуально в ситуации анатомической аномалии расположения сосудов целикомезентериального бассейна, встречающейся в 45% наблюдений [28, 29], а также при выраженном абдоминальном ожирении. Для определения анатомии оперируемой области можно ориентироваться по данным КТ-ангиографии, которую необходимо выполнять всем пациентам в предоперационном периоде. Однако быстрее всего определить сосудистую анатомию и устье чревного ствола можно именно с помощью интраоперационного УЗИ. Полагают, что интраабдоминальное УЗИ чревного ствола и верхней брыжеечной артерии во время операции менее подвержено ошибкам из-за технических трудностей, позволяет измерить более точно диаметр сосуда, скорость кровотока в нем и оценить адекватность декомпрессии чревного ствола [30]. Оценка степени восстановления просвета чревного ствола в процессе декомпресии во время операции позволяет дать убедительный прогноз. Известно, что окончательное восстановление просвета чревного ствола после декомпрессии происходит постепенно в послеоперационном периоде. Полного восстановления просвета, как правило, не происходит вообще, что связано с врожденным характером аномалии и изменением стенки самого чревного ствола в ходе формирования организма на протяжении всей жизни человека. Учитывая, что формирование каркаса диафрагмы и развитие сосудов у детей еще не завершены, мы можем ожидать более убедительные результаты декомпрессии чревного ствола именно у пациентов детского возраста.
Таким образом, на данный момент каждый пациент с синдромом компрессии чревного ствола остается сложным для клинициста. Важнейшим вопросом в обследовании и лечении таких пациентов остается определение показаний к оперативному вмешательству. До сих пор хирургическая декомпрессия чревного ствола вызывает множество тактических вопросов, хотя с развитием этой методики на многие из них уже найден ответ. На сегодняшний день очевидно, что оптимальным доступом для выполнения декомпрессии чревного ствола является лапароскопический.
Над статьей доктора Пузанова Сергея Юрьевича работали литературный редактор Вера Васина , научный редактор Динар Сафин и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Компрессионный стеноз чревного ствола ( Celiac artery compression syndrome , или синдром Данбара) — это комплекс симптомов, который возникает после сдавления чревного ствола. Из-за нехватки кровотока в артериях, питающих желудок, селезёнку и печень, у пациента появляется боль в животе после приёма пищи, нарушается стул, постепенно снижается вес.
Со временем стеноз приводит к появлению хронической абдоминальной ишемии — постоянному кислородному голоданию желудка, печени и селезёнки [2] . Состояние может осложниться развитием язвы желудка , двенадцатиперстной кишки и истощением.
Впервые компрессию чревного ствола описал американский врач J. D. Dunbar в 1965 году [1] . Она есть у 10–24 % людей в мире [3][5] .
Обычно стеноз чревного ствола протекает бессимптомно. Признаки нарушения возникают только у 1–5 % людей с этой патологией из-за сниженного притока крови к желудку и другим органам. В основном симптомы возникают у молодых людей 23–35-ти лет, из них 47 % женщин и 53 % мужчин [3][5] .
На развитие компрессионного стеноза в первую очередь влияют врождённые анатомические особенности :
- высокое отхождение чревного ствола от брюшной аорты;
- расположение чревного ствола в грудном сегменте аорты;
- узкая грудная клетка (астеническое телосложение);
- низкое расположение диафрагмы, её ножек и срединной дугообразной связки;
- множество нервных узлов солнечного сплетения в месте отхождения чревного ствола от аорты [4][9] .
Основными факторами перехода бессимптомной формы стеноза в клинически значимую являются:
- курение ;
- нарушение реологических свойств крови (её сгущение, склонность к тромбообразованию);
- формирование атеросклеротической бляшки в устье чревного ствола;
- анемия ;
- избыточная физическая нагрузка.
Внешний (экстравазальный) стеноз может долго протекать бессимптомно и проявиться только в пожилом возрасте с развитием генерализованного атеросклероза и образованием атеросклеротической бляшки в чревном стволе. В этом случае тактика лечения несколько отличается от тактики ведения молодых пациентов. Подробнее об этом поговорим ниже, в разделе «Лечение».
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы стеноза чревного ствола
- боль в животе после приёма пищи;
- диспепсические расстройства: изжога, тошнота, горечь во рту, проблемы со стулом;
- прогрессирующая потеря веса;
- слабость и утомляемость;
- неспецифические психоэмоциональные расстройства, такие как депрессия , неврозы , зацикливание на своей болезни;
- жалобы, связанные с сопутствующими заболеваниями.
Боль в животе носит тянущий или ноющий характер. Обычно возникает через 15 – 20 минут после приёма пищи и самостоятельно проходит через 40 – 90 минут. Как правило, локализуется в верхних отделах живота (в эпигастрии), но иногда из-за связи чревного сплетения с другими зонами боль возникает в правой и левой подвздошной области, под правым подреберьем или вокруг пупка. Ещё одной причиной болей в животе может стать физическая нагрузка или психоэмоциональное напряжение [7] .
Диспепсические расстройства , в отличие от боли в животе, беспокоят пациентов не только после приёма пищи. Зачастую они становятся постоянными и плохо поддаются медикаментозной терапии.
Из-за боли и тошноты после приёма пищи пациенты часто боятся есть и постепенно начинают худеть . От недоедания и плохого кровоснабжения возникает слабость и утомляемость. Иногда вес не снижается, но набрать его при стенозе не получается.
Во время гастроскопии у людей со стенозом чревного стола часто выявляют грыжу пищеводного отверстия диафрагмы (ГПОД), а при УЗИ органов брюшной полости — желчнокаменную болезнь . Эти сопутствующие заболевания плохо сказываются на выраженности симптомов и качестве жизни пациента.
ГПОД, как правило, проявляется жгучими болями за грудиной по ходу пищевода, изжогой и отрыжкой. При желчнокаменной болезни периодически возникают приступообразные боли в правом подреберье и тошнота. Нередко развивается острое воспаление желчного пузыря, которое требует экстренной операции.
От появления первых симптомов стеноза до постановки верного диагноза обычно проходит не один год [6] . Очень часто пациенты с этой патологией приходят на приём к хирургу гастроэнтерологу, терапевту или в экстренном порядке поступают в больницу с подозрением на другие острые заболевания, такие как панкреатит, желчная колика, аппендицит , язва желудка или двенадцатиперстной кишки . Их оперируют по поводу предполагаемых болезней, но симптомы не исчезают.
Чтобы избавить себя от ненужных операций и вовремя поставить верный диагноз, пациенту стоит в первую очередь обратиться к гастроэнтерологу и пройти дообследование.
Патогенез стеноза чревного ствола
Чревный ствол — это толстая короткая ветвь брюшного отдела аорты. Она начинается сразу под диафрагмой и делится на три артерии, которые снабжают кровью печень, селезёнку и желудок.
Обычно развитие стеноза неразрывно связано с двумя анатомическими особенностями:
- отхождением ствола от аорты сразу под срединной дугообразной связкой диафрагмы;
- тесным контактом с чревным сплетением и наслоением его тканей на чревный ствол [9] .
Окружающие ткани плотно сдавливают чревный ствол и образуют механическую преграду, сужая просвет ствола. Из-за возникшего стеноза к органам поступает меньше крови, чем нужно.
Особенно остро эта нехватка ощущается при переваривании пищи: она становится причиной появления боли в животе. Со временем из-за нехватки кислорода, который должен поступать с кровью, развивается хроническая абдоминальная ишемия [10] .
Нередко при обследовании по каким-либо смежным проблемам у пациентов выявляют гемодинамически значимый стеноз — с диаметром ствола более 70 %. Несмотря на анатомическую предрасположенность и механическую преграду, к органам всё-таки поступает достаточное количество крови, богатой кислородом, поэтому у пациента не возникают типичные признаки абдоминальной ишемии.
Другой причиной, по которой стеноз никак себя не проявляет себя, является коллатеральный (обходной) кровоток. Но он не всегда может обеспечить органы достаточным притоком крови.
Классификация и стадии развития стеноза чревного ствола
Пока у этой патологии нет единой общепринятой классификации. Множество авторов предлагали разные варианты, но они не получили повсеместного распространения.
Наиболее популярной и практически значимой считается хирургическая классификация А. А. Спиридонова [8] . Она помогает понять, нужна ли пациенту операция, спрогнозировать и оценить результаты лечения.
Вместе с соавторами А. А. Спиридонов разделил развитие болезни на четыре стадии:
Гастроэнтерологи часто используют классификацию, предложенную доктором Л. Б. Лазебником и соавторами [11] . В ней хроническая абдоминальная ишемия разделена на четыре функциональных класса (ФК):
- I ФК — симптомы не выражены, кровоток нарушается только после приёма пищи или физической нагрузки, например бега.
- II ФК — боль возникает в покое и усиливается при нагрузке на органы пищеварения, человек постепенно худеет, кишечник и поджелудочная железа перестают нормально работать: помимо боли в верхних отделах живота возникает тошнота и рвота, стул становится кашицеобразным .
- III ФК — выраженное нарушение кровотока в покое сочетается с постоянной болью в животе, развитием гастрита и язв.
- IV ФК — стадия деструктивных изменений, вплоть до некроза стенки желудка. Стадия развивается очень редко и в основном связана с тромбозом чревного ствола — полной закупоркой его просвета.
Осложнения стеноза чревного ствола
К осложнениям относятся клинические проявления в стадии декомпенсации:
- Язвы желудка или двенадцатиперстной кишки . Возникают из-за ишемии слизистой оболочки органа. Их проявления несколько схожи со стенозом: боли в верхних отделах живота, вздутие, тошнота, изжога, иногда рвота. Но в отличие от стеноза, боли при гастрите и язве возникают на «голодный» желудок.
- Кахексия(истощение) . Боль после приёма пищи вынуждает больного отказаться от еды. Из-за этого в организм перестают поступать необходимые вещества (витамины, минералы, белки, жиры, углеводы, аминокислоты), нарушается выработка ферментов, создание новых клеток и другие процессы.
Кроме этого, у язвенной болезни есть свои жизнеугрожающие осложнения:
- Желудочно-кишечное кровотечение . Проявляется рвотой в виде кофейной гущи, чёрным дёгтеобразным стулом (меленой), слабостью, головокружением и потерей сознания.
- Перфорация язвы . Кислое содержимое желудка, проникая в брюшную полость, обжигает и инфицирует её. Это приводит к развитию перитонита — смертельно опасному состоянию, которое требует экстренной операции.
- Пенетрация язвы . Язвенный дефект образует свищевой ход и проникает в поджелудочную железу, общий желчный проток или желчный пузырь и вызывает воспаление.
- Рубцово-язвенный стеноз . После заживления язвы в выходном отделе желудка или луковице двенадцатиперстной кишки замещаются рубцовой тканью. Из-за этого просвет органа сужается, что затрудняет прохождение пищи. При тяжёлой форме рубцово-язвенного стеноза развивается непроходимость: пища перестаёт попадать в кишечник.
- Малигнизация язвы . Клетки в области язвенного дефекта могут трансформироваться в раковые, что приводит к развитию злокачественной опухоли . Это осложнение характерно для большинства язв желудка: в 92 % случаев хроническая язва является предраковым состоянием [20][21] .
Диагностика стеноза чревного ствола
Подтвердить или исключить компрессионный стеноз чревного ствола нетрудно. Но прежде чем врач заподозрит это редкое заболевание, может пройти много времени: в среднем около трёх лет [5] . За этот период у пациента диагностируют и лечат другие сопутствующие болезни с похожими симптомами, но это не приводит к стойкой ремиссии и не улучшает состояние больного.
Чтобы поставить верный диагноз, нужно исключить другие, более очевидные причины.
Диагностика начинается с тщательного сбора жалоб и истории болезни (анамнеза). Обычно заподозрить стеноз позволяет триада симптомов: боль в верхних отделах живота, которая возникает после приёма пищи и самостоятельно проходит через 2 часа, постепенная потеря веса и диспепсические расстройства, описанные выше [12] .
При объективном осмотре можно заметить дефицит массы тела, бледность и сухость кожи. Выслушивание стетоскопом помогает уловить систолический шум в верхней части живота: он указывает на препятствие кровотоку. При прощупывании живота возникает умеренная боль в верхних отделах.
При УЗДС чревного ствола оцениваются такие параметры, как диаметр сосуда, процент стеноза, пиковая систолическая и конечная диастолическая скорость кровотока (ПССК и КДСК). Исследование проводится стоя, важно сравнить параметры на вдохе и на выдохе [13] .
Ангиография помогает выявить точное место стеноза и его степень сразу во время исследования. Недостатком метода является его инвазивность: это операция, которая требует анестезии [15] .
КТ-ангиография с внутривенным контрастированием и 3D-реконструкцией позволяет с высокой точностью подтвердить внешнюю компрессию чревного ствола и оценить степень стеноза [14]. Она также помогает определить угол, под которым чревный ствол отходит от аорты. Всё это нужно для того, чтобы спланировать операцию [12]. Аппараты для такого исследования есть даже в районных центрах.
Лечение стеноза чревного ствола
Лечение стеноза бывает консервативным и оперативным. Первый вариант возможен в стадии компенсации и субкомпенсации. Он направлен на купирование симптомов. Если консервативная терапия оказалась неэффективной, пациенту назначают оперативное лечение.
Консервативное лечение не влияет на основную причину болезни. Оно сугубо симптоматическое или направлено на сопутствующие заболевания: ГПОД или желчнокаменную болезнь.
В качестве симптоматического лечения используют различные лекарства :
- гастропротекторы — защищают и восстанавливают слизистую оболочку желудка;
- обволакивающие препараты — используют с той же целью непосредственно перед приёмом пищи;
- прокинетики — положительно влияют на моторику желудка, назначают при тошноте во время еды или гастроэзофагеальном рефлюксе (ГЭРБ);
- спазмолитики — воздействуют на гладкую мускулатуру, снижая болевой синдром;
- нестероидные противовоспалительные препараты (НПВП) — используются для обезболивания.
Следующий важный момент консервативного лечения — щадящая диета . Важно исключить из рациона острую, жирную и жареную пищу. Чтобы снизить нагрузку на желудок, рекомендуется питаться дробно, небольшими порциями. Также важно избегать стрессов и чрезмерной физической нагрузки. Всё это помогает снизить интенсивность боли после еды.
Некоторые клиники в комплексное лечение включают психотерапию и иглорефлексотерапию [16] . У последнего метода лечения нет безоговорочно доказательной базы, но многие практикующие врачи отмечают его эффективность в комплексной терапии.
Если консервативное лечение не помогает, встаёт вопрос о проведении операции.
Чтобы выяснить, нужна ли пациенту операция, врач должен определить клиническую стадию болезни, выраженность симптомов, частоту их появления и оценить результаты обследования: УЗДС или КТ-ангиографии.
Затем нужно выбрать метод оперативного лечения:
- отрытая или лапароскопическая декомпрессия чревного ствола [7] ;
- реконструктивная операция;
- эндоваскулярная хирургия;
- гибридное оперативное лечение.
Отрытая операция — самый частый способ хирургического лечения. Чтобы добраться до чревного ствола, доктор рассекает брюшную стенку, а затем — давящие на него структуры: срединную дугообразную связку диафрагмы и ткани чревного сплетения.
Эта операция эффективна, но довольно травматична. После вмешательства организм восстанавливается примерно три месяца. Могут образоваться вентральные грыжи, при которых внутренние органы смещаются кнаружи. Иногда стеноз развивался повторно [17] .
Лапароскопическая декомпрессия чревного ствола по технике выполнения принципиально не отличается от открытой операции. Разница — в менее травматичном (малоинвазивном) доступе и удобном отображении зоны вмешательства, которая видна всей операционной бригаде.
Боль в ране после такой операции менее выражена, пациент быстрее восстанавливается: в среднем 4–5 дней он находится в стационаре под наблюдением врача, а через 3–4 недели возвращается к обычной жизни и привычным нагрузкам.
Об успешной лапаросокпической декомпрессии чревного ствола первым сообщил американский хирург S. Roayaie в 2000 году [19] . С тех пор эту методику осваивают многие хирурги, но пока она не смогла «вытеснить » открытую декомпрессию. Это связано с техническими трудностями во время операции и приверженности пожилых хирургов к традиционной, более привычной методике.
Реконструктивные операции рекомендуются при выраженных изменениях, которые не позволяют освободить чревный ствол от сдавливающих тканей. Они выполняются сосудистыми хирургами в специализированных центрах. Врачи делают пластику чревного ствола или заменяют его трансплантатом — искусственным или естественным, т. е. другим сосудом. Эти операции выполняются открытым способом и переносятся пациентом так же, как и открытая декомпрессия чревного ствола.
Эндоваскулярная операция рекомендуется пациентам старше 60 лет, артерии которых сужены атеросклеротическими бляшками. Чревный ствол расширяют с помощью баллонного дилататора или стента [18] . Оба варианта можно выполнить только после предварительной хирургической декомпрессии [12] .
Хотя эндоваскулярные операции являются самым малоинвазивным способом лечения, они сопровождаются определёнными рисками: деформацией, переломом, миграцией стентов или тромбозом стентированной артерии.
Гибридное (комбинированное) лечение проводится, если чревный ствол сужен как изнутри, так и снаружи. Оно заключается в одномоментном или поэтапном выполнении двух методов лечения: декомпрессии чревного ствола и установки стента [18] .
После эндоваскулярных и реконструктивных операций нужно наблюдаться у сосудистого хирурга и постоянно принимать препараты, разжижающие кровь. Схемы приёма зависят от проведённой операции. Эти обязательные меры помогут избежать повторного стеноза.
Прогноз. Профилактика
Компрессионный стеноз чревного ствола не угрожает жизни, но существенно сказывается не её качестве [12] . Многие пациенты жалуются на то, что им страшно есть и сложно работать из-за боли или общего недомогания.
При эффективном консервативном лечении стеноза прогноз благоприятный: пациент может спокойно работать и принимать пищу. Но если заболевание переходит в стадию декомпенсации, симптомы прогрессируют, а консервативное лечение не приносит облегчения, устранить причину можно только с помощью операции. Без неё прогноз будет неблагоприятным. Поэтому пациентам рекомендуется как можно раньше обратиться к врачу и пройти все назначенные обследования. Это поможет вовремя выявить болезнь и определить тактику лечения.
Предупредить развитие стеноза нельзя, так как это анатомическая особенность. Чтобы снизить риск развития симптомов, рекомендуется отказаться от курения, правильно, сбалансировано питаться и физически не перегружать себя.
Читайте также:
