Ожирение как причина рака эндометрия
Добавил пользователь Alex Обновлено: 08.01.2026
Аденокарцинома матки - частота, факторы риска
В настоящее время в США рак эндометрия (РЭ) — самое распространенное злокачественное новообразование органов таза у женщин. По данным Американского онкологического общества (ACS), в 2005 г. диагностировано приблизительно 40 800 новых случаев РЭ, что поставило его на 4-е место в структуре онкологической патологии женского населения.
Рост заболеваемости стал заметным только в течение последних трех десятилетий. В 1970-е годы эксперты ACS подсчитали, что количество больных РЭ увеличилось в 1,5 раза. В конце 1980-х годов наметилась тенденция к снижению заболеваемости; на протяжении последних нескольких лет этот показатель оставался постоянным. В период увеличения количества заболевших раком эндометрия (РЭ) прогнозируемая смертность несколько снизилась, а совсем недавно снова возросла.
В 1990 г., согласно ACS, отмечено 4000 летальных исходов от рака эндометрия (РЭ), в 2005 г. — 7310 случаев. На рисунке ниже представлены наиболее часто встречающиеся злокачественные опухоли у женщин и смертность от них в 2005 г. в США. Более частое применение эстрогенов в период 1970-х и начале 1980-х годов сопровождалось заметным ростом заболеваемости раком эндометри. Однако эта взаимосвязь не выявлена в других странах.
Например, в Норвегии и Чехословакии прирост заболеваемости составлял 50—60%, несмотря на недоступность эстрогенных препаратов или их редкое назначение. Независимо от причин, вызвавших увеличение частоты рака эндометри, эта злокачественная опухоль стала существенной проблемой для здравоохранения.
Аденокарцинома эндометрия возникает в репродуктивном возрасте и в менопаузе. Медиана возраста больных с впервые выявленным РЭ составляет 61 год, большинство женщин в возрасте 50—59 лет. Приблизительно у 5% женщин аденокарциному эндометрия диагностируют в возрасте до 40 лет, а у 20—25 % — до наступления менопаузы.
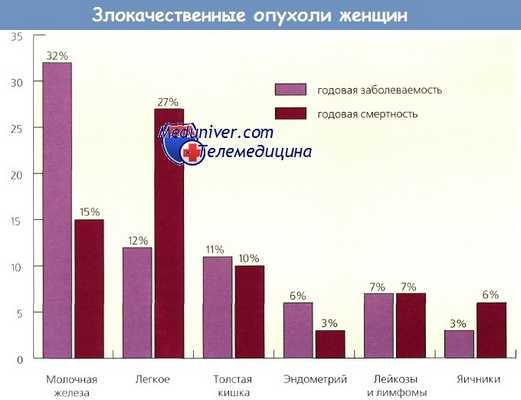
Вновь диагностированные случаи наиболее часто встречающихся злокачественных опухолей у женщин и смертность от них (в процентах) за 2005 г. в США.
Все больше данных свидетельствует о том, что применение комбинированных пероральных контрацептивов снижает риск РЭ. Центры по контролю заболеваемости США (CDC) на основании данных 8 популяционных онкологических регистров проанализировали данные всех больных РЭ в возрасте 20—54 лет и сравнили результаты с контрольной группой пациенток, которые были отобраны методом рандомизации в тех же центрах. Сравнение первых 187 случаев РЭ с 1320 в группе контроля показало, что в определенный момент времени относительный риск РЭ у женщин, применявших пероральные контрацептивы, в 2 раза ниже по сравнению с теми, кто никогда эти препараты не получал.
Этот защитный эффект наблюдался у женщин, которые использовали контрацептивы на протяжении как минимум 12 мес, и сохранялся в течение 10 лет после окончания их приема, причем он был более выраженным у нерожавших женщин. Эти исследователи установили, что каждый год в США благодаря эффекту применявшихся ранее или применяемых в настоящее время пероральных контрацептивов предотвращается около 2000 случаев РЭ.
Обнаружено, что курение сигарет снижает риск рака эндометрия (РЭ). Lawrence и соавт. в популяционном исследовании типа «случай-контроль» женщин в возрасте 40 — 60 лет выявили значимое снижение относительного риска РЭ при активном курении (р > 0,05): он уменьшался примерно на 30% при выкуривании одной пачки сигарет в день и еще на 30% при выкуривании еще большего их количества. На эффект курения не влиял ни менструальный статус, ни экзогенное поступление эстрогенов. В зависимости от массы тела наблюдалось 4-кратное увеличение отношения шансов, обусловленное курением: наибольшее снижение риска РЭ отмечалосьу полных женщин. Сдругой стороны, у некурящих женщин с избыточной массой тела, у которых основным источником эстрогенов было периферическое превращение андрогенов в эстрогены, относительный риск РЭ возрастал в 12 раз.
Несмотря на то что курение, несомненно, снижает риск рака эндометрия (РЭ), этот его положительный эффект явно уступает существенному риску возникновения рака легких и развитию других опасных для здоровья заболеваний, которые вызывает табачный дым.
Идентифицированы множественные факторы риска рака эндометрия (РЭ); MacMahon разделяет их на три категории:
- варианты анатомического развития или физиологического функционирования;
- явная патология или болезнь;
- воздействие внешних канцерогенных факторов. К вариантам анатомического развития или физиологического функционирования, часто сопровождающим РЭ, относятся ожирение, отсутствие родов в анамнезе и поздняя менопауза. Оценка этих трех факторов в отношении возможного риска РЭ представлена в таблице. Так, например, если у пациентки нет родов в анамнезе и она страдает ожирением, а менопауза наступила в 52 года или позднее, для нее вероятно 5-кратное увеличение риска РЭ.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Роль ожирения в этиопатогенезе рака эндометрия
В обзоре литературы представлен взгляд на ожирение как на один из основных факторов риска рака эндометрия первого патогенетического варианта.
Ключевые слова: рак эндометрия, ожирение, индекс массы тела, андрогены, эстрогены, ароматазы, лептин.
Рак эндометрия (РЭ) является самой распространенной онкогинекологической патологией в экономически развитых странах и занимает 7-е место среди причин смертности от злокачественных новообразований в Западной Европе [20]. В Европейском Союзе ежегодно заболевают 81500 женщин. В Российской Федерации в 2009 году у 18523 женщин диагностирован РЭ, стандартизованная заболеваемость составляет 15,53 на 100 000 женского населения. Многие годы РЭ занимает второе место среди онкологической патологии женщин, уступая лишь раку молочной железы, и первое место среди опухолей женской половой сферы [5].
Средний возраст возникновения РЭ равен 60 годам, но 90% женщин заболевает в возрасте старше 50 лет [31]. Отмечается тенденция роста заболеваемости среди женщин репродуктивного и перименопаузального возраста: до 40% от общего числа [5].
Разные факторы риска, гистопатологические варианты и молекулярные механизмы развития опухоли приводят к двум патогенетическим вариантам РЭ. Традиционный или гормонозависимый патогенетический вариант характеризуется возникновением и развитием опухоли на фоне хронической гиперэстрогении из предшествующей гиперплазии эндометрия. Альтернативный или гормононезависимый патогенетический вариант – развитие опухолей эндометрия при отсутствии гиперплазии и хронической гиперэстрогении, по течению и прогнозу он наиболее агрессивный.
Одним из факторов риска РЭ первого патогенетического варианта считается ожирение, более 40% случаев РЭ развиваются на его фоне. Ожирение повышает риск РЭ в любом возрасте, вне зависимости от применения КОК, курения, длительности менопаузы и наличия сахарного диабета [36, 37]. Умеренно повышают риск РЭ избыточный вес в пубертатном периоде и в молодом возрасте. Но в зрелом возрасте высокий индекс массы тела (ИМТ) уже достоверно повышает риск РЭ [40].
Ожирение – хроническое заболевание, характеризующееся избыточным накоплением жира в организме, при котором ИМТ составляет 30 кг/м 2 и выше.
Ожирение рассматривается как ведущая среди потенциально устранимых причин смертности, уступая только табакокурению. К концу ХХ века по данным ВОЗ избыточную массу тела имело около 30% жителей нашей планеты, а это в абсолютных цифрах около 1,7 млрд. человек. Заболеваемость ожирением на планете за последнее десятилетие увеличилась на 75%, во всех регионах мира прогнозируется сохранение этой тенденции [33].
Несмотря на отсутствие широкомасштабных эпидемиологических исследований, в настоящее время в России не менее трети трудоспособного населения имеют избыточную массу тела, и четверть страдают ожирением. По данным эпидемиологов, у жителей мегаполисов ожирение встречается чаще, чем в сельской местности [4]. Ожирение поражает женщин на 20% чаще мужчин, и в 2 раза чаще у женщин регистрируется III степень. Пик развития ожирения приходится на возраст 45-55 лет. В 3-4 раза чаще ожирение встречается в возрасте 40-60 лет, чем в возрасте 15-20 лет [6].
К сожалению, не существует единой патогенетической классификации ожирения. Информативным показателем степени ожирения считается ИМТ, который рассчитывается делением показателя массы тела в килограммах на квадрат показателя роста в метрах. По классификации массы тела по ИМТ, утверждённой ВОЗ в 1999 г., нормальным считается ИМТ в пределах 18,5-24,9, когда риск сопутствующих заболеваний для популяции в пределах среднего. ИМТ менее 18,5 говорит о дефиците массы тела, риск, соответственно, низкий. Предожирение и повышенный риск сопутствующей патологии вероятен при ИМТ 25,0-29,9. Ожирение I степени (ИМТ 30,0-34,9) уже существенно повышает риск сопряжённой с ним патологии. При ожирении III степени (ИМТ выше 40) степень риска квалифицируется как крайне высокая.
Кроме самого факта наличия ожирения и его степени, для оценки риска ассоциированных с ожирением заболеваний существенное значение имеет характер распределения жира. Оценка типа распределения жира проводится по результатам измерения окружности талии (ОТ) и окружности бедер (ОБ), а также соотношения этих показателей (ОТБ). Выделяют андроидный и гиноидный типы ожирения.
Для андроидного (мужского, висцерального, абдоминального) типа характерно отложение жира в верхних отделах туловища, особенно в области живота. При андроидном типе ОТБ превышает 0,85 для женщин и 0,95 для мужчин.
Гиноидное (женское, ягодичное) ожирение характеризуется преимущественным отложением жира в нижних отделах туловища. При нём ОТБ распределения жира менее 0,85 для женщин и менее 0,95 для мужчин. Нарушения углеводного обмена, сердечно-сосудистые заболевания регистрируются значительно чаще при андроидном типе ожирения. Характер распределения жировой клетчатки влияет и на степень риска РЭ: при андроидном типе распределения жировой клетчатки риск развития РЭ увеличивается в 6 раз. Риск РЭ даже при нормальном весе в 3,2 раза выше при андроидном типе [17].
У женщин старшего возраста избыточная прибавка в весе ассоциирована с отсутствием или малым числом родов, ранним возрастом первых родов, патологической прибавкой веса во время беременности и коротким периодом грудного вскармливания [23].
Обращает на себя внимание совпадение возрастных пиков заболеваемости ожирением и РЭ, оба развиваются чаще всего в пре- и постменопаузе. По мнению ряда авторов для развития РЭ возможно большее значение имеет абсолютная масса жировой ткани, нежели относительный вес женщины [1, 8, 12].
Ожирение – результат дисбаланса между получаемой и потребляемой энергией. Три пути расходования энергии организма: затраты на поддержание основных физиологических функций в стандартных условиях – основной обмен; специфическое динамическое действие пищи: дополнительный расход энергии на пищеварение и стимуляцию метаболизма, обусловленный притоком нового субстрата – термогенный эффект и физическая активность – наибольший расход. Нарушение баланса между интенсивностью липогенеза и липолиза с относительным преобладанием процессов липогенеза – основное звено патогенеза ожирения. Избыточная калорийность пищи с преобладанием вечернего её приема в сочетании со снижением энергозатрат при недостаточной физической активности – самая частая причина ожирения. Остальные этиологические факторы, такие как генетическая предрасположенность, церебральные и эндокринные причины, а также ятрогенное ожирение, встречаются существенно реже.
Известны такие функции жировой ткани как депонирование энергии и воды в организме; участие в процессах обмена жировых кислот и углеводов, в синтезе жира из углеводов, в регуляции фосфорно-кальциевого обмена (начальные этапы синтеза витамина D), в метаболизме половых стероидов. Сравнительно недавно установлено, что жировая ткань является так же источником синтеза ряда факторов, обладающих эндокринным, паракринным и аутокринным действиями.
Обсуждается непосредственная роль самой жировой ткани в генезе ожирения. Установлено, что преимущественно при ожирении происходит гипертрофия адипоцитов, однако при тяжелых формах заболевания наблюдается также увеличение и количества жировых клеток. Существует «критическая жировая масса», являющаяся триггером для образования новых адипоцитов, и это подтвердил эксперимент.
Роль нарушения регуляции энергетического баланса в предрасположенности к развитию ожирения, в частности дисбаланса различных пептидов (лептина, грелина и др.) и нейропептидов (нейропептида Y и др.) также обсуждается. Полипептидный гормон лептин, синтезируемый и секретируемый жировыми клетками, участвует в регуляции энергетического обмена, уменьшая аппетит и повышая расход энергии путем механизма обратной связи между его уровнем и выработкой участвующего в формировании чувства голода гипоталамического нейропептида Y [6]. Ведущая функция лептина – регуляция внутриклеточного гомеостаза жирных кислот, предотвращение развития эктопического отложения жира в тканях, в норме не депонирующих жир, в периоды переедания – липотоксикоза [41].
У подавляющего большинства тучных людей уровень лептина повышен. С увеличением тучности уровень лептина в крови возрастает и снижается при уменьшении количества жировой ткани. Однако при наступлении так называемой «точки липостаза», когда за короткий период времени человек теряет более 30 кг, лептин запускает цикл противодействия снижению веса, и аппетит растёт, а человек вновь набирает массу. Продукция лептина в подкожной жировой клетчатке выше, чем в жировых депо. Лептин циркулирует в связанном с транспортным белком виде, резистентность к нему объясняется аномалиями в структуре лептин-связывающего белка – «лептинорезистентность». Возможной причиной лептинорезистентности является аномалия рецепторов гипоталамуса. Согласно теории, выдвинутой E. Petridou [29], в секреторную фазу менструального цикла лептин ингибирует синтез прогестерона. Показано, что высокие концентрации лептина у женщин с ожирением снижают протекторное действие прогестерона на эндометрий [18]. Установлена корреляция уровня лептина и повышения риска РЭ [29]. Но не ясно, связано ли повышение риска РЭ только с высоким уровнем лептина или в совокупности с наличием ожирения.
Изучена роль серотонина в формировании пищевого поведения: повышение его уровня в гипоталамических структурах в эксперименте вызывает чувство сытости. Подобным действием обладает и дофамин – при повышении активности катехоламинов потребность в еде снижается [6]. Увеличение содержания белка грелина также усиливает чувство голода [6]. Нарушения обмена серотонина и рецепции эндорфинов влекут изменения в психоэмоциональной сфере, что напрямую отражается и на пищевом поведении. В данном контексте употребление углеводистых продуктов является своеобразным допингом, а ожирение имеет сходство с такими болезнями, как алкоголизм и наркомания.
Не вызывает сомнений наличие генетической предрасположенности к ожирению. При избытке массы тела у одного из родителей, ожирение развивается у 40% детей. Часто обсуждается вопрос о доминирующем значении семейного стереотипа питания, однако исследования с раздельно живущими однояйцовыми близнецами подтверждают именно роль наследственного фактора. Наследственный фактор в настоящее время рассматривается как полигенный – открыто множество генов, отвечающих за развитие ожирения [6]. Выявлены мутации в гене липопротеинлипазы у больных с ожирением и сахарным диабетом II типа, изучается роль рецептора, активирующего пролифератор пероксисом PPAR.
Возрастное повышение активности регуляторных центров гипоталамуса и снижение их чувствительности к стимулирующим или тормозящим влияниям с периферии, играет значимую роль в формировании ожирения. Процесс старения организма сопровождается изменением соотношения между гормонами, способствующими мобилизации жира, и гормонами, активирующими липогенез в пользу преобладания гормонов, способствующих концентрации жира в висцеральных депо [13]. Снижение скорости основного обмена в постменопаузе у женщин выражено в большей степени, чем у мужчин того же возрастного периода. В менопаузу изменяется и соотношение пептидов и нейромедиаторов, участвующих в регуляции центра голода и насыщения: уровень анорексигенных факторов (лептина, дофамина, холецистокинина) значительно ниже, чем у женщин в пременопаузе. В то же время, содержание орексигенных факторов (нейропептида Y, галанина, норадреналина) повышено [7].
Результаты ряда клинических и экспериментальных исследований демонстрируют и участие эстрогенов в регуляции пищевого поведения. Известно, что такие нарушения пищевого поведения, как булимия, анорексия и пищевые эксцессы встречаются преимущественно у женщин [16].
ОЖИРЕНИЕ В ЭТИОПАТОГЕНЕЗЕ РАКА ЭНДОМЕТРИЯ
При ожирении в жировой ткани увеличивается конверсия андрогенов в эстрогены, что повышает риск развития РЭ. Яичники пременопаузальных женщин в норме продуцируют прогестерон. В пременопаузе, особенно у тучных женщин, превалируют ановуляторные циклы, и эстрогены остаются не уравновешенными эндогенным прогестероном, что и ведёт к повышению риска РЭ [22]. В норме в постменопаузе яичники не продуцируют ни эстрогены, ни прогестерон; эстрогены образуются из андростендиола, секретируемого надпочечниками. При посредстве ароматаз происходит конверсия андростендиола в эстрон, а превращение эстрона в эстрадиол происходит в периферической жировой ткани. Поскольку яичники в постменопаузе не вырабатывают прогестерон, концентрация эстрадиола сыворотки крови очень высока. Повышение риска РЭ в постменопаузе в 5-10 раз связывают именно с отсутствием выработки овариального прогестерона [21]. У женщин нормальной массы тела только 1% андростендиона конвертируется в эстрон, в то время как при ожирении конверсия достигает уже 10% [2, 9]. Уровень эстрогенемии у постменопаузальных женщин в большей степени определяется именно массой тела, второстепенны возраст и продолжительность менопаузы [2].
Сопровождающие ожирение нарушения энергетического баланса, повышение ИМТ и снижение уровня белка, связывающего половые стероиды (БСПС), – факторы, повышающие риск развития РЭ. БСПС – гликопротеин, имеющий специфическое сродство к эстрогенам и андрогенам, к снижению уровня БСПС приводит повышение ИМТ [21]. При изменении ИМТ у женщин в пременопаузе при возрастании массы тела более чем на 30 кг, снижается уровень БСПС и соответственно повышается количество свободного эстрадиола в циркулирующей крови. Исследование N. Potischman и соавт. [30] подтверждает ассоциацию ожирения с повышением уровня сывороточного эстрадиола как следствия снижения концентрации БСПС, связывающего эстрогены.
Таким образом, ожирение способствует развитию гиперпластических и неопластических процессов в эндометрии. При этом роль ожирения рассматривается в нескольких ракурсах: как источник эндогенного образования эстрогенов из андрогенов и как комплекс метаболических сдвигов, потенцирующих вероятность развития опухолей [5, 32]. Дисрегуляция эндогенных стероидов и факторов роста является отправной точкой для нарушения баланса между процессами клеточной пролиферации и апоптозом. Хроническое, не уравновешенное эндогенным прогестероном или его синтетическими аналогами, воздействие эстрогенов на эндометрий приводит к повышению митотической активности клеток эндометрия и, в свою очередь, повышению репликации ДНК и накоплению соматических мутаций с формированием гиперплазии и малигнантного фенотипа [10].
Атипическая гиперплазия эндометрия может расцениваться как облигатный предрак только в сочетании с комплексом обменно-эндокринных нарушений [5, 35]. Группа исследователей, изучавших инциденты РЭ агрессивного клинического течения, пришла к выводу, что риск РЭ высокой степени агрессии достоверно выше у женщин с ожирением, родивших менее двух детей, принимающих более 8 лет ЗГТ эстрогенными препаратами, с сопутствующим сахарным диабетом [38]. При сочетании ожирения и сахарного диабета, троекратно увеличивается риск РЭ по сравнению с не страдающими диабетом женщинами [7]. Сахарный диабет повышает риск РЭ только у женщин с ожирением [11]. Установлено, что ожирение способствует манифестации генетически детерминированной гиперинсулинемической инсулин-резистентности [9]. E. Weiderpass и соавт. показали, что только у тучных женщин артериальная гипертония является фактором риска РЭ [37].
ПРОФИЛАКТИКА ОЖИРЕНИЯ КАК ПРОФИЛАКТИКА РАКА ЭНДОМЕТРИЯ
Несомненна роль санитарно-просветительной работы и превентивных мероприятий среди находящихся в группе риска по развитию ожирения детей и взрослых в профилактике ожирения. Развитию и закреплению устойчивой мотивации к предупреждению и лечению избыточного веса не только с эстетической целью, но и с целью профилактики опасного для жизни заболевания будет способствовать внедрение в массы знаний об ожирении как об одном из основных факторов риска развития РЭ.
Учитывая тот факт, что в основе ожирения всегда лежит дисбаланс между количеством потребляемой с пищей энергии и энергозатратами организма, основной целью коррекции питания является создание энергетического дефицита. Исследование A.J. Littman и соавт. [25] подтверждают достоверное снижение риска РЭ у женщин, придерживающихся низкокалорийной диеты с высоким содержанием овощей и фруктов. При возрастании физической активности уменьшается количество висцерального жира и предотвращается снижение мышечной массы при похудании [34]. Расходование энергии важно для поддержания оптимального веса.
«Проект здорового образа жизни» изучал возможности профилактики прибавки веса у 535 здоровых пременопаузальных женщин среднего возраста 47 лет, с ИМТ от 20 до 34 [24]. В основной группе из 275 человек проводилась коррекция образа жизни: снижение общей калорийности пищи, ограничение употребления жиров до 25% суточного рациона, повышение физической активности. 260 женщин контрольной группы не получали подобных рекомендаций. К концу периода наблюдения в 54 недели 35% женщин находились в постменопаузе. Уменьшение употребления жиров, особенно насыщенных, и холестерина с пищей у женщин в пременопаузе способствует статически значимому снижению массы тела, индекса ОТ/ОБ, а также темпов прироста триглицеридов, глюкозы и инсулина. Отмечена также корреляция снижения массы тела с повышением физической активности.
Анализ 13-ти исследований показал достоверную редукцию риска РЭ (на 30-40%) среди физически активных женщин [15]. C.E. Matthews с соавторами показали, что риск РЭ снижается и при интенсивных занятиях спортом (упражнения на тренажерах, бег и т.п.), и при умеренных физических нагрузках (пешеходные прогулки, танцы, садоводство, работа по дому) [26].
Подтверждение прямой связи ожирения с высоким риском РЭ свидетельствует о необходимости включения в государственные и международные программы профилактики РЭ положений, предупреждающих ожирение.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Ожирение как причина рака эндометрия
Внимание исследователей привлек тип ожирения у пациенток с раком эндометрия (РЭ). В работе, выполненной в Университете Южной Флориды, обнаружено, что по сравнению с женщинами группы контроля для больных РЭ характерны более высокие показатели соотношения окружностей талии и бедер, толщины кожных складок живота и бедра и толщины кожных складок подвздошной области и бедра. С увеличением этих показателей повышается относительный риск РЭ.
Преимущественное отложение жира в верхней части тела — значимый фактор риска этого заболевания. Результаты, полученные Swanson и соавт. в крупном многоцентровом исследовании типа «случай-контроль», включавшем 403 больных РЭ и 297 женщин группы контроля, подтвердили и уточнили ранее имевшиеся данные по этой проблеме. Для женщин с массой тела более 78 кг риск заболеть РЭ в 2,3 раза выше по сравнению с теми, у кого масса тела менее 58 кг. У женщин с массой тела более 96 кг относительный риск возрастал до 4,3.
Ожирение преимущественно верхней части тела (соотношение талия/рост) — фактор риска, который не зависит от массы тела. Для пациенток, относящихся к самому верхнему квартилю как по массе тела, так и по соотношению окружностей талии и бедер, риск РЭ увеличивался в 5,8 раза. Установлена обратная зависимость между ростом сидя и риском РЭ. Увеличение массы жировой ткани сопровождается снижением содержания не только циркулирующего в крови прогестерона, но и белков, связывающих половые гормоны. Это относится к сывороточному гормонсвязывающему глобулину (СГСГ), синтез которого при РЭ снижен.
Содержание СГСГ прогрессирующе уменьшается по мере увеличения жировой ткани в верхней части тела. При понижении концентрации в крови СГСГ отмечается повышение эндогенной продукции не связанного с белком эстрадиола. Поскольку развитие РЭ связано с ожирением, большое внимание уделяют особенностям пищевого рациона больных. Доказано, что у женщин-вегетарианок в постменопаузе содержание эстриола, всех эстрогенов и пролактина в крови было ниже, а уровень СГСГ — выше. Levi и соавт. в исследовании типа «случай-контроль» провели оценку пищевых факторов у 274 больных РЭ и у 572 женщин группы контроля из двух регионов Швейцарии и Северной Италии.
Они собрали подробный диетический анамнез. Полученные данные подтвердили наличие взаимосвязи между ожирением и раком эндометрия (РЭ). В отношении диеты они обнаружили выраженную связь с общим количеством получаемой с пищей энергии. После поправки па общую энергоценность диеты была выявлена зависимость риска РЭ от употребления различных видов мяса, яиц, бобовых, жировых добавок и сахара. Существенный защитный эффект обнаружен при повышенном употреблении различных видов овощей, свежих фруктов, цельнозернового хлеба и макаронных изделий, что связано с повышенным потреблением аскорбиновой кислоты и b-каротина.
Интересная диетическая особенность заключается в пользе оливкового масла в плане профилактики рака эндометрия (РЭ). Ранее было отмечено, что количество и вид пищевого жира влияют на метаболизм эстрогенов. Показано, что реабсорбция эстрогенов в кишечнике увеличивается на фоне приема пищи, богатой жирами или с большим количеством говядины.
Сахарный диабет и артериальная гипертензия часто сопровождают рак эндометрия (РЭ). По данным Kaplan и Cole, после поправки на возраст, массу тела и социально-экономическое положение относительный риск РЭ, связанный с наличием в анамнезе сахарного диабета, составляет 2,8. Повышенное АД широко распространено среди пациенток старшей возрастной группы с избыточной массой тела. Тем не менее вряд ли гипертензия сама по себе представляет существенный фактор риска, несмотря на то что нередко встречается в сочетании с ИБС — 25 % больных РЭ.
Ожирение и риск рака эндометрия: возможности для профилактики

Понимание ожирения и риска рака эндометрия: возможности для профилактики
Understanding obesity and endometrial cancer risk: opportunities for prevention.
Schmandt RE, Iglesias DA, Co NN, Lu KH
Во всем мире ожирение стало главной проблемой здравоохранения. Избыточный вес и ожирение не только увеличивают риск сердечно-сосудистых заболеваний и диабета 2 типа, но также являются известными факторами риска многих типов рака. Среди всех форм рака, увеличение индекса массы тела наиболее строго связано с повышением риска рака эндометрия и смертности. Базовые молекулярные механизмы, лежащие в основе участия жировой ткани и ожирения в патогенезе рака эндометрия, становятся все более понятными, что помогло раскрыть многие новые рациональные cтратегии ведения пациенток, поведенческие и медикаментозные мероприятия, направленные на профилактику как первичного заболевания, так и рецидива.
Злокачественные заболевания являются второй по частоте ведущей причиной смерти женщин.[1] Частота рака эндометрия составляет 24 случая на 100 000женщин, занимая 4-оеместо среди наиболее распространенных форм рака в женской популяции.[2] Если заболевание диагностируется на ранней стадии, то эта форма рака характеризуется относительно хорошим прогнозом. Рак эндометрияболее распространен у женщин в постменопаузе, но при наличии определенных факторов риска, он может быть обнаружен и у более молодых женщин.
Многие поддающиеся изменению и неподдающиеся изменению факторы риска связаны с раком. Генетические факторы могут быть унаследованы и способствовать повышению риска определенного типа рака у конкретной пациентки. Репродуктивные факторы (например, возраст менархе или менопаузы) также частично наследуются и в большей мере не могут контролироваться пациентками. Использование гормонов, факторы образа жизни и лечение проблем со здоровьем, которые влияют на риск рака или прогноз, являются поддающимися изменению факторами.[3]
Ожирение связано со множественными неблагоприятными медицинскими эффектами. Это − известный сердечно-сосудистый фактор риска, который приводит к увеличению заболеваемости диабетом, оказывает стрессорное влияние на скелетную систему и связан с увеличением риска определенных типов рака. В течение длительного времени риск рака эндометрия связывался с ожирением. Статья Schmandt и соавт. рассматривает патофизиологические механизмы, посредством которых ожирение увеличивает риск рака эндометрия и предлагает некоторые потенциальные терапевтические инструменты.
Резюме обзора
Эстрогены оказывают стимулирующий и пролиферативный эффект на слизистую оболочку матки. Во время менструального цикла прогестерон, который продуцируется после овуляции, вызывает дифференцирование и децидуализацию клеток эндометрия. В конце цикла, когда активность желтого тела снижается, следует менструация и отторжение функционального слоя эндометрия. Когда эндометрий подвергается влиянию эстрогена без противодействия прогестерона( например, отсутствие родов, ановуляторные циклы и использованием онотерапии эстрогенами), риски развития гиперплазии и рака эндометрия увеличиваются.
Ожирение − общеизвестный фактор риска рака эндометрия, что связано с неблагоприятными эндокринными и воспалительными эффектами жировой ткани. Адипоциты экспрессируют ароматазу, которая преобразовывает яичниковые андрогены в эстрогены, способствующие пролиферации ткани эндометрия. Уровни глобулина, связывающего половые гормоны ниже у женщин с ожирением и поэтому уровень свободных биологически активных фракций гормонов выше. Кроме того, у страдающих ожирением женщин повышена концентрация свободного инсулина и его активность, вследствие снижения уровня связывающего инсулин глобулина. Инсулин и инсулин-подобный фактор роста (ИПФР) также проявляет пролиферативный эффект в отношении эндометрия наряду с другими факторами роста (например, эпидермальным фактором роста). Инсулин и ИПФР стимулируют пути усиления пролиферации эндометрия, которые итак находятся в гиперактивном состоянии у женщин с повышенным риском развития рака эндометрия.
Жировая ткань секретирует воспалительные факторы, названные адипокинами. Эти факторы частично ответственны за инсулинорезистентность, которая сопровождает ожирение и поэтому играют определенную роль в усилении процесса пролиферации эндометрия. Адипонектин также производится жирной тканью и оказывает ингибирующее влияние на пути пролиферации клеток эндометрия. Уровень адипонектина обратно пропорционально коррелирует с массой жира. Повышение риска рака эндометрия у женщин с ожирением обусловлено многими причинами:преобразование андрогенов в эстрогены под влиянием ароматазы; повышение уровня свободных эстрогенов и инсулина, а также уровня ИПФР; увеличение продукции провоспалительных адипокинов; и более низкий уровень адипонектина.
Понимание важности вышеуказанных патогенетических звеньев влияния ожирения на рак эндометрия открывает новые терапевтические возможности. Известно, что прогестерон, как в составе комбинированных оральных контрацептивов, так и в виде монотерапии перорально или внутриматочно может использоваться для профилактики и лечения гиперплазии и рака эндометрия. Потеря веса с помощью диеты, физических занятий или бариатрической хирургии, а значит снижение жировой ткани, оказывает защитный эффект в отношении рака эндометрия. Использование средств, повышающих чувствительность к инсулину (например, метформина) также может быть связано со снижением риска. Лечение метформином вызывает снижение уровня инсулина и потерю веса, за счет чего, активируются пути ингибирования процессов пролиферации клеток эндометрия.Как было показано, метформин снижает активность ароматазы в адипоцитах и повышает экспрессию прогестероновых рецепторов.
Рак эндометрия наиболее распространен в пятое и шестое десятилетие жизни женщины. Помимо репродуктивных факторов, влияние эстрогена без противодействия прогестерона играет важную роль в качестве фактора риска. Ожирение, которое связано с более высокими уровнями эстрогена, является независимым поддающимся изменению (модифицируемым) фактором риска рака матки. Определенные проблемы со здоровьем (например, диабет и гипертония) также считаются факторами риска этого типа рака. Уровень этих проблем со здоровьем выше у женщин, страдающих ожирением; поэтому, избыточный вес и ожирение являются общим фактором риска для многих проблем со здоровьем.
Schmandt и соавт.рассмотрели множественные эндокринные и воспалительные пути, объясняющие связь между ожирением и ракомэндометрия. Понимание этих путей помогает в разработке методов профилактики и лечения. Самая важная возможность, которой располагают пациентки – это изменение образа жизни и как результат, потеря веса. Диетические изменения; регулярная физическая активность; или в более серьезных случаях бариатрическая хирургия могут привести к сокращению жировой массы. Потеря веса также улучшает контроль за уровнем глюкозы и приводит к более низким уровням инсулина. Результирующий эффект − снижение риска ракаэндометрия, диабета и сердечно-сосудистых заболеваний.
Измерение уровня адипокино вможно использоваться для оценки индивидуального риска и ответа на терапию. Прогестерон может быть назначен в виде различных препаратов и путей введения и считается первой линией профилактики и терапии. Лекарства, которые благоприятно влияют на уровни адипокина и инсулина также могут применяться в качестве терапевтических инструментов. Метформин известен своими многочисленными благоприятными воздействиями. Механизмы, с помощью которых метформин может предотвратить развитие рака эндометрия давно и хорошо описаны, но результаты будущих клинических исследований должны подтвердить наличие такого эффекта.
Следование рекомендациям по изменению образа жизни связано с бесчисленными выгодами для здоровья.Вместо того, чтобы ждать, когда появятся проблемы со здоровьем, пациентам с избыточным весом и ожирением нужно предоставить необходимую информацию, что могло побудить их внести изменения в повседневный образ жизни. Безусловно, это часто связано с определенные трудностями и является своеобразным вызовом для большинства пациентов, но результаты стоят того.
Рак эндометрия (рак тела матки) - симптомы и лечение
Что такое рак эндометрия (рак тела матки)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ильина Антона Алексеевича, онколога-гинеколога со стажем в 13 лет.
Над статьей доктора Ильина Антона Алексеевича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Рак эндометрия (endometrial cancer) — это злокачественная опухоль, которая развивается из клеток внутреннего слоя матки. Основным симптомом, который появляется уже на начальной стадии болезни, являются кровянистые выделения из половых путей.
Рак эндометрия ещё называют раком тела матки и аденокарциномой эндометрия.
Распространённость
Рак эндометрия — это самая частая злокачественная опухоль женских половых органов. Но если болезнь выявлена своевременно и проведено адекватное лечение, большинство пациенток выздоравливает [1] .
В основном раком эндометрия заболевают женщины в постменопаузе: более 90 % случаев диагностируются после 50 лет. Чаще всего болезнь встречается среди пациенток в возрасте 65–69 лет — заболеваемость среди них составляет 98,1 на 100 тыс. женщин. Средний возраст на момент начала болезни — 63 года. До 49 лет рак эндометрия встречается относительно редко: в 4–5 % от всех случаев [11] .
Факторы риска
Около 5 % случаев рака эндометрия имеют наследственный характер. Злокачественная опухоль эндометрия может развиться при наследственном неполипозном колоректальном раке (синдроме Линча) [12] . Болезнь возникает из-за поломки генов MLH1, MSH2, MSH6 или PMS2. При таких мутациях риск развития рака эндометрия и колоректального рака составляет 24–51 %, рака яичников — 11–15 % [13] .
Помимо генетической предрасположенности, на заболеваемость влияют следующие факторы:
- лишний вес (риск развития рака эндометрия повышается в 1,32 раза); (в 2,54 раза); (в 2,1 раза);
- раннее начало и позднее прекращение менструаций: до 10–12 и после 55 лет (в 2,1 раза); (в 2,9 раза);
- приём Тамоксифена — гормонального препарата для лечения рака молочной железы (в 2,5 раза);
- монотерапия эстрогенами более пяти лет (в 10–30 раз); ;
- лучевая терапия на органы малого таза.
Ожирение является одним из основных факторов риска. Жировая ткань преобразует в эстрогены другие гормоны — андрогены. Если уровень эстрогенов значительно повышен, то риск развития опухолей эндометрия также увеличивается. Получается, чем больше жировой ткани, тем выше вероятность заболеть раком эндометрия.
Тамоксифен — это препарат, который используется при лечении рака груди. В ткани молочной железы он действует как антиэстроген, но в матке механизм действия иной, аналогичный гормону эстрогену. При лечении Тамоксифеном рекомендуется ежегодно наблюдаться у гинеколога.
При синдроме поликистозных яичников значительно повышается уровень андрогенов и эстрогена, а также снижается уровень прогестерона. Изменение соотношения эстрогена и прогестерона является одной из основных причин развития рака эндометрия.
Предшествующая лучевая терапия. Радиация используется для лечения некоторых типов опухолей. При облучении сложно, а иногда невозможно не затронуть смежные органы. Радиация повреждает ДНК здоровых тканей и может приводить к развитию рака в прежде здоровых органах.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рака эндометрия
Эффективных программ скрининга рака эндометрия пока не существует. Единственный способ обнаружить заболевание на ранней стадии — это ежегодно посещать гинеколога. Также к доктору нужно обратиться, если болит низ живота или появились кровянистые выделения из половых путей между менструациями или в постменопаузе. Кровянистые выделения при раке эндометрия встречаются у 90 % пациенток. Чаще всего выделения слабые или умеренные, их характер зависит от распространения опухоли.
Признаком злокачественной опухоли также может быть изменение характера выделений, даже без примеси крови [2] . Боль, потеря веса и тяжесть в животе появляются уже на поздних стадиях болезни.
Патогенез рака эндометрия
Матка состоит из двух частей: тела и шейки. В теле матки выделяют три слоя:
- наружный — серозная оболочка;
- средний — миометрий, или мышечный слой;
- внутренний — эндометрий, который частично отторгается вместе с кровью при каждой менструации.
Аденокарцинома развивается непосредственно из эндометрия.
В 1963 году была предложена и обоснована теория о двух основных типах аденокарциномы матки. Первый вариант наблюдается у 60–70 % пациенток и протекает с нарушениями углеводного и жирового обмена на фоне избыточного количества эстрогенов [14] [15] . Женщины с этим типом рака страдают маточными кровотечениями, бесплодием, ожирением и сахарным диабетом. У них поздно наступает менопауза и развиваются гиперпластические процессы в эндометрии (качественно-количественное изменение его клеток).
Второй патогенетический вариант болезни встречается у 30–40 % пациенток. У них описанные выше нарушения выражены слабо или отсутствуют [14] [15] . Изменения в эндометрии носят атрофичный характер, развиваются полипы, атипическая гиперплазия и рак.
Отнести заболевание к первому типу можно в следующих случаях:
- присутствует более половины перечисленных признаков;
- симптомы гиперэстрогении (болезненные менструации и маточные кровотечения вне их) сочетаются с обменными нарушениями, например с ожирением и сахарным диабетом.
Согласно другому разделению, к первому типу рака эндометрия относят эндометриоидный рак, ко второму — неэндометриоидный (серозный или светлоклеточный). Они встречаются в 80–90 % и 10–20 % случаев соответственно [3] . Такое разделение связано с различиями в молекулярном профиле опухолей, методах лечения и прогнозе.
Чаще всего раковые опухоли образуются из-за повреждения гена-супрессора PTEN, который подавляет развитие и рост раковых клеток. Данная аномалия встречается у 83 % пациенток с раком эндометрия [4] .
Болезнь также может развиваться при поломке в системе репарации (т. е. исправления) ошибок спаривания нуклеотидов. Эта система отвечает за важный этап нормального деления здоровых клеток. Рак эндометрия первого типа, как правило, связан с мутациями в генах KRAS и CTNNB. Второй тип часто протекает на фоне хромосомной нестабильности, генетических расстройств и мутации в гене р53.
Классификация и стадии развития рака эндометрия
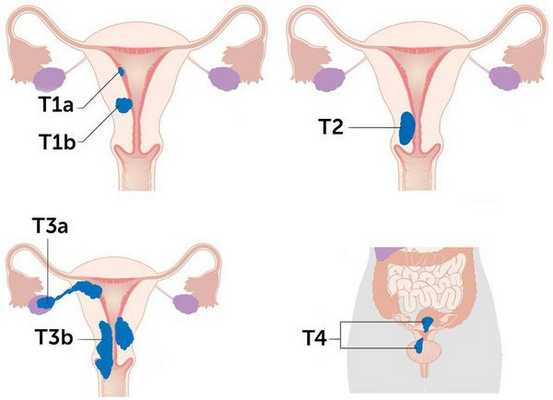
В онкологии существуют две системы TNM, т. е. стадирования рака — FIGO (International Federation of Gynecology and Obstetrics) и AJCC (American Joint Committee on Cancer). Обе системы используют следующие ключевые параметры для описания рака и установки стадии:
- размер опухоли (Tumor);
- наличие или отсутствие опухоли в лимфатических узлах (Node);
- наличие или отсутствие метастазов опухоли (Metastasis) [5] .
Исходя из этих признаков, выделяют четыре основные стадии. Чем меньше стадия, тем лучше прогноз. Рак обычно стадируется дважды. Первый раз — до лечения, такое стадирование называется клиническим. Второй раз — после операции, такое стадирование называется патологоанатомическим и считается более точным и окончательным. Со временем опухоль может расти или распространяться на органы, в которых её раньше не было, а также повторно развиваться после полного излечения. В этом случае стадия, установленная однажды, меняться не будет.
Стадии рака эндометрия по системе TNM
Более схематично стадии рака эндометрия отражены на рисунке:
Согласно международной гистологической классификации рака тела матки, выделяют несколько видов опухолей:
- Злокачественные эпителиальные опухоли. В эту группу входят различные виды рака, среди которых эндометриальная аденокарцинома, серозный и светлоклеточный рак.
- Злокачественные смешанные эпителиальные и мезенхимальные опухоли — аденосаркома и карциносаркома.
- Мезенхимальные опухоли — леймиосаркома, эпителиоидная и миксоидная леймиосаркома, эндометриальная стромальная саркома низкой и высокой степени злокачественности.
Лучший прогноз имеет эндометриоидная форма, худший — серозная и светлоклеточная, но основным прогностическим критерием является стадия заболевания. Например, выживаемость с IV стадией эндометриоидного рака ниже, чем с I стадией светлоклеточного.
Рак тела матки также классифицируется на основании вида клеток, из которых он развился. Чтобы установить разновидность рака и его дифференцировку, исследуются удалённые органы или их части. Тип опухоли устанавливает эксперт-патолог, работающий с тканями под микроскопом.
Дифференцировка — это схожесть раковой клетки со здоровой. Она отражает, насколько быстро опухоль может расти и распространяться. Описаны три степени дифференцировки: G1, G2, G3, где G3 — самая неблагоприятная с быстрым ростом опухоли. Сейчас чаще выделяют только два класса: низкой злокачественности (low grade) и высокой (high grade). Low grade включает G1 и G2, a high grade — G3.
Осложнения рака эндометрия
Без специализированного лечения рак эндометрия неизбежно прогрессирует: боль и кровотечение из половых путей усиливаются, мочевой пузырь и прямая кишка сдавливаются, их функции нарушаются. У пациенток учащается мочеиспускание и стул либо, наоборот, возникают запоры.
Если опухоль проросла в мочевой пузырь и кишку, в моче и кале может появиться кровь. Очаги опухоли могут также образоваться в других органах и тканях: печени, лёгких и брюшной полости. При метастазах в лёгких появляется кашель, боль в грудной клетке и одышка; метастазы в печени проявляются болью в правом подреберье [6] .
Диагностика рака эндометрия
В отличие от рака шейки матки для рака эндометрия не существует программ скрининга. Диагноз устанавливается после комплексного обследования, которое включает:
- осмотр на гинекологическом кресле;
- подтверждение наличия опухолевых клеток;
- магнитно-резонансную томографию (МРТ) с контрастированием;
- ультразвуковое исследование (УЗИ);
- компьютерную томографию (КТ).
Осмотр на гинекологическом кресле позволяет оценить, где расположена и насколько распространилась опухоль, а также выявить, поражены ли смежные органы малого таза.
Подтверждение наличия опухолевых клеток, или верификация, — это необходимый компонент обследования. Получить клетки можно двумя способами:
- Пайпель-биопсия — процедура, при которой эндометрий забирается из полости матки с помощью тонкого зонда. Не требует общего наркоза и специальных условий.
- Гистерорезектоскопия — операция, при которой перед забором эндометрия врач может осмотреть полость матки. Гистероскопия предпочтительна при безоперационном лечении, проводится под наркозом и редко занимает более 15 минут. Точность гистероскопии выше, чем пайпель-биопсии, и составляет около 72 % [7] .
Ультразвуковое исследование может быть выполнено через брюшную стенку и интравагинально, т. е. через влагалище. Интравагинальное УЗИ позволяет лучше оценить состояние эндометрия, аномальное утолщение которого может косвенно указывать на онкологическое заболевание. Данная процедура является относительно простой и не требует специальной подготовки, поэтому часто назначается пациенткам на первом этапе диагностики. Правильно интерпретировать результаты УЗИ может только врач-онкогинеколог.
Магнитно-резонансная томография с контрастированием является более точным методом диагностики по сравнению с УЗИ. МРТ назначается при планировании лечения и позволяет определиться с объёмом операции.
Компьютерную томографию (КТ) с контрастированием применяют, чтобы определить, есть ли метастазы в органах грудной клетки и брюшной полости.
Специфических онкомаркеров для диагностики рака эндометрия не существует. Один из немногих маркеров с относительной чувствительностью — Са-125, но такой анализ не входит в стандартное обследование. Этот онкомаркер выявляется при лимфоме, раке яичников, поджелудочной и молочной железы. Также его уровень может повышаться при беременности, различных воспалительных заболеваниях или доброкачественных образованиях, например кистах яичников и миоме матки.
Лечение рака эндометрия
Основной метод лечения рака эндометрия — это операция, при которой удаляются тело и шейка матки с придатками.
Операция может проводиться через три вида доступа:
- лапаротомный (разрез передней брюшной стенки);
- лапароскопический (через проколы 5–10 мм);
- влагалищный.
Чаще всего применяется лапароскопия, так как после неё пациентки быстрее всего восстанавливаются.
Необходимость лимфодиссекции (удаления лимфатических узлов) зависит от наличия факторов риска метастазирования опухоли, результатов морфологического заключения и данных инструментальной диагностики. При удалении лимфатических узлов важно оценить, есть ли в них опухолевые клетки, что имеет решающее значение при планировании лечения после операции.
Чем больше объём операции, тем выше риски послеоперационных осложнений. При удалении лимфоузлов примерно в половине случаев образуются лимфокисты — отграниченные скопления лимфатической жидкости в малом тазу [8] . Чтобы минимизировать риски их развития и избежать лимфодиссекции, в некоторых клиниках используется технология определения сигнальных лимфоузлов (СЛУ). Во время процедуры в шейку матки вводится краситель, который по лимфатическим сосудам попадает в лимфоузлы. Затем хирург находит лимфоузлы, в которых накопился краситель, и удаляет узел, расположенный ближе всего к матке. Далее, непосредственно во время операции, проводится гистологическое исследование, позволяющее подтвердить или исключить наличие метастазов в СЛУ и избежать их полного удаления.
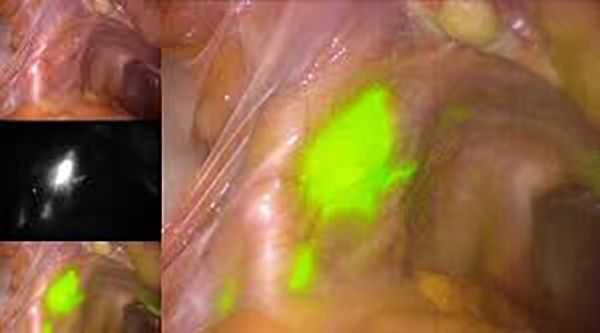
Если женщина планирует беременность, то в некоторых случаях допустимо безоперационное лечение. Оно возможно при эндометриоидном типе рака, стадии IA и высокой дифференцировке. Лечение проводится гормональными препаратами, которые блокируют работу яичников и оказывают терапевтический эффект на опухоль. Применяются два основных препарата: Мегестрола ацетат и Медроксипрогестерон.
Продолжительность гормонального лечения, как правило, составляет 6–12 месяцев. Затем при хорошем эффекте врач может разрешить беременность. После родов зачастую рекомендуется удалить матку, так как опухоль часто развивается повторно.
Лучевая терапия или химиотерапия на первом этапе менее эффективны, чем хирургическое лечение. Они назначаются, если нельзя провести операцию, например при тяжёлых хронических заболеваниях, распространённости опухоли и лечении рецидивов.
Чтобы предотвратить повторное появление опухоли, после операции могут проводиться дистанционное облучение малого таза и брахитерапия (контактная лучевая терапия, при которой источник излучения вводится внутрь поражённого органа).
Метод подбирается врачом в зависимости от типа и стадии рака, состояния лимфатических узлов. Например, при неэндометриоидном раке после операции назначается химиотерапия в сочетании с брахитерапией, а при эндометриальном раке I стадии может быть достаточно брахитерапии или наблюдения.
Прогноз. Профилактика
Без лечения рак эндометрия неизбежно прогрессирует и со временем приводит к гибели пациентки.
Для оценки прогнозов в онкологии используется термин «пятилетняя выживаемость», который сравнивает пациентов с конкретной стадией болезни с людьми из общей популяции. Например, если пятилетняя выживаемость при первой стадии болезни достигает 95 %, то такие пациенты по сравнению со здоровыми людьми с вероятностью 95 % проживут пять лет.
При своевременном выявлении и лечении рак эндометрия имеет самые благоприятные прогнозы среди всех злокачественных опухолей женских половых органов:
- для I стадии пятилетняя выживаемость составляет 85–95 %;
- для II — 65–70 %;
- для III — 29 % [9] .
Стадия болезни является самым значимым фактором при определении прогноза, но далеко не единственным. Онкологи оценивают гистологический тип опухоли, её дифференцировку, размеры, расположение в матке, прорастание или метастазирование в другие органы и лимфатические узлы. Точный прогноз врач сможет дать только после всестороннего анализа этих параметров.
Читайте также:
