Печень при застойной сердечной недостаточности - диагностика
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Сердечная недостаточность (СН) представляетсобой конечную стадию всех болезней сердцаи характеризуется системными гемодинамическими изменениями, отрицательно влияющимина состояние всех органов и систем, в томчисле печени. Крупные рандомизированныеклинические исследования, в которые включали преимущественно пациентов с хроническойСН со сниженной фракцией выброса (ФВ)левого желудочка, продемонстрировали высокую частоту изменений печеночных показателей и их неблагоприятное влияние нажизненный прогноз. Особый интерес представляют пациенты с СН и сохраненной фракциейвыброса левого желудочка, имеющие такиесопутствующие заболевания, как ожирение,сахарный диабет и артериальная гипертония.Эти же заболевания часто наблюдаются упациентов с неалкогольной жировой болезньюпечени (НАЖБП). У пациентов с ожирением,сахарным диабетом и артериальной гипертонией наличие НАЖБП ассоциируется с субклинической СН. Методы диагностикикардиогенного поражения печени, в том числефиброза, не разработаны. Наиболее изученанепрямая эластометрия. В многочисленныхисследованиях выявлена достоверная корреляция между плотностью печени и лабораторными параметрами ее поражения у пациентов сдекомпенсацией СН, а сама плотность печенирассматривается в качестве предиктора неблагоприятных исходов. В то же время не определены пороговые значения плотности печени упациентов с хронической СН, что ограничиваетприменение непрямой эластометрии для оценки истинного фиброза печени при этом состоянии. На сегодняшний момент интерпретацияизменений активности печеночных ферментовпри хронической СН остается неоднозначной,отсутствуют номенклатура и четкая классификация поражения печени при СН. Роль НАЖБПу пациентов с клинически явной ХСН изученаплохо.
Сердечная недостаточность (СН) представляет собой конечную стадию всех болезней сердца и одну из главных причин заболеваемости и смертности населения во всем мире. Несмотря на достигнутый прогресс в разработке фармакологических и электрофизиологических методов лечения пациентов с данной патологией, декомпенсация СН остается ведущей при чиной госпитализации, что определяет необходимость выявления предикторов неблагоприятного исхода и их коррекции.
СН характеризуется системными гемодинамическими и нейрогуморальными изменениями и отрицательно влияет на работу всех органов и систем, в том числе печени. Взаимосвязи сердца и печени объединяют в себе множество состояний – острую или хроническую дисфункцию печени при острой или хронической СН (ХСН), острое и хроническое поражение сердца у пациентов с поражением печени, а также одновременное вовлечение сердца и печени при системных заболеваниях 1. Кроме того, пациенты с СН представляют собой неоднородную когорту со множественными сопутствующими некардиальными заболеваниями. Около 40% пожилых пациентов с СН имеют 5 и более других состояний, которые могут затруднять диагностику СН, осложнять ее клиническое течение и ограничивать подходы к лечению. Доказано, что наличие сопутствующих некардиальных состояний ухудшает прогноз пациентов с СН 5.
Считается, что при ХСН нарушение перфузии тканей в результате снижения сердечного выброса вызывает гепатоцеллюлярный некроз ("ишемический гепатит"), сопровождающийся повышением, главным образом, активности аминотрансфераз [8], а застой крови в печени из-за повышенного центрального венозного давления вызывает нарастание содержания как прямого, так и непрямого билирубина в сыворотке ("застойная гепатопатия"). Фиброз ("кардиальный цирроз") формируется в результате длительных гемодинамических нарушений, приводящих к нарушению функции печени с нарушением коагуляции и снижением синтеза альбумина [9]. Как правило, нарушение функции печени при ХСН протекает бессимптомно и выявляется лишь при лабораторном исследовании, при этом степень повышения печеночных маркеров невысокая.
В зависимости от лабораторных изменений выделяют 4 типа печеночно-сердечных взаимодействий: (1) гепатоцеллюлярный тип, характеризующийся синдромом цитолиза (повышением активности аминотрансфераз), (2) холестатический тип (повышение активности g-глутамилтранспептидазы [ГГТ] и щелочной фосфатазы [ЩФ]), (3) повышение уровня общего билирубина, (4) смешанный тип 13. У пациентов с длительным анамнезом СН может наблюдаться снижение синтетической функции печени – гипоальбуминемия, гипопротромбинемия, снижение активности холинэстеразы (ХЭ).
| Автор, год | Название исследование, ФВ | n | Частота отклонения от нормы, % | ||||
|---|---|---|---|---|---|---|---|
| АСТ | АЛТ | ЩФ | ОБ | Альбумин | |||
| Примечание: ФВ – фракция выброса левого желудочка, ОБ – общий билирубин, нд – нет данных. * показано прогностическое значение | |||||||
| Nikolaou M, 2013 [15] | SURVIVE, | 1134 | 26* | 26* | 11* | нд | нд |
| Biegus J, 2016 [16] | PROTECT, | 2033 | 20* | 12* | нд | нд | 40* |
| Allen LA, 2009 [17] | CHARM, 36% [26–50] | 2679 | 4,1 | 3,1 | 14,0 | 13,0* | 18,3 |
| Ambrosy A, 2012 [4] | EVEREST, ФВ ≤40% | 2061 | 21 | 21 | 23 | 26* | 17* |
| Samsky M, 2015 [18] | ASCEND-HF, ФВ | 4228 | 30 | 22 | нд | 42* | нд |
Печеночно-сердечные взаимосвязи изучались при ретроспективном анализе крупных рандомизированных клинических исследований, в которые включали пациентов с декомпенсаций ХСН (табл. 1). Большинство работ продемонстрировали сходную распространенность изменений печеночных показателей и умеренное их повышение (не более трех раз по сравнению с верхней границей нормы). Однако изменение печеночных показателей ассоциировалось с неблагоприятным прогнозом для жизни. В исследовании SURVIVE у пациентов с повышенной активностью АЛТ и/или АСТ смертность в течение 31 и 180 дней была достоверно выше, чем у больных с нормальной активностью аминотрансфераз, в то время как высокая активность ЩФ ассоциировалась с увеличением смертности в течение 180 дней [15]. В исследовании PROTECT повышение активности аминотрансфераз и гипоальбуминемия при поступлении в стационар были связаны с более высоким риском как госпитальной смерти, так и смерти от всех причин в течение 180 дней [16]. В программе CHARM повышенный уровень общего билирубина был самым сильным независимым предиктором смерти от сердечно-сосудистых заболеваний и госпитализации по поводу декомпенсации ХСН. [17]. Неблагоприятное прогностическое значение уровней общего билирубина и альбумина было продемонстрировано в исследовании EVEREST, в котором оба показателя были достоверно связаны с риском достижения первичных конечных точек [4]. В исследовании ASCEND-HF гипербилирубинемия была связана с 30-дневной смертностью и частотой повторной госпитализации [18]. В отдельных работах не было выявлено достоверных корреляций между повышением печеночных маркеров и ФВ, а также значимых взаимосвязей между печеночными показателями и конечными точками в зависимости от ФВ [17,18].
ГГТ является одним из признаков холестаза и считается маркером злоупотребления алкоголем и заболеваний желчевыводящих путей. Эти состояния, как правило, были критериями исключения пациентов с ХСН из крупных исследований. Тем не менее, в исследовании EVEREST более чем у половины пациентов с ХСН наблюдалось повышение активности ГГТ в сыворотке крови [4]. G. Poelzl и соавт. продемонстрировали высокую частоту повышения активности ГГТ у пациентов с ХСН – 42,9% у мужчин (>65 Ед/л) и 50,2% у женщин (>38 Ед/л). Активность ГГТ ассоциировалась с тяжестью заболевания и была прогностическим фактором, не зависившим от возраста, индекса массы тела, ишемической этиологии, тяжести ХСН по NYHA и содержания NT-proBNP [19]. М. Ess и соавт. при обследовании 1087 амбулаторных пациентов со стабильной ХСН выявили увеличение активности ГГТ у 43% мужчин и 48% женщин. Активность ГГТ была независимым фактором, ассоциировавшимся с неблагоприятными исходами у этих пациентов [20].
Интересные результаты были получены в исследовании, в которое были включены 274 пациента с ХСН с сохраненной фракцией выброса левого желудочка (возраст 71,3±8,4 лет, 69,3% женщин). Средняя длительность наблюдения составила 21,5±18,6 мес. Комбинированная конечная точка, включавшая в себя госпитализацию по поводу СН и/или смерть от любой причины, была достигнута у 97 (35,4%) больных. У этих пациентов активность ГГТ была достоверно выше, чем у остальных больных (р<0,001), в то время как уровни других показателей холестаза, в том числе ЩФ и общего билирубина, не отличались между двумя группами (p=0,126 и p=0,774, соответственно). У пациентов с активностью ГГТ в сыворотке более 36 Ед/л число неблагоприятных событий значительно превышало таковое у больных с более низкой активностью фермента (p=0,012). Полученные данные показали, что активность ГГТ может служить независимым предиктором клинического исхода при ХСН с сохраненной фракцией выброса левого желудочка [21].
В российском ретроспективном исследовании повышение по крайней мере одного маркера повреждения печени было выявлено у 85,1% из 322 пациентов, госпитализированных с декомпенсацией СН, в том числе повышение активности аминотрансфераз у 21,1%, содержания билирубина у 82,0%, активности ЩФ у 27,2% и ГГТ у 37,2% [22,23]. Высокая частота изменений печеночных показателей могла быть связана с тяжелым течением СН (у половины пациентов IV ФК), выраженными симптомами застоя крови и низким значением средней фракции выброса левого желудочка.
В настоящее время особый интерес вызывают пациенты с ХСН и сохраненной фракцией выброса левого желудочка, страдающими такими сопутствующими заболеваниями, как ожирение, сахарный диабет и артериальная гипертония. Эти же заболевания часто наблюдаются у пациентов с неалкогольной жировой болезнью печени (НАЖБП). Предполагается, что СН и НАЖБП имеют одни и те же факторы риска, сходный патофизиологический процесс (например, фиброз органов, системное воспаление низкой активности) и могут иметь некоторые потенциальные корреляции. У пациентов с ожирением, сахарным диабетом и артериальной гипертонией наличие НАЖБП ассоциируется с различной степенью субклинической СН 26. Кроме того, при НАЖБП могут поражаться сердечные клапаны за счет тесной связи этого заболевания с повышенным риском распространенного атеросклероза [29]. Хотя некоторые исследования были небольшими (менее 100 пациентов), их результаты оставались достоверными после внесения поправки на кардиометаболические факторы риска. Следует отметить, что в большинстве исследований диагноз НАЖБП устанавливали с помощью различных визуализирующих методов, в том числе ультразвукового исследования, компьютерной или магнитно-резонансной томографии, и не подтверждали при биопсии печени.
Взаимосвязь НАЖБП и клинически явной ХСН в настоящее время изучена недостаточно. Мы наши только одно исследование, в котором оценивали значение НАЖБП при декомпенсации ХСН с низкой фракцией выброса левого желудочка у 102 пациентов (71 мужчина) в возрасте в среднем 53,99±16,97 лет. Стеатоз печени диагностировали с помощью ультразвукового исследования. НАЖБП была выявлена у 37 (36,3%) пациентов, т.е. чаще, чем в общей популяции [30]. Средняя фракция выброса левого желудочка была сопоставимой у пациентов с НАЖБП и без НАЖБП (24,11±8,54% и 25,05±10,58%, соответственно). Больные с НАЖБП были достоверно моложе, имели более высокие индекс массы тела и индекс массы миокарда левого желудочка. Комбинированную конечную точку, включавшую в себя повторную госпитализацию по поводу СН, смерть от сердечно-сосудистых заболеваний, трансплантацию сердца и сердечную ресинхронизирующую терапию, оценивали через 1, 3, 6 и 12 мес после первичной госпитализации. Частота ее достоверно не отличалась между двумя группами. Обращает на себя внимание, что среди маркеров повреждения печени изучалась только активность АСТ и АЛТ. Ни у одного пациента не было выявлено синдрома цитолиза, а по средней активности аминотрансфераз исследуемые группы не отличались [31].
В конечном итоге у пациентов с ХСН развивается фиброз печени со снижением ее синтетической функции, проявляющимся гипоальбуминемией и повышением международного нормализованного отношения (МНО). Однако содержание альбумина и МНО могут меняться вследствие гемодилюции, застойной энтероколонопатии и применения антикоагулянтов. Измене ния лабораторных маркеров поражения печени на поздних стадиях СН неспецифичны для фиброза печени, и, наоборот, нормальные лабораторные показатели функции печени могут наблюдаться при наличии тяжелого фиброза 32.
Диагностика фиброза печени у пациентов с декомпенсацией ХСН представляет сложную задачу. Визуализирующие методы (компьютерная томография, ультразвуковое исследование) имеют низкую чувствительность (30%) и прогностическую ценность (21%) по сравнению с биопсией печени [35]. Однако последняя имеет ограниченное применение в обычной клинической практике в связи с инвазивностью (риск инфекции, кровотечения, пневмоторакса, гемоторакса или повреждения соседних органов) и высокой стоимостью [36]. Среди неинвазивных методов диагностики фиброза печени наибольшую распространенность получила непрямая эластометрия печени, хотя результаты этого исследования в большей степени отражают изменения плотности/жесткости печени, обусловленные гиперволемией при ХСН. Кроме того, в настоящее время нет рекомендованных пороговых уровней плотности печени у таких пациентов, что ограничивает применение непрямой эластометрии для оценки истинного фиброза печени при ХСН.
Тем не менее, в многочисленных исследованиях были выявлены достоверные корреляции между плотностью печени и лабораторными параметрами поражения печени у пациентов с декомпенсацией СН 40. Плотность печени, оцененная с помощью непрямой эластометрии, рассматривается в качестве предиктора неблагоприятных исходов у пациентов с СН [41]. В данной работе была установлена большая вероятностьповторных госпитализаций и наступления комбинированной конечной точки при плотности печени ≥11,1 кПа при поступлении и ≥8,2 кПа при выписке (рис. 1). Кроме того, плотность печени может быть маркером остаточного застоя крови даже у пациентов, получающих оптимизированной терапию, у которых отсутствуют явные признаки перегрузки объемом или повышенные лабораторные показатели повреждения печени [42]. Следует отметить, что проспективные исследования, в которых изучалось значение непрямой эластометрии у больных ХСН, обладали незначительной статистической мощностью и были одноцентровыми.
![Кривые Каплана-Мейера кумулятивной вероятности выживания без повторных госпитализаций с ухудшением сердечной недостаточности (А) и без комбинированной конечной точки (Б) в зависимости от значений плотности печени при поступлении и выписке [41 с изменениями].](/pimg3/pechen-pri-zastoynoy-870235.jpg)
Рис. 1. Кривые Каплана-Мейера кумулятивной вероятности выживания без повторных госпитализаций с ухудшением сердечной недостаточности (А) и без комбинированной конечной точки (Б) в зависимости от значений плотности печени при поступлении и выписке [41 с изменениями].
Таким образом, изменение лабораторных показателей поражения печени часто наблюдается у пациентов с СН и ассоциируется с неблагоприятным прогнозом. В современных руководствах рекомендуется оценивать уровень печеночных маркеров у всех пациентов с острой СН [43,44], однако интерпретация изменений активности печеночных ферментов остается неоднозначной. На сегодняшний день методы диагностики кардиогенного поражения печени, в том числе фиброза, не разработаны, отсутствует номенклатура и четкая классификация поражения печени при СН. Мало изучена роль НАЖБП у пациентов с клинически явной ХСН.
Хроническое пассивное полнокровие печени (K76.1)
Хроническое пассивное полнокровие печени - состояние, включающее в себя спектр печеночных расстройств, которые возникают в условиях правосторонней сердечной недостаточности.
Хроническое пассивное полнокровие печени почти никогда не бывает единственным или основным диагнозом, чаще фигурируя в качестве осложнения основного заболевания.
Примечание. В данную подрубрику включены следующие клинические понятия:
- кардиальный цирроз печени;

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
Выделено 3 стадии изменений в печени:
1. Стадия мускатной печени. Орган увеличен, уплотнен. На разрезе ткань имеет пеструю окраску (как ядро мускатного ореха) - на серо-желтом фоне (результат жировой дистрофии гепатоцитов) видны множественные мелкие темно-красные участки (полнокровные центры долек).
2. Стадия мускатного (застойного) фиброза. Печень плотная за счет разрастания волокнистой ткани. На разрезе ткань пестрая ("мускат наоборот") - на темно-красном фоне (результат смещения полнокровия из центра долек на периферию) обнаруживаются многочисленные мелкие серые очаги (фиброз в центре долек).
3. Стадия сердечного (застойного) цирроза. О данной стадии говорят в случае деформации печени (поверхность ее становится бугристой).
Этиология и патогенез
Этиология и патогенез
Застойное (пассивное) полнокровие печени чаще всего является результатом повышения давления в системе нижней полой вены, связанного с декомпенсацией функции правого желудочка или обоих желудочков. Состояние является клинико-морфологическим проявлением сердечной или легочно-сердечной недостаточности.
К непосредственным причинам правожелудочковой недостаточности могут относиться констриктивный перикардит, митральный стеноз, трикуспидальная регургитация, легочное сердце, кардиомиопатии Кардиомиопатии (син. кардиопатия) — заболевания миокарда, при которых сердечная мышца структурно и функционально изменена в отсутствие патологии коронарных артерий, артериальной гипертензии и поражения клапанного аппарата
.
Патофизиологическая сущность общего венозного полнокровия состоит в перераспределении объема крови в общем круге кровообращения с накоплением ее в венозной части большого круга кровообращения (полых венах, а иногда и в сосудах легких) и уменьшением в артериальной части. Повышенное венозное давление в правом предсердии передается на печень через нижнюю полую вену и печеночные вены.
На клеточном уровне венозный застой препятствует эффективному синусоидальному кровотоку в терминальных печеночных венулах. Результаты возникающего синусоидального застоя венозной крови проявляются виде паренхиматозной атрофии, некроза, отложения коллагена, и, в конечном счете, фиброза.
Альтернативная теория предполагает, что сердечный цирроз - это не только ответ на хроническое повышение венозного давления и синусоидальный застой. Для развития фиброза печени может потребоваться более высокая степень обструкции сосудов, такая как, например, внутрипеченочный тромбоз. Тромбоз, в этом случае, может распространяться от синусоидов печеночных венул на средние вены печени и далее на ветви портальной вены, в результате постепенного отмирания паренхимы и фиброза.
Морфология: печень увеличена, капсула напряжена, передний край тупой, ложе желчного пузыря отечно; на разрезе - подчеркнутый рисунок долек.
Микроскопически: центральные вены и прилежащие капилляры расширены, заполнены кровью; печеночные пластинки раздвинуты, сдавлены; ретикулиновая строма сохранена.
При подостром застойном полнокровии печень уменьшена, края ее острые. На разрезе центр долек - темно-красный, запавший, периферия - желто-коричневая (мускатная печень). Микроскопически: печеночные пластинки в центре долек атрофированы, иногда до полного исчезновения.
Эпидемиология
Признак распространенности: Редко
Соотношение полов(м/ж): 1.2
Эпидемиология заболевания неизвестна, так как признаки "мускатной печени" достоверно обнаруживаются в основном на аутопсии, а при жизни маскируются симптомами основного заболевания. Считается, что с развитием кардиохирургии и трансплантологии, количество случаев сердечного цирроза печени в развитых странах сокращается.
Пол. Считается, что имеет место небольшое преобладание мужского пола. В старческом возрасте возможно небольшое преобладание женщин.
Возраст. Хотя признаки правосторонней сердечной недостаточности могут встречаться в любом возрасте (например, у младенцев в силу врожденных пороков сердца), преобладающим возрастом считается зрелый и старческий. Это связано с превалированием ишемической болезни сердца и других причин. Таким образом, распространенность увеличивается с возрастом.
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
дискомфорт в правом подреберье; желтуха; гепатомегалия; спленомегалия; гипотрофия; анорексия; асцит; отеки нижних конечностей; анасарка; вздутие шейных вен; расширение вен нижних конечностей; цианоз нижних конечностей; снижение температуры нижних конечностей; пигментация кожи нижних конечностей; шумы в сердце; расширение границ сердца вправо; хрипы в легких; плеврит; одышка; тошнота
Cимптомы, течение
I. Общая информация
2. Симптомы со стороны сердца могут быть разделены на те, которые сопровождают недостаточность правого желудочка сердца и бивентрикулярную недостаточность.
При физикальном обследовании преобладают признаки сердечной недостаточности.
2. Повышенное давление в яремной вене:
2.1 Вздутие шейных вен может быть вызвано применением давления в области правого подреберья в течение 1 минуты (гепатоюгулярный рефлюкс).
2.2 Парадоксальный рост венозного давления в яремной вене во время вдоха (симптом Куссмауля) может указывать на констриктивный перикардит, дисфункцию правого желудочка сердца, стеноз трехстворчатого клапана или легочное сердце Сердце легочное - патологическое состояние, характеризующееся гипертрофией и (или) дилатацией (стойкое диффузное расширение просвета) правого желудочка сердца в результате легочной гипертензии; возникает, как правило, при поражениях бронхов, легких, легочных сосудов, диафрагмы, плевры и грудной клетки
.
3. Хрипы в легких вследствие бивентрикулярной недостаточности и равномерное ослабление дыхания вследствие плеврита.
4. Аускультативная картина клапанной недостаточности или стеноза (в зависимости от этиологии). Перкуторная картина расширения границ сердца вправо или вправо и влево.
Диагностика
Диагноз хронического пассивного полнокровия печени выставляется на основании:
- подтвержденного (инструментально, клинически) факта хронической сердечной недостаточности (правожелудочковой или бивентрикулярной);
- умеренных изменений лабораторных показателей (печеночные пробы);
- исключения других причин формирования фиброза печени.
Неинвазивные исследования
1. Обзорная рентгенография органов грудной клетки:
- признаки кардиомегалии;
- признаки легочной венозной гипертензии;
- признаки отека легких или плеврита; плевральный выпот обычно больше справа.
2. Трансторакальная допплеровская ЭхоКГ может помочь в установлении причин хронической сердечной недостаточности: определить массу и размеры желудочков сердца, патологию клапанов, функцию сократимости сердечной стенки.
3. Допплерография нижней полой вены может показать уменьшение ее размера на вдохе и диаметр равный или более 2,3 см, что характерно для правожелудочковой недостаточности.
При исследовании печеночных вен может вывляться обратный систолический ток, что весьма специфично для трикуспидальной регургитации.
Метод показан для оценки результатов лечения хронической сердечной недостаточности и степени регрессии сердечного цирроза. Если регрессии не происходит, следует рассмотреть вариант синдрома Бадда-Киари (см. "Веноокклюзионная болезнь печени" - K76.5).
4. Радионуклидные методы исследования (с таллием или технецием) применяются для выявления обратимой ишемии миокарда у пациентов с кардиальным циррозом при декомпенсированной сердечной недостаточности. Использование технеция и позитронно-эмиссионной томографии (ПЭТ) могут определить дилатационную кардиомиопатию.
5. КТ и МРТ наиболее предпочтительны для диагностики констриктивных заболеваний перикарда. Оба исследования могут измерять фракцию выброса и эффективно исключить или подтвердить наличие кардиального цирроза печени. При кардиальном циррозе также выявляется гепато- и спленомегалия.
6. Электрокардиография:
6.1 Часто выявляются признаки ишемии миокарда, гипертрофии желудочков и расширение правого предсердия.
6.2 Гипертрофия правого желудочка, отклонение электрической оси вправо, блокада правой ножки пучка Гиса позволяют предложить хроническую перегрузку правого желудочка давлением.
Инвазивные исследования
Диагностический парацентез может помочь различить этиологию асцита. Полученная информация будет особенно полезна для больных с алкоголизмом и неуточненными заболеваниями сердца.
Как правило, "кардиальный асцит" показывает высокое содержание альбумина с градиентом по отношению к сыворотке (SAAG) более 1,1 г/дл и высокое содержание общего белка (более 2,5 г / дл) в асцитической жидкости.
У пациентов с некардиальным цирротическим асцитом также имеется высокое значение SAAG, но в асцитической жидкости общий белок будет больше, чем 2,5 г/л только у 10%.
С терапевтической целью (эвакуация асцита) лапароцентез рекомендуется применять только при терапии, рефрактерной к диуретикам. Поскольку синтетическая функция печени при кардиальном циррозе обычно сохранена, парентерального введения альбумина после пункции обычно не требуется.
2. Катетеризация сердца / коронарная ангиография.
Процедура может быть показана пациентам с кардиальным циррозом и сердечной недостаточностью в контексте известной или подозреваемой ИБС. Исследование используется преимущественно для оценки анатомии коронарных артерий и определения потребности в реваскуляризации.
Катетеризация правых отделов сердца для диагностики легочной гипертензии проводится при наличии клинических и УЗИ признаков.
Менее чем у 1% пациентов с хронической печеночной недостаточностью легочная гипертензия развивается в отсутствие базовой легочной и/или сердечной патологии (идиопатическая портопульмональная гипертония). Это состояние может прогрессировать до правожелудочковой недостаточности и затруднять ответ на вопрос: является ли печеночная недостаточность следствием заболевания печени или сердца.
Лабораторная диагностика
I. Лабораторная оценка тяжести повреждения печени включает определение:
- печеночных трансаминаз;
- щелочной фосфатазы;
- общего билирубина и альбумина.
1.1 Повышение билирубина в сыворотке крови.
Наблюдается у 15-50 % пациентов с сердечной недостаточностью.
Повышение, как правило, умеренное, обычно менее 4,5 мг/дл (80 ммоль/л). Примерно 50-60% сывороточного билирубина при этом составляет неконъюгированный билирубин (связано с комбинацией легкого гемолиза и нарушений процессов поглощения и конъюгации).
Значительное повышение уровня билирубина в сыворотке крови может наблюдаться при острой правосторонней сердечной недостаточности.
После улучшения печеночного кровотока билирубин в сыворотке крови может довольно быстро снизиться с нормализацией в среднем в течение 3-7 дней.
У пациентов с хронической сердечной недостаточностью (ХСН) уровень билирубина может не вернуться к нормальным показателям в течение длительного времени, даже после нормализации кровотока вследствие образования ковалентной связи билирубина с альбумином, которая формирует дельта билирубин, имеющий длительный период полураспада (21 день).
Повышение уровня общего билирубина является независимым предиктором неблагоприятного прогноза у больных с сердечной недостаточностью.
У пациентов, которые подвергаются пересадке сердца, повышение уровня билирубина более чем в 3 раза выше нормы является значительным негативным прогностическим индикатором выживаемости после выписки.
1.2. Трансаминазы.
Трансаминазы повышаются умеренно - от 2 до 4-х раз.
В стадии компенсации ХСН повышение трансаминаз встречается редко (у 10% пациентов).
Аномальные значения чаще встречаются у пациентов со средним давлением в правом предсердии (свыше 10 мм рт.ст.) и сердечном индексе менее 1,5 л/мин/м 2 , то есть в стадии суб- или декомпенсации.
Увеличение трансаминаз более чем в 10 раз от нормы наблюдается у пациентов с острой декомпенсацией ХСН, артериальной гипотонией, шоком или указывает на гепатит.
Повышение уровня АСТ, как правило, немного выше, чем АЛТ и возникает раньше.
Очень высокие уровни АСТ могут быть найдены у пациентов с медикаментозным или вирусным гепатитами. Однако при вирусных гепатитах уровень АЛТв основном выше, чем уровень АСТ.
При улучшении кровообращения АСТ быстро нормализуется, что также отличает кардиальный цирроз от токсических и вирусных гепатитов.
Умеренное увеличение уровня AСT может быть вызвано инфарктом миокарда. Последующая дисфункция миокарда и сердечная недостаточность могут усложнить интерпретацию повышения АСТ.
1.3. Повышение уровня щелочной фосфатазы.
Отмечается редко при сердечной недостаточности и носит очень умеренный характер (выше норме не более, чем в 2 раза). Более высокие показатели требуют проведения дифференциальной диагностики с синдромом холестаза Холестаз - нарушение продвижения желчи в виде застоя в желчных протоках и (или) проточках.
.
Точный механизм, приводящий к увеличению ЩФ у больных с кардиальным циррозом, неизвестен.
При узловой регенеративной гиперплазии, осложненной сердечной недостаточностью, повышенный уровень ЩФ может быть единственным биохимическим признаком процесса.
1.4. Снижение альбумина наблюдается у 30-50% пациентов. Уровень нормализуется спустя месяц после компенсации ХСН.
1.5. Протромбиновое время: принято считать, что удлинение ПТ и МНО наблюдается у 80% пациентов с острой или хронической правосторонней сердечной недостаточностью. Нормализация показателя происходит в течение 2-3 недель, после достижения стойкой компенсации.
2.2 Определение уровня тиреотропного гормона показано пациентам с необъяснимыми признаками кардиального цирроза и фибрилляцией предсердий.
III. У пациентов с сердечным циррозом, особенно при обострении (усилении симптомов), следует дополнительно определить маркеры повреждения миокарда, исследовать электролиты и креатинин сыворотки, провести общие анализы крови (количество эритроцитов) и мочи.
Дифференциальный диагноз
Осложнения
Лечение
Общие правила
Терапия направлена в первую очередь на лечение этиологически значимого фактора, то есть состояния, вызвавшего хроническое венозное полнокровие. Наличие кардиального цирроза само по себе редко влияет на исход сердечной недостаточности и какой-либо самостоятельной терапии, как правило, не подлежит.
Диета. Ограничение натрия менее 2 г/сут. - фундаментальный принцип немедикаментозной терапии.
Режим. Умеренные нагрузки, определенные кардиологом, на фоне корректируемой сердечной недостаточности более полезны, чем строгий постельный режим.
Медикаменты
1. Наиболее общие рекомендации включают в себя парентеральное применение диуретиков (в условиях стационара). Диуретическая терапия является краеугольным камнем медикаментозной терапии. Спиронолактон особенно показан при сердечно-сосудистой недостаточности III-IV класса (по классификации Нью-Йоркской кардиологической ассоциации).
2. При достижении нормоволемии, если левожелудочковая недостаточность является основной причиной, показаны бета-блокаторы и ингибиторы АПФ.
3. Правожелудочковая или бивентрикулярная недостаточность лечатся по стандартным схемам.
Прогноз
Влияние кардиального цирроза на выживаемость пациентов с хронической сердечной недостаточностью неизвестно, однако цирроз является одним из относительных противопоказаний к пересадке сердца.
Тем не менее, исследования по изучению обратимости сердечного цирроза у пациентов, перенесших пересадку сердца, показали, что синтетическая функция печени значительно улучшилась в течение 3 месяцев после пересадки.
Госпитализация
За редким исключением пациенты с кардиальным циррозом и симптомами острой сердечной недостаточности требуют госпитализации. Это особенно важно при впервые выявленной сердечной недостаточности. Госпитализация также показана, когда хронические симптомы становятся невосприимчивыми к амбулаторной терапии и большие дозы оральных диуретиков не обеспечивают адекватного диуреза, что сопровождается усилением отеков и прибавкой в весе более 800 г/сутки или 2 кг/неделю.
Помимо этого, показанием к госпитализации служит уменьшение переносимости стандартной физической активности (например, уменьшение дистанции, пройденной за определенной время).
Печень при застойной сердечной недостаточности - диагностика
Печень при сердечной недостаточности (СН). Биомаркеры сердечной недостаточности
Функция печени при сердечной недостаточности часто нарушена из-за сопутствующей гепатомегалии. Уровни аспартатаминотрансферазы и аланинаминотрансферазы повышаются, а протромбиновое время может замедлиться. В редких случаях может возникнуть гипербилирубинемия. Всем пациентам с СН необходимо сдать анализ мочи на бактериологические инфекции, микроальбуминурию и микрогематурию. У пациентов с почечной недостаточностью (ПН) при терапии диуретиками следует уделить особое внимание концентрации мочи и объему экскреции.
Биомаркеры все больше используют у пациентов с сердечной недостаточностью в целях получения важной диагностической и прогностической информации. Миокардиальные биомаркеры, например НУП, являются эффективным дополнительным средством диагностики у пациентов с СН. Предсердный натрий-уретический пептид, и МНУП секретируются в ответ на увеличение напряжения стенки сердца и/или циркуляции нейрогормонов. ПНУП и МНУП первоначально были синтезированы как прогормоны, протеолитически расщепленные в дальнейшем для образования больших биологически пассивных NT-ПНУП или NT-МНУП и меньших биологически активных пептидов (ПНУП или МНУП).
В связи с тем что ПНУП характеризуется малым периодом полувыведения, клинически значимым является только NT-ПНУП. Что касается МНУП, то клинически значимыми являются как N-терминальный рго-МНУП, так и МНУП. Уровни циркуляции ПНУП и МНУП у пациентов с систолической дисфункцией повышаются, а у пациентов с СН при нормальной ФВ увеличиваются, но в меньшей степени. Известно, что при СН во время систолы содержание МНУП непосредственно связано с напряжением стенок миокарда, ФВ и ФК.
Показатель уровня МНУП в плазме используют для определения кардиальных и экстракардиальных причин диспноэ. Также уровень МНУП предоставляет прогностическую информацию для пациентов с ХСН и/или острыми коронарными синдромами (ОКС). В последнее время изменения концентрации NT-МНУП используют для оценки реакции организма больного на терапию при СН. Высокие уровни МНУП являются более мощным прогностическим фактором при систолической или диастолической дисфункции ЛЖ, чем повышенное содержание NT-ПНУП.
Несмотря на то что скрининг популяции с использованием МНУП в настоящее время не рекомендуется, у пациентов с риском развития СН определение МНУП может способствовать более ранней диагностике развития симптомов СН и, соответственно, более раннему началу лечения. Уровни НУП повышаются с возрастом и при ПН, более высокая концентрация наблюдается у женщин, которая может возрастать при недостаточности ПЖ любой этиологии. Природа более высоких показателей МНУП у женщин не выяснена, но, возможно, причиной может быть более высокое напряжение стенок миокарда в меньшем по размеру сердце женщины.
Уровни могут быть ошибочно низкими у пациентов, страдающих ожирением, и могут приходить в норму у пациентов, проходящих надлежащую терапию. Нормальный сывороточный уровень МНУП имеет высокую прогностическую ценность (95%) отрицательного результата для исключения диагноза СН. Другими кардиальными нарушениями, способными вызвать увеличение уровней НУП, являются: гипертрофия левого желудочка, порок сердца, острая и хроническая ишемия, гипертензия, легочное сердце и эмболия легких.
Другие биомаркеры, такие как С-реактивный белок (С-РБ), фактор некроза опухоли и мочевая кислота, при СН также повышаются и могут быть источником важной прогностической информации. Креатинкиназа и тропонин (I или Т) могут умеренно увеличиваться у пациентов с тяжелой СН, при значительном напряжении стенки миокарда и/или субэндокардиальной ишемии. У пациентов в начальной стадии ОСН на увеличение уровней сердечных ферментов может влиять миокардит.
Исследования нейроэндокринной активации (например, норадреналина, ангиотензина II, активности ренина плазмы) технически сложны и зависят от применения лекарственных средств, модулирующих нейроэндокринные системы; по этой причине не рекомендуется их проведение в повседневной практике для диагностических или прогностических целей. Повторные серии измерений > 1 биомаркера в итоге могут способствовать своевременной коррекции терапии при СН, однако в настоящее время их не рекомендуют.
КТ, МРТ, УЗИ признаки пассивного полнокровия печени
а) Терминология:
1. Синоним:
• «Застойная печень» при заболеваниях сердца
2. Определение:
• Стаз крови в паренхиме печени в результате нарушения венозного оттока
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Расширение печеночных вен с наличием двунаправленного кровотока («туда и обратно»), обнаруживаемого при допплерографии
• Ключевые моменты:
о Изменения со стороны печени при заболеваниях сердца:
- В острой фазе: увеличение печени и ее гетерогенность
- Поздние проявления: кардиальный цирроз; уменьшение печени (как и при циррозе, обусловленном иными причинами)
(Слева) На КТ в артериальной фазе контрастного усиления у мужчины 57 лет, недавно перенесшего инфаркт миокарда, определяется обратный заброс контраста в расширенную нижнюю полую вену и печеночные вены.
(Справа) На более каудальном КТ срезе в портально-венозной фазе контрастного усиления у этого же пациента визуализируются печеночные вены, не заполняющиеся контрастом при антеградном движении крови в печени. Печень увеличена в размерах, ее паренхима минимально и неравномерно накапливает контраст; изменения ее внешнего вида иногда называют «мускатной печенью». (Слева) На аксиальной КТ в артериальной фазе контрастного усиления у женщины 63 лет, которой изначально был выставлен диагноз «криптогенный цирроз», определяется заброс контрастного вещества в расширенные печеночные вены и нижнюю полую вену. В плевральной полости справа находится жидкостное содержимое.
(Справа) На КТ в артериальной фазе контрастного усиления у этой же пациентки определяется оседание контраста в дорсальной части расширенной нижней полой вены, и даже в правой почечной вене.
2. КТ признаки пассивного полнокровия печени:
• Раннее ретроградное контрастное усиление и дилатация нижней полой вены (НПВ) и печеночных вен:
о Вследствие заброса контраста из правого предсердия в НПВ
• Неоднородный, «пестрый» внешний вид паренхимы печени на КТ в артериальной и (или) венозной фазе
• Участки снижения плотности возле воротной вены (периваскулярная лимфедема)
• Гепатомегалия и асцит
• Изменения со стороны органов грудной клетки различаются в зависимости от первичного заболевания сердца:
о При констриктивном перикардите сердце уменьшено в размерах
о Кардиомегалия возникает на фоне поражения клапанов сердца или вследствие кардиомиопатии
о Возможно также наличие выпота в полости перикарда или плевры
3. МРТ признаки пассивного полнокровия печени:
• Т2 ВИ:
о Повышение интенсивности сигнала возле ветвей воротной вены (перипортальный отек)
• Т1 ВИ с контрастным усилением:
о Дилятация нижней полой вены и печеночных вен (изменения аналогичны таковым на КТ с контрастным усилением)
(Слева) На трансабдоминальной сонограмме у женщины 63 лет, предъявляющей жалобы на боль в правом подреберье, определяется циркулярный отек стенки желчного пузыря и задняя акустическая тень от конкремента, находящегося внутри него.
(Слева) На аксиальной сонограмме у этой же пациентки определяется резкое расширение позадипеченочной части нижней полой вены и печеночных вен в месте впадения их в НПВ. (Слева) На сонограмме правой печеночной вены с использованием допплеровского датчи -ка определяется выраженный фазовый спектр.
(Справа) На сонограмме главного ствола воротной вены (допплерография) в этом же случае определяется увеличение пульсовых волн. Расширение нижней полой вены, печеночных вен, отек стенки желчного пузыря в сочетании с явным фазовым кровотоком в печеночных венах и повышенной пульсацией воротной вены являются классическими сонографическими признаками пассивного венозного полнокровия и ключевым моментом, позволяющим отличить это состояние от острого холецистита.
5. Рекомендации по визуализации:
• Лучший метод диагностики:
о Цветовая допплерография; для определения природы заболевания сердца - МРТ
• Выбор протокола:
о Двухфазная КТ или МРТ с целью оценки распространенности поражения печени
(Слева) На аксиальной КТ в венозной фазе контрастного усиления у этой же пациентки определяется двухсторонний гидроторакс на фоне утолщения и обызвествления перикарда, сдавливающего и деформирующего правый и левый желудочки (констриктивный перикардит).
(Справа) На КТ в венозной фазе контрастного усиления (эта же пациентка) определяется дилятация нижней полой вены. Печень уменьшена в размерах, контуры ее неровные. (Слева) На КТ в венозной фазе контрастного усиления в этом же случае определяется неравномерное (слоями) смешивание контраста и крови в расширенной НПВ, что свидетельствует о значительном сопротивлении току венозной крови в направлении сердца.
(Справа) На КТ в венозной фазе контрастного усиления у этой же пациентки визуализируется печень с неровными, бугристыми краями и расширенными фиссурами. Констриктивный перикардит, заподозренный на основании данных КТ-исследования, впоследствии подтвердился. Хроническое застойное полнокровие печени привело к кардиальному циррозу.
в) Дифференциальная диагностика:
1. Синдром Бадда-Киари:
• Сужение нижней полой вены, печеночных вен; асцит
• Нарушение морфологии печени, асцит, формирование венозных коллатералей
2. Цирроз печени:
• Уменьшение размеров печени с наличием узлов в ее структуре, признаки портальной гипертензии
• Отсутствие изменений со стороны размеров вен печени и характера кровотока в них
3. Острые вирусные гепатиты:
• Печеночная и воротная вена имеют нормальный размер, кровоток в них не нарушен
г) Патология. Общая характеристика:
• Этиология:
о Застойная сердечная недостаточность
о Констрикгивный перикардит
о Перикардиальный выпот
о Поражение трехстворчатого клапана или клапана легочной артерии
о Кардиомиопатия
• Клинические и лучевые признаки заболеваний сердца
д) Клинические особенности. Проявления:
• Наиболее частые признаки/симптомы:
о Увеличение и болезненность печени,боль в правом подреберье из-за растяжения капсулы печени
о Признаки печеночной недостаточности могут обнаруживаться раньше, чем признаки заболевания сердца:
- Так, может ошибочно быть выставлен диагноз «криптогенный цирроз» при изменениях со стороны печени, обусловленных констриктивным перикардитом
о Диагноз устанавливается на основании данных клинического и лучевого исследования
• Клинический профиль:
о Гепатомегалия у гепатоюгулярный рефлюкс у пациента, страдающего заболеванием сердца
е) Диагностическая памятка. Следует учесть:
• Различия между острыми пассивным застоем в печени, вирусными гепатитами и проявлениями синдрома Бадда-Киари
• Различия между хроническим кардиальным циррозом и цирротическими изменениями иной этиологии
Особенности гепатокардиальных взаимоотношений у пациентов с хронической сердечной недостаточностью и нарушениями углеводного обмена: возможности дополнительной терапии
Поражение печени при хронической сердечной недостаточности (ХСН) у пациентов с нарушениями углеводного обмена (НУО) развивается в достаточно большом числе случаев. Показатели ремоделирования сердца и структурно-функциональные изменения печени при этом тесно взаимосвязаны и взаимообусловлены, а тяжелое поражение печени ассоциируется с плохим прогнозом при ХСН [1]. При этом механизмы формирования структурных и функциональных нарушений печени при ХСН ишемического генеза при ее сочетании с НУО имеют определенные особенности, опосредуемые присутствием как ХСН, так и неалкогольной жировой болезни печени (НАЖБП). НАЖБП наиболее распространена прежде всего в популяции пациентов с мета- болическим синдромом (МС) и сахарным диабетом (СД) 2-го типа [2]. В основе формирования поражения печени у пациентов с ХСН ишемического генеза лежат прежде всего гемодинамические механизмы, что сопровождается повышением механического давления в печеночных синусоидах и желчных канальцах, повышением уровня γ-глутамилтранспептидазы (ГГТП) и щелочной фосфатазы (ЩФ) в сыворотке крови даже при начальных проявлениях сердечной недостаточности, а выраженность холестаза коррелирует с классом ХСН [3]. По данным исследования CHARM (2009) [4], повышенный уровень билирубина был наиболее важным предиктором госпитализаций по поводу декомпенсации ХСН и кардиоваскулярной смертности. Венозный застой, ишемия за счет снижения сердечного выброса, артериальная гипоксемия приводят к формированию гипоксии печеночной ткани и ее ишемическому повреждению. Клиническими форма- ми поражения печени при ХСН ишемического генеза являются: застойная гепатопатия, ишемический гепатит, кардиальный фиброз и цирроз печени [5].
В основе формирования поражения печени при МС и СД 2-го типа – НАЖБП (стеатоз, стеатогепатит, фиброз) лежат иные патогенетические механизмы и прежде всего феномен инсулинорезистентности (ИР). Отмечено, что НАЖБП статистически значимо ассоциирована как с печеночной ИР, так и с ИР жировой и периферических тканей [6], в результате чего повышается периферический липолиз и увеличивается количество свободных жирных кислот (СЖК), доступных для захвата и последующего окисления гепатоцитами, формируется каскад реакций, ведущих к интенсификации синтеза атерогенных фракций липопротеинов. Увеличение поступления СЖК в печень, снижение скорости b-окисления СЖК в митохондриях печени, а также повышенный синтез жирных кислот в митохондриях печени, которые являются высокоактивным субстратом перекисного окисления липидов (ПОЛ), по мнению D. Pessoyre et al. (2000) [7], способствуют запуску внутриклеточной вы- работки митохондриями субстанций окислительного стресса, вызывающих индукцию цитокинов, FAS-лигандов и, в итоге, воспаление и некроз гепатоцитов, развитие фиброза и в дальнейшем цирроза печени. Кроме того, повышенное содержание СЖК и триглицеридов (ТГ) в гепатоците коррелирует с формированием феномена «липотоксичности» на уровне гепатоцита [8], что рассматривается как ключевой фактор активации фиброгенеза в клетках Ито [9].
Следует отметить и еще один неблагоприятный результат «печеночной липотоксичности» – нарастание в крови содержания атерогенных форм липопротеинов низкой и очень низкой плотности, способствующих развитию и прогрессированию атеросклеротического процесса. М. Ekstedt et al. (2006) показали, что 14-летний риск смерти от сердечно-сосудистых заболеваний (ССЗ) у пациентов с неалкогольным стеатогепатитом (НАСГ) был вдвое выше, чем в общей популяции [10]. Тяжесть кардиальной патологии прямо коррелирует с сердечно-сосудистыми исходами [11].
Поэтому для оценки особенностей гепатокардиальных взаимоотношений у пациентов с ХСН и НАЖБП в рамках МС или СД в клинике внутренних болезней Волгоградского государственного медицинского университета было проведено проспективное исследование в параллельных группах, в которое были включены 410 па- циентов в возрасте от 45 до 65 лет. Все больные проходили стационарный этап реабилитации после перенесенного инфаркта миокарда (ИМ).
В зависимости от наличия МС или СД пациенты были рандомизированы в группы. 1-я группа (n=50) была представлена пациентами с ХСН I–III функционального класса (ФК) по классификации ОССН (2002) на 22–30-е сут после перенесенного ИМ с клинико-лабораторными проявлениями МС (ВНОК, 2009) без нарушений углеводного обмена (33 мужчины, 17 женщин, средний возраст – 56,4±3,5 года).
2-я группа (n=50) включала пациентов с ХСН и МС с нарушениями углеводного обмена (17 мужчин, 33 жен- щины, средний возраст – 57,4±3,6 года), из которых 32% пациентов имели нарушение гликемии натощак, 68% – нарушение толерантности к углеводам. 3-я группа включала 210 пациентов в возрасте от 45 до 65 лет (средний возраст – 60,8±4,8 года) с ХСН I–III ФК на 22–30-е сут после перенесенного ИМ и СД 2-го типа. На момент включения в исследование у пациентов имелась компенсация углеводного обмена, достигнутая с помощью диеты и пероральных сахароснижающих средств в соответствии с клиническими рекомендациями Российской ассоциации эндокринологов (2011). 4-я группа (n=100) была представлена пациентами в возрасте от 45 до 65 лет (средний возраст – 58,6±4,2 года) с ХСН I–III ФК на 22–30-е сут после перенесенного ИМ без клинико-лабораторных проявлений МС или СД 2-го типа (группа контроля).
Все пациенты получали базисную терапию сердечной недостаточности (бисопролол, периндоприл, ацетилсалициловая кислота, клопидогрел, симвастатин, диуретики (фуросемид или индапамид), спиронолактон, при необходимости – нитраты) и базисную сахароснижающую терапию (метформин и/или глибенкламид). Средние дозы базисных препаратов, применяемых для лечения ХСН и СД 2-го типа, статистически достоверно не различались между группами.
Всем пациентам проводили физикальное обследование, рассчитывали индекс массы тела (ИМТ). Пациенты выполняли нагрузку в виде теста 6-минутной ходьбы (ТШХ), у них определяли уровень N-терминального мозгового натрийуретического пептида (NT-proBNP) имму- ноферментным методом (Biomedica, Slovakia). Оценку структурно-функционального состояния сердца проводили с помощью эхокардиографии по общепринятой методике на аппарате Siеmens Sonoline G50 (Германия) с допплеровским датчиком. Вариабельность ритма сердца (ВРС) проводили на приборе «Варикард-1.41» (Россия). Запись ЭКГ осуществляли в течение 5 мин утром в состоянии покоя в одном из стандартных отведений в положении лежа через 15 мин после адаптации больного к обстановке и во время активной ортостатической пробы с расчетом основных показателей (Баевский Р.М. и др., 2001).
Оценка структурного состояния печени проводилась на ультразвуковом сканере My Lab-90 (Esaote, Италия). Изучение функционального состояния печени включало определение активности аланиновой (АЛТ) и аспарагиновой (АСТ) аминотрансфераз, ЩФ и ГГТП, общего белка и альбумина, общего билирубина, тимоловой пробы и протромбинового индекса в сыворотке крови по общепринятым методикам на биохимическом анализаторе Liasys-2 (AMS, Италия). Рассчитывали индекс стеатоза печени по Lee Jeong-Hoon et al. (2010) по формуле:
ИС = 8 × (AЛТ/AСT) + ИМТ (+2 у женщин; +2 при наличии СД),
где ALT – показатель активности АЛТ в Е/л, AST – показатель активности АСТ в Е/л, ИМТ – индекс массы тела (кг/ м 2 ).
Изучение состояния углеводного и липидного обмена, оценка ИР проводились с помощью общепринятых методик.
Статистическая обработка результатов исследования осуществлялась при помощи пакета прикладных программ для обработки медицинской и биологической информации Statistica 7.0 (StatSoft, Inc., США) с привлечением встроенных функций программы MC Excel и программы Statistica 7.0 (StatSoft,Inc. При поиске патогенетических особенностей ХСН при разной степени выраженности нарушения углеводного обмена в целях удобства анализа снижение размерности фазового пространства до фазовой плоскости использовали с привлечением либо аппарата пошагового линейного дискриминантного анализа, либо канонической корреляции.
Программа и протокол исследования рассмотрены и одобрены региональным этическим комитетом (протокол № 154-212 от 12 марта 2011 г.).
При ультразвуковом исследовании печени гепатомегалия была отмечена у 48% пациентов с ХСН и МС без НУО, 68% и 92% пациентов с ХСН и МС с НУО и СД 2-го типа соответственно vs в 36% случаев в группе пациентов с «изолированной» ХСН. У 100% у больных с ХСН и СД 2-го типа были отмечены признаки стеатоза печени, который, по данным многофакторного регрессионного анализа, в группе ХСН и НУО был связан с показателями оценки вариабельности сердечного ритма (ИСП=27,981+0,01156*SIс-0,002*TPл+0,2778*LFл- 1,121*LF/HFл, R2=0,316), глюкозы крови натощак (ИСП=14,1197+4,9083*глю, R2=0,3098), липидного профиля (ИСП=30,652+2,437*ОХС+3,7226*ТГ-3,97*ХСЛНП +1,8224*ИА-5,7741* ХС ЛПОНП, R2=0,2375), окислительного стресса (ИСП=-6,4938+5,2133*МДА+0,027*Кат, R2 =0,2813).
Анализ распределения пациентов разных групп в пространстве функций «Гепато» и «Кардио» показывает, что в группах больных с ХСН и МС как без НУО, так и с НУО, ХСН и СД 2-го типа и ХСН имеет место различный характер гепатокардиальных взаимоотношений (рис. 1).
Анализ распределения пациентов разных групп в пространстве функций «Гепато» и «Кардио» (рис. 2) показывает, что снижение медиальных значений функции «Гепато» в ряду «ХСН – ХСН+МС без НУО – ХСН+МС с НУО – ХСН+СД» сопровождается одновременным снижением медиальных значений функции «Кардио». Таким образом, полученные результаты свидетельствуют о том, что в группах больных с ХСН и МС как без НУО, так и с НУО, ХСН и СД 2-го типа и ХСН имеет место различный характер гепатокардиальных взаимоотношений.
Примечание: SDNN (мс) – стандартное отклонение величин интервалов RR за весь рассматриваемый период;
IC (%) – индекс централизации регуляторных систем;
HF, LF, VLF (%) – соответственно мощность спектра высокочастотного, низкочастотного и очень низкочастотного компонента
вариабельности в % от суммарной мощности колебаний
Рис. 2. Относительный вклад групп показателей, отражающих состояние синдрома кардиальной дисрегуляции и нарушения функционального состояния печени у пациентов исследуемых групп, в первый набор функций
Анализ полученных в ходе исследования данных свидетельствуют о том, что повышение активности СНС в группе пациентов с ХСН и МС с НУО и ХСН и СД 2-го типа, опосредованное как наличием ХСН, так и присутствием МС, сопровождается нарастанием индекса стеатоза печени и повышением уровня ГГТП. С другой стороны, по данным L. Puthtmana et al. (2001) [12], НАЖБП может способствовать дальнейшему прогрессированию автономной дисфункции, что приводит к формированию факторов дополнительного кардиоваскулярного риска у пациентов с ХСН и НУО, а также может усугублять структурно-функциональные нарушения co стороны сердца. В ходе исследования было показано: показатель индекса стеатоза печени, а также частота встречаемости гиперферментемии ГГТП, АСТ и АЛТ в группах больных с ХСН и МС, СД 2-го типа оказались взаимосвязанными с различными типами ремоделирования сердца, что может говорить о существовании гепатокардиального континуума.
Гепатокардиальные взаимоотношения в группе пациентов с изолированной ХСН носят иной характер, что, по-видимому, связано с тем, что в основе формирования поражения печени у пациентов с ХСН ишемического генеза лежат прежде всего гемодинамические механизмы (нарушения портальной гемодинамики, снижение линейной скорости кровотока по портальным венам, значительное расширение печеночных и нижней полой вены, увеличение застоя в воротной вене). Эти изменения сопровождаются повышением механического давления в печеночных синусоидах и желчных канальцах, что может приводить к повышению уровня ЩФ в сыворотке крови даже при самых умеренных уровнях сердечной недостаточности [3]. Пассивный венозный застой, ишемия за счет снижения сердечного выброса, артериальная гипоксемия формируют гипоксию печеночной ткани – «ишемическую гепатопатию» [1], а гиперсимпатикотония, отмечаемая в группе пациентов с ХСН, выступает лишь как триггер сердечно-сосудистых нарушений.
Безусловно, основой профилактики ремоделирования и развития фиброза сердца и печени у пациентов с ХСН является использование препаратов, влияющих на активность ренин-ангиотензин-альдостероновой системы (РААС). [13], что связано с существенной ролью внутриорганной РААС в регуляции роста, пролиферации, апоптоза клеток, образования активных форм кислорода, воспаления и фиброгенеза. Однако присутствие НАЖБП у пациентов с ХСН и особенности формирования гепатокардиальных взаимоотношений диктуют необходимость использования дополнительной гепатопротекторной терапии у этой категории пациентов. Интерес представляют экспериментальные данные, свидетельствующие о гепатопротекторных свойствах таурина в лечении НАЖБП. зхРезультаты экспериментального исследования Gentile et al. (2011) говорят о возможности таурина снижать выраженность стресса эндоплазматического ретикулума, окислительного стресса, подавлять активность каспазы-3 и апоптоз гепатоцитов, проявления хронического системного воспаления в гепатоцитах.
Кроме того, таурин подавлял аккумуляцию ТГ в гепатоцитах, что позволяет рассматривать его как перспективный препарат для профилактики и лечения НАЖБП [14]. На модели НАСГ у крыс было показано, что при диете, обогащенной жирами, таурин существенно уменьшает вес печени, активность трансаминаз в сыворотке, уровень ТГ и глюкозы, окислительный стресс, количество экспрессируемой mRNA фактора некроза опухоли α, трансформирующего ростового фактора β и проколлагена 1; значительно увеличивает экспрессию адипонектина по сравнению с таковой в опытной группе.
Поэтому на втором этапе исследования в нашей клинике проводилась оценка эффективности таурина (Дибикор, ООО «ПИК-ФАРМА», Россия) в составе комбинированной терапии ХСН у пациентов с СД 2-го типа 4–месячная терапия Дибикором в дозе 500 мг 2 р./сут в составе комбинированной терапии у пациентов с СД 2–го типа и ИБС позволила не только дополнительно снизить уровень атерогенных липидов (обнаружено статистически значимое снижение уровня ХС ЛПНП (Δ, % = -17%) и ТГ (Δ, % = -16%) в группе пациентов, принимавших таурин в дополнение к базисной терапии ХСН и СД 2-го типа), но и способствовала снижению уровня ферментов цитолиза на фоне приема статинов, что может быть опосредовано его модулирующим (индуцирующим) действием на систему CYP450 3A4 и гепатопротекторным действием [15]. Результаты наших исследований согласуются с данными исследования Н.В. Лосева и Е.Е. Моисеенко [16], в котором таурин продемонстрировал гепатопротекторное и дополнительное липидснижающее действие у пациентов с НАСГ, ассоциированным с ожирением и СД, в виде положительного влияния на динамику печеночных проб у пациентов, принимающих статины. Благоприятное влияние таурина на уровень ТГ является патогенетически важным, т. к. их избыток коррелирует с формированием феномена липотоксичности на уровне гепатоцита, способствуя активации их апоптоза [17].
Исходно повышение активности АСТ и АЛТ выше нормальных значений (но не более 3-кратного превышения верхней границы нормы) отмечалось в 20% случаев во 2-й группе и в 23,3% – в 1-й группе. Через 16 нед. приема таурина в составе комбинированной терапии СД 2-го типа и ХСН и ни у одного пациента во 2-й группе не регистрировалась гиперферментемия, тогда как в 1-й группе в 10% случаев сохранилось повышение уровня активности АСТ. Различие между группами статистически значимо. Кроме того, отмечено достоверное снижение активности АСТ и АЛТ во 2-й группе пациентов, дополнительно принимающих таурин ( Δ, % = -39,06 и -26,93 соответственно vs Δ , % = - 4,1 и -0,98 в 1-й группе).
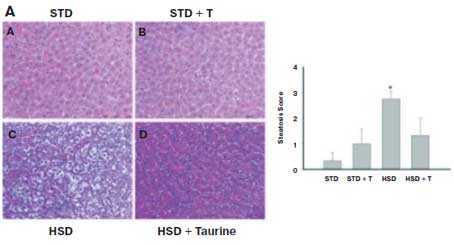
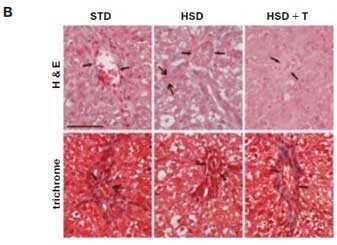
Рис. 3. Эффект таурина на стеатоз у крыс, индуцированный высококрахмалистой (STD) или высокосахарозной диетой (HSD).
Гистологическая картина печени. Окраска гематоксилином и эозином (Н&Е) и трихромом.
Длительность исследования и включение таурина (Т) в диету – 4 нед. [14]
* - р
Выявлено снижение активности как ЩФ, так и ГГТП у пациентов, получающих комбинированную терапию с включением таурина. Активность ЩФ снизилась на 22,7% во 2-й vs 0,34% в 1-й группе (р Таблица 1.
Динамика показателей функционального состояния печени у больных ХСН и СД 2-го типа при приеме Дибикора в составе комбинированной терапии
Установленное в ходе исследования положительное влияние таурина на функциональные показатели, характеризующие синдром цитолиза и холестаза, по-видимому, обусловлено доказанными антиоксидантными и противовоспалительными свойствами таурина [18].
Нами проводилась оценка индекса стеатоза печени (FLI) [19] и фиброза печени (NFS) [20], рекомендованного EASL – ALEN для неинвазивной диагностики тяжести поражения печени (2015) в различных клинических ситуациях [21].
FLI = (e 0,953*loge (ТГ) + 0,139*ИМТ + 0,718*loge (ГГТП) + 0,053*ОТ – 15,745) / (1 + e 0,953*loge (ТГ) + 0,139*ИМТ + 0,718*loge (ГГТП) + 0,053*ОТ – 15,745 ) * 100 и NAFLD Fibrosis Score (NFS) = (-1,675 + 0,037 x воз- раст (года) + 0,094 x ИМТ (кг/м 2 ) + 1,13 x НТГ/СД (да = 1, нет = 0) + 0,99 x АСТ/AЛТ отношение – 0,013 x число тромбоцитов (x10 9 /л) – 0,66 x альбумин г/дл).
Полученные результаты свидетельствуют о том, что назначение таурина в составе комбинированной терапии пациентам с ХСН и СД 2-го типа с НАЖБП сопровождалось достоверным снижением индекса стеатоза печени на Δ, % = -12,4% vs Δ,% = 0,68% в контрольной группе. Различия между группами достигли статистической значимости. Результаты согласуются с данными экспериментального исследования C.L. Gentile et al. (2011), которые показали высокий терапевтический потенциал таурина при неалкогольном стеатозе печени [14] (рис. 3).
Таким образом, применение таурина в клинике и эксперименте свидетельствуют о его значимых органо-гепатопротекторных эффектах и может быть использовано для коррекции метаболических нарушений и усиления липидоснижающего действия статинов при НАЖБП.
Литература
Читайте также:
