Передача болевого раздражения в спинной мозг. Спинальные ноцицептивные нейроны
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Для цитирования: Амелин А.В. Современные аспекты патогенеза и фармакотерапии боли в спине. РМЖ. 2013;22.
Боль в спине является одной из частых причин нетрудоспособности, она значительно снижает качество жизни и остается одной из ведущих причин обращения за медицинской помощью. Боль в нижней части спины возникает значительно чаще, чем боль в шее или грудном отделе. Источниками боли в спине могут быть многочисленные анатомические структуры позвоночника, окружающие его ткани и внутренние органы. Такие эмоциональные расстройства, как тревога и депрессия, вносят большой вклад в развитие боли и ее хронизацию. Формирование хронической боли также зависит от особенностей развития личности, окружения больного, выбранной пациентом ментально-поведенческой стратегии преодоления боли. Чаще всего боль в спине имеет мышечное и спондилогенное происхождение, т.е. она связана с изменениями в мышцах спины, теле позвонков, межпозвонковом диске, суставах, связках. В случае развития конфликта между спинномозговым корешком и структурами позвоночника (чаще всего грыжевым выпячиванием межпозвонкового диска и остеофитом) развивается радикулопатия. Иногда причинами боли в спине могут стать патология внутренних органов грудной и брюшной полости, малого таза, а также психические расстройства.
Болевой синдром в области спины требует от врача дифференциально-диагностического подхода с корректной оценкой факторов риска и взвешенной терапевтической тактикой. Дифференциальная диагностика боли в спине предполагает исключение прогностически неблагоприятных и опасных состояний. Следует обращать внимание на наличие лихорадки, локальной болезненности и повышения местной температуры в паравертебральной области, которые характерны для инфекционного поражения позвоночника. Этот риск повышен у пациентов, получавших иммуносупрессивную терапию, в/в инфузии, страдающих ВИЧ-инфекцией. О наличии опухоли (первичной или метастатической) может свидетельствовать беспричинное снижение веса, злокачественное новообразование любой локализации в анамнезе, сохранение боли в покое и ночью, а также возраст пациента старше 50 лет. Компрессионный перелом позвоночника чаще отмечается в случаях травм, при применении кортикостероидов и у пациентов старше 50 лет.
Считается, что боль в спине часто имеет смешанный ноцицептивно-нейропатический характер, т.е. возникает вследствие активации болевых рецепторов (ноцицепторов) и повреждения невральных структур (например, корешков).
Ноцицептивная боль, как правило, острая, соответствует степени действия тканевого повреждения и длительности повреждающих факторов. Ноцицептивные болевые синдромы возникают в результате активации ноцицепторов при травме, воспалении, ишемии, чрезмерном растяжении тканей. Примерами являются боли при воспалении суставов позвоночника. В случае вовлечения в патологический процесс костной или мышечной ткани возникает ощущение тупой, ноющей боли. Эта боль усиливается при движении, ослабевает в покое и обычно хорошо локализована. При состоявшемся повреждении тканей возникает воспалительная реакция, одним из следствий которой является воспалительная боль. Макрофаги, тучные клетки и нейтрофилы выделяют многочисленные медиаторы воспаления. Последние воздействуют на ноцицепторы и повышают их чувствительность, в результате чего даже незначительное раздражение воспринимается как болевой сигнал. Хотя воспалительная боль является вариантом ноцицептивного типа боли, некоторые авторы выделяют ее как самостоятельную форму. Большинство специалистов рассматривают ее как вариант ноцицептивной боли, т.к. и при механическом, и термическом или химическом воздействии на ноцицепторы присутствуют те или иные элементы воспаления.
Другим частым патофизиологическим механизмом ноцицептивной боли является мышечный спазм. При боли в спине повышенная возбудимость ноцицепторов неминуемо вызывает рефлекторную активацию мотонейронов в соответствующих сегментах спинного мозга и сокращение мышц с последующим возбуждением мышечных ноцицепторов. Рефлекторное напряжение мышц вначале имеет защитный характер, поскольку приводит к иммобилизации пораженного сегмента, однако если ноцицептивная импульсация длительна, то такие мышцы сами становятся источником боли. Нейрогенное асептическое воспаление, возникающее при длительном напряжении мышц, способствует появлению участков болезненных мышечных уплотнений, которые еще больше усиливают афферентный поток ноцицептивных импульсов в структуры ЦНС. Все это приводит к сенситизации большого количества центральных ноцицептивных нейронов. Этот порочный круг играет важную роль в хронизации боли. Периферическое повреждение запускает целый каскад патофизиологических процессов, затрагивающих всю ноцицептивную систему от тканевых рецепторов до корковых нейронов, вызывая в них стойкие изменения возбудимости и развитие сенситизации, которые проявляются повышением болевой чувствительности, явлениями аллодинии. Выраженность и продолжительность периферической и центральной сенситизации при ноцицептивной боли напрямую зависят от характера и продолжительности повреждения тканей. Чем длительнее сохраняется повреждение, тем длительнее будет боль. Таким образом, эффективное купирование острой боли и устранение болезненного мышечного напряжения позволяют предупредить развитие хронической боли в спине.
Современная фармакотерапия острой боли в спине по своей сути представляет вынужденную полипрагмазию со всеми проблемами безопасности лечения, т.к. предполагает одновременное использование нестероидных противовоспалительных препаратов, неопиодных и опиодных анальгетиков, мышечных релаксантов центрального действия и ряда других препаратов.
Одним из возможных путей решения данной проблемы может стать применение лекарственного средства, обладающего сразу несколькими механизмами действия и влияющего на ряд звеньев патогенеза острой боли в спине. В настоящее время для лечения острого болевого синдрома за рубежом и в России широко применяется флупиртин (Катадолон® форте). Уникальность этого препарата в том, что он одновременно устраняет острую боль, мышечный спазм и препятствует развитию механизмов сенситизации в нейронах спинного мозга, что предотвращает переход острой боли в хроническую. Миорелаксирующий эффект флупиртина реализуется благодаря стимуляции ГАМК-рецепторов и блокированию передачи болевого импульса на мотонейроны и промежуточные нейроны спинного мозга, при этом мышечный тонус нормализуется в области боли, не вызывая генерализованной мышечной слабости. Анальгезирующее действие флупиртина обусловлено непрямым антагонизмом к NMDA-рецепторам. В терапевтических дозах препарат способствует открытию потенциалнезависимых калиевых каналов, что приводит к стабилизации мембранного потенциала нервной клетки. Установлено, что влияние на ток ионов калия опосредовано воздействием препарата на систему регуляторного G-белка. Это вызывает угнетение активности NMDA-рецепторов и, как следствие, блокаду нейрональных ионных каналов кальция, снижение внутриклеточного тока ионов кальция, угнетение возбуждения нейрона в ответ на ноцицептивные стимулы. В результате предупреждается формирование сенситизации и феномена «wind up» – увеличения нейронального ответа на повторные болевые стимулы. Это, в свою очередь, предотвращает усиление боли и переход ее в хроническую форму. Появление пролонгированной формы флупиртина – Катадолона Форте (400 мг) – расширяет возможности врача в проведении эффективной терапии острой неспецифической боли в спине.
Возникновение стреляющей, жгучей боли, иррадирующей в зону иннервации того или иного спинномозгового корешка или нерва и сопровождающейся объективно выявляемым изменением чувствительности, характерно для нейропатического болевого синдрома. Наиболее частыми причинами появления нейропатического компонента при боли в спине являются диско-радикулярный конфликт, стеноз позвоночного канала, спондилез. Нейропатический компонент боли выявляется у 10–19% пациентов с болью в спине [8–10]. Важную роль в формировании нейропатической боли играют изменения нейрофизиологических характеристик нервных волокон, нейронов спинномозговых ганглиев и задних рогов спинного мозга. Известно, что интенсивность боли не коррелирует со степенью протрузии диска или выраженностью компрессии корешка. Как правило, такие боли кроме иррадиации в конечности сопровождаются другими симптомами поражения корешков (снижение поверхностной и глубокой чувствительности, двигательные нарушения). Присутствие нейропатического компонента боли значительно усугубляет течение болевого синдрома в спине, способствует его хронизации и быстрой дезадаптации больных, нарушает качество их жизни, повышает расходы на лечение [10–12], способствует развитию инсомнии, тревоги, депрессии [13–15].
Для многих врачей лечение пациентов с хронической нейропатической болью остается сложной проблемой [16]. Одним из главных механизмов нейропатической боли является периферическая сенситизация, при которой особая роль принадлежит избыточной экспрессии и активности вольтаж-зависимых натриевых каналов на мембранах сенсорных периферических нейронов. В этом случае предпочтительнее назначить препараты, блокирующие эти каналы: пластины с лидокаином или антиконвульсанты (карбамазепин, окскарбазепин). Другим важным механизмом нейропатической боли является центральная сенситизация (гипервозбудимость центральных сенсорных нейронов), проявляющаяся аллодинией и вторичной гипералгезией. В этом случае патогенетически обоснованным является назначение средств, уменьшающих центральную сенситизацию: антиконвульсантов габапентина или прегабалина, которые связываются с α2δ-субъединицей кальциевых каналов и снижают частоту деполяризации ноцицептивных нейронов в заднем роге спинного мозга.
Результаты систематических обзоров свидетельствуют, что среди используемых для лечения нейропатической боли антидепрессантов, опиоидов и антиконвульсантов наиболее благоприятным соотношением эффективность/переносимость обладает прегабалин, что делает его в настоящее время препаратом первого выбора для лечения боли с нейропатическим компонентом [16]. В ряде клинических исследований прегабалин продемонстрировал не только высокую анальгетическую активность, но и эффективность в отношении сопутствующих аффективных расстройств и инсомнии у пациентов с периферической диабетической полиневропатией [23–26], постгерпетической невралгией [27–29], спинальной центральной нейропатической болью [30]. Принимая во внимание высокую коморбидность хронической нейропатической боли с тревогой и инсомнией, становится понятной важная роль прегабалина в лечении таких пациентов [16, 21, 45, 46].
Недавно на фармацевтическом рынке России появился новый европейский дженерик прегабалина – Альгерика®. Препарат рекомендован для лечения нейропатической боли в дозах от 150 до 600 мг/сут. Эффективным и безопасным представляется индивидуальный подбор дозы Альгерики методом постепенного увеличения суточной дозы на 75 мг каждые 7 дней.
Использование прегабалина в комплексном лечении больных с радикулопатией способствует более эффективному лечению этой патологии.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Передача болевого раздражения в спинной мозг. Спинальные ноцицептивные нейроны
Пути передачи болевых сигналов. Передача боли в спинном мозге
Хотя все болевые рецепторы являются свободными нервными окончаниями, они используют два раздельных пути для передачи сигналов в центральную нервную систему. Эти пути в основном соответствуют двум типам боли: путь быстрой (острой) болим путь медленной (хронической) боли.
а) Периферические болевые волокна - быстрые и медленные. Сигналы быстрой (острой) боли возникают при действии механических и термических раздражителей и передаются по периферическим нервам к спинному мозгу тонкими волокнами типа Аδ со скоростью от 6 до 30 м/сек. Наоборот, медленная (хроническая) боль вызывается в основном химическими болевыми стимулами, но иногда — длительно действующими механическими и тепловыми раздражителями. Этот тип боли передается к спинному мозгу волокнами типа С со скоростью 0,5-2 м/сек.
В связи с этой двойной системой болевой иннервации в ответ на внезапный болевой стимул часто возникает двойственное болевое ощущение: быстрая (острая) боль, передаваемая в мозг волокнами типа Аδ, и примерно через секунду развивается медленная боль, которая передается волокнами типа С. Острая боль быстро информирует о повреждающем влиянии и, следовательно, играет важную роль в инициации немедленной реакции человека, позволяющей ему устраниться от стимула. Медленная боль со временем обычно усиливается. Это ощущение в итоге вызывает невыносимые страдания, связанные с длительной болью, и заставляет человека делать все возможное, чтобы удалить источник боли.
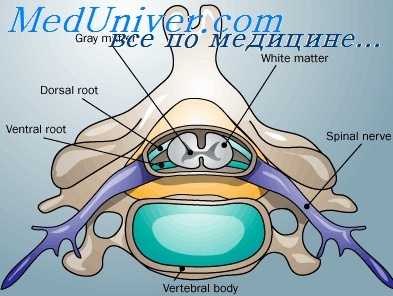
Войдя в спинной мозг через его задние корешки, болевые волокна заканчиваются на переключающих нейронах задних рогов. Здесь, как видно на рисунках ниже, также есть две системы обработки болевых сигналов на их пути в головной мозг.
Передача сигналов быстрой (острой) и медленной (хронической) боли в спинной мозг и через него в головной мозг Передача болевых сигналов в ствол мозга, таламус и кору большого мозга по пути проведения быстрой (острой) боли и медленной (хронической) боли
б) Два пути болевых сигналов в спинном мозге и мозговом стволе. Неоспиноталамический и палеоспиноталамический тракты. После входа в спинной мозг болевые сигналы направляются в головной мозг по двум путям:
(1) неоспиноталамическому тракту;
(2) палеоспиноталамическому тракту.
1. Неоспиноталамический тракт для проведения быстрой боли. Быстрые болевые волокна типа Аδ передают главным образом сигналы механической и острой термической боли. Они заканчиваются в основном на уровне I пластины (краевой) заднего рога, как показано на первом рисунке выше, и возбуждают нейроны второго порядка неоспиноталами-ческого тракта. Они дают начало длинным волокнам, которые сразу же переходят на противоположную сторону спинного мозга через переднюю комиссуру и затем поднимаются вверх к головному мозгу в составе переднебоко-вых столбов.
2. Окончание неоспиноталамического тракта в стволе мозга и в таламусе. Немногие волокна неоспиноталамического тракта заканчиваются в ретикулярных областях ствола мозга, но большинство проходят весь путь к таламусу без перерыва, заканчиваясь в вентробазальном комплексе вместе с трактом задних столбов/медиальной петли для тактильных ощущений. Небольшое число волокон переключается также в задней группе ядер таламуса. Из этих таламических областей сигналы передаются к другим областям основания мозга, а также к соматосенсорной коре.
3. Способность нервной системы локализовать источник быстрой боли в организме. Источник быстрой (острой) боли в разных частях тела локализуется гораздо точнее, чем источник медленной (хронической) боли. Однако если стимулируются только болевые рецепторы без одновременного возбуждения тактильных, быстрая боль тоже плохо локализуется, часто лишь в пределах 10 см от стимулируемой зоны. Если же одновременно стимулируются тактильные рецепторы, возбуждающие систему задних столбов/медиальной петли, то возможна практически точная локализация.
Глутамат — возможный нейромедиатор волокон быстрой боли. Полагают, что окончания болевых волокон типа Аδ в спинном мозге выделяют медиатор глутамат. Это один из наиболее широко распространенных возбуждающих медиаторов в центральной нервной системе, длительность действия которого составляет лишь несколько миллисекунд.
Видео проводящие пути болевой и температурной чувствительности
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Электрофизиологический анализ мембранных потенциалов клеток заднего рога в ответ на периферические повреждающие стимулы свидетельствует о сложном профиле их электрической активности. Происходит ранняя быстрая мембранная деполяризация, которую связывают с активацией АМРА-рецепторов глутаматом, высвобождающимся из первичных центростремительных нервов. За этим начальным ответом следует более медленно развивающаяся вторичная деполяризация. Глутамат, действующий на NMDA-рецепторы, и субстанция Р, которое считаются главным нейротрансмиттером в этом участке, а также другие нейропептиды типа вазоактивного интестинального полипептида, соматостатина и холецистокинина также могут регулировать этот процесс.
Дополнительная важная роль глутамата, действующего на NMDA-рецепторы, расположенные на спинальных ноцицептивных нейронах, заключается в индукции спинального «вовлечения».
Это «вовлечение» — электрофизиологическое явление, аналогичное «долгосрочному потенцированию» в других областях мозга. Его можно определить как увеличение амплитуды мембранной деполяризации в спинальных ноцицептивных нейронах после повторного возбуждения их С-волокон болевыми стимулами.
«Вовлечение» спинного мозга объясняет, почему острая боль иногда переходит в хроническую спонтанно и без всякой видимой физиологической причины. Клеточный механизм этого «вовлечения», как полагают, включает следующие шаги:
• активация NMDA-рецепторов глутаматом либо непосредственно на ноцицептивном нейроне, либо на смежных нейронах;
• открытие NMDA-связанных Са2+-каналов в этих нейронах;
• активация Са2+-кальмодулин-зависимой синтазы оксида азота для высвобождения NO.
NO — свободно диффундирующий и хорошо растворимый в липидах медиатор, который быстро проходит ретроградно к первичному центростремительному окончанию нерва, чтобы увеличить выделение глутамата (и, возможно, также субстанция Р).
Таким образом, начальный выброс даже очень маленького количества глутамата от сенсорных терминалов С-волокон способен вызвать выделение все большего количества глутамата, усиливая деполяризацию ноцицептивных нейронов и завершая процесс «вовлечения». В связи с этим можно предсказать, что прерывание этого круга путем назначения ингибиторов NOS типа метилового эфира L-Ng-нитроаргинина у экспериментальных животных облегчает боль. Будут ли такие лекарства эффективны при хронической боли, зависит от новых формул ингибиторов NOS с меньшим количеством побочных эффектов.
Электрическая активность спинальных ноцицептивных нейронов «настроена» на нейротрансмиттеры, высвобожденные из спинальных нейронов и главного супраспинального нисходящего нервного пучка. Местный контроль над болевой чувствительностью спинного мозга обеспечивается опиоидными пептидами, в особенности мет-энкефалином и бета-эндорфином и в меньшей степени лей-энкефалином и динорфином. Каждый из этих пептидов расположен в пределах нейронов I и II пластин дорсальной части спинного мозга и обеспечивает анальгетический агонизм определенных опиоидных рецепторов.
Эпидурально введенные опиоиды (например, морфин) снимают боль, действуя на спинальном уровне. При системном введении опиоиды также влияют на восприятие боли в более высоких мозговых центрах. Механизм действия опиоидов в спинном мозге заключается в ингибировании выделения субстанции Р и глутамата из терминалей С-волокон, хотя клеточный механизм этого неясен.
- Вернуться в оглавление раздела "фармакология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Боль: от патогенеза к выбору лекарственного препарата
Боль является наиболее частой и сложной по субъективному восприятию жалобой пациентов. В 40% всех первичных обращений к врачу боль является ведущей жалобой. Большая распространенность болевых синдромов оборачивается значительными материальными, социальными и духовными потерями.
Как уже говорилось выше, комитет по классификации Международной ассоциации по изучению боли определяет боль как «неприятное сенсорное и эмоциональное переживание, связанное с существующим или возможным повреждением ткани или описываемое в терминах такого повреждения» [37]. В этом определении подчеркивается, что ощущение боли может возникать не только при повреждении ткани, но даже при отсутствии какого-либо повреждения, что указывает на важную роль психических факторов в формировании и поддержании боли.
Классификация боли
Боль - понятие клинически и патогенетически сложное и неоднородное. Она различается по интенсивности, локализации и по своим субъективным проявлениям. Боль может быть стреляющей, давящей, пульсирующей, режущей, а также постоянной или периодической. Все существующее многообразие характеристик боли во многом связано с самой причиной, вызвавшей ее, анатомической областью, в которой возникает ноцицептивный импульс, и очень важно для определения причины боли и последующего лечения [3].
Одним из наиболее существенных факторов в понимании этого феномена является разделение боли на острую и хроническую (рис. 8).
Рис. 8. Боль: острая и хроническая. Главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения.
Острая боль всегда указывает на конкретную проблему или угрозу для человека. В этом ее биологический смысл и «польза». Хроническая боль является во всех случаях патологическим состоянием, приводящим к дезадаптации и снижению качества жизни пациента. А для общества хроническая боль оборачивается огромными экономическими потерями.
Острая боль - это сенсорная реакция с последующим включением эмоционально-мотивационных вегетативных и других факторов при нарушении целостности организма. Развитие острой боли связано, как правило, с вполне определенными болевыми раздражениями поверхностных или глубоких тканей и внутренних органов, нарушением функций гладкой мускулатуры. Острый болевой синдром развивается в 80% случаев, имеет защитное, предупредительное значение, так как свидетельствует о «повреждении» и вынуждает человека предпринять меры для выяснения причины боли и ее устранения. Длительность острой боли определяется временем восстановления поврежденных тканей и/или нарушенной функции гладких мышц и обычно не превышает 3 месяцев. Острая боль обычно хорошо купируется анальгетиками.
В 10–20% случаев острая боль переходит в хроническую, которая длится более 3–6 месяцев. Однако главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения. Хроническая боль не носит защитного характера. Хроническая боль в последние годы стала рассматриваться не только как синдром, но и как отдельная нозология. Ее формирование и поддержание зависит в большей степени от комплекса психологических факторов, нежели от характера и интенсивности периферического ноцицептивного воздействия. Хроническая боль может сохраняться после завершения процессов заживления, т.е. существовать вне зависимости от повреждения (наличия ноцицептивного воздействия). Хроническая боль не купируется анальгетиками и часто приводит к психологической и социальной дезадаптации пациентов.
Одной из возможных причин, способствующих хронификации боли, является лечение, неадекватное причине и патогенезу болевого синдрома. Устранение причины острой боли и/или максимально эффективное ее лечение - залог профилактики трансформации острой боли в хроническую.
Важное значение для успешного лечения боли имеет определение ее патогенеза. Наиболее часто встречается ноцицептивная боль, возникающая при раздражении периферических болевых рецепторов - «ноцицепторов», локализованных практически во всех органах и системах (коронарный синдром, плеврит, панкреатит, язва желудка, почечная колика, суставной синдром, повреждения кожи, связок, мышц и т.д). Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы [9].
Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), но могут носить и хронический характер (остеоартроз). При этом виде боли фактор, вызвавший ее, как правило, очевиден, боль обычно четко локализована (обычно в зоне повреждения). Описывая ноцицептивную боль, пациенты чаще всего пользуются определениями «сжимающая», «ноющая», «пульсирующая», «режущая». В лечении ноцицептивной боли хороший терапевтический эффект можно получить при назначении простых анальгетиков и НПВП. При ликвидации причины (прекращении раздражения «ноцицепторов») ноцицептивная боль проходит [9].
Причинами нейропатической боли могут быть повреждения афферентной соматосенсорной системы на любом уровне, начиная от периферических чувствительных нервов и заканчивая корой больших полушарий, а также нарушения в нисходящих антиноцицептивных системах. При поражении периферической нервной системы боли называют периферическими, при поражении центральной нервной системы - центральными (рис. 9).
Нейропатическая боль, возникающая при повреждении различных участков нервной системы, характеризуется пациентами как жгучая, стреляющая, холодящая и сопровождается объективными симптомами раздражения нервов (гиперестезия, парестезия, гипералгезия) и/или нарушения их функции (гипестезия, анестезия). Характерным симптомом нейропатической боли является аллодиния - феномен, характеризующийся возникновением боли в ответ на действие безболевого стимула (поглаживание кисточкой, ватой, температурного фактора).
Рис. 9. Периферическая и центральная нейропатическая боль.
Нейропатическая боль характерна для хронических болевых синдромов разной этиологии. При этом их объединяют общие патофизиологические механизмы формирования и поддержания боли.
Нейропатическая боль плохо поддается лечению стандартными анальгетиками и НПВП и часто приводит к выраженной дезадаптации пациентов.
В практике невролога, травматолога, онколога встречаются болевые синдромы, в клинической картине которых наблюдаются симптомы как ноцицептивной, так и нейропатической боли - «смешанная боль» (рис. 10). Такая ситуация может возникать, например, при компрессии опухолью нервного ствола, раздражении межпозвонковой грыжей спинномозгового нерва (радикулопатии) или при компрессии нерва в костном или мышечном канале (туннельные синдромы). В лечении смешанных болевых синдромов необходимо воздействие на оба, ноцицептивный и нейропатический, компоненты боли.
Рис. 10. Представленность различных типов боли.
Ноцицептивная и антиноцицептивная системы
Сегодняшние представления о формировании боли основаны на представлениях о существовании двух систем: ноцицептивной (НС) и антиноцицептивной (АНС) (рис. 11).
Ноцицептивная система (является восходящей) обеспечивает проведение боли от периферических (ноцицептивных) рецепторов до коры головного мозга. Антиноцицептивная система (является нисходящей) предназначена для контроля над болью [17, 18].
На первом этапе формирования боли происходит активация болевых (ноцицептивных) рецепторов. К активации болевых рецепторов может привести, например, воспалительный процесс. Это вызывает проведение болевых импульсов к задним рогам спинного мозга.
На сегментарном спинальном уровне происходит модуляция ноцицептивной афферентации, которая осуществляется влиянием нисходящих антиноцицептивных систем на различные опиатные, адренергические, глютаматные, пуриновые и другие рецепторы, расположенные на нейронах заднего рога. Этот болевой импульс затем передается в вышележащие отделы центральной нервной системы (таламус, кора головного мозга), где происходит обработка и интерпретация информации о характере и локализации боли.
Рис. 11. Современные представления о боли: ноцицептивная (НС) и антиноцицептивная системы (АНС).
Однако итоговое восприятие боли в значительной степени зависит от активности АНС. АНС головного мозга играют ключевую роль в формировании боли и изменении реакции на боль. Очевидна их широкая представленность в головном мозге и включение в различные нейротрансмиттерные механизмы (норадреналин, серотонин, опиоиды, дофамин). АНС работают не изолированно, а, взаимодействуя между собой и с другими системами, они регулируют не только болевую чувствительность, но и сопряженные с болью вегетативные, моторные, нейроэндокринные, эмоциональные и поведенческие проявления боли. Это обстоятельство позволяет рассматривать их как важнейшую систему, определяющую не только характеристики болевого ощущения, но и его многообразные психофизиологические и поведенческие корреляты [3]. В зависимости от активности АНС боль может усиливаться или уменьшаться.
Препараты для лечения боли
Препараты для лечения боли назначают с учетом предполагаемых механизмов боли. Понимание механизмов формирования болевого синдрома позволяет проводить индивидуальный подбор лечения. При ноцицептивной боли с наилучшей стороны зарекомендовали себя нестероидные противовоспалительные препараты (НПВП) и опиоидные анальгетики. При нейропатической боли обоснованным является применение антидепрессантов, антиконвульсантов, местных анестетиков, а также блокаторов калиевых каналов.
Нестероидные противовоспалительные препараты
Если в патогенезе болевого синдрома ведущую роль играют механизмы воспаления, то наиболее целесообразно в этом случае применение НПВП. Их использование позволяет подавить синтез альгогенов в поврежденных тканях, что предотвращает развитие периферической и центральной сенситизации [26]. Помимо болеутоляющего эффекта препараты из группы НПВП оказывают противовоспалительное и жаропонижающее действие.
Современная классификация НПВП предполагает разделение этих средств на несколько групп, отличающихся селективностью в отношении ферментов циклооксигеназы 1 и 2 типа, которые участвуют в ряде физиологических и патологических процессов (рис. 12).
Рис. 12. Селективные и неселективные НПВП.
Считается, что противоболевой эффект препаратов из группы НПВП связан в основном с их влиянием на ЦОГ2, а желудочно-кишечные осложнения обусловлены их влиянием на ЦОГ1. Однако исследования последних лет обнаруживают и другие механизмы анальгетического действия некоторых препаратов из группы НПВП. Так, было показано, что диклофенак (Вольтарен) может оказывать противоболевое действие не только через ЦОГ-зависимые, но и другие периферические, а также центральные механизмы [15].
Местные анестетики
Ограничения поступления ноцицептивной информации в ЦНС можно достичь при применении различных местных анестетиков, которые могут не только предотвратить сенситизацию ноцицептивных нейронов, но и способствовать нормализации микроциркуляции в зоне повреждения, уменьшению воспаления и улучшению обмена веществ. Наряду с этим местные анестетики расслабляют поперечно-полосатую мускулатуру, устраняют патологическое напряжение мышц, которое является дополнительным источником боли [26].
К местным анестетикам относят вещества, вызывающие временную потерю чувствительности тканей в результате блокады проведения импульсов в нервных волокнах. Наибольшее распространение среди них получили лидокаин, новокаин, артикаин и бупивакаин. Механизм действия местных анестетиков связан с блокированием Na + -каналов на мембране нервных волокон и торможением генерации потенциалов действия.
Антиконвульсанты
Длительно существующее раздражение ноцицепторов или периферических нервов приводит к развитию периферической и центральной сенситизации (гипервозбудимости).
Существующие сегодня антиконвульсанты, применяемые для лечения боли, имеют различные точки приложения. Дифенин, карбамазепин, окскарбазепин, ламотриджин, вальпроаты, топиромат действуют главным образом, подавляя активность потенциал-зависимых натриевых каналов, предотвращая спонтанную генерацию эктопических разрядов в поврежденном нерве. Эффективность этих препаратов доказана у пациентов с тригеминальной невралгией, диабетической невропатией, фантомно-болевым синдромом.
Габапентин и прегабалин тормозят вход ионов кальция в пресинаптическую терминаль ноцицепторов, тем самым уменьшая выброс глутамата, что приводит к уменьшению возбудимости ноцицептивных нейронов спинного мозга (уменьшает центральную сенситизацию). Эти препараты также модулируют активность NMDA-рецепторов и снижают активность Na + -каналов.
Антидепрессанты
Антидепрессанты и препараты из группы опиоидов назначают с целью усиления антиноцицептивных влияний. При лечении болевых синдромов в основном используют препараты, механизм действия которых связан с блокадой обратного захвата моноаминов (серотонина и норадреналина) в ЦНС. Обезболивающий эффект антидепрессантов может быть частично обусловлен и непрямым анальгетическим действием, так как улучшение настроения благоприятно сказывается на оценке боли и уменьшает болевое восприятие. Кроме того, антидепрессанты потенцируют действие наркотических анальгетиков, повышая их сродство к опиоидным рецепторам [26].
Мышечные релаксанты
Мышечные релаксанты применяют в случаях, когда вклад в формирование боли вносит мышечный спазм. Следует отметить, что мышечные релаксанты оказывают воздействие на уровне спинного мозга, а не на уровне мышц.
В нашей стране для лечения болезненных мышечных спазмов используются тизанидин, баклофен, мидокалм, а также препараты из группы бензодиазепинов (диазепам). В последнее время с целью расслабления мышц в лечении миофасциальных болевых синдромов применяются инъекции ботулинотоксина типа А [22]. У представленных препаратов - разные точки приложения. Баклофен является агонистом ГАМК-рецепторов, ингибирует активность вставочных нейронов на спинальном уровне.
Толперизон блокирует Na + -и Ca 2+ -каналы интернейронов спинного мозга и уменьшает выброс болевых медиаторов в нейронах спинного мозга. Тизанидин относится к мышечным релаксантам центрального действия. Основная точка приложения его действия находится в спинном мозге. Стимулируя пресинаптические a2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют рецепторы к N-метил-D-аспартату (NMDA-рецепторы). Вследствие этого на уровне промежуточных нейронов спинного мозга происходит подавление полисинаптической передачи возбуждения. Поскольку именно этот механизм отвечает за избыточный мышечный тонус, то при его подавлении мышечный тонус снижается. В дополнение к миорелаксирующим свойствам, тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект.
Исходно тизанидин был разработан для лечения мышечного спазма при различных неврологических заболеваниях (при травматических повреждениях головного и спинного мозга, рассеянном склерозе, инсульте). Однако в скором времени после начала его применения были выявлены анальгетические свойства тизанидина. В настоящее время применение тизанидина в монотерапии и в комплексном лечении болевых синдромов получило широкое распространение [11].
Селективные активаторы нейрональных калиевых каналов (SNEPCO)
Принципиально новым классом препаратов для лечения болевых синдромов являются селективные активаторы нейрональных калиевых каналов - SNEPCO (Selective Neuronal Potassium Channel Opener), оказывающие воздействие на процессы сенситизации нейронов заднего рога за счет стабилизации мембранного потенциала покоя.
Первый представитель этого класса лекарственных средств - флупиртин (Катадолон), обладающий широким спектром ценных фармакологических свойств, выгодно отличающих его от других обезболивающих препаратов.
В последующих главах подробно изложены сведения о фармакологических свойствах и механизме действия Катадолона, представлены результаты исследований его эффективности и безопасности, рассказывается об опыте применения препарата в разных странах мира, даны рекомендации по применению Катадолона при различных болевых синдромах.
Стадии восприятия боли. Активация ноцицепторов в периферических тканях
Болевое ощущение рассматривается как процесс, состоящий из трёх стадий. Понимание процессов, которые управляют восприятием боли в поврежденных тканях, спинном мозге и более высоких мозговых центрах, необходимо для адекватного устранения боли. Очень упрощенно восприятие боли может быть представлено тремя стадиями:
• болевая детекция в периферических тканях после активации специализированных рецепторов боли (ноцицепторов);
• передача болевой информации от периферии к дорсальным рогам спинного мозга, где она ингибируется или усиливается комбинацией локальных (спинных) нейрональных цепей и нисходящих трактов от более высоких мозговых центров;
• передача информации о боли к более высоким мозговым центрам, которые инициируют ответ.
Каждая из этих стадий управляется разнообразными местными гормонами в периферических участках и неиротрансмиттерами в центральных участках. Взаимодействия между различными неиротрансмиттерами очень сложны и до конца не изучены.

Первый шаг в восприятии боли — активация ноцицепторов в периферических тканях. В отличие от других чувствительных рецепторов, которые воспринимают такие стимулы, как механическое давление или температурные изменения, ноцицепторы плохо определены анатомически. Вероятно, они являются простыми нервными окончаниями в коже, мышцах и глубже во внутренних органах. Как именно ноцицепторы активируются, например при повреждении ткани, остается загадкой, хотя множество медиаторов воспаления, присутствующих в участке повреждения ткани, могут стимулировать ноцицепторы и вызывать боль, включая гистамин (также вызывает зуд) и брадикинин (БК).
Гистамин и БК при нанесении в низких дозах на поверхность вскрытого волдыря на коже у добровольцев вызывают боль. БК действует через G-белок-связанные рецепторы (В1 и В2), чтобы вызвать различные провоспалительные эффекты, включая расширение сосудов и отек. Возбуждение рецепторов БК также активизирует на мембране фермент фосфолипазу А2, деятельность которой, в свою очередь, вызывает мембранную деэтерификацию, ведя к высвобождению арахидоновой кислоты (эйкозатетраеновой кислоты) и последующему биосинтезу простагландинов (ПГ) (например, ПГЕ2 и ПП2) циклооксигеназой (ЦОГ).
Не удивительно, что простагландины найдены в месте воспалительного ответа (например, в синовиальной жидкости, полученной из суставов пациентов с ревматоидным артритом или остеоартрозом). ПГ вызывают гипералгезию, но не алгезию. Физиологические концентрации ПГЕ2 и ПП2 не вызывают боль, когда их наносят на открытую ожоговую поверхность у добровольцев или после внутрикожного введения животным. Однако такие концентрации ПГ мощно потенцируют болевой эффект от механического или химического раздражения, аналогично нанесению гистамина и БК.
5-НТ — другой местный гормон, который вызывает болевой ответ через периферические ноцицепторы, вероятно более выраженный, чем вызываемый БК или гистамином. Разнообразие метаболических веществ, высвобождающихся из поврежденных клеток (например, АТФ, молочная кислота, К+) и ацидотические состояния, наблюдаемые во время воспаления, также обусловливают болевую активность.
Читайте также:
- Повреждения связочного аппарата позвоночника. Переломы отростков позвонков
- Классификация антиаритмических средств. Классификация Vaughan-Williams
- Лечение мужского бесплодия при паховой сосудистой обструкции, вазорезекции
- Лучевая диагностика параганглиомы средостения на КТ, МРТ
- Как вправить вывих нижней челюсти
