Перспективы применения контрастной эхокардиографии
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
РНЦХ им. акад. Б.В. Петровского РАМН
кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого Московского медицинского университета им. И.М. Сеченова, Москва, Россия
ФГАОУ ВО «ПМГМУ им. И.М. Сеченова», Москва, Россия
Контрастно-усиленное ультразвуковое исследование как наиболее информативный метод диагностики нестабильности атеросклеротической бляшки сонной артерии
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2018;(9): 52‑56
На сегодняшний день в патогенезе атеросклероза отмечается актуальность процесса неоваскуляризации. Благодаря значительному успеху фундаментальной и экспериментальной науки было обнаружено, что именно неоваскуляризация и длительно текущий воспалительный процесс сопровождают атерогенез, от начальных проявлений до тромботических осложнений. Именно явление неоваскуляризации представляется основным предиктором нестабильности атеросклеротической бляшки, которая сопровождается кровоизлияниями внутрь бляшки с последующим ее повреждением, что может быть причиной развития фатальных последствий. Осложнениями атеросклероза сонных артерий являются инсульты и транзиторные ишемические атаки. Для полноценной диагностики таких патологий требуется использование широкого спектра диагностических и патогистологических методов. Наиболее перспективным методом диагностики является контрастная расширенная ультразвуковая диагностика (CEUS), которая посредством инъекции контрастных веществ позволяет оценить степень неоваскуляризации в атеросклеротической бляшке и определить дальнейшие перспективы консервативного лечения и оперативных методик.
Эффективная диагностика стеноза внутренней сонной артерии (ВСА) — актуальная проблема, которая требует всестороннего изучения вследствие ограничений диагностических возможностей в определении степени стеноза и его значимости для последующих лечебных мероприятий. Основной причиной стеноза ВСА является атеросклероз. Четкая визуализация и определение таких признаков нестабильности атеросклеротической бляшки, как изъязвление и неоваскуляризация, позволят на ранних этапах заболевания предсказать последующие осложнения и наиболее грозное из них — инсульт. Примерно 25—50% всех случаев инсульта вызвано нестабильной атеросклеротической бляшкой, расположенной в сонных артериях [1, 2].
Инсульт — третья по частоте причина смертности после ишемической болезни сердца и рака [3]. Основным неинвазивным методом диагностики патологии сонных артерий сегодня является ультразвуковое дуплексное сканирование (УЗДС) с допплерографией, однако он имеет некоторые ограничения в применении и не всегда предоставляет точные диагностические данные о стенозе сонной артерии [4—9]. Так, с помощью УЗДС с допплерографией достаточно сложно дифференцировать критический стеноз от полной окклюзии сосуда. Ограничивающими факторами для использования этого метода являются кальцифицирование бляшки, большая глубина залегания сосудов или их извитость. Все это может повлиять на точность исследования [10]. Для улучшения визуализации атеросклеротической бляшки и оценки степени стеноза сонных артерий целесообразно применение контрастных агентов. Именно на этом построена технология УЗДС с контрастированием (CEUS).
Нестабильность атеросклеротической бляшки
Эхогенность бляшек сонной артерии, как показывают результаты цветного допплеровского исследования, может быть использована как маркер их уязвимости [11]. Для диагностики и прогнозирования инсульта принято оценивать степень стеноза сонной артерии, однако следует учитывать и особенности морфологии бляшки [12]. Долгое время считалось, что именно изъязвление атеросклеротической бляшки служит главной причиной развития инсультов при заболеваниях ВСА [13]. Между тем предполагается, что воспалительные изменения и процессы неоваскуляризации бляшки ведут к ее разрыву [14, 15].
С повреждением атеросклеротической бляшки связано появление микроэмболических сигналов (МЭС), которые обнаруживаются при проведении транскраниального допплеровского исследования у пациентов с инсультом либо транзиторной ишемической атакой в анамнезе [16]. МЭС образуют небольшие плотные частицы, отрывающиеся от атеросклеротических бляшек, а затем с током крови попадающие в внутричерепные артерии [17]. МЭС обнаруживаются у 43% пациентов с симптомами стеноза ВСА и у 10% пациентов, у которых стеноз протекает бессимптомно [18].
Процесс неоваскуляризации внутри атеросклеротической бляшки связан с высоким риском ее дестабилизации [19]. Нарушение кровоснабжения и вызванная этим ишемия растущей бляшки приводят к росту новых микрососудов внутри стенки/бляшки из адвентиции, что зачастую связано и с развитием воспалительного процесса [20, 21].
Контрастно-усиленное ультразвуковое дуплексное сканирование
Контрастно-усиленное УЗДС (CEUS) сонной артерии позволяет проводить неинвазивную последовательную оценку морфологии сонной артерии [22].
Технология CEUS зарекомендовала себя как многообещающая методика визуализации микрососудов с пораженной атеросклерозом сосудистой стенкой. УЗ-контрастные микропузырьки вводились внутривенно и функционировали исключительно как внутрисосудистые субстанции. Свойство контрастно-усиленного УЗИ (CEUS) контрастировать и подсчитывать характеристики не только макроциркуляторного, но и микроциркуляторного русла, вплоть до капиллярной перфузии, дает дополнительные возможности при оценке нестабильности бляшки посредством измерения степени неоваскуляризации внутри атеросклеротической бляшки. В исследовании с помощью методики CEUS были получены данные о степени нестабильности атеросклеротической бляшки, которые подтверждены в ходе изучения гистологических образцов после каротидной эндартерэктомии. Различные ретроспективные исследования показали, что повышенное контрастирование бляшки при использовании контрастно-усиленного УЗИ свидетельствует о высокой степени васкуляризации, что ассоциировано с различными клиническими симптомами атеросклероза сонной артерии [23].
Контрастное вещество
Для УЗИ с контрастным усилением применяется специальное, состоящее из микропузырьков вещество, использовавшееся еще в 1968 г. R. Gramiak и P. Shah в эхокардиографии [24]. Из-за своего размера микропузырьки не могут пройти через стенку сосуда, поэтому они циркулируют в пределах сосудистого русла. Эхогенность микропузырьков обусловлена большим значением акустического импеданса по сравнению с жидкостью, в которой они распространяются, и их способностью поглощать и отражать УЗ-сигнал. Отраженное звуковое поле, таким образом, содержит различные гармоники частоты возбуждения, что делает сигнал от микропузырьков отличным от сигналов окружающих его тканей [25].
Микропузырьки первого поколения были наполнены обычным воздухом и выводились легкими из кровотока слишком быстро, не обеспечивая достаточной продолжительности контрастирования, поэтому не существовало возможности полноценно описать характер поражения сонных артерий. Спустя некоторое время создали эхо-контрастное вещество с более длительным периодом нахождения его в сосудистом русле [26]. SonoVue и Sonazoid — второе поколение контрастных веществ. Их пузырьки диаметром 1—10 мкм содержат менее растворимый газ — перфлюрбутан или сульфургексафлурид, находящийся в оболочке из фосфолипидов или альбуминов. Этим обусловлена их большая устойчивость in vivo, позволяющая контрастировать сосуды с низкой скоростью кровотока, как, например, новообразованные сосуды атеросклеротических бляшек. Контрастное вещество с микропузырьками вводится внутривенно [6, 28]. При 3 MГц SonoVue демонстрирует максимальный коэффициент обратного рассеивания и приблизительно через 6 мин половина контрастного вещества разрушается. Более 80% компонентов данного контраста выводится легкими в течение 11 мин [6, 29].
Доступные к настоящему времени микропузырьки были апробированы у пациентов, подтверждена их безопасность. Побочные эффекты при их применении наблюдались крайне редко, однако известны случаи аллергических реакций на контрастное вещество, возникновения приступов нестабильной стенокардии, инфаркта миокарда, острой сердечной недостаточности и эндокардита [27]. Сейчас в клинической практике используются 4 вида контрастных веществ второго поколения: Оптисон (перфлюитренпротеин типа А), Дефинитин (микросферы из перфлюитренлипида), Соновью (сульфогексафлюрид, инкапсулированный в фосфолипиды) и Левовист (гранулы, состоящие из галактозы и пальмовой кислоты). Контрастирование с использованием микропузырьков применяется в нейросонологии при транскраниальном цветовом УЗИ в случае недостаточной чрезвисочной визуализации [30]. Однако подобное контрастирование пока не было введено для УЗ-оценки сонных артерий. Тем не менее в 2011 г. Европейской федерацией ассоциаций по ультразвуку в медицине и биологии для внепеченочного применения контрастно-усиленного УЗИ рекомендовано использовать микропузырьки для улучшения визуализации просвета, а также для определения степени окклюзии сонной артерии и характеристики степени ее стеноза [31].
Перспективы применения CEUS в диагностике
В течение последних лет большое внимание уделяется развитию неинвазивных диагностических методик для идентификации нестабильной атеросклеротической бляшки [32]. Основной целью является обнаружение неоангиогенеза и воспалительного процесса.
Многочисленные недавние исследования показали возможность использования УЗИ с контрастированием для оценки процессов неоваскуляризации внутри атеросклеротических бляшек. В дальнейшем этот метод можно будет использовать и для оценки уязвимости бляшек сонных артерий [33—36].
Описано применение контрастно-усиленного УЗИ сонных артерий для обнаружения неоангиогенеза. Данный метод может применяться для стратификации сосудистых рисков [37]. В доклинических испытаниях контрастно-усиленное УЗИ применялось для визуализации на молекулярном уровне путем направления микропузырьков к таким молекулам, как васкулярная молекула клеточной адгезии 1 или P-селектин [32]. Задачей являлась визуализация не только процесса неоваскуляризации внутри бляшки, но и непосредственно воспаленного эндотелия, вовлеченного в атеросклеротический процесс [23].
Оценка процессов неоваскуляризации в атеросклеротических бляшках открывает большие перспективы для диагностики бляшек с высоким риском разрыва, так как на данный момент количество методов для проведения такой диагностики ограничено [38].
В последнее время появилось много информации о том, что ряд клеточных процессов, таких как воспаление, накопление липидов, ангиогенез и тромбоз, может происходить в участках сосуда, пораженных атеросклеротическим процессом [38]. Данные явления с высокой долей вероятности имеют связь с разрывом бляшки [39]. Хотя нет достоверных сведений о механизме превращения бессимптомной бляшки в уязвимую, доказано влияние процессов неоваскуляризации бляшки на вероятность ее разрыва [40, 41].
Подтверждено наличие связи между результатами мониторинга МЭС и полученным коэффициентом контрастности при проведении контрастно-усиленного УЗИ. В то же время не обнаружено выраженной корреляции между результатами мониторинга МЭС и данными цветного допплеровского исследования — основного метода диагностики при стенозе ВСА. Несмотря на то что эхо-прозрачность бляшки служит маркером высокого риска повреждения, некоторые исследования показывают, что УЗИ с контрастированием является более точным методом оценки уязвимости бляшки, чем цветное допплеровское исследование [11].
В то же время методика контрастно-усиленного УЗИ имеет свои ограничения, связанные с оборудованием, включая контрастное вещество, которое весьма специфично и пока широко не распространено [23].
Таким образом, контрастно-усиленное УЗИ является перспективным методом неинвазивной диагностики атеросклеротического поражения ВСА, позволяющим оценивать не только эхогенность бляшки, но и наличие процессов неоваскуляризации, связанных с повышением риска разрыва бляшки. Применение данного метода в клинической практике может расширить возможности врачей в прогнозировании осложнений атеросклероза ВСА благодаря обеспечению лучшего понимания патогенетических механизмов процесса. Контрастно-усиленное УЗИ сонных артерий может помочь определить пациентов, атеросклеротические бляшки у которых наиболее уязвимы и, следовательно, имеют большую вероятность разрыва, ведущего к развитию инсультов или транзиторных ишемических атак.
Перспективы применения контрастной эхокардиографии
Перспективы развития стресс-ЭхоКГ
а) Применение контрастной эхокардиографии, режима второй гармоники и трехмерной эхокардиографии. При неоптимальном качестве эхо-изображения и недостаточной визуализации эндокарда возможности использования стресс-ЭхоКГ в значительной мере ограничены. В последние годы удалось достичь существенного улучшения контурирова-ния эндокарда таких пациентов с помощью эхо контрастных средств и режима второй гармоники.
1. Эхоконтрастные средства. Сегодня на рынке представлен целый ряд эхоконтрастных средств, проходящих через малый круг. Кроме эхоконтрастных препаратов первого поколения, разработаны препараты второго поколения на фтороуглеродной основе, отличающиеся более высокой стабильностью микропузырьков. В отношении эхоконтрастных средств первого поколения было показано значительное улучшение визуализации миокарда у пациентов с недостаточным качеством эхоизображения.
Большая надежность оценки исследования привела также к меньшей вариабельности заключений различных исследователей по одному и тому же пациенту.
Применение эхоконтрастных средств второго поколения и эхокардиографических технологий с низким механическим индексом (MI) позволило в последние годы еще улучшить визуализацию миокарда и достичь уровня, существенно превышающего уровень тех исследований, которые используют только режим второй гармоники. В результате появляется возможность анализа локальной сократимости, по своей точности не уступающего результатам МРТ, как это было показано в сравнительном мультицентровом исследовании.
2. Повышение диагностической точности. Почти во всех опубликованных работах по стресс-ЭхоКГ оценивается рутинная методика без использования режима второй гармоники или контрастного усиления. Можно ожидать, что диагностическая точность стресс-ЭхоКГ, зависящая от качества визуализации эндокарда, в отдельных случаях может быть еще повышена при использовании режима второй гармоники или введения контрастного средства. Данные технологии позволяют также применять стресс-ЭхоКГ у пациентов, прежде недоступных этому исследованию из-за недостаточной визуализации эндокарда.
3. Трехмерная стресс-эхокардиография. Трехмерная визуализация миокарда в реальном времени используется при добутаминовой стресс-ЭхоКГ. При этом по сравнению с двумерной технологией уменьшается время исследования, возникает тенденция к увеличению чувствительности в диагностике ишемической болезни сердца, а также улучшается сопоставимость оценок эхокардиограммы различными исследователями.
Применение режима второй гармоники для улучшения визуализации эндокарда во время стресс-ЭхоКГ. Применение эхоконтрастного средства во время стресс-ЭхоКГ для улучшения визуализации эндокарда.
б) Количественная оценка результатов стресс-эхокардиографии. Традиционная оценка стресс-ЭхоКГ основана на субъективном анализе эхоизображений. Анализу подвергается как движение эндокарда внутрь желудочка, так и систолическое утолщение его стенки. Субъективный характер оценки может приводить к существенным расхождениям между заключениями различных исследователей. Следует стремиться к объективному, количественному анализу локальной сократимости.
В последние годы изучались возможности так называемого цветокодированного анализа движений эндокарда и тканевой допплерографии с позиций разработки методики количественного анализа локальной сократимости миокарда.
1. Цветокодированный анализ движений эндокарда. В данном режиме для отображения амплитуды локальных движений эндокарда одного сердечного цикла используется цветовая шкала; в разных сегментах желудочка шкала охватывает различный диапазон значений. В исследовании, включившем 89 пациентов с добутаминовой стресс-ЭхоКГ, было показано, что автоматизированный цветокодированный анализ движений эндокарда имеет более высокую чувствительность при выявлении индуцируемых нарушений локальной сократимости, чем визуальная интерпретация малоопытным исследователем. Однако эта методика позволяет провести анализ лишь движений эндокарда во времени и не учитывает информацию о систолическом утолщении стенки или скорости регионального движения миокарда.
2. Тканевая допплер-эхокардиография. В противоположность предыдущей, эта методика позволяет определять скорость регионального движения миокарда. Анализируются низкочастотные, но при этом высокоамплитудные допплеровские сигналы, исходящие из миокарда. Допплеровские сигналы миокарда отличаются от сигналов кровотока существенно более низкими скоростями движения, но и значительно более высокой амплитудой движений.
Поэтому методика тканевой допплер-ЭхоКГ позволяет количественно оценить скорости движения миокарда. При добутаминовой стресс-ЭхоКГ допплеровский сигнал в области интактных сегментов демонстрирует существенное увеличение скорости движения миокарда. А в ишемизированных сегментах на фоне максимальной нагрузки добутамином отмечаются значимо меньшие скорости движения миокарда, чем в неишемизированных.
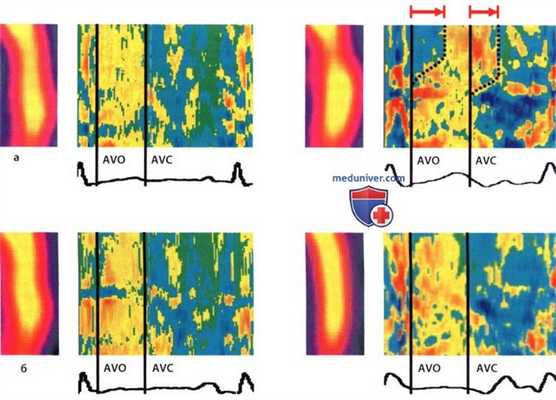
Перфузионная сцинтиграфия и режим оценки скорости деформации у пациента со стенозом ПМЖВ высокой степени.
Результаты обследования до ангиопластики (а) и после (б). Слева результат обследования в покое, справа - на фоне нагрузки.
До ангиопластики (а) нагрузочная сцинтиграфия демонстрирует дефект перфузии, а на изображении скорости деформации видна задержка сокращения соответствующего отдела миокарда (желтый цвет как признак запаздывания локального сокращения после закрытия аортального клапана: AVC).
Запаздывающее сокращение также обозначается как постсистолическое сокращение. После ангиопластики (б) дефект перфузии при сцинтиграфии не выявляется, а в режиме оценки скорости деформации нет задержки сокращения.
AVO - открытие аортального клапана, AVC - закрытие аортального клапана.
3. Режим оценки скорости деформации (strain rate). Однако возможности количественной оценки региональной функции миокарда - как с помощью цветокодированного анализа движений эндокарда, так и при использовании тканевой допплер-ЭхоКГ - ограничены. Ограничения эти возникают из-за смещений и вращений всего сердца целиком, что может приводить к искажению результатов регионального анализа движений миокарда. В так называемом режиме оценки скорости деформации («Strain Rate Imaging») определяются не абсолютные скорости движения миокарда, а различия в скоростях движения соседних точек миокарда.
При исследовании 44 пациентов была выявлена чуть большая диагностическая точность диагностики миокардиальной ишемии при использовании режима оценки скорости деформации, чем при традиционном анализе локальной сократимости. В рамках этого исследования лучшим параметром для идентификации индуцированной ишемии было признано отношение постсистолического укорочения миокарда к максимальной сегментарной деформации.
Дальнейшие исследования в будущем покажут, насколько эти методики могут быть применены в клинической практике для количественной оценки результатов стресс-ЭхоКГ.
а) Физические основы. Доступность современных ультразвуковых контрастных средств привела к целому ряду фармакологических и технических усовершенствований, открывших эхокардиографии совершенно новые перспективы в диагностике и терапии. Контрастспецифические визуализирующие методики позволяют селективно отображать сигналы от контрастного средства и могут надежно подавлять тканевые сигналы, даже от подвижных структур, таких как сердце. Новые алгоритмы используются как для эмиссии ультразвуковых волн, так и для регистрации и обработки сигналов, отраженных от тканей и контрастного средства. Описанные в отдельных статьях визуализирующие методики основаны на различных волновых свойствах микросфер контрастного средства в зависимости от энергии ультразвука.
Рисунок ниже поясняет эти характерные волновые свойства микросфер контрастного средства при различном уровне ультразвуковой энергии. Дополнительно на рисунке показано, что довольно высокий процент микросфер контрастного средства может быть изменен и даже разрушен уже при низких уровнях ультразвуковой энергии. Как раз эти свойства контрастных микросфер принципиально отличаются от отражающих свойств тканей и являются основой для новых стратегий визуализации и терапии, описываемых в статьях на сайте.
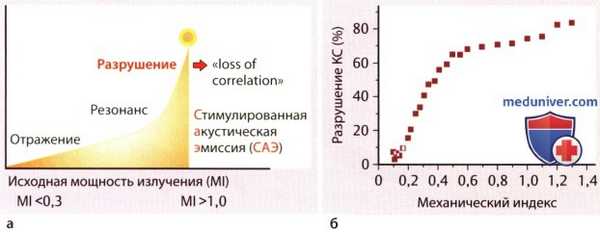
Влияние ультразвуковой энергии на контрастное средство:
а - Влияние энергии ультразвука (механический индекс, MI) на отражательные свойства контрастного средства.
б - Процент разрушения контрастного средства Дефинити в зависимости от MI.
б) Молекулярное построение изображения:
1. Принцип. Благодаря стабилизации оболочки и газового ядра ультразвуковые контрастные средства 2-го поколения можно рассматривать как строго внутрисосудистые усилители сигнала, чье поведение в потоке сходно с поведением эритроцитов. Это позволяет визуализировать сосуды вплоть до микроциркуляторного русла. Многочисленные коллективы занимались вопросом, возможно ли наряду с качественным и количественным анализом макро- и микроциркуляции при помощи модификации микросфер контрастного средства прийти к «таргетному» или даже молекулярному построению изображений. Рисунки ниже демонстрируют примеры таких возможных модификаций, превращающих нормальный микропузырек контрастного средства в так называемый «нацеленный» или «таргетный» («targeted-microbubble»). Основной принцип этих изменений заключен в варьировании оболочки микросферы.
Для этого в оболочку контрастного средства вводятся, например, носители заряда (положительный или отрицательный заряд), биотиновые или стрептовидинбиотиновые комплексы или даже целые комплексы антител.
При помощи соединения с биотином (В) ультразвуковые контрастные средства могут специфически связываться с помеченным антителами эпитопом (цель - target) (см. текст). Перенос медикаментов или генов через модифицированные микропузырьки. Изображенные синим цветом вещества переносятся на оболочке, в оболочке или внутри оболочки, а в нужном месте высвобождаются при разрушении пузырьков. «Пузырек» дополнительно имеет антитела на своей поверхности, позволяющие целенаправленно связываться с антигеном (targeting) перед высвобождением содержимого.
2. Диагностика атеросклероза. В одной из более ранних работ коллектив исследователя Villanueva показал, что возможно присоединение к микропузырькам моноклональных антител к молекуле внутриклеточной адгезии (ICAM-1) (44). ICAM-1 является представителем группы лейкоцитарных молекул адгезии (LAM). Увеличенная экспрессия LAM является специфическим показателем начинающейся эндотелиальной дисфункции. При целенаправленном обнаружении IСАМ-1 на эндотелиальных клетках при помощи микропузырьков, покрытых антителами анти-ICAM-1, впервые был создан ультразвуковой инструмент для ранней диагностики атеросклероза. В модели на животных была изучена и другая важная область применения этой визуализирующей стратегии (также с позитивными результатами): диагностика острой реакции отторжения после трансплантации сердца.
3. Диагностика воспаления. В области диагностики воспалительных реакций Linder и соавт. впервые показали, что микропузырьки задерживаются в месте воспаления. Это происходит из-за связывания микропузырьков с лейкоцитами и из-за их фагоцитоза лейкоцитами. При этом микропузырьки сохраняют свои акустические свойства. При включении фосфатидилсерина в липидную оболочку микропузырьков этот эффект можно усилить. Тем самым создается интересная область применения в сфере сердечно-сосудистых заболеваний, особенно в диагностике постишемических воспалительных реакций миокарда, но, возможно, и в диагностике миокардита. Та же группа при помощи ЭхоКГ с лейкоцит-таргетным контрастным средством впервые продемонстрировала возможность неинвазивной визуализации реперфузионного повреждения миокарда. Schumann и соавт. показали улучшение детекции тромбов при использовании GP-IIb/IIIа-специфических лигандов в оболочке микропузырьков.
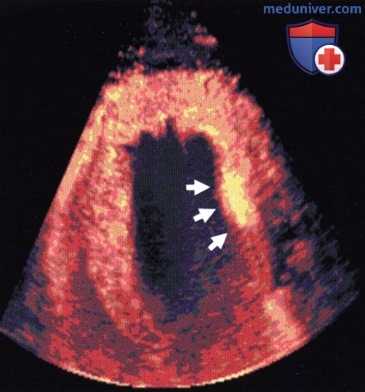
Маркировка статичных лейкоцитов в сердце свиньи через 20 мин после инъекции. Контрастное средство обнаруживается только в миокарде (стрелки: очаг постишемического воспаления).
4. Маркировка целевых областей и отдельных клеток. Рисунок ниже демонстрирует наиболее интересную для исследований возможность маркировки целей при помощи комплексов биотина с антителами. При этом сначала комплекс биотин-антитело связывается с эпитопом целевой области. Последующее добавление биотина (шаг 2) позволяет биотинилированным микросферам контрастного средства связываться с целевой областью. Из-за большого количества доступных антител, особенно для моделей на морских свинках, здесь имеется интересная возможность для применения исследовательских результатов; первые подобные контрастные средства уже находятся в стадии клинического тестирования.
Наряду с маркировкой фиксированных целевых областей можно помечать и отдельные клетки. Здесь принципиально возможным является маркировка клеток ex vivo. Это особенно справедливо для фагоцитирующих клеток, которые можно будет обнаруживать в организме при периферическом внутривенном введении. Точно так же при помощи лигандов создается возможность для специфической маркировки клеток в кровотоке. В научных публикациях эти методики обозначаются как «cell tracking» (отслеживание клеток) и «cell trafficing» (изучение движения клеток) и важны для исследования воспалительных реакций, а также в большой области заместительно-клеточной терапии (исследование стволовых клеток). При этом становится возможным (особенно в модели на животных) неинвазивное отслеживание отдельных клеток в организме с высоким пространственным разрешением. Это удается потому, что высокая чувствительность и специфичность сигналов от контрастного средства позволяет визуализировать даже отдельные микросферы контраста.
в) Использование тканевых эффектов микропузырьков:
1. Кавитация. Дискуссия о потенциальных биологических эффектах ультразвука так же стара, как и сам метод. Кроме нагревания тканей ультразвуковыми волнами, особенную роль в этом играют эффекты кавитации. Термин «кавитация» обозначает образование в жидкости при пониженном давлении пузырьков газа. Такая область пониженного давления может возникнуть при ультразвуковом облучении в отрицательную фазу волны, когда локальное давление ультразвука становится достаточно низким, чтобы растворенный в крови газ переходил в газообразное состояние. Подобно тому, как это бывает в технике (например, при использовании гребных винтов кораблей), при схлопывании этих газовых пузырьков может повреждаться ткань. При диагностическом использовании ультразвука его энергия удерживается на таком низком уровне, что повреждения клеток не возникают.
Но этот биологический эффект может быть более выраженным при введении микросфер ультразвукового контрастного средства в случае достаточно высокого акустического давления и при использовании соответствующим образом построенных ультразвуковых импульсов. Skyba и соавт. показали in vivo (в экспериментах на животных), что при внутривенном введении контрастного средства и облучении ультразвуком можно вызвать повреждение капилляров. Другие группы в опытах на морских свинках при использовании ультразвука с нефизиологически высокой энергией наблюдали повреждения капилляров миокарда при инфузии контрастного средства.
2. Индукция артериогенеза. Однако этот нежелательный биологический эффект, не возникающий при диагностическом использовании ультразвуковых контрастных средств с обычными в клинической практике дозами контраста, может быть использован в терапевтических целях. Song и соавт. показали, что индуцированная ультразвуком деструкция контрастных микросфер в скелетной мышце крысы может вызвать артериогенез. При этом сознательно повреждались сосуды скелетной мышцы при помощи облучения ультразвуком после введения контрастного средства. Одну и две недели спустя после вмешательства у обработанных животных была обнаружена значительно повышенная плотность капилляров. Для объяснений механизма этого артериогенеза Yoshida и соавт. обнаружили повышенное количество воспалительных клеток после таргетной ультразвуковой терапии пузырьками и повышенную продукцию ФРЭС (фактора роста эндотелия сосудов). Индукция этих воспалительных реакций была объяснена как следствие опосредованного ультразвуком повреждения капилляров и повышения оксидативного стресса в окружающих тканях.
В хронической модели ишемии на задней лапе животного был обнаружен неоангиогенез, что привело к значительно более высокой толерантности к нагрузке, так что авторы постулировали возможное применение этой методики в области рефрактерного к лечению терминального артериосклероза.
Imada и соавт., кроме того, показали, что индуцированная ультразвуком деструкция контрастного средства в комбинации с трансплантацией стволовых клеток костного мозга может индуцировать усиление регионального ангиогенеза и артериогенеза. Еще одну возможную область применения прямого действия ультразвука предложили Fitzgerald и соавт. Они показали, что облучение сосудистых стентов приводит к уменьшению неоинтимальной гиперплазии. Эта методика также еще находится на ранней экспериментальной стадии.
г) Сонотромболизис. Уже в 1995 г. Tachibana и соавт. показали, что в экспериментальной модели тромбоза при введении ультразвукового контрастного средства и одновременном облучении ультразвуком разрушение тромба в рамках урокиназного лизиса происходит гораздо быстрее. Mizushige и соавт. на той же модели показали, что для этой терапии особенно подходят новые контрастные средства (2-го поколения). Culp и соавт. в 2003 г. сообщили, что в экспериментах на животных при тромбозированных артериовенозных диализных шунтах после введения ультразвукового контрастного средства и применения нового терапевтического ультразвукового датчика можно было произвести сонотромболизис в шунте и реканализацию во всех случаях острого тромбоза шунта.
1. Инфаркт головного мозга. В первом небольшом клиническом исследовании Eggers и соавт. показали, что у пациентов в острой стадии инсульта, которым был противопоказан тромболизис RTPA (рекомбинантным тканевым активатором плазминогена), одночасовое прерывистое облучение ультразвуком привело к значительно лучшей реперфузии, чем в контрольной группе без лечения. Отсюда авторы сделали заключение, что наряду с улучшением тромболизиса (например, RTPA) от этой методики могут выиграть пациенты с противопоказаниями к традиционному тромболизису. Daffertshofer и соавт. также подтвердили эти результаты в экспериментах на животных и показали лучшую эффективность RTPA-лизиса, что выразилось в меньшем объеме инфаркта. При этом индукция ультразвуком кровотечений не отмечалась.
2. Инфаркт миокарда. Cohen и соавт. при исследовании ретеплазного и тенектеплазного лизиса у пациентов с инфарктом миокарда показали преимущество его сочетания с одновременным чрескожным облучением ультразвуком. В этом исследовании использовался аппарат с низкочастотными ультразвуковыми импульсами, наносившимися через укрепленный на коже грудной клетки датчик. В этом исследовании не было описано никаких побочных явлений. Разработанный прибор в настоящее время находится на стадии клинического тестирования. С точки зрения авторов именно такая методика имеет перспективу на быстрый успех, поскольку без проблем может быть встроена в рутинную схему лечения.
д) Сонопорация:
1. Принцип. Таргетная и локально-региональная доставка веществ и, тем самым, локально-региональная терапия является предметом многочисленных научных усилий с использованием самых различных таргетных носителей. Хотя липосомы, церамиды и другие вещества могут в принципе проникать через эндотелий сосудов, но их нацеленное применение возможно лишь в ограниченной степени. Ультразвуковые контрастные средства впервые дают возможность преодолеть эти ограничения. При так называемой сонопорации фармакологически действенные молекулы или медикаменты при помощи опосредуемых ультразвуком эффектов могут проникать через клеточную мембрану и высвобождаться в заданной целевой области. Точный механизм сонопорации до сих пор не ясен. Однако в записях с высокой частотой кадров было показано, что при взрывах микросфер контрастного средства из газовых пузырьков выходят так называемые «микроструи» («microjets») или «микропар» («micro-streamings»). Фотографии на растровом электронном микроскопе сонопорированных клеток показали наличие в клеточной мембране временных микропор, через которые активно или пассивно медикаменты переходят в цитозоль.
Price с соавт. показал принципиальную применимость этой методики с использованием флуоресцирующих полимерных микросфер с диаметром в 205 и 503 нм.
2. Повышенное локально-региональное усвоение веществ. При одновременном введении микросфер ультразвукового контрастного средства и «фактора роста эндотелия сосудов» («vascular endothelial growth factor», VEGF) было показано более чем 10-кратное повышение усвоения VEGF при одновременном облучении ультразвуком и введении контрастных микросфер. Bekerdjan и соавт. показали органоспецифический локально-региональный перенос флуоресцирующих протеинов в кардиальные структуры. Mehier-Humbert и соавт. постулировали, что сонопорация вызывает появление временных микропор, нанося клетке сублетальное повреждение. Авторы показали, что индуцированные микропоры обнаруживаются лишь в течение очень короткого времени (от миллисекунд до нескольких секунд). В области терапии опухолей в опытах на животных уже были изучены первые применения локальнорегиональной химиотерапии. В одной из новых работ при помощи сонопорации после внутривенного введения доксорубицина была обнаружена значимо повышенная концентрация препарата в сосудистой стенке венозных шунтов в бассейне сонной артерии. Тем самым была уменьшена гиперплазия интимы.
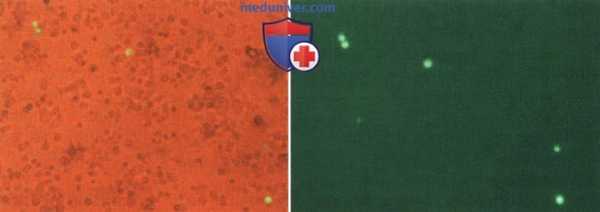
Доказательство экспрессии генов после опосредованной ультразвуком трансфекции (сонопорации) плазмидной ДНК, кодированной на флуоресцирующий белок (eGFP), в клеточной культуре.
Через 36-48 ч после облучения ультразвуком белок (флуоресценция) обнаруживается во флуоресцентном микроскопе как специфическое доказательство трансфекции.
Эта методика имеет значительный потенциал в рамках невиральной генной терапии.
д) Генная терапия:
1. Локальная невиральная генная терапия. Teupe и соавт. и наша собственная рабочая группа показали в первых исследованиях in vitro, что при помощи сонопорации можно переносить не только медикаменты или даже протеины, но и производить трансфекцию плазмидной ДНК при помощи разрушения в клетках микропузырьков, содержащих плазмиды. В эксперименте была произведена трансфекция LacZ-кодирующей плазмидной ДНК, а также плазмиды, кодированной eNOS. Была доказана как успешная экспрессия, так и эффективность генного продукта. Эту новую терапевтическую стратегию можно обобщить термином «локальная невиральная генная терапия», и она представляет собой новую интересную форму применения генных конструктов. Важными преимуществами по сравнению с виральной генной трансфекцией являются отсутствие иммуногенности и локально-региональное применение. Рабочая группа под руководством Grayburn показала высокую эффективность миокардиальной трансфекции. На данный момент, кроме трансфера плазмидной ДНК, уже был продемонстрирован трансфер «малой интерферентной РНК» («small interference RNA», siRNA). Тем самым становится возможным не только стимулировать экспрессию генов, но и целенаправленно подавлять экспрессию определенного белка в заданной целевой области.
2. Применение фокусированного ультразвука. Современные ультразвуковые методики, например такие, как высокоинтенсивный фокусированный ультразвук (High Intensity Focused Ultrasound, HIFU), могли бы играть особенную роль в клинических условиях. В настоящее время проводится интенсивная работа над новыми конструкциями, при помощи которых можно было бы успешно стимулировать поступление препаратов, белков, трансфицировать плазмидные ДНК/siRNA или даже вирусные частицы. Ценность этих новых методик, особенно на фоне возможных повреждений тканей, еще следует определить. Но поскольку при помощи фокусированного ультразвука биологические эффекты, возникающие при сонопорации, можно ограничит ь очень малыми целевыми объемами, в конечном итоге успех этих новых методических разработок зависит от развития эффективных конструкций.
Практическое применение контрастной эхокардиографии миокарда
а) Информативные ультразвуковые методики. Для контрастной ЭхоКГ миокарда следует использовать контраст-специфические ультразвуковые методики.
В режиме второй гармоники, обычно используемом сегодня в двумерной ЭхоКГ, отображаемая на мониторе интенсивность сигнала всегда является суммой эхогенностей крови и ткани. Поскольку сосуды составляют примерно 5% от объема миокарда, то эффект контрастирования миокарда после внутривенного введения ультразвукового контрастного средства невелик и непригоден для клинической диагностики. При помощи контрастспецифических ультразвуковых методик (пульс-инвертированная методика, энергетическая пульс-инвертированная методика, энергетическая допплер-ЭхоКГ, режим каденции, режим 1,5-гармоники) можно практически до нуля редуцировать интенсивность сигнала от ткани.
При этом будут отображаться исключительно структуры, содержащие ультразвуковое контрастное средство. Визуализируется очень интенсивный сигнал от полостей сердца и более слабое прокрашивание миокарда. Часто эпикардиальный край контрастируется несколько сильнее по причине эпикардиально расположенных сосудов. Исследование миокардиальной перфузии может проводиться как в режиме реального времени (realtime), так и с помощью облучения короткими импульсами - в определенной триггерной точке сердечного цикла.
Методики, специфические для контрастной ЭхоКГ, например режим каденции (Cadence Imaging): без использования контрастного средства (слева) видны лишь отдельные шумовые сигналы, а во время внутривенной инфузии 1 мл/мин Соновью достигается интенсивное контрастирование левого желудочка и менее выраженное окрашивание миокарда (апикальная позиция по длинной оси). Низкоэнергетическая (realtime) методика для контрастной ЭхоКГ миокарда: непрерывное введение контрастного средства и непрерывное облучение с низкой энергией ультразвука приводят к гомогенному контрастированию миокарда (а), кратковременное облучение с более высокой энергией сначала приводит к выраженному повышению эхогенности (б) и затем к разрушению контрастного средства в данном слое миокарда (в). В полостях сердца также происходит частичное разрушение, которое, однако, не приводит к существенному изменению изображения.
Если затем продолжается облучение с низкой энергией ультразвука, то при нормальной перфузии прокрашивание миокарда контрастным средством восстанавливается за 1-2 с (г).
1. Низкоэнергетические методики. При снижении исходной мощности излучения датчика (механический индекс 0,05-0,3) можно настолько снизить разрушение микропузырьков в облучаемом поле, что становится возможным непрерывное облучение. В то время как сама миокардиальная ткань при низкой мощности излучения почти не отражает ультразвуковые волны, сигналы от контрастного средства в миокарде, как правило, хорошо распознаются. Для того чтобы оценить кинетику потоков контрастного средства в миокарде, производится разрушение контрастного средства в исследуемой плоскости при помощи кратковременного повышения исходной мощности излучения до обычного для двумерной ЭхоКГ уровня (механический индекс >1,0), после чего оценивается время повторного притока контраста.
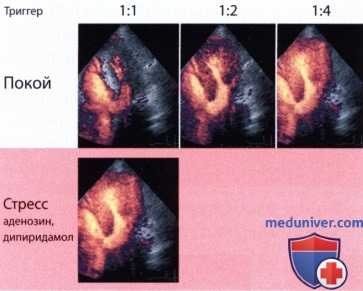
Высокоэнергетическая методика для контрастной ЭхоКГ миокарда. Облучение происходит через определенные промежутки времени для записи отдельных кадров, что приводит к быстрому разрушению микропузырьков, но и к интенсивному сигналу от контрастного средства. Триггерной точкой обычно выбирается конец систолы или конец диастолы. При использовании протокола с аденозином или дипиридамолом выбирается триггер 1/1, т.е. на каждый сердечный цикл производится одно кратковременное облучение. Таким образом время для притока микропузырьков в облучаемую зону миокарда равно одному сердечному циклу. Этого оказывается достаточно для нормального миокарда в состоянии гиперемии.
Если же перфузия миокарда ограничена, то соответствующие зоны остаются темными. В покое миокардиальный кровоток значительно медленнее. Здесь требуется выбрать более долгий интервал, чтобы добиться полноценного контрастирования миокарда (пауза между двумя высокоэнергетическими кадрами составляет 4-6 сердечных циклов).
2. Высокоэнергетические методики. В этом случае используются ультразвуковые колебания с обычной для двумерной ЭхоКГ энергией, что приводит к быстрому разрушению микропузырьков в плоскости исследования. Преимущества «высокоэнергетической» методики заключаются в более высоком соотношении сигнал-шум в сравнении с «низкоэнергетическими». Высокоэнергетические методики используют специфические сигналы, возникающие при разрушении ультразвукового контрастного средства.
Особенно быстро разрушаются микропузырьки, наполненные воздухом, такие как Левовист или Кардиосфера. Эти контрастные средства могут быть разрушены за короткое время, необходимое для построения одного кадра. Постоянное облучение при использовании высокоэнергетических методик невозможно; им требуется периодическая регистрация в специальный «триггерный» момент времени. Для этого в конце диастолы или в конце систолы регистрируется один или несколько кадров. Облучение необходимо постоянно прерывать, чтобы обеспечить приток контрастного средства из соседних слоев. Перерывы в облучении должны быть тем дольше, чем медленнее притекает к миокарду контрастное средство. Поэтому и при высокоэнергетических методиках можно оценивать кинетику притока контрастного средства: чем короче интервал до восполнения контраста в миокарде, тем лучше миокардиальная перфузия.
б) Нормальная перфузия миокарда:
1. Контрастирование миокарда. При использовании контрастспецифических ультразвуковых методик после внутривенного введения контрастного средства, проходящего через легочный круг, возникает гомогенное прокрашивание отделов миокарда. Обнаружение миокардиального контрастирования указывает на интактное микроциркуляторное русло и, тем самым, на жизнеспособный миокард. Но для отнесения данного сегмента в группу «нормально перфузируемого миокарда» дополнительно требуется еще определенный уровень потока контрастного средства в миокарде. Количественная оценка миокардиального кровотока хотя и возможна, но в клинической практике является слишком утомительной и до сих пор недостаточно воспроизводимой.
2. Гиперемия миокарда. Кроме того, миокардиальный поток в покое очень вариабелен и даже при коронарном стенозе высокой степени часто не снижен. Поэтому оценка «нормальности» миокарда лучше всего производится в состоянии максимальной миокардиальной гиперемии. Гиперемию миокарда проще всего вызвать вазодилататором (аденозин, дипиридамол).
Кинетика притока контрастного средства в миокард после целенаправленного разрушения микропузырьков: в покое (прерывистая линия) возобновление контрастирования наблюдается лишь спустя 4 сердечных цикла, т.е. интенсивность сигнала достигает видимого (красного) диапазона. При введении аденозина (сплошная линия) приток контраста происходит значительно быстрее, и уже через один сердечный цикл контрастное средство визуализируется в миокарде. H-PDI - энергетическая гармоническая допплерография. Нормальная перфузия миокарда, внутривенная инфузия 0,8 мл Соновью, режим модуляции энергии: слева - регистрация вскоре после разрушения контрастного средства в миокарде, справа -через 1 с полноценное и гомогенное контрастирование миокарда.
3. Оценка миокардиального кровотока. Миокардиальный кровоток оценивается на основании скорости микропузырьков, которые вместе с кровью пассивно перемещаются через миокард. Лучше всего удается оценить миокардиальный кровоток во время внутривенной инфузии контрастного средства. После целенаправленного разрушения контрастного средства в миокарде можно исследовать приток контрастного средства в миокард. При максимальной гиперемии приток контраста из относительно больших сосудов в микроциркуляторное русло происходит за 1-2 с.
4. «Низкоэнергетические» методики. В случае «низкоэнергетических» методик производится кратковременное облучение ультразвуком с мощностью, обычной для двумерной ЭхоКГ. В результате разрушается контрастное средство, находящееся в плоскости сканирования. Время до повторного прокрашивания миокарда коррелирует со скоростью кровотока в микроциркуляторном русле.
5. «Высокоэнергетические» методики. В случае «высокоэнергетических» методик оценка скорости потока проще: в каждый сердечный цикл происходит однократное облучение для регистрации лишь одного кадра. После кратковременного облучения, которое всегда приводит к разрушению контрастного средства, в течение одного сердечного цикла имеется время для притока контраста. Если за этот период восстанавливается контрастирование миокарда, то при использовании микропузырьков, наполненных азотом, можно говорить о нормальной перфузии.
УЗИ с эхоконтрастированием
Одним из самых перспективных методов исследования в лучевой диагностике сегодня является ультразвуковое исследование контрастным усилением.
О том, какие возможности открывает технология эхоконтрастирования, об особенностях и достоинствах этого метода, рассказывает Андрей Владимирович Мищенко, д.м.н., заведующий отделением лучевой диагностики ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.

Что такое УЗИ с эхоконтрастом? Чем оно отличается от обычного УЗИ?
Благодаря использованию контрастного вещества в УЗ-исследовании появились новые возможности. В первую очередь ультразвуковое исследование с контрастным усилением предназначено для оценки васкуляризации, то есть кровоснабжения того или иного органа или структуры. Повышенная васкуляризация – это один из признаков злокачественных новообразований.
Если раньше о васкуляризации можно было судить только на основании доплеровских исследований, то теперь уже на первичном этапе дифференциальной диагностики мы можем по характеру васкуляризации предполагать доброкачественный или злокачественный характер изменений, понять есть ли кровоснабжение паталогической ткани. УЗИ с ЭК крайне важно и эффективно для выявления васкуляризированных участков, когда при обычном УЗИ на вид ткань есть, но нельзя сказать, растущая эта ткань, кровоснабжаемая, или фиброзная (плохо кровоснабжаемая – рубец).
Эхоконтрастирование очень помогает в определении масштаба поражения опухолевого процесса.
УЗИ с эхоконтрастом позволяет найти ответы на многие другие вопросы, не прибегая к иным методам лучевой диагностики: КТ, МРТ, ПЭТ-КТ – высокотехнологичным, но и обладающим определенным вредным воздействием на человека за счет рентгеновского, гамма-излучения, нефротоксичных контрастных препаратов.
На снимках наглядно видно отличие от обычного УЗИ:
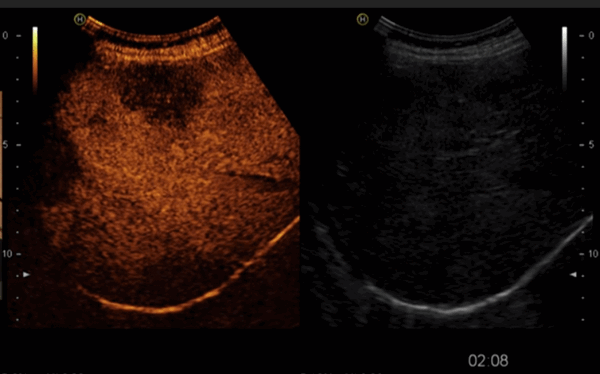
Режим эхоконтрастирования (слева) позволяет четко локализовать очаговое поражение печени.
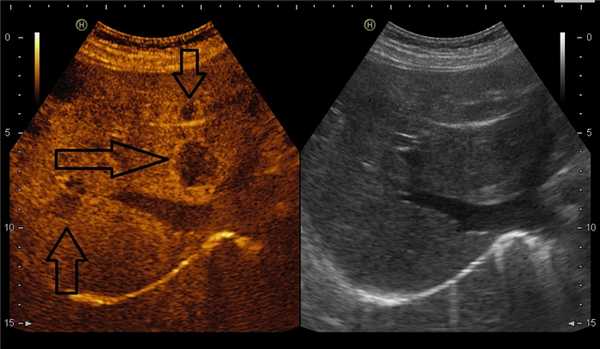
В режиме эхоконтрастирования (слева) четко видны метастазы в печени.
Какие эхоконтрастные препараты применяются для УЗИ?
Для контрастирования традиционно применяли раньше компьютерную томографию (КТ) или магнитно-резонансную томографию (МРТ). Контрастный препарат, используемый в КТ или МРТ, показывает и сосудистые структуры и их проницаемость. Соответственно, на изображении специалисту трудно понять — это так много сосудов в ткани или они так легко проницаемы.
Препарат же, используемый в УЗИ при контрастировании, отличается от тех, что применяют в КТ или МРТ. В УЗИ с эхоконтрастированием «свечение» препарата происходит только за счет сосудистого русла т.к. микропузырьки не выходят за пределы сосудистой стенки, не проникают в интерстиций (межклеточное пространство, которое составляет как бы остов большинства тканей).
Врач-диагност четко понимает, что микроциркуляторные сосуды находятся здесь в очень высокой концентрации. Чаще всего опухоль отличается по строению от нормального органа именно сосудистым руслом: либо это низкая концентрация сосудов на площадь, либо наоборот высокая.
Кто определяет целесообразность применения контрастирования?
Назначает исследование обычно врач-рентгенолог и ультразвуковой диагност, которые впервые сталкиваются с пациентом.
Благодаря научной литературе, конференциям и школам по лучевой диагностики, которые проводят специалисты нашего отделения, все больше врачей-онкологов понимают перспективность и преимущества этой технологии, и онколог на первичном приеме уже может рекомендовать сделать УЗИ именно с эхо-контрастированием, понимая, что ситуация сложная и она может быть разрешена только при эхо-контрастировании.
Чаще в ходе УЗ-исследования врач принимает решение, нужно ли продолжать и доводить методику сканирования до использования эхо-контрастирования, либо он получил уже всю необходимую информацию. При этом, врач ультразвуковой диагностики должен быть экспертом, понимать суть происходящих патологических процессов и постараться в заключении ответить на все вопросы, необходимые врачу-онкологу для принятия решений по назначению лечения. То есть, часто человека записывают на «простое УЗИ», а уже специалист определяет, есть ли необходимость делать УЗИ с контрастом.
Сколько по времени длится прием пациента при УЗИ с ЭК?
Стандартный прием УЗИ занимает не более 20 минут на одну зону сканирования. Формально, контрастирование незначительно увеличивает время приема еще на минут 5-10. Чаще необходимо приготовить кабинет к инъекции контрастного препарата, поэтому пациента просят подождать. Основное время врач-специалист УЗД тратит на специальный обсчет и анализ изображений уже без пациента.
Эхоконтрастирование – непростая процедура, требующая специального оборудования и навыков. Внутри раствора должны сформироваться микропузырьки газа, нужно подготовить специальный раствор с ними, проследить, чтобы они не разрушились, аккуратно хранить и ввести.


Для каких заболеваний эта методика исследования особенно эффективна?
Методика контрастирования в онокологической практике используется при поражениях различных огранов: печени, почек и мочевого пузыря, лимфатических узлов, щитовидной и молочной железы, матки, яичников, опухолей мягких тканей, также есть сведения об успешном применении эхоконтрастировния в исследовании предстательной и поджелудочной железы. Эти исследования в полном объеме проводятся и в НМИЦ онкологии имени Н.Н.Петрова.
УЗИ в гинекологии применяют реже, чем в других сферах. Мы осторожно подходим к новым технологиям. Перед использованием в рутинной практике, около года мы накапливали свой опыт исследований, а также внимательно изучали достижения европейских и американских специалистов. С помощью УЗИ с ЭК мы проверяем уже известные нам случаи и, таким образом, можем оценить эффективность новой техники. Сейчас в НМИЦ онкологии им. Н.Н. Петрова выполняется ультразвуковое исследование с контрастным усилением шейки матки, а также яичников и тела матки с целью дифференциальной диагностики и оценки распространённости опухолей.
Расскажите, пожалуйста, каковы области применения и перспективы развития этой методики в онкологии.
Области применения ультразвука с контрастным усилением:
- Диагностика
- Поликонтрастные свойства (УЗИ, МРТ-наночастицы, МР-спектроскопия по фосфору, флюоросцентная эндо-, микроскопия)
- Визуализация опухоли
- васкуляризация
- оценка распространенности (инвазия сосудов, других органов и структур)
- поражение лимфатических узлов
- Количественная оценка эффективности противоопухолевой терапии
- Оценка аблационных методов лечения и эмболизации
- Специализированные
- эндоУЗИ
- интраоперационные УЗИ
- Лечение
- Таргетная доставка лекарств и метаболитов
- Усиление HIFU-эффекта
На сегодняшний день применение УЗИ с эхоконтрастированием очень важно и эффективно для диагностики опухоли, оценке ответа на лечение, эффективности противоопухолевой терапии – как классического: хирургического, лучевого и химиотерапии, так и экспериментального малоинвазивного – аблации (крио-, лазеро-, радиочастотного, высокоинтенсивного ультразвука и др.)
Вопросы завтрашнего дня – это применение микропузырьковых растворов в лечении онкологических заболеваний – это таргетная доставка лекарств и метаболитов, усиление HIFU-эффекта. HIFU-терапия – это технология нового поколения, которая использует энергию ультразвуковых колебаний для лечения глубоко лежащих тканей.
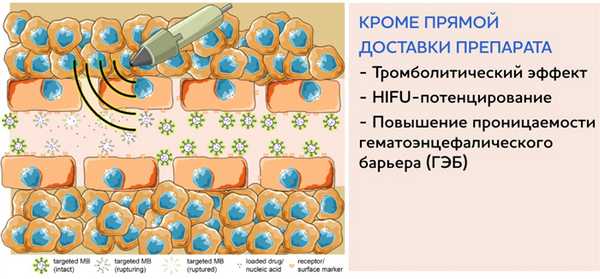
Другим перспективным свойством микропузырьковых растворов является их потенциальная возможность быть видимыми с помощью любых методов лучевой диагностики (КТ, МРТ, радионуклидная диагностика). Возможно, это тоже найдет свое воплощение в будущем.


Авторская публикация:
Мищенко Андрей Владимирович
доктор медицинских наук, зав.отделением лучевой диагностики
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Читайте также:
- Подкожный разрыв ахиллова сухожилия: атлас фотографий
- Влияние тромболизиса на летальность. Анализ эффективности тромболизиса при инфаркте миокарда
- Опухоли полости рта. Опухолеподобные поражения полости рта.
- Медикаментозно-обусловленная патология миокарда. Лекарственная патология сердца.
- Предраковые состояния желудка - диагностика кишечной метаплазии
