Поддержание осмотического равновесия. Осмотическое равновесие сред организма
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Водно – солевой обмен – совокупность процессов распределения воды и минеральных веществ между вне – и внутриклеточным пространством и внешней средой. Обмен воды связан с обменом солей. Распределение воды связан с осмотическим давлением. От количественного и качественного состава минеральных веществ в жидкости организма зависит протекание всех важных процессов. Поддержание постоянства осмотического, объемного и ионного равновесия жидкостей организма с помощью рефлекторных механизмов – водно – электролитный гомеостаз. Вода в организме присутствует 2 видов:
экзогенная (поступающая извне)
эндогенная (образующаяся при окислении жиров)
Функции воды:
часть протоплазмы клеток и тканей (тело состоит на 65% из воды)
растворяет и переносит вещества
участвует в реакциях обмена
уменьшает силу трения
участвует в терморегуляции
обеспечивает эластичность тканей
входит в состав пищеварительных соков
Суточная потребность в воде – 40 мл на каждый кг массы (2 – 3 литра). Соотношение между водой, поступившей в организм и выделившейся из него – водный баланс. Органы, выделяющие воду – почки, легкие, кожа, кишечник. Для организма важно, чтобы приход воды покрывал расход. Уменьшение воды на 10% - обезвоживание (гипогидратация), на 20% - приводит к смерти.
Минеральные соли поступают в организм с пищей и водой за исключением поваренной соли. Функции минеральных солей:
биологические постоянные гомеостаза
создают и поддерживают осмотическое давление крови
поддерживают pH крови – 7,36 – 7,42
участвуют в ферментативных реакциях
участвуют в водно – солевом обмене
принимают участие в процессах возбуждения, торможения, мышечного сокращения, свертываемости крови
являются составной частью костей, гемоглобина, пищеварительных соков
Виды минеральных солей:
макроэлементы (натрий, магний, калий, кальций, фосфор, хлор)
микроэлементы (железо, марганец, кобальт, цинк, фтор, йод) – необходимы в очень небольших количествах
Натрий поступает в организм в виде поваренной соли – это единственная соль, которую добавляют к пище. Суточная потребность в натрии – 15 гр. Натрий участвует в поддержании осмотического равновесия, влияет на рост, регулирует работу сердечной мышцы. Дефицит натрия приводит к слабости, апатии, подергиванию мышц.
Калий поступает в организм с овощами, фруктами и мясом. Суточная потребность – 2 гр. Он регулирует сердечный ритм и поддерживает АД, автоматизм сердечной мышцы, важен для питания клеток, деятельности мышц, поддержания водно – солевого баланса, нейроэндокринной регуляции. Поддерживает осмотическое давление, стимулирует образование ацетилхолина. Дефицит калия приводит к слабости, сонливости, нарушению рефлексов. Увеличение калия может привести к остановке сердца.
Хлор поступает в организм виде поваренной соли. Участвует в поддержании осмотического давления крови, входит в состав соляной кислоты желудочного сока.
Кальций поступает в организм с молочными продуктами (особенно сырами), зеленью. Это важная константа крови, входит в состав костей (9 – 11 мг/ %).
В организме взрослого человека содержится 1-2 кг кальция, из них 99% входит в состав костной и хрящевой тканей, остальное содержится в мягких тканях и межклеточной жидкости. Уменьшение кальция приводит к кальциевой тетании и смерти в результате прекращения дыхания. Он необходим для процесса свертывания крови. Кальций уменьшает проницаемость клеточных мембран, активирует амилазу и липазу, стимулирует работу миокарда, способствует выведению свинца из костной ткани, играет во всех стадиях свертывания крови, оказывает антистрессовое воздействие, выводит тяжелые металлы, радионуклиды, обладает антиаллергическим действием. Он играет важную роль в сокращении мышц, снижает риск высокого АД, гипертонии беременных, рождения недоношенных детей, предохраняет от рака матки, поджелудочной железы и толстой кишки. Суточная потребность – 0,8 гр.
Магний оказывает влияние на тонус мышечной оболочки сосудов, снимает спазмы, понижает АД, снижает уровень холестерина в крови. Дефицит вызывает нарушения в эмоциональной сфере, он незаменим для профилактики стресса и синдрома хронической усталости. Суточная дозировка – 500 мг.
Медь участвует в синтезе коллагена и эластина, защищает от свободных радикалов, участвует в синтезе гемоглобина, необходима для усвоения железа, участвует в кроветворении, обладает противовоспалительным действием, необходима для вынашивания плода. Суточная дозировка 20 мг. Дефицит приводит к преждевременному старению кожи и сосудов, повышению уровня холестерина, инсультам, задержке полового развития и бесплодию.
Цинк (микроэлемент) входит в состав ферментов, укрепляет иммунитет, стимулирует работу всей гормональной системы, поджелудочной железы, стимулирует синтез гормона роста, тестостерона. Отвечает за обоняние, зрение, вкус и необходим для заживления ран. Цинк участвует в синтезе и сохранении инсулина. Суточная дозировка 200 мг. Дефицит приводит к снижению иммунитета, аппетита, анемии, аллергии и дерматиту, нарушению половых функций у мужчин. Содержится в семенах тыквы и подсолнечника.
Железо поступает в организм с мясом, печенью и бобовыми. Суточная потребность – 15млг. Является составной частью гемоглобина и дыхательных ферментов. В организме содержится 3 гр железа. Дефицит железа приводит к малокровию.
Йод поступает в организм с водой, протекающей через горные породы и обогащающийся там йодом. Также он может поступать с йодированной солью или морепродуктами. Суточная потребность – 0,03 мг. Участвует в синтезе гормонов щитовидной железы. Дефицит приводи к возникновению зоба.
Хром необходим для нормальной жизнедеятельности сосудов и сердечной мышцы, активности инсулина, способствует снижению уровня холестерина крови. Дефицит приводит к апатии и быстрому утомлению. Суточная дозировка – 200 мкг.
Марганец входит в состав ферментов, участвует в реакциях иммунитета, стимулирует процессы мышления, кроветворения и тканевого дыхания. Суточная дозировка – 10 мг. дефицит приводит к переутомлению, снижению внимания, памяти, нарушению сна, сахарному диабету и новообразованиям косвенно.
Кремний важен для поддержания стенок сосудов (придает прочность, эластичность и проницаемость). Дефицит приводит к инсультам и кровоизлияниям.
Селен – важнейший из микроэлементов. Он обладает защитным действием для организма – продлевает жизнь. Предохраняет от рака, стимулирует иммунитет, является антиоксидантом, способствует росту и развитию организма. Дефицит приводит к
Поддержание осмотического равновесия. Осмотическое равновесие сред организма
Соотношение между осмотическим давлением и осмолярностью. Осмолярность жидких сред организма
Осмотическое давление раствора прямо пропорционально концентрации растворенных в нем частиц. Это справедливо для растворенных веществ как с большим, так и малым размером молекул. Например, одна молекула альбумина с молекулярной массой 70000 создает такой же осмотический эффект, как одна молекула глюкозы, молекулярная масса которой равна 180. Одна молекула NaCl, однако, обладает двумя осмотически активными частицами: ионами Na+ и Cl-, осмотический эффект которых (по сравнению с альбумином или глюкозой) в 2 раза выше, поэтому осмотическое давление раствора пропорционально его осмолярности — мере концентрации растворенных частиц.
В соответствии с правилом Вант-Гоффа осмотическое давление (π) можно рассчитать по формуле: π = CRT, где С — концентрация растворенного вещества в осмолях на литр, R — универсальная газовая постоянная и Т — температура в градусах по Кельвину (273° + температура по Цельсию). Если π выражается в общепринятых для биологических жидкостей единицах — миллиметрах ртутного столба, Т соответствует нормальной температуре тела (273° + 37° = 310° по Кельвину), рассчитанное значение π для раствора 1 осм/л составит 19300 мм рт. ст. Это значит, что для концентрации 1 мосм/л π равно 19,3 мм рт. ст. Таким образом, каждый миллиосмоль трансмембранного градиента концентрации создает осмотическое давление 19,3 мм рт. ст.
а) Расчет осмолярности и осмотического давления раствора. Предполагая, что мембрана непроницаема для растворенного вещества, можно рассчитать возможное осмотическое давление раствора, используя правило Вант-Гоффа. Например, осмотическое давление 0,9% раствора NaCl рассчитывают следующим образом: 0,9% означает, что 100 мл раствора содержит 0,9 г NaCl, или 9 г/л. Поскольку молекулярная масса NaCl составляет 58,5 г/моль, молярность раствора составит: 9 г/л разделить на 58,5 г/моль, или 0,154 моль/л. Поскольку каждая молекула NaCl эквивалентна 2 осмолям, осмолярность раствора составит: 0,154x2, или 308 мосм/л. Следовательно, осмолярность раствора равна 308 мосм/л. Возможное осмотическое давление раствора составит: 308 мосм/л х 19,3 мм рт. ст., или 5944 мм рт. ст.
Данный расчет является приблизительным, поскольку в растворе вследствие сил межионного взаимодействия между ионами Na+ и Сl- нет полной независимости. Теоретически рассчитанное с помощью правила Вант-Гоффа значение следует скорректировать с учетом поправки, носящей название осмотического коэффициента. Для NaCl он равен 0,93. Следовательно, реальное значение осмолярности 0,9% раствора NaCI составит 308x0,93, или 286 мосм/л. На практике при определении осмолярности и осмотического давления растворов, используемых для инфузий, поправкой на осмотический коэффициент иногда пренебрегают.
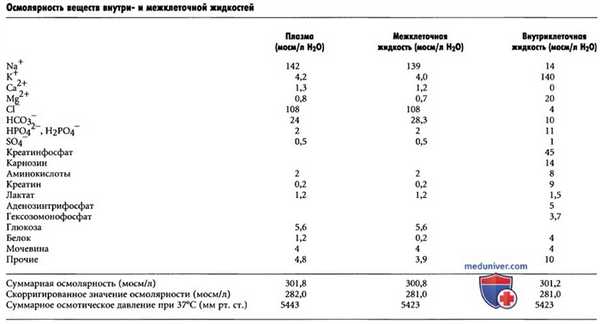
б) Осмолярность жидких сред организма. В таблице выше, обратим внимание на приблизительные значения осмолярности различных веществ, растворенных в плазме, межклеточной и внутриклеточной жидкостях. Отметим, что около 80% всей осмолярности межклеточной жидкости обусловлены ионами Na+ и Cl-, тогда как во внутриклеточной жидкости почти половина осмолярности создается ионами К+, а оставшаяся часть распределена между ионами других веществ.
Как видно из таблицы выше, суммарная осмолярность каждой из трех основных жидкостей организма составляет около 300 мосм/л. По сравнению с межклеточной и внутриклеточной жидкостями осмолярность плазмы на 1 мосм/л выше. Это небольшое различие обусловлено белками, которые поддерживают в просвете капилляров более высокое давление (выше на 20 мм рт. ст.), чем в окружающей межклеточной жидкости.
в) Скорригированное значение осмолярности жидких сред организма. В нижней строке таблицы выше приведено скорригированное значение осмолярности плазмы, межклеточной и внутриклеточной жидкостей. Причиной введения поправок являются силы притяжения и отталкивания между ионами или молекулами в растворе, которые вызывают, соответственно, небольшое увеличение или небольшое снижение осмотической «активности» растворенного вещества.
г) Суммарное осмотическое давление жидких сред организма. В таблице выше также приведены суммарные значения осмотического давления различных жидкостей, измеренные по разные стороны мембраны, при этом одна ее сторона погружалась в дистиллированную воду. Отметим, что суммарное давление в плазме равно произведению скорригированной осмолярности плазмы (282 мосм/л) на коэффициент 19,3. В итоге получим 5443 мм рт. ст.
Видео физиология фильтрации в почках и поддержки осмотического давления крови - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Регуляция обмена жидкости. Осмос и осмотическое давление
Поддержание адекватного объема одной или обеих (внутри- и внеклеточной) жидких сред организма является частой проблемой при лечении тяжелобольных. Распределение внеклеточной жидкости между плазмой и межклеточным пространством в основном зависит от уравновешивания сил гидростатического и коллоидно-осмотического давления, которые действуют на мембрану капилляров.
Распределение жидкости между внутри- и внеклеточной средами в основном определяется осмотическими силами мелких молекул растворенных веществ, преимущественно натрия, хлора и других электролитов, действующих по разные стороны мембраны. Причина этого распределения обусловлена свойствами мембран, проницаемость которых для воды высока, а для ионов даже очень небольшого диаметра, таких как натрий и хлор, практически равна нулю. Следовательно, вода быстро проникает через мембрану, а внутриклеточная жидкость, тем не менее, остается изотоничной по отношению к внеклеточной.
В следующем разделе рассмотрим взаимосвязь между внутри- и внеклеточной жидкостями и причины осмотического характера, способные влиять на перенос жидкости между этими средами.
В статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.

Теоретические основы осмоса и осмотического давления
Основы осмоса и осмотического давления изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). В этой статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
Осмос — процесс диффузии воды через полупроницаемую мембрану. Он происходит из области с высокой концентрацией воды в область с ее низкой концентрацией. Растворение вещества в воде приводит к снижению концентрации воды в данном растворе. Следовательно, чем больше концентрация вещества в растворе, тем ниже в нем содержание воды. Кроме того, вода диффундирует из области с низкой концентрацией вещества (высоким содержанием воды) в область с высокой концентрацией вещества (низким содержанием воды).
Поскольку проницаемость мембраны клеток избирательна (она относительно низка для большинства растворенных веществ, но высока для воды), то при повышении концентрации вещества с одной стороны мембраны вода проникает в эту область путем диффузии. Если растворенное вещество, такое как NaCl, добавить во внеклеточную жидкость, вода будет быстро выходить из клетки до тех пор, пока концентрации молекул воды по обе стороны мембраны не уравняются. Если, напротив, концентрация NaCl во внеклеточной жидкости снизится, вода из внеклеточной жидкости устремится в клетки. Интенсивность, с которой вода диффундирует в клетку, называют осмотической силой.
а) Соотношение молей и осмолей. Поскольку концентрация воды в растворе зависит от количества в нем частиц вещества, под термином «концентрация вещества» (независимо от его химического состава) понимают общее число частиц вещества в растворе. Это число измеряют в осмолях. Один осмоль (осм) соответствует одному молю (1 моль, 6,02x10 23 ) частиц растворенного вещества. Следовательно, каждый литр раствора, содержащий 1 моль глюкозы, соответствует концентрации 1 осм/л. Если молекула диссоциирует на 2 иона, т.е. возникают две частицы (например, NaCl распадается на ионы Na+ и Сl-), то одномолярный раствор (1 моль/л) будет иметь осмолярность 2 осм/л. Аналогично раствор, содержащий 1 моль вещества, которое диссоциирует на 3 иона, например сульфат натрия Na2SО4, будет содержать 3 осм/л. Поэтому термин «осмоль» определяют, ориентируясь не на молярную концентрацию вещества, а на число растворенных частиц.
В целом осмоль — слишком большая величина, чтобы использовать ее в качестве единицы измерения осмотической активности жидких сред организма. Обычно используют 1/1000 осмоли — миллиосмолъ (моем).
б) Осмоляльность и осмолярность. Осмолялъностью называют осмоляльную концентрацию вещества в растворе, которая выражается в количестве осмолей на килограмм растворителя. Когда же речь идет о количестве осмолей в литре раствора, эту концентрацию называют осмолярностью. Для сильно разведенных растворов, которыми являются жидкие среды организма, справедливо использовать оба термина, т.к. разница значений невелика. Во многих случаях сведения о жидких средах организма легче выражать в литрах, чем в килограммах, поэтому в большинстве расчетов, используемых в клинике, а также в следующих главах, за основу принята не осмоляльность, а осмолярность.
в) Осмотическое давление. Осмос молекул воды через избирательно проницаемую мембрану может быть уравновешен силой, приложенной в направлении, обратном осмосу. Величину давления, необходимую для прекращения осмоса, называют осмотическим давлением. Таким образом, осмотическое давление является непрямой характеристикой содержания воды и концентрации веществ в растворе. Чем оно выше, тем меньше в растворе содержание воды и выше концентрация растворенного вещества.
Высокое осмотическое давление по обе стороны клеточной мембраны может возникать при относительно небольших изменениях концентрации растворенных веществ во внеклеточной жидкости. На каждый миллиосмоль разности концентраций непроникающих веществ (для которых мембрана непроницаема) приходится, как изложено ранее, осмотическое давление 19,3 мм рт. ст.
Если клеточная мембрана покрыта водой и осмолярность внутри клетки составляет 282 мосм/л, то предполагаемое значение осмотического давления может быть более 5400 мм рт. ст. Данный пример иллюстрирует степень величины сил, способных перемещать воду через мембрану, если между внутри- и внеклеточной жидкостями не установлено осмотическое равновесие.
В результате действия этих сил относительно небольшие изменения концентрации веществ, не проникающих в клетку, способны существенно менять объем клеток.
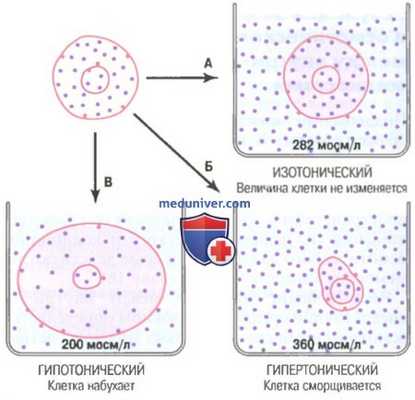
Влияние изотонического (А), гипертонического (Б), гипотонического (В) растворов на объем клеток
а) Изо-, гипо- и гипертонические растворы. Влияние растворов, содержащих различную концентрацию непроникающих веществ, на объем клетки показано на рисунке выше. Если поместить клетку в такую жидкость с осмолярностью 282 мосм/л, клетка не будет ни сморщиваться, ни набухать, поскольку содержание воды по обе стороны клеточной мембраны одинаково, а растворенные вещества не способны входить или выходить из клетки.
Раствор, в котором не происходит изменение объема клетки, называют изотоническим. Это, например, крайне важный для клиники 0,9% раствор NaCl. Вводить его в кровь можно без опасения нарушить равновесие между внутри- и внеклеточной жидкостями.
Если клетку поместить в раствор непроникающих веществ с концентрацией ниже 282 мосм/л, т.е. в гипотонический раствор, вода с помощью диффузии будет входить в клетку и вызывать ее набухание. Движение воды будет происходить до тех пор, пока осмолярность по обе стороны мембраны не станет одинаковой. Растворы NaCl, концентрация которых ниже 0,9%, относят к гипотоническим, они вызывают набухание клеток.
Помещение клетки в раствор с высокой концентрацией непроникающего вещества, т.е. в гипертонический раствору приведет к движению воды из клетки наружу, таким образом концентрируя внутриклеточную и разбавляя внеклеточную жидкости. В данном случае клетка будет сморщиваться до тех пор, пока концентрации не выровняются. Растворы NaCl с концентрацией выше 0,9% являются гипертоническими.
б) Изо-, гипер- и гипоосмолярные растворы. Термины «изотонический»у «гипотонический»у «гипертонический» показывают, что будет происходить с клетками при погружении в эти растворы. Тоничность растворов зависит от концентрации веществ, для которых мембрана непроницаема. Некоторые растворенные вещества, однако, способны проникать через мембрану. Вне зависимости от того, способно ли вещество проникать через клеточную мембрану, растворы с такой же осмолярностью, как и цитоплазма клетки, называют изоосмолярными.
Термины «гиперосмолярный» и «гипоосмолярный» относят к растворам, осмолярность которых без оценки проницаемости наружной мембраны клетки соответственно выше или ниже осмолярности обычной внеклеточной жидкости. К временному изменению равновесия между внутри- и внеклеточной жидкостями способны вещества с высокой проницаемостью, например мочевина. Однако с течением времени равновесие восстанавливается, практически не влияя на гомеостаз.
в) Быстрое достижение равновесия между внутри- и внеклеточной жидкостями. Перенос жидкости через мембрану происходит настолько быстро, что различия в осмолярности между этими двумя средами исчезают в течение нескольких секунд или, самое большее, нескольких минут. Быстрое перемещение воды через мембрану не означает скорого наступления полного равновесия между внутри- и внеклеточной жидкостями в организме.
Это можно объяснить тем, что обычным путем поступления жидкости в организм является всасывание в полости желудочно-кишечного тракта, где она должна быть перенесена кровью ко всем тканям перед установлением осмотического равновесия, которое наступает лишь примерно через 30 мин после приема жидкости.
II. Дисгидрии.
Нарушения водного обмена носят название дисгидрий (данные таблицы 6 и схемы 1). Дисгидрии проявляются двумя формами:
1) гипергидратация – избыточное содержание жидкости в организме;
2) гипогидратация (обезвоживание) – уменьшение общего объема жидкости.
Гипергидратация и гипогидратация подразделяются в свою очередь на три формы:
Возможны комбинированные формы дисгидрий – одновременно гипогидрия и гипергидрия, но в разных секторах организма: клеточном и околоклеточном. Важной характеристикой дисгидрий является величина осмотического давления жидкости (в норме 285-300 мосм/л). Осмотическое давление может либо не изменяться (изоосмолярная дисгидрия), либо повышаться (гиперосмолярная дисгидрия), либо снижаться (гипоосмолярная дисгидрия).
Нарушения водно-электролитного баланса.
Изотоничный (изоосмолярный) дисбаланс.
Увеличение или уменьшение внеклеточной жидкости имеет результатом концентрационный эквивалент 0,9% раствору хлорида натрия (соли) – (физиологический раствор); клетки не сморщиваются и не разбухают.
Гипертоничный (гиперосмолярный) дисбаланс.
Дисбаланс, который имеет в результате концентрацию внеклеточной жидкости выше, чем 0,9% раствор соли, т.е. теряется вода или прибавляются электролиты; клетки сморщиваются в гипертоническом растворе.
Гипотонический (гипоосмолярный) дисбаланс.
Дисбаланс, в результате которого во внеклеточной жидкости меньше, чем 0,9% раствор соли, т.е. увеличивается вода, или уменьшаются электролиты. Клетки отекают в гипотоническом растворе.
Схематическое представление о перемещении воды из одного сектора жидкости в другой
1. Нормальное осмотическое равновесие 2. Добавление растворов электролитов к внеклеточной жидкости. Нарушение осмотического равновесия.
3Вода движется из внутриклеточного во внеклеточное пространство согласно осмотическому градиенту. Осмотическое равновесие восстанавливается с уменьшением внутриклеточной жидкости.
4. Добавление свободной воды к внеклеточной жидкости. Нарушение осмотического равновесия.
5. Восстановление осмотического равновесия.
Жидкость движется из внеклеточного во внутриклеточное пространство согласно осмотическому градиенту. Осмотическое равновесие восстанавливается с увеличением содержания внутриклеточной и внеклеточной жидкости.
II. 1. ГИПОГИДРАТАЦИИ
Гипогидратация возникает в следующих случаях:
1) вследствие нарушения поступления воды в организм (водное голодание, нарушение глотания, коматозное состояние и др.);
2) вследствие повышенной потери воды (кровопотеря, полиурия, понос или рвота, гипервентиляция, усиленное потоотделение, потеря биологических жидкостей с экссудатом или с обширных раневых поверхностей).
При обезвоживании теряется в первую очередь внеклеточная жидкость и ионы натрия, а при более тяжелой его степени – ионы калия и внутриклеточная жидкость. Крайняя степень обезвоживания называется эксикозом и считается наиболее тяжелой формой расстройства водного обмена.
В целом обезвоживание влечет за собой уменьшение объема циркулирующей крови – гиповолемию, сгущение крови и повышение ее вязкости, тяжелые нарушения кровообращения, микроциркуляции, коллапс. Нарушения кровообращения ведут к развитию гипоксии, в первую очередь, ЦНС. Гипоксия клеток ЦНС может сопровождаться помрачением сознания, комой, нарушением функций жизненно-важных центров. Одновременно гипогидратация сопровождается развитием компенсаторных реакций (Рис. 1). Гиповолемия и снижение в результате этого почечного кровотока вызывают избыточную продукцию АДГ и альдостерона, под действием которых усиливается реабсорбция в дистальных отделах нефрона воды и ионов натрия. Диурез может уменьшиттся в 5 раз до уровня облигатного количества мочи, которое еще не вызывает нарушений выведения азотистых шлаков. Но дальнейшее концентрирование мочи, когда ее плотность увеличивается до 1040 и выше, приводит к развитию канальцевого ацидоза и гибели тубулярного аппарата. Особенно тяжело переносят обезвоживание детский организм, в частности дети первых двух лет жизни, у которых возможны самые серьезные осложнения, вплоть до летального исхода.
Читайте также:
