Постоянный гемодиализ. Гемофильтрация
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Показания и осложнения гемофильтрации при отравлении
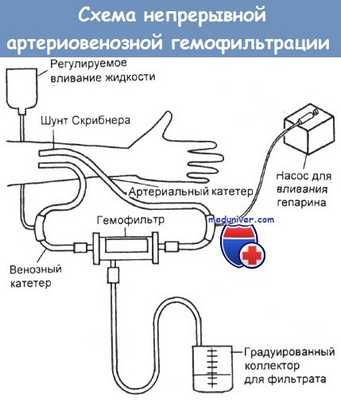
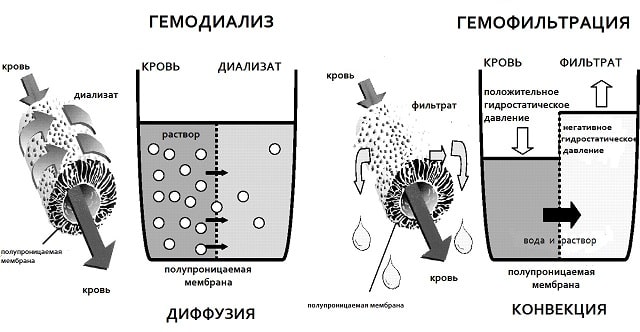
Во время гемофильтрации разница артериального и венозного давлений обеспечивает конвекционный транспорт растворенных веществ через волокнистую или плоскослойную мембрану. Это позволяет поддерживать высокую скорость удаления из крови воды и веществ с относительной молекулярной массой не более 40 000.
По технике проведения гемофильтрация сходна с гемодиализом, только кровь в первом случае прокачивают через гемофильтр. Процедуру можно проводить прерывисто при скорости отведения ультрафильтрата до 6 л/ч или непрерывно, когда эта скорость составляет около 100 мл/ч.
При лечении отравлений второй способ — непрерывная артериовенозная гемофильтрация — предпочтительнее именно в связи с увеличением периода очистки крови.
С ними хорошо связываются, в частности, мышьяк, блокаторы кальциевых каналов, диазепам, фенитоин, салицилаты и другие нестероидные противовоспалительные средства, тироксин и трициклические антидепрессанты. Слабо связываются с белками спирты, аминогликозиды, атенолол и литий. Гемоперфузия представляет собой лучший способ быстрого удаления хорошо связывающихся с белками токсинов.
В случае отравления диализируемыми ядами с малым объемом распределения (например, аспирином, теофиллином) оптимальной процедурой является острый гемодиализ. Как и гемоперфузия, он представляет собой кратковременное вмешательство, и после его окончания остается возможность резкого повышения концентрации нежелательных веществ в крови.
Если у фильтруемого или диализируемого токсина большой объем распределения, стоит подумать об артериовенозной гемофильтрации или непрерывном гемодиализе. В этой области еще следует провести дополнительные контролируемые исследования.
Гемодиафильтрация — это сочетание непрерывной гемофильтрации с гемодиализом. Для лечения отравлений этот метод применяют редко.
Осложнения гемофильтрации
К осложнениям при гемофильтрации относятся засорение фильтра и слабое кровотечение. Horton и Godley сравнили непрерывную артериовенозную гемофильтрацию (НАВГ) с гемодиализом с точки зрения преимуществ и недостатков обоих методов.
Непрерывная артериовенозная гемофильтрация (НАВГ) бывает полезна для удаления таких веществ, как литий, метанол, этанол, этиленгликоль, ванкомицин, аминогликозиды и N-ацетилпрокаинамид.
Судя по результатам исследований на животных, НАВГ может с успехом использоваться для очистки организма от железа при тяжелых отравлениях этим металлом, особенно если развивается острая почечная недостаточность.
Преимущества и недостатки непрерывной артериовенозной гемофильтрации (НАВГ) по сравнению с гемодиализом
а) Преимущества:
Непрерывная артериовенозная гемофильтрация (НАВГ) поддерживает устойчивый гемостаз за счет медленного, постепенного изменения объема жидкости и осмоляльности сыворотки.
Непрерывная артериовенозная гемофильтрация (НАВГ) не ведет к гипотензии и дисбалансу.
Непрерывная артериовенозная гемофильтрация (НАВГ) позволяет непрерывно контролировать баланс жидкости и снижает необходимость в ограничении ее введения.
Непрерывная артериовенозная гемофильтрация (НАВГ) требует циркуляции меньшего объема крови вне тела.
Непрерывная артериовенозная гемофильтрация (НАВГ) не влияет на комплемент и лейкоциты.
Непрерывная артериовенозная гемофильтрация (НАВГ) не требует дорогого оборудования и длительной подготовки персонала.
Непрерывная артериовенозная гемофильтрация (НАВГ) дает более высокий клиренс растворенных веществ со средней молекулярной массой.
б) Недостатки:
Оба метода требуют антикоагуляционного вмешательства.
При обоих методах возникают осложнения, связанные с нарушением целостности сосудов.
Персонал бывает незнаком с методом НАВГ.
Непрерывная артериовенозная гемофильтрация (НАВГ) дает более низкий клиренс веществ с малой молекулярной массой.
Непрерывная артериовенозная гемофильтрация (НАВГ) не способна поддерживать азотный баланс у пациентов с усиленным катаболизмом.
Видео оборудование и методика гемодиализа
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Постоянный гемодиализ. Гемофильтрация
Показания к гемофильтрации. Прогноз почечной недостаточности
Главным показанием для гемофильтрации у критических больных является необходимость коррекции тяжелых эндо- и экзотоксикозов, нарушений гомеостаза и временного замещения функции жизненно важных органов. Диализ и фильтрация относятся к методам временного замещения функции почек по поддержанию баланса жидкости и электролитов, кислотно-основного состояния, метаболизма и коррекции эндотоксикоза. В этой связи, естественно, главным показанием к их применению является острая почечная недостаточность либо в виде самостоятельного критического синдрома, либо как компонента синдрома полиорганной недостаточности.
В настоящее время известно, что прогноз ОПН, СПОН зависит от исходного состояния пациента, количества органов, вовлеченных в патологический процесс, метода и режимов проведения ЭКД, характеристики гемодиафильтров и ряда других факторов. Bellomo R. and Ronco С. в обзоре «Acute Renal Failure in the Intensive Care Unit: Which Treatment Is Best?» приводит суммированные результаты лечения ОПН различными авторами и методами ЭКД. Стандартный гемодиализ применен у 482 больных, из них выжили 167 (34,6 %), постоянные методы внепочечного очищения крови (ПАВГФ, ПВВГФ, ПАВГД, ПВВГД) применены у 1131 больного, из них выжили 450 (39,8 %).
Как следует из приведенных данных, выживаемость больных с ОПН находится в пределах от 6,9— 11,6 до 60,6 % и зависит, по мнению многочисленных исследований, от целого ряда причин.
Так, тип диализной мембраны, по мнению Schiffl H. et al., играет существенную роль для прогноза ОПН У критических больных. Автором были изучены результаты лечения бикарбонатным диализом 76 больных с ОПН, в том числе 59 с послеоперационной почечной недостаточностью. У 38 (50 %) пациентов были использованы диализаторы с мембраной из купрофана (1-я группа) и у 38 (50 %) — из полиакрилонитрила (PAN). Выявлены достоверно лучшие результаты по восстановлению функции почек и госпитальной выживаемости в группе больных, леченных с помощью биосовместимой мембраны PAN. В 1 -й группе восстановление функции почек наступило у 23 %, во второй — у 58 % больных (р > 0,05). Летальность в 1-й группе — 66 %, во второй - 37 % (Р > 0,05).
Bellomo R. et al. изучали результаты лечения ОПН как компонента синдрома полиорганнной недостаточности у больных с сепсисом в зависимости от тяжести исходного состояния (шкала APACHE II) и примененных методов внепочечного очищения крови (постоянная гемодиафильтрация — 87 пациентов, традиционнный ГД — 40 пациентов). Показано, что при APACHE II > 30 выживаемость достоверно выше в группе больных, леченных постоянной гемодиафильтрацией, по сравнению с группой больных, леченных традиционным ГД (51,2 и 26,6 % соответственно).
Maher E.R. et al. изучали результаты выживаемости среди 90 больных с ОПН в зависимости от тяжести исходного состояния, применяемых методов интенсивной терапии. 33 % пациентов переведены из отделения интенсивной терапии, госпитальная выживаемость — 24 %. Метод внепочечного очищения крови не влиял на выживаемость, однако дополнительный машинный гемодиализ потребовался 33 из 65 пациентов, леченных ПАВГФ, и не одному из 22, леченных ПГДФ (р > 0,001). Артериальная гипотензия, необходимость инотропной поддержки, олигоурия и сепсис значительно ухудшали прогноз ОПН. APACHE II Score при поступлении хорошо предсказывала выживаемость. Среди пациентов с APACHE II Score > 40 выживших не было, по сравнению с выжившими 40 % больных, у которых APACHE II была 10—19. Авторы предлагают использовать APACHE II Score для последующего сравнительного анализа результатов лечения больных с ОПН в различных лечебных учреждениях.
Barton I.K. (1993), изучив результаты лечения 250 больных с ОПН постоянной гемофильтрацией (общая выживаемость — 53 %), выявил, что исход заболевания был связан с возрастом, необходимостью использования ИВЛ и катехоламинов, объемом мочи (анурия, олигоурия), метаболическим ацидозом, уровнем билирубинемии.
Storck M. et al. изучали результаты лечения 116 больных с ОПН в зависимости от суточного объема удаляемого ультрафильтрата. Использовали постоянную спонтанную артериовенозную гемофильтрацию (суточный объем 7 ± 0,4 л ультрафильтрата) и постоянную высокопоточную (кровяная помпа) артериовенозную гемофильтрацию (суточный объем 15,6 ± 1,9 л ультрафильтрата). Оба метода адекватно контролировали азотемию и водно-электролитный гомеостаз. Выживаемость больных ОПН коррелировала с суточным объемом ультрафильтрации и была значительно выше в группе больных, у которых использовали кровяную помпу (29,4 %), по сравнению с больными, которых лечили спонтанной гемофильтрацией (12,5 %).
Frost L. et al. приводят результаты лечения 68 пациентов с ОПН, что составило 3,4 % от всех оперированных на «открытом сердце». Половина всех смертей произошла в первые несколько послеоперационных суток и была обусловлена синдромом низкого сердечного выброса и прогрессированием синдрома полиорганной недостаточности. Госпитальная смертность составила 63 %.
Baudouin S. et al. приводят результаты лечения 35 пациентов, которым после операций на «открытом сердце» потребовалось проведение ГФ для лечения ОПН (2,7 % от общего количества оперированных в условиях ИК). 26 пациентов (74 %) умерли во время пребывания в отделении интенсивной терапии. Еще 3 пациента умерли во время нахождения в госпитале после перевода из ОИТ. Исход заболевания был особенно неблагоприятным у пациентов с послеоперационной сердечно-сосудистой недостаточностью (16 пациентов, 0 выживших). Выживаемость определялась числом поврежденных органов в начале лечения ГФ. Так, выжили 100 % пациентов с недостаточностью одной системы и лишь 10 % пациентов с недостаточностью трех и более систем организма.
Представленные многочисленные литературные данные характеризуют гемодиализ и гемофильтрацию как методы, позволяющие замещать функцию почек при острой почечной недостаточности и синдроме полиорганной недостаточности, элиминировать циркулирующие патологические субстанции при эндотоксикозах, корригировать нарушения гомеостаза и активно воздействовать на функцию жизненно важных органов и систем организма, в первую очередь на кардиореспираторную систему критически тяжелых больных. В настоящее время проблема применения этих высокоэффективных методов внепочечного очищения крови, безусловно, нуждается в дальнейшей разработке для уточнения показаний и противопоказаний, корректировки режимов процедуры, разработки принципов дифференцированного их применения у различных категорий больных.
Продолженная ЗПТ может применяться для коррекции водно-электролитного баланса путем изменения состава замещающего раствора и диализата. Эффективность гемофильтрации в плане снижения уровня плазменного калия прямо пропорциональна объемам удаляемой во время процедуры жидкости и ее замещающих растворов, не содержащих калий. Однако эффективность ПАВГФ и ПВВГФ в достижении нормального значения плазменной концентрации калия достаточно низкая. В этой связи при клинически значимой гиперкалиемии следует применять продолженный гемодиазиз или гемофильтрацию с диали-зирующим раствором, не содержащим калий (L0, В0 —Hospal).
При коррекции метаболического алколоза концентрацию бикарбоната в течение сеанса гемофильтрации можно измерить или предсказать, используя формулу:
HC03 (f) = UFx НСО3 (s) x 1,124,
где HCО3 и HCО3 (s) — концентрация бикарбоната в ультрафильтрате и сыворотке крови; UF — общее количество ультрафильтрата; 1,124 — средний коэффициент просеивания бикарбоната.
Когда гемофильтрация применяется в режиме дегидратационной терапии (без замещающего раствора), потери бикарбоната компенсируются за счет снижения потребности организма в основаниях, и в этом случае концентрация бикарбоната в плазме изменяется незначительно. Напротив, при использовании замещающего раствора для поддержания баланса жидкости в организме количество теряемого бикарбоната с ультрафильтратом значительно увеличивается и может обусловить снижение рН крови (нормализация рН при алколозе или ацидоз). Проведение процедур ЗПТ с использованием бикарбонатных диализирующего и замещающего растворов обеспечивает адекватный буферный баланс и меньшие колебания КОС.
Применение ЗПТ в форме изолированной ультрафильтрации представляет особый интерес при лечении застойной сердечной недостаточности и коррекции гемодилюции при искусственном кровообращении (в первую очередь, в кардиохирургии новорожденных и детей).
Проблему лечения тяжелой сердечной недостаточности, рефрактерной к традиционно проводимой терапии сердечными гликозидами, диуретиками, периферическими вазодилататорами, ингибиторами ангиотензинпревращающего фермента, а также специальным мероприятиям (постельный режим, ограничения в диете и в парентеральном введении жидкости, применение допамина добуталине (ДБ) в малых — менее 5 мкг/кг в 1 мин — дозах как в виде монотерапии, так и в сочетании с петлевыми диуретиками или эуфиллином), в настоящее время нельзя считать решенной. Существенное место в этой проблеме занимают вопросы предоперационной подготовки больных с хронической декомпенсацией кровообращения, отечным синдромом.
Успешное лечение декомпенсации кровообращения позволяет ускорить сроки оперативного лечения, снизить частоту тяжелых периоперационных осложнений в системе кровообращения и, следовательно, улучшить прогноз. Одним из наиболее эффективных методов лечения рефрактерной сердечной недостаточности стала изолированная ультрафильтрация (ИУФ), которая достаточно длительное время применяется для плановой и экстренной дегидратации больных с почечной недостаточностью, а в настоящее время ее используют в комплексном лечении больных с тяжелой сердечной недостаточностью для снижения увеличенной преднагрузки сердца, терапии отечного синдрома, устойчивого к проводимой терапии диуретиками различных групп.
Преимуществом данного метода является возможность быстрого и программированного удаления значительного количества жидкости у больных с гипергидратацией, гиперволемией сохраняя при этом стабильными основные параметры гомеостаза (кислотно-основное равновесие, осмоляльность, электролитный состав организма), а также возможность влиять на факторы, определяющие преднагрузку желудочков и объем сердечного выброса.
Наряду с хорошим терапевтическим эффектом ИУФ (уменьшение одышки, асцита и периферических отеков, размеров печени, улучшение функционального состояния почек и сердца) у целого ряда больных данная процедура не улучшает, а приводит к усугублению имеющихся нарушений центральной и периферической гемодинамики, что диктует необходимость дальнейшего изучения механизмов воздействия данной процедуры на систему кровообращения.
Высокообъемная гемофильтрация
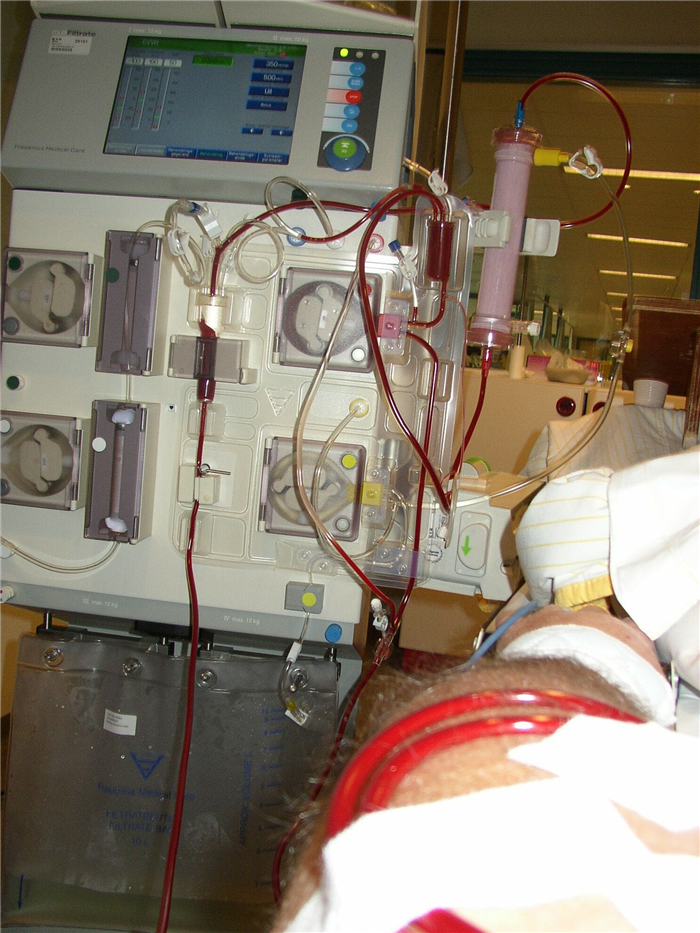
Гемофильтрация представляет собой заместительную терапию, подобную гемодиализу, очищение крови посредством фильтрации и удаление отходов, таких как креатинин и мочевина, а также свободной воды из крови. Это метод гемокоррекции, основанный на принципе конвекционного и фильтрационного переноса воды, низко- и среднемолекулярных веществ из циркулирующей вне тела крови через полупроницаемую мембрану с внутривенным замещением кровезаменяющим раствором. Используется в основном в условиях интенсивной терапии.
В отличие от гемодиализа и перитонеального диализа, оба из которых основаны на диффузии молекул через градиент концентрации, гемофильтрация использует конвективный перенос растворенного вещества (известный как растворитель), в результате чего молекулы захватываются движущимся потоком растворителя. Процесс приводит к получению большого объема фильтрата, содержащего избыток частиц отходов. Для эффективного удаления низкомолекулярных веществ объем фильтрации должен быть равен объему воды тела (не менее 60-80%).
Гемофильтрация была впервые использована для лечения пациентов с почечной недостаточностью в 1977 году. Основными причинами её развития были нехватка технического оборудования и специалистов, необходимых для обеспечения гемодиализа, в сочетании с отличной толерантностью даже у пациентов с гемодинамически скомпрометированными состояниями. Кроме того, баланс жидкости можно точно контролировать и регулировать, позволяя использовать другие вспомогательные меры, такие как общее парентеральное питание.
Гемофильтрация большого объема (высокообъемная гемофильтрация или вено-венозная гемофильтрация) является привлекательной терапией для лечения септической острой почечной недостаточности и абдоминальной ишемии. Скорость ультрафильтрации при этом достигает 6 литров в час.
При высокообъемной гемофильтрации её доза выше обычной почечной дозы. Объем замещения жидкости зависит от клинических показателей пациента.
Показания и противопоказания к методу лечения
- Острая почечная недостаточность,
- Абдоминальная ишемия,
- Дисбаланс жидкости и электролита,
- Общее парентеральное питание с ограничением жидкости,
- Отек мозга с повышенным внутричерепным давлением,
- Тяжелые ожоги,
- Септический шок с множественной недостаточностью органа,
- Гепаторенальный синдром,
- Печеночная энцефалопатия,
- Отек легких, сердца, печени или почек,
- Сепсис,
- Гипергидратация при неправильном плазмозамещении,
- Осложнения хронической диализной терапии.
Процедура гемофильтрации практически не имеет противопоказаний (к ним можно отнести длительные кровтечения и геморрагический инсульт). Однако, каждый конкретный случай рассматривается индивидуально.
Как проходит метод лечения
Для проведения гемофильтрации используют аппарат называемый гемопроцессор. Пациент при этом лежит на кровати. Продолжительность процедуры зависит от состояния пациента.
Перед процедурой пациенту вводят препарат предупреждающий свертывание крови.
Во время гемофильтрации кровь пациента пропускается через набор насосно-компрессорных труб (фильтровальная схема) через машину на полупроницаемую мембрану (фильтр), где удаляются отходы и вода. Добавляется заместительная жидкость, подогреваемая термостатом, и кровь возвращается пациенту.
Кроме того, гемопроцессор снабжен весами, определяющими количество фильтрата и замещающего раствора, и микропроцессором для автоматического управления процедурой.
Диализный катетер помещается в одну из основных вен тела. Также аппарат можно подсоединить к пациенту с помощью артериовенозного шунта. Этот катетер имеет две отдельные линии. Кровь вытекает из катетера в гемопроцессор, затем попадает в фильтр, где отбирается отработанная жидкость. Затем заменяются текучие среды и электролиты (например, натрий и калий). Наконец, кровь возвращается пациенту через катетер.
Скорость удаления растворенного вещества пропорциональна приложенному давлению, которое может быть настроено в соответствии с требованиями медицинских условий. Гемофильтрация нуждается в огромном потоке воды через полупроницаемую мембрану. Этот поток воды стимулируется градиентом давления со стороны крови на так называемую сторону фильтрата мембраны.
Гемофильтрация обычно используется до тех пор, пока функция почек пациента не вернется в норму.
Как правило, замещающая жидкость, буферный раствор электролита, близкий к составу плазменной воды0. Существует также несколько видов замещающего раствора, отличающиеся по содержанию катионов, анионов, глюкозы и осмотическому давлению.
Замещающий раствор вводят после фильтра (посдилюция) или перед фильтром (предилюция).
Возможные осложнения при лечении
Современные гемопроцессоры предусматривают защиту от воздушной эмболии, утечки крови и жидкостного дисбаланса, поэтому осложнения редки.
Иногда может наблюдаться кровотечение, гипер- или дегидратация, стресс, гипокликемия, озноб или повышение температуры тела, артериальная гипотензия и сердечная слабость.
Прогноз после метода лечения
Высокообъемная гемофильтрация позволяет укоротить противовоспалительную фазу сепсиса, уменьшить проявления имунопаралича и риск развития вторичной инфекции.
Острая почечная недостаточность
Острая почечная недостаточность – потенциально обратимое, внезапно наступившее выраженное нарушение или прекращение функции почек. Характерно нарушение всех почечных функций (секреторной, выделительной и фильтрационной), выраженные изменения водно-электролитного баланса, быстро нарастающая азотемия. Почечная недостаточность ведет к выраженным нарушениям метаболических процессов в организме и без лечения приводит к смерти от остановки сердца.
Причины и факторы риска
Этиология преренальной ОПН
Преренальная ОПН может развиваться при состояниях, которые сопровождаются снижением сердечного выброса (при тромбоэмболии легочной артерии, сердечной недостаточности, аритмии, тампонаде сердца, кардиогенном шоке). Нередко причиной становится уменьшение количества внеклеточной жидкости (при диарее, дегидратации, острой кровопотери, ожогах, асците, вызванном циррозом печени). Может возникать вследствие выраженной вазодилатации, возникающей при бактериотоксическом или анафилактическом шоке.
Этиология ренальной ОПН
Возникает при токсическом воздействии на почечную паренхиму удобрений, ядовитых грибов, солей меди, кадмия, урана и ртути. Развивается при бесконтрольном приеме нефротоксичных медикаментов (противоопухолевые препараты, ряд антибиотиков и сульфаниламидов). Рентгенконстрастные вещества и перечисленные препараты, назначенные в обычной дозировке, могут стать причиной ренальной ОПН у больных с нарушением функции почек. Кроме того, данная форма ОПН возникает при циркуляции в крови большого количества миоглобина и гемоглобина (при выраженной макрогемаглобинурии, переливании несовместимой крови, длительном сдавлении тканей при травме, наркотической и алкогольной коме). Реже развитие ренальной ОПН обусловлено воспалительным заболеванием почек.
Этиология постренальной ОПН
Развивается при механическом нарушении пассажа мочи при двухсторонней обструкции мочевых путей камнями. Реже возникает при опухолях предстательной железы, мочевого пузыря и мочеточников, туберкулезных поражениях, уретритах и периуретритах, дистрофических поражениях забрюшинной клетчатки. При тяжелых сочетанных травмах и обширных хирургических вмешательствах острая почечная недостаточность вызывается несколькими факторами (шок, сепсис, переливание крови, лечение нефротоксичными препаратами).
Классификация
Выделяют следующие формы ОПН:
- Гемодинамическая (преренальная). Возникает вследствие острого нарушения гемодинамики.
- Паренхиматозная (ренальная). Причиной становится токсическое или ишемическое поражение почечной паренхимы, реже – острый воспалительный процесс в почках.
- Обструктивная (постренальная). Развивается вследствие остро возникшей обструкции мочевыводящих путей.
Симптомы и течение ОПН
Выделяют четыре фазы острой почечной недостаточности:
Состояние пациента определяется основным заболеванием, вызывающим ОПН. Клинически начальная фаза обычно не выявляется из-за отсутствия характерных симптомов. Циркуляторный коллапс, возникающий в этой фазе, имеет очень малую продолжительность, поэтому проходит незамеченным. Неспецифичные симптомы ОПН (сонливость, тошнота, отсутствие аппетита, слабость) замаскированы проявлениями основного заболевания, травмы или отравления.
Анурия возникает редко. Количество отделяемой мочи - менее 500 мл в сутки. Характерна выраженная протеинурия, азотемия, гиперфосфатемия, гиперкалиемия, гипернатиемия, метаболический ацидоз. Отмечается понос, тошнота, рвота. При отеке легкого вследствие гипергидратации появляется одышка и влажные хрипы. Больной заторможен, сонлив, может впасть в кому. Нередко развивается перикардит, уремический гастроэнтероколит, осложняющийся кровотечениями. Пациент подвержен инфекции вследствие снижения иммунитета. Возможен панкреатит, стоматит паротит, пневмония, сепсис.
Олигоанурическая фаза ОПН развивается в течение первых трех суток после воздействия. Позднее развитие олигоанурической фазы считается прогностически неблагоприятным признаком. Средняя продолжительность этой стадии 10-14 дней. Период олигурии может укорачиваться до нескольких часов или удлиняться до 6-8 недель. Продолжительная олигурия чаще возникает у пожилых пациентов с сопутствующей сосудистой патологией. При олигурической стадии ОПН, длящейся более месяца, необходимо провести дополнительную дифференциальную диагностику для исключения прогрессирующего гломерулонефрита, почечного васкулита, окклюзии почечной артерии, диффузного некроза коры почек.
Длительность диуретической фазы – около двух недель. Суточный диурез постепенно увеличивается и достигает 2-5 литров. Отмечается постепенное восстановление водно-электролитного баланса. Возможна гипокалиемия вследствие значительных потерь калия с мочой.
Происходит дальнейшее восстановление почечных функций, занимающее от 6 месяцев до 1 года.
Осложнения острой почечной недостаточности
Выраженность нарушений, характерных для почечной недостаточности (задержка жидкости, азотемия, нарушение водно-электролитного баланса) зависит от состояния катаболизма и наличия олигурии. При выраженной олигурии отмечается снижение уровня клубочковой фильтрации, существенно уменьшается выделение электролитов, воды и продуктов азотного обмена, что приводит к более выраженным изменениям состава крови.
При олигурии увеличивается риск развития водной и солевой сверхнагрузки. Гиперкалиемия при острой почечной недостаточности вызвана недостаточным выведением калия при сохраняющемся уровне его высвобождения из тканей. У больных, не страдающих олигурией, уровень калия составляет 0,3-0,5 ммоль/сут. Более выраженная гиперкалиемия у таких пациентов может говорить об экзогенной (переливание крови, лекарственные препараты, наличие в рационе продуктов, богатых калием) или энодгенной (гемолиз, деструкция тканей) калиевой нагрузке.
Первые симптомы гиперкалиемии появляются, когда уровень калия превышает 6,0-6,5 ммоль/л. Больные жалуются на мышечную слабость. В некоторых случаях развивается вялый тетрапарез. Отмечаются изменения ЭКГ. Снижается амплитуда зубцов P, увеличивается интервал P-R, развивается брадикардия. Значительное повышение концентрации калия может вызвать остановку сердца.
На первых двух стадиях ОПН наблюдаются гипокальциемия, гиперфосфатемия, слабо выраженная гипермагниемия.
Следствием выраженной азотемии является угнетение эритропоэза. Сокращается продолжительность жизни эритроцитов. Развивается нормоцитарная нормохромная анемия.
Угнетение иммунитета способствует возникновению инфекционных заболеваний у 30-70% пациентов с острой почечной недостаточностью. Присоединение инфекции утяжеляет течение заболевания и нередко становится причиной смерти больного. Развивается воспаление в области послеоперационных ран, страдает полость рта, дыхательная система, мочевыводящие пути. Частым осложнением острой почечной недостаточности является сепсис, который может вызываться как грамположительной, так и грамотрицательной флорой.
Отмечается сонливость, спутанность сознания, дезориентация, заторможенность, чередующаяся с периодами возбуждения. Периферическая нейропатия чаще возникает у пожилых пациентов.
- Осложнения со стороны сердечно-сосудистой системы
При ОПН может развиться застойная сердечная недостаточность, аритмия, перикардит, гипертензия.
Больных беспокоит ощущение дискомфорта в брюшной полости, тошнота, рвота, потеря аппетита. В тяжелых случаях развивается уремический гастроэнтероколит, часто осложняющийся кровотечениями.
Прогноз
Летальность в первую очередь зависит от тяжести патологического состояния, ставшего причиной развития ОПН. На исход заболевания влияет возраст больного, степень нарушения функции почек, наличие осложнений. У выживших пациентов почечные функции восстанавливаются полностью в 35-40% случаев, частично – в 10-15% случаев. 1-3% больных необходим постоянный гемодиализ.
Читайте также:
