Постремиссионная терапия острого миелоидного лейкоза - трансплантация костного мозга
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Трансплантация костного мозга при остром миелоидном лейкозе - эффективность
Современная стратегия терапии острого миелоидного лейкоза (ОМЛ) определяется максимально возможным использованием потенциала интенсивной индукции, консолидации и поддерживающего лечения.
Во-первых, трансплантация стволовых гемопоэтических клеток всегда является этапом в лечении больных острым миелоидным лейкозом; во-вторых, всегда подразумевается отбор больных в соответствии с их возрастом и соматическим статусом, адекватностью химиотерапии, развитием рецидива до выполнения ТКМ, наличием HLA-совместимого донора (для аллогенной ТКМ); в-третьих, сравнение результатов лечения больными, которым проводят химиотерапию или выполняют трансплантацию, возможно лишь на основе анализа рандомизированных групп в рамках многоцентровых кооперированных исследований; в-четвертых, эффективность выполнения ТКМ необходимо оценивать в зависимости от цитогенетических аномалий, которые определяют течение заболевания.
К концу 2001 г. завершены 4 многоцентровых рандомизированных исследования, проведенных в Европе и США. Их цель — сравнить эффективность постремиссионной терапии острого миелоидного лейкоза, выполненной в 3 вариантах: в виде интенсивной химиотерапии, аутологичной и аллогенной ТКМ. В настоящем анализе данные отдельных исследовательских центров не учитываются.
Безрецидивная и общая выживаемость больных, которым выполнили аутологичную трансплантацию костного мозга (ТКМ) или осуществляли химиотерапию
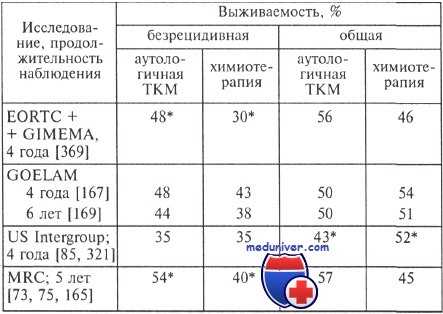
* Статистически значимые различия
В таблице приводится описание основных этапов лечения в рандомизированных исследованиях, проведенных итальянской исследовательской группой (GIMEMA) совместно с общеевропейской (EORTC), а также французской (GOELAM), американской (US Intergroup) и английской (MRC) группами.
Аутологичная трансплантация костного мозга является высокодозной консолидацией полной ремиссии острого миелоидного лейкоза (ОМЛ). Удалось полностью выполнить программу лечения, предусмотренного в исследованиях, по данным группы EORTC+GIMEMA, в 74,2 % случаях при запланированной аутотрансплантации и в 82,5 % — химиотерапии, во французском исследовании GOELAM в 87,2 и в 71 % соответственно, в объединенной американской группе — в 60 и 92 % соответственно и в Великобритании в 66,3 % в случае запланированной аутологичной ТКМ.
Частота развития рецидивов и смертность среди больных, которым проводили химиотерапию или выполняли аутологичную трансплантацию костного мозга (ТКМ)

* Единственное исследование, где отсутствуют статистически достоверные различия
Таким образом, процент выполняемости запланированной терапии достоверно отличается в зависимости от выбранной по случайному признаку программы лечения: аутологичная ТКМ — 71 %, химиотерапия — 88 %. Эти различия, по-видимому, характеризуют аутологичную ТКМ как рискованный метод лечения, требующий принятия очень ответственных решений как больным, так и врачом.
Ее долгосрочная эффективность по сравнению со стандартной консолидацией отражена в таблице. Анализ проведен по принципу «намерение лечить», т. е. в анализ включали всех больных независимо от того, выполнили ли им запланированное лечение или нет.
Безрецидивная выживаемость больных, которым выполнена аутологичная трансплантация костного мозга или проведена химиотерапия, в зависимости от группы прогноза, определенного по цитогенетическим маркерам
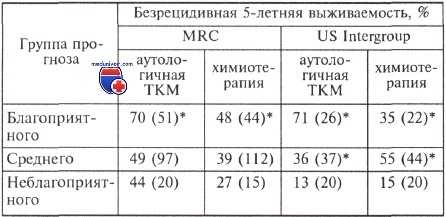
* Статистически значимые различия.
Примечание. В скобках указано число больных
Результаты исследования MRC-10 целесообразно рассмотреть отдельно, поскольку в нем оценивали эффективность аутологичной ТКМ, выполняемой как пятый курс химиотерапии, в сравнении с 4 курсами химиотерапии и прекращением лечения после них. Это исследование доказало, что аутологичная трансплантация костного мозга достоверно улучшает безрецидивную выживаемость больных — 54 % в сравнении с 40 %, при этом авторы подчеркивают, что неясно, сама ли трансплантация костного мозга или дополнительный пятый курс химиотерапии сыграли принципиальную роль.
Последующее исследование MRC-12, сравнивающее эффективность 5 курсов химиотерапии и 4 в сочетании с аутологичной трансплантации костного мозга, показало отсутствие различий между двумя подходами. Общая выживаемость 1224 больных, включенных в исследование, одинакова при проведении 4 или 5 курсов. Тем не менее исследователи отмечают некоторые преимущества у больных в возрасте 15—35 лет после проведения им 5-го курса химиотерапии.
Безрецидивная выживаемость больных в зависимости от числа лейкоцитов и варианта ОМЛ по данным французского исследования

Примечание. В скобках указано число больных
Достоверные различия по безрецидивной выживаемости у больных ОМЛ при проведении аутологичной трансплантации костного мозга получены еще в одном из приведенных в таблице исследований — EORTC+GIMEMA. При выполнении аутологичной трансплантации костного мозга безрецидивная выживаемость составила 48 % в сравнении с 30 % при химиотерапии. Предметом критики в этом исследовании стали результаты стандартной химиотерапии. Некоторые авторы расценивают 30 % безрецидивную выживаемость у больных моложе 55 лет как крайне низкий показатель, обусловленный недостаточной адекватностью химиотерапии.
Основными причинами неудач химиотерапии у больных ОМЛ с достигнутой полной ремиссией являются рецидивы и смерть от проведенного лечения. Вероятность развития этих событий при проведении аутологичной трансплантации или химиотерапии отражена в таблице.
Как видно из таблицы, вероятность развития рецидивов после выполнения аутологичной трансплантации костного мозга значительно меньше (притом, что аутологичная трансплантация костного мозга осуществлена лишь 70 % больных из всех рандомизированных на этот вариант терапии). Однако высокая летальность, обусловленная трансплантацией, нивелирует преимущества последней при анализе безрецидивной выживаемости.
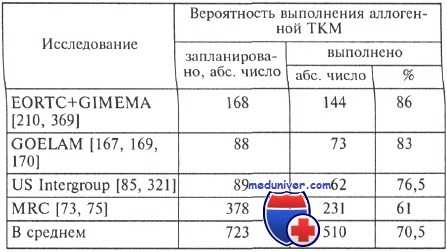
Выполняемость аллогенной трансплантации костного мозга
Анализ эффективности аутологичной трансплантации костного мозга в зависимости от группы прогноза, определенной по цитогенетическим маркерам, не позволяет сделать однозначные выводы. Это связано как с противоречивостью данных, так и с малым числом больных. Данные представлены в таблице.
Как видно из таблице, по результатам исследований MRC и US Intergroup безрецидивная выживаемость после выполнения аутологичной трансплантации костного мозга у больных из группы благоприятного прогноза выше. У больных из группы среднего прогноза преимущества аутологичной трансплантации костного мозга выявлены лишь в исследовании US Intergroup. Одинаково малоэффективной трансплантации костного мозга оказалась у больных из группы неблагоприятного прогноза, однако следует отметить, что показатели безрецидивной выживаемости у этих больных значительно отличаются в каждом исследовании. Это позволяет сделать вывод о том, что в американском исследовании программа химиотерапии менее интенсивная.
При отсутствии возможности оценивать цитогенетические маркеры в анализ прогностических факторов могут быть включены такие простые параметры, как число лейкоцитов в дебюте заболевания и вариант острого миелоидного лейкоза (ОМЛ).
Данные французского исследования GOELAM демонстрируют, что различий в 4-летней безрецидивной выживаемости в зависимости от числа лейкоцитов в дебюте заболевания (более или менее 30 • 109/л) и варианта ОМЛ при сравнении эффективности аутологичной трансплантации костного мозга и интенсивной консолидации не получено. Вывод этого исследования — выполнение аутологичной трансплантации костного мозга больным ОМЛ в период первой полной ремиссии не обязательно. Однако число больных в группах крайне невелико, и большинство исследователей указывают, что аутологичная трансплантация костного мозга может быть включена в программу терапии больных в период первой полной ремиссии ОМЛ при условии снижения летальности, связанной с самой трансплантацией.
Безрецидивная 5-летняя выживаемость больных острым миелоидным лейкозом в зависимости от группы прогноза и наличия у них HLA-совместимого донора
Эффективность аллогенной трансплантации костного мозга зависит не только от мощного лучевого и выраженного цитостатического воздействий, но и от реакции иммунной системы донора костного мозга на опухолевые клетки больного (реакция трансплантат против лейкоза). Именно иммунные механизмы обеспечивают основное противоопухолевое воздействие. К сожалению, у большинства пациентов HLA-совместимого донора нет. По данным обсуждаемых исследований, HLA-совместимого донора определяли у 22—26 % больных, у которых была достигнута полная ремиссия.
Причем учитывали только больных в возрасте максимально до 45 лет, при котором возможно было проведение аллогенной трансплантации костного мозга. Число больных, которым выполнили запланированную ранее аллогенную трансплантацию костного мозга, по данным разных исследований, колеблется от 60 до 86 %. Данные по выполняемости аллогенной трансплантации костного мозга представлены в таблице.
Существенные различия между запланированными и реально выполненными трансплантациями могут быть связаны с токсичностью предшествующей химиотерапии, с развитием ранних рецидивов, отказами пациентов.
Анализ ее эффективности следует проводить по так называемому принципу — донор есть/донора нет. В группу «донор есть» включают больных, у которых имеется HLA-совместимый донор, а в группу «донора нет» тех, у кого HLA-совместимый донор отсутствует. В группе «донор есть» анализируют результаты лечения всех больных независимо от того, выполнили им аллогенную трансплантацию костного мозга или нет.
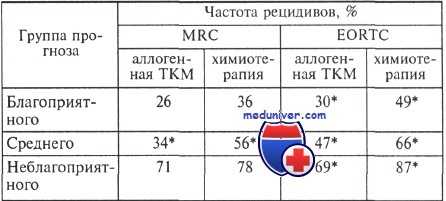
Частота развития рецидивов у больных, которым выполнили аллогенную трансплантацию костного мозга или провели химиотерапию
В таблице приведены показатели 5-летней безрецидивной выживаемости больных в зависимости от наличия или отсутствия у них HLA-совместимого донора и группы прогноза, определенного по цитогенетическим маркерам, в трех исследованиях: MRC, US Intergroup, EORTC+GIMEMA.
Следует напомнить, что в группе «есть донор» представлены показатели больных, большинству из которых (в среднем 70 %) выполнили аллогенную трансплантацию костного мозга. Так же как и при анализе результатов аутологичной трансплантации костного мозга, становится очевидной разнородность результатов аллогенной трансплантации костного мозга. Так, если в английском исследовании MRC аллогенная трансплантация костного мозга имеет преимущество перед химиотерапией лишь у больных из группы среднего прогноза, то в американском исследовании US Intergroup статистически достоверные различия в пользу аллогенной трансплантации костного мозга получены у больных из группы благоприятного и неблагоприятного прогноза.
В европейском исследовании EORTC+GIMEMA, итоги которого подводились в 2001 г., показатели безрецидивной выживаемости во всех группах статистически не отличаются. По данным 2004 г., показатели безрецидивной выживаемости больных из разных прогностических групп были практически такими же, за исключением группы высокого риска: у больных из группы благоприятного прогноза — 61 % (донор есть) и 66 % (донора нет), промежуточного прогноза — 45 % (донор есть) и 49 % (донора нет), плохого прогноза —43 % (донор есть) и 18,4 % (донора нет).
В этом исследовании AMLCG из 340 больных моложе 60 лет, у которых была получена полная ремиссия, лишь 56 (16 %) выполнена аллогенная ТКМ. В предшествующих исследованиях немецкой группы AMLCG аллогенная ТКМ была выполнена 10 % больных — 51 и 42 соответственно. При выполнении анализа с помощью близнецового метода авторы вновь убедительно демонстрируют преимущества аллогенной ТКМ. Трехлетняя безрецидивная выживаемость больных при выполнении химиотерапии составляет 39,3 %, аллогенной ТКМ - 60,1 % (р = 0,02).
Бесспорным доказательством преимущества аллогенной трансплантации костного мозга может служить анализ терапии 149 больных ОМЛ (15—55 лет), которых наблюдали и лечили в Северном регионе Великобритании. Так, полная ремиссия была достигнута у 74 % больных в возрасте до 40 лет и у 58 % — в возрасте от 40 до 55 лет. После проведения двух курсов индукции и двух курсов консолидации (протокол MRC-10) всем больным терапию прекращали. Тем больным, у которых были HLA-совместимые доноры, выполняли аллогенную ТКМ. У 28 больных моложе 40 лет выявили HLA-совместимых родственных доноров, 22 из них провели аллогенную ТКМ (одну — сингенную). Безрецидивная 4-летняя выживаемость с момента достижения полной ремиссии составила 24 % у больных, которым выполнили программу химиотерапии, и 62 % у больных, которым провели аллогенную ТКМ. Конечно, число анализируемых больных невелико.
Сравнительная оценка эффективности химиотерапии и аллогенной трансплантации костного мозга близнецовым методом
Примечание. Различия высокодостоверны
Кроме того, приведены результаты лечения, которое осуществляли в одном исследовательском центре, однако преимуществом этого исследования является то, что в анализ включены все заболевшие ОМЛ в одном географическом регионе и им четко выполнили программу лечения. Вывод однозначный — при наличии донора следует выполнять аллогенную ТКМ.
По данным Международного регистра, за период с 1988 по 1995 г. больным ОНЛЛ было выполнено в общей сложности 3503 аллогенных ТКМ от родственного донора и 208 от неродственного, 1403 аутологичных ТКМ. С учетом значительной селекции пациентов получены хорошие результаты у больных в первой ремиссии, во второй ремиссии и в развернутой фазе болезни. Более 5 лет без рецидива живут 59 % больных ОНЛЛ в первой ремиссии, 35 % во второй полной ремисии и 25 % больных, которым ТКМ была выполнена вне полной ремиссии.
Последние цифры — действительно уникальные результаты, поскольку при лечении больных ОМЛ во второй ремиссии и тех, у кого ремиссию не удается достичь, стандартные и даже агрессивные программы химиотерапии неэффективны. Выполнение аутоло-гичной ТКМ больным в первой полной ремиссии позволяет практически 50 % из них прожить более 5 лет. В том случае если аутологичную ТКМ выполняют больным во второй ремиссии, то безрецидивная выживаемость в течение 5—6 лет составляет 35— 40 %. Из тех больных, у которых не была достигнута полная ремиссия, без рецидива более 4 лет живут лишь 10 %. ТКМ от неродственного донора уступает по долгосрочным результатам как аутологичной, так и аллогенной родственной: более 4 лет без рецидива живут 40 % больных. Аллогенная ТКМ от неродственного донора характеризуется очень высокой летальностью в первые 100 дней и в течение 1-го года.
Приведенные данные свидетельствуют о том, что трансплантация костного мозга, как аллогенного, так и аутологичного костного мозга, можно рассматривать в качестве альтернативы стандартной современной химиотерапии для больных в первой ремиссии и считать единственным подходом, который предоставляет возможность определенному проценту больных во второй ремиссии или вне ремиссии прожить более 5 лет. Однако вновь хотелось бы остановиться на вопросах селекции, поскольку речь идет лишь о той категории больных, которым вообще возможно проведение ТКМ (возраст менее 45 лет, хороший соматический статус).
Выполнение как аутологичной, так и аллогенной трансплантации костного мозга у больных в период первой полной ремиссии ОМЛ не решает основных вопросов терапии этого заболевания, так как половина больных — лица старше 60 лет, полные ремиссии достигаются лишь у 2/3 больных моложе 60 лет, часть больных умирают в период консолидации, некоторые отказываются от предложенного лечения и т. д., однако ТКМ, особенно аллогенная, — это новый способ воздействия на опухолевые клетки. Аллогенная ТКМ, индуцируя такой феномен, как трансплантат против лейкоза, является эффективным противоопухолевым воздействием. Она может служить основой для моделирования и создания новых методов биологического лечения ОМЛ, не сопряженных, как сама ТКМ, с большим числом побочных эффектов.
Таким образом, трансплантация костного мозга — это этап в терапии ОЛ. Эту процедуру необходимо выполнять в специализированных центрах, где осуществляют не менее 10 аллогенных и 10 аутологичных ТКМ в год. Это условие представляется важным, иначе летальность, обусловленная развитием осложнений вследствие самой процедуры, будет очень высока, что естественным образом отразится на общей выживаемости больных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Постремиссионная терапия острого миелоидного лейкоза - трансплантация костного мозга
Несмотря на существующие противоречия относительно формы проведения постремиссионной терапии при остром миелобластном лейкозе (ОМЛ), ее необходимость не вызывает сомнений. Индукционная терапия не в состоянии обеспечить полную эрадикацию лейкозного клона.
Современная терапия острого миелобластного лейкоза (ОМЛ)
1. Острые миелоидные лейкозы:
Индукционная терапия: режимы на основе антрациклина и цитарабина.
Интенсивная постремиссионная терапия: ТКМ или терапия высокими дозами цитарабина необходимы для обеспечения длительной ремиссии.
Поддерживающая терапия обычно не показана, за исключением случаев острого промиелоцитарного лейкоза (ОПЛ).
2. Острый промиелоцитарный лейкоз: Индукционная терапия: ретиноевая кислота в сочетании с режимами, содержащими цитарабин и антрациклин; мероприятия по профилактике и лечению синдрома ДВС: введение криопреципитата или свежезамороженной плазмы для поддержания уровня фибриногена больше 1 г/л; трансфузии тромбоцитов для поддержания количества тромбоцитов больше 50 х 10 9 /л.
3. Рецидив: миелотрансплантация или высокодозная терапия цитарабином.

В связи с эффективностью высоких доз цитарабина при лечении рецидивов острого миелоидного лейкоза (ОМЛ) эта программа применяется и для постремиссионной терапии. Введение цитарабина в дозах от 1 до 3 г/м2 (обычно от 6 до 12 введений каждые 12 часов в виде 3-часовой инфузии) обеспечивает 5-летнюю выживаемость у 30-40% больных, что существенно выше, чем при использовании стандартных режимов консолидации.
Интенсификация высокими дозами цитарабина после достижения полной ремиссии (ПР) на фоне программы «7+3» приводит к длительной безрецидивной выживаемости более чем у 80% больных с прогностически благоприятными изменениями кариотипа, t(8;21) или inv(16). Иногда используется поздняя интенсификация (через 6-12 месяцев после достижения полной ремиссии (ПР)).
Аллогенная трансплантация костного мозга (АлТКМ) или периферических стволовых клеток (АлТСКК) в качестве постремиссионной терапии представляют собой интенсификацию, требующую использования миелоаблативных режимов терапии для максимального уничтожения лейкозных клеток. Донорский костный мозг или СКК периферической крови оказывают иммунологическое действие на реципиента за счет реакции «трансплантат против лейкоза», являющейся частью реакции «трансплантат против хозяина» (РТПХ).

Аллогенная миелотрансплантация в первой полной ремиссии (ПР) является эффективным методом терапии острого миелоидного лейкоза (ОМЛ) у больных моложе 50-55 лет и обеспечивает длительную безрецидивную выживаемость у 45-50% пациентов; рецидив развивается в 10-20% случаев. В настоящее время АлТКМ/ТСКК может быть выполнена у 10% больных острым миелоидным лейкозом (ОМЛ), поэтому интенсивно разрабатываются и внедряются альтернативные виды миелотрансплантации: АлТКМ/ТСКК от неродственных гистосовместимых доноров и после немиелоаблативных режимов кондиционирования.
Трансплантация аутологичного костного мозга (АТКМ) или стволовых клеток периферической крови (АТСКК) — метод высокодозной постремиссионной терапии у больных острым миелоидным лейкозом (ОМЛ), не имеющих совместимого донора. Данный подход исключает возможность развития РТПХ, но при этом существует опасность контаминации трансплантата резидуальными лейкозными клетками. Клиническая эффективность различных методов очистки костного мозга не очевидна. Безрецидивная выживаемость после проведения АТКМ/АТСКК составляет 40-50%.
Таким образом, у молодых больных острым миелоидным лейкозом (ОМЛ) существует три варианта постремиссионной терапии (АлТКМ/АлТСКК, АТКМ/АТСКК и высокодозная химиотерапия), причем существенные различия в общей выживаемости больных отсутствуют (прежде всего за счет высокой токсичности аллогенной трансплантации).
Лечение рецидива острого миелоидного лейкоза - эффективность схем
У большинства больных острым миелобластным лейкозом развивается рецидив. Химиотерапия в этих случаях часто неэффективна, а медиана выживаемости не превышает нескольких месяцев после достижения второй полной ремиссии (ПР). Длительную вторую полную ремисиию (ПР) может обеспечить АлТКМ/АлТСКК, однако отсутствует единое мнение о времени ее выполнения.
Теоретически более правильным является проведение противорецидивного лечения с целью достижения второй полной ремиссии (ПР). У значительной части больных, однако, этого сделать не удается, поэтому часть авторов считает проведение АлТКМ/АлТСКК в раннем рецидиве столь же эффективным, как и миелотрансплантацию после получения второй полной ремиссии (ПР).
Аналогичная стратегия используется при аутологичной трансплантации: больным, у которых была произведена заготовка СКК, может быть выполнена АТКМ/АТСКК как метод индукции второй полной ремиссии (ПР). Длительная безрецидивная выживаемость при второй полной ремиссии (ПР) составляет 30%, при третьей полной ремиссии (ПР) — 20%.
Большинству пациентов миелотрансплантация не может быть выполнена. В этом случае проводится противорецидивная химиотерапия. Прогностическое значение имеет длительность первой полной ремиссии (ПР). Эффективность лечения ниже при раннем рецидиве (длительность первой полной ремиссии (ПР) менее 12 месяцев), а при рецидиве, развившемся ранее 6 месяцев после достижения первой полной ремиссии (ПР), вероятность ответа чрезвычайно низка.
При позднем рецидиве (длительность первой полной ремиссии (ПР) более 12 месяцев) вторая ПР может быть достигнута при использовании прежних индукционных режимов. При планировании лечения следует учитывать характер и интенсивность предшествующей терапии (кумулятивные дозы доксорубицина и даунорубицина не должны превышать 550 мг/м2, митоксантрона — 160 мг/м2, эпирубицина — 1000 мг/м2, винкристина — 15-25 мг/м2).

Большинство пациентов с рецидивом острым миелоидным лейкозом (ОМЛ) не отвечают на проводимую терапию, поэтому проводится поиск методов, способствующих преодолению химиорезистентности. К ним относятся:
1) назначение высоких доз препарата для увеличения его внутриклеточной концентрации;
2) комбинация цитарабина с флударабином;
3) применение колониестимулирующих факторов (КСФ) для стабилизации лейкозных клеток в клеточном цикле и усиления чувствительности к цитостатикам;
4) использование дериватов циклоспорина с целью реверсии mdr-гена (гена «множественной лекарственной устойчивости»).

При развитии рецидива острого миелоидного лейкоза (ОМЛ) после аллогенной миелотрансплантации медиана выживаемости больных составляет 3-4 месяца. В ряде случаев у молодых пациентов с поздним рецидивом может быть выполнена повторная АлТКМ/ТСКК, однако при этом 3-летняя выживаемость не превышает 10%. Альтернативные подходы включают в себя инфузию донорских лимфоцитов или отмену иммуносупрессивной терапии циклоспорином с целью развития реакции «трансплантат против лейкоза».
Проводятся испытания новых методов лечения острого миелоидного лейкоза (ОМЛ), к которым относятся:
1) иммунотерапия (ИЛ-2, анти-CDЗЗ, радиоиммуноконъюгаты с 131I,90Y, дендритические клетки);
2) модуляторы множественной лекарственной устойчивости (велкейд, генасекс, PSC-833);
3) молекулярная терапия (ингибиторы трансмембранной тирозинкиназы, тирозинкиназы c-kit, фарнезилтрансферазы и др.).
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
- ОМЛ с типичными генетическими изменениями.
- ОМЛ с изменениями, обусловленными дисплазией.
- Вторичные острые миелоидные лейкозы, возникшие в результате лечения других заболеваний.
- Болезни с пролиферацией миелоидного ростка при синдроме Дауна.
- Миелоидная саркома.
- Бластная плазмацитоидная дендритноклеточная опухоль.
- Другие виды острого миелоидного лейкоза.
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% - нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Читайте также:
- Ресинхронизация сердца при сердечной недостаточности. Имплантируемый кардиовертер-дефибриллятор при СН
- Проводящая глухота с микрогнатией и вислоухостью. Синдром Ушера
- Диагностика болезни Ходжкина - обследования
- Лечение отравления противоглистными, противомалярийными лекарствами
- Синхронизированная с электрокардиограммой ОФЭКТ. Планарное изображение перфузии миокарда
