Поздние и замедленные кожные реакции. Внутрикожные пробы
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Поздние и замедленные кожные реакции. Внутрикожные пробы
Parish (1970) установил, что антитела, вызывающие кратковременную сенсибилизацию (IgG-KBC), могут индуцировать также немедленные кожные реакции. Пока подкласс этих антител еще не был точно определен. Однако работы Parish, так же как Stanworth и Smith (1973), позволяют предполагать участие IgG4. Согласно данным других исследований, возможна также роль IgG2 [Malley et al., 1973].
«Поздние» и «замедленные» кожные реакции обычно наблюдаются после внутрикожных введений 0,1 мл раствора соответствующей концентрации антигена. Во избежание слишком сильных реакций надо пользоваться концентрацией, которая при предварительной уколочной пробе не вызывает реакции или ведет к образованию иузыря размером меньше 3 мм.
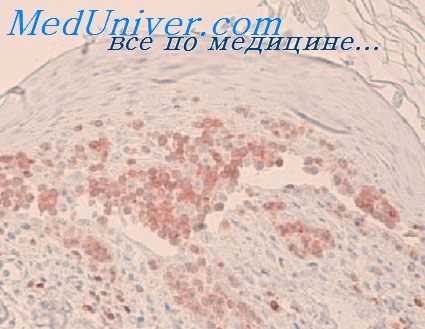
У некоторых лиц внутрикожная инъекция 0,1 мл соответствующей суспензии антигена может вызвать не только немедленную реакцию, которая быстро проходит, по и последующую отечную припухлость, не связанную с раздражением, примерно через 6—12 ч. Этот отек может иметь гистологические признаки реакции Артюса при достаточно большой дозе, но встречаются и менее типичные гистологические изменения, а именно появление моиопуклеаров без тканевого некроза, если используются меньшие дозы. Исследования с помощью иммунофлюоресценции показали присутствие антител IgG и комплемента вначале снаружи, а позднее внутри фагоцитарных клеток, и у большинства обследуемых можно обнаружить также специфические преципитирующие антитела, циркулирующие в крови [Pepys et al., 1968].
По всем этим причинам, видимо, такую реакцию можно рассматривать как реакцию типа III. Dolovich и соавт. (1973) предположили недавно, что реакции, протекающие в те же сроки и наблюдаемые через 6—8 ч, могут быть опосредованы только антителами IgE и, далее, что тип кожной реакции больше зависит от дозы, чем от типа антител. В настоящее время необходимо помнить об этих обеих возможностях.
Важно также заметить, что точные сроки появления «поздних» кожных реакций вариабельны. Они выявляются между 4-м и 24-м часом, что, видимо, зависит от точного количественного соотношения между антигеном и антителами. Таким образом, на практике внутрикожную реакцию надо, как правило, читать минимум через 10 мин, 4 ч, 8 ч, 24 ч (и для выявления замедленных кожных реакций — см. ниже — через 48 и 72 ч). Получив фактические данные, можно заняться их интерпретацией в отдельности. При заболеваниях органов дыхания ряд антигенов, вызывающих немедленную реакцию, индуцирует также двойную (немедленную и позднюю) реакцию.
Типичные примеры двойных реакций можно наблюдать, пользуясь такими грибковыми антигенами, как Aspergillus fumigatus, Candida albicans, гетерологичными белками [Hargreave, Pepys, 1972].
Внутрикожпые пробы могут вызвать также реакцию через 48—72 ч, типичную для ПЧЗТ, опосредованной Т-клетками. Гистологически она характеризуется лимфоцитарной инфильтрацией. Способность к реакции может быть передана несенсибилизированному реципиенту с лимфоцитами сенсибилизированного индивида, но не сывороткой.
Огромное значение имеют сроки развития этих кожных реакций, если рассматривать их как кожную модель иммунопатогенеза процессов, происходящих в легких.
К антигенам, имеющим важное значение для легких и обычно вызывающим реакции замедленного типа, относятся очищенный белковый дериват (PPD) Mycobacterium tuberculosis, соматический белковый антиген Candida albicans [Faux, 1969], другие грибы, включая Histoplasma capsulatum, и антигены легочного коккцидиоидомикоза и бластомикоза.
Кожные реакции замедленного типа могут быть использованы также для определения различных нарушений функции (из-за дефицита Т-клеток или наличия блокирующих антител), если применяются такие антигены, которые у большинства нормальных лиц вызывают данный вид реакций. Для этой цели можно пользоваться PPD, антигеном С. albicans, трихофитином, стрептокиназой и антигеном паротита. В настоящее время первые три антигена легко приобрести в Великобритании.
Для того чтобы расцепить отрицательные кожные тесты как признак угнетения функции лимфоцитов, необходимо проверить силу использованного экстракта, которая может быть весьма вариабельной, и надо знать, что среди нормальной популяции преобладают лица с положительной реакцией.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
АЛЛЕРГИЧЕСКИЕ ДИАГНОСТИЧЕСКИЕ ПРОБЫ
АЛЛЕРГИЧЕСКИЕ ДИАГНОСТИЧЕСКИЕ ПРОБЫ (греческий allos — другой и ergon — действие) — методы диагностики аллергических заболеваний и заболеваний с аллергическим компонентом в патогенезе. Пробы основаны на местной или общей реакции сенсибилизированного организма в ответ на введение специфичного аллергена.
При диагностике аллергических заболеваний в процессе сбора анамнеза выделяют предполагаемую группу аллергенов, которые могли вызвать у больного состояние гиперчувствительности. С этими аллергенами проводят Аллергические Диагностические Пробы вне фазы обострения болезни. Применяют кожные, провокационные и элиминационные Аллергические Диагностические Пробы.
Кожные пробы (см.) — наиболее безопасный и простой вид аллергических диагностических проб в зависимости от способа введения аллергена существуют аппликационные, скарификационные и внутрикожные пробы.
Аппликационные пробы применяют при повышенной чувствительности к простым химическим веществам, некоторым медикаментам у больных с контактным дерматитом.
К скарификационным пробам прибегают при повышенной чувствительности к пыльцевым, бытовым и эпидермальным аллергенам у больных поллинозами, бронхиальной астмой, аллергическим ринитом, крапивницей и отеком Квинке.
Внутрикожные пробы применяют при повышенной чувствительности к бактериальным и грибковым аллергенам у больных бронхиальной астмой, хронической рецидивирующей крапивницей и инфекционными заболеваниями. Эти пробы в 100 раз более чувствительны, чем скарификационные, но менее специфичны и дают больше осложнений. Нужно помнить, что некоторые аллергены (пенициллин и другие антибиотики) при постановке аллергических диагностических проб больным с повышенной чувствительностью к этим препаратам могут вызвать тяжелые осложнения (шок) при проведении скарификационных и особенно внутрикожных проб. Иногда для диагностики применяют Прауснитца—Кюстнера реакцию (см.).
Кожные Аллергические Диагностические Пробы используют и при некоторых инфекционных и паразитарных заболеваниях, сопровождающихся аллергической сенсибилизацией организма. При диагностике туберкулеза применяют скарификационную пробу Пирке и внутрикожную пробу Манту (см. Туберкулинодиагностика). При диагностике бруцеллеза применяют внутрикожную пробу Бюрне; аллергеном служит раствор бруцеллина, содержащий антигенный набор трех различных возбудителей бруцеллеза. При диагностике эхинококкоза применяют внутрикожную пробу Касони. Аллергеном служит вытяжка из содержимого пузыря эхинококка. При положительной реакции в месте инъекции аллергена развивается воспалительная реакция с гиперемией и отечностью. При диагностике туляремии применяют внутрикожную пробу с тулярином (убитая нагреванием взвесь бактерий), при диагностике дизентерии — пробу с дизентерином Цуверкалова. Некоторые пробы применяют для выявления предрасположенности к инфекционным заболеваниям: реакцию Дика — при диагностике скарлатины, реакцию Шика — в диагностике дифтерии.
Провокационные пробы (см.) применяют в тех случаях, когда данные аллергологического анамнеза не соответствуют результатам кожных проб. Провокационные пробы наиболее специфичны в диагностике аллергических заболеваний. Существуют назальные, конъюнктивальные, ингаляционные и другие провокационные пробы.
Назальный провокационный тест применяют при диагностике аллергического ринита: пипеткой закапывают в обе ноздри по 2—3 капли контрольной жидкости; при отсутствии реакции начинают исследование с возрастающими концентрациями аллергена; при затруднении носового дыхания, чиханье, ринорее проба считается положительной.
Конъюнктивальный тест применяют при диагностике поллинозов с явлениями конъюнктивита: после предварительного испытания с контрольным раствором аллерген закапывают пипеткой в нижний конъюнктивальный мешок; покраснение, слезотечение и зуд век — признаки положительной реакции. Ингаляционный тест применяют при диагностике бронхиальной астмы: раствор аллергена дают больному при помощи аэрозольного распылителя: при положительной пробе жизненная емкость легких снижается, развивается бронхо-спазм, который купируют бронхолитиками. При применении провокационных проб учитывают и поздние реакции.
Провокационные пробы применяют также при диагностике физической аллергии (см. Аллергия). Xолодовую пробу — при диагностике хронической рецидивирующей крапивницы: кусок льда закрепляют с помощью бинта; при положительном результате через 10 минут после удаления льда на коже образуется уртикарный волдырь. Тепловую пробу используют для диагностики крапивницы: пробирку с горячей водой (t° 40—42°) помещают на 10 минут на кожу ладонной поверхности предплечья. Положительная реакция характеризуется образованием на месте контакта уртикарного волдыря.
Элиминационные пробы (см.) применяют главным образом при пищевой аллергии. В основе лежит исключение из пищи предполагаемого аллергена.
Библиография: Адрианова Н. В. и Титова С. М. Аллергологический кабинет, М., 1970; Современная практическая аллергология, под ред. А. Д. Адо и А. А. Польнера, М., 1963.
Поздняя реакция Артюса. Особенности реакций гиперчувствительности
При реакции Артюса антигены взаимодействуют с антителами в тканевых пространствах с образованием комплексов антиген — антитело, при этом обычно участвует комплемент, и окружающие клетки повреждаются активированным комплементом или вследствие выделения протеолитических ферментов (лизосом) при разрушении фагоцитов, поглотивших иммунные комплексы. После внутрикожной инъекции антигена кожная реакция типа III характеризуется возникающим примерно через 4 ч отеком, который проходит в течение суток.
После введения в бронхи наблюдают три различные реакции, которые, как можно предположить на основании той же их последовательности во времени, как и в кожной реакции типа III, видимо, зависят от реакции типа III в легких. Эти реакции таковы: 1) общие симптомы с лихорадкой, недомоганием, болями в конечностях и лейкоцитозом; 2) одышка без свистящего дыхания, но с «рестриктивным» ограничением вентиляции и снижением фактора переноса окиси углерода, т. е. ФПОУ; 3) повышение сопротивляемости в дыхательных путях, т. е. бронхиальная астма, которая развивается примерно через 4 ч.
Иммунные комплексы разного состава вызывают различные формы повреждения тканей [Spector, Heesom, 1969]. Комплексы, образующиеся с избытком антител, обычно нерастворимы, и когда они появляются в тканевых пространствах, то индуцируют повреждение тканей, как описано выше (типичная реакция Артюса). При избытке антигена образуются растворимые комплексы; когда особый пусковой механизм повышает проницаемость капилляров, они могут преципитироваться. Примерами этого явления можно считать легочный отек при вирусемии и бактериемии.
При эквивалентных количествах антител и антигена в тканях экспериментальных животных наблюдалась граиулематозная реакция. Возможно, что иммунные комплексы образуются также, когда антитела реагируют с компонентом мертвой ткани или с антигеном, связанным с таким компонентом, и подобные иммунные комплексы в дальнейшем перерабатываются фагоцитарными клетками.
Образование комплексов этого рода может наблюдаться как вторичное явление при некоторых заболеваниях, сопровождающихся присутствием антиядерных антител; антитела реагируют с «обнаженными» ядерными антигенами клеток воспаления или самой поврежденной ткани. При многих болезнях можно ожидать одновременное образование иммунных комплексов разного количественного состава и поэтому важно знать о возможных типах повреждения тканей.
При реакции типа IV антитела не участвуют. Антигены после переработки их макрофагами стимулируют превращение малых лимфоцитов в сенсибилизированные клетки, секретирующие ряд растворимых факторов; некоторые из них ответственны за воспалительные реакции повышенной чувствительности замедленного типа. Реакция типа IV важна при туберкулезе легких, гистоплазмозе, кокцидиоидомикозе и других грибковых инфекциях. На основании новейших методов, разработанных для выявления сенсибилизированных лимфоцитов, можно полагать, что реакция этого типа происходит также при болезнях, которые ранее объясняли только тканевыми повреведениями типа I и типа III, т. е. при бронхиальной астме и экзогенном аллергическом альвеолите.
Мы (ради ясности) в отдельности рассматривали тканевые реакции, опосредованные антителами различных типов и сенсибилизированными лимфоцитами. Однако становится все более очевидным, что реакции Т- и В-клеток тесно взаимосвязаны. Т-клетки, видимо, не только способствуют образованию антител, но и контролируют его. В клинической медицине можно встретить одновременное сочетание нескольких иммунологических Timers реакций. Таким образом, реакции, которые вызываются в отдельности в экспериментальных условиях, нередко отличаются от реакций, наблюдаемых у человека при клинических заболеваниях органов дыхания.
Рассмотрев в этом разделе некоторые иммунологические предположения, в следующих главах мы должны критически обсудить доказательства за и против роли этих явлений при разных заболеваниях легких.
Эозинофилы. Структура и функции эозинофилов
Эозинофилы традиционно рассматриваются как признак реакций, опосредованных реагинами IgE, и хотя они очень часто сопутствуют реакциям этого типа, нельзя утверждать, что роль их заключается только в этом. Выраженную эозинофилию в крови и тканях можно обнаружить без повышенного уровня сывороточного IgE при самых разнообразных болезнях, включая криптогенную легочную эозинофилию, узелковый полиартериит, лекарственные реакции, рак и лимфогранулематоз. Наконец, выраженная тканевая эозинофилия без эозинофилии крови наблюдается при таких болезнях, как эозинофильная гранулема, и при многих хронических активных воспалительных процессах.
В последние годы открыты два фактора, хемотаксичные для эозинофилов: ФХЭ-А (фактор хемотаксиса эозинофилов-анафилаксии), выделяемый тучными или базофилыгыми клетками, и ФХЭ-К (фактор хемотаксиса эозипофилов-комплемента), который является фрагментом комплемента (С-5а). Таким образом, существует возможность накопления эозинофилов в тех местах, где активируются тучные клетки (при реакциях IgE или цитофильных реакциях IgG) или где происходят реакции, зависимые от комплемента по классическому или альтернативному пути. Таким образом, мы видим, что возможности развития тканевой эозинофилии весьма широки.
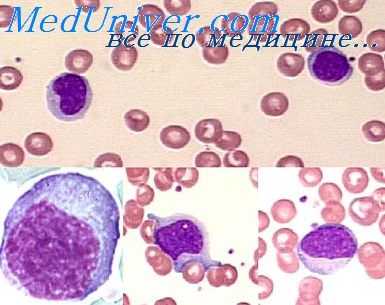
Структура эозинофилов. Отличительное свойство этого гранулоцита заключается в ацидофильном окрашивании его цитоплазматических гранул. Под электронным микроскопом можно видеть, что гранулы кристаллического типа отграничены двухслойной мембраной [Bessis, Thiery, 1961]. Эти гранулы содержат ряд биологически активных веществ. Они отличаются от нейтрофилов высоким содержанием иероксидазы и наличием богатого аргинином основного белка. Эозипофильные гранулы содержат также относительно больше арилсульфатазы, |3-глюкороиидазы, [3-глицерофосфатазы и фосфолипазы D.
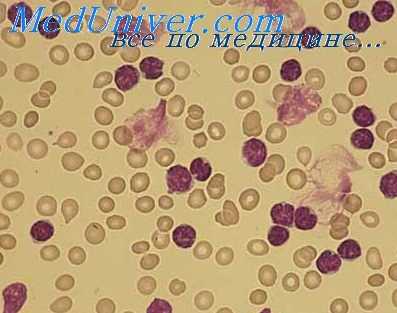
Эозинофилы исходят из костного мозга и после выброса в кровь могут созревать далее в селезенке. Их полупериод жизни в крови, по-видимому, равен 7 ч [Spry, 1971]. Стимул, мобилизующий эозинофилы из костного мозга, вероятно, обусловлен лимфоцитами [Basten, Beeson, 1970; Walls et al, 1971]. Эта способность к стимуляции эозинофилии передается с лимфоцитами, но не с сывороткой и снижается при облучении или после тимэктомии.
Функция эозинофилов. Хемотаксис эозинофилов осуществляется ФХЭ-А, продуцируемым тучными клетками после антигенной стимуляции предварительно сенсибилизированных тучных клеток [Kay, Austem, 1971], а также фрагментом комплемента С5 (С5а) (ФХЭ-К). Особенно интересно отметить выраженный синергизм между ФХЭ-А и ФХЭ-К [Kay et al., 1973]. Возможно, что этим объясняется большее число эозинофилов при бронхолегочном аспергиллезе, когда происходит реакция, опосредованная IgE и IgG, чем при неосложненной астме, когда действует только IgE.
Эозинофилы обладают всеми основными признаками фагоцитарных клеток с рецепторами, способными к иммунному прилипанию, после чего происходят поглощение и умерщвление микроорганизма. Эозинофилы человека имеют рецепторы для Fc-участков IgG C4 и С3b (Anwar, Kay, неопубликованные данные).
Роль эозинофилов в повышенной чувствительности немедленного типа все еще мало известна. Однако есть довольно много указаний па то, что эозинофилы играют центральную роль в прекращении реакций типа I. Обнаружены ингибиторы выделения гистамина, исходящие из эозинофилов, вероятно, простагландипы [Hubscher, 1975], а также гистаминаза [Zeiger, Colten, 1974] и арилсульфатаза, способная инактивировать медленно реагирующее вещество анафилаксии (МРВ-А) [Wasserman et al., 1975]. Эти данные позволяют предполагать, что эозинофил является клеткой, регулирующей повышенную чувствительность немедленного тина. Jones и Кау (1976) приводят более прямые доказательства роли эозинофила как регулятора тканевого уровня гистамина. Они обнаружили большее скопление гистамина в тканях морских свипок после пассивных кожных анафилактических реакций (ПКА), если животные предварительно лишены эозинофилов.
КОЖНЫЕ ПРОБЫ
Кожные пробы — диагностический метод выявления специфической сенсибилизации организма человека или животного путем введения через кожу аллергена и оценки воспалительной реакции кожи.
Кожные пробы используют для качественного и количественного исследования. В первом случае — в целях диагностики некоторых инфекционных (туберкулез, бруцеллез и др.) и паразитарных (Эхинококкоз) заболеваний и выявления сенсибилизации при аллергических заболеваниях, во втором случае — для установления порога чувствительности кожи больного путем испытания десятикратных разведений аллергенов. Таким образом вычисляют начальную дозу аллергена, необходимую для специфической гипосенсибилизации (см.).
Существуют две методики Кожных проб. Прямая методика, когда аллерген вводят без повреждения или с повреждением кожи, может быть капельной, аппликационной (эпикутанной, или лоскутной), скарификационной, пробой уколом и внутрикожной. К прямой методике относятся также холодовая и тепловая пробы. Непрямая методика — реакция пассивного переноса по Прауснитцу—Кюстнеру (см. Прауснитца—Кюстнера реакция), когда сыворотку больного с содержащимися в ней антителами вводят внутрикожно здоровому лицу с последующим введением в то же место аллергена, к к-рому чувствителен больной. Эта методика применяется, когда прямое кожное тестирование невозможно или очень опасно (напр., при анафилактическом типе повышенной чувствительности к пенициллину), а специфическая диагностика необходима.
В зависимости от времени возникновения воспалительной реакции различают К. п. немедленного (I и III типы аллергических реакций) и замедленного (IV тип аллергических реакций) типов (см. Аллергия). Механизм К. п. немедленного типа основан на том, что при сенсибилизации организма реагины фиксируются не только в тканях «шоковых» органов (см. Анафилаксия), но и в клетках кожи. При нанесении на кожу специфического аллергена (антигена) в ней происходит реакция аллерген—антитело и выделяются биологически активные вещества (см. Медиаторы аллергических реакций). Через 15—20 мин. образуется волдырь, окруженный зоной гиперемии, воспалительная реакция волдырно-эритематозного типа (I тип реакции). При реакции III типа на месте введения аллергена развиваются отек и гиперемия. Эти изменения возникают через 3—4 часа, достигают максимума через 7—8 час. и исчезают через 24 часа. К. п. III типа расцениваются как проявление аллергической реактивности типа феномена Артюса (см. Артюса феномен) и зависят от присутствия циркулирующих преципитинов. При реакциях замедленного типа, возникающих через 24—48 час. после воздействия аллергена, в формировании на месте К. п. инфильтрата принимают участие лимфоидные клетки. При взаимодействии рецепторов лимфоцитов с аллергеном из лимфоцитов выделяются медиаторы, обусловливающие развитие воспалительной реакции.
Выбор методики кожного тестирования зависит от заболевания, предполагаемой степени и вида аллергической гиперчувствительности (немедленного, замедленного), а также групповой принадлежности испытываемого аллергена. При повышенной чувствительности к простым хим. веществам, нек-рым медикаментам и т. д., выражающейся клинически контактным аллергическим дерматитом, диагностическое значение имеют только аппликационные К. п. При бронхиальной астме, аллергическом рините, поллинозах, при которых предполагается повышенная чувствительность к аллергенам небактериального происхождения, начинают исследование с пробы уколом или скарификационной пробы. При крапивнице, отеке Квинке, пищевой аллергии, мигрени выявить аллергию с помощью К. п. удается реже, т. к. они дают отрицательные результаты с целым рядом таких пищевых аллергенов, которые при употреблении per os вызывают четко выраженное заболевание. К. п. с медикаментами малодостоверны. Отрицательные К. п. не означают, что к данному аллергену нет сенсибилизации, т. к. и в таких случаях встречаются тяжелые анафилактические реакции. Бактериальные аллергены, как правило, тестируются внутрикожно (за исключением реакции Пирке). При скарификационной методике они не дают достаточно четких результатов, что обусловлено более низким по сравнению с небактериальными экстрактами содержанием специфических субстанций.
При постановке Кожной пробы необходимо учитывать неодинаковую реактивность кожи. Наиболее чувствительной является кожа передней поверхности предплечья, груди, живота, спины около позвоночника и над лопатками. На локтевой ямке реакция получается более сильной, но менее специфичной. Кожная чувствительность в период обострения болезни или сразу после нее менее выражена. При постановке К. п. общие реакции типа анафилактического шока (см.) возникают редко. Осложнения чаще наблюдаются при использовании таких сильных аллергенов, как аллергены из пыльцы растений, шерсти и эпидермиса животных, тел насекомых, сыворотки животных. Наибольшую опасность представляют медикаменты, в частности антибиотики (особенно пенициллин). Тестирование с пенициллином следует проводить в случае крайней необходимости, применяя очень большие разведения; начинают исследование с нанесения капли испытуемого р-ра на кожу и лишь при отрицательной реакции проводят скарификационную пробу. Для профилактики общих реакций типа анафилактического шока следует начинать тестирование небактериальных аллергенов со скарификационной методики, строго соблюдая все необходимые предосторожности, и только при отрицательных результатах переходить на внутрикожную. В связи с тем что между аллергической чувствительностью кожи и «шоковых» органов нет полного соответствия, при специфической диагностике аллергических заболеваний нельзя полагаться только на результаты К. п. Важное диагностическое значение К. п. приобретает тогда, когда ее результат полностью соответствует анамнестическим данным. При несоответствии данных анамнеза результатам К. п. используют другие методы исследования: in vivo — провокационные пробы (см.), in vitro — определение в крови IgE-антител методом радиоаллергосорбента, тест специфического освобождения гистамина, базофильный тест (см.) и т. д.
Капельные пробы используются для выявления сенсибилизации к медикаментам, в первую очередь к антибиотикам. Применяются невысокие концентрации веществ: 0,25% р-р новокаина, от 0,5 до 100 ЕД/мл антибиотиков, 2,5% р-р резорцина и т. д. На кожу живота или передней поверхности предплечья, предварительно обработанную 70% спиртом, наносят каплю испытуемого вещества и обводят место пробы карандашом. Параллельно ставят контрольную К. п. с растворителем. Для выявления реактивности кожи используется 0,01% р-р гистамина — положительный контроль. Учитывают немедленную (в течение 20 мин.) и замедленную (в течение 24—48 час.) реакцию. В случае положительной реакции на месте нанесения капли р-ра вещества развиваются эритема, отек, папулы и пузырьковые элементы. В случае отрицательной реакции переходят к скарификации.
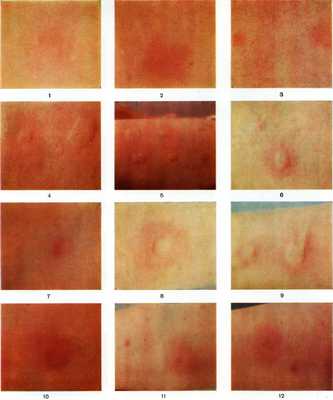
Кожные пробы. Рис. 1 — 3. Аппликационные пробы: рис. 1 — реакция слабоположительная; рис. 2 — реакция положительная; рис. 3 — слева небольшая эритема (реакция слабоположительная), справа большая эритема (реакция положительная). Рис. 4 — 5. Скарификационные пробы: рис. 4 — слева небольшой отек (реакция положительная), справа большой отек (реакция резко положительная); рис. 5 — слева направо: две пробы (верхняя и нижняя) — большой отек с «псевдоподиями» (реакция резко положительная), остальные четыре пробы — небольшой отек (реакция положительная). Рис. 6 — 9. Внутрикожные пробы немедленного типа: рис. 6 — реакция положительная; рис. 7 — реакция слабоположительная; рис. 8 — реакция резко положительная; рис. 9 — слева волдырь (реакция положительная), в центре волдырь с эритемой и псевдоподиями (реакция резко положительная),, Рис. 10— 12. Внутрикожные пробы замедленного типа: рис. 10 — реакция резко положительная; рис. 11 — слева небольшая гиперемия (реакция сомнительная), справа гиперемия более выражена (реакция слабоположительная); рис, 12 — справа небольшая гиперемия (реакция сомнительная), слева выраженная гиперемия (реакция положительная).
Аппликационные пробы применяются при профилактике кожных заболеваниях и представляют собой провокационные пробы, при которых на участок неповрежденной дерматитом кожи передней поверхности предплечья, спины или живота наносят известное количество испытуемого вещества для воспроизведения процесса в миниатюре. Аппликационные К. п. легче контролировать, чем реакции при более глубоком повреждении кожи (скарификационные и внутрикожные). Существуют закрытые и открытые аппликационные пробы. Открытые применяют для масляно-смолистых или текучих веществ. Вещество наносят или непосредственно на кожу (красители, косметические вещества), или в виде «кожного окна», через к-рое наблюдают реакцию: кожу обрабатывают 70% спиртом и высушивают; после этого квадратный кусочек целлофана или стекла с трех сторон прикрепляют лейкопластырем и в образовавшийся карман вводят испытуемую жидкость. Закрытые аппликационные пробы производят следующим образом. На поверхность кожи накладывают квадратный кусок марли размером 1 см 2 , смоченный испытуемым р-ром. Сверху прикрывают куском целлофана или вощаной бумаги несколько большего размера и заклеивают так, чтобы марля не выходила за край наклейки (во избежание ее быстрого высыхания). Одновременно с испытуемыми р-рами в качестве контроля ставится проба с тест-контрольной жидкостью или физиологическим раствором. Р-р испытуемого вещества подбирают таким образом, чтобы он не вызывал раздражения кожи у здорового человека. При появлении зуда или чувства жжения в месте проведения пробы больной должен снять наклейку и марлю и удалить остатки испытуемого вещества с поверхности кожи спиртом или эфиром. Испытуемый материал держат на коже не более 5 дней. Результат аппликационных К. п. оценивают через 20 мин., 12 час., 1, 3 и 7 сут. после снятия вещества (цветн. рис. 1—3). Специфичность аппликационных К. п. весьма высока, если соблюдаются все технические правила их постановки, т. е. правильно подбирается концентрация аллергена, учитываются показатели контрольной пробы и т. д. Специфичность их аналогична специфичности скарификационных К. п. и гораздо выше, чем при внутрикожных. Безопасность значительно выше, чем при внутрикожных пробах, т. к. поверхностные слои клеток кожи препятствуют быстрому проникновению аллергена в организм. При быстрой реакции аллерген удаляют. При позднем типе реакции аллерген тоже удаляют, как только появятся симптомы раздражения кожи. Прием антигистаминных препаратов не влияет на результаты проб; кортикостероидные препараты, наоборот, значительно снижают интенсивность реакции.
Скарификационные пробы введены в практику Шлоссом (E. Schloss) в 1912 г. Они менее чувствительны, чем внутрикожные пробы, но более специфичны и безопасны. Скарификационные пробы проводят на коже передней поверхности предплечья. Используют пыльцевые аллергены, содержащие 1000 и 10 000 PNU (единиц белкового азота), и бытовые и эпидермальные аллергены, содержащие 5000—10 000 PNU. Если экстракт аллергена содержит 20 000 PNU, его разводят тест-контрольной жидкостью. На предварительно обработанную 70% спиртом и высушенную кожу наносят капли стерильных аллергенов на расстоянии 3—4 см друг от друга. Аллергены набирают из флаконов через резиновые пробки иглой шприца (для каждого аллергена используется отдельный шприц). Затем через каждую каплю аллергена отдельной иглой или скарификатором делают две параллельные царапины длиной по 0,5 см каждая так, чтобы не повредить сосуды. При использовании порошкообразных аллергенов сначала на кожу наносят капли тест-контрольной жидкости, затем сухой стерильной иглой (отдельная игла для каждого аллергена) берут небольшие количества аллергена (на кончике иглы), вносят в каплю тест-контрольной жидкости и той же иглой делают скарификацию. В качестве отрицательного контроля обязательно применяют тестирование с тест-контрольной жидкостью, а в качестве положительного — с р-ром гистамина в разведении 1: 10 000. Одновременно делают не более 20 тестов. Оценка результатов скарификационных тестов производится через 20 мин. (цветн. рис. 4—5).
Проба уколом является модификацией скарификационных Кожных проб, при этой пробе возможность повреждения кровеносных сосудов меньше, чем при скарификации. Выполняют ее с теми же аллергенами. Для пробы уколом берется более концентрированный р-р аллергена, чем при выполнении скарификационной К. п., т. к. в кожу попадает минимальное количество аллергена. Техника пробы уколом имеет различные модификации. Классическую пробу проводят следующим образом. На предварительно дезинфицированную кожу наносят каплю испытуемого аллергена и через каплю прокалывают иглой эпидермис кожи. Оценка пробы уколом проводится так же, как при скарификационной пробе. Только после получения отрицательных результатов этой пробы или скарификационной пробы с небактериальными аллергенами переходят к внутрикожным пробам.
Внутрикожные пробы применяются преимущественно для выявления сенсибилизации к аллергенам бактериального или грибкового происхождения. Для диагностики аллергических заболеваний впервые предложены Р. Куком в 1911 г. Внутрикожные пробы оказывают существенную помощь при диагностике туберкулеза (реакция Манту), бруцеллеза (реакция Бюрне), эхинококкоза (реакция Касони) и др. Внутрикожная реакция Манту дополняет пробу Пирке.
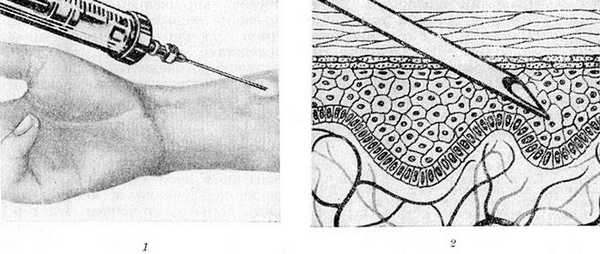
Схематическое изображение постановки внутрикожной пробы: 1 — внутрикожное введение аллергена; 2 — схематическое изображение введения иглы в слой эпидермиса.
При внутрикожном введении аллергена обеспечивается более тесный контакт его с клетками кожи, чем при скарификации. Поэтому внутрикожные пробы примерно в 100 раз более чувствительны, но менее специфичны, чем скарификационные. Они могут давать местные и общие аллергические осложнения. Для внутрикожных тестов используются шприцы с делениями по 0,01 мл и тонкие иглы с коротким срезом и незатупленным острием. Для каждого аллергена необходим отдельный шприц и отдельная игла. Предварительно кожу передней поверхности предплечья обрабатывают 70% спиртом. Инъекция производится следующим образом: кончик иглы, надетой на шприц с небольшим количеством исследуемого аллергена, под очень малым углом вводят в поверхностный слой эпидермиса срезом иглы вверх так, чтобы отверстие иглы полностью скрылось в эпидермисе (рис.), после чего внутрикожно вводят необходимое количество аллергена. Чем поверхностнее сделана инъекция, тем выше чувствительность К. п. Реакция на тот же аллерген при его подкожном введении будет совсем слабой, а при внутримышечном введении — отрицательной. При правильной технике введения на поверхности кожи сразу же после введения образуется инфильтрат. При тестировании неинфекционных аллергенов их вводят внутрикожно в количестве 0,01—0,02 мл экстракта. Бактериальные аллергены вводят в больших количествах — от 0,05 до 0,1 мл. Обязательно параллельное тестирование с тест-контрольной жидкостью. Одновременно можно делать не более 10 внутрикожные тестов с аллергенами из разных групп. При отрицательных и слабых реакциях ставят дополнительно еще 10 тестов. Результат пробы смотрят через 15—20 мин. и через 24 и 48 час. (цветн. рис. 6—12).
Холодовая и тепловая пробы. Для диагностики так наз. физической аллергии применяют холодовую и тепловую пробы. При холодовой пробе на коже ладонной поверхности предплечья фиксируется кусок льда 2—3 см в диам. на 3 мин. или пробирка, наполненная водой с кусочками льда, на 10 мин. При положительной реакции (при холодовой крапивнице контактного типа) на коже образуется уртикарный волдырь, обычно без «псевдоподий», по форме совпадающий с очертаниями кусочка льда или пробирки. Тепловая проба проводится следующим образом. Пробирку с водой, нагретой до t° 40—42°, укрепляют на коже передней поверхности предплечья на 10 мин. Положительная проба характеризуется образованием уртикарного волдыря на месте контакта. К. п. при физической аллергии не выявляют специфического аллергена, а позволяют лишь установить наличие у больного повышенной чувствительности к температурному фактору.
Оценка кожных проб
При оценке Кожных проб (табл.) необходимо учитывать, что их специфичность не является абсолютной. В отдельных случаях они могут быть положительными, но не иметь отношения к этиологии заболевания. Такие реакции называются ложноположительными. Причинами ложноположительных реакций могут быть: 1. Повышенная чувствительность капилляров кожи к механическому раздражению. В этом случае все пробы, включая и пробу с тест-контрольной жидкостью, дают волдырный отек и не могут учитываться как положительные. Иногда такую реакцию удается снять назначением антигистаминных препаратов. 2. Использование тупых или слишком толстых игл, или нанесение слишком глубокой скарификации. 3. Неспецифическое раздражающее действие аллергена вследствие его неправильного приготовления (аллерген должен быть изотоничным и иметь нейтральную реакцию). 4. Введение избыточного количества аллергена (при внутрикожном тестировании). 5. Загрязнение инструментов (шприцев, игл) аллергенами, оставшимися от предыдущего тестирования, или р-ром гистамина. 6. Повышенная чувствительность к консервантам, на которых готовятся аллергены (мертиолат, фенол, глицерин). 7. Близкое иммунологическое сходство между нек-рыми аллергенами в связи с наличием общих антигенных группировок.
Если в анамнезе имеются четкие указания на этиологическое значение определенного аллергена, а К. п. дают с ним отрицательные результаты, то такие ответы называются ложноотрицательными. Причинами ложноотрицательных реакций могут быть следующие: 1) потеря экстрактами аллергенных свойств вследствие длительного и неправильного хранения или в процессе изготовления (особенно быстро инактивируются пищевые аллергены); 2) отсутствие или снижение чувствительности больного, вызванное: а) истощением запаса антител в период или после тяжелого обострения болезни, б) отсутствием кожно-сенсибилизирующих антител при некоторых видах аллергии, напр, при пищевой аллергии (см.), в) снижением реактивности кожи, связанным с нарушением кровообращения, отеком, дегидратацией, влиянием ультрафиолетовой радиации, с общей кахексией и преклонным возрастом, г) приемом больным незадолго перед тестированием антигистаминных препаратов, адреналина и эфедрина.
Читайте также:
