Преднагрузка и постнагрузка на сердце. Механизм Франка-Старлинга
Добавил пользователь Валентин П. Обновлено: 20.01.2026
Три взаимосвязанных фактора детерминируют величину УО и соответственно СВ, т. е. фактически — насосную функцию сердца (преднагрузка, инотропное состояние миокарда и постнагрузка).
Кардиомиогенная ауторегуляция
Ведущим механизмом регуляции насосной функции сердца является кардиомиогенная ауторегуляция. Существуют два способа реализации данного механизма:
1. гетерометрический — его основу составляет прямая зависимость силы сокращения сердечной мышцы от предварительного изменения длины кардиомиоцитов. Установлено, что сила каждого сердечного сокращения зависит от величины объема растяжения его камер поступающей кровью и определяется конечно-диастолической длиной кардиомиоцитов;
2. гомеометрический — его основу составляет изменение «механического напряжения» сердечной мышцы (отдельных кардиомиоцитов или миокардиальной стенки камер сердца) при ее сокращении в так называемом изометрическом режиме, т. е. без изменения длины миофибрилл. Вообще «механическое напряжение» — это научное понятие, которое трактуется как мера внутренних сил, возникающих в деформируемом теле под влиянием различных факторов. В кардиологии такое напряжение ассоциируют с понятием «инотропное состояние (или сократимость) сердечной мышцы».
Оба способа кардиомиогенной ауторегуляции реализуются во всех камерах сердца. Считается, что миогенный механизм наиболее важен для регуляции зависимости силы сокращения сердца от давления в аорте (эффект Анрепа). Данный эффект состоит в том, что при увеличении давления в аорте («на выходе» из сердца) сила и скорость сердечных сокращений возрастают, что позволяет сердцу преодолевать возросшее сопротивление «на выходе» и поддерживать оптимальным сердечный выброс.
Преднагрузка
Преднагрузка является мерой объема крови, поступающей в камеры сердца, который создает давление наполнения полостей сердца (прежде всего, желудочков), необходимое для растяжения кардиомиоцитов по отношению к их исходной длине. Увеличение преднагрузки наблюдают при гиперволе-мии и недостаточности сердечных клапанов. В этом случае независимо от инотропного состояния сердечной мышцы ее работу регулирует в основном длина мышечных волокон желудочка в конце диастолы, т. е. конечно-диастолический объем желудочка.
Закон Франка—Старлинга
Еще в XVIII в. было установлено, что повышение наполнения желудочка, т.е. увеличение конечного диастолического объема или преднагрузки, приводит к возрастанию силы сердечных сокращений и УО. Это свойство сердца является проявлением закона Франка—Старлинга. В экспериментах на изолированных мышечных клетках с их растягиванием (увеличением длины) подвешенными грузиками было доказано, что при последовательном увеличении преднагрузки [на рисунке — это сила тяги (вес) подвешенных гирь — А, В, С, D] в активированном миоците повышается его напряжение без реального сокращения.
Закон Франка—Старлинга: сила сокращения желудочков сердца, измеренная любым способом, является функцией длины мышечных волокон перед сокращением
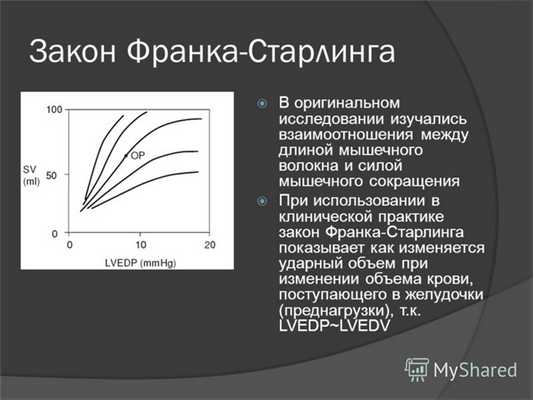
В графической форме показана зависимость силы сердечного сокращения от величины конечного диастолического объема. При кровенаполнении интактного левого желудочка в умеренном количестве (объемы А, В, С) внутриполостное давление медленно повышается, что затем обеспечивает увеличение силы сердечных сокращений. Давление, создаваемое в период изоволюмической (начальной) фазы систолы, отражает увеличение сократимости желудочка. При увеличении инотропного состояния желудочка кривая изоволюмического систолического давления смещается вверх (пунктирная линия)].
Это так называемое изометрическое сокращение (фрагмент I). Создаваемое напряжение мышц в ответ на воздействие каждой из четырех преднагрузок показано на фрагменте И. Воздействие увеличивающихся преднагрузок А, В и С вызывает возрастание напряжения миоцита. Однако при дальнейшем увеличении преднагрузки (гиря D) перекрытие толстых и тонких филаментов начинает уменьшаться, что выражается в падении напряжения активированного миоцита во время его изометрического сокращения (фрагменты I и II, фрагмент III).
Если левый желудочек будет наполняться кровью в возрастающем количестве, но при этом сохранять свой объем неизменным, ход кривой изоволюмического систолического давления будет отражать напряжение, т.е. сократительную способность, син: инотропное состояние) желудочков. Эта кривая аналогична кривой напряжения (изометрического сокращения), установленной для изолированных мышечных клеток.
В физиологических условиях наполнение желудочка в возрастающем объеме приводит к повышению внутриполостного давления, которое детерминирует увеличение силы сокращения желудочков.
Если на сердце действуют симпатомиметики, которые, опосредуя свои эффекты через (1-адренорецепторы, повышают концентрацию внутриклеточного Са2+, то это приводит к увеличению сократимости миокарда. Чем больше повышается внутриполостное давление крови при данном неизменном объеме наполнения желудочков, тем больше смешается вверх кривая изоволюмического давления отражая повышение сократимости стенки желудочка.
Когда давление в полости левого желудочка поднимается выше давления крови в аорте, аортальный клапан открывается и кровь изгоняется из левого желудочка. При повышении аортального давления сила сокращения желудочка должна также увеличиваться — это ответ на увеличение постнагрузки. В определенном лимитированном диапазоне наполнение желудочка в возрастающих количествах приводит к увеличению силы его сокращения благодаря возрастанию внутриполосгного давления.
Инотропное состояние миокарда
В качестве синонима данного понятия часто используют термин «сократимость» миокарда. Сократимость желудочка, например, характеризуется его способностью без увеличения конечно-диастолического объема, те. без участия механизма Франка—Старлинга, выбрасывать в аорту больший объем крови.
Инотропный эффект может быть положительным или отрицательным. Положительный инотропный эффект может проявиться в условиях увеличения притока крови к камерам сердца, например, при усиленной мышечной работе, централизации кровообращения в условиях развития экстремальных состояний организма, гиперволюмии различного генеза, пороках сердца -недостаточности клапанного аппарата. Отрицательный инотропный эффект может быть вызван изменением кровообращения при переходе из горизонтального в вертикальное положение (ортостатическая проба).
При снижении инотропности (сократимости) растяжение сердечной мышцы (увеличение конечно-диастолического объема) не сопровождается увеличением напряжения миокарда, т.е. для реализации данного способа регуляции не имеет значения степень конечно-диастолического растяжения кардиомиоцитов.
Сократимость детерминирует силу сердечных сокращений, которую на молекулярном уровне определяет интегративная активность саркомеров. Сократительная сила, генерируемая саркомером, зависит от степени взаимоперекрытия в них толстых и тонких нитей. Увеличение степени перекрытия и перекрестного взаимодействия нитей приводит к повышению силы сокращения. При достижении порогового уровня дальнейшее перекрытие взаимодействия нитей прекращается, что останавливает процесс увеличения сократительной силы.
При какой-либо фиксированной (постоянной) длине кардиомиоцитов (например, при неизменяющимся конечно-диастолическом объеме) сократительная сила зависит от их текущего функционального состояния и влияния на него целого ряда регулирующих факторов. К этим факторам относят:
• Катехоламины. Их количество определяется активностью симпатической нервной системы, которая свои положительные хронотропный и инотропный эффекты реализует через p-адренорецепторы миокарда. Этот механизм является наиболее важным в регуляции насосной функции сердца в физиологических условиях. Сократительная способность усиливается также катехоламинами, поступающими к сердцу с кровью из ганглиев симпатической нервной системы и хромаффинной ткани мозгового слоя надпочечников.
• Ионы кальция. Увеличение концентрации внутриклеточного Са2+ способствует усилению взаимодействия между тонкими и толстыми нитями, что увеличивает сократительный потенциал кардиомиоцитов.
• Кардиотропные симпатомиметические препараты (сердечные гликозиды, изопротеренол, кофеин, теофиллин и их производные) способны улучшать взаимоотношения между силой и скоростью сокращения кардиомиоцитов, что предопределяет использование таких препаратов в терапевтических целях для усиления работы сердца при любом конечнодиастолическом объеме.
Постнагрузка
Постнагрузка — это сопротивление изгнанию крови из желудочков в аорту и легочную артерию. Основным фактором постнагрузки является увеличение общего периферического сосудистого сопротивления (ОПСС). Причинами повышения постнагрузки, препятствующей изгнанию крови из сердца, могут быть артериальные гипертензии, стеноз аортального отверстия, коар-кгация аорты и сужение просвета легочной артерии, гидроперикардит.
Величина ударного объема напрямую зависит от степени укорочения волокон миокарда желудочка. Скорость и степень укорочения мышечных волокон стенки желудочка при том или ином значении длины миокардиального волокна в диастолу и сократимости миокарда обратно пропорциональны постнагрузке, испытываемой миокардом.
Величина постнагрузки при здоровом сердце зависит от уровня давления в аорте, но постнагрузка может быть определена и как напряжение или сила, развиваемые стенкой желудочка во время выброса крови. Следовательно, постнагрузка, испытываемая волокнами сердечной мышцы, также зависит от размеров сердца, что согласуется с законом Лапласа, в соответствии с которым напряжение мышечных волокон равно произведению давления в полости желудочка на радиус желудочка, деленному на толщину стенки желудочка.
Таким образом, при одном и том же аортальном давлении постнагрузка, испытываемая дилатированным желудочком, выше, чем желудочком с нормальными размерами. Более того, при любом давлении в аорте и объеме левого желудочка постнагрузка на миокард обратно пропорциональна толщине его стенки.
В свою очередь давление в аорте во многом зависит от периферического сосудистого сопротивления, физических характеристик артериального русла и объема крови, находящегося в нем в момент выброса крови из желудочка. При любом значении конечно-диастолического объема желудочка и уровне сократимости миокарда величина ударного объема левого желудочка находится в прямой зависимости от постнагрузки.
Как уже отмечено выше, повышение преднагрузки и сократимости миокарда стимулирует укорочение волокон миокарда, а постнагрузки замедляет этот процесс. Основными детерминантами ударного объема являются степень укорочения волокон миокарда и размеры левого желудочка.
Артериальное давление — это функция сердечного выброса и системного периферического сосудистого сопротивления. Величина постнагрузки зависит от размеров левого желудочка и уровня артериального давления. Повышение артериального давления, вызванное вазоконстрикцией, например, приводит к возрастанию постнагрузки, что по механизму обратной связи оказывает депрессивное влияние на процесс укорочения волокон миокарда, снижает величину ударного объема и сердечного выброса. Это в свою очередь способствует восстановлению артериального давления до исходного уровня.
Таким образом, миогенные механизмы регуляции деятельности сердца могут обеспечивать значительные изменения силы его сокращений.
Петля «давление-объем» — графический образ насосной функции сердца
Для удобства и объективизации анализа сердечной деятельности взаимосвязь преднагрузки, инотропного состояния и постнагрузки, т.е. факторов, определяющих насосную функцию сердца, нередко взаимоотношения между давлением и объемом крови в полостях сердца, интегрируют графически в виде соответствующих диаграмм (син: петель) «давление-объем» [в контексте излагаемого материала «петля» — это научное понятие (син.: цикл Карно), которое используют для обозначения обратимого кругового процесса (исторически оно вошло в научный лексикон при изучении термодинамики)].
Динамика «построения» такой петли (на примере насосной функции левого желудочка) представлена ниже.
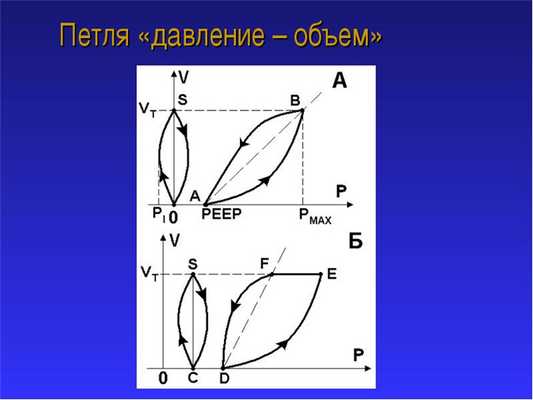
Когда открывается митральный клапан, левый желудочек начинает заполняться кровью. Объем желудочка постепенно растет, а в конце его диастолы происходит систола левого предсердия, которая активно увеличивает наполнение желудочка и соответственно давление в его полости — это преднагрузка. Наклон кривой диастолического давления является показателем диастолической «жесткости» (сопротивляемости, растяжимости) левого желудочка.
Затем начинается систола (период изоволюмического сокращения): давление в желудочке резко возрастает (кривая идет вверх) и когда оно превысит давление в аорте, открываются аортальные клапаны, а кровь начинает поступать в аорту. Сопротивление току крови в момент открытия аортальных клапанов — это постнагрузка (сопротивление опорожнению сердца). Далее кровь поступает в сосуды, объем желудочка уменьшается сначала медленно, а затем быстро падает давление в его полости. Окончание систолы зависит от сократительной способности миокарда (чем лучше сократимость, тем левее будет расположен этот угол и шире петля объем—давление).
Площадь петли численно равна работе, т.е. насосной функции, левого желудочка за один сердечный цикл, а форма петли отражает механизмы выполнения данной работы. Разумеется, площадь и форма петли зависят от конкретных условий функционирования сердечной помпы.
Таким образом, петля «объем — давление» позволяет визуализировать, т. е. формировать зрительный образ насосной функции сердца,проводить объективный анализ состояния внутрисердечной гемодинамики и ее изменений под влиянием различных факторов, в т.ч. лекарственных средств, действующих на инотропное состояние миокарда, преднагрузку и постнагрузку. В интегрированном виде данное утверждение проиллюстрировано на рис. 1.16.
При увеличении постнагрузки петля «объем-давление» перемещается вверх. Такой сдвиг связан с тем, что аортальные клапаны (правый верхний угол петли) открываются лишь тогда, когда систолическое изоволюмическое давление желудочка превысит давление в аорте. Сопротивление току крови в момент открытия аортальных клапанов — это постнагрузка, которая определяется двумя факторами: сопротивлением опорожнению сердца и напряжением волокон миокарда. В изоволюмическую фазу систолы напряжение волокон должно увеличиваться для преодоления сопротивления току крови. При этом очевидно, что чем меньше сократимость миокарда, тем меньше будет ширина петли и правее расположен ее левый верхний угол (окончание систолы).
При увеличении преднагрузки петля «объем-давление» смещается вправо. Левый нижний угол петли — время открытия митрального клапана (начало диастолического наполнения левого желудочка).Объем левого желудочка постепенно растет, а в конце диастолы увеличивается также давление в его полости (правый нижний угол петли соответствует окончанию диастолы) — это преднагрузка. Данный угол смещается вправо из-за повышения конечного диастолического давления в левом желудочке.
Таким образом, на приведенном примере можно убедиться, что петля «объем — давление», а точнее — ее площадь графически (количественно) отражает насосную функцию левого желудочка по преодолению аортального давления крови, а форма петли, т. е. ее структура, — механизм выполнения данной работы.
Преднагрузка и постнагрузка на сердце. Механизм Франка-Старлинга
Насосная функция сердца. Оценка насосной функции сердца
При выслушивании сердца стетоскопом мы не можем отметить момент открытия клапанов, потому что в норме это сравнительно медленный и беззвучный процесс. Однако когда клапаны закрываются, их края вибрируют из-за резких изменений давления; при этом возникают звуки, которые распространяются в грудной клетке во всех направлениях.
Во время сокращения желудочков первым возникает звук, связанный с закрытием А-В клапанов. Этот звук, низкочастотный и продолжительный, называют первым тоном сердца. Когда в конце систолы закрываются полулунные клапаны аорты и легочной артерии, слышен громкий хлопок. Этот звук, высокочастотный и короткий, называют вторым тоном сердца.
Работа сердца в течение одного сердечного цикла— это количество энергии, которое сердце преобразует в полезную работу, перекачивая ударный объем крови в артерии. Чтобы рассчитать работу сердца за минуту, необходимо работу, произведенную за один сердечный цикл, умножить на частоту сердечных сокращений.
Внешняя работа правого желудочка в норме составляет 1/6 работы левого желудочка, что связано с шестикратной разницей уровней систолического давления левого и правого желудочков. Кинетическая составляющая работы каждого желудочка пропорциональна массе изгнанной крови, умноженной на квадрат скорости ее изгнания.
Обычно кинетическая составляющая работы левого желудочка не превышает 1% общих затрат и не учитывается при расчетах. Но в ряде патологических случаев, например при аортальном стенозе, когда скорость кровотока через стенози-рованные клапаны резко возрастает, более 50% общих энергозатрат расходуется на этот вид работы.
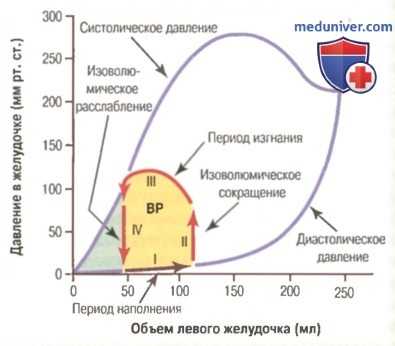
Связь между объемом левого желудочка и внутрижелудочковым давлением во время диастолы и систолы.
Красными стрелками показана рабочая диаграмма «объем-давление» (изменение внутрижелудочкового объема и давления в течение сердечного цикла).
ВР — внешняя работа.
Оценка насосной функции сердца
На рисунке представлена диаграмма, которая помогает понять механизм насосной функции левого желудочка. Особое значение имеют две кривые с обозначениями «диастолическое давление» и «систолическое давление». Это так называемые кривые «объем-давление».
Диастолическое давление измеряется перед самым началом сокращения желудочка, каждый раз в условиях все большего объема крови, наполняющей сердце. Этот показатель называют конечно-диастолическим давлением желудочка.
Систолическое давление регистрируется во время сокращения желудочков также при разном уровне наполнения его кровью.
При увеличении объема желудочка до 150 мл диастолическое давление существенно не меняется. Это значит, что наполнение желудочка кровью происходит легко, не встречая существенного сопротивления. Наполнение желудочка объемом крови большим, чем 150 мл, приводит ко все большему увеличению диастолического давления. Это связано с ограниченной возможностью желудочка растягиваться: с одной стороны, в состав стенки желудочка входит малорастяжимая фиброзная ткань, а с другой — сердце окружено перикардом, заполненным несжимаемой жидкостью.
Во время сокращения желудочка систолическое давление растет даже при незначительном увеличении объема крови и достигает максимальной величины при объеме 150-170 мл. Дальнейшее увеличение объема крови в желудочке приводит к снижению систолического давления. Это связано с перерастяжением миокарда, при котором нити актина и миозина в миофибриллах расходятся слишком далеко и взаимодействуют слишком слабо.
Интересно, что максимальный уровень систолического давления в левом желудочке сердца здорового человека лежит между 250 и 300 мм рт. ст.. Этот уровень широко варьирует у разных людей и, кроме того, зависит от нервных влияний. В правом желудочке максимальный уровень систолического давления лежит между 60 и 80 мм рт. ст.
Диаграмма «объем-давление» в течение сердечного цикла. Работа сердца. Красные стрелки на рисунке формируют петлю, которую называют рабочей диаграммой «объем-давление» во время сердечного цикла.
Диаграмма характеризует нормальную насосную функцию левого желудочка и может быть разделена на 4 фазы.
Фаза I. Период наполнения. На диаграмме эта фаза начинается от уровня наполнения желудочка 45 мл и диастолического давления 0 мм рт. ст.; 45 мл — это объем крови, оставшийся в желудочке после предыдущего сокращения, который называют конечно-систолическим объемом. За счет притока крови из предсердия объем желудочка увеличивается на 70 мл и достигает 115 мл. Это так называемый конечно-диастолический объем. Таким образом, диаграмма «объем-давление» во время фазы I соответствует красной стрелке «I», показывая увеличение объема крови в левом желудочке до 115 мл и диастолического давления — до 5 мм рт. ст.
Фаза II. Период изоволюмического сокращения. Во время этой фазы объем крови в желудочке не меняется, поскольку все клапаны закрыты. Однако внутрижелудочковое давление увеличивается до уровня давления в аорте, т.е. до 80 мм рт. ст., на что указывает красная стрелка «II».
Фаза III. Период изгнания. Во время изгнания систолическое давление растет, т.к. сокращение желудочка продолжается. В то же время объем желудочка уменьшается, поскольку аортальные клапаны открыты и кровь из желудочка поступает в аорту. Стрелка «III» на диаграмме отражает эти изменения.
Фаза IV. Период изоволюмического расслабления. В конце периода изгнания аортальные клапаны закрываются и давление в желудочке падает до уровня диастолического. Стрелка «IV» на диаграмме отражает снижение давления в желудочке без каких-либо изменений его объема. Итак, левый желудочек вернулся к своему начальному состоянию с объемом крови 45 мл и давлением 0 мм рт. ст. Читатель, хорошо знакомый с законами физики, без труда поймет, что площадь, ограниченная стрелками диаграммы, отражает внешнюю работу левого желудочка в течение одного цикла сокращения. В условиях эксперимента диаграмма «объем-давление» позволяет рассчитать внешнюю работу, выполняемую сердцем.
Когда сердце перекачивает большой объем крови, рабочая площадь диаграммы увеличивается. Она увеличивается вправо, потому что желудочек заполняется большим объемом крови в диастолу; она увеличивается вверх, потому что желудочек, сокращаясь сильнее, создает более высокое давление; наконец, площадь диаграммы увеличивается влево, потому что желудочек, сокращаясь сильнее, оставляет меньший конечно-систолический объем крови, особенно под влиянием симпатических нервов.
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, – 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин – доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
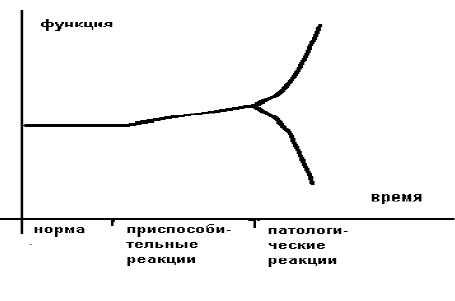
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение – определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» - сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани – мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности – церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) – больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) – жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов – централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции – застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров – плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы – развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
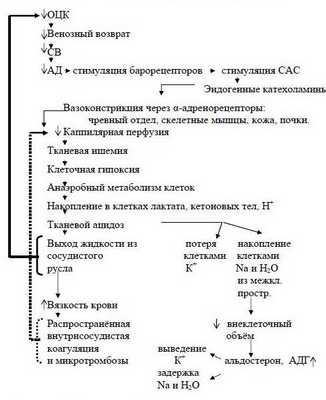
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" – развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов – раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
После окончания систолы желудочков возникает диастолический период желудочков сердца (диастола), длящаяся 0,47 с. Он включает в себя следующие периоды и фазы (при частоте сердечных сокращений 75 в минуту):
Период расслабления (0,12 с), состоящий из:
— протодиастолического интервала — 0,04 с (время от начала расслабления миокарда желудочков до закрытия полулунных клапанов);
— фазы изометрического (изоволюмического) расслабления — 0,08 с (время от закрытия полулунных клапанов до открытия атриовентрикулярных).
Период наполнения (0,35 с) состоящий из:
— фазы быстрого наполнения — 0,08 с (с момента открытия атриовентрикулярных клапанов);
— фазы медленного наполнения — 0,18 с;
— фазы наполнения желудочков, обусловленной систолой предсердий — 0,09 с.
Рис. 9.9. Сопоставление потенциала действия и сокращения миокарда с фазами изменения возбудимости. 1 — фаза деполяризации; 2 — фаза начальной быстрой реполяризации; 3 — фаза медленной реполяризации (фаза плато); 4 — фаза конечной быстрой реполяризации; 5 — фаза абсолютной рефрактерности; 6 — фаза относительной рефрактерности; 7 — фаза супернормальной возбудимости. Рефрактерность миокарда практически совпадает не только с возбуждением, но и с периодом сокращения.
К концу систолы желудочков и началу диастолы (с момента закрытия полулунных клапанов) в желудочках содержится остаточный, или резервный, объем крови (конечно-систолический объем). В это же время начинается резкое падение давления в желудочках (фаза изоволюмического, или изометрического, расслабления). Способность миокарда быстро расслабляться является важнейшим условием для наполнения сердца кровью. Когда давление в желудочках (начальное диастолическое) становится меньше давления в предсердиях, открываются атриовентрикулярные клапаны и начинается фаза быстрого наполнения, во время которой кровь с ускорением поступает из предсердий в желудочки. Во время этой фазы в желудочки поступает до 85 % их диастолического объема. По мере заполнения желудочков скорость их наполнения кровью снижается (фаза медленного наполнения). В конце диастолы желудочков начинается систола предсердий, в результате чего в желудочки поступает еще 15 % их диастолического объема. Таким образом, в конце диастолы в желудочках создается конечно-диастолический объем, которому соответствует определенный уровень конечно-диастолического давления в желудочках. Конечно-диастолический объем и конечно-диастолическое давление составляет так называемую преднагрузку сердца, которая является определяющим условием для растяжения волокон миокарда, т. е. реализации закона Франка—Старлинга.
Частота генерации возбуждения клетками проводящей системы и соответственно сокращений миокарда определяется длительностью рефрактерной фазы, возникающей после каждой систолы. Как и в других возбудимых тканях, в миокарде рефрактерность обусловлена инактивацией натриевых ионных каналов, возникающей в результате деполяризации (см. рис. 9.9).
Для восстановления входящего натриевого тока необходим уровень реполяризации около 40 мВ. До этого момента имеет место период абсолютной рефрактерности, который продолжается около 0,27 с. Далее следует период относительной рефрактерности (см. рис. 9.9), в течение которого возбудимость клетки постепенно восстанавливается, но остается еще сниженной (длительность 0,03 с). В этот период сердечная мышца может ответить дополнительным сокращением, если стимулировать ее очень сильным раздражителем.
За периодом относительной рефрактерности следует короткий период супернормальной возбудимости (см. рис. 9.9). В этот период возбудимость миокарда высока и можно получить дополнительный ответ в виде сокращения мышцы, нанося на нее подпороговый раздражитель.
Длительный рефрактерный период имеет для сердца важное биологическое значение, так как он предохраняет миокард от быстрого или повторного возбуждения и сокращения. Этим исключается возможность тетанического сокращения миокарда и нарушения нагнетательной функции сердца.
К тетаническому сокращению и утомлению в физиологическом понимании этого термина миокард не способен. При раздражении сердечная ткань ведет себя как функциональный синцитий, и сила каждого сокращения определяется по закону «все или ничего», согласно которому при возбуждении, превышающем пороговую величину, сокращающиеся волокна миокарда развивают максимальную силу, не зависящую от величины над-порогового раздражителя.
Преждевременное сокращение всего сердца или его частей в результате дополнительного возбуждения миокарда вызывает экстрасистолу. По месту возникновения дополнительного возбуждения различают синусовые, предсердные, атриовентрикулярные и желудочковые экстрасистолы.
Оценивая сократительные свойства мышцы, очень важно определить степень напряжения мышцы перед началом сокращения (так называемую преднагрузку), а также нагрузку, которую мышце предстоит преодолеть, развивая сокращение (так называемую постнагрузку).
Для сердца преднагрузка определяется величиной конечно-диастолического давления, когда наполнение желудочков кровью завершилось.
Постнагрузка желудочка определяется величиной давления в артерии, берущей начало от данного желудочка. На рисунке это соответствует систолическому давлению во время фазы III диаграммы «объем-давление». (Иногда постнагрузка несколько вольно определяется как сосудистое сопротивление, а не давление в сосудах.)
Понятия преднагрузки и постнагрузки имеют большое практическое значение: нарушение функции сердечно-сосудистой системы может протекать с резкими изменениями как преднагрузки или постнагрузки, так и обоих этих факторов одновременно.
Потребление кислорода сердцем. Сердечная мышца, так же как и скелетная мышца, использует химическую энергию для сократительной деятельности. Энергия освобождается главным образом при окислении жирных кислот и в меньшей степени — при окислении других субстратов, таких как лактат и глюкоза. Таким образом, уровень потребления кислорода сердечной мышцей является основным показателем энергетического обеспечения деятельности сердца.
Эффективность сердечных сокращений. В процессе сокращения сердечной мышцы большая часть освободившейся химической энергии превращается в тепло, а меньшая часть энергии затрачивается на совершение работы. Отношение рабочих энерготрат к общему количеству выделенной энергии характеризует эффективность сердечных сокращений, или коэффициент полезного действия сердца. КПД сердца здоровых людей составляет примерно 20-25%. В случае сердечной недостаточности этот показатель может уменьшаться до 5-10%.
В условиях покоя сердце перекачивает от 4 до 6 л крови в минуту. При тяжелой физической нагрузке сердцу необходимо перекачивать в 4-7 раз больше крови, чем в покое. Такому усилению сердечной деятельности способствуют: (1) внутрисердечные механизмы, регулирующие насосную функцию в зависимости от объема притекающей к сердцу крови; (2) центральные нервные механизмы, контролирующие частоту и силу сердечных сокращений с участием автономной (вегетативной) нервной системы.
Механизм Франка-Старлинга
Нам известно, что в разных ситуациях объем крови, который сердце перекачивает за минуту, почти полностью определяется венозным возвратом, т.е. объемом крови, поступающим в сердце из вен. Это можно объяснить следующим образом: кровоток каждого отдельного органа контролируется местными механизмами в зависимости от метаболических потребностей данного органа; кровь, оттекающая от отдельных органов, сливается в общую венозную систему и поступает к сердцу; сердце, в свою очередь, автоматически перекачивает всю поступившую к нему кровь в артериальное русло, снабжая периферические органы, и т.д.
Способность сердца адаптироваться к увеличению объема поступающей к нему крови называют внутрисердечным механизмом Франка—Старлинга, названным в честь выдающихся физиологов прошлого века. Суть механизма в следующем: чем больше степень растяжения миокарда объемом притекающей крови, тем больше сила сокращения сердечной мышцы и, следовательно, тем больше объем крови, который сердце перекачивает в аорту. Другими словами, в физиологических пределах сердце перекачивает всю кровь, которая возвращается к нему по венам.
Как объяснить механизм Франка-Старлинга? Когда избыточный объем крови поступает в желудочки, волокна сердечной мышцы растягиваются. Нити актина и миозина в миофибриллах занимают положение, близкое к оптимальному для развития большей силы сокращения. Таким образом, желудочки автоматически перекачивают избыточный объем крови в артерии.
Способность мышечных волокон, растянутых до оптимальной длины, сокращаться с большей эффективностью характерна для всех поперечнополосатых мышц, а не только для миокарда.
Усиление насосной функции сердца при увеличении венозного возврата происходит и по другой причине. Растяжение стенки правого предсердия приводит к увеличению частоты сердечных сокращений на 10-20%, что тоже вносит вклад в увеличение выброса крови из желудочков в артерии.
Видео физиология закона Франка-Старлинга
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:
- Примеры энуклеации при ретинобластоме
- Дифференциальная диагностика папиллита. Гипертрофия анальных сосочков.
- Гистологические исследования в гематологии. Показания к трепанобиопсии
- Селективные противовоспалительные препараты - лечим воспаление без опасности для желудка
- Рентгенограмма, сцинтиграмма, КТ, МРТ бластических костных метастазов позвоночника
