Препараты для химиотерапии болезни Ходжкина
Добавил пользователь Morpheus Обновлено: 22.01.2026
Современное лечение лимфогранулематоза - химиотерапия
Современные методы лечения лимфогранулематоза базируются на концепции о курабельности заболевания.
Для лечения используются:
1) лучевая терапия;
2) химиотерапия;
3) комбинированное лечение (химиотерапия с последующей лучевой терапией);
4) трансплантация гемопоэтических стволовых клеток.
Лучевая терапия лимфогранулематоза может использоваться в качестве:
а) единственного метода лечения (радикальная лучевая терапия);
б) компонента комбинированного лечения;
в) паллиативного средства.
Методика радикальной лучевой терапии была разработана в 60-е годы XX в. Основной принцип метода — облучение очагов первичного поражения и зон вероятного метастазирования в дозе, достаточной для уничтожения опухолевых клеток. Суммарная доза при этом составляет 40-45 Гр на очаг и 30-35 Гр на зоны профилактического облучения. Для уменьшения токсического действия используется фракционированное облучение небольшими разовыми дозами 5 дней в неделю в течение 4-5 недель.
Основные варианты радикальной лучевой терапии:
а) многопольное (последовательное) облучение;
б) крупнопольное (мантиевидное) облучение, при котором лучевая терапия проводится одновременно на все зоны (при поражении выше диафрагмы — шейные, надключичные и подмышечные лимфатические узлы с обеих сторон, а также медиастинальные лимфоузлы).
Частными вариантами мантиевидного облучения являются инвертированное Y-облучение (лучевая терапия на селезенку, парааортальные и паховые лимфатические узлы) и общее облучение лимфоидной ткани (лучевая терапия на все группы лимфатических узлов выше и ниже диафрагмы и селезенку).
Радикальная лучевая терапия резко улучшила прогноз заболевания. В 40-50-е годы XX века ремиссии были практически недостижимы, а более 5 лет жили только 5% пациентов. Радикальная лучевая терапия обеспечивает 5-летнюю безрецидивную выживаемость 90% больных с I стадией, 80% — со II стадией заболевания и существенно улучшает результаты лечения в далеко зашедших стадиях заболевания.

Вскоре после внедрения в практику радикальной лучевой терапии было установлено, что:
1) наилучший эффект достигается при I—II стадиях лимфогранулематоза; в далеко зашедших стадиях результаты значительно хуже, а частота побочных эффектов — выше;
2) наличие В-симптомов резко ухудшает результаты лечения. В связи с этим лучевая терапия стала единственным методом лечения больных лимфогранулематоз IA и IIА стадий, а при IB, IIB и IIIА стадиях использовалась вместе с химиотерапией (комбинированное лечение).
Позднее выяснилось, что результаты лучевой терапии при IA и IIА стадиях лимфогранулематоза ухудшаются при:
1) экстранодальных поражениях;
2) массивном поражении лимфатических узлов;
3) массивном поражении селезенки;
4) поражении не менее 3 зон лимфатических узлов;
5) увеличении СОЭ не менее 50 мм/ч. При наличии любого из этих факторов лучевую терапию стали дополнять химиотерапией.
У больных лимфогранулематоз III и IVA стадии в настоящее время чаще используется химиотерапия. Комбинированное химиолучевое лечение при этих стадиях используется все реже. При лимфогранулематозе IVB стадии лучевая терапия применяется в качестве паллиативного средства.
Наиболее частыми побочными эффектами лучевой терапии являются острые пневмониты, хронические рестриктивные заболевания легких, острые и хронические перикардиты и миокардиты, инфаркты миокарда (после лучевой терапии на область средостения), гипотиреоз и узловой зоб (после облучения шейно-надключичной области). Кроме того, в отдаленные сроки после лучевой терапии в больших дозах и комбинированного химиолучевого лечения достоверно чаще развиваются вторичные злокачественные новообразования: солидные опухоли (рак легкого, желудка, молочной и щитовидной желез), острые миелоидные лейкозы, неходжкинские лимфомы. В связи с этим в последние годы лучевая терапия при лимфогранулематозе используется все реже, причем уменьшаются как суммарные очаговые дозы (до 30 Гр и ниже), так и объем облучения.
Химиотерапия при лимфогранулематозе
Монохимиотерапия при лимфогранулематозе применяется редко и лишь с паллиативной целью (у пожилых пациентов с тяжелыми сопутствующими заболеваниями или в терминальной стадии заболевания, сопровождающейся гипоплазией костного мозга).
Основой лечения подавляющего большинства больных лимфогранулематозом (90-95%) является полихимиотерапия (ПХТ). Первая программа ПХТ (МОРР) была внедрена в практику в 1964 г. и привела к значительному улучшению прогноза у больных с далеко зашедшими стадиями лимфогранулематоза. Схема МОРР и ее модификации (MVPP, COPP, CVPP, ChlVPP) используются и сейчас, но чаще применяется программа ABVD (в большинстве стран это стандарт полихимиотерапии при лимфогранулематозе), а также режимы, состоящие из большого количества препаратов с целью предотвращения перекрестной химиорезистентности — альтернирующая схема МОРР (COPP)/ABVD и гибридная программа МОРР (COPP)/ABV.
Целью полихимиотерапии при любой стадии лимфогранулематоза является достижение полной ремиссии. Для этого проводят в большинстве случаев не менее 6 циклов химиотерапии, в том числе 2 — для консолидации ремиссии. Если ремиссия получена только после 6-го курса, проводят еще два курса лечения по той же программе.
Комбинированное лечение больных с III—IV стадиями лимфогранулематоза в последние годы стало использоваться реже. Лучевая терапия после полихимиотерапии обязательно применяется лишь в двух случаях:
1) при массивном поражении лимфатических узлов (bulky disease) до начала лечения;
2) при сохранении после полихимиотерапии резидуальной опухоли.
Основные побочные эффекты полихимиотерапии:
1) гематологическая токсичность (нейтропения, реже — тромбоцитопения и анемия);
2) диспепсические явления (тошнота и рвота);
3) сенсорная (реже моторная) нейропатия (винкристин);
4) фиброз легких (блеомицин);
5) кардиотоксичность (доксорубицин);
6) стерильность.
Основные схемы лечения лимфогранулематоза первой линии
Частота и выраженность побочных эффектов увеличиваются по мере кумуляции препаратов. Для оценки конкретных проявлений токсичности и решения вопроса о необходимости уменьшения дозы препараты используются формализованные шкалы токсичности.
После проведения цикловой полихимиотерапии у больных лимфогранулематозом увеличивается частота солидных и гематологических опухолей, однако злокачественные новообразования встречаются существенно реже, чем после лучевой терапии.
В последние годы внедряются новые режимы полихимиотерапии первой линии (VD, Stanford 5 и ВЕАСОРР), но по данным рандомизированных исследований окончательно не доказано их преимущество перед «золотым стандартом» — схемой ABVD. Заслуживает внимания так называемый «эскалированный» ВЕАСОРР, отличающийся от обычного режима более высокими дозами химиопрепаратов. В связи с эскалацией дозы обязательно применение Г-КСФ для сокращения периода нейтропении и выполнения протокола лечения в полном объеме. Установлено преимущество «эскалированного» ВЕАСОРР перед схемой COPP-ABVD при лечении больных с III и IV стадиями заболевания.
Развитие рецидива ухудшает прогноз лимфогранулематоза, но не означает фатального исхода: при рецидиве после лучевой терапии пациент может быть излечен с помощью полихимиотерапии, при рецидиве после полихимиотерапии — с помощью полихимиотерапии второй линии (B-CAV, СЕР, Dexa-BEAM).
В группах риска активно используется трансплантация гемопоэтических стволовых клеток (у подавляющего большинства пациентов — аутологичная). Основными показаниями к трансплантации являются:
1) первый рецидив, особенно при длительности первой полной ремиссии (ПР) менее года;
2) вторая ПР или второй и последующие рецидивы, чувствительные к полихимиотерапии;
3) отсутствие ПР после стандартной полихимиотерапии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Препараты для химиотерапии болезни Ходжкина
Химиотерапия при болезни Ходжкина предназначена для генерализованных стадий IIIБ, IVA и IVB. Ответы, получаемые этим лечением — ободряющие, хотя в этих случаях еще нельзя ставить вопрос об излечимости, как это происходит при локализированных стадиях, подвергаемых интенсивной рентгенотерапии.
Среди множества веществ, оказывающих цитостатическое действие, при болезни Ходжкина используются 4 класса медикаментов, а именно: алкилирующие вещества, алкалоидные производные Vinca rosea, производные метил-гидразина и кортикоидные гормоны. За последнее время некоторые авторы попробовали применять и некоторые цитостатические антибиотики.
Ниже в таблице приводятся наиболее часто используемые медикаменты при болезни Ходжкина, образ их введения и дозы, а также и вторичные эффекты, которые они способны вызывать.
Алкилирующие вещества. Азотиприт [methyl-bis-(b-chlorethylamine) (caryolysine, mustine) является первым цитостатиком, внедренным в терапевтический арсенал, причем он занимает и в настоящее время важное место в лечении болезни Ходжкина. Вводится только внутривенно. Весьма малостабильный и реагирует быстро с биологическими материалами. Медикамент плохо переносится, так как дает тошноты и рвоты, продолжающиеся иногда 2—3 дня после применения.
Главные цитостатические медикаменты, применяемые для лечения болезни Ходжкина
| Медикамент | Метод введения | Суточная доза (мг) | Общая доза (мг) | Вторичные эффекты |
| Азотиприт | в/в | 6/м2 через каждые 7 дней | 30—40/м2 | Тошнота, Грвоты. Кожные пузыри. Тромбофлебиты. Медуллярная токсичность. |
| Циклофосфамид | в/в, в/м., перорально | 300—500 | 7000—10 000 | Медуллярная токсичность. Геморрагический цистит. Алопеция. |
| Хлорамбуцил | перорально | 6—8 | длинный промежуток времени | Умеренная медуллярная токсичность. Тошнота, рвоты. |
| B.C.N.U. | в/в | 150—200/м2 | 600—800/м2 | Тошнота, рвоты. Муллярная токсичность. Гепатическая токсичность. Азотемия. Легочный фиброз. |
| C.C.N.U. | перорально | 100—130/м2 | 600—800/м2 | Такие же как при BCNU |
| Винкристин | в/в | 1,4/м2 | по переносимости | Нейротоксичность с парестезиями и парезами периферических нервов, параличный илеус; везикальная атония; медуллярная токсичность. Алопеция. |
| Винбластин | в/в | 6/м2 | длинное применение | Медуллярная токсичность. Тошнота, рвоты. Запор. Парестезии. |
| Прокарбазин | перорально | 100/м2 | 6000—9000/м2 | Тошнота, рвоты. Медуллярная токсичность. Депрессивные состояния. Алопеция. Кожные высыпания. |
| Блеомицин | в/в, в/м | 10/м2 | 400/м3 | Лихорадка. Кожные высыпания и поражения. Кожная пигментация. Алопеция. Ротовые и вульварные изъязвления. Легочный фиброз. |
| Адриабластин | в/в | 25—40/м2 | 450/м2 | Медуллярная токсичность. Алопеция. Ротовые изъязвления. Тошнота, рвоты. Сердечная токсичность с расстройствами ритма, а со временем, необратимая декомпенсация. |
Циклофосфамид [N, N-bis, (b-chlorethyl)NO-propilen-phosphoramid] (endoxan, Cytoxan) представляет то преимущество, что может применяться внутривенно, внутримышечно и перорально. Медикамент действует только in vivo вследствие окисления на уровне печеночных микросомальных энзимов. Циклофосфамид особенно активен при лимфомах, несмотря на то, что до сих пор не удалось доказать лучшую метаболизацию препарата при этих болезнях.
Наиболее специфическими вторичными эффектами этого препарата являются алопеция и геморрагический цистит.
Хлорамбуцил [acid-p-bis (b-chlorethylylamino-phenylbutyricum] (leukeran, chlorammophene), ароматное производное азотиприта, вводится перорально. Широко используется в терапии поддерживания.
Между различными аклилирующими веществами существует перекрестная резистентность, но иногда эту устойчивость можно преодолеть при помощи изменения доз или образа лечения.
За последнее время вошли в терапевтический арсенал лимфом новые вещества, которые несмотря на то, что имеют в своем составе алкилирукь щий радикал, действуют как ингибиторы синтеза нуклеиновых кислот. Такимих являются BCNU [1,3 bis (2chloroetbyl)-l nitrosureea] (carmustine) и CCNU [l-(2-chloroethyl))-3-cyclohexyl-l-nitrosoureea] (lomustine). Эти медикаменты не представляют перекрестной резистентности с вышеупомянутыми алкилирующими агентами и были включены в терапевтику устойчивых форм.

Алкалоиды из Vinca rosea, представленные винкристином (oncovine) и винбластином (velbe), входят в группу наиболее используемых медикаментов для лечения болезни Ходжкина. Препарат вводится только внутривенно. Среди особых вторичных эффектов следует отметить возникновение неврологических явлений. Если винбластин вызывает лишь маловыраженные симптомы периферической невропатии, после применения винкристина, эти невропатии периферической и автономной нервной системы могут принимать суровые аспекты, с мышечными атрофиями и функциональным бессилием, которые могут привести к прекращению лечения.
В основном, эти неврологические расстройства проходят спонтанно, после прекращения лечения.
Прокарбазин [chlorhydrat l-methyl-2 para (isopropyl-carbamylbenzil) hydrazine] (natulan) — сравнительно новый препарат, оказывающий особую активность при болезни Ходжкина. Применяется перорально, вызывая в начале лечения тошноту и рвоты, явления, которые сокращаются при продолжении введения медикамента. Сочетание с антиэметиками и иногда с витамином В6 в инъекциях, намного улучшает вторичные диггестивные эффекты натулана.
Производные кортизона (prednisoil, hidrocortizon,deltailuorocorti-zon) обычно применяются при застарелых формах болезни. Они влияют в первую очередь на грануломатозно-воспалительный компонент, в то время как эффекты на 'гуморальную пролиферацию несколько меньше. Оказывают немедленное действие на общие явления, лихорадку, прурит. Вторичные эффекты появляются после длительного применения и хорошо известны: кушингоидный синдром, диабет, желудочные и дуоденальные язвы и т.д.
Во избежание этих осложнений, De Vita и другие авторы предлагают для долгосрочного лечения применение прерывистой терапии высокими дозами, вводимыми через 2 дня.
За последние годы были введены в лечение болезни Ходжкина и некоторые цитостатические антибиотики как например блеомицин и адриамицин, показанные при устойчивых к классическим лечениям формах.
Химиотерапия при лимфоме
Химиотерапия при лимфоме — это спасение жизни, которую иными способами сохранить не удастся. Конечно лекарства не обещают 100% радикальности, как операция при раке, но вместе с облучением это единственно возможное и эффективное лечение. Проблема в том, что лимфомы способны изменяться, что обещает рецидивы и независимость от терапии.
Как проходит химиотерапия при лимфоме
При подавляющем большинстве злокачественных лимфом или лимфосарком химиотерапия подаётся на первое-второе и на третье, при некоторых клеточных вариантах после первой линии дополняется лучевой терапией в скромных, по сравнению с раковыми заболеваниями, дозах.
Роль облучения — поддержка достигнутого результата и дополнение его позитивом. Сегодня полностью отошли от радикальной программы лучевой терапии, несколько десятилетий доминировавшей при лимфоме Ходжкина, отказавшись от профилактического облучения не поражённых опухоль лимфоколлекторов. Из профилактического — только введение цитостатиков в спинномозговую жидкость, уменьшающее вероятность злокачественного поражения головного мозга и его оболочек.
Химиотерапия злокачественных лимфом получила новое развитие, наряду с проверенными десятилетиями схемами в «золотой стандарт» включена высокодозная ХТ (ВДХТ) с обязательной пересадкой предварительно собранных собственных кроветворных клеток. Пока не удалось разрешить трагическую дилемму трансплантации — она помогает пациенту выжить, но может способствовать рецидиву.
Сегодняшнее противоопухолевое лечение лимфом отобрало самые результативные комбинации, учитывающие иммуногистохимические характеристики злокачественных клеток. Для каждого прогностического варианта определено оптимальное число циклов, возраст больного и его хронические болезни уже не противопоказание для активного лечения, потому что созданы лекарственные комбинации на все случаи болезни, тем не менее, ограничения по применению цитостатиков включены в стандарты.
Химиотерапия используется всегда, когда в ней есть необходимость и нет абсолютных противопоказаний. На выборе схемы лечения сказываются не только клеточный вариант и прогностические характеристики лимфомы, распространённость болезни по данным ПЭТ-КТ, но и исходное состояние здоровья пациента.
Химиотерапия при лимфоме Ходжкина
Лимфома Ходжкина (или по-старому лимфогранулематоз) — одно из самых благоприятно текущих заболеваний лимфоидной ткани. Ходжкинская лимфома входит в ограниченное число болезней, излечиваемых только одной химиотерапией, но важная ремарка: диагностированная на ранней стадии и с признаками благоприятного течения. Прогноз ожидается малооблачным при небольшом поражении — не более двух групп лимфоузлов в верхней или нижней половине тела — по одну сторону диафрагмы, лучше без вовлечения лимфоузлов средостения и с исходными нормальными клиническими и биохимическими анализами крови.
Каждого пациента после первичного обследования относят к трём основным группам, по стандартам которых будет проводится противоопухолевое лечение, во всех случаях на первом этапе проводится химиотерапия, затем результат закрепляется трёхнедельным облучением зон поражения.
Первичная терапия из четырёх цитостатиков и «золотой стандарт» — схема ABVD, но при неважном прогнозе на излечение молодым пациентам (а молодые — это граждане до 50 лет без хронических болезней) может предлагаться терапия шестью и даже восемью препаратами, что при снижении частоты неудач терапии повышает трёхлетнюю выживаемость. Многокомпонентные комбинации чреваты 100% повреждением форменных элементов крови, поэтому в схему часто входит стимуляция выработки лейкоцитов (нейтрофилов).
Число курсов зависит от исходного поражения и прогноза, в лучшем случае при лимфоме I-II стадии предложат от 2 до 4 циклов четырёхкомпонентной схемы. При том же объёме поражения, но худших прогностических факторах, потребуется 4-6 курсов. Для повышения результативности первых два цикла у сохранных молодых пациентов заменяют на 6-компонентную схему, затем проводят 2 стандартных ABVD и можно уходить на облучение.
Распространенные стадии не обещают хорошего прогноза, поэтому химиотерапия длительная и многокомпонентная. Причём сколько циклов потребуется — 6 или 8, определят по результатам первых 4 циклов: если опухоль полностью ушла и ПЭТ это покажет — предложат пройти только два цикла, затем назначается трёх-четырёхнедельное облучение. При незначительном эффекте — 8 циклов и лучевая терапия на пораженные лимфоузлы.
Высокодозная химиотерапия с трансплантацией гемопоэтических, то есть кроветворных костномозговых, стволовых клеток проводится при рецидиве лимфомы Ходжкина. Для подготовки к высокодозному лечению за 2 недели введут винбластин или винкристин, так называемую терапию «спасения», что позволит определиться со степенью реакции на цитостатики, уменьшить объем поражения лимфоузлов, а также предотвратить очень опасную реакцию массивного распада опухолевых узлов.
У пожилых пациентов, в популяции это каждый третий больной, лечение выбирается с учетом хронической патологии. Так у курильщиков и страдающих болезнями легких в комбинацию не включают блеомицетин, накапливающийся в легочной ткани и вызывающий специфическое воспаление. При сердечной патологии кардиотоксичные антрациклины заменяют на другие противоопухолевые антибиотики.
Лимфома Ходжкина чувствительна к множеству цитостатиков, что позволяет найти оптимальную комбинацию, вплоть до применения одного-единственного цитостатика.
Химиотерапия при неходжкинских лимфомах
Неходжкинские лимфомы представлены множеством морфологических видов, каждый с особенностями течения и лечения. Разберём самые частые варианты заболевания.
Самая благоприятная по течению фолликулярная лимфома встречается в каждом пятом случае злокачественных лимфом у взрослых. В самом начале процесса без явных признаков активности не всегда требуется безотлагательная химиотерапия, у некоторых пациентов прогноз настолько неплох, что можно ограничиться облучением лимфомы либо длительным наблюдением с тщательным мониторингом анализов и регулярным обследованием каждые 3 месяца.
Сразу ХТ начинается только при вовлечении в злокачественный процесс любых органов или при поражении не менее трёх лимфатических зон с размером узлов более 3 сантиметров, или при лихорадке с потливостью, или при плохих показателях крови.
Оптимальный режим — R-CHOP, сочетающий сравнительно мягкие в плане осложнений алкилирующие цитостатики с иммунным препаратом ритуксимабом. Это моноклональное антитело при начальном и прогностически благоприятном процессе используют без ХТ — в монорежиме внутривенно, подкожно каждые 8 недель в течение двух лет применяют для поддержания позитивного результата после завершения циклов.
Вопрос о высокодозной химиотерапии с пересадкой костного мозга ставится при рецидиве или переходе фолликулярной лимфомы в более агрессивную, вероятность чего возрастает с течением времени, так через 10 лет переход в диффузную В-крупноклеточную лимфому отмечается у каждого шестого, а через 15 лет — у каждого второго. По истечении полутора десятилетий после первичного лечения частота рецидивов лимфомы сходит на нет.
У каждого третьего первичного пациента с лимфомой выявляют диффузную крупноклеточную В-клеточную лимфому (ДВКЛ), ежегодно её диагностируют только у пяти из каждых ста тысяч россиян.

Стандарт химиотерапии при неагрессивном варианте ДВКЛ, позволяющий 80% больных прожить дольше пятилетки — 6 циклов комбинации CHOP с ритуксимабом. При полном уничтожении новообразований в результате лекарственного воздействия, возможно подключение лучевой терапии в обычной для лимфом дозе 30-36 грей, а при остаточных опухолевых очагах дозу облучения доводят до 36-40 Грей.
Аналогичная комбинация цитостатиков с иммунным препаратом неважно работает при агрессивном варианте и большом распространении, поэтому химиотерапию усугубляют уменьшением интервалов между циклами R-CHOP или переводят на многокомпонентные комбинации.
При неблагоприятном прогнозе всем пациентам уже на первой линии проводится профилактика поражения головного мозга — введение высоких дох метотрексата и цитарабина в спинномозговую жидкость.
После завершения основной программы поддерживающая химиотерапия не проводится из-за не столь хорошей чувствительности опухолевых клеток к лекарствам. При рецидиве крупноклеточной лимфомы прибегают к комбинациям 2-й линии и трансплантации стволовых клеток крови после высокодозной ХТ.
Периферическая Т-клеточная лимфома — каждый четвёртый случай злокачественного поражения Т-клеточного ростка кроветворения или каждая шестая лимфома. Морфологически группа представлена разнообразными клеточными вариантами. Агрессивно текущее заболевание, как правило, вовлекает не только лимфатические узлы, но и другие органы.
В первой линии используют традиционный CHOP, но в редких случаях удается отказаться от ВДХТ с аутологичной трансплантацией клеток костного мозга. Некоторые виды лимфом благоприятного течения отзываются на облучение и L-аспарагиназу. При отсутствии эффекта лечение подбирается индивидуально.
Лимфомы одного названия предполагают множество различных морфологических вариантов заболевания, внутри групп клетки различаются ИГХ-характеристиками, предполагающими возможности индивидуального подбора противоопухолевого лечения, поэтому специалисты нашей Клиники могут предложить не один-два стандарта, а десятки комбинаций ХТ.
Возможные осложнения после химиотерапии при лимфоме
Тошноту и рвоту уменьшает включение в схемы глюкокортикоидных гормонов. Многокомпонентные комбинации обязательно предваряются введением антиэметиков , приём которых продолжается после завершения терапии.
Для профилактики нейтропении через сутки после цитостатика вводят стимулятор КСФ, что помогает не снижать следующую дозу и не увеличивать интервал без лечения.
Повреждение миокарда характерно для антрациклинов, облучение средостения дополнительно увеличивает кардиотоксичность. Осложнение может проявиться через несколько лет, профилактика не разработана, поэтому у страдающих сердечно-сосудистыми болезнями из схемы исключают антрациклины.
При чувствительности к ХТ и большом распространении лимфомы возможно развитие синдрома лизиса опухоли (СЛО), когда вышедшие из погибшие опухолевых клеток вещества отравляют организм, приводя к почечной недостаточности и гиперкалиемии с фатальной аритмией. Индуцированный лекарствами распад опухоли научились предотвращать.
При пересадке донорского костного мозга высока вероятность отторжения — реакция трансплантат-против-хозяина. При высокодозной терапии отдается предпочтение пересадке собственных клеток даже при угрозе рецидива лимфомы. Рецидив можно вылечить, отторжение трансплантата фатально для пациента.
Методы химиотерапии при лимфоме
Пациент получает лечение всеми способами, кроме внутримышечных инъекций из-за раздражающего действия цитостатиков и опасности осложнений со стороны мягких тканей.
Большинство цитостатиков вводится внутривенно струйно — болюсно или капельно.
Частый компонент схем — преднизолон принимается в таблетках, цитостатик прокарбазин — в капсулах.
Ритуксимаб применяется внутривенно и подкожно, подкожные инъекции удобны для поддержки.
Профилактика нейролейкемии проводится интратекально — введением препарата в спинномозговой канал, потому что организм специальным гематоэнцефалическим барьером защищает головной мозг от проникновения лекарства в крови.
Противопоказания к применению химиотерапии при лимфоме
Абсолютные противопоказания к ХТ при лимфомах — только декомпенсация других хронических заболеваний с существенным снижением функции органов.
Лимфомы чувствительны к лекарствам, а эффективное лечение существенно улучшает состояние, поэтому к терапии прибегают и у тяжелых больных с прогрессированием злокачественного процесса.
При ограниченных физических возможностях пожилых пациентов с большим числом хронических болезней подбирают «посильную» терапию, благо спектр активных препаратов при лимфоме очень объемен.
Препараты, применяемые при химиотерапии
При лимфомах применяется почти два с половиной десятка противоопухолевых препаратов, из которых составляют несколько десятков схем. Можно пересчитать по пальцам цитостатики, не используемые при лимфосаркомах.
Рацион и диета при химиотерапии при лимфоме
Из-за морфологической разнородности и множества клинических вариаций лимфом не было ни одного клинического исследования по симптоматической и сопроводительной терапии.
Диета должна учитывать исходное состояние организма и понесенные им в результате ХТ потери, поэтому общих рекомендаций «для всех» не существует, подбор оптимального питания всегда индивидуален и должен осуществляться специалистом-нутрициологом.
Прогнозы для пациентов
Эффективность лечения оценивают в середине программы и по её окончании, причём оптимально ПЭТ-КТ обследование.
На прогнозе сказывается очень много факторов, для каждого заболевания разработан свой прогностический индекс, поэтому и в диагнозе обязательно указывают прогностическую группу.
В конечном итоге перспективы на дальнейшую жизнь определяет результат химиотерапии и скорость развития рецидива.
Каждому хочется знать — что ждёт впереди, при злокачественном процессе важнее — как лечат и где лечат, потому что без современного обследования невозможно подобрать оптимальную терапию. В клинике «Евроонко» всё проходит на очень высоком уровне, вы можете лично убедиться в этом.
Препараты для химиотерапии
В настоящее время существует более сотни препаратов для химиотерапии рака (химиопрепаратов). Они различаются по химической структуре и механизмам действия, благодаря этому врач-химиотерапевт может подобрать наиболее оптимальное сочетание препаратов для конкретного пациента, в зависимости от типа, стадии рака и других факторов.
Как работают химиопрепараты?
Несмотря на разные механизмы действия, все химиопрепараты работают в одном направлении: они нарушают клеточный цикл, останавливают размножение раковых клеток и вызывают их гибель.
Противопоказания к химиотерапии
Несмотря на потенциальную пользу, которую способны принести химиопрепараты, некоторым пациентам они противопоказаны из-за высокого риска тяжелых побочных эффектов. К основным противопоказаниям относят тяжелую тромбоцитопению, острые инфекции с высокой температурой, тяжелые нарушения со стороны сердечно-сосудистой системы, легких, печени, почек, первый триместр беременности, перенесенные серьезные операции, пожилой возраст, сильное истощение.
Перед началом курса химиотерапии врач должен тщательно оценить состояние пациента, выявить имеющиеся у него проблемы со здоровьем и связанные с ними потенциальные риски.
Противопоказания к применению противоопухолевых препаратов бывают не только абсолютными, но и относительными. Химиотерапию проводить можно, но только с соблюдением некоторых условий:
- Снизить дозы, подобрать препараты, которые наиболее безопасны.
- Использовать один препарат химиотерапии вместо комбинации из двух и более.
- Перед началом курса провести лечение и устранить имеющиеся проблемы со здоровьем.
- Выждать некоторое время, например, после перенесенной операции или пока не стихнет инфекция.
В каждом случае требуется индивидуальный подход.
Типы химиопрепаратов
Препараты для химиотерапии делят на группы, в зависимости от химической структуры и механизма действия. Один и тот же препарат может работать разными способами и относиться к разным группам. Зная, к какой группе относится химиопрепарат, врач может прогнозировать лечебные и побочные эффекты, правильно спланировать курс лечения.

Цитостатики и цитотоксические препараты
Традиционно противоопухолевые препараты делят на две группы:
- останавливают размножение раковых клеток и запускают в них процесс запрограммированной клеточной смерти — апоптоз. К этой группе относят, в частности, фторурацил, цисплатин, доксорубицин.
- Цитотоксические (цитотоксины) повреждают ядро, оболочку и другие компоненты клетки, приводят к её гибели.
Также в настоящее время существуют таргетные препараты, которые нарушают жизнедеятельность и размножение опухолевых клеток путем воздействия на определенные молекулы-мишени, и иммунопрепараты, которые задействуют ресурсы противоопухолевого иммунитета.
Алкилирующие агенты
Самая старая группа средств для химиотерапии. Они так названы потому, что могут алкилировать различные молекулы, включая ДНК, РНК и белки. Препарат связывается с молекулой ДНК и приводит к ее разрыву во время удвоения в процессе деления клетки. В итоге запускается процесс запрограммированной клеточной гибели — апоптоз.
Алкилирующие агенты атакуют клетки на любой стадии клеточного цикла. Химиотерапия данными средствами эффективна при многих типах рака: легких, яичников, молочной железы, а также при саркомах, множественных миеломах, болезни Ходжкина, лимфоме, лейкемии.
Представители группы: цисплатин, карбоплатин, дакарбазин, хлорамбуцил, оксалиплатин, темозоломид.
Антиметаболиты
Эти препараты атакуют опухолевые клетки на стадии удвоения хромосом во время деления. Они нарушают синтез новых РНК и ДНК, занимая места нуклеотидов — «звеньев», из которых состоят цепочки нуклеиновых кислот. Антиметаболиты эффективны в качестве химиотерапии при раке кишечника, яичников, молочной железы, лейкемии.
Представители группы: 5-фторурацил, 6-меркаптопурин, капецитабин, гемцитабин, метотрексат.
Противоопухолевые антибиотики
Напоминают антибактериальные препараты, которые используются для лечения инфекций. Эти химиопрепараты повреждают ДНК опухолевых клеток и нарушают их размножение. Существуют разные группы антибиотиков для химиотерапии, одна из них — антрациклины. Эти препараты нарушают функции ферментов, которые необходимы для удвоения ДНК.
Представители антрациклинов: доксорубицин (адриамицин), эпирубицин, даунорубицин, идарубицин.
Представители противоопухолевых антибиотиков, не являющихся антрациклинами: блеомицин, митоксантрон, митомицин-С, актиномицин D.
Ингибиторы топоизомеразы
Молекула ДНК состоит из двух цепочек, закрученных в спираль. Для того чтобы скопировать ее во время деления клетки, спираль нужно «распутать». За эту функцию отвечает особый фермент топоизомераза. Существуют средства для химиотерапии, которые блокируют его, тем самым нарушая процессы клеточного деления. Ингибиторы топоизомеразы эффективны при раке желудка и кишечника, яичников, легких, при лейкозах.
Представители группы: топотекан, иринотекан, этопозид, тенипозид, митоксантрон.
Ингибиторы митоза
Средства для химиотерапии из этой группы имеют растительное происхождение. Они блокируют деление клеток, нарушая функцию микротрубочек и некоторых белков-ферментов. Ингибиторы митоза применяют для лечения рака молочной железы, легких, миеломы, лимфомы, лейкозов.
Представители группы: доцетаксел, паклитаксел, винбластин, винкристин.
Винкаалкалоиды
Первые ингибиторы митоза из этой группы — винбластин и винкристин — были выделены из растения барвинок розовый (Vinca rosea). Затем на основе винбластина были созданы полусинтетические соединения для химиотерапии — винорелбин и виндезин. Основной механизм действия этих препаратов состоит в том, что они связывают с белком тубулином в составе микротрубочек и не дают ему полимеризоваться. Деление клеток останавливается.
Также винкаалкалоиды нарушают другие клеточные процессы: изменяют обмен аминокислот и некоторых других веществ, влияют на синтез нуклеиновых кислот, жиров, клеточное дыхание.
Таксаны
Эти препараты начали широко применяться для химиотерапии с 90-х годов прошлого столетия. Первым был получен 1960-х годах паклитаксел из экстракта тихоокеанского тиса (Taxus brevifolia). В 1980-х годах из экстракта хвои европейского тиса (Taxus baccata) удалось выделить более мощный препарат — доцетаксел.
Таксаны тоже влияют на микротрубочки, но не так, как винкаалкалоиды. Они, напротив, ускоряют полимеризацию тубулина, впоследствии препятствуют его деполимеризации и распаду микротрубочек. Из-за этого также нарушается деление клеток.
Глюкокортикостероиды
Глюкокортикостероиды, или глюкокортикоиды, представляют собой препараты гормонов коры надпочечников. Они обладают многими функциями, в частности, принимают участие в регуляции обмена веществ, подавляют иммунные реакции и воспаление. Также эти препараты обладают противоопухолевыми свойствами. Иногда глюкокортикоиды используют для поддерживающей терапии. Они помогают устранить вызванную противоопухолевыми препаратами тошноту и рвоту, предотвратить аллергические реакции.
Представители группы: метилпреднизолон, преднизон, дексаметазон.
Лекарства для химиотерапии, которые не относятся к каким-либо группам
Некоторые химиопрепараты не входят ни в одну группу и обладают собственными механизмами действия. Например, ингибитор протеосом бортезомиб, фермент L-аспарагиназа.
Принципы применения препаратов для лечения рака
Для того чтобы обеспечить необходимую эффективность химиотерапии, нужно придерживаться некоторых правил:
- Как можно более раннее начало лечения. Пациент должен начать получать химиопрепараты сразу же, как только выявлены показания к их применению. К сожалению, в российских государственных клиниках дела с этим обстоят не лучшим образом. Зачастую не сразу удается попасть на прием к врачу и пройти необходимые обследования. Крупные онкологические центры постоянно сильно загружены, и пациентам приходится ждать своей очереди, чтобы начать лечение. Но рак не станет ждать, он прогрессирует, и со временем прогноз может ухудшиться. В «Евроонко» доступны все группы препаратов, и мы всегда начинаем терапию в кратчайшие сроки.
- Применение комбинаций препаратов. Обычно назначают 2–3 химиопрепарата с разными механизмами действия.
- Правильный подбор схемы химиотерапии. Разные типы рака обладают неодинаковой чувствительностью к тем или иным противоопухолевым препаратам. Врачи ориентируются на протоколы лечения. Эти документы составлены на основе результатов научных исследований с участием тысяч пациентов по всему миру, и в них расписаны сочетания препаратов, которые с наибольшей вероятностью будут эффективны при тех или иных злокачественных опухолях. На случай, если терапия первой линии не помогает, предусмотрены «запасные» варианты.
- В максимально короткие сроки нужно создать в тканях оптимальную концентрацию химиопрепарата и затем поддерживать её. Для этого важно правильно определиться с дозировками и частотой введений. Химиотерапию проводят циклами: больному вводят препараты, а затем дают некоторое время (обычно 1–3 недели) на «передышку». Курс может состоять из нескольких циклов.
- При неоперабельном раке лечение продолжают, пока препараты работают или не начинают вызывать тяжелые побочные эффекты.
- Пациент должен переносить химиотерапию комфортно. В «Евроонко» постоянно контролируют его состояние, проводят необходимые исследования и анализы, вводят противоопухолевые препараты под прикрытием поддерживающей терапии.
Дозировки
Подбор оптимальной дозы химиопрепаратов можно в какой-то степени сравнить с хождением по канату. Если дозировка будет слишком низкой, лечение станет недостаточно эффективным и ухудшится прогноз, а если слишком высокой, можно получить тяжелые осложнения. Ситуация осложняется тем, что «канат» у каждого пациента разной «толщины» — это зависит от размеров тела, индивидуальной способности организма метаболизировать лекарство.
Обычно дозировку химиопрепаратов рассчитывают, основываясь на площади поверхности тела или весе пациента. Также нужно учитывать общее состояние здоровья, сопутствующие заболевания.
Способы введения в организм
Чаще всего химиопрепараты вводят внутривенно или перорально (от латинского per os — «через рот»). Но существуют и другие пути введения:
- Подкожные и внутримышечные инъекции.
- Интратекально — в спинномозговую жидкость.
- Внутрибрюшинно — в брюшную полостью. При канцероматозе брюшины применяется современная методика HIPEC (гипертермическая интраперитонеальная химиотерапия), когда после удаления из брюшной полости всех крупных очагов её промывают подогретым раствором химиопрепарата, чтобы уничтожить оставшиеся мелкие очаги.
- Внутриплеврально — в плевральную полость, окружающую легкие.
- Внутриартериальная химиотерапия — непосредственно в артерию, питающую опухоль. При этом можно использовать высокие дозы химиопрепаратов: они почти не проникают в системный кровоток и не вызывают серьезных побочных эффектов.
- Введение в мочевой пузырь с помощью катетера.
Когда больному требуется лечение в течение длительного времени, в «Евроонко» применяют имплантируемые венозные порт-системы. Под кожу подшивают небольшой резервуар, одна из стенок которого представлена специальной мембраной, и соединяют его катетером с веной. В дальнейшем лекарства вводят с помощью иглы, которой прокалывают кожу и находящуюся под ней мембрану.
Эффективность препаратов, применяемых при химиотерапии
Для того чтобы судить об эффективности химиотерапии, обычно нужно провести не менее 2–3 циклов лечения. Затем выполняют исследования, которые помогают визуализировать и измерить опухоль, проводят анализы на онкомаркеры. Возможен один из четырех результатов:
- Полный ответ. Опухоль исчезла, уровень онкомаркера снизился и находится в пределах нормы.
- Частичный ответ. Опухоль уменьшилась, уровень онкомаркера при этом также может снизиться.
- Стабильное состояние: размеры и количество опухолей, уровень онкомаркера не изменились.
- Прогрессирование на фоне лечения: опухоль продолжает расти, появляются новые очаги, уровень онкомаркера повышается.
Если лечение эффективно, его продолжают по прежней схеме. В противном случае комбинации химиопрепаратов нужно менять.
Побочные эффекты применения химиопрепаратов
Химиотерапия вызывает различные побочные эффекты. Симптомы могут возникать спустя некоторое время после начала лечения и даже по завершении курса. Одни из них быстро проходят, другие сохраняются в течение длительного времени. Степень их выраженности тоже бывает разной, это зависит от многих факторов, таких как возраст, состояние здоровья пациента, тип, доза и способ введения химиопрепарата, параллельный прием других лекарств.
Вы можете подробно узнать о возможных побочных эффектах химиопрепаратов на этой странице.
Что такое персонализированная химиотерапия?
За последние годы подходы к классификации злокачественных опухолей несколько изменились. Раньше ученые могли лишь рассматривать раковые клетки под микроскопом, сейчас появилась возможность изучать их молекулярно-генетические характеристики. Клетки могут выглядеть одинаково, но иметь разный набор изменений в генах. В них вырабатываются разные вещества, которые по-разному помогают им выживать, размножаться, защищаться от агрессии иммунитета.
Если рассматривать рак на молекулярно-генетическом уровне, то окажется, что двух одинаковых опухолей практически не существует. Каждый пациент индивидуален, каждому нужен свой подход при выборе комбинации химиопрепаратов. Такое лечение называется персонализированным. Оно наиболее эффективно, так как в нем реализован важнейший принцип медицины: «лечить не болезнь, а больного».
Сейчас молекулярно-генетические исследования, которые помогают назначить персонализированную химиотерапию, доступны далеко не в каждой клинике. Но за ними — будущее онкологии.
Таргетная терапия и иммунотерапия: «усовершенствованные» химиопрепараты
Возможность изучать молекулярно-генетические характеристики рака привела к появлению относительно новой группы противоопухолевых средств — таргетных препаратов. Эти «снайперы» действуют на конкретные молекулы, которые необходимы злокачественным опухолям для роста, выживания, защиты от иммунитета. В отличие от классических химиопрепаратов, таргетные препараты не действуют на здоровые клетки, реже вызывают тяжелые побочные эффекты.
Большие надежды современные ученые и врачи-онкологи возлагают на иммунопрепараты. Эти лекарственные средства используют возможности иммунной системы, чтобы уничтожать раковые клетки.
Развитие онкологии не останавливается. Ученые продолжают работать над созданием новых противоопухолевых препаратов. Некоторые лекарства сейчас проходят клинические испытания. К сожалению, создание и проверка новых препаратов — процесс долгий и недешевый. Тем не менее, прогресс есть, а значит, есть и надежда для онкологических больных.
Препараты для восстановления после химиотерапии
Как мы уже упоминали, химиопрепараты атакуют не только опухолевые, но и здоровые клетки. После курса лечения в той или иной степени могут пострадать разные органы. Это неизбежное зло, с которым приходится мириться, чтобы уничтожить раковые клетки.
Для более быстрого и полноценного восстановления после химиотерапии каждый пациент получает индивидуальную программу лечения. В первую очередь усилия направлены на восстановление состава крови, нормализацию работы печени, почек, сердца, борьбу с депрессией и другими психоэмоциональными проблемами.
Выбор препаратов для восстановительного лечения после химиотерапии довольно большой. Важно не забывать и о таких «скучных» мерах, как правильный образ жизни, питание, полноценный сон и отдых, физическая активность. БАДы тоже могут быть полезны, но если вы решили принимать их, сначала нужно проконсультироваться с лечащим врачом.
Схемы химиотерапии болезни Ходжкина - монохимиотерапия, полихимиотерапия
Монохимиотерапия: лечение болезни Ходжкина производилось долгое время только одним цитостатиком, в виде ударных лечебных курсов, причем суточные и максимальные дозы вводились согласно таблице. Для монохимиотерапии наиболее часто употребляемыми медикаментами являются: азотиприт, натулан, циклофосфамид, винбластин. Согласно статистике, благодаря этим медикаментам получаются результаты приблизительно в 50—71% случаев.
Однако процент полных ремиссий довольно низкий (25%), а средняя продолжительность ремиссий колеблется между 3 и 6 месяцами (Mathe и Kenis). По статистике бухарестского Института Внутренней Медицины, наилучшие результаты были получены вследствие применения натулана или винбластина (Gociu и сотр.). Продолжительность ремиссий увеличивается при помощи поддерживающего лечения. В настоящее время монохимиотерапия значительно сократилась, ограничиваясь лишь лицами старше 60 лет, плохо переносящими полихимиотерапию.
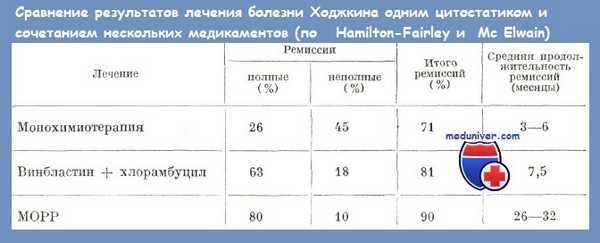
Полихимиотерапия: сочетание 2 или нескольких цитостатиков при лечении болезни Годжкина привело к росту процента, качества и продолжительности ремиссий. В таблице ниже приводятся сравнительно результаты, полученные от монхимиотерапии и полихимиотерапии.
Были испробованы различные формулы медикаментозных комбинаций, в которые входили 2—5 веществ. Преследуемой целью было пресечение клеточной пролиферации по нескольким метаболическим путям. Поэтому вещества, используемые в той или иной комбинации, обладают каждое своим образом действия, например: аклилирующее вещество (азотиприт или его производное); ингибитор нуклеиновых кислот (натулан, BCNU, CCNU); токсическое вещество для миототического веретена (винкристин или винбластин); кортикоидные гормоны.

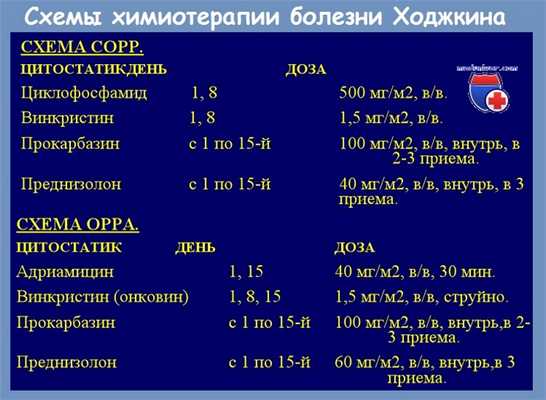
В своем обзоре литературы по специальности Goldsmith и Carter доказывают, что наилушчие результаты были получены посредством комбинаций, предложенной De Vita и сотр.: азотиприт, винкристин, натулан, преднисон, известной под названием МОРР.
Лечение осуществляется в виде 2 недельного курса с 2 недельным перерывом мечду курсами. Применяется необходимое число курсов до получения полной ремиссии, с еще двумя дополнительными курсами.

Как правило, применяются минимум 6 курсов лечения. Важно соблюдать введение всех медикаментов, а также ритмичность курсов, так как продление перерывов благоприятствует возвратам. Если происходит понижение количества лейкоцитов и/или тромбоцитов, лечение следует продолжать приспособляя дозы согласно таблице.
Результаты, полученные при помощи курсов лечения МОРР, пересмотренные после 15 лет их применения (De Vita и сотр.) можно считать очень хорошими, так как и в их случаях можно ставить вопрос о излечении. Процент полных ремиссий достиг 80. У пациентов с полными ремиссиями наблюдались 5-летние выживания в 82% случаев и 10-летние выживания в 73%.
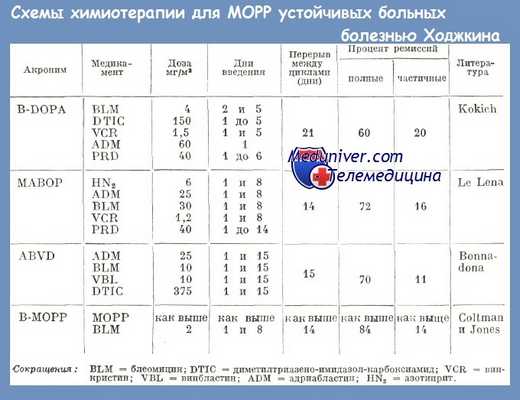
Применение лечения МОРР пациентам, которым применялись другие лечения, дает менее благоприятные результаты: в среднем 50% ремиссий, продолжительностью в 7 месяцев.

Некоторые авторы заменили винкристин с винбластином (лечение MVPP) (Hamilton, Fairley и Мс Elvain), причем полученные результаты подобны тем, которые были получены курсами лечения МОРР). Замещение азотиприта с циклофосфамидом (лечение СОРР) дает более низкий процент полных ремиссий.
Устойчивые к курсовым лечениям МОРР случаи вообще трудно поддаются лечению. За последние годы был предложен ряд новых лекарственных комбинаций, которые можно использовать и как первоначальное лечение.
У детей младше 16 лет ответ на лечение слабее, чем у взрослых. При лечениях МОРР частота полных ремиссий составляет 53% (DeVita и сотр.). Smith и сотр. предлагают применять лучевую терапию одновременно с химиотерапией. Первые результаты повидимому удовлетворительные.
Читайте также:
