Примеры интравитреальной химиотерапии диссеминации ретинобластомы
Добавил пользователь Владимир З. Обновлено: 09.01.2026
Ретинобластома: признаки, гистология, лечение, прогноз
Ретинобластома - наиболее часто встречающаяся внутриглазная злокачественная опухоль детского возраста (1-45), развивающаяся приблизительно у 1 из 15000 живых новорожденных. Эта злокачественная опухоль развивается скрыто, проявляется лишь безболезненной лейкокорией и приводит к гибели пациента (1,2). При отсутствии лечения летальный исход наступает в течение 1-2 лет. Массивные опухоли, прорастающие окружающие ткани, характеризуются наибольшим риском метастазирования. Во всем мире выживаемость при ретинобластоме коррелирует с уровнем экономического развития: в Африке она составляет приблизительно 30%, 60% - в Азии, 80% - Латинской Америке, и от 95% до 97% в Европе и Северной Америке (1).
а) Генетика. Причиной ретинобластомы является соматическая или зародышевая мутация 13 хромосомы (3-8). При всех двусторонних и семейных формах ретинобластомы имеются зародышевые мутации. При односторонней ретинобластоме зародышевая мутация выявляется в 15% случаев и соматическая мутация - в 85% случаев. У пациентов с зародышевой мутацией может присутствовать видимые клинические проявления синдрома 13q хромосомы; также у них отмечается высокий риск развития пинеа-лобластомы и других злокачественных опухолей.
Пинеалобластома и другие параселлярные опухоли с точки зрения анатомии, эмбриологии и иммунологии идентичны ретинобластоме (9-16). У пациентов с зародышевой мутацией отмечена тенденция к развитию этих злокачественных опухолей, обычно они возникают в течение года после диагностики ретинобластомы и почти всегда в возрасте моложе пяти лет (14). Сочетание двусторонней ретинобластомы и пинеалобластомы получило название трилатеральной ретинобластомы. Но этот термин не совсем точен, поскольку у некоторых пациентов с пинеалобластомой ретинобластома развивается только с одной стороны или не развивается вовсе.
С другой стороны, другие злокачественные опухоли у таких больных могут развиваться в течение всей жизни (17-21), наиболее часто это остеосаркома длинных костей, саркома мягких тканей и меланома кожи. Если пациенты с зародышевой мутацией выживают после второй злокачественной опухоли, у них также сохраняется риск развития третьей, четвертой и пятой опухолей. У детей, получавших системную химиотерапию по поводу ретинобластомы, отмечается снижение риска развития других злокачественных опухолей в отдаленном периоде (21).
б) Клиническая картина. Клинические признаки ретинобластомы варьируют в зависимости от распространенности опухоли (22-45). В большинстве случаев опухоль выявляется у детей в возрасте младше трех лет. Однако эта опухоль может диагностироваться и в более старшем возрасте, у подростков или даже у взрослых (29, 30). В Соединенных Штатах первыми симптомами опухоли чаще всего являются лейкокория (56%), косоглазие (24%) и низкие зрительные функции (8%) (22). В более позднем исследовании другой группы пациентов, проведенном в США и включавшем в себя около 1200 глаз, средний возраст на момент манифестации заболевания составил 15 месяцев, 51% составили пациенты мужского пола, 49% - женского, одностороннее поражение наблюдалось в 53% случаев, в 47% диагностирована двусторонняя опухоль (23). Другие крайние цифры были получены в некоторых областях Африки, где опухоль чаще всего манифестирует буфтальмом (56%) и лейкокорией (32%), при этом отмечается высокий риск двусторонней энуклеации и летального исхода (24).
Клинически ретинобластома возникает в виде мелкого прозрачного новообразования сенсорной сетчатки, которое можно легко не заметить при офтальмоскопии. По мере увеличения опухоли она становится матово-белой, появляются расширенные ретинальные питающая артерия и дренирующая вена, может развиваться вторичная отслойка сетчатки. Среди первых симптомов наиболее известен белый зрачковый рефлекс, получивший название лейкокория. По мере роста опухоли она перестает быть исключительно интраретинальным новообразованием и демонстрирует экзофитный рост, эндофитный рост, или комбинацию этих двух типов роста. Экзофитный рост характеризуется увеличением опухоли кнаружи, в субретинальное пространство, что вызывает отслойку вышележащей сетчатки. Эндофитный рост характеризуется появлением в стекловидном теле отсевов опухолевых клеток, иногда препятствующих визуализации сетчатки. Изредка в ткани ретинобластомы может формироваться внутренняя полость, что указывает на высокую дифференцировку опухоли (36).
Реже наблюдается диффузный инфильтративный рост, характеризуемый развитием плоской или минимально проминирующей опухоли (31); хотя диффузная ретинобластома обычно локализуется в задних отделах сетчатки, изредка она развивается вблизи ora serrata и над цилиарным телом и не прорастает расположенные сзади структуры (32). Ретинобластома становится причиной вторичной глаукомы приблизительно в 17% случаев, обычно вследствие неоваскуляризации радужки и вторичного закрытия угла передней камеры (33). Неоваскуляризация радужки может сопровождаться спонтанными гифемами, которые изредка являются первым симптомом опухоли. Воспаление, вызванное некротической внутриглазной ре-тинобластомой, может симулировать или провоцировать целлюлит глазницы (34). Хотя обычно сохраняются прозрачность и правильное положение хрусталика, в редких случаях развиваются катаракта и подвывих хрусталика. В далекозашедших случаях наблюдается экстрасклераль-ное распространение опухоли, которая выглядит как объемная эрозивная масса.
РЕТИНОБЛАСТОМА: КЛИНИЧЕСКАЯ КАРТИНА
На ранних стадиях ретинобластома представляет собой мелкое прозрачное новообразование сетчатки. Несколько увеличившись, она становится матовой и более заметной, со временем появляются расширенные сосуды - питающая ретинальная артерия и дренирующая вена. Иногда при офтальмоскопии в ткани опухоли визуализируются очаги кальциноза «мелового» белого цвета. Опухоли фовеолярной области вызывают нарушение фиксации взора и развитие косоглазия, как эзотропии, так и экзотропии. Со временем развивается характерный белый зрачковый рефлекс (лейкокория). В большинстве случаев опухоль диагностируется уже после развития лейкокории.
Мелкая ретинобластома снизу от центральной ямки правого глаза. Несколько более крупная ретинобластома сверху от диска зрительного нерва. Обратите внимание на расширенные сосуды - питающую артерию и дренирующую вену. Более крупная ретинобластома в верхней части макулярной зоны. Обратите внимание на расширение сосудов верхней аркады, идущих от диска зрительного нерва, при этом сосуды нижней аркады не расширены. Две ретинобластомы, прилегающие к диску зрительного нерва. Верхняя опухоль диссеминирует в вышележащее стекловидное тело (эндофитный рост), нижняя опухоль все еще лежит в плоскости сетчатки. Массивная ретинобластома эндофитного типа. Массивная ретинобластома экзофитного типа.
в) Спонтанный регресс. Приблизительно в 3% случаев отмечается тенденция к спонтанному регрессу ретинобластомы (37-40). Первоначально была описана спонтанно регрессировавшая ретинобластома, имевшая достаточно типичные клинические признаки. Впоследствии был описан доброкачественный вариант ретинобластомы, названный рети-ноцитомой или ретиномой. Для обозначения сначала увеличивавшейся до определенного размера, а затем самостоятельно регрессировавшей опухоли мы предпочитаем пользоваться термином спонтанно регрессировавшая ретинобластома. Доброкачественный вариант опухоли, увеличивавшейся до определенного размера, а затем стабилизировавшейся, мы называем спонтанно стабилизировавшаяся ретинобластома (1).
г) Международная классификация ретинобластомы. В настоящее время в крупных лечебных центрах, занимающихся лечением таких пациентов используется Международная классификация ретинобластомы (41-43) (табл. 15.1). Нюансы этой классификации и их использование для прогнозирования и оценки перспектив сохранения глаза после проведения хеморедукции и интраартериальной химиотерапии обсуждаются в соответствующих публикациях (44, 45). Классификация сведена в таблицу, которую мы приводим ниже.
Ниже описаны и проиллюстрированы клинические варианты, диагностика, лечение и дифференциальная диагностика ретинобластомы.
Клинические примеры ретинобластомы:
Редактор: Искандер Милевски. Дата публикации: 17.6.2020
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Роль интравитреальной химиотерапии с мелфаланом в комбинированном лечении ретинобластомы с эндофитным характером роста
Для цитирования: Саакян С.В., Харлампиди М.П., Иванова О.А. и др. Роль интравитреальной химиотерапии с мелфаланом в комбинированном лечении ретинобластомы с эндофитным характером роста // Эффективная фармакотерапия. 2019. Т. 15. № 33. С. 8–12.
- Аннотация
- Статья
- Ссылки
- Английский вариант
Цель – оценить эффективность интравитреальной химиотерапии (ИВХТ) в комбинированном лечении ретинобластомы с эндофитным характером роста.
Материал и методы. За период 2013–2018 гг. на базе отдела офтальмоонкологии и радиологии ФГБУ «Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации проведено комбинированное лечение с включением ИВХТ с мелфаланом 19 детям (28 глаз). Средний возраст пациентов составил 27 ± 12 месяцев. Количество инъекций (от одной до пяти) ИВХТ зависело от реакции на лечение. Процедуру проводили на фоне системной химиотерапии, в двух случаях одновременно с брахитерапией, в одном – в сочетании с транспупиллярной термотерапией, в четырех – после брахитерапии.
Результаты. У всех пациентов отмечалась положительная динамика в виде частичной или полной регрессии опухолевых отсевов в стекловидное тело, уменьшения объема диссеминации опухолевых очагов по сетчатке. На фоне системной полихимиотерапии наблюдался стойкий эффект. При невозможности проведения системной химиотерапии положительный эффект носил временный характер, что потребовало назначения повторной ИВХТ или применения локальных методов лечения. По завершении процедуры у двух пациентов зафиксировано кратковременное снижение зрения, обусловленное отеком сетчатки и диска зрительного нерва и тромбозом центральной вены сетчатки, которые были купированы после инстилляций противовоспалительных препаратов и дегидратационной терапии. В двух случаях увеличилось преретинальное кровоизлияние. У всех пациентов на глазном дне выявлены хориоретинальные дистрофические изменения.
Выводы. Несмотря на побочные явления, ИВХТ в схеме комбинированного лечения ретинобластомы групп C, D и E считается эффективным методом при запущенных формах ретинобластомы с эндофитным характером роста и массивной диссеминацией опухолевых клеток по сетчатке.
- КЛЮЧЕВЫЕ СЛОВА: ретинобластома, интравитреальная химиотерапия, диссеминация, мелфалан
Рис. 3. Ретинобластома с эндофитным характером роста и опухолевыми клонами в стекловидном теле (А – до лечения, Б – после одного курса ИВХТ)
Рис. 4. Ретинобластома с эндофитным характером роста и множественными опухолями в сетчатке (А – до лечения, Б – после двух курсов ИВХТ)
Рис. 5. Отек диска зрительного нерва и папиллярное кровоизлияние после комбинированного лечения ретинобластомы с включением ИВХТ
Ретинобластома (РБ) – нейроэктодермальная злокачественная опухоль сетчатки, относящаяся к одним из наиболее тяжелых заболеваний глаз у пациентов младшего возраста. По последним данным, частота РБ составляет 1 : 15 000 живых новорожденных [1].
Алгоритм комбинированного лечения РБ включает в себя лекарственные, лазерные, лучевые и хирургические методы. При РБ применяются хирургическое ликвидационное (энуклеация) и локальное (разрушающая лазеркоагуляция, транспупиллярная термотерапия, криодеструкция, брахитерапия) органосохраняющее лечение. Одним из компонентов лечения РБ является системная (адъювантная и неоадъювантная) и локальная (суперселективная интраартериальная (СИАХТ), интравитреальная (ИВХТ), периокулярная) химиотерапия [2–16].
Впервые ИВХТ применили L. Ericson и B. Rosengren. В 1961 г. они ввели тиотеп в стекловидное тело при РБ с опухолевыми клонами [8]. Преимущество данного метода заключается в обеспечении максимальной концентрации химиопрепарата (мелфалана) внутри глаза без системного воздействия на организм [13]. В начале 2000-х гг. метод стал широко применяться при эндофитных формах РБ c преретинальными и диффузными отсевами в стекловидное тело [9–16].
Цель данной работы – оценить эффективность ИВХТ с мелфаланом в комбинированном лечении ретинобластомы с эндофитным характером роста.
Материал и методы
За период 2013–2019 гг. на базе отдела офтальмоонкологии и радиологии ФГБУ «Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца» Минздрава России проведено комбинированное лечение с включением ИВХТ с мелфаланом 19 детям (28 глаз). Средний возраст пациентов составил 27 ± 12 месяцев. У всех больных имела место эндофитная форма РБ с преретинальными и диффузными отсевами в стекловидное тело групп C, D и E (рис. 1).
Для проведения ИВХТ использовали тонкие иглы (30 или 32 G). Мелфалан вводили через плоскую часть цилиарного тела (рис. 2) [17]. Доза препарата составила от 16 до 25 мкг на один курс. В зависимости от реакции на лечение проводили от одной до пяти инъекций мелфалана один раз в три-четыре недели (всего 33 процедуры). Процедуры ИВХТ выполняли на фоне системной химиотерапии, в двух случаях одномоментно с брахитерапией, в одном – одновременно с транспупиллярной термотерапией, в четырех – после брахитерапии. Срок наблюдения составил 36 ± 1,2 месяца.
Результаты и обсуждение
Во всех случаях отмечалась положительная динамика в виде частичной или полной регрессии опухолевых отсевов в стекловидное тело, уменьшения объема диссеминации опухолевых очагов по сетчатке (рис. 3).
На фоне системной полихимиотерапии регистрировался стойкий эффект. При невозможности проведения системной химиотерапии положительный эффект носил временный характер, что потребовало назначения повторной ИВХТ или использования локальных методов лечения (рис. 4).
В двух случаях увеличилось преретинальное кровоизлияние. У всех пациентов на глазном дне выявлены хориоретинальные дистрофические изменения (рис. 6). Экстраокулярного роста опухоли по раневым каналам не зафиксировано.
В последние годы часто используется системная полихимиотерапия на основе препарата платины – карбоплатина в комбинации с цитостатиком винкристином и полусинтетическим производным подофилотоксина – этопозидом. Комбинированное воздействие этих препаратов направлено на разрушение ДНК опухолевой клетки, нарушение процесса ее репликации, снижение биологической и ферментативной активности ядер опухолевых клеток, торможение пролиферации клеток и подавление нуклеотидного транспорта, уменьшение параметров первичной опухоли, увеличение резектабельности, повышение абластики, предотвращение развития метастазов [1–4, 13].
Широкое применение системной химиотерапии обусловлено ее эффективностью в разрушении опухоли и предотвращении метастатической болезни. Тем не менее на фоне такой терапии неизбежно возникают побочные эффекты. Как следствие – ухудшается соматический статус пациентов, нарушается режим проведения терапии, снижается ее эффективность [19]. Кроме того, со временем возрастает частота запущенных форм и развиваются рефрактерные формы РБ.
В целях усовершенствования видов химиотерапии, облегчения переносимости системной химиотерапии, уменьшения количества и тяжести ее осложнений были разработаны методы доставки химиопрепаратов непосредственно к опухолевому очагу. В связи с этим особую значимость приобрели методы локальной химиотерапии (СИАХТ, ИВХТ) [5, 9–16].
В начале 2000-х гг. был возрожден и усовершенствован метод селективного интраартериального введения препарата, предложенный в 1987 г. японскими врачами [20]. Однако он не нашел широкого распространения в мире [21]. Развитие высоких технологий в XXI в. позволило усовершенствовать методику и снизить риск возможных осложнений. Первые публикации с анализом результатов применения суперселективной химиотерапии у детей с запущенными формами РБ появились в 2006 г. [22].
Опубликованные результаты лечения методом СИАХТ подтверждают его эффективность при бинокулярных формах РБ со смешанным характером роста [22].
Данные исследований, проведенных в отделе офтальмоонкологии и радиологии Национального медицинского исследовательского центра глазных болезней им. Гельмгольца, также подтвердили эффективность ИАХТ с мелфаланом при резистентных опухолях с экзофитным характером роста, локализующихся в постэкваториальной зоне [5]. Эффект цитостатика алкилирующего типа действия из группы производных бис-бета-хлорэтиламина – мелфалана обусловлено образованием иона этиленимония, алкилирующего связи многих внутриклеточных молекул, в том числе нуклеиновых кислот (посредством связывания с гуанином в 7-й позиции), с блокированием их полимеризации и редупликации, формированием дефектных форм ДНК и блокадой митоза быстро делящихся опухолевых клеток. Препарат активен в отношении находящихся в покое и активно делящихся опухолевых клеток. Его действие фазонеспецифично, но наиболее чувствительны клетки, находящиеся в конце фазы G2 и переходе G2-1, при применении в более высоких дозах – в переходе S-G2 и фазе синтеза ДНК [23].
M. Ueda и cоавт. изучали влияние мелфалана на эритроциты кролика и человека in vitro для определения его токсичной концентрации при РБ путем проведения электроретинографии (ЭРГ). Мелфалан не оказывал существенного влияния на альфа- и бета-волну или колебательный потенциал, что позволило говорить о применении препарата in vivo [24].
Попытки интравитреального введения цитостатиков предпринимались давно, однако показания к этому методу были сформулированы в 2010–2012 гг. В Российской Федерации ИВХТ применяют в соответствии с Федеральными клиническими рекомендациями по диагностике, мониторингу и лечению детей с ретинобластомой, утвержденными Ассоциацией врачей-офтальмологов [25]. Появление новых цитостатиков сделало возможным разрушение опухолевых клонов в стекловидном теле при эндофитной РБ путем интравитреального введения химиопрепаратов [9–16, 26], что резко расширило показания для органосохраняющего лечения.
Интравитреальная химиотерапия с мелфаланом в составе комбинированной терапии считается методом выбора при далеко зашедших формах РБ групп C и D с эндофитным характером роста и массивной диссеминацией опухолевых клеток по сетчатке и в стекловидное тело. Несмотря на побочные эффекты, подобная терапия обеспечивает частичную или полную резорбцию либо кальцификацию узлов РБ в сетчатке и опухолевых клонов в стекловидном теле. Метод исключает развитие системных осложнений и позволяет сохранить зрение.
Отдаленные итоги лечения детей с интраокулярной ретинобластомой
Для цитирования: Саакян С.В., Иванова О.А., Горовцова О.В. и др. Отдаленные итоги лечения детей с интраокулярной ретинобластомой // Эффективная фармакотерапия. 2019. Т. 15. № 33. С. 14–17.
Цель – проанализировать отдаленные результаты комбинированного лечения пациентов с интраокулярной ретинобластомой групп C и D.
Материал и методы. Всего в исследование включено 70 пациентов (77 глаз) с интраокулярной ретинобластомой (группы C – 22 глаза и D – 55 глаз), получавших лечение в 2012–2017 гг. по трехстороннему протоколу органосохраняющего лечения ретинобластомы RB2012. У 28 пациентов имела место бинокулярная ретинобластома, у 42 – монокулярная. Средний возраст пациентов с монокулярной ретинобластомой составил 17,1 ± 1,2 месяца, с билатеральной – 9,5 ± 0,9 месяца. Средний срок наблюдения – 46,0 ± 13,7 (28–77) месяца.
Результаты. В 37,6% случаев (n = 29) отсутствовала необходимость в локальной терапии после проведения суперселективной интраартериальной и интравитреальной химиотерапии в связи с полной регрессией опухоли клинически и по данным ультразвукового исследования. Фокальные методы применяли при стабилизации заболевания (n = 23), прогрессировании (n = 8, из них новые очаги опухоли на сетчатке в группе C (n = 1) и D (n = 7)) и рецидиве (n = 14, из них новые очаги на сетчатке в группе C (n = 5) и D (n = 6) и новые очаги на сетчатке и отсевы в стекловидное тело в группе D (n = 3)). В ряде случаев в качестве «долечивания» использовали агрессивные методы органосохраняющего лечения: вторую линию системной химиотерапии (n = 5), дистанционную лучевую терапию (n = 2), стереотаксическую хирургию с применением аппарата «Гамма-нож» (n = 4), а также ликвидационное лечение – энуклеацию (n = 14). Общая пятилетняя выживаемость составила 97,7%, общая пятилетняя органная выживаемость – 81,8% в группе C и 80,0% в группе D.
Выводы. Показана высокая эффективность комбинированного органосохраняющего лечения интраокулярной ретинобластомы. Общая пятилетняя выживаемость достигла 97,7%, при этом удалось сохранить 80,9% глаз, из них в подавляющем большинстве случаев – без проведения дистанционной лучевой терапии. Как следствие – снижение вероятности развития вторых злокачественных опухолей и повышение качества жизни пациентов.
- КЛЮЧЕВЫЕ СЛОВА: ретинобластома, локальная химиотерапия, выживаемость, критерий Фишера, органосохраняющее лечение
Ретинобластома (РБ) – наиболее частая первичная злокачественная внутриглазная опухоль в педиатрической популяции [1]. Ежегодно в мире выявляется около 7000–8000 новых случаев РБ [2]. В 2/3 всех случаев отмечается несемейный (спорадический) характер РБ, ассоциированный с нормальной продолжительностью жизни после лечения [3]. В 1/3 случаев определяют семейный характер заболевания, связанный с герминальной мутацией в гене RB1 [3].
В настоящее время в развитых странах выживаемость пациентов с РБ достигает 99% [4]. Благодаря появлению новых технологий диагностики и лечения РБ смертность от этого заболевания в развитых странах снизилась до 5%, в то время как в странах Африки она остается высокой – до 70% [2].
В запущенных случаях для сохранения жизни ребенка прибегают к энуклеации пораженного глаза. Органосохраняющие методы при небольших и средних опухолях включают локальное лечение (крио- и фотокоагуляцию и брахитерапию) [5, 6]. В последние годы стал доступен метод суперселективной интраартериальной химиотерапии (СИАХТ), позволяющий расширить показания для органосохраняющего лечения РБ, а также интравитреальная химиотерапия (ИВХТ) [5, 7–9].
Цель данной работы – проанализировать отдаленные результаты комбинированного лечения пациентов с интраокулярной ретинобластомой групп C и D.
Всего в исследование было включено 70 пациентов (77 глаз) с интраокулярной РБ групп C и D, получавших лечение в 2012–2017 гг. по трехстороннему протоколу органосохраняющего лечения ретинобластомы RB2012 (ФГБУ «Национальный медицинский исследовательский центр (НМИЦ) глазных болезней им. Гельмгольца», НМИЦ онкологии им. Н.Н. Блохина, НМИЦ «МНТК „Микрохирургия глаза“» им. акад. С.Н. Федорова). У 28 пациентов имела место бинокулярная РБ, у 42 – монокулярная. Средний возраст пациентов с монокулярной РБ составил 17,1 ± 1,2 месяца, с билатеральной – 9,5 ± 0,9 месяца. Средний срок наблюдения – 46,0 ± 13,7 (28–77) месяца. Все пациенты были разделены на группы в соответствии со стадией заболевания по классификации ABC – группу C (22 глаза с отдельными локализованными опухолями с минимальным обсеменением субретинального пространства или стекловидного тела), группу D (55 глаз с диффузно распространенной опухолью со значительным обсеменением субретинального пространства).
Лечение проводили в соответствии с режимом 2 трехстороннего протокола по схеме: винкристин – 1,5 мг/м 2 внутривенно в первый день, этопозид – 150 мг/м 2 внутривенно в первый и второй дни, карбоплатин – 560 мг/м 2 внутривенно в первый день. Детям в возрасте до 36 месяцев дозу рассчитывали на 1 кг массы тела: винкристин – 0,05 мг/кг, карбоплатин – 18,6 мг/кг, этопозид – 5 мг/кг. Селективная внутриартериальная химиотерапия мелфаланом проводилась не ранее чем после одного курса системной химиотерапии в дозе 5–7,5 мг/м 2 каждого пораженного глаза со степенью распространения опухоли, соответствующей группам C или D. При одновременном лечении обоих глаз доза мелфалана составила 5 мг/м 2 , при односторонней РБ – 7,5 мг/м 2 . Интравитреально вводили 16 мкг мелфалана (0,05 мл).
Статистический анализ проводили с применением точного критерия Фишера. Выживаемость пациентов после лечения рассчитывали статистическим методом множительных оценок Каплана – Мейера. Для оценки различия между двумя выборками использовали двухвыборочный критерий Вилкоксона (Манна – Уитни) и регрессионную модель Кокса. Для анализа полученной информации все наблюдения были разделены на два типа:
- цензурированные (незавершенные): исход на момент окончания исследования (пациенты живы) не наступил либо пациенты выбыли из него (в том числе смерть от других причин);
- нецензурированные (завершенные): зафиксирована смерть пациента от прогрессирования ретинобластомы.
Расчеты проводили с помощью пакета программ для Windows (Microsoft Excel, Statistica 10.1).
Результаты и их обсуждение
Отдаленные результаты наблюдения доступны для всех включенных в исследование пациентов. В 37,6% случаев (n = 29) отсутствовала необходимость в локальной терапии после проведения СИАХТ и ИВХТ в связи с полной регрессией опухоли клинически и по данным ультразвукового исследования. На рисунках 1 и 2 представлены примеры РБ группы D до ИВХТ и на фоне курса терапии. Основными методами «долечивания» пациентов при недостаточной эффективности селективной интраартериальной и интравитреальной химиотерапии, прогрессировании заболевания или его рецидиве (появлении новых очагов на сетчатке и/или в стекловидном теле) служили фокальная терапия и локальная химиотерапия. Фокальная терапия включала транспупиллярную термотерапию, криодеструкцию, брахитерапию офтальмоаппликаторами и комбинацию указанных подходов. Данные методы применяли при стабилизации заболевания (n = 23), прогрессировании (n = 8, из них новые очаги опухоли на сетчатке в группе C (n = 1) и D (n = 7)) и рецидиве (n = 14, из них новые очаги на сетчатке в группе C (n = 5) и D (n = 6) и новые очаги на сетчатке и отсевы в стекловидное тело в группе D (n = 3)). В ряде случаев в качестве «долечивания» применяли агрессивные методы органосохраняющего лечения: вторую линию системной химиотерапии (n = 5), дистанционную лучевую терапию (n = 2), стереотаксическую хирургию с применением аппарата «Гамма-нож» (n = 4), а также ликвидационное лечение – энуклеацию (n = 14).
На рисунке 3 представлена общая выживаемость пациентов через пять лет наблюдений. Спустя один и три года наблюдений все 70 пациентов были живы (выживаемость – 100%). Через 45 месяцев наблюдений один пациент умер вследствие развития второй злокачественной опухоли (острый миелолейкоз). Таким образом, общая пятилетняя выживаемость составила 97,7%.
Общую органную выживаемость (долю сохраненных глаз в максимальном периоде наблюдения) оценивали отдельно по группам C и D (рис. 4). Так, в группе C (n = 22) одногодичная выживаемость составила 90,9 ± 6,1%, трехлетняя – 81,8 ± 8,2% (оставалась неизменной в течение пяти лет наблюдения). 18 глаз (82%) из 22 удалось сохранить, при этом дистанционная лучевая терапия была проведена только в одном случае. В группе D (n = 55) одногодичная выживаемость составила 94,5 ± 3,1%, трехлетняя – 83,6 ± 5,0%, пятилетняя – 80,0 ± 6,0%, что соответствовало 44 сохраненным глазам из 55 (во всех случаях без проведения дистанционной лучевой терапии). При анализе показателя в общей когорте пациентов одногодичная выживаемость составила 93,5 ± 2,8%, трехлетняя – 83,1 ± 4,3%, пятилетняя – 80,9 ± 4,7%. Таким образом, удалось сохранить 62 глаза из 77.
Локальная химиотерапия остается одним из наиболее перспективных методов лечения РБ, в том числе далеко зашедших ее стадий.
C.L. Shields и соавт. анализировали результаты применения СИАХТ у 60 пациентов (70 глаз). Эффективность достигнута в 100% в группах B и C, в 94% – в группе D, в 36% – в группе E [10].
Y.P. Gobin и соавт. опубликовали результаты наблюдения за 78 пациентами (95 глаз) с РБ групп D и E. Ремиссия в течение двух лет составила 70% для всех глаз, 81,7% – для пациентов, получивших СИАХТ в качестве основного лечения, и 58,4% – для неэффективно перенесших предшествующую внутривенную химиотерапию и/или наружную лучевую терапию [11].
В работе С.В. Саакян и соавт. представлены результаты лечения 28 детей (35 глаз) с РБ групп С (n = 6), D (n = 10) и E (n = 22).
Авторы установили первичную далеко зашедшую форму РБ – восемь глаз, формы РБ, резистентные к проведенной системной химиотерапии и локальному лечению, – 30 глаз. Во всех случаях проведена СИАХТ. Из 30 сохраненных глаз – 25 с резистентными к проведенному ранее системному и локальному лечению и пять глаз с далеко зашедшей формой РБ. 28 пациентам из 30 удалось сохранить предметное зрение. Вместе с тем срок наблюдения (8 ± 2,5 (1–17) месяца) требовал более длительного анализа полученных данных [12]. Представленные в настоящей работе результаты соответствуют литературным данным и свидетельствуют об эффективности комбинированного лечения при РБ групп C и D.
Показана высокая эффективность комплексного органосохраняющего лечения интраокулярной ретинобластомы. Общая пятилетняя выживаемость достигла 97,7%. Удалось сохранить 80,9% глаз, причем в подавляющем большинстве случаев – без проведения дистанционной лучевой терапии. Это позволило снизить вероятность развития вторых злокачественных опухолей и повысить качество жизни пациентов.
Примеры интравитреальной химиотерапии диссеминации ретинобластомы
Примеры интраартериальной химиотерапии ретинобластомы
Интраартериальная терапия представляет собой метод доставки химиопрепарата непосредственно в глазную артерию по катетеру, проведенному через бедренную артерию в аорту, а оттуда во внутреннюю сонную артерию. Глазная артерия является ветвью внутренней сонной артерии, катетер подводится к ее устью, и химиопрепарат вводится непосредственно в артерию. Этот эффективный метод используется для лечения как небольших, так и крупных опухолей, односторонних и двусторонних поражений, в качестве как первичной, так и вторичной терапии.
Небольшая ретинобластома макулярной области. После интраартериального введения двух доз химиопрепарата наблюдается полный регресс опухоли. Крупная ретинобластома с тотальной отслойкой сетчатки. После интраартериального введения трех доз химиопрепарата наблюдается полный регресс опухоли. Массивная ретинобластома с тотальной отслойкой сетчатки и диссеминацией в стекловидное тело. После интраартериального введения четырех доз химиопрепарата достигнут полный регресс опухоли.
РЕТИНОБЛАСТОМА: ИНТРААРТЕРИАЛЬНАЯ ХИМИОТЕРАПИЯ В КАЧЕСТВЕ ВТОРИЧНОГО ЛЕЧЕНИЯ
Интраартериальная химиотерапия может проводиться в качестве как первичной, так и вторичной терапии. В последнем случае ее обычно проводят после безуспешной внутривенной химиотерапии.
Небольшая опухоль макулярной области, рецидивировавшая после внутривенной химиотерапии. После интраартериального введения трех доз химиопрепарата был достигнут регресс опухоли. Крупная периферическая опухоль, рецидивировавшая после внутривенной химиотерапии. После интраартериального введения четырех доз химиопрепарата был достигнут полный регресс опухоли. Массивная субретинальная диссеминация, рецидивировавшая после внутривенной химиотерапии. После интраартериального введения пяти доз химиопрепарата был достигнут регресс опухоли.
РЕТИНОБЛАСТОМА: ВНУТРИВЕННАЯ ПЛЮС ИНТРААРТЕРИАЛЬНАЯ ХИМИОТЕРАПИЯ РАСПРОСТРАНЕННОЙ ДВУСТОРОННЕЙ РЕТИНОБЛАСТОМЫ
Лечение более распространенных двусторонних ретинобластом, в том числе двусторонних опухолей групп D и Е, часто начинают с внутривенной химиотерапии с целью сохранения глаза и профилактики метастазирования. Однако в некоторых случаях также назначают и интраартериальную химиотерапию с целью профилактики развития местного рецидива.
Массивные ретинобластомы обоих глаз, отнесенные к группе Е Международной классификации. После внутривенной и интраартериальной химиотерапии были достигнуты полный регресс опухоли и восстановление зрительных функций. Массивные ретинобластомы обоих глаз у ребенка, отнесенные к группе Е Международной классификации. После внутривенной и интраартериальной химиотерапии был достигнут полный регресс опухоли. Диагностированы складки сетчатки, окружающие центральную ямку. Массивная ретинобластома левого глаза того же ребенка, что и на рисунке выше. Опухоль отнесена к группе Е Международной классификации. После внутривенной и интраартериальной химиотерапии был достигнут полный регресс опухоли. Сетчатка в фовеолярной области осталась плоской, сохраняются перспективы восстановления зрительных функций.
Ретинобластома: клиника, диагностика и лечение
Ретинобластома – эмбриональная детская опухоль сетчатки глаза. Среди всех детских злокачественных новообразований, поражающих глазное яблоко, ретинобластома имеет наибольшее распространение.
На протяжении последнего десятилетия частота выявления данной патологии увеличивается. В настоящее время встречаемость ретинобластомы составляет 1 случай на 10-20 тысяч живых новорожденных.
Шестьдесят процентов выявленных опухолей являются ненаследственными (спорадическими); остальные 40% составляют наследственно-обусловленные формы.
Около 90% случаев ретинобластомы диагностируются до 3 лет. Пик заболевания – 2 года. Заболевание одинаково часто выявляется среди мальчиков и девочек.
Билатеральное (двухстороннее) поражение встречается у четверти больных наследственно-обусловленной формой. У 25% больных с наследственной формой заболевания встречается двухсторонняя (мед. – «билатеральная») локализация.
Причины. Роль наследственности в заболеваемости ретинобластомой.
Ген этого заболевания называется «ген Rb». Это один из первых открытых и более всего изученных генов, отвечающих за развитие онкологических заболеваний. Его характеристики:
- располагается в срединном отделе длинного плеча хромосомы 13q14.1;
- состоит из 27 экзонов;
- занимает 180000 пар нуклеотидов геномной ДНК;
- в норме экспрессируется в клетках всего организма.
Большая часть наследственных и спорадических фактов заболевания обуславливаются делецией в срединном участке длинного плеча хромосомы 13.
В 1971 году Knudson выдвинул гипотезу, согласно которой есть единый механизм формирования ретинобластомы – как наследственной, так и нет, – связанный с инактивацией или утратой двух аллелей гена Rb.
Когда происходит герминальная мутация, все ретинобласты гетерозиготного носителя уже обладают инактивированным аллелем Rb. Чтобы сформировалась ретинобластома, будет достаточно лишь одной телесной мутации, которая затронет оставшуюся копию гена. Переход Rb из гетерозиготного состояния в гомозиготное и является причиной инактивации двух аллелей Rb. Этим и инициируется злокачественное перерождение клетки.
Ненаследственная форма чаще всего проявляется односторонним новообразованием. Ее обнаруживают в 60% случаев. Возникает такая патология в первые 3 года жизни. Данная форма объясняется мутацией в двух аллелях RB1 гена, однако лишь в клетках сетчатки.
Двустороннее поражение может объясняться тем, что в половых клетках родителей присутствует непроявившаяся мутация. Ее они передали ребенку, и возникла болезнь. Также объяснить возникновение такой ретинобластомы можно мутацией de novo, происходящей на ранних стадиях развития эмбриона.
То есть, билатеральные формы патологии при спорадическом типе следует относить к врожденным формам.
Особенности клиники наследственных форм – это:
- ранний возраст заболевающих;
- многофокусность;
- двухстороннее расположение;
- мультицентрический рост новообразования с преобладанием смешанных и экзофитных форм;
- наличие у кого-то в семье такой же опухоли;
- молекулярные и хромосомные аномалии Rb гена.
Если в поколениях не было такого заболевания, характер опухоли односторонний и однофокусный, то можно предполагать, что мутация возникла в родословной впервые.
Симптомы ретинобластомы
- сниженная острота зрения;
- лейкокория (вы можете увидеть на рис. 1 этот симптом, называемый также «кошачий глаз»), то есть свечение зрачка бело-желтым цветом, когда от поверхности опухоли отражается свет, это нередко заметно на фотографиях;
- косоглазие;
- ослабление прямой реакции зрачка на свет;
- расширение зрачка.
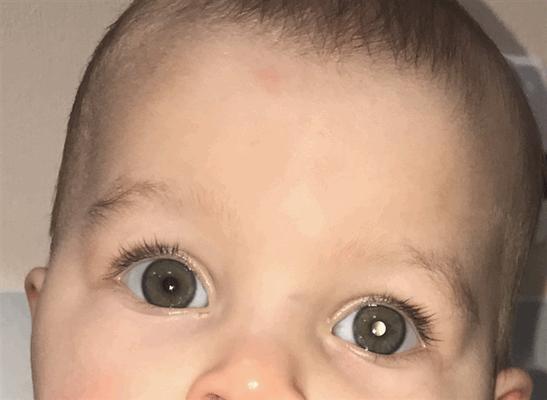
Рис. 1. Симптом «кошачьего глаза»
По мере того, как новообразование растет и распространяется, формируются: вторичная (на фоне основного заболевания) глаукома, буфтальм (у маленьких детей – увеличение глазного яблока), воспалительные изменения (иридоциклит, увеит). Когда возникает отек орбитальной клетчатки, есть вероятность выпячивания глаза (экзофтальма).
Классификация ретинобластомы
АВС (Амстердам)
В Амстердаме в 2001-м году предложили международную классификацию интраокулярной (внутриглазной) ретинобластомы. Главная цель этой классификации – определить четкие показания к тому, чтобы проводить органосохраняющую терапию. Если поражение двухстороннее, то классификация применяется отдельно к каждому глазу.
Клинические группы, в соответствии с классификацией:
- А – интраретинальные новообразования до 3 мм в размере, располагающиеся в 1,5 мм от диска зрительного нерва и более 3 мм от центральной ямки.
- В – остальные опухоли, располагающиеся отдельно, ограниченные сетчаткой с вероятным наличие субретинальной жидкости в не более чем 3 мм от основы опухоли, не сопровождающееся субретинальным обсеменением (рис. 2).
- С – раздельные опухоли с местным обсеменением стекловидного тела над новообразованием и субретинальным обсеменением в не более чем 3 мм от образования с вероятностью наличия жидкости в субретинальном пространстве в 3-6 мм от основания опухоли.
- D – рассеянные опухоли с крупными опухолевыми массами, разнокалиберными отсевами в стекловидном теле и/или субретинальном пространстве в более чем 3 мм от новообразования с субретинальной жидкостью более 6 мм от образования, включая полную отслойку сетчатки (рис. 3 и 4).
- Е – определяется одним из перечисленных ниже факторов неблагоприятного прогноза:
- новообразование прилегает к хрусталику;
- неоваскулярная глаукома;
- высыхание, утрата функции глаза (фтизис);
- кровоизлияние, ввиду которого утрачена прозрачность стекловидного тела;
- опухоль, располагающаяся кпереди от передней поверхности стекловидного тела и также захватывающая цилиарное тело и переднюю часть глаза;
- некротизированная опухоль с асептическим целлюлитом орбиты;
- ретинобластома в диффузной инфильтративной форме.
![]()
Диагностика ретинобластомы
Применяются следующие клинические методы:
- сбор анамнеза;
- оценка жалоб ребенка;
- физикальный осмотр;
- инструментальные обследования.
Особое внимание врач обращает на наличие наследственного фактора.
Проводится окулистом с медикаментозным расширением зрачка. Врач осматривает глаз с боковым освещением, делает биомикроскопию, офтальмоскопию, тонометрию. Если обследуется совсем маленький ребенок, то применяется наркотический сон.
Является обязательным исследованием, в соответствии со стандартом обследования при таком заболевании. Одной из самых информативных методик признана УЗ-биолокация. Благодаря ей, выявляются плюс-ткани, и это позволяет отличить ретинобластому от отслойки сетчатки, эндофтальмита, фиброза стекловидного тела, ретролентальной фиброплазии.
Чтобы определить величину затухания УЗ в опухоли используют квантитативную эхографию. Для получения информации о динамике злокачественного процесса важное значение имеет УЗ-эхобиометрия. С ее помощью определяют степень проминенции (т. е. то, насколько оно выступающее) новообразования.
МРТ головного мозга и орбит
Магнитно-резонансная томография дает возможность в деталях увидеть распространение процесса за пределы глазного яблока и точно определить стадию болезни. Такое исследование нужно проводить всем пациентам, у которых ретинобластома диагностирована впервые. Контраст при МРТ повышает информативность.
![Визуализация ретинобластомы с помощью МРТ. Клиническая группа В]()
Рис. 2. Визуализация ретинобластомы с помощью МРТ. Клиническая группа В
![Визуализация ретинобластомы с помощью МРТ. Размеры образования соответствуют клинической группе D]()
Рис. 3. Визуализация ретинобластомы с помощью МРТ. Размеры образования соответствуют клинической группе D
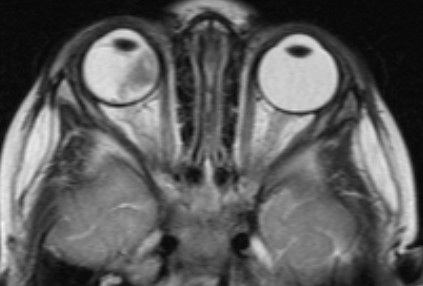
![Визуализация ретинобластомы с помощью МРТ. Фронтальное изображение орбит. Клиническая группа D]()
Рис. 4. Визуализация ретинобластомы с помощью МРТ. Фронтальное изображение орбит. Клиническая группа D
Исследование спинномозговой жидкости, костного мозга
Проводится больным, у которых процесс достаточно сильно распространен, чтобы уточнить, есть ли дистантные (удаленные от очага) метастазы.
Цитология цереброспинальной жидкости при прорастании новообразований в субарахноидальное пространство позволяет обнаружить клетки опухоли.
Методы лечения
Сегодня самое пристальное внимание уделяется органосохраняющим методикам. Кроме местной и системной химиотерапии, лучевой терапии, если есть показания, применяются:- фотокоагуляция (удаление новообразования путем воздействия на него мощным световым потоком);
- криодеструкция (разрушение опухоли холодом);
- лазерная деструкция (удаление опухоли лазером).
Принципы органосохраняющей терапии при лечении ретинобластомы
- Больным из группы А проводят только местное лечение (лазерную коагуляцию, криодеструкцию, диатермокоагуляцию).
- Больным из группы В показано 6 курсов двухкомпонентной ПХТ (полихимиотерапии), а также дополнительно – одна из методик местного лечения (лазерная деструкция, криодеструкция, брахитерапия).
- Тем, кто относится к группам С и D, назначаются 6 курсов ПХТ, состоящей из трех компонентов. Лечение дополняют местной химиотерапией и, если существует необходимость, физическими способами деструкции опухоли.
Пациентам из группы Е показана энуклеация (то есть удаление глазного яблока, предполагающее также пересечение наружных глазных мышц и зрительного нерва). В течение 5-7 дней после хирургического вмешательства выполняют глазное протезирование. Подбор постоянного протеза осуществляется в течение 1,5 месяцев после операции.
Энуклеация глаза имеет четкие показания:
- пациент должен относиться к группе Е по амстердамской классификации АВС;
- двусторонняя форма заболевания, необратимая утрата функции одного глаза;
- отсутствие возможности после консервативного лечения оценить степень поражения глаза ввиду катаракты или кровоизлияния в стекловидное тело;
- если поражение обоих глаз зашло слишком далеко и нет шанса восстановить зрение, проводится двусторонняя энуклеация (удаляются оба глаза).
Хирургическое лечение сочетается с ПХТ, облучением, лазерной деструкцией и др.
ПХТ (консервативная терапия) после энуклеации
Показана в следующих случаях:
- прорастание опухоли в зрительный нерв и экстрабульбарное распространение;
- большие или множественные узлы новообразования, локализация опухоли в перипапиллярной зоне, интраокулярная диссеминация (распространение) процесса в радужку, стекловидное тело и др., вовлечение в злокачественный процесс хориоидеи и зрительного нерва.
Если имеет место ретроламинарное распространение образования, то ПХТ дополняется лучевым лечением.
Если опухоль прорастает до линии резекции зрительного нерва и/или имеет место экстрасклеральное распространение, то таких пациентов относят к группе высокого риска. Им показана дистанционная лучевая терапия в сочетании с ПХТ, а затем – высокодозная ПХТ с последующей аутотрансплантацией (пересадкой собственных) периферических стволовых клеток крови.Предлагаем ознакомиться с несколькими наиболее часто применяемыми схемами ПХТ, которые показаны при данном заболевании:
- «Циклофосфан» в дозировке 400 мг/м2 в день. Если вес ребенка – менее 12 кг, то дозировка рассчитывается как 13 мг на кг веса в сутки. Дни 1-5, внутривенно, капельно.«Карбоплатин» в дозировке 500 мг/м2. Если вес ребенка – до 12 кг, то рассчитывается как 12 мг на кг веса в сутки. 5-й день, внутривенно, капельно.
Локальная (местная) химиотерапия
Данная химиотерапия показана пациентам из групп С и D в сочетании с системной ПХТ. Методика заключается в том, что с помощью супертонкого катетера через внутреннюю сонную и бедренную артерию прямо в устье глазной артерии вводится цитостатический препарат под названием «Мелфалан». Перед этим проводится каротидная ангиография внутренней сонной артерии, чтобы визуализировать строение сосудов.
Химиотерапия «Мелфаланом» (селективная внутриартериальная) проводится через 3-4 недели после 1-го курса системной химиотерапии. Дозировка составляет 5-7,5 мг/м2:
- дозировка 5 мг/м2 показана, когда одновременно лечатся оба глаза;
- если поражен только один, то нужно вводить 7,5 мг/м2.
В стекловидное тело (мед. – «интравитреально») вводится 16 мкг «Мелфалана» (это 0,05 мл). Эта концентрация эффективна по отношению к опухолевым отсевам и безопасна.
Физические методы лечения
К ним относятся:
- лазерная деструкция;
- фотокоагуляция;
- криодеструкция;
- транссклеральная диатермокоагуляция.
Рассмотрим данные методики подробно.
Выполняется на аргоне, может применяться для терапии заболевания в 1-й стадии и при небольших опухолевых узлах. При двусторонних ретинобластомах для терапии оставшегося глаза данную методику применяют в комплексе с другими. Наиболее часто ее сочетают с облучением, химиотерапией. Обычно – на последних этапах лечения.
Преимущество такой технологии – выраженная реакция тканей, находящихся вблизи очага поражения. Это позволяет проводить лазерную деструкцию, когда опухоли располагаются рядом со зрительным нервом.
Сочетается с другими методиками (ПХТ, лучевым лечением и др.) на последних этапах терапии. Рекомендуется применять данный метод при 1-й стадии болезни и небольших опухолях: выстояние узла – до 8 мм, поражение глазного дна – до 25% площади.
Вначале формируют двойной вал коагулянтов вокруг образования, чтобы нарушить его кровоснабжение и создать хориоретинальный барьер. Когда пройдет 3-4 недели, начинают разрушающую коагуляцию («выпаривание») опухолевой ткани. Для этого нужно 2-7 сеансов с перерывом в 3-4 недели. В течение всего курса рассасываются кровоизлияния и отечность.
Методика противопоказана, когда:
- новообразование расположено близко к диску зрительного нерва и макулярной зоне;
- опухоль большая.
Показано применение этой методики в сочетании с фотокоагуляцией. Охлаждающими веществами выступают углекислый газ и жидкий азот.
- размер опухоли от 0,5 до 7 диаметра диска зрительного нерва, образование «вдается, вминается» (то есть «проминирует») на 3-3,5 мм.
Преимущество перед диатермокоагуляцией – меньшее повреждение склеры.
Данная методика направлена на то, чтобы разрушить сосуды, которые питают опухоль, а также коагулировать («выпарить») опухолевую ткань. Применяется в сочетании с фотокоагуляцией.
Показания ограничены только случаями неэффективности других методов. Это связано с малой эффективностью и выраженной послеоперационной реакцией у пациентов.Может проводиться в качестве профилактического воздействия после операции. Делается каждый день со 2-3-го послеоперационных дней. Разовая экспозиционная доза – 1,8 Гр, суммарная очаговая – 35-50 Гр. Курс терапии составляет 1-2 серии облучения с интервалом 1,5-2 месяца.
Чтобы профилактировать появление катаракты в зоне воздействия и лучевой кератит, при двусторонней форме заболевания по каплям вливают 2%-й только что приготовленный раствор «Цистеина» или 1%-й р-р «Тауфона» перед каждым сеансом. Дозировка – 2 капли 6 раз с интервалом 15 минут.
![]()
Наблюдение, объем и сроки обследования
При обнаружении болезни на ранних стадиях выживаемость достигает 100%.
После окончания лечения за детьми с этим заболеванием обеспечивается диспансерное наблюдение у окулиста в поликлинике и в онкодиспансере по месту жительства. Специалист (врач-окулист) должен осматривать ребенка 1 раз в 2 месяца в 1-й год после окончания терапии, а затем:
- во 2-й год – 1 раз в 3 месяца;
- в следующие 2 года – 1 раз в 6 месяцев;
- далее – 1 раз в год.
С такой же периодичностью должны проводиться и осмотры онкологом.
Офтальмологическое исследование проводится с медикаментозным расширением зрачка. Детей младшего возраста обследуют в состоянии наркотического сна.
Если в семье были случаи ретинобластомы, то впервые офтальмолог должен осмотреть ребенка еще в роддоме.
Больные постоянно состоят на учете.
Также под диспансерным наблюдением должны находиться маленькие дети, появившиеся на свет в семьях, в которых есть больные ретинобластомой.
![Ретинобластома: клиника, диагностика и лечение]()
![]()
Авторская публикация:
Иванова Светлана Вячеславовна
Врач-детский онколог, научный сотрудник, кандидат наук
НМИЦ онкологии им Н.Н. Петрова![]()
Под научной редакцией:
Кулева Светлана Александровна
Заведующий отделением, врач- детский онколог, ведущий научный сотрудник, профессор
НМИЦ онкологии им. Н.Н. ПетроваЧто вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Читайте также:
- Коллоидная киста щитовидной железы - лучевая диагностика
- Лучевая диагностика десмопластической фибромы челюсти
- Имплантация интраокулярной линзы (ИОЛ) при дислокации хрусталиковых масс. Принципы
- Классификация дефектов слуховых косточек Остина и Вульштейна
- Классификация микроорганизмов. Принципы классификации микроорганизмов. Систематика микроорганизмов. Естественная ( филогенетическая ) систематика микроорганизмов.