Примеры МРТ метастазов в хориоидею
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Меланома хориоидеи — это пигментная опухоль злокачественного характера собственной сосудистой оболочки глаза (хориоидеи). Данная опухоль является одной из самых частых внутриглазных новообразований. Меланома хориоидеи является основной причиной смертности и инвалидизации онкобольных с поражением органа зрения. Заболевание может протекать практически бессимптомно, но при этом имеет высокую склонность к метастазированию, поэтому проблема ее выявления на начальных стадиях является крайне актуальной.
Этиологические факторы
Большинство случаев меланомы хориоидеи являются спорадическими, то есть обусловлены теми или иными мутациями клетки-предшественницы меланоцитарного звена, которая может дать начало патологическому опухолевому клону. Кроме того, есть предположение о наследственной причине данного заболевания. Воздействие такого типичного провоцирующего фактора для меланомы кожи, как повышенная инсоляция, для этой опухоли также не исключается.
В группе риска находятся пожилые люди (средний возраст манифестации опухоли — 60 лет). Немного чаще болеют мужчины. Склонны к появлению меланомы хориоидеи обладатели светлой кожи и волос, невусов и веснушек.
Клиническая картина
Жалобы пациентов зависят от размера и локализации меланомы хориоидеи, а также от наличия сопутствующих осложнений, к которым относятся: отслойка сетчатки вторичного характера, появление дегенеративных процессов в сетчатке, помутнение хрусталика.
На первичном приеме у офтальмолога обычно определяется снижение остроты зрения, появление перед глазом слепых участков (скотом), гемианопсий (выпадения половин поля зрения). В случае позднего обращения, больные жалуются на боль в глазу (вторичная глаукома), расширение сети сосудов. Также на склере может определяться пигментное пятно (экстраокулярный рост новообразования).
Стадии развития меланомы хориоидеи
Согласно международной классификации различают 4 стадии развития данной опухоли. Критерии распространенности опухолевого процесса:
- Т1 — размер меланомы 10 мм и менее, толщина — 2,5 мм и менее.
- Т2 — размер новообразования 10–16 мм, наибольшая толщина составляет 2,5–10 мм.
- Т3 — размером 16 мм и/или толщина более 10 мм без распространения за пределы глазного яблока.
- Т4 — наибольший размер опухоли 16 мм и/или толщина более 10 мм с распространением за пределы глазного яблока.
Также выделены 4 клинические стадии меланомы хориоидеи. Для каждой из них характерны определенные симптомы заболевания:
- Для первой, так называемой стадии «спокойного глаза», свойственно отсутствие ярких клинических проявлений и жалоб. Возможно наличие помутнения сетчатки, также могут определяться дефекты поля зрения.
- Вторая стадия характеризуется появлением боли в глазах, воспаления, покраснения глазного яблока, отека век.
- На третьей стадии меланома хориоидеи выходит за границы глазного яблока, формируется экзофтальм, склера теряет целостность.
- Четвертая стадия сопровождается генерализацией процесса. Общее состояние пациента ухудшается. Больные жалуются на сильную боль, снижается масса тела, нарастает интоксикация. Появляются метастазы меланомы внутренних органов: печени, легких, костей. Поражение того или иного органа провоцирует появление соответствующих симптомов. Может выявляться дальнейшее снижение остроты зрения, чувство пелены или тумана перед глазами. Данные проявления вызываются кровотечениями в стекловидное тело, помутнением хрусталика.
Симптомы второй и третьей стадии меланомы хориоидеи ярко выражены при расположении опухоли в центральной или парацентральной части глазного дна. Для периферической локализации новообразования характерно длительное отсутствие субъективных ощущений. В этом случае меланома выявляется либо случайно, либо на стадии распада опухоли и ее вторичных проявлений.
Виды меланомы глаза
Разработана классификация меланомы хориоидеи по морфологическому признаку. В зависимости от клеточной структуры, выделяют следующие типы данной опухоли:
- Веретеноклеточный.
- Эпителиоидный.
- Смешанный (микстмеланома).
- Фасцикулярный.
- Некротический.
Данная классификация имеет определенные недостатки, так как некротическая меланома хориоидеи определяется клинически, а вот определить ее клеточную принадлежность из-за обширного некроза невозможно. Веретенообразный и фасцикулярный тип имеют сходный прогноз. В связи с этим, в настоящее время морфологически принято выделять только 2 типа: веретеноклеточный и эпителиоидный. Смешанная форма занимает промежуточное положение. Ее прогноз зависит от преобладания тех или иных клеток. Наименее благоприятной прогностически считается эпителиоидноклеточная меланома хориоидеи.
Диагностика
Учитывая клинические особенности меланомы хориоидеи, ее диагностика, особенно на начальных этапах, представляет определенные трудности. Помимо анализа жалоб больного и клинико-анамнестических данных, учитываются результаты следующих инструментальных исследований:
- Биомикроскопии.
- Офтальмоскопии.
- Ультразвукового исследования глаза.
- Диафаноскопии и др.
Меланома хориоидеи является новообразованием с высоким риском появления метастазов. Поэтому при обследовании пациента необходимо использовать также методы диагностики метастатических очагов: УЗИ органов брюшной полости и лимфатических узлов, рентгенографию легких, КТ, МРТ.

Способы лечения меланомы хориоидеи
Выделяют органосохраняющие методы лечения данной опухоли и хирургический метод без сохранения глаза. В случаях, когда не удается сохранить глаз, производят энуклеацию — изолированное удаление глазного яблока или экзентерацию — иссечение вместе с глазным яблоком всего содержимого орбитальной полости.
Показания к энуклеации:
- Опухоль значительного размера.
- Распространение меланомы на диск зрительного нерва.
- Полное отсутствие зрительной функции.
- Экстрабульбарный рост опухоли.
- Вторичная глаукома.
После удаления глазного яблока, проводится имплантация внутреннего протеза и последующее наружное протезирование. Эти меры позволяют не только достичь хорошего косметического результата, но и препятствуют деформации лица.
К органосохраняющим методам лечения меланомы хориоидеи относятся:
Лучевая терапия. В зависимости от способа подведения излучения, лучевую терапию при данном заболевании проводят контактным или дистанционным способом. Контактное облучение, или брахитерапия, представляет собой имплантацию радиоактивных элементов вблизи очага меланомы.
Показания к проведению брахитерапии:
- Отсутствие признаков распада.
- Диаметр новообразования до 15 мм.
- Отстояние от диска зрительного нерва не менее 2 диаметров самого диска.
Брахитерапия является самым эффективным методом органосохраняющего лечения при меланоме хориоидеи. Его применение способно снизить вероятность образования метастазов опухоли.

В составе системного лечения, актуально проведение иммунной терапии. Также при оказании помощи больным с меланомой хориоидеи в поздних стадиях учитываются особенности ее метастазирования. Для данной опухоли характерно изолированное поражение печени метастазами. В таких случаях с успехом применяется химиоэмболизация данного органа.
Такой распространенный метод лечения меланомы кожи, как таргетная терапия, при меланоме хориоидеи не применяется, так как при данном виде опухоли отсутствуют специфичные BRAF-мутации.
Профилактика и диспансерное наблюдение
Рекомендовано пожизненное наблюдение за больными, которые получали лечение меланомы хориоидеи. После проведения лучевой терапии и удаления новообразования, офтальмолог должен осматривать пациентов каждые полгода в течение 2 лет, а далее — 1 раз в год. С целью раннего выявления метастазов назначают УЗИ органов брюшной полости и рентгенографию легких 1-2 раза в год.
Прогноз для жизни при меланоме хориоидеи
Продолжительность жизни при данном виде рака зависит от локализации и размера опухоли, возраста пациента, морфологии новообразования, проведенного лечения и других особенностей. Пятилетняя выживаемость на начальных стадиях меланомы хориодиеи после применения органосохраняющих радикальных методов составляет 93%, десятилетняя — 89%. На поздних стадиях, при выявлении метастазов печени медиана выживаемости составляет лишь 4-6 месяцев. Для пациентов с метастатическим поражением других органов годичная выживаемость составляет 76%.
Динамика метастатического поражения хориоидеи на фоне полихимиотерапии (клинический случай)
В качестве иллюстрации приводим собственное клиническое наблюдение. Пациентка Ш., 34 года, в октябре 2020 года обратилась с жалобами на искажения предметов и снижение остроты зрения правого глаза в течение двух недель.
Анамнез: в октябре 2010 года у пациентки выявлен рак правой молочной железы, а в феврале 2011 года выполнена радикальная мастэктомия. В предоперационном периоде пациентка получила 4 цикла полихимиотерапии (ПХТ) по схеме FAC (фторурацил, адриамицин (доксорубицин), циклофосфамид) и радикальный курс дистанционной лучевой терапии на область правой молочной железы, парастернальную, надключичную и аксилярную области традиционным фракционированием с разовой очаговой дозой 2 Гр. Суммарная очаговая доза – 64 Гр. В послеоперационном периоде проведено 4 цикла ПХТ по схеме АТ (доксорубицин, таксотер). Далее в течение 5 лет пациентка получала гормональную терапию аналогами лютеинизирующего рилизинг-гормона, в течение 3 лет использовался тамоксифен и в течение 2 лет – анастрозол. В сентябре 2020 года были выявлены метастазы в правом легком и лимфоузлах средостения. Спустя месяц (октябрь 2020 г.) выявлен метастатический узел в желудке.
На момент обращения к офтальмологу: максимальная острота зрения (МОЗ) правого глаза - 0,7 н/к, левого - 0,8 с sph -0,5Д=0,9. ВГД OD=15,3 мм рт.ст., OS - 17,2 мм рт.ст. Передний отрезок обоих глаз – без патологии. При офтальмоскопии на глазном дне правого глаза выявлен отек в макулярной зоне, по ходу верхне-височной аркады – незначительно проминирующий округлый очаг желтоватого цвета размером 1-1,5 ДД. Перипапилярно с носовой стороны имелся плоский округлый очаг размером 1 ДД, на средней периферии в наружной половине диагностированы два плоских округлых очага желтоватого цветы с «пестрой» поверхностью размерами 1 ДД (рис. 1). На глазном дне левого глаза парамакулярно выявлены два плоских очага желтоватого цвета размерами 1 ДД. По ходу верхне-носовой аркады в 1,5 ДД от ДЗН визуализировали плоский очаг желтоватого цвета с пестрой поверхностью размером 1 ДД, на средней периферии снизу – 2 округлых очага желтоватого цвета с «пестрой» поверхностью размерами 2 и 1,5 ДД (рис. 2). В общей сложности было выявлено 9 очагов: 4 – в правом глазу и 5 – в левом.
По данным УЗИ обоих глаз зон проминенции выявлено не было. При проведении ОКТ в макулярной зоне правого глаза выявлена отслойка нейроэпителия (ОНЭ) высотой 309 мкм. Субфовеолярно с распространением в сторону верхне-височной аркады визуализировано расширение хориоидального комплекса с ровным профилем передней поверхности, асимметрией формы скатов хориоидального комплекса и неравномерной умерено рефлективной структурой. В зоне максимальной проминенции очага хориокапилляры не визуализировались. В надлежащей сетчатке – участки утолщения слоя ретинального пигментного эпителия, отек фоторецепторного и ядерных слоев. Аналогичные изменения имели и остальные очаги, в том числе на парном глазу. На поверхности и/или по скатам очагов выявлена ОНЭ. Толщина хориоидального комплекса в зоне максимальной проминенции очагов варьировала от 391 до 1062 мкм на правом глазу и 535-1254 мкм – на левом.
На основании данных анамнеза, билатерального многофокусного поражения с характерной ОКТ-картиной [6, 12-14] был поставлен диагноз метастатического поражения хориоидеи. Следует отметить, что описываемые в литературе неровности передней поверхности хориоидального комплекса («lumpy, bumpy») характерны для метастазов больших размеров [6, 13, 14], а на ранних стадиях процесса он может быть ровным или иметь незначительную неровность [15], что и имело место в данном случае.
Ранее симптоматическим лечением метастазов хориоидеи была признана лучевая терапия (дистанционная гамма-терапия или облучение узким медицинским протонным пучком), приводящая к регрессии опухолевого узла, резорбции субретинальной жидкости и повышению остроты зрения [2]. Считают, что лучевая терапия требует длительного периода лечения, что может быть неудобным и непрактичным у тяжелобольных пациентов [6]. Первые работы по успешному применению ПХТ в лечении пациентов с диссеминированным метастатическим процессом появились еще в 1970-80-х гг. [16], но, несмотря на это, долгое время эффективность ПХТ ставилась под сомнение [17]. В последние годы при многофокусном билатеральном поражении хориоидеи в сочетании с метастазами другой локализации предпочтение отдают системной химиотерапии, иммуно- или гормональной терапии [6].
С учетом наличия диссеминированного метастатического процесса пациентке была рекомендована консультация онколога. В октябре-ноябре пациентка получила 6 циклов ПХТ по схеме ТС (паклитаксел, карбоплатин).
На фоне проведенного лечения пациентка отметила уменьшение искажений перед правым глазом, при этом МОЗ повысилась до 0,8 н/к. При осмотре глазного дна правого глаза отмечено уменьшение размеров очага по ходу верхне-височной аркады и ОНЭ в макулярной зоне. Очаги в перипапиллярной зоне и на средней периферии с височной стороны не определены (рис. 4). При осмотре глазного дна левого глаза отмечено уменьшение размеров очагов по ходу верхне-носовой и нижне-височной аркад, а парамакулярно расположенные очаги уже не определялись (рис. 5).
По данным ОКТ на правом глазу субфовеолярная ОНЭ уменьшилась до 43 мкм. Толщина хориоидального комплекса в зонах, ранее соответствовавших зонам максимальной проминенции очагов, уменьшилась до 232-451 мкм на правом глазу и до 206-587 мкм – на левом (рис. 6, 7).
Уменьшение толщины хориоидального комплекса сопровождалось усилением рефлективности хориоидального комплекса с «уплотнением» его структуры, что скорее всего свидетельствует о формировании рубца на месте хориоидального метастаза. В фовеолярной зоне правого глаза появились участки деструкции РПЭ (штрихообразная гипертрансмиссия). В сетчатке над остальными очагами выявлено увеличение гиперрефлективных изменений на уровне РПЭ. На участках ранее существовавшей ОНЭ отмечено уменьшение рефлективности слоя фоторецепторов, она сохранялась только вокруг наиболее крупных очагов.
Приведенное наблюдение свидетельствует о большей информативности оптической когерентной томографии для выявления начальных, офтальмоскопически «скрытых» метастазов в хориоидею. Это позволяет рекомендовать обязательное билатеральное ОКТ-исследование не только макулярной зоны, но и средней периферии у больных с онкологическим анамнезом. Есть основания полагать, что его можно использовать и для оценки проводимого лечения (особенно это заметно на метастазах малых размеров), в частности, полихимиотерапии.
Примеры МРТ метастазов в хориоидею
Метастатические опухоли сосудистой оболочки глаза, сетчатки и диска зрительного нерва
Метастатический рак, вероятно, является наиболее часто встречающейся интраокулярной злокачественной опухолью. По проблеме метастатического поражения внутриглазных структур опубликованы результаты многочисленных больших серий наблюдений, обзоры и клинические случаи, в настоящей статье мы цитируем лишь некоторые из них (1-53). Несмотря на то, что метастазы в сосудистой оболочке - наиболее часто встречающееся злокачественное внутриглазное новообразование, в практике офтальмоонколога эта патология встречается реже, чем меланома сосудистой оболочки, вероятно, потому, что у многих из этих больных уже имеется далеко зашедшее системное раковое поражение и такие больные не попадают в поле зрения офтальмолога.
Метастазы рака достигают интраокулярные структуры гематогенным путем и чаще всего поражают сосудистую оболочку, >90% из них локализуется в задней части хориоидеи, а
Чаще всего встречаются внутриглазные метастазы рака, метастазы сарком и меланом наблюдаются реже. Большинство метастазов в сосудистой оболочке - это метастазы рака молочной железы у женщин и метастазы легких у мужчин. Реже в роли первичной опухоли выступает рак желудочно-кишечного тракта, почек, щитовидной железы, поджелудочной железы, предстательной железы и других органов. Иногда в сосудистую оболочку метастазируют меланома кожи и карциноидные опухоли легких, такие поражения имеют характерные отличительные признаки.
Из всех пациентов, попадающих на прием к офтальмологу с метастазами в сосудистой оболочке, примерно у 25-30% в анамнезе отсутствуют сведения о системном раковом поражении (1). В ходе последующего системного обследования примерно у 17% пациентов первичную раковою опухоль выявить не удается, и она остается неустановленной (1). Поэтому клиницисту необходимо знать клинические проявления внутриглазного метастатического поражения.
а) Клиническая картина. Клиническая картина внутриглазных метастазов варьирует в зависимости от локализации опухоли (1-53). Проявления метастазов в радужке отличаются разнообразием (4,5). Они могут представлять собой единичные или множественные узелки в строме радужки желтого, белого или розового цвета. Они могут выглядеть как одна или несколько четко отграниченных опухолей или иметь рыхлую структуру и давать отсевы клеток в водянистую влагу, формируя картину внутриглазного воспаления и опухолевый псевдогипопион. Метастазы в цилиарном теле зачастую бывает сложно обнаружить клинически. Они могут выглядеть как солитарное объемное образование или вызывать симптомы воспаления, симулируя иридоциклит.
Метастазы хориоидеи обычно выглядят как одно или несколько желтых образований на глазном дне одного или обоих глаз. Отмечается предрасположенность к поражению задней части хориоидеи, часто метастазы локализуются в макулярной области. В отличие от метастазов в радужке и цилиарном теле, метастазы хориоидеи, как правило, не вызывают выраженных симптомов воспаления, но обычно сопровождаются вялотекущей вторичной отслойкой сетчатки. Хотя метастазы хориоидеи обычно имеют желтую окраску, метастазы меланомы зачастую имеют серый или коричневый цвет, а метастазы карциноидной опухоли, рака щитовидной железы и почечноклеточного рака часто бывают оранжевого цвета. Метастазы в сетчатке, встречающиеся крайне редко, могут симулировать окклюзивный васкулит и давать отсевы клеток в стекловидное тело.
Метастазы в стекловидном теле также встречаются редко и, вероятно, развиваются из поражений сетчатки. Обычно они проявляют себя появлением опухолевых клеток в стекловидном теле, что напоминает первичный воспалительный процесс или первичную лимфому. Метастатические поражения диска зрительного нерва могут развиваться вследствие разрастания юкстапапиллярных метастазов в хориоидее или же могут представлять собой изолированное поражение зрительного нерва; в последнем случае диск зрительного нерва пораженного глаза выступает в стекловидную полость (6). Часто развивается вторичная глаукома, особенно при опухолях радужки и цилиарного тела.
Метастазы рака легких в радужке с кровоизлиянием и вторичной гифемой. Метастаз карциноидной опухоли бронха в радужке: наблюдается характерная «мясная» розово-оранжевая окраска. Множественные метастазы мелкоклеточного рака легкого в радужке у женщины 78 лет. Тот же глаз, показанный на рисунке выше, после внешнего облучения: наблюдается регресс опухолей. Узловой метастаз рака желудка с псевдогипопионом, образовавшимся вследствие дисперсии клеток основной опухоли. Метастаз саркомы Юинга бедра в радужке у пациентки 19 лет. Отмечаются многочисленные опухолевые узелки на поверхности радужки и рыхлая опухоль, создающая картину «псевдогипопиона» в нижней части передней камеры.
МЕТАСТАЗЫ В ХОРИОИДЕЕ НЕВЫЯВЛЕННЫХ ПЕРВИЧНЫХ ОПУХОЛЕЙ, ДИАГНОСТИРОВАННЫЕ С ПОМОЩЬЮ ТОНКОИГОЛЬНОЙ АСПИРАЦИОННОЙ БИОПСИИ
Иногда у больного обнаруживают новообразование сосудистой оболочки, по своей картине соответствующее метастазу, но в результате системного обследования первичную опухоль выявить не удается, данные о раке в анамнезе больного также отсутствуют, и для подтверждения диагноза метастаза выполняется тонкоигольная аспирационная биопсия. В некоторых случаях на локализацию первичной опухоли могут указывать характерные цитопатологические признаки или результаты иммуногистохимического исследования. Однако у других пациентов цитопатологическое исследование подтверждает диагноз метастатического поражения, но локализация первичной опухоли так и остается неизвестной. Ниже проиллюстрировано несколько случаев, в каждом из которых диагноз ставился на основании цитопатологического исследования материала, полученного при тонкоигольной аспирационной биопсии, но первичная опухоль так и не была выявлена.
Метастаз в хориоидее кверху от диска зрительного нерва. Метастаз в хориоидее в макулярной зоне. Метастаз в хориоидее кверху от диска зрительного нерва. Метастаз в хориоидею макулярной зоны. Метастаз в хориоидее снизу от диска зрительного нерва с фиброзной метаплазией пигментного эпителия сетчатки. Метастаз в хориоидее, окружающий и прорастающий диск зрительного нерва.
б) Диагностика. Диагностика внутриглазных метастазов обычно включает в себя сбор анамнеза о ранее существовавших раковых опухолях и тщательную биомикроскопию на щелевой лампе и офтальмоскопию. Диагностике помогают дополнительные методы исследования, такие, как флюоресцентная ангиография и ультразвуковое исследование. При флюоресцентной ангиографии гиперфлюоресценция метастазов в хориоидее, как правило, начинается в позднюю венозную фазу, обычно позже, чем гиперфлюоресценция меланомы или гемангиомы хориоидеи. При ультразвуковом A-сканировании обычно отмечается высокая эхогенность ткани метастаза, а при В-сканировании - акустическая плотность образования; такая же картина наблюдается при гемангиоме хориоидеи. В редких случаях метастаз в хориоидее может принимать грибовидную форму, аналогично меланоме хориоидеи (19).
Оптическая когерентная томография с увеличенной глубиной сканирования (enhanced depth imaging optical coherence tomography-EDI-OCT) - новый метод, позволяющий выявлять субклинические метастазы глазного яблока, оценивать топографию поверхности опухоли и ее инвазивность. При ОКТ с увеличенной глубиной сканирования в большинстве случаев наблюдается сдавление мелкими хориоидальными метастазами слоя хориокапилляров, при этом новообразование имеет контур типа «кочек и ухабов». Также отмечается утрата фоторецепторов и скопление субретинальной жидкости (21). В сложных случаях, когда с помощью перечисленных выше методов обследования не удается поставить диагноз, выполняется тонкоигольная биопсия с цитологическим исследованием аспирированного материала (17).
в) Патологическая анатомия. В большинстве случаев диагноз внутриглазного метастаза ставится клинически, забор ткани для гистологического исследования не выполняется. Однако метастазы в сосудистой оболочке формируют классическую макроскопическую и микроскопическую картину. При макроскопическом исследовании эти злокачественные новообразования обычно имеют белую или желтую окраску, они могут быть диффузными или узловыми и иметь широкое основание. Гистологическое строение метастазов в сосудистой оболочке варьирует в широких пределах, оно зависит от типа и локализации первичной опухоли и степени ее дифференцировки (1-3).
Иногда опухоль настолько низко дифференцирована, что при исследовании тканей глаза локализацию первичной опухоли определить трудно. В таких случаях некоторую помощь в классификации новообразования и определении локализации первичной опухоли оказывает иммуногистохимическое исследование.
г) Лечение. Способы лечения при метастазах в сосудистой оболочке различаются в зависимости от клинической ситуации (1-8, 22-25). Мелкие бессимптомные опухоли или образования, реагирующие на проведенную ранее или проводимую во время выявления метастаза химиотерапию, могут не требовать немедленного лечения и подлежат лишь периодическому наблюдению. По поводу более крупных вызывающих жалобы опухолей проводится внешнее облучение или брахитерапия с применением аппликатора. Недавно был описан прекрасный эффект фотодинамической терапии при лечении мелких метастазов в задней части хориоидеи. Фотодинамическая терапия длится всего несколько минут, тогда как любая методика лучевой терапии требует гораздо больше времени (22, 24).
Системный прогноз зависит от типа опухоли. У больных с метастазами рака молочной железы в хориоидею прогноз зачастую более благоприятный, тогда как метастазы рака легких или меланомы характеризуются значительно худшим прогнозом. У пациентов с метастазами карциноидной опухоли прогноз зачастую гораздо более благоприятный, так как метастатические очаги этой опухоли могут оставаться относительно стабильными в течение месяцев или лет (1).
Клинические примеры метастатических опухолей сосудистой оболочки глаза, сетчатки и диска зрительного нерва:
Редактор: Искандер Милевски. Дата публикации: 11.6.2020
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ФГБУ "НИИ глазных болезней" РАМН, Москва
Кафедра офтальмологии ГБОУ ДПО "Российская медицинская академия последипломного образования"
Выживаемость больных меланомой хориоидеи больших размеров
Журнал: Вестник офтальмологии. 2014;130(4): 39‑44
Стоюхина А.С., Чесалин И.П. Выживаемость больных меланомой хориоидеи больших размеров. Вестник офтальмологии. 2014;130(4):39‑44.
Stoiukhina AS, Chesalin IP. Survival rates for large choroidal melanomas. Vestnik Oftalmologii. 2014;130(4):39‑44. (In Russ.).
В современной онкологии одним из важных критериев оценки эффективности лечения принято считать 5- и 10-летнюю выживаемость больных после проведенного лечения.
Общая 5-летняя выживаемость больных меланомой хориоидеи (МХ) после лечения, по данным литературы, составляет 72% [1]. Следует подчеркнуть, что авторы не приводят сведений о зависимости выживаемости от метода лечения и исходных размеров опухоли. В то же время имеются данные о 79-95% 5-летней [2, 3] и 85% 10-летней [4] выживаемости больных МХ после брахитерапии (БТ).
Что касается энуклеации как метода лечения глаз с МХ, то имеются сведения, указывающие на зависимость смертности в течение 5 лет после энуклеации от исходных размеров опухоли. Так, при малых меланомах она составляет 16%, при опухолях средних размеров - 32%, а при больших МХ достигает 53% [5]. Спустя 15 лет после публикации указанных сведений появились исследования J. Gambrelle и соавт. [6], доказывающие низкую 5-летнюю специфическую выживаемость после первичной энуклеации (всего 31,45%). Все перечисленные данные касаются европейской популяции больных, в которой, как известно, преобладает смешанно-клеточный гистотип меланомы, который следует расценивать как один из неблагоприятных прогностических факторов 8.
В немногочисленной отечественной литературе приведены сравнительные показатели продолжительности жизни больных МХ после локального разрушения опухоли и энуклеации при больших МХ [10, 11]. Но в данных работах отсутствует сравнительная характеристика результативности как органосохранного, так и ликвидационного (энуклеация) лечения с учетом исходных размеров опухоли.
Как известно, при анализе выживаемости больных МХ имеют значение не только клиническая стадия и размеры опухоли, но и ее гистологический, генетический типы и уточненная причина смерти [13].
По данным COMS, 2-, 5- и 10-летний уровень метастазирования МХ составляет 10, 25 и 34% соответственно и только у 0,24% больных метастазы выявляют в момент постановки диагноза [14]. Но каждый 1 мм увеличения толщины меланомы повышает риск метастазирования в течение 10 лет на 5% [15]. Таким образом, исходные размеры опухоли являются определяющими для оценки витального прогноза.
С учетом изложенного возрастает значение метрической классификации меланом хориоидеи.
В настоящее время существуют две наиболее часто используемые метрические классификации МХ. Речь идет о классификациях J. Shields [16] и COMS (Collaborative Ocular Melanoma Study) [17]. Параметры МХ, согласно приведенным классификациям, представлены в табл. 1.
Как следует из табл. 1, в классификации COMS значительно увеличена толщина меланом в группе средних и больших опухолей. Это, естественно, привело к расширению показаний для их органосохранного лечения. Локальное разрушение опухоли (БТ, транспупиллярная термотерапия - ТТТ) начали проводить при проминенции ее более 6 мм [18, 19].
Обоснованием такого подхода к лечению МХ явились сведения о том, что общая и специфическая смертность, а также продолжительность жизни без метастазов достоверно не различаются после энуклеации и органосохранного лечения больших МХ [11, 20, 21].
В связи с изложенным была сформулирована цель настоящего исследования: проанализировать 5-летнюю специфическую выживаемость пациентов с большими МХ (по классификации J. Shields) с учетом проведенного лечения.
Материал и методы
Методом сплошной выборки исследована медицинская документация 103 больных, получивших лечение по поводу больших МХ в различных специализированных офтальмологических центрах Москвы в течение 2002-2007 гг. и находящихся на диспансерном наблюдении в городском офтальмоонкологическом центре при Московской офтальмологической больнице. В исследование включены пациенты с исходной проминенцией опухоли от 5,0 до 10,2 мм, так как при наличии б́ольшей проминенции опухоли органосохранное лечение не проводили. Исходный диаметр основания опухоли варьировал от 7,3 до 20 мм. До начала лечения, по данным проведенного общего обследования, метастазы у всех пациентов отсутствовали.
Органосохранное лечение получили 60 человек. БТ была выполнена 46 пациентам (в 37 случаях однократно), БТ в сочетании с ТТТ - 14 больным (в одном случае с последующей эндорезекцией опухоли). В этой группе у 16 больных была выполнена вторичная энуклеация.
Первичная энуклеация по поводу большой МХ проведена 63 больным.
Протоколы патогистологического исследования, подтверждающие диагноз МХ, изучены во всех 79 случаях.
Статистическая обработка результатов выполнена в программах Microsoft Excel и Statistica 6.0. Для оценки выживаемости использовали метод Каплана-Мейера и двувыборочный анализ по Гехану-Вилкоксону, в котором группирующей переменной являлся тип лечения.
Результаты и обсуждение
В зависимости от проведенного лечения пациенты разделены на две группы. 1-ю группу составили лица, получившие органосохранное лечение (в том числе и те, которым была выполнена вторичная энуклеация), во 2-й группе единственным методом лечения была первичная энуклеация. Характеристика обеих групп представлена в табл. 2.
Как следует из табл. 2, представленные группы по показателям практически не различались и все МХ по проминенции выходили за пределы 6 мм, иными словами, были отнесены к большим опухолям.
В 1-й группе от гематогенного метастазирования умерли 16 (26,67%) больных в среднем через 4,06±1,03 года после начала лечения. Обращает на себя внимание тот факт, что средний исходный диаметр опухоли у этих больных составил 15,37±1,24 мм, что достоверно отличалось (р=0,002) от исходного диаметра у пациентов без метастазов (13,12±0,78 мм). Достоверных различий в исходной проминенции МХ получено не было (6,68±0,64 и 7,06±0,44 мм соответственно). Таким образом, нельзя исключить из факторов риска метастазирования и диаметр опухоли.
У 16 больных этой группы была выполнена вторичная энуклеация в среднем через 2,95±1,44 года после начала лечения. До лечения у этих больных средняя максимальная проминенция опухоли составляла 7,33±1,82 мм, а средний максимальный диаметр - 13,82±1,52 мм. Таким образом, указанные параметры меланомы у этих больных существенно не отличались от исходных размеров опухоли у пациентов, получивших только органосохранное лечение.
Как показывают наши наблюдения, вторичную энуклеацию после органосохранного лечения больших МХ пришлось выполнить у 26,67% больных, основной причиной для энуклеации явился продолженный рост опухоли.
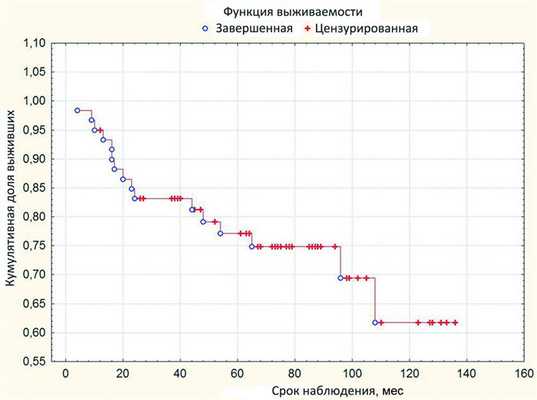
При анализе по Каплану-Мейеру 5-летняя выживаемость без энуклеации составляет 0,7708, стандартная ошибка 0,0563, а 9-летняя - достигает 0,6175 при стандартной ошибке 0,0988 (рис. 1). Рисунок 1. Рис. 1. Выживаемость без энуклеации после проведения органосохранного лечения.
И тем не менее, в наших наблюдениях в среднем через 35 мес энуклеация оказалась необходимой практически у каждого 4-го больного. Полученные данные совпадают с данными литературы о высоком риске энуклеации после проведении БТ с рутением-106 в течение 5 лет наблюдения [2].
Во 2-й группе от гематогенного метастазирования умерли 10 (15,83%) пациентов в среднем через 5,2±1,54 года после энуклеации. Несмотря на то что исходные размеры опухолей у этих больных несколько превышали таковые у больных без метастазов, статистической значимости различий не получено.
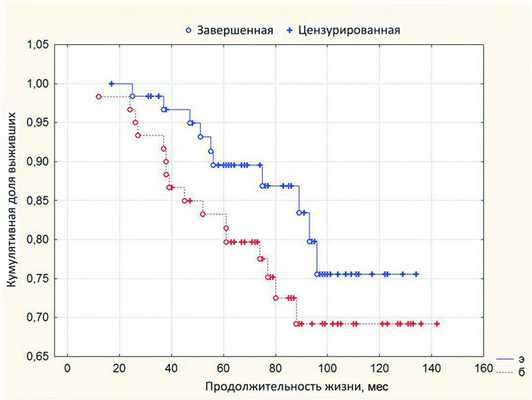
Таким образом, в группе больных, перенесших первичную энуклеацию, витальный прогноз оказался несколько лучше, чем после органосохранного лечения. Тем не менее при проведении двухвыборочного анализа по Геноху-Вилкоксону статистически значимой разницы в выживаемости (р=0,11) у пациентов этих двух групп не получено (рис. 2). Рисунок 2. Рис. 2. Выживаемость после органосохранного лечения (б) и первичной энуклеации (э). Разница продолжительности жизни также оказалась статистически недостоверной (р=0,17).
Как видно из табл. 3 , имеются различия в результатах, полученных в ходе исследований [11, 20], которые можно объяснить разным подходом к формированию групп исследования. К примеру, в работе Т.В. Шириной [20] сравниваются группы больных, получивших только органосохранное лечение, с группой больных, которым была проведена и первичная, и вторичная энуклеация. С нашей точки зрения, это не совсем корректно, так как проведение предшествующего органосохранного лечения также может оказывать влияние на витальный прогноз (техника проведения операции, гистотип опухоли). Кроме того, при исследовании общей выживаемости не учтен возраст больных в анализируемых группах. А между тем хорошо известно, что старший возраст больных - один из факторов риска метастазирования меланомы. В работе А.А. Ярового и соавт. [11] сравниваются показатели метастазирования после органосохранного лечения и первичной энуклеации больших меланом. Случаи вторичной энуклеации не включены в исследование. Хотя доказано, что продолжительность жизни больных с момента выявления метастазов может достигать 62 мес и зависит от общеонкологического лечения [12].
Заключение
Как показали наши исследования, при условии однотипности исходных биометрических показателей опухоли после первичной энуклеации витальный прогноз несколько лучше, чем после органосохранного лечения, даже с учетом старшего возраста больных этой группы.
Следует отметить, что после органосохранного лечения за более короткий промежуток времени (в 1,3 раза) от гематогенного метастазирования умерли в 1,6 раза больше больных, чем после первичной энуклеации, хотя при анализе по Гехану-Вилкоксону подтверждения статистической значимости этих различий не получено.
Таким образом, в каждом конкретном случае большой МХ следует подходить индивидуально и решать вопрос о методе лечения с учетом возраста больных, размеров опухоли и психологического настроя пациентов. Следует учитывать, что даже при отсутствии достоверной разницы выживаемости у пациентов со средними МХ, получивших БТ и перенесших энуклеацию, имеются различия в качестве жизни: у пациентов, перенесших энуклеацию, достоверно ниже частота тревожных состояний, связанных с риском рецидива опухоли [22].
Метастазы в головном мозге
Метастатический рак мозга (другое название — вторичный рак мозга) — распространение раковых клеток в головном мозге из злокачественной опухоли, расположенной в другой части тела. Некоторые факты и цифры:
- Вторичный раз могла встречается в 10 раз чаще, чем первичный, то есть тот, который изначально развивается в головном мозге; в головной мозг возникают у 20-40% онкологических больных (в среднем у каждого четвертого);
- Ежегодно метастатический раз мозга диагностируют у 50 000 — 70 000 россиян;

Пару десятилетий назад при множественных метастазах в головной мозг на пациенте можно было ставить крест – нейрохирургические учреждения, делавшие успехи в терапии первичных опухолей головного мозга, таких больных не брали, потому как оперативное лечение в этом случае уже было почти невозможным. Даже в столице не более трёх специалистов готовы были попробовать лучевую терапию, между тем как по данной теме было защищено несколько диссертаций, демонстрирующих очень неплохой результат. Но практическая деятельность сталкивалась с клиническими трудностями, делающими спасение пациента весьма трудоёмким.
Метастазы злокачественных опухолей в головном мозге постигают каждого четвёртого больного, при посмертном исследовании их находят у шести из десяти. Метастазы выявляются на порядок чаще, чем первичные опухоли центральной нервной системы, которыми охотно занимаются нейрохирурги. Российская онкологическая статистика учитывает только первичные опухоли головного мозга и вообще первичные раки, но не знает, сколько больных имеют метастазы куда бы то ни было, а не только в головной мозг.
Метастазы в головном мозге.
Любая опухоль метастазирует в мозг, но чаще всего рак лёгкого, особенно крайне агрессивный мелкоклеточный — до 80% больных, а также рак молочной железы, кишки, почки и меланома, но все они метастазируют много реже рака лёгкого. Сегодня метастазы в головном мозге находят чаще, чем в конце прошлого века, чему весьма способствуют методы нейровизуализации — КТ и МРТ и увеличение выживаемости онкологических больных в результате успехов онкологической науки. Заметно повысилась и активность онкологов, не только решающихся на лечение самых непростых больных, но и имеющих возможность выхаживать таких пациентов.

Андрей Львович Пылёв, главный врач сети "Евроонко", онколог, кандидат медицинских наук
Как правило, большинство больных к моменту выявления внутричерепных метастазов имеют другие, подчас неизлечимые и распространённые, очаги опухоли, состояние их оставляет желать лучшего, а локальная терапия внутричерепных метастазов чревата ранним рецидивом. Внедрение высокотехнологичного лечения, как хирургического, так и лучевого, помогло избавиться от профессионального пессимизма и увеличило 5-летнюю выживаемость пациентов, придав их жизни вполне приемлемое качество.
Почему возникают метастазы в головном мозге?
Метастазирование — довольно сложный процесс. Он состоит из нескольких этапов. Опухоль должна прорасти в соседние ткани, затем ее клетки отрываются и проникают в кровеносные или лимфатические сосуды. Мигрируя с током крови, раковые клетки оседают в разных органах. Какое-то время они «дремлют», затем начинается бурный рост.
Чаще всего — в 48% случаев — метастазы в мозг связаны с раком легких. Наиболее агрессивен немелкоклеточный рак легкого — он метастазирует в мозг в 80% случаев. Реже встречаются метастазы при раке молочной железы (15%), мочеполовой системы (11%), остеогенной саркоме (10%), меланоме (9%), раке головы и шеи (6%).
Метастаз в головном мозге в динамике
Клинические проявления метастазов
Симптоматика зависима от размеров внутричерепных опухолевых очагов, их количества и расположения. Принципиально клинические симптомы можно разделить на две группы:
- локальные, обусловленные расположением опухоли в конкретном отделе мозга, отвечающем за определённые функции определённого органа;
- общемозговые симптомы, связанные с размером дополнительной опухолевой ткани, мешающей функционированию самого мозга.
К примеру, опухоль рядом со структурами, обеспечивающими иннервацию глаза, проявится выпадением полей зрения, когда глазом не воспринимаются отдельные участки сектора обзора. Множество мелких узлов даст картину отёка головного мозга, поскольку лишние граммы опухоли в замкнутой черепной коробке мешают нормальной циркуляции жидкостей и сдавливают нормальные ткани.
У половины больных вторичные новообразования головного мозга откликаются головной болью, очень часто интенсивность боли меняется вместе с положением головы, когда при наклоне под определённым углом частичное восстановление циркуляции ликвора временно приводит к уменьшению боли. К сожалению, со временем рост метастазов сделает боль постоянной, а замкнутость пространства приведёт к невыносимой интенсивности. Нередки головокружения и двоение, если смотреть обоими глазами.

Коридор клиники Евроонко
У каждого пятого пациента развиваются двигательные нарушения вплоть до пареза половины тела. У каждого шестого страдают интеллектуальные способности, столько же мучается от изменений поведения, нарушений движений и походки, чуть реже отмечаются судороги, но и совершенно бессимптомное течение, когда метастатические образования выявляют лишь при обследовании, тоже не редкость. Тем не менее, при увеличении размеров опухоли даже в такой относительно благоприятной ситуации довольно быстро нарушаются функции организма.
Отёк ткани вокруг опухоли — перифокальный отёк вкупе с повышением внутричерепного давления (ВЧД) вызывают общемозговые симптомы с головной болью, головокружением, двоением, рвотой при малейшем движении или даже при открывании глаз, постоянной икотой, приводят к угнетению сознания вплоть до мозговой комы. Снижение частоты сердцебиений и дыханий при очень высоком «верхнем» систолическом давлении свидетельствуют о крайне высоком и чреватом гибелью внутричерепном давлении.
В практике выделяют варианты развития первичной симптоматики при метастазах рака в центральную нервную систему по превалирующему комплексу клинических признаков.
- Похожий на инсульт апоплексический вариант, развивается остро и проявляется очаговыми нарушениями — свидетельством поражения определённого участка мозга. Такой вариант, как правило, связан либо с закупоркой сосуда, либо его разрывом опухолью с последующим кровоизлиянием в головной мозг.
- Ремиттирующий вариант характеризуется волнообразным течением, когда симптомы то уменьшаются, то прогрессируют, напоминая атеросклеротическое поражение сосудов.
У некоторых больных метастазы головного мозга протекают бессимптомно. Обнаруживают их только во время обследования.
Как диагностируют метастазы в головном мозге?
«Золотой стандарт» в диагностике метастатического рака головного мозга — магнитно-резонансная томография (МРТ). Во время этого исследования получают изображения внутренних структур тела, используя сильное магнитное поле. По снимкам врач может судить о количестве, размерах, расположении метастатических очагов.
Биопсия — исследование, во время которого получают фрагмент ткани и исследуют его на предмет раковых клеток. Если у человека уже диагностирован рак в другом органе и обнаружены очаги в головном мозге, потребности в данном методе диагностики обычно нет. Биопсия нужна, если есть очаги в мозге, но не найдена первичная опухоль.
Лечение метастазов
Без лечения продолжительность жизни больного от момента выявления метастатического поражения головного мозга едва ли превышает месяц, но это в среднем. Только добавление высоких доз гормонов способно двукратно увеличить продолжительность жизни и несколько улучшить её качество, но опять только на время, тогда как химиолучевое лечение может дать до полугода жизни.
Тактика лечения зависит от некоторых факторов:
- Количество, размер и расположение метастазов;
- Возможность удалить очаги хирургическим путем;
- Чувствительность первичной опухоли к химиопрепаратам и лучевой терапии;
- Общее состояние больного;
- Наличие других метастазов, возможность бороться с ними.
Прогностически неблагоприятна локализация опухоли в недоступной для манипуляций задней черепной ямке, нарушение циркуляции ликвора и вероятность вклинения опухоли в естественные черепные отверстия.
Несомненно, что только хирургическое пособие вкупе с дополнительным лекарственным и лучевым лечением даёт большие надежды. Но нейрохирургическое вмешательство возможно при одном или единичных опухолевых узлах, и, конечно, технически доступных. Паллиативную операцию выполняют при угрожающем нарастании давления и кровотечении, когда удаление даже одного из множества узлов способно радикально улучшить клиническую картину, чтобы присовокупить в дальнейшем консервативное лечение. Возможны разные варианты удаления опухолевых узлов.

При технически не удаляемых и чувствительных к противоопухолевым лекарствам видах рака, таких как молочная железа, мелкоклеточный рак лёгкого и герминогенные опухоли яичка, на первом этапе прибегают к химиотерапии, к которой в дальнейшем присоединяют облучение всего массива головного мозга. При радиочувствительных опухолях лечение можно начать с тотального облучения мозга. При опухолях не более 3,5 см и менее четырёх узлов как единственный метод эффективна стереотаксическая радиохирургия. К опухоли подводят с разных сторон несколько пучков радиоволн, они пересекаются в одном месте – там, где находится метастаз. В итоге раковые клетки уничтожаются, а окружающие здоровые ткани получают минимальную безопасную дозу. В комплексе с облучением мозга и химиотерапией результат лучше.
Система для стереотаксической радиохирургии
Лучевая терапия всегда сопровождается нарастанием отёчности ткани мозга, поэтому облучение всегда проводится на фоне дегидратации — симптоматической терапии, разгружающей от излишней жидкости. Поэтому радиолог может отказать в лечении пациенту, устойчивому к мочегонным препаратам, а также при уже смещённом головном мозге, поскольку дальнейшее смещение может стать для больного фатальным. Не возьмут на облучение тяжёлого пациента с выраженными клиническими проявлениями, тем более с судорогами или мутным сознанием. Уже после одного-двух сеансов облучения к имеющемуся высокому внутричерепному давлению присоединится лучевой отёк ткани, и без того очень неважное состояние пациента ухудшиться.
Возможны варианты последовательностей и сочетания методов, как при впервые выявленных метастазах в головной мозг, так и при рецидиве после лечения. Во всяком случае, при невозможности активной тактики и прогрессировании процесса клинические руководства рекомендуют прибегнуть к химиотерапии на фоне наилучшей поддерживающей симптоматической терапии (стероиды, обезболивающие, противосудорожные препараты и др.). Схема определяется первичной опухолью, то есть при раке лёгкого помогают одни препараты, при раке почки — другие. Химиотерапию проводят до выявления признаков прогрессии опухоли.
Терапия метастазов злокачественных опухолей в головной мозг не дело энтузиастов-одиночек, это работа команды онкологов, нейрохирургов, радиологов, химиотерапевтов и реаниматологов, вооружённых знаниями и отличным оборудованием для диагностики и лечения, как в клиниках «Евроонко».
Каковы прогнозы при метастазах в головной мозг?
Прогноз зависит от типа первичной опухоли, количества метастазов, возраста и состояния пациента. В среднем пациенты живут 2-3 месяца. Но если метастазы единичные, пациенту меньше 65 лет, и в организме нет других метастазов, средняя продолжительность жизни может составить 13,5 месяцев.
Врачи онкологи и реаниматологи «Евроонко» знают, как помочь пациенту с метастатическим раком. Грамотное лечение избавит от тяжелых симптомов, подарит драгоценное время.
Читайте также:
