Прионопатия с изменчивой чувствительностью к действию протеаз
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Прионопатия с переменной чувствительностью к протеазам (VPSPr) (ранее известный как Прионопатия, чувствительная к протеазе) является спорадическим прионный белок болезнь впервые была описана в аннотации к конференции по прионам в 2006 г., а это исследование было опубликовано в отчете 2008 г. по 11 случаям. Исследование было проведено Gambetti P., Zou W.Q. и сотрудниками из Национального центра наблюдения за патологией прионных болезней США. [1] [2] Впервые он был идентифицирован как отдельное заболевание в 2010 году Цзоу В.К. и сотрудники из Национального центра наблюдения за патологией прионных заболеваний США. [3]
У пациентов наблюдаются поведенческие и психиатрические симптомы, нарушения речи (афазия и / или дизартрия ) и прогрессирующее когнитивное и моторное снижение (слабоумие, атаксия, паркинсонизм, психоз, афазия и перепады настроения ). Средний возраст начала заболевания составляет 70 лет, а продолжительность выживания - 24 месяца. Около 40% пациентов имеют семейный анамнез слабоумие. Как и CJD, его можно ошибочно принять за Деменция Альцгеймера.
Диагностика затруднена, так как патогномоничные признаки на МРТ, такие как кортикальная лента или признак хоккейной клюшки, периодические острые волновые комплексы на ЭЭГ и тесты на 14-3-3 белок и тау-белок обычно бесполезны, и мутаций в кодирующей области гена PrP не наблюдалось, в отличие от CJD и Вариант CJD. [6] Диагноз можно поставить на патологическое обследование. Есть уникальные микроскопические и иммуногистохимический особенности, и прионы не могут быть переварены с помощью протеаз. Поскольку 8 из 10 пациентов имели положительный семейный анамнез деменции в первоначальном исследовании, предполагалось наличие генетической причины. Некоторые предполагали, что заболевание может быть спорадической формой. Синдром Герстмана – Штройсслера – Шейнкера (СОС). [7]
В 2013 году Zou W.Q. и соавторы показали, что специфический протеазно-устойчивый PrP (PrPres), первоначально обнаруженный в VPSPr, также обнаруживается в мозге пациентов с генетической CJD, связанной с мутацией PrP Valine (V) в изолейцин (I) по остатку 180 (PrPV180I); кроме того, они обнаружили, что патологический PrP как из VPSPr, так и из gCJDPrPV180I имеет сходный гликоформ-селективный механизм образования прионов. [8,9] Интересно, что авторы также продемонстрировали, что устойчивый к протеазе PrPres как из VPSPr, так и из gCJDV180I не имеет гликозилированных видов PrP в первом сайте N-связанного гликозилирования на остатке 181, и они предположили, что дефицит гликозилирования PrP может быть вовлечен в патогенез этих двух состояний. В 2014 году Gambetti P., Zou WQ и соавторы обнаружили, что примерно у 54% мышей, инокулированных гомогенатами головного мозга VPSPr, наблюдались гистопатологические поражения, а у 34% был обнаружен патологический PrP, аналогичный таковому у VPSPr при первом пассаже, но прионное заболевание не было обнаружено на второй отрывок [10], предполагающий, что инфекционность патологического PrP от VPSPr ниже по сравнению с таковой от наиболее распространенного спорадического CJD.
Прионопатия с изменчивой чувствительностью к действию протеаз
ИП — ингибитор протеазы
ПВТ — противовирусная терапия
ПППД — препарат прямого противовирусного действия
ХГС — хронический гепатит С
ПЭГ-ИФН — пегилированный интерферон-α
УВО — устойчивый вирусологический ответ
Противовирусная терапия (ПВТ) хронического гепатита С (ХГС) в последние годы эволюционирует очень быстрыми темпами. В 2011 г. на смену комбинации пегилированного интерферона-α (ПЭГ-ИФН) с рибавирином (РБВ), в течение десятилетия являвшейся практически безальтернативным вариантом лечения, пришли трехкомпонентные схемы ПВТ, включающие (кроме ПЭГ-ИФН и РБВ) ингибитор вирусной протеазы (ИП) — препарат непосредственно действующий на вирус (рис. 1).
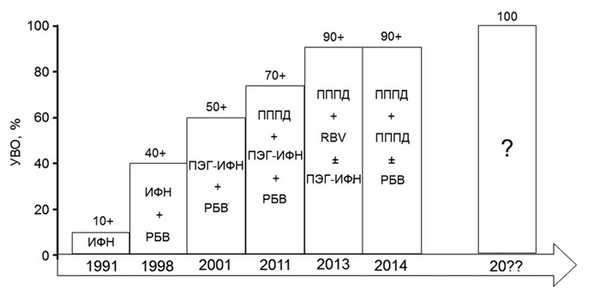
Рис. 1. Эволюция ПВТ ХГС. УВО — устойчивый вирусологический ответ.
В настоящее время существует 3 основных класса препаратов прямого противовирусного действия (ПППД): ингибиторы NS¾A-протеазы, ингибиторы NS5В-полимеразы (нуклеоз (т)идные и ненуклеоз (т)идные) и ингибиторы NS5A- комплекса вируса гепатита С (HCV).
В 2013—2014 гг. за рубежом появились схемы ПВТ, в которых ПЭГ-ИФН не является обязательным компонентом (так называемые безинтерфероновые варианты лечения, состоящие только из комбинаций ПППД различных классов). Вероятно, сейчас уже можно задумываться и о появлении идеального препарата для лечения больных гепатитом С. Однако ближайшие перспективы лечения больных ХГС, очевидно, связаны именно с применением комбинаций ПППД.
До недавнего времени в нашей стране основной стратегией лечения больных, инфицированных HCV 1-го генотипа, являлась трехкомпонентная терапия, состоящая из комбинации ПЭГ-ИФН и РБВ с одним из ИП (телапревиром, боцепревиром или симепревиром) [1].
В отличие от ПЭГ-ИФН и РБВ, влияющих на вирус преимущественно через иммунную систему организма больного, ПППД (в том числе ингибиторы NS¾A-протеазы) непосредственно подавляют вирусные белки. С началом применения ПППД для лечения больных ХГС появилась новая для этого заболевания проблема (хорошо знакомая специалистам, занимающимся гепатитом В и ВИЧ-инфекцией) — резистентность вируса. Этот феномен обусловлен формированием мутаций, позволяющих вирусу изменять свои свойства, в результате чего противовирусный препарат теряет эффективность.
Важной характеристикой любого ПППД является его генетический барьер, определяющийся минимальным количеством мутаций, которые одновременно должны присутствовать в геноме вируса, для приобретения им резистентности. Если для формирования резистентности достаточно лишь одной мутации, то препарат расценивается как имеющий низкий генетический барьер. Препарат, для возникновения устойчивости к которому необходимо одновременно наличие нескольких мутаций в геноме вируса, считается обладающим высоким генетическим барьером.
Ингибиторы NS¾A-протеазы как первой, так и второй волны относятся к препаратам с низким генетическим барьером (табл. 1).
Таблица 1. Основные характеристики ингибиторов NS¾A-протеазы HCV
Исходно в организме больного ХГС существует гетерогенная популяция вируса (в том числе различные резистентные к ПППД варианты). При монотерапии ПППД с низким генетическим барьером (например, одним из ингибиторов NS¾A-протеазы) вирусная нагрузка (ВН) вначале быстро, затем плавно снижается за счет эффективного ингибирования чувствительных вариантов HCV (дикого типа), доминирующих в начале ПВТ. При достаточной продолжительности такого воздействия можно добиться полной элиминации вируса дикого типа. Популяция резистентных (устойчивых к действию ПППД) вариантов HCV, присутствующих в начале терапии в незначительном количестве, при этом может расти в геометрической прогрессии.
Описано значительное количество мутаций в регионе NS¾A-протеазы HCV, в том числе ассоциированных с резистентностью вируса к ИП [2—4]. Аминокислотные замены, связанные со значительным снижением чувствительности к действию каждого из препаратов, выделены на рис. 2 жирным шрифтом.
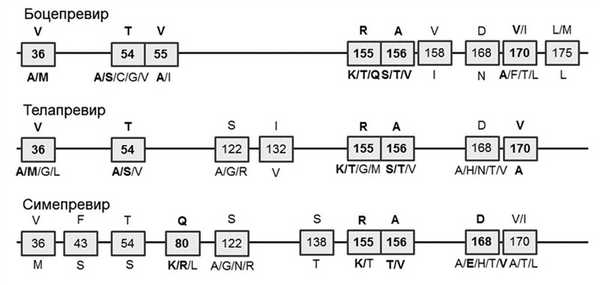
Рис. 2. Варианты мутаций в гене NS¾A-протеазы вируса, ассоциированные с резистентностью к ИП.
Мутации в регионе NS¾A-протеазы HCV приводят к нарушению связывания препарата с каталитическим центром указанного фермента и как следствие ослаблению ингибирующего влияния ИП на репликацию вируса.
Формирование резистентности зависит не только от характеристик препарата, но также от особенностей вируса. Одним из основных свойств вируса является его способность выживать и размножаться в организме. Для формирования клинически значимой резистентности варианты вируса, устойчивые к действию ПППД в силу наличия определенных мутаций, должны быть способны заполнить собой пространство, освобожденное диким типом HCV под влиянием ПВТ. Поэтому штаммы вируса, обладающие высокой устойчивостью к действию препарата, в сочетании со слабой способностью к репликации, клинически не столь значимы (в плане неэффективности лечения), как варианты HCV, менее устойчивые к терапии, но способные на ее фоне активно размножаться.
Непременным условием эффективного воздействия на HCV является достаточная концентрация противовирусного препарата в организме. При адекватном количестве действующего вещества подавляется репликация не только дикого штамма HCV, но и его менее чувствительных к терапии вариантов. В связи с этим при проведении ПВТ с применением ПППД особое значение имеет точное соблюдение больным схемы приема лекарственного препарата.
Хорошо известно, что залогом успеха при проведении терапии ПЭГ-ИФН с РБВ является чувствительность пациента к действию интерферона (ИФН). При безинтерфероновых вариантах лечения эффективность напрямую зависит от наличия клинически значимой резистентности к применяемым ПППД.
Значение резистентности вируса при использовании схем ПВТ, сочетающих ПЭГ-ИФН/РБВ с ПППД (ИП), неясно. В клинических исследованиях II и III фаз показано, что у большинства пациентов, не достигших УВО в результате трехкомпонентной терапии с телапревиром и боцепревиром, после окончания лечения доминирует вирусная популяция, резистентная к действию ИП [5—7]. Несмотря на это отдельные специалисты при терапии ПЭГ-ИФН/РБВ и ИП решающую роль отводят чувствительности больного к действию ИФН, пренебрегая при этом вкладом резистентности в эффективность (или неэффективность) лечения [8].
Мы согласны, что при использовании схем ПВТ, включающих ПЭГ-ИФН (в любых сочетаниях), именно чувствительность пациента к ИФН в основном определяет успешность лечения. Вместе с тем считаем, что в некоторых случаях (в частности, при трехкомпонентной терапии с ИП) решающее значение для результата терапии может иметь наличие или отсутствие у вируса резистентности к ПППД.
При высокой чувствительности пациента к ИФН наличие мутаций устойчивости к ИП незначимо, так как подавление всех штаммов вируса (диких и резистентных) обеспечивается ПЭГ-ИФН/РБВ.
При низкой чувствительности к ИФН выявление мутаций резистентности незначимо в силу того, что проводимая в данном случае по сути монотерапия ИП дает слабый эффект и всегда обречена на неудачу.
Очевидно, что решающее значение для результата лечения устойчивость к действию ИП (наряду с продолжительностью ПВТ) может иметь при умеренной чувствительности к ИФН. Предполагаемая динамика концентрации чувствительных и резистентных вариантов вируса на фоне терапии ПЭГ-ИФН/РБВ в сочетании с ПППД, имеющим низкий генетический барьер (например, с ИП), представлена на рис. 3.
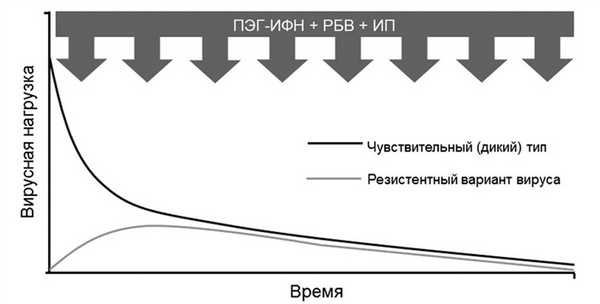
Рис. 3. Динамика В.Н. на фоне терапии с ИП при умеренной чувствительности к ИФН.
Материалы и методы
Обследовали 8 больных ХГС (4 мужчин и 4 женщины европеоидной расы) в возрасте от 21 года до 65 лет (медиана 52,5 года), инфицированных HCV генотипа 1b. Из 8 участников 7 имели генотип СТ IL-28B. Ни у кого из обследованных не выявлено ожирения и/или инсулинорезистентности.
Выраженность фиброза печени оценена с помощью общепринятых для этого методов: 3 больным выполнена эластометрия печени с помощью аппарата FibroScan («Echosens», Франция), 2 — пункционная биопсия печени, у 2 применялись оба метода. У одного пациента оценка фиброза (в силу неприменимости указанных методов) не произведена. У 2 человек на момент включения в исследование обнаружен тяжелый фиброз (цирроз) печени, у 2 выявлен умеренный фиброз, у остальных не получено данных, подтверждающих наличие фиброзных изменений в печени.
Все 8 человек перед включением в исследование получили курс ПВТ с ИП (3 с боцепревиром, 4 с телапревиром, 1 с симепревиром), в результате которого они не достигли УВО. У 4 больных ранее имелся безуспешный опыт лечения ПЭГ-ИФН/РБВ. В сроке до 1 года после завершения лечения с применением ИП всем участникам проведено исследование для выявления мутаций в регионе NS¾A-протеазы HCV.
В целях выделения РНК HCV использовали комплект реагентов РИБО-преп, для обратной транскрипции — REVERTA-L, для генотипирования вируса — АмплиСенс HCV-Генотип-FL, для определения однонуклеотидного полиморфизма в гене IL-28B — АмплиСенс Геноскрин-IL28B-FL. Для выявления мутаций устойчивости HCV к ингибиторам NS¾A-протеазы методом прямого секвенирования использована экспериментальная серия набора реагентов АмплиСенс HCV-NS3-Resist-seq. Анализировали фрагмент генома вируса, кодирующий NS3-протеазу, размером 650 п.н., включающий следующие позиции, ассоциированные с возникновением устойчивости вируса к данному классу препаратов: V36AM, F43S, T54AS, V55AK, Q80KR, S122AR, R155KTQ, A156STVD, D168AETV, IV170FAT, M175L. Реакцию циклического секвенирования, очистку продуктов реакции секвенирования, денатурацию и автоматическую детекцию нуклеотидной последовательности осуществляли с использованием реактивов и оборудования «Applied Boisystems» (США).
Результаты и обсуждение
У 5 из 8 обследованных обнаружены мутации в регионе NS¾A-протеазы вируса: у 2 человек не влияющие на эффективность действия препарата, у 3 существенно снижающие чувствительность к И.П. Сведения о предыдущем курсе лечения и основные результаты обследования пациентов приведены в табл. 2. Мутации в геноме HCV, ассоциированные с резистентностью к действию ИП, выделены жирным шрифтом.
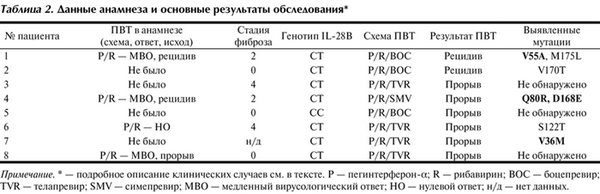
Таблица 2. Данные анамнеза и основные результаты обследования* Примечание. * — подробное описание клинических случаев см. в тексте. P — пегинтерферон-α; R — рибавирин; BОС — боцепревир; TVR — телапревир; SMV — симепревир; МВО — медленный вирусологический ответ; НО — нулевой ответ; н/д — нет данных.
Почти всех участников нашего исследования на основании генотипа IL-28B, стадии фиброза, а также (главным образом) по ответу на курс ПВТ можно отнести к лицам с умеренной чувствительностью к ИФН. Исключение составил пациент № 5, исходно представлявшийся как идеальный кандидат для лечения. Молодой возраст, генотип СС IL-28B, отсутствие фиброза, отрицательный результат теста на РНК HCV после 4-недельной вводной фазы перед добавлением боцепревира внушали оптимизм относительно успешности результата лечения. Однако за 1 мес до окончания ПВТ у данного пациента произошел вирусологический прорыв. Благоприятное сочетание исходных характеристик, хорошая чувствительность к ИФН (подтвержденная достижением быстрого вирусологического ответа после вводной фазы) и отсутствие мутаций устойчивости в регионе NS¾A-протеазы HCV не позволяют объяснить неудачу лечения в данном случае ничем иным, кроме несоблюдения больным графика приема лекарственных препаратов (хотя сам больной это отрицает).
Анализируя результаты курса терапии у остальных 7 пациентов, следует отметить, что наряду с умеренной чувствительностью к действию ИФН решающими факторами неэффективного лечения у них стали наличие резистентности вируса к ИП и/или недостаточная продолжительность периода, в течение которого применялись 3 препарата.
Участники № 1, 4 и 7 нашего исследования, у которых обнаружены мутации в геноме HCV (см. табл. 2), существенно снижающие чувствительность к действию ИП (см. рис. 2), очевидно, имели очень скромные шансы на достижение УВО. Наличие у вируса резистентности к ИП по сути превращало их трехкомпонентную терапию в лечение лишь ПЭГ-ИФН с РБВ, безуспешный опыт которого у пациентов № 1 и 4 уже имелся. Несомненно, выявление резистентности вируса в начале периода применения трех препаратов обеспечило бы более точное раннее прогнозирование эффективности лечения и способствовало бы принятию адекватного решения о досрочном прекращении бесперспективного курса ПВТ у этих больных.
Вместе с тем участникам № 2, 3, 6 и 8 (см. табл. 2) отсутствие мутаций в регионе NS¾A-протеазы HCV, ассоциированных с клинически значимой резистентностью, давало шанс на успешное лечение, но только при достаточной продолжительности приема ИП.
У пациентки № 2 после вводной фазы, предусмотренной схемой терапии, в крови продолжала выявляться РНК HCV, что указывало на сниженную чувствительность больной к действию ИФН. При этом уже после 4 нед терапии с боцепревиром был достигнут ответ на лечение (в крови отсутствовала РНК HCV), который сохранялся до конца лечения. Однако спустя 3 мес после окончания курса ПВТ отмечен рецидив репликации вируса. Вероятно, продление периода терапии тремя препаратами, которая у данной пациентки была эффективной, могло бы существенно повысить ее шансы на выздоровление.
В исследовании SPRINT-2 показано, что у не леченных ранее пациентов ответ на 4-недельную терапию ПЭГ-ИФН/РБВ (по сути отражающий чувствительность к действию ИФН) является мощным прогностическим фактором достижения УВО. Больные ХГС, отвечающие снижением после вводной фазы уровня РНК HCV ≥1 log 10 от исходного, имеют значительно более высокие шансы на выздоровление при ПВТ с боцепревиром по сравнению с лицами, отвечающими снижением ВН р<0,001) [9].
У участников № 3, 6 и 8, получавших терапию с телапревиром, РНК HCV не обнаруживалась с 4-й недели лечения и в последующем в течение всех 12 нед периода применения 3 препаратов, после завершения которого (на фоне лечения ПЭГ-ИФН/РБВ) у всех 3 пациентов отмечен вирусологический прорыв.
Очевидно, что и у этих пациентов отсутствие клинически значимой резистентности давало шанс на успешный исход лечения, однако 12-недельная продолжительность терапии с телапревиром оказалась для них недостаточной.
Заключение
С началом применения ПППД для лечения больных ХГС возникла новая для этого заболевания проблема — резистентность вируса. Этот феномен обусловлен наличием у вируса мутаций, изменяющих его свойства и снижающих эффективность ингибирующего влияния ПППД. Мутации устойчивости описаны для всех трех классов ПППД: ингибиторов NS¾A-протеазы, ингибиторов NS5В-полимеразы и ингибиторов NS5A-комплекса HCV. Для нашей страны (с учетом текущих стандартов ПВТ) пока наибольший интерес представляет резистентность вируса к ингибиторам NS¾A-протеазы первой и второй волны (телапревиру, боцепревиру и симепревиру).
Нет сомнений, что с внедрением в клиническую практику безинтерфероновых схем ПВТ значение проблемы резистентности HCV значительно возрастет. Больные ХГС, которые не достигли УВО после курса ПВТ, включавшего ПППД, вероятно, станут наиболее сложной категорией пациентов. «Перелечивание» таких больных превратится в весьма непростую задачу для врача.
В связи с этим необходимо использовать все возможности для достижения максимального результата, в том числе при проведении трехкомпонентной терапии с ИП.
Наше исследование показало, что у больных ХГС, имеющих умеренную чувствительность к действию ИФН и получающих терапию с ИП, наличие резистентности к ИП может в некоторых случаях иметь решающее значение для эффективности лечения.
В отсутствие быстрого ответа на фоне терапии ПЭГ-ИФН/РБВ в комбинации с ИП определение мутаций устойчивости HCV может способствовать раннему прогнозированию эффективности лечения. При выявлении клинически значимой резистентности целесообразно досрочное прекращение ПВТ.
Пациентам с умеренной чувствительностью к ИФН, не имеющим клинически значимой резистентности к ИП, продление периода, на протяжении которого применяются три препарата, может повысить вероятность достижения УВО.
Безусловно, наши выводы носят предварительный характер и для их подтверждения нужны более масштабные исследования.
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Чувствительность к андрогенам: за пределами общеизвестного
Журнал: Проблемы эндокринологии. 2018;64(5): 315‑320
Гонадные и внегонадные эффекты тестостерона у мужчин активно исследуются в последние годы. На сегодняшний день не вызывает сомнения увеличение рисков ожирения, сахарного диабета 2-го типа, артериальной гипертензии и атеросклероза у мужчин с дефицитом тестостерона. Одним из механизмов, посредством которых реализуется действие тестостерона, является чувствительность к андрогенам, определяемая длиной CAG-повторов в гене андрогенного рецептора. Увеличение количества CAG-повторов снижает их активность и проявляется низкой чувствительностью к тестостерону. Напротив, уменьшение числа тринуклеотидных повторов сопровождается повышением чувствительности рецепторов к андрогенам. В этом обзоре рассмотрены данные о влиянии полиморфизма гена андрогенного рецептора на эмбриогенез и дифференцировку пола, регуляцию сперматогенеза, прогрессирование рака и доброкачественной гиперплазии предстательной железы, симптоматику гипогонадизма, контроль углеводного и липидного обменов, минеральную плотность костной ткани, эндотелий сосудов, ответ на заместительную терапию тестостероном, а также на психосоциальные аспекты личности мужчин. Внедрение исследования полиморфизма гена рецептора андрогенов в клиническую практику позволит не только прогнозировать фертильность мужчины или риск развития рака простаты, но и подбирать индивидуальную терапию дефицита тестостерона.
Действие андрогенов затрагивает практически все органы и системы. Формирование половых признаков в процессе эмбриогенеза, становление и функционирование репродуктивной системы и обеспечение фертильности — это лишь малая часть эффектов тестостерона (Т) и его метаболитов. Гораздо шире внегонадное действие андрогенов, представленное их влиянием на сердечно-сосудистую систему, липидный и углеводный обмены, минерализацию костной ткани, стимуляцию кроветворения, формирование и функционирование когнитивных функций, психосоциальную адаптацию и сексуальность. Одним из наиболее важных вопросов клинической практики является различная выраженность симптомов гипогонадизма, а также разный ответ на заместительную терапию у пациентов с одинаковым уровнем сывороточного Т. Ответ на этот вопрос кроется в определении чувствительности к андрогенам и является на сегодняшний день крайне малоизученным. Данный обзор содержит анализ наиболее актуальных исследований, опубликованных в рецензируемых журналах баз данных PubMed и eLibrary.
Структура и функции андрогенного рецептора
Многогранное действие Т реализуется через андрогенные рецепторы (AR), расположенные внутриклеточно и структурно относящиеся к рецепторам стероидных гормонов. AR присутствуют в клетках семенников, простаты, кожи, нервной системы и других тканей. Генетический контроль за активностью этих рецепторов осуществляется геном AR, который и обусловливает чувствительность к андрогенам и реализацию действия Т. Широта и разносторонность эффектов, реализуемых через ген AR, впечатляют — от дифференцировки пола в эмбриогенезе, регуляции сперматогенеза, прогрессирования рака и доброкачественной гиперплазии предстательной железы (ДГПЖ), симптоматики гипогонадизма до влияния на углеводный и липидный обмены, минеральную плотность костной ткани, эндотелий сосудов и даже психосоциальные аспекты личности.
Ген AR локализован на длинном плече Х-хромосомы и состоит из 8 экзонов, кодирующих 3 структурно-функциональных белковых домена. N-концевой домен участвует в гомодимеризации рецептора и связывании с ко-активаторами или ко-репрессорами и представлен экзоном 1. Второй — ДНК-связывающий домен содержит петлевой участок из двух «цинковых пальцев» (экзоны 2 и 3). С-концевой домен обеспечивает связывание со стероидными гормонами и представлен экзонами 4—8 [1].
В последние годы внимание исследователей особенно сосредоточено на изучении первого экзона гена AR, для которого характерны повторы последовательности из трех нуклеотидов — цитозина, аденина и гуанина — CAG. Триплет CAG кодирует аминокислоту глутамин, поэтому от числа тринуклеотидных повторов зависит количество глутамина в белке. Так, меньшему числу CAG-повторов соответствует меньшая степень конформационных изменений рецептора, что делает связь гормона и рецептора прочнее и приводит к повышению транскрипционной активности AR. Напротив, с увеличением числа CAG-повторов связь между андрогенами и рецептором становится слабее и транскрипционная активность AR снижается. Таким образом, чем больше длина CAG-повторов, тем слабее оказывается эффект андрогенов при одинаковым уровне Т [2]. Слабая активность андрогенов, вызванная удлинением триплета, находит отражение в механизме обратной связи в пределах гипоталамо-гипофизарно-гонадной оси. У здоровых мужчин удлинение CAG-повторов сопровождается усилением секреции лютеинизирующего гормона (ЛГ) [3], что при интактных клетках Лейдига вызывает повышенную продукцию Т и, следовательно, компенсирует ослабление действия андрогенов. Результатом гипертестостеронемии будет повышенная ароматизация Т в эстрадиол, концентрация которого возрастет. По-видимому, именно с этим связана гинекомастия у пациентов с увеличенным числом CAG-повторов [4]. Высокие концентрации эстрадиола у мужчин с удлинением CAG-повторов и сохраненной обратной связью в оси гипоталамус-гипофиз-гонады может усиливать эффекты этих гормонов в эстроген-зависимых тканях, например в костной [3]. Рядом исследователей обнаружена отрицательная корреляция между длиной CAG-повторов и минеральной плотностью костной ткани [5—7]. Эта связь прослеживалась и у молодых субъектов, но с увеличением возраста мужчин негативное влияние полиморфизма гена AR на минеральную плотность костной ткани усиливалось.
Для мужчин европейской популяции нормальным считается количество CAG-повторов от 9 до 37. Однако в этом нормативе существуют популяционные различия. Так, среднее число CAG-повторов в гене AR у мужчин-европейцев составляет 21, у африканцев — 17, у азиатов — 23. При этом, например 25 CAG-повторов хотя и укладывается в нормативные значения, зачастую бывает связано с ослаблением действия андрогенов, проявляющимся соответствующей клинической симптоматикой [8].
Эмбриогенез и дифференцировка пола
Предстательная железа
Одним из наиболее андроген-чувствительных органов является простата, имеющая большое число рецепторов к андрогенам. Предполагается, что полиморфизм гена AR с его способностью моделировать эффекты андрогенов влияет на долю злокачественных клеток в предстательной железе (ПЖ) [9]. Согласно метаанализу множества исследований [10], отношение шансов возникновения рака ПЖ при снижении частоты тринуклеотидных повторов составляет 1,19.
Возможная связь между ДГПЖ и CAG-полиморфизмом гена AR имеет также другой аспект: ДГПЖ представляет собой разрастание ткани переходной зоны и периуретральной области ПЖ (эпителиальная и фибромышечная гиперплазия). В 2 крупных исследованиях сравнивали сопоставимые когорты здоровых добровольцев и пациентов с ДГПЖ. Отношение шансов увеличения размеров простаты до необходимого хирургического вмешательства в группе с частотой CAG-повторов 24 составляло 1,92. Более того, при снижении длины CAG-повторов увеличивалась частота средних и тяжелых обструктивных симптомов нижних мочевых путей. Также была найдена обратная корреляция между частотой аденом и размером простаты, с одной стороны, и длиной CAG-повторов — с другой [11, 12]. Помимо этого, была выявлена связь полиморфизма гена AR с сексуальной активностью мужчин с ДГПЖ [13].
Фертильность
Установлена связь числа CAG-повторов в гене AR с олигозооспермией [14, 15]. Хорошо известно, что для осуществления сперматогенеза необходима стимуляция клеток Сертоли фолликулостимулирующим гормоном (ФСГ). Так, интратестикулярная активность андрогенов опосредуется важным кофактором, положительно влияющим на функцию клеток Сертоли. Установлена отрицательная связь числа CAG-повторов с эффективностью сперматогенеза [16]. Наиболее тяжелые формы нарушений сперматогенеза наблюдаются у пациентов со спинобульбарной атрофией Кеннеди — редким наследственным заболеванием, характеризующимся яркой неврологической симптоматикой в сочетании с гипогонадизмом и бесплодием. При этом число тринуклеотидных повторов в гене AR достигает 36 и более [17].
Клинические проявления гипогонадизма и психосоциальные аспекты личности
Анализируя клинические проявления андрогенного дефицита, следует подчеркнуть их тесную связь с полиморфизмом гена AR. Так, среди пациентов с нормальными концентрациями Т у мужчин с большим числом CAG-повторов увеличен риск развития симптомов андрогенного дефицита [18, 19]. Регрессионный анализ данных международного опросника Aging Males’ Symptoms выявил нарастание симптомов дефицита Т по двум шкалам (психологической и соматической) по мере увеличения длины CAG-повторов в гене AR, тогда как симптомы сексуальной шкалы были связаны непосредственно с уровнем эндогенного Т [18]. Азиатское исследование с участием 702 мужчин, не выявив связи между уровнем Т и распределением в популяции полиморфизма гена AR, показало, что при уровне Т выше 340 нг/дл пациенты с числом CAG-повторов более 25 имели достоверно более высокий риск развития симптомов андропаузы, чем лица со значением тринуклеотидных повторов менее 22 [19]. Иными словами, мужчины с нормотестостеронемией, имеющие большую длину CAG-повторов в гене AR, подвержены более высокому риску возникновения симптомов андрогенного дефицита.
Кроме того, установлена связь между длиной CAG-повторов в гене AR с неспецифическими проявлениями андрогенного дефицита, такими как тревожность и депрессия [20, 21]. Регрессионный анализ выявил положительную связь числа CAG-повторов с выраженностью депрессии у мужчин старше 50 лет. Это демонстрирует нарастание симптомов депрессии синхронно с увеличением длины тринуклеотидных повторов по мере ослабления чувствительности рецепторов к андрогенам независимо от уровня эндогенного Т [21]. Показано также, что генетически детерминированное удлинение CAG-повторов в гене AR является независимым фактором риска высокой тревожности, панических атак и фобических расстройств [20].
Удивительными кажутся данные о связи полиморфизма гена AR с интеллектуальной одаренностью мальчиков [22]. Так, установлено, что высокий уровень интеллекта (IQ более 130) у мальчиков ассоциирован с малой длиной CAG-повторов в гене AR, даже при допубертатно низких уровнях Т. Другими словами, высокая чувствительность к андрогенам является фактором, предрасполагающим к интеллектуальной одаренности вне зависимости от уровня самого Т.
Представляют интерес данные о полиморфизме гена AR у мужчин с синдромом Клайнфельтера, имеющих дополнительную Х-хромосому, на которой и расположен обсуждаемый ген [23]. Длина тринуклеотидных повторов имела положительную связь с ростом, но в то же время была отрицательно связана с минеральной плотностью костной ткани и отношением размаха рук к росту, что отражает негативное влияние андрогенов на эпифизарные зоны роста кости. Кроме того, удлинение CAG-повторов способствовало развитию гинекомастии и уменьшению размеров тестикул, тогда как укорочение длины триплета ассоциировалось со стабильными партнерскими отношениями и профессиями, требующими более высокого уровня образования.
Поразительно, что чувствительность к андрогенам может обусловливать и такое явление, как транссексуализм. Установлено, что удлинение цепи CAG-повторов в гене AR является одной из трех изученных генетических причин мужского транссексуализма [24].
Метаболический статус
Выявлена положительная независимая корреляция числа CAG-повторов в гене AR с содержанием жировой ткани тела, уровнем лептина и инсулина. Малое число CAG-повторов было независимо ассоциировано с протективными параметрами (низкая жировая масса, низкий уровень инсулина плазмы), но одновременно и с нежелательными факторами (низкий уровень липопротеинов высокой плотности) [25]. Сходные данные в отношении дислипидемии были получены и в исследовании больных сахарным диабетом 2-го типа [26].
Еще одним интереснейшим аспектом влияния полиморфизма гена AR является эффективность заместительной терапии тестостероном (ЗТТ) у пациентов с различными формами гипогонадизма. Крупное исследование TIMES 2 показало, что высокая чувствительность к андрогенам, моделируемая малым числом CAG-повторов в гене AR, независимо положительно связана с более значимой динамикой уровня инсулина натощак, триглицеридов, диастолического артериального давления и индекса инсулинорезистентности НОМА на фоне ЗТТ. Однако связи полиморфизма гена AR с уровнем гликированного гемоглобина, другими показателями липидограммы, ожирением или распределением жировой ткани не выявлено [10]. Негативное влияние удлинения CAG-повторов было обнаружено и в другом исследовании [27], показавшем более высокие цифры артериального давления и худшие значения липидограммы на фоне ЗТТ в сочетании с более низкими значениями гематокрита, находящегося под контролем андрогенов. Еще одним параметром, реагирующим на ЗТТ, является размер ПЖ [28]. Выявлена негативная связь между длиной тринуклеотидных повторов и изменением объема ПЖ на фоне терапии Т [10]. Причем 20 триплетов гена AR и менее повышают риск увеличения размеров ПЖ и темпы роста уровня простат-специфического антигена (ПСА) [27].
Терапия Т у пациентов с синдромом Клайнфельтера при коротких триплетных повторах вызывает более глубокое подавление уровня ЛГ, выраженный рост концентрации ПСА и повышает уровень гемоглобина [23].
Эндотелий
Одной из важнейших точек приложения внегонадного действия Т является эндотелий, причем данное взаимодействие моделируется полиморфизмом гена AR. Этот вопрос наименее изучен. Ранее у здоровых добровольцев была обнаружена связь низкого числа CAG-повторов в гене AR с нарушениями артериальной вазореактивности вне зависимости от уровня общего и свободного T [29]. Некоторыми исследованиями [30, 31] доказано ухудшение функции эндотелия у больных сахарным диабетом 2-го типа. В то же время существуют данные о негативном влиянии дефицита Т на сердечно-сосудистую систему у мужчин [32, 33]. При исследовании влияния полиморфизма гена AR на формирование нарушений функции эндотелия у мужчин с сахарным диабетом 2-го типа [34] было установлено, что большее количество CAG-повторов в гене рецептора AR через ослабление чувствительности к андрогенам обусловливает снижение выраженности эндотелий-зависимой вазодилатации в ходе пробы с реактивной гиперемией одновременно с усилением продукции таких маркеров дисфункции эндотелия, как P-селектин и резистин. Таким образом, увеличение числа CAG-повторов в гене AR ухудшает как сосудодвигательную, так и секреторную функцию эндотелия и может рассматриваться как предиктор развития и прогрессирования сердечно-сосудистых поражений у мужчин с сахарным диабетом.
Нарастающий интерес исследователей к изучению биохимических и молекулярных механизмов действия Т диктует необходимость расшифровки генетических аспектов функционирования AR. Изучение чувствительности к андрогенам, определяемой длиной тринуклеотидного повтора CAG в гене AR, не только объясняет феномен различного ответа на ЗТТ у пациентов с одинаковым уровнем эндогенного Т, но и необходимо для понимания половой дифференцировки, психологического статуса, сексуальности и репродуктивного потенциала, а также рисков развития рака ПЖ и ДГПЖ, остеопороза, нарушений углеводного, липидного обменов и даже сердечно-сосудистых заболеваний у мужчин. Наиболее важной в клинической практике является возможность прогнозирования ответа пациента на ЗТТ. У лиц с малым числом CAG-повторов в гене AR из-за высокой чувствительности к андрогенам могут быть использованы более низкие дозы препаратов Т, тогда как неэффективность стартовой дозы ТЗТ у мужчин с большим числом тринуклеотидных повторов, свидетельствует о необходимости повышения дозы вводимого Т. На сегодняшний день определение CAG-полиморфизма гена AR не рекомендовано для рутинной практики, однако в ближайшем будущем оно может быть использовано, в частности для подбора индивидуальной терапии андрогенного дефицита.
Дополнительная информация
Источник финансирования. Работа выполнена при поддержке Российского научного фонда (грант РНФ № 14−25−00052).
Конфликт интересов. Авторы статьи заявляют об отсутствии финансовой заинтересованности и других потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов:
Сбор и анализ материала, написание текста — Хрипун И.А.; написание и редактирование текста — Воробьев С.В. Оба автора внесли существенный вклад в проведение поисково-аналитической работы и подготовки статьи, прочли и одобрили финальную версию текста перед публикацией.
Как проявляются прионные болезни

В последние годы многие интернет-ресурсы заполонили статьи о вреде и пользе прионов. Эти противоречивые молекулы представляют собой особый класс вид инфекционных агентов (белки с измененной структурой, которые не содержат нуклеиновых кислот). Их свойством является способность увеличивать численность при помощи живых клеток подобно вирусам. Прионы способны также вызывать болезни, поражающие преимущественно нервную систему.
Что такое прионные болезни?
Прионные болезни (прионопатии) — это группа заболеваний с нейродегенеративным механизмом, которые невозможно вылечить. Под действием неизвестных факторов (как врожденных, так и приобретенных) нормальный клеточный прионный белок изменяет форму и превращается в патологический. Считается, что такие заболевания могут возникать в результате генетических мутаций: реже заражение происходит при контакте с биологическим материалом больного человека.
Новообразованные прионы накапливаются в организме, провоцируя появление основных симптомов. На это могут понадобиться многие годы, поэтому средний возраст заболевших всегда не младше 30 лет. Обратное возвращение белка в нормальную форму невозможно: поэтому все недуги, вызываемые прионами, являются смертельными. При исследовании мозгового вещества пациента с подобным заболеванием обнаруживаются морфологические изменения: мозг имеет губчатую структуру с множеством микроскопических точечных отверстий.
Куру: механизм заражения и симптомы
Куру — одна из самых редких прионопатий. До середины прошлого столетия куру часто встречалась среди коренного населения Папуа-Новой Гвинеи. У членов племени была традиция поедания частей тела умершего человека: считалось, что таким образом родственникам усопшего передается его сила. Чаще всего заболеванию были подвержены женщины и дети, так как именно им доставался наиболее зараженный прионами орган — мозг.
Куру опасна тем, что первые признаки недуга могут проявиться даже через 20-50 лет после употребления зараженного биологического материала. Основные симптомы недуга:
- спонтанные неконтролируемые движения тела и конечностей в виде подергивания;
- непроизвольный смех и сардоническая улыбка;
- резкие смены настроения;
- быстро прогрессирующее слабоумие и нарушение ориентации в пространстве.
Средняя продолжительность жизни больных с куру не превышает одного года. Это связано с прогрессирующим поражением нервной системы.
Заболевание Крейтцфельда-Якоба

Эта патология в 90% случаев обусловлена употреблением в пищу зараженной говядины, реже причиной развития болезни Крейтцефельда-Якоба является наследование мутантного гена (от 5 д 15 %). Недуг чаще встречается у мужчин старше 45-60 лет. Заболевание развивается постепенно: сначала пациент обращает внимание на ухудшение памяти, снижение способности к концентрации. Постепенно присоединяются спутанность сознания и спонтанные движения различных мышечных групп, нарушается походка. Диагностика недуга осуществляется с помощью КТ, МРТ, электроэнцефалографии. В среднем от момента возникновения первых проявлений до момента гибели проходит от 5 месяцев до 2,5 лет.
Смертельная бессонница: почему страдает мозг?
Другой, не менее редкой формой прионопатий является смертельная бессонница. Каждый человек хотя бы раз в своей жизни сталкивался с обычным нарушением сна, которое возникает при сбое привычного режима. Однако смертельная бессонница — это совершенное другое состояние, которое приводит к медленному разрушению не только нервной системы, но и психики человека. Основные проявления болезни:
- нарушения сна;
- панические атаки и склонность к истерии;
- галлюцинации и бред;
- невозможность самообслуживания;
- неадекватное, агрессивное поведение;
- увеличение артериального давления.
Смерть наступает через 9-70 месяцев после того, как обнаруживаются первые симптомы.
Прионопатия с изменением чувствительности к воздействию протеаз
Эта прионопатия является одним из недавно обнаруженных заболеваний, связанных с образованием в организме аномального белка. Согласно данным статистики, она поражает около 2-4 людей на 100 миллионов человек. Средний возраст заболевших — 70 лет. В основе этой прионопатии лежит изменение чувствительности прионов к действию ферментов организма — протеаз. Это приводит к усиленному расщеплению аномальных белков и прогрессированию болезни. Такая прионопатия начинается с изменений в психике больного: он становится агрессивными, вспышки злости и гнева чередуются с приступами эйфории, нарушается речь, страдает координация. Пациенты постепенно теряют способность к коммуникации и самообслуживанию. Продолжительность жизни людей с подобным недугом составляет не более 24 месяцев.
Заболевание Герстманна—Штреусслера—Шейнкера

Прионопатия Герстманна—Штреусслера—Шейнкера передается по наследству. Особенностью этой болезни является более раннее начало (в возрасте до 40 лет), а также относительно медленное течение. Пациенты предъявляют жалобы на неуклюжесть, нарушения походки, снижение слуха. Также в первую очередь страдает речь: больной не может внятно сформулировать предложения, постоянно теряет мысль в своих рассуждениях. Постепенно поражается мышечная система, может развиваться полная неподвижность верхних конечностей. Смерть обычно наступает в течение 5 лет после постановки диагноза от нарушения работы дыхательных мышц или сопутствующих осложнений (пневмония, гангрена).
Существует ли профилактика прионных заболеваний?
Защитить мозг человека от наследственных прионопатий не представляется возможным. Однако в случае с приобретенной формой заболевания рекомендуется соблюдать определенные правила безопасности (в особенности людям, которые так или иначе контактируют с биологическим материалом), позволяющие уменьшить риск возникновения недуга. Профилактика прионопатий включает в себя:
Личная психология: как жить с порогом высокой чувствительности?

Человек — интереснейшее создание с точки зрения психологического, биологического и энергетического подходов. Ощущения, реакции поведения, чувства — это то, что составляет внутренний мир любой личности. Подчас в нем скрыто множество загадок и факторов, которые делают человека тем, кем он является, а природу каждого неповторимой и индивидуальной. Психология личности занимается рассмотрением и изучением процессов, протекающих в сознании и бессознательном.
Ни для кого не секрет, что на одни и те же события люди склонны реагировать по-разному. То, что для одного человека не имеет значения и остается им едва замеченным, для другого может принимать масштабы вселенской катастрофы. Личная психология объясняет это наличием разного уровня чувствительности. Что такое порог чувств? Где находится грань между тем, что воспринимается без ущерба для настроения и тем, что практически невозможно пережить и вызывает сильный стресс? Ответы на эти и другие вопросы можно найти в данной статье. Также здесь будут рассмотрены методы, помогающие выработать привычки, которые позволят не принимать события близко к сердцу, а значит, сделать жизнь приятней и радостней.
Чувствительность в личной психологии

Чувствительность в характере человека — это ощущение ранимости, неуверенности и сензитивности. Сензитивность — это обострение чувств. Такие проявления личности характеризуются в психологии как повышенная впечатлительность, состояние застенчивости и внутренней скованности.
Высокий порог чувствительности зависит от множества факторов. Во-первых, это наследственная предрасположенность. Дети часто повторяют некоторые черты своих родителей. Это может происходить как на генетическом уровне, так и на поведенческом — когда в детском возрасте малыши бессознательно усваивают реакцию и поведение матери или отца на происходящие жизненные события.
Исследуя порог собственной чувствительности, важно обратиться к предкам — поведение кого из родственников повторяет человек, который является излишне ранимым. Также объяснить, почему люди слишком серьезно относятся к вещам, можно, изучив особенности реакции психики — как правило, человек реагирует определенным образом на одни и те же раздражители. Какое место в жизни занимают события, вызывающие чувство грусти, боли, душевные переживания? Как часто они повторяются? Имели ли похожие события и чувства место в детском возрасте?
Ответив на эти вопросы можно установить закономерность, вследствие которой человек очень остро реагирует на происходящее вокруг.
Психика и сензитивность
Эмоции человека тесно связаны с сензитивностью или чувствительностью. Как правило, повышенная эмоциональность — это результат особенности личности принимать события слишком близко к сердцу. Эмоциональные проявления могут быть кратковременными или долговременными в зависимости от тяжести раздражителя. Крайним проявлением повышенной сензитивности могут выступать нарушения психического состояния. Обычно они проявляются в излишних подозрениях человека по отношению к окружающим людям, напоминая пароноидальные явления. В таком случае следует получить консультацию специалиста. Психолог или психотерапевт помогут найти причины, и предложит эффективные методы работы с целью коррекции поведения.
Психика человека — очень тонкий механизм. Проявления, которые сначала можно принять за особенности характера, могут оказаться заболеваниями. Иногда повышенная чувствительность может быть связана с такими нарушениями психической сферы как посттравматическое расстройство, невроз, патологии личности, тревожность, эндогенная депрессия и другие.
Чувства и отношения

Влияние данной характеристики на отношения с окружающими людьми может доставлять много неудобств. Люди с высоким порогом сензитивности часто проявляют реакции раздражительности, обидчивости, обвинения. Иногда им свойственна позиция жертвы — в таком случае им может казаться, что весь мир настроен враждебно, окружающие не хотят выполнять свои обязанности и нести ответственность.
Для того чтобы отношения с людьми приносили радость, а эмоции были под контролем, нужно работать над изменением способа взаимодействия с миром. Лучше всего этому могут помочь индивидуальная работа с психологом или групповой тренинг личностного роста. Однако существуют способы коррекции сознания и мышления, которые следует взять на вооружение самостоятельно.
Психика — пластичная система. Она поддается коррекции, когда человек задается целью изменить свою жизнь в лучшую сторону.
Привычки и здоровый оптимизм
Психология успешного и эффективного взаимодействия как категория личностного роста, говорит о том, что у человека всегда есть выбор. Однако не все следуют этому замечательному принципу. Под гнетом проблем часто кажется, что обстоятельства сильнее, нежели личная инициатива. Однако это не так.
Чтобы обладать качествами оптимиста и идти по жизни с улыбкой, важно осознать, что в мире представлено большое количество возможностей для выбора. Если человек может выбирать такую реакцию поведения, как обида, грусть, разочарование, то точно так же он может выбрать и реализовать прямо противоположный способ поведения — позитив, уверенность, предприимчивость. Все дело в привычной и безопасной реакции поведения.
Определитесь, что выбираете вы, когда в очередной раз страдаете от несовершенства событий или отношений. После этого, задайте себе вопрос: как важно мне поддерживать мнение о том, что мир и люди несправедливы ко мне? Какую важную внутреннюю установку, сформировавшуюся, возможно, в детстве, вы поддерживаете таким образом? Это может быть любая негативная установка, например: я недостаточно хорош, другие люди недостаточно хороши, никому нельзя доверять, все хотят мне навредить, меня никто не любит и так далее.
Как научиться контролировать эмоции

Повышенная чувствительность предполагает проявление бурных эмоций. Управлять своими внутренними реакциями помогут процессы, контролирующие сознание. Это йога, медитация, спорт или личная терапия. Для того чтобы привести в норму внутренний эмоциональный баланс, нужно хорошо знать свою психологию и контролировать процессы, которые способствуют всплеску чувств. Скорая помощь для того, чтобы научиться сдерживать эмоциональные порывы:
Читайте также:
- Папиллярная карцинома щитовидной железы - патогенез, прогноз
- Моторная функция желудка. Двигательная функция желудка.
- Влияние эндокринных желез на трофику желудка
- Тактика ведения преждевременных родов. Консервативно-выжидательная тактика.
- Лучевая диагностика фораминальной экструзии межпозвонкового диска
