Признаки повторного инфаркта миокарда. Течение повторного инфаркта миокарда
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Рецидив инфаркта миокарда. Повторный инфаркт миокарда
Рецидивом инфаркта миокарда называют повтор острого инфаркта в течение всего острого периода предшествующего инфаркта, т. е. рецидив возникает в периоде от 3 дней до 2 месяцев от начала первого инфаркта. В большинстве случаев такой рецидив локализуется в области первого инфаркта или по его периферии, как бы увеличивая его размеры. Иногда он имеет локализацию и в отдалении от первого инфаркта. Повторным инфарктом миокарда называют острый инфаркт развившийся на фоне постинфарктного кардиосклероза, т.е. позже чем через 2 месяца от начала первого инфаркта.
Он может развиться как в той же стенке сердца, что и первый, так и в другой стенке, в том числе и в области, диаметрально противоположной расположению первого инфаркта по их отношению к «электрическому центру» сердца. В зависимости от взаиморасположения инфарктов и их размеров существенно зависит электрокардиографическая картина и трудности диагностики как в остром периоде повторного инфаркта, так и в периоде его рубцевания.
Рецидив инфаркта миокарда развивается в течение острого инфаркта, т.е. от 3 дней до 2 месяцев от начала первого инфаркта. В остром периоде рецидива или повторного инфаркта могут наблюдаться изменения всех зубцов и сегментов ЭКГ. Комплекс QRS деформируется вследствие изменения направления уже отклоненного ранее патологического вектора ЭДС в зависимости от взаиморасположения первичного и повторного инфарктов.
При повторном инфаркте, развившемся на противоположной первому инфаркту стороне левого желудочка, начальный вектор QRS отклоняется в сторону, противоположную исходному его направлению, определенному первым инфарктом. Вследствие этого зубец Q, отражающий первый инфаркт, уменьшается или исчезает в зависимости от величины повторного инфаркта. Эти же соотношения размеров противолежащих инфарктов обусловливают появление или отсутствие патологического зубца Q в отведениях, соответствующих локализации повторного инфаркта (или в отведениях противоположных ему увеличение реципрокного зубца R).
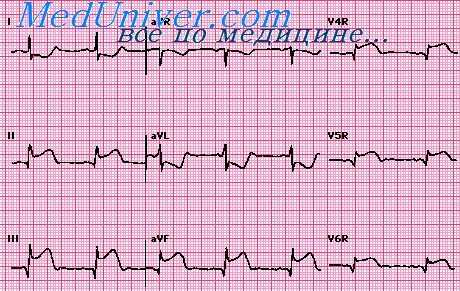
Если повторный инфаркт больше первого, то старый зубец Q исчезает, новый патологический Q появляется в отведениях, соответствующих повторному инфаркту, или увеличивается R в отведениях, противоположных повторному инфаркту. В этом случае диагностируется один инфаркт. А при равных размерах инфарктов в рубцовой стадии могут отсутствовать признаки обоих инфарктов. Однако даже в таких случаях в острейшем периоде повторного инфаркта зарегистрируется подъем сегмента RS - Т или его реципрокное смещение вниз в отведениях с противоположной стороны.
Повторный инфаркт миокарда нередко локализуется на той же стороне сердца, что и первичный, как бы увеличивая его. В таких случаях появляется патологический зубец Q или снижается зубец R в отведениях, расположенных рядом с отведениями, где ЭКГ была ранее изменена и смещается вверх сегмент RS - Т. Если рецидив не увеличивает размеры инфаркта, то останутся прежние изменения QRS (QS или Or) и выявится подъем RS - Т, затем инверсия Т. При одностороннем расположении обоих инфарктов на ЭКГ в рубцовой стадии наблюдается картина одного обширного инфаркта.
В случаях расположения инфаркта первичного и повторного в разных стенках (но не диаметрально противоположных друг другу) на ЭКГ могут быть изменения комплекса QRS, сегмента RS -Т и зубца Т, характерные для обоих инфарктов.
Конечная часть желудочкового комплекса, как правило, существенно изменяется в острой стадии повторного инфаркта. Однако эти изменения сегмента RS - Т и зубца Т могут быть непродолжительными, особенно смещения RS - Т. поэтому необходима ежедневная ЭКГ динамика.
При повторных инфарктах часто наблюдаются изменения зубца Р. указывающие на перегрузку левого предсердия.
Для диагностики на ЭКГ повторного инфаркта, определения его размеров и диагностики старого рубца огромное значение имеет сопоставление последних ЭКГ со старыми ЭКГ.
Повторный инфаркт миокарда неуточненной локализации (I22.9)
Повторные инфаркты вызывают трудности при ЭКГ. Все многообразие электрокардиографических сдвигов при повторных инфарктах можно представить в трех основных вариантах:
вновь возникшие изменения при повторных инфарктах миокарда полностью маскируют признаки, оставшиеся на ЭКГ после первичного инфаркта миокарда;
ЭКГ-признаки повторного инфаркта полностью маскируются изменениями, обусловленными Рубцовыми изменениями;
на ЭКГ сохраняются изменения после перенесенного инфаркта, на которые наслаиваются новые изменения.
Оценка ЭКГ при повторных инфарктах миокарда очень трудна. Характерные ЭКГ-проявления, обусловленные развитием повторного острого инфаркта, могут быть полностью нивелированы старыми рубцовыми изменениями или при появлении новых некротических участков могут исчезать признаки старых рубцов.
При большинстве повторных инфарктов не представляется возможным определить их локализацию, так же как не всегда удается определить зональность в очаге острого повреждения. Нет параллелизма между эволюцией ЭКГ-изменений и клиническим течением инфаркта.
В большинстве случаев развитие острого повторного инфаркта миокарда может быть с достоверностью выявлено только при сопоставлении со старыми ЭКГ, на которых сохраняются признаки предыдущих инфарктов.
Определенные изменения ЭКГ
I. Зубец Q в I отведении — не менее 20% величины зубца R в этом же отведении при отрицательном зубце Т и подобных изменениях в aVL.
II. Зубец Q во II, III, aVF отведениях и отрицательный зубец Т в этих же отведениях. Зубец Q не меньше 25% высоты зубца R в III отведении и не меньше 0,03 с в этих отведениях.
III. Зубец Q в грудных отведениях V 1 — V 3 с отрицательными или двухфазными зубцами T в V 2 и V 3 (комплекс QRS не больше 0,10 с).
IV. Зубец Q в отведениях V 4 и V 5 не меньше 0,4 мВ и в V 6 — 0,2 мВ с отрицательным зубцом Т в этих отведениях.
V. Смещение сегмента RS — Т выше изоэлектрической линии с последующим снижением его и образованием отрицательного зубца Т.
При анализе ЭКГ с повторными инфарктами можно выделить следующие варианты
I. При свежем заднем инфаркте на фоне обширных рубцовых изменений в передней стенке левого желудочка на ЭКГ доминируют признаки заднего инфаркта; признаки переднего инфаркта редуцируются, но полностью не исчезают.
II. При остром трансмуральном переднем инфаркте на фоне обширного рубца задней стенки левого желудочка исчезают его признаки и обнаруживаются признаки острого инфаркта передней стенки.
III. Повторный острый инфаркт на периферии старого рубца может проявиться наличием свежих изменений в отведениях, расположенных рядом с отведениями, регистрирующими старый рубец.
IV. Повторный острый инфаркт в области, диаметрально противоположной старому рубцу, может не проявиться сам и нивелировать признаки старого рубца. При более обширном остром инфаркте изменения ЭКГ свойственны острому инфаркту; если острый инфаркт имеет меньшие размеры, чем старые рубцы, то регистрируются только признаки старого.
V. Если повторный инфаркт имеет не прежнюю локализацию, но и не диаметрально противоположен старому рубцу, могут регистрироваться как признаки острого инфаркта, так и признаки старых рубцов.
VI. При отсутствии достоверных признаков повторного острого инфаркта единственным ЭКГ-подтверждением возможного повторного инфаркта могут быть косвенные признаки: возврат к картине более острой стадии — подъем сегмента ST с последующей эволюцией ST — T на фоне патологического зубца Q как признака ранее перенесенного инфаркта. При отсутствии закономерной эволюции ST — Т даже кратковременное повторное появление признаков острой стадии является косвенным подтверждением повторного инфаркта при соответствующей клинической картине.
Экспертами ВОЗ предложено различать определенные изменения ЭКГ, свидетельствующие о наличии инфаркта миокарда, и двусмысленные изменения ЭКГ, позволяющие подозревать его.
Повторный инфаркт миокарда
Повторный инфаркт миокарда – это некроз сердечной мышцы, возникающий после полного завершения предыдущего инфаркта миокарда. Провоцирующими факторами выступают несоблюдение пациентом схемы поддерживающей терапии, физические и умственные перегрузки, тяжелые формы дислипидемии и другие сопутствующие болезни. Патология проявляется некупируемыми сжимающими болями в области сердца, одышкой, предобморочным состоянием, неконтролируемым чувством страха. Для диагностики назначают ЭКГ, ЭхоКГ, коронарографию и комплекс лабораторных исследований. Основу лечения составляет экстренная реперфузия с помощью фибринолитиков, стентирования, баллонной ангиопластики.
МКБ-10


Общие сведения
Повторные коронарные атаки наблюдаются как минимум у 26,5% пациентов, перенесших инфаркт миокарда (ИМ). Около трети случаев происходит в течение первого года после первичного эпизода нарушения кровотока в сердечной мышце. При постановке диагноза стоит учитывать различия в терминологии: в российской кардиологии повторными называют инфаркты, развивающиеся спустя 8 и более недель от первого сердечного приступа, тогда как в зарубежной практике к этой категории относят второй, третий и все последующие случаи ИМ без привязки к временным интервалам.
Причины
Пациенты, которые сталкивались с критическими кардиоваскулярными событиями, имеют повышенный риск повторного развития инфаркта. Это связано с наличием рубца на миокарде и другими структурно-функциональными патологиями сердечной мышцы, которые нарушают гемодинамику, ухудшают адаптацию сердечно-сосудистой системы к изменяющимся параметрам кровотока. Предрасполагающими факторами формирования повторного инфаркта миокарда (ПИМ) выступают:
- Низкая приверженность терапии. По прошествии 6 месяцев после острого инфаркта только 82% больных продолжают принимать назначенную врачом антитромботическую терапию, к концу первого года лечения комплаенс больных понижается до 38%. Это способствует прогрессирующим нарушениям гемодинамики и повышенному риску тромбозов.
- Стрессовые факторы. В периоде реабилитации после ИМ больные проявляют повышенную чувствительность к эмоциональным и физическим нагрузкам, поэтому несоблюдение щадящего режима чревато острым коронарным синдромом (ОКС). Осложнение возникает вследствие неполного восстановления функции кардиоваскулярной системы.
- Рефрактерная дислипидемия. Нарушения липидного обмена, которые не удается корректировать комбинацией гиполипидемических препаратов, в разы повышают вероятность повторных инфарктов. Для заболевания характерна нестабильность атеросклеротических бляшек, вследствие чего они могут спонтанно отрываться и закупоривать коронарные сосуды.
- Немодифицируемые факторы. К ним относят отягощенную наследственность, мужской пол и пожилой возраст. Эти причины аналогичны таковым при первичном инфаркте, у больных с ишемическими атаками в анамнезе они также имеют большую значимость.
Факторы риска
В группе риска возникновения повторных инфарктов миокарда находятся пациенты с сопутствующими заболеваниями. Вероятность патологии резко повышается при аутоиммунных болезнях: узелковом периартериите, ревматоидном артрите, системной красной волчанке. Предрасполагающим фактором инфаркта являются заболевания крови (тромбоцитопеническая пурпура, истинная полицитемия, тромбоцитозы), метаболические нарушения (амилоидоз, мукополисахаридоз, гомоцистинурия). Острые коронарные атаки чаще возникают у пациентов с установленным искусственным клапаном сердца.
Патогенез
Гибель участка сердечной мышцы при повторном инфаркте происходит по тем же законам, что и первичный случай ОКС. У большинства больных пусковым фактором выступает закупорка сосуда атеросклеротической бляшкой в результате разрыва ее фиброзной капсулы, эрозии стенки, протрузии кальцинированных участков в артериальный просвет. Изредка ПИМ наблюдается при быстром накоплении атеросклеротических отложений в сосудах или кровоизлияниях в эту зону.
Вторым этапом патогенеза является ограничение кровотока в одной из зон сердечной мышцы, которое усугубляется остаточными нарушениями перфузии после предыдущего сердечного приступа. Обратимая ишемия продолжается в течение 2-4 часов, после чего наблюдается гибель миокарда. Далее происходит ферментативное расплавление мышечной ткани, развиваются процессы воспаления и инфильтрации миокарда лейкоцитами, после чего начинается организация рубца.

Классификация
Систематизация повторного инфаркта миокарда не отличается от общепринятой в практической кардиологии. По клиническому течению выделяют развивающийся ИМ — в первые 6 часов, острый – от 6 часов до 7 дней, рубцующийся— 7-28 дней, заживший — с 29 дня болезни. При постановке окончательного диагноза используются разные виды классификаций ПИМ:
- По степени тяжести. Согласно Killip, выделяют 4 класса ИМ – от отсутствия сердечной недостаточности (I) до кардиогенного шока (IV).
- По особенностям патогенеза. Различают повторный инфаркт миокарда с подъемом сегмента ST, который возникает при трансмуральном повреждении и полной окклюзии магистральной венечной артерии, и без подъема ST, развивающийся при ограничении кровотока на небольшом участке.
- По локализации. В зависимости от локализации повреждения сердечной мышцы левого желудочка выделяют переднебоковой, передневерхушечный, нижнебоковой, заднебазальный и другие варианты ПИМ. В особую категорию относят правожелудочковый инфаркт.
- По глубине повреждения. Наиболее опасным является трансмуральный ИМ, который захватывает все слои миокарда. Также выделяют интрамуральный, субэпикардиальный и субэндокардиальный варианты заболевания.
Симптомы повторного инфаркта миокарда
По клиническому течению ПИМ практически не отличается от впервые возникшего коронарного синдрома. Однако у пациентов с предшествующими ишемическими событиями в анамнезе чаще развиваются атипичные, в том числе безболевые формы инфаркта миокарда. У трети больных наблюдается продромальный период в виде сжимающих болей в груди, перебоев в работе сердца. Далее инфаркт проходит типичные периоды: острейший, острый, подострый и постинфарктный.
При классической форме ИМ основной жалобой пациентов являются резкие боли в левой половине грудной клетки. Они возникают внезапно, могут быть связаны с сильным стрессом или физической активностью. Болевой синдром длится дольше 20 минут, не поддается купированию нитроглицерином, как обычный приступ стенокардии. Боли отдают в руку, лопатку, нижнюю челюсть. Пациент ощущает сильное беспокойство и страх смерти, его кожа покрывается холодным потом и резко бледнеет.
Для астматического варианта характерна сильная одышка и приступ удушья, возникающий без видимой причины. Для облегчения состояния человек занимает положение сидя с упором руками на колени (ортопноэ). Боли в грудной клетке имеют невысокую интенсивность, многие пациенты их не замечают, поскольку внимание сфокусировано на расстройствах дыхания. Тяжелые формы ПИМ сопровождаются хрипами, выделением розовой пены изо рта.
Повторный инфаркт миокарда может протекать в абдоминальной форме, особенно если очаг некроза расположен в нижних отделах сердца. В этом случае интенсивные боли возникают в эпигастральной области. Они напоминают приступ острого панкреатита, гастрита, обострения язвенной болезни. Иррадиация болевого синдрома происходит в межлопаточную область. Больные страдают от тошноты, отрыжки, длительной икоты.
Реже наблюдается аритмическая форма, которая проявляется сильным сердцебиением, приступом головокружения, слабостью. Нарушения центрального кровотока вызывают кратковременные обмороки. Похоже симптомы имеет цереброваскулярный вариант повторного инфаркта, который проявляется симптомами ишемии головного мозга. Изредка наблюдается малосимптомный (стертый) вариант течения ПИМ.
Осложнения
К острым последствиям относят левожелудочковую недостаточность – отек легких и кардиогенный шок. До 90% пациентов имеют нарушения ритма и проводимости, которые иногда переходят в фибрилляцию желудочков и чреваты летальным исходом. Около 15% больных рискуют столкнуться с аневризмой левого желудочка, развивающейся при обширных трансмуральных инфарктах. К поздним осложнениям относят синдром Дресслера, тромбоэндокардит, постинфарктную стенокардию.
Диагностика
Пациенты с признаками сердечного приступа требуют экстренной помощи кардиолога или врача реанимационного отделения. При обследовании определяют неспецифические симптомы острой сердечной недостаточности, по возможности узнают медицинскую историю пациента и наличие у него инфаркта миокарда в прошлом. Обследование проводится в первые 2 часа от поступления больного в стационар, включает следующие методы диагностики:
- ЭКГ. Острая ишемия миокарда определяется при подъеме сегмента ST. К специфическим признакам ИМ относят глубокий зубец Q в стандартных или грудных отведениях, слишком широкий зубец R в сочетании с конкордантным позитивным зубцом Т. При подозрении на поражение задней стенке сердца показана регистрация кардиограммы в дополнительных отведениях V7-V9.
- УЗИ сердца. Эхокардиография назначается при критических проявлениях сердечной недостаточности, в том числе при кардиогенном шоке. Исследование информативно для выявления функциональных нарушений сердечной деятельности, которые возникают в первые минуты от развития инфаркта еще до грубых изменений на электрокардиограмме.
- Коронарография. Рентгенконтрастное исследование венечных сосудов, питающих миокард, признано «золотым стандартом» для подтверждения ПИМ. По результатам диагностики определяют наличие, степень и локализацию тромбоза сосудов, выбирают оптимальный метод консервативного или хирургического устранения препятствий кровотоку.
- Лабораторный комплекс. В кратчайшие сроки после поступления выполняют анализы на тропонин, КФК и прочие миокардиальные маркеры. Полная диагностическая программа включает клинический анализ крови, липидограмму, исследования на глюкозу и гликированный гемоглобин. Ценное прогностическое значение имеет оценка электролитного спектра крови, уровня Д-димера и натрийуретического пептида.
Дифференциальная диагностика
При остром болевом синдроме в груди слева исключают расслоение аорты, тромбоэмболию легочной артерии, перикардит. Сопутствующие нарушения дыхания требуют дифференциальной диагностики со спонтанным пневмотораксом. Атипичные формы повторного инфаркта дифференцируют с острым панкреатитом, пневмонией, межреберной невралгией. При отсутствии четких электрокардиографических и лабораторных критерий ИМ важно исключить нестабильную стенокардию.

Лечение повторного инфаркта миокарда
Экстренная медикаментозная терапия
Первичные терапевтические мероприятия включают введение опиоидных анальгетиков для ликвидации болевого синдрома и оксигенотерапию при снижении сатурации менее 90%. При повторном инфаркте миокарда сразу назначают нагрузочные дозы ацетилсалициловой кислоты в комбинации со вторым антиагрегантом по выбору врача. Терапия дополняется внутривенным введением антикоагулянтов, применением транквилизаторов при выраженной тревожности и беспокойстве больного.
При наличии противопоказаний или технической невозможности проведения хирургического вмешательства стратегией выбора признана фибринолитическая терапия. Она проводится в первые 12 часов от поступления больного и направлена на растворение тромба в венечном сосуде. Вовремя выполненный фибринолиз восстанавливает кровообращение и создает условия для нормализации функций участка миокарда, который находился в состоянии обратимой ишемии.
Хирургическое лечение
Чрескожное коронарное вмешательство (ЧВК) является стандартом реперфузионной терапии у пациентов с повторными инфарктами миокарда. ЧВК рекомендовано всем больным при подъеме ST на кардиограмме, пациентам без элевации ST, которые имеют признаки гемодинамической нестабильности, длительные боли в груди, жизнеугрожающую аритмию. Предпочтительным вариантом является установка стентов с лекарственными покрытиями, альтернативное лечение — баллонная ангиопластика.
Поддерживающая терапия
После стабилизации состояния и выписки пациента назначается продолжительная или даже пожизненная фармакотерапия, направленная на предупреждение повторных случаев инфаркта миокарда. Стандартом лечения называют двойную антитромботическую терапию (ДАТТ), которая включает комбинацию 2-х антиагрегантов. По показаниям проводится тройная терапия, включающая ДАТТ и один антикоагулянт, двойная терапия — антиагрегант и пероральный антикоагулянт.
Прогноз и профилактика
Исход повторного инфаркта зависит от объема повреждения сердечной мышцы, своевременности диагностики заболевания и полноты назначенного лечения. Хотя такие пациенты имеют более высокие риски осложненного течения ИМ, при ранней и комплексной терапии удается восстановить показатели гемодинамики и работу сердечной мышцы. Основными методами профилактики ПИМ являются диспансерное наблюдение у кардиолога и соблюдение схемы ДАТТ после первичного инфаркта.
2. Повторный инфаркт миокарда: оценка, риски, профилактика/ И.В. Самородская, С.А. Бойцов// Российский кардиологический журнал. – 2017. – №6.
3. Основные факторы, определяющие риск развития повторного инфаркта миокарда/ О.Л. Барбараш, Д.Ю. Седых, Е.В. Горбунова// Сердце: журнал для практикующих врачей. – 2017. – №1.
4. Прогнозирование повторного инфаркта миокарда у больных с постинфарктным кардиосклерозом/ А.Н. Шопин// Практическая медицина. – 2011. – №1.
Инфаркт миокарда
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.
Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный - с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный - с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» - с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные - с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое < 80 рт. ст., пульсовое < 30 мм мм рт. ст.), отмечается тахикардия, аритмия.
Острый период
В остром периоде инфаркта миокарда болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита.
В результате процессов некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Длительность и высота подъема температуры при лихорадке зависят от площади некроза. Артериальная гипотензия и признаки сердечной недостаточности сохраняются и нарастают.
Подострый период
Болевые ощущения отсутствуют, состояние пациента улучшается, нормализуется температура тела. Симптомы острой сердечной недостаточности становятся менее выраженными. Исчезает тахикардия, систолический шум.
Постинфарктный период
В постинфарктном периоде клинические проявления отсутствуют, лабораторные и физикальные данные практически без отклонений.
Атипичные формы инфаркта миокарда
Иногда встречается атипичное течение инфаркта миокарда с локализацией болей в нетипичных местах (в области горла, пальцах левой руки, в зоне левой лопатки или шейно-грудного отдела позвоночника, в эпигастрии, в нижней челюсти) или безболевые формы, ведущими симптомами которых могут быть кашель и тяжелое удушье, коллапс, отеки, аритмии, головокружение и помрачение сознания.
Атипичные формы инфаркта миокарда чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, недостаточностью кровообращения, на фоне повторного инфаркта миокарда.
Однако атипично протекает обычно только острейший период, дальнейшее развитие инфаркта миокарда становится типичным.
Стертое течение инфаркта миокарда бывает безболевым и случайно обнаруживается на ЭКГ.
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца - кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Диагностика инфаркта миокарда
Среди диагностических критериев инфаркта миокарда важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при инфаркте миокарда зависят от формы (типичной или атипичной) заболевания и обширности поражение сердечной мышца. Инфаркт миокарда следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой сердечной недостаточности.
К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном инфаркте миокарда), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном инфаркте миокарда). При ЭхоКГ выявляется нарушение локально сократимости желудочка, истончение его стенки.
В первые 4-6 часов после болевого приступа в крови определяется повышение миоглобина - белка, осуществляющего транспорт кислорода внутрь клеток.Повышение активности креатинфосфокиназы (КФК) в крови более чем на 50% наблюдается спустя 8—10 ч от развития инфаркта миокарда и снижается до нормы через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. Инфаркт миокарда исключается при трех отрицательных результатах.
Для диагностики инфаркта миокарда на более поздних сроках прибегают к определению фермента лактатдегидрогеназы (ЛДГ), активность которой повышается позже КФК – спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для инфаркта миокарда является повышение изоформ миокардиального сократительного белка тропонина - тропонина-Т и тропонина-1, увеличивающихся также при нестабильной стенокардии. В крови определяется увеличение СОЭ, лейкоцитов, активности аспартатаминотрансферазы (АсАт) и аланинаминотрансферазы (АлАт).
Коронарная ангиография (коронарография) позволяет установить тромботическую окклюзию коронарной артерии и снижение желудочковой сократимости, а также оценить возможности проведения аортокоронарного шунтирования или ангиопластики - операций, способствующих восстановлению кровотока в сердце.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.
Прогноз при инфаркте миокарда
Инфаркт миокарда является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. Насосная способность сердца связана с локализацией и объемом зоны инфаркта. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность.
По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением инфаркта миокарда.
Профилактика инфаркта миокарда
Необходимыми условиями профилактики инфаркта миокарда являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
Безболевой инфаркт миокарда ( "Немой" инфаркт миокарда , Бессимптомный инфаркт миокарда )
Безболевой инфаркт миокарда — это атипичная форма некроза сердечной мышцы, которая развивается вследствие острого нарушения кровообращения и не сопровождается характерными клиническими признаками. Проявляется неспецифическими симптомами: слабостью, одышкой, дискомфортом в грудной клетке. У 1% больных не возникает никаких симптомов инфаркта. Для диагностики используются тесты на маркеры повреждения миокарда, электрокардиография и ЭхоКГ. Лечение включает тромболитическую и антикоагулянтную терапию. При необходимости реперфузия миокарда достигается путем ангиопластики или коронарного шунтирования.
В большинстве случаев инфаркту миокарда (ИМ) предшествует длительно протекающая патология сердечно-сосудистой системы, поэтому удается четко установить этиологию возникшего неотложного состояния. Безболевой вариант имеет те же этиологические факторы, что и другие клинические формы болезни. В современной кардиологии выделяют 3 основные причины инфаркта:
- Коронарный тромбоз. Более 90-95% случаев обусловлены внезапным уменьшением кровотока в коронарных сосудах, которое вызвано закупоркой венечной артерии тромбом. Обычно состояние возникает на фоне атеросклеротического поражения сосудистой стенки и сопровождается вазоспазмом.
- Эмболия коронарной артерии. Существует несколько вариантов окклюзии сосудов, питающих миокард: тромбоэмболия при нарушении свертывания крови или тромбозе вен нижних конечностей, септическая эмболия при эндокардите или коронарите. В крайне редких случаях наблюдается жировая эмболия.
- Изолированный коронароспазм. Спазм неизмененных венечных артерий встречается очень редко и составляет около 0,5% всех причин безболевого варианта инфаркта. Коронароспазм может быть обусловлен массивной интоксикацией организма, серьезными нарушениями вегетативной иннервации.
Основным фактором риска ИМ является атеросклероз. Остальные предрасполагающие факторы подразделяются на большие и малые. К «большим» относят:
- дислипопротеинемии;
- артериальную гипертензию;
- сахарный диабет 2 типа;
- ожирение;
- неправильный образ жизни (гиподинамия, вредные привычки), которые ухудшают формирование коллатеральных сосудов в миокарде и усугубляют ишемию.
При сочетании двух и более факторов риск начала инфаркта возрастает в 2-4 раза. «Малые» факторы включают дефицит фолиевой кислоты, подагру, аутоиммунные процессы.
Выделяют несколько патогенетических периодов течения безболевого инфаркта. Острейшая стадия длится до двух часов и охватывает время от начала ишемического процесса в миокарде до первых проявлений некроза. Отсутствие характерного приступа боли связано с нарушением вегетативной иннервации сердца — синдромом «кардиальной гипестезии».
В остром периоде (около 2-х суток) наблюдается отграничение очага некроза мышцы от здоровых тканей, в кровь начинают поступать кардиоспецифические ферменты. Подострый период (28 дней) характеризуется постепенным замещением очага некротического поражения мышечных волокон первичной соединительной тканью. В постинфарктном периоде (до 6 месяцев) происходит формирование плотного рубца на месте повреждения.
С учетом анатомических изменений безболевой инфаркт представлен 3 основными типами:
- трансмуральным (захватывает всю толщу миокарда);
- субэндокардиальным;
- субэпикардиальным;
- интрамуральным (внутристеночным).
Согласно локализации некроза выделяют безболевой инфаркт левого или правого желудочка, межжелудочковой перегородки. В клинической практике наиболее важна классификация по объему поражения, включающая:
- ИМ с зубцомQ. Более частый вариант инфаркта, который классифицируется как крупноочаговый. На электрокардиограмме формируется патологический зубец Q в нескольких отведениях, что указывает на локализацию процесса в определенном участке мышечной стенки.
- ИМ без зубцаQ. Этот термин соответствует мелкоочаговому инфаркту, когда глубины и степени поражения мышечной оболочки недостаточно для образования отрицательного зубца Q. Считается прогностически благоприятный вариантом безболевого ИМ.
По клиническому течению выделяют первичный безболевой ИМ, рецидивирующий — образование новой зоны некроза в течение 28 суток после первого эпизода, повторный — возникает спустя 28 дней и дольше после первичного поражения. В отдельную категорию относят безболевой инфаркт миокарда с затяжным течением, для которого характерно отсутствие фиброзных процессов спустя 1-1,5 месяца после некроза и длительно сохраняющееся тяжелое состояние больного.
Симптомы
У 40-60% пациентов наблюдается продромальный период (предынфарктное состояние), который в основном развивается при психоэмоциональном стрессе. Нарастает слабость, снижается трудоспособность. Человек начинает испытывать необъяснимое чувство тревоги, характерны частые ночные пробуждения. Больные с ИБС отмечают увеличение частоты и длительности приступов стенокардии. Антиангинальные препараты в этот период действуют менее эффективно.
Безболевая форма острейшего периода не имеет специфических проявлений. К продромальным симптомам добавляются колебания артериального давления, головная боль. На протяжении 12-24 часов возможна субфебрильная температура тела. Пациенты жалуются на сильную слабость, одышку, повышенную потливость. Иногда беспокоит дискомфорт в области грудной клетки. у 1% людей инфаркт протекает истинно бессимптомно («немое» течение).
Опасность безболевой формы поражения миокарда заключается в несвоевременном обращении за медицинской помощью. При этом варианте заболевания намного чаще встречаются осложнения, а риск внезапной смерти на 30-60% выше, чем при других клинических вариантах инфаркта. Около 10-15% причин смертности при инфаркте миокарда занимают механические осложнения — аневризма левого желудочка, разрыв межжелудочковой перегородки.
Самое распространенное осложнение острого периода — нарушение сердечного ритма, выявляемое у 90% пациентов. Во время острой фазы зачастую развивается сердечно-сосудистая недостаточность. Клиническими признаками этого неотложного состояния служат сердечная астма, отек легких. У 10-15% больных формируется кардиогенный шок, который ассоциируется с высоким риском летального исхода. К отдаленным осложнениям ИМ относят синдром Дресслера, кардиосклероз.
Постановкой диагноза занимается квалифицированный терапевт-кардиолог, так как безболевой инфаркт нужно дифференцировать с множеством других патологий. Поскольку при заболевании отсутствуют патогномоничные физикальные данные, основное место в диагностике занимают лабораторно-инструментальные исследования. Для верификации диагноза рекомендованы:
- Электрокардиография. При подозрении на безболевой ИМ необходима регистрация кардиограммы в кратчайшие сроки. Характерные признаки: формирование глубокого зубца Q, подъем сегмента ST выше изоэлектрической линии. На основе анализа ЭКГ в 12 отведениях определяется локализация участка некроза.
- ЭхоКГ. Двухмерная эхокардиография является ценным исследованием для дифференциальной диагностики безболевого инфаркта и других кардиологических болезней. На наличие некроза миокарда указывают нарушения подвижности стенки желудочка, снижение фракции выброса левого желудочка менее 40%.
- Оценка маркеров повреждения миокарда. Для подтверждения диагноза в первые 6 часов используются автоматические тесты на КФК-МВ и миоглобин. В более поздние сроки регистрируется повышение уровня тропонинов и ЛДГ. Дополнительно исследуют кровь на острофазовые показатели.

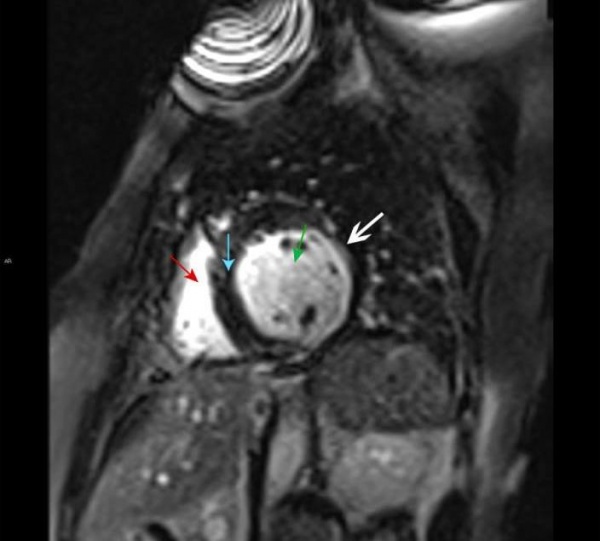
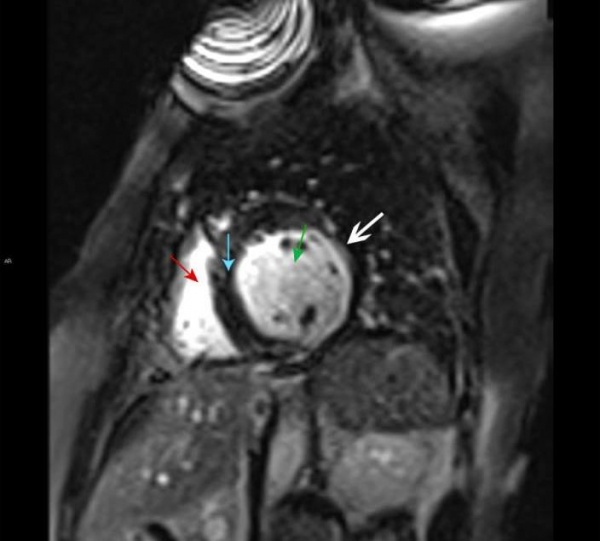
МРТ сердца. Правый желудочек (красная стрелка), левый желудочек (зеленая стрелка), межжелудочковая перегородка (синяя стрелка). Позднее контрастное усиление субэндокардиальной зоны левого желудочка, характерное для инфаркта миокарда (белая стрелка).
Лечение безболевого инфаркта миокарда
Консервативная терапия
Лечение безболевой формы инфаркта проводится в специализированном кардиологическом или реанимационном отделении. Лечебные мероприятия в острейшем и остром периоде направлены на ликвидацию ишемии миокарда и предотвращение ранних осложнений. Для этих целей подбирается медикаментозная схема, которая включает несколько групп препаратов:
- Тромболитики. Тромболитическая терапия (ТЛТ) — основной метод лечения, который используется на протяжении первых 12 часов для реперфузии миокарда и ограничения зоны некроза. Применяются специфические ферментные средства и активаторы плазминогена, которые разрушают тромб в венечной артерии.
- Антикоагулянты. Низкомолекулярные гепарины и антиагреганты назначаются для профилактики повторного тромбообразования и улучшения реологических свойств крови. Препараты эффективно дополняют метод ТЛТ.
- Бета-блокаторы. Лекарственные средства улучшают кровоснабжение и повышают сократимость миокарда, уменьшают частоту фатальных аритмий. Бета-блокаторы снижают вероятность рецидивов после отмены ТЛТ, а также уменьшают показатели ранней летальности.
Для лечения пациентов пожилого возраста или находящихся в состоянии кардиогенного шока целесообразно использовать малоинвазивные оперативные вмешательства. В течение нескольких первых часов выполняется чрескожная транслюминальная коронарная ангиопластика (ЧТКА). Метод быстро восстанавливает кровоток в венечных сосудах и снижает риск осложнений инфаркта.
Реже прибегают к расширенной оперативной методике — хирургическому шунтированию коронарных артерий. Операция рекомендована при неэффективности ЧТКА, сочетании инфаркта с дефектом межжелудочковой перегородки или митральной регургитацией. Проведенная в подостром периоде безболевого инфаркта, операция дает хорошие результаты при многососудистом повреждении коронарного дерева.
Прогноз заболевания определяется тяжестью перенесенного инфаркта и показателями фракции выброса ЛЖ. При назначении комплекса лечебных и санаторно-курортных мероприятий улучшение качества жизни достигается даже у больных из группы высокого риска. Первичная профилактика предусматривает борьбу с гиперлипидемией, медикаментозный контроль артериальной гипертензии и устранение поведенческих факторов риска.
1. Клинические особенности атипичных форм инфаркта миокарда/ З.Н. Лигай, А.Е. Матекова, А.М. Атаханова, А.А. Танирбергенова// Вестник КазНМУ. — 2018.
4. Атипичное течение острого инфаркта миокарда: клинико-анамнестическая характеристика пациентов, тактика ведения и исходы (по данным Регистра острого инфаркта миокарда)/ А.А. Гарганеева, Е.А. Кужелева, К.Н. Борель, Е.А. Паршин// Кардиоваскулярная терапия и профилактика. — 2016.
Читайте также:
