Механизм действия осмотических диуретиков на почки
Добавил пользователь Alex Обновлено: 28.01.2026
Концепция первичной профилактики в клинической практике Концепция первичной профилактики сердечно-сосудистых заболеваний (ССЗ), связанных с атеросклерозом, приобретает большую значимость, что обусловлено увеличением сердечно-сосудистой заболеваемости
Концепция первичной профилактики в клинической практике
Концепция первичной профилактики сердечно-сосудистых заболеваний (ССЗ), связанных с атеросклерозом, приобретает большую значимость, что обусловлено увеличением сердечно-сосудистой заболеваемости и смертности в нашей стране. Проблема носит не только медицинский, но и социальный характер, поскольку наибольшее число пациентов находится в трудоспособном возрасте.
Первичная профилактика подразумевает выявление и коррекцию факторов риска развития ССЗ. На протяжении последних 50 лет было выявлено более 200 факторов риска, которые внесли различный вклад в развитие сердечно-сосудистых осложнений. Эксперты ВОЗ выделяют семь факторов риска (артериальная гипертензия (АГ), гиперхолестеринемия, курение, ожирение, алкоголь, малоподвижный образ жизни), на долю которых приходится 75,6% потенциального риска развития инфаркта миокарда (ИМ) и инсульта [1]. Согласно данным проспективных исследований, смертность от АГ составляет 40% показателей смертности от ССЗ и 70–80% смертности от мозгового инсульта [2]. Однако у лиц, страдающих АГ, риск развития сердечно-сосудистых осложнений определяется не только уровнем артериального давления (АД) (хотя увеличение цифр АД сочетается с нарастанием коронарного риска), но и наличием других факторов риска и сопутствующих заболеваний, а также поражением органов-мишеней. По данным ГНИЦ практической медицины, только 10% больных АГ не имеют других факторов риска; у 20% выявляется один дополнительный фактор, у 40% АГ сочетается с двумя факторами риска, а 30% лиц имеют три и более факторов риска [3].
В 90-х годах XX в. была разработана концепция суммарного риска сердечно-сосудистых осложнений. Благодаря результатам проспективных исследований, проводившихся не менее 10 лет, разработаны таблицы для определения риска возможного развития сердечно-сосудистых осложнений (ИМ, инсульт и смерть от сердечно-сосудистых осложнений) [4]. Для этого, наряду со степенью повышения АД, учитываются возраст, пол, курение, уровень общего холестерина и наличие сахарного диабета. Какие преимущества имеет определение суммарного риска? Во-первых, определив уровень различных факторов риска, мы получаем унифицированное значение — уровень общего (суммарного) риска для каждого индивидуума. Это позволяет оценить состояние пациента в целом и определить тактику его дальнейшего ведения (применение только немедикаментозной терапии, назначение одного препарата или агрессивное многокомпонентное лечение). Во-вторых, с помощью таблицы риска можно контролировать эффективность проведенной терапии. Например, применяя европейскую таблицу SCORE, мы обнаружили следующее: среди 500 больных АГ I–II степени 18% имеют низкий коронарный риск и у 21% выявлен умеренный риск, тогда как 60% амбулаторных больных, страдающих АГ не менее 5 лет, имеют высокий и очень высокий суммарный риск развития сердечно-сосудистых осложнений [3].
Чем обусловлен высокий суммарный коронарный риск среди амбулаторных пациентов с АГ? Среди больных с высоким коронарным риском у 42% АГ сочетается с абдоминальным ожирением, гиперлипидемией и нарушением толерантности к глюкозе, у 30% выявлено сочетание АГ с абдоминальным ожирением и гиперлипидемией без нарушения углеводного обмена. В 21% случаев высокий коронарный риск обусловлен сочетанием АГ и гиперлипидемии, и всего лишь у 3% больных риск увеличивается за счет высоких цифр АД. Таким образом, в большинстве случаев высокий суммарный коронарный риск обусловлен не только выраженностью АГ, но и наличием метаболических нарушений.
Под термином «метаболические нарушения» подразумеваются нарушения жирового, углеводного и липидного обменов. В 1988 г. появился новый термин — «метаболический синдром», включающий АГ, абдоминальное ожирение, гипертриглицеридемию, низкий уровень холестерина липопротеидов высокой плотности и нарушение толерантности к глюкозе. Патогенетической основой этого нарушения является инсулинорезистентность [5]. Было показано, что в развитии АГ в рамках метаболического синдрома задействованы три механизма: 1) нарушение реабсорбции натрия и задержка жидкости в организме; 2) изменение транспорта ионов; 3) активация симпатоадреналовой и ренин-ангиотензин-альдостероновой системы. Следовательно, в патогенезе АГ в сочетании с метаболическими нарушениями усиление реабсорбции натрия в почечных канальцах играет важную роль. В связи с этим возникает вопрос, являвшийся на протяжении многих лет объектом бурной дискуссии: оправдано ли применение диуретиков у больных с АГ и метаболическими нарушениями? Если да, то какой из них является предпочтительным для длительного применения?
Современная классификация диуретиков: механизмы действия, показания и метаболические эффекты
В зависимости от почечной локализации и механизма действия, мочегонные препараты, или диуретики, подразделяются на шесть групп: тиазиды, тиазидоподобные, петлевые, калийсберегающие, осмотические диуретики и ингибиторы карбоангидразы (табл.).
Тиазидные диуретики действуют в основном на клетки дистального извитого канальца изнутри, где блокируют реабсорбцию натрия хлорида. Это приводит к снижению объема циркулирующей крови, следовательно, к снижению сердечного выброса и уровня АД. Данный эффект наступает через 1–2 ч и длится обычно 12–18 ч. Тиазиды являются самыми сильными калийвыводящими мочегонными. Тиазидоподобные диуретики структурно схожи с тиазидами, при этом наряду с незначительной диуретической активностью, обладают выраженным антигипертензивным свойством. Петлевые диуретики воздействуют на толстые восходящие отделы петли Генле, блокируя реабсорбцию ионов натрия, хлора, воды и вызывают выраженный диурез. Этими препаратами пользуются для лечения отечного синдрома различного генеза. Калийсберегающие диуретики (спиронолактон) связаны с конкурентной блокадой связывания альдостерона с рецепторами собирательных трубок почечных нефронов, вследствие чего уменьшаются реабсорбция натрия и секреция калия. В результате повышается выведение натрия и воды при сохранении калия в кровотоке. Эти препараты применяются в основном при сердечной недостаточности, асците и гипокалиемии. Осмотические диуретики вызывают нарушение реабсорбции жидкости и натрия в канальцевом аппарате почек, что связано с их высокой осмотической активностью. В конечном итоге это приводит к массивному диурезу. Механизм действия еще одного диуретика связан с угнетением фермента карбоангидразы в проксимальных канальцах почек, вследствие чего снижается реабсорбция бикарбоната. При этом нереабсорбированный натрий выделяется в виде бикарбонатов с мочой [6, 7].
Среди всех мочегонных препаратов для длительного контроля АД пользуются двумя группами диуретиков: тиазидными и тиазидоподобными [8].
Антигипертензивный эффект тиазидных диуретиков имеет дозозависимый эффект. При дозе гипотиазида (наиболее часто употребляемого тиазида в России) 50–100 мг/сут гипотензивный эффект отмечается у 80–90% больных, при дозе 25 мг/сут — у 60–75% и при 12,5 мг/сут только у 50–60%. Однако препарат имеет ряд негативных метаболических эффектов. В первую очередь, это диабетогенный эффект, влияние на липидный и пуриновый обмены. Механизм негативного действия тиазидов обусловлен выраженным выводом калия. Потеря внеклеточного и внутриклеточного калия в β-клетках поджелудочной железы приводит к нарушению секреции инсулина и гипергликемии. Установлено, что диабетогенный эффект является дозозависимым [6]. По данным исследования MRFIT, применение гипотиазида выше 50 мг/сут в течение 6 лет привело к развитию сахарного диабета 2 типа достоверно чаще при сравнении с двумя исследованиями (SHEP, TOMHS), в которых на фоне 25 мг гипотиазида не отмечалось достоверного увеличения риска развития сахарного диабета 2 типа [9]. Влияние тиазидов на липидный обмен больше зависит от длительности приема препарата. Прием тиазидов на протяжении 3–12 мес приводит к увеличению уровня холестерина на 5%. В некоторых случаях эта группа препаратов способна спровоцировать клиническую картину подагры или способствовать увеличению уровня мочевой кислоты, что также является дозозависимым эффектом.
Тиазидоподобные диуретики относятся к молодому поколению мочегонных препаратов. Они применяются в малых дозах и, в отличие от тиазидов, гораздо меньше влияют на реабсорбцию натрия хлорида (и, соответственно, обладают минимальным калийвыводящим свойством). Эти обстоятельства позволяют рассуждать об отсутствии у тиазидоподобных диуретиков отрицательного метаболического и диабетогенного эффекта. Благодаря сосудорасширяющему эффекту данные препараты широко применяются в качестве антигипертензивных средств в виде монотерапии и в сочетании с другими гипотензивными препаратами [10].
Роль диуретиков в снижении сердечно-сосудистых осложнений: краткий метаанализ проспективных исследований
За последние 30 лет проведено более 10 крупных исследований с применением диуретиков. В сравнительных исследованиях с твердыми конечными точками изучалась роль диуретиков в снижении ССЗ и смертности [9]. В трех крупных исследованиях анализировалась эффективность применения диуретиков у больных с метаболическими нарушениями и гипергликемией.
В исследовании SHEP (Systolic Hypertension in the Eldery Program) пациенты старше 60 лет с изолированной АГ путем рандомизации были распредены в две группы: в первой получали хлорталидон в дозе 12,5–25 мг/сут, во второй — плацебо [11]. При необходимости в первой группе в схему терапии добавляли атенолол 25–50 мг/сут, во второй группе — другие антигипертензивные препараты. Конечными точками считали смертельный и несмертельный инсульт, ИМ и смерть от ССЗ. Снижение уровня АД до 143/68 мм рт. ст. (во второй группе — 155/72 мм рт. ст.) на фоне хлорталидона сопровождалось снижением случаев ИМ, инсульта и всех сердечно-сосудистых осложнений.
В 2002 г. были опубликованы результаты одного из масштабных исследований в истории медицины (ALLHAT), в котором участвовали 42000 больных с АГ с сочетанием одного или нескольких факторов риска. Треть больных наряду с АГ имела сахарный диабет и другие метаболические нарушения [12]. Целью исследования было сравнение влияния диуретика хлорталидона в дозе 12,5–25 мг и других антигипертензивных препаратов (доксазозин — 2–8 мг, амлодипин — 2,5–10 мг, лизиноприл — 10–40 мг) на сердечно-сосудистую заболеваемость и смертность. На фоне хлорталидона отмечалось преимущественное снижение риска инсульта и сердечной недостаточности, тогда как по частоте смертельного и несмертельного ИМ эффективность диуретика и ингибитора АПФ были сопоставимы. Однако в группе больных, получавших тиазидный диуретик, частота вновь возникшего сахарного диабета 2 типа была достоверно выше по сравнению с антагонистами кальция и ингибиторами АПФ. В целом тиазидные диуретики в среднетерапевтической дозе при длительном приеме у больных с высоким риском и метаболическими нарушениями достоверно снижают риск развития ССЗ и их осложнений.
В исследовании J. R. Flack et al. было показано более выраженное снижение микроальбуминурии на фоне терапии Индапамидом 2,5 мг/сут (68 ± 38 мкг/мин) по сравнению с аналогичным показателем при применении каптоприла 37,5 мг/сут в три приема (78 ± 51 мкг/мин) при одинаковом антигипертензивном эффекте [15].
В ходе крупного исследования PROGRESS было показано, что достоверное снижение вероятности повторного инсульта у пациентов с АГ на 43% достигалось только в группе пациентов, получавших Индапамид 2,5 мг/сут в комбинации с периндоприлом 4 мг/сут. В группе больных, принимавших периндоприл в качестве монотерапии, достоверного снижения вероятности инсульта отмечено не было [16].
Таким образом, у больных АГ с высоким сердечно-сосудистым риском и метаболическими нарушениями тиазидоподобные диуретики оказывают антигипертензивный, кардиопротекторный, нефропротекторный эффекты, а также снижают вероятность развития инсульта.
Метаболические эффекты тиазидоподобных диуретиков
Одним из трех требований к антигипертензивным препаратам, применяемым у больных с высоким коронарным риском и метаболическими нарушениями, является метаболическая нейтральность. В начале 1990-х годов на основании анализа крупномасштабных исследований было выдвинуто предположение о том, что метаболические эффекты антигипертензивных препаратов могут оказать влияние на эффективность терапии в плане предупреждения сердечно-сосудистых осложнений. В частности, было показано, что при длительном применении β-блокаторов и диуретиков реальное снижение риска сердечно-сосудистых осложнений оказалось ниже ожидаемого — отчасти это обусловлено отрицательным метаболическим эффектом данных препаратов. По мнению ведущего американского ученого N. Kaplan, положительный гипотензивный эффект препарата не должен конкурировать с проатерогенным и продиабетическим действием, поскольку возрастает риск развития сахарного диабета и эффективность терапии в плане предупреждения развития сердечно-сосудистых осложнений может снижаться [15]. С этой точки зрения изучение метаболических эффектов тиазидоподобных диуретиков представляется весьма интересным. В зарубежной литературе опубликованы результаты нескольких исследований, посвященных изучению метаболических эффектов индапамида. G. Leonetti et al. показали, что двухлетняя монотерапия у больных с АГ не привела к изменению уровня глюкозы как натощак, так и через 2 ч после применения теста толерантности к глюкозе [16]. Другой автор, А. Harrower, оценивая влияние индапамида на параметры углеводного обмена, выявил: терапия в течение 6 мес не ухудшает показатели уровней глюкозы, инсулина и мочевой кислоты [9]. По данным Meyer-Sabellek, индапамид на протяжении 6 мес нейтрально влияет на уровень основных параметров липидного спектра [17].
Заключение
Большинство пациентов с АГ имеют высокий коронарный риск, что обусловлено не только выраженностью АД и поражением органов-мишеней, но и наличием дислипидемии, нарушений углеводного обмена и ожирения. По прогнозам ВОЗ, в ближайшие 20 лет ожидается увеличение числа больных с метаболическими нарушениями на 50%.
Повышенная реабсорбция натрия в проксимальных отделах почечных канальцев является одним из трех механизмов развития АГ в сочетании с метаболическими нарушениями. С одной стороны, применение диуретиков является патогенетически обоснованным, с другой, — негативные метаболические эффекты на фоне приема тиазидов увеличивают риск развития сахарного диабета. Однако существует мнение, что польза от применения диуретиков при АГ в сочетании с гипергликемией и метаболическими нарушениями значительно превышает предполагаемый вред от побочных метаболических эффектов. Хороший антигипертензивный эффект, органопротекция, переносимость и приемлемая цена являются важными аргументами для широкого применения диуретиков в клинической практике. Основоположник теории о метаболическом синдроме G. Reaven в одном из последних интервью, говоря о применении тиазидных диуретиков, отметил, что: «у пациентов с метаболическим синдромом тиазидные диуретики в качестве антигипертензивного препарата могут применяться в дозе 12,5 мг/сут». Итак, тиазидные диуретики могут применяться в малых дозах в составе комбинированной антигипертензивной терапии.
Тиазидоподобный диуретик индапамид применяется в малых дозах и, в отличие от тиазидов, гораздо меньше влияет на реабсорбцию натрия хлорида (соответственно, обладает минимальным калийвыводящим свойством). Доказано, что он выступает в качестве периферического вазодилататора за счет блокады кальциевых каналов и стимуляции синтеза простагландина Е2. По данным клинических исследований, длительный прием индапамида имеет нейтральный метаболический эффект, уменьшает гипертрофию левого желудочка и микроальбуминурию. У больных с АГ и метаболическими нарушениями индапамид может применяться как в сочетании с липидснижающими и антигипергликемическими лекарственными средствами, так и в комбинации с другими антигипертензивными препаратами.
Литература
- Yusuf S., Hawken S., Ounpuu S. еt al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (The INTERHEART study) // Lancet 2004; 364: 937–52.
- Thompson G. R., Wilson P. W. Coronary risk factors and their assessment. Science press. London, 1992: 55–60.
- Мамедов М. Н. Метельская В. А., Перова Н. В. Метаболический синдром: пути реализации атеротромбогенного потенциала // Кардиология. 2000. Т. 40. № 2. С. 83–89.
- European Society of Cardiology guidelines for the management of arterial hypertension. Guidelines Committee // J. Hypertens. 2003; 21(6): 1011–1053.
- Reaven G. Role of insulin resistance in human disease // Diabetes. 1988; 37: 1595–1607.
- Дедов И. И. Сахарный диабет и артериальная гипертензия. М.: МИА, 2006. С. 24–26, 196–208.
- Чазова И. Е., Мычка В. Б. Метаболический синдром. М.: Медиа медика, 2004. С. 102–108.
- Небиеридзе Д. В., Оганов Р. Г. Метаболические и сосудистые эффекты антигипертензивной терапии. М.: Универсум Паблишинг, 2005. С. 58–66.
- What’s What. A guide to acronyms for cardiovascular trials. 4th edition. Experta Medica. Netherlands. 1999: 200–282.
- Harrower A. Противогипертензивная терапия у больных сахарным диабетом: опыт применения индапамида // Am. J. Med. 1988; 84 (1B): 89–91.
- Curb J., Pressel S., Culter J. Effect of diuretic-based antihypertensive treatment on cardiovascular risk in older diabetic patients with isolated systolic hypertension // JAMA. 1996; 276: 1886–92.
- The ALLHAT Group. Major cardiovascular events in hypertensive patients randomized to doxazocin vs chlortalidon // JAMA. 2000; 283: 1967–75.
- Gosse P., Sheridan D., Zannad F. Regression of left ventricular hypertrophy in hypertensive patients treated with indapamide SR versus enalapril: the LIVE study // Hypertension. 2004; 18: 1465–75.
- Marre M., Fernandez M., Garcia-Puig J. Value of natrilix SR in hypertensive type 2 diabetic patients with microalbuminuria // Hypertension. 2002; 20(4): 338–42.
- Kaplan N., Schachter M. New frontiers in hypertension. Lippincatt Williams and Wilking. 2002: 20–28.
- Leonetti G. Эффективность индапамида при длительном лечении артериальной гипертензии: результаты двухлетнего многоцентрового исследования // Am. J. Cardiol. 1990; 65: 67H–71H.
- Meyer-Saballek W. Содержание липопротеидов в сыворотке: многолетнее лечение индапамидом больных артериальной гипертензией // Hypertension. 1985; 7(II): 170–174.
- Мамедов М., Перова Н., Косматова О. и др. Перспективы коррекции проявлений метаболического синдрома: влияние сочетанной гипотензивной и гиполипидемической терапии на уровень суммарного коронарного риска и тканевую инсулинорезистентность // Кардиология. 2003. Т. 43. № 3.С. 13–19.
М. Н. Мамедов, доктор медицинских наук
ГНИЦ профилактической медицины, Москва
Механизм действия осмотических диуретиков на почки
Показания для назначения мочегонных (диуретиков)
Диуретики (салуретики) увеличивают образование мочи (диурез). Строго говоря, этот термин относится к препаратам с прямым воздействием на почки. Основной эффект таких препаратов — усиление экскреции мочи за счет угнетения реабсорбции NaCl и воды.
Наиболее значимые показаниям к применению диуретиков перечислены ниже.
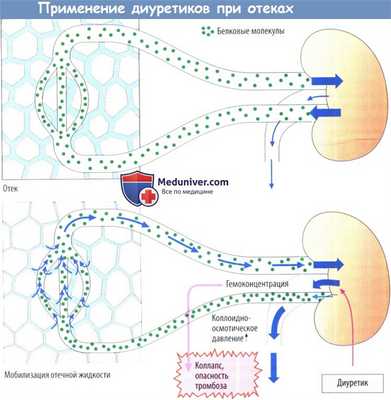
а) Устранение отека. При отеке в тканях происходит избыточное накопление жидкости, главным образом во внеклеточном (интерстициальном) пространстве. Повышенная почечная экскреция Na + и воды после приема диуретика приводит к уменьшению объема плазмы и гемоконцентрации.
В результате этого наряду с концентрацией белка в плазме возрастает и онкотическое давление, жидкость перемещается из интерстициального пространства в капиллярное русло. Количество жидкости, содержащейся в ткани, уменьшается, и отек сходит. Уменьшение объема плазмы и жидкости, содержащейся в интерстициальном пространстве, означает снижение объема внеклеточной жидкости (ВКЖ).
В зависимости от конкретного состояния используют тиазидные и петлевые диуретики, антагонисты альдостерона и осмотические диуретики.
б) Антигипертензивная терапия. Диуретики относятся к препаратам первого выбора для снижения АД. Даже в низкой дозировке они уменьшают общее периферическое сопротивление (без значительного снижения объема ВКЖ) и посредством этого нормализуют АД.
в) Лечение застойной сердечной недостаточности. Снижая периферическое сопротивление, диуретики помогают сердцу выбрасывать кровь (уменьшение постнагрузки); возрастает минутный объем сердца и устойчивость к физической нагрузке. В связи с увеличением экскреции жидкости снижается объем ВКЖ и венозный возврат (уменьшение преднагрузки).
Проходят такие симптомы венозного застоя крови, как отеки голеней и стоп, увеличение печени. В основном используют тиазидные (во можно сочетаниес калийсберегающими) и петлевые диуретики.
г) Профилактика почечной недостаточности. При недостаточности кровообращения (шок), например вторично из-за массивной кровопотери, почки могут прекращать продукцию мочи (анурия). Отток мочи пытаются поддерживать с помощью диуретиков. Показано применение либо осмотических, либо петлевых диуретиков.
Активное применение диуретиков влечет за собой риск возникновения побочных эффектов:
1) снижение ОЦК может привести к гипотензии и коллапсу,
2) в связи с увеличением концентрации эритроцитов и тромбоцитов возрастает риск внутрисосудистого свертывания или тромбоза.
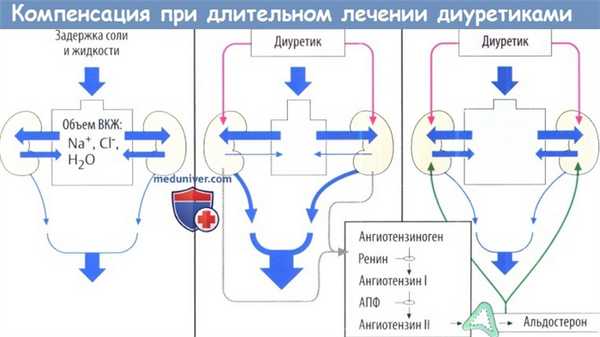
Когда в результате лечения диуретиками происходит значительное уменьшение количества NaCI и воды (снижение объема ВКЖ), организм запускает механизмы компенсации, в частности происходит активация РААС. Из-за снижения ОЦК подвергается опасности почечный кровоток. Это приводит к выделению из почек ренина, который ферментативно катализирует образование ангиотензина I.
Ангиотензин I с помощью АПФ превращается в ангиотензин II. Ангиотензин II стимулирует высвобождение альдостерона. Этот минералокортикоид вызывает реабсорбцию NaCI и воды в почках и тем самым противодействует эффекту диуретиков. Ингибиторы АПФ и антагонисты ангиотензина II повышают эффективность диуретиков, предотвращая этот дисрегуляторный ответ.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
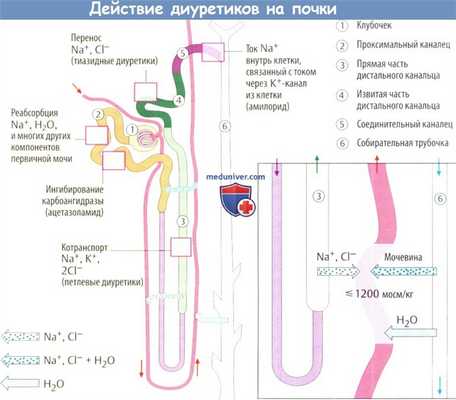
а) Реабсорбция NaCl в почках. Нефрон — наименьшая функциональная единица почки. Ультрафильтрация плазмы в капсуле Боумена в петлях гломерулярных капилляров приводит к образованию первичной мочи. В проксимальных канальцах 70%ультрафильтрата возвращаются обратно посредством изоосмотической реабсорбции NaCl и воды. Далее по ходу почечных канальцев в толстом сегменте восходящей части петли Генле всасывается NaCl без воды.
Противоположные функции этих частей петли Генле наряду с параллельным расположением прямых сосудов обеспечивают противоточный механизм, обусловливающий очень высокую концентрацию NaCl в мозговом веществе почки. В дистальной части извитых канальцев, соединительном сегментеи собирательных трубочках снова происходит реабсорбция NaCI, сопровождающаяся компенсаторной секрецией К + в (мозговые) собирательные трубочки.
В соединительных канальцах и собирательных трубочках вазопрессин (антидиуретический гормон, АДГ) увеличивает проницаемость эпителия для воды за счет включения молекул аквапорина в часть плазматической мембраны, обращенную в просвет канальцев. Гиперосмолярная среда мозгового вещества почки служит движущей силой для прохождения воды. Таким образом, вода задерживается в организме, а концентрированная моча выделяется. Столь эффективные механизмы реабсорбции позволяют образовывать около 1 л/сут вторичной мочи из 150-180 л/сут первичной мочи.
Перенос Na + через клетки канальцев во всех сегментах нефрона осуществляется сходным по сути образом. Внутриклеточная концентрация Na + значительно ниже, чем в первичной моче, т. к. Na + /К + -АТФаза базолатеральной мембраны постоянно выкачивает Na + из клетки в интерстиций. Наряду с результирующим градиентом концентрации между просветом канальца и клеткой движение ионов Na + через мембрану осуществляется и с помощью переносчиков.
Все диуретики угнетают реабсорбцию Na + . Этот эффект может быть обусловлен либо уменьшением движения Na + внутрь клетки, либо нарушением его движения из клетки.
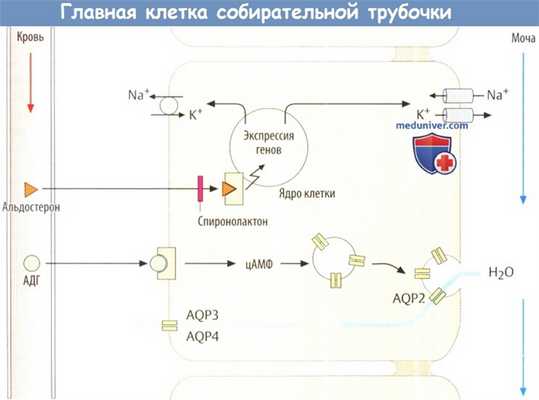
б) Аквапорины. В силу своей структуры клеточные мембраны проницаемы для воды. По этой причине в мембрану встроены специальные поры, пропускающие воду. Они состоят из белков, называемых аквапоринами, которые широко распространены в различных вариациях как среди растений, так и животных. В почках человека существуют следующие типы аквапорина: - AQP1, находятся в проксимальных канальцах и нисходящей части петли Генле;
- AQP2, находятся в соединительных канальцах и собирательных трубочках; плотность их расложения в части плазматической мембраны, обращенной в просвет канальца, регулируется вазопрессином;
- AQPЗ и AQP4 присутствуют в базолатеральной области мембраны, что позволяет воде проходить в интерстиций.
Здесь можно описать действие альдостерона на почки. Этот гормон, вырабатываемый в надпочечниках, стимулирует синтез Na + /К + -АТФазы и Na + -ионных каналов. В результате повышается реабсорбция воды и Na + . Соответственно антагонисты альдостерона, такие как спиронолактон или эплеренон, будут связывать мочегонное действие.
в) Осмотические диуретики. К ним относятся маннитол и сорбитол, которые оказывают действие преимущественно на проксимальные канальцы, предотвращая реабсорбцию воды. Эти многоатомные спирты не абсорбируются и вследствие этого связывают соответствующий объем воды. Они также не всасываются через кишечный эпитетелий, т. к. клетки организма не имеют механизмов переноса для этих веществ и, соответственно, должны вводиться путем в/в инфузии.
В результате действия осмотических диуретиков выводится большой объем разбавленной мочи, как при декомпенсированном сахарном диабете. Для достижения эффективного осмотического диуреза необходимо в/в вливание 0,5-2 л 10% маннитола. Это серьезная нагрузка на сердце и кровообращение (отек легких) и может привести к развитию синдрома гиперинфузии.
Осмотические диуретики. Петлевые диуретики
Мочегонные средства, или диуретики, — это препараты, которые увеличивают количество выделяемой мочи. Большинство диуретиков также увеличивают выделение с мочой растворенных веществ, особенно натрия и хлора. В клинике преимущественно используют средства, уменьшающие реабсорбцню натрия в канальцах и вызывающие натрийурез (усиленное выделение натрия), что, в свою очередь, повышает диурез (усиленное выделение воды), т.е. в большинстве случаев увеличение выделения воды — вторичный процесс, возникающий вследствие низкой реабсорбции натрия в канальцах.
Ионы Na+, остающиеся в просвете канальцев, создают высокое осмотическое давление, которое препятствует реабсорбции воды. Поскольку канальцевая реабсорбция многих растворенных веществ (ионов калия, хлора, магния и кальция) по отношению к реабсорбцин натрия вторична, прием ряда мочегонных препаратов также увеличивает выделение этих веществ с мочой.
Наиболее часто диуретики применяют для снижения объема внеклеточной жидкости, что особенно важно при заболеваниях, сопровождающихся отеками или повышением артериального давления. Потеря организмом натрия уменьшает в основном объем внеклеточной жидкости, поэтому показаниями к применению мочегонных средств служат состояния, при которых объем внеклеточной жидкости увеличен.
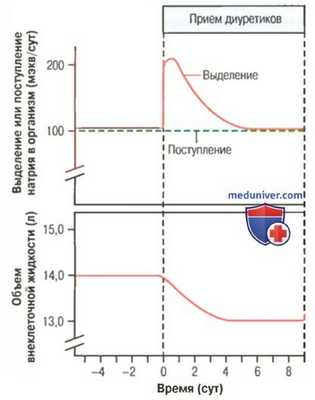
Выделение натрия и состояние объема внеклеточной жидкости при приеме диуретиков.
Резкое увеличение выделения натрия сопровождается уменьшением объема внеклеточной жидкости.
При постоянном уровне поступления натрия в организм уровень его выделения благодаря механизмам компенсации становится равен поступившему количеству
Некоторые диуретики способны увеличить выделение мочи более чем в 20 раз уже через несколько минут после введения. Однако эффективность воздействия большинства препаратов на выделение почками соли и воды снижается в течение нескольких суток от начала их регулярного приема (для облегчения понимания просим вас изучить рисунок выше), что является следствием активации других компенсаторных реакций.
Эти ответы развиваются вследствие снижения объема внеклеточной жидкости, что часто сопровождается снижением артериального давления и скорости клубочковой фильтрации, увеличением секреции ренина и образованием ангиотензина II. Развитие подобных реакций в итоге уменьшает влияние диуретиков на выделение мочи. Итак, восстановление гомеостаза, при котором выделение мочи станет равным поступлению жидкости в организм, произойдет лишь после снижения показателей артериального давления и объема внеклеточной жидкости и, соответственно, уменьшения выраженности симптомов, проявляющихся в виде артериальной гипертонии или отеков, явившихся поводом для назначения диуретиков.
Множество диуретиков, используемых в клинике, имеют разные механизмы действия и, следовательно, снижают реабсорбцию в различных сегментах канальцевой системы нефрона. Классификация мочегонных средств и механизмов их действия приведены в таблице ниже.

а) Осмотические диуретики снижают реабсорбцию воды, увеличивая осмотическое давление жидкости в просвете канальца. Введение в кровоток крови веществ, которые плохо реабсорбируются в канальцах, например мочевины, маннитола и сахарозы, вызывает увеличение выделения молекул этих осмотически активных веществ в просвет канальцев. Высокое осмотическое давление, вызванное этими веществами, существенно снижает реабсорбцию воды, способствуя попаданию большого количества жидкости в конечную мочу.
Большой объем мочи также образуется при определенных заболеваниях, когда избыток растворенных веществ не способен реабсорбироваться из просвета канальцев. Например, при увеличении концентрации глюкозы в крови, достигающей высокого уровня при сахарном диабете, ее высокая фильтрационная нагрузка превышает возможность клеток канальцев реабсорбировать это вещество из жидкости внутри просвета канальцев, т.е. превышает значение максимального транспорта для глюкозы.
При содержании глюкозы в плазме порядка 250 мг/дл клетки эпителия канальцев способны лишь ненамного усилить реабсорбцию.
Избыток глюкозы остается в просвете канальца, она действует подобно осмотическим диуретикам, вызывая быструю потерю жидкости с выделяемой мочой. У больных сахарным диабетом повышенное выделение мочи уравновешивается высоким уровнем потребления жидкости благодаря активации механизма жажды.
б) Петлевые диуретики уменьшают активную реабсорбцию ионов натрия, хлора и калия в толстом сегменте восходящего отдела петли Генле. Фуросемид, этакриновая кислота и буметанид — мощные мочегонные средства, которые уменьшают активную реабсорбцию в толстом восходящем отделе петли Генле, блокируя деятельность переносчика, расположенного на апикальной мембране клеток эпителия канальцев и совместно транспортирующего 1 ион Na+, 2 иона Сl- и 1 ион К+. Эти диуретики являются наиболее эффективными препаратами, используемыми в клинике.
Блокируя активный котранспортный механизм в петле Генле, петлевые диуретики увеличивают выделение с мочой ионов Na+, Сl-, К+, других электролитов, а также воды по двум причинам: (1) существенно увеличивают количество растворенных веществ в просвете дистальных сегментов нефрона, действуя как осмотические вещества, препятствуя таким образом реабсорбции воды; (2) влияют на противоточно-множительную систему, уменьшая поглощение ионов из петли Генле в мозговое вещество почки, снижая таким образом в нем осмолярность межклеточной жидкости.
Благодаря этому свойству диуретики нарушают способность почек формировать концентрированную или разведенную мочу. Образование разведенной мочи нарушается вследствие снижения реабсорбции ионов Na+ и Сl- в петле Генле, что способствует выделению большого количества этих ионов, а также соответствующего объема жидкости с конечной мочой.
Способность почек концентрировать мочу нарушается вследствие снижения содержания этих ионов, а следовательно, и низкой осмолярности межклеточной жидкости в мозговом веществе почки, поэтому снижается реабсорбция жидкости в собирательных протоках и, как следствие, уменьшается способность почек образовывать максимально концентрированную мочу. Кроме того, снижение осмолярности в мозговом веществе уменьшает реабсорбцию воды в нисходящем отделе петли Генле.
Таким образом, при использовании диуретиков в конечную мочу может поступать до 20-30% жидкости, прошедшей почечный фильтр, благодаря чему при необходимости можно в течение нескольких минут увеличить выделение мочи по сравнению с нормой в 25 раз.
Видео физиология фильтрации в почках и поддержки осмотического давления крови - профессор, д.м.н. П.Е. Умрюхин
Диуретики в лечении сердечно-сосудистой патологии
Для цитирования: Шилов А.М., Чубаров М.В., Князева С.А., Мельник М.В. Диуретики в лечении сердечно-сосудистой патологии. РМЖ. 2002;10:437.
ММА имени И.М. Сеченова
В настоящее время диуретики занимают ведущее место в лечении сердечной недостаточности и артериальной гипертензии различной этиологии.
Использование диуретических препаратов в лечении сердечно–сосудистых заболеваний началось в середине прошлого столетия, когда в 1956 году был синтезирован и впервые применен в клинической практике хлортиазид. В 1958 г. был создан более мощный тиазидный диуретик – гидрохлортиазид, в 1959 г. появился тиазидоподобный диуретик хлорталидон. 60–е годы характеризовались интенсивным применением тиазидных диуретиков в кардиологической практике, однако накопленный клинический опыт и экспериментальные исследования показали на фоне благоприятного эффекта ряд побочных реакций, которые снижали ожидаемый терапевтический успех, что побудило исследователей к поиску новых диуретических препаратов [1,2].
Диурез – мочеотделение, регулируемое почечными и внепочечными механизмами. К внепочечным механизмам относятся:1) состояние насосной функции сердца, 2) натрийдиуретический гормон предсердий, 3) антидиуретический гормон гипофиза, 4) альдостерон – гормон коры надпочечников. Внутрипочечный механизм регуляции диуреза осуществляется через увеличение или снижение фильтрации и реабсорбции солей из первичной мочи (в частности, ионов натрия) и облигатно к ним Н2О эпителием почечных канальцев.
Диуретики – лекарственные препараты, снижающие реабсорбцию натрия и воды, что ведет к увеличению диуреза, по своему механизму действия делятся на осмотические, солевые, водные (рис. 1).
Рис. 1. Схема действия диуретиков
Осмотические (маннитол, глюкоза, органические кислоты) и водные (демоклоциклин, препараты лития) диуретики применяются пpи лечении сердечной недостаточности. Солевые диуретики – при лечении артериальной гипертензии, острой и хронической сердечной недостаточности [3].
Согласно современным представлениям о строении нефрона – функциональной единицы почки и функции его различных отделов, солевые диуретики делятся на тиазидные, петлевые и калийсберегающие.
На рисунке 2 представлена схема строения и функции нефрона. Мочевыделительная функция регулируется двумя основными процессами в нефроне: фильтрацией в гломерулярном аппарате и реабсорбцией в различных отделах нефрона. Транспортная функция различных отделов нефрона представлена на рисунке 2. Реабсорбция жидкости через проксимальные отделы извитых тубул осуществляется изоосмотическим механизмом вслед за реабсорбцией приблизительно двух третей фильтрованного натрия. NаНСО3 реабсорбируется неэлектрогенным механизмом через секрецию ионов водорода. Подобный активный транспорт солей создает трансэпителиальный градиент осмотического давления, который позволяет осуществлять пассивный выход воды из нефрона в перитубулярные капилляры. Подъем концентрации Cl – в тубулярной жидкости соответствует снижению концентрации НCО3 – и становится определяющей силой движения ионов Cl – вниз по концентрационному градиенту. Прямая часть проксимального канальца осуществляет активный электрогенный транспорт Nа + . Оставшаяся одна треть гломерулярного фильтрата поступает в нисходящее колено петли Генле. Тонкая часть нисходящего колена петли Генле проницаема для Н2О и непроницаема для Nа + , удерживая NaCl в жидкости нефрона. В восходящий отдел петли Генле жидкость поступает с высокой концентрацией NaCl, который в начальной части пассивно выходит в перитубулярное пространство, создавая делюцию тубулярной жидкости. В толстом отделе восходящего колена петли Генле имеет место активная реабсорбция Cl – и пассивное выведение Nа + . В дистальном отделе извитых канальцев нефрона на активную реабсорбцию Nа + имеет место секреция в просвет нефрона К + и Н + . Собирательные канальца почки непроницаемы для воды в отсутствие антидиуретического гормона. В этом отделе альдостерон активизирует реабсорбцию Nа + и секрецию в мочу ионов водорода и калия.
Рис. 2. Схема строения нефрона и точки приложения диуретиков
Тиазидные диуретики в основном действуют на уровне проксимальных и дистальных канальцев нефрона через блокирование противотранспорта натрия и хлора, что ведет к осмотической задержке воды в нефроне и уменьшению объема циркулирующей плазмы в сосудистом русле.
Петлевые диуретики (фуросемид, этакриновая кислота и их производные) блокируют реабсорбцию хлора, что приводит к задержке натрия и облигатной задержке воды в нефроне.
Калийсберегающие диуретики (спиронолактон) являются блокаторами альдостерона в дистальном извитом канальце нефрона и собирательного канала почки, сохраняя при этом реабсорбцию калия, но способствуя выведению натрия и хлора с мочой и увеличивая диурез. Механизм действия амилорида и триамтерена несколько иной: эти диуретики осуществляют свой диуретический эффект сохранением концентрации калия в сыворотке через прямое ингибирующее воздействие на натрий в эпителии нефрона, без блокады альдостерона, поэтому эти диуретики могут «работать» без первичного и вторичного альдостеронизма [4].
Помимо диуретического эффекта, данный класс препаратов может оказывать ряд побочных отрицательных эффектов (нарушение водно–электролитно–щелочного баланса, повреждение форменных элементов крови), приводя к анемии, агранулоцитозу, тромбоцитопении, системным повреждениям в виде кожного васкулита, что в конечном итоге может вызвать сложные нарушения гемодинамики, вплоть до внезапной кардиогенной смерти или развитию печеночной комы. Возможные побочные эффекты диуретиков представлены в таблице 1.
Участие почки в регуляции насосной функции сердца и уровня артериального давления представлено на рисунке 3.
Рис. 3. Гипотетическая схема регуляции насосной деятельности сердца и артериального давления
Минутный объем сердца (МО) – интегральный показатель насосной деятельности сердца является производной величиной сократительного состояния миокарда (ударный объем) и частоты сердечных сокращений:
Одновременно МО контролируется объемом притекаемой крови к сердцу, т.е. объемом циркулирующей крови (ОЦК). ОЦК регулируется почкой через ренин–ангиотензин–альдостероновую систему. Включение ренин–ангиотензиновой системы осуществляется юкстагломерулярным аппаратом почек в результате снижения почечного кровотока в корковом слое, что ведет к выбросу ренина, который, в свою очередь, превращает ангиотензиноген в ангиотензин–1. Ангиотензин–1 под воздействием ангиотензинпревращающего фермента (АПФ) переходит в ангиотензин–2, являющийся мощным вазоконстриктором, стимулирующим рецепторы АТ сосудистой стенки. Воздействуя на кору надпочечников, ангиотензин–2 стимулирует синтез альдостерона, который снижает секрецию натрия в мочу в дистальных отделах собирательных почечных канальцев, приводя тем самым к задержке жидкости в сосудистом русле, т.е. увеличению ОЦК. В свою очередь, увеличение ОЦК ведет к увеличению МО. Одновременно увеличение концентрации натрия в крови способствует отеку сосудистой стенки, делает ее более чувствительной к прессорным агентам и способствует увеличению общего периферического сосудистого сопротивления (ОППС).
Уровень АД определяется произведением МО, как показателя насосной деятельности сердца, и ОПСС:
АД = МО x ОПСС, т.е.
АД = УО x ЧСС x ОПСС
ЧСС и сократительное состояние миокарда контролируется симпато–адреналовой системой через стимуляцию b –адренорецепторов, что приводит к учащению сердечного ритма и усилению сокращения миокарда, в конечном итоге – к увеличению УО.
Регуляция ОПСС осуществляется симпато–адреналовой системой (путем стимуляции a – и b –адренорецепторов) и ренин–ангиотензин–альдостероновой системой.
Распределение адренорецепторов в сердечно–сосудистой системе гетерогенно. В сердце преимущественно расположены b 1–адренорецепторы, в сосудистой стенке артерий и вен – a – и b 2–адренорецепторы. Стимуляция a – и b 2–адренорецепторов в венах вызывает повышение их тонуса, уменьшение емкости венозного русла, увеличение притока крови к сердцу и МО. Стимуляция b –адренорецепторов в артериях вызывает их сужение и повышение ОПСС. Стимуляция b 2–адренорецепторов в артериях вызывает вазодилатирующий эффект и снижает ОПСС.
ОППС зависит не только от тонуса артериального русла, но и от реологических свойств крови согласно упрощенной формуле Пуазейля:
ОПСС =( L x h ) / S , где
L – длина сосудов h – реологические свойства крови S – диаметр сосудов.
Реологические свойства крови определяются гематокритом (полицитемия), вязкостью крови (гиперлипидемия, гиперфибриногенемия, гипергликемия), подвижностью эритроцитов, агрегационным состоянием тромбоцитов и т.д.
Таким образом, имеют место 5 основных областей приложения терапевтических воздействий при лечении СН и АГ:
1) симпато–адреналовая система – блокада a – и b –адренорецепторов;
2) почки – диуретики;
3) ренин–ангиотензин–альдостероновая система – ингибиторы АПФ и блокаторы АТ1–рецепторов сосудов;
4) сосудистая система – периферические вазодилататоры, в частности, антикальциевые препараты;
5) реология крови – антиагреганты, гиполипидемические, сахароснижающие и т.п.
Современную кардиологию невозможно представить без b –адреноблокаторов, которых известно более 20 наименований, ингибиторов АПФ [5]. Однако в настоящее время диуретики занимают приоритетное место в лечении дилатационной кардиопатии и АГ.
При лечении АГ выделяют три основные цели: непосредственную, промежуточную и конечную [1,6,7].
Непосредственная цель антигипертензивной терапии – снижение АД до «нормального» уровня (< 130/85 мм рт.ст.), а при возможности – и «оптимального» уровня (< 120/80 мм рт.ст.).
Промежуточная цель – профилактика поражения органов–мишений (ЦНС, сердце, почки).
Конечная цель – улучшить качество и увеличить продолжительность жизни пациентов с АГ за счет профилактики или регресса сердечно–сосудистых осложнений.
Накопленный клинический опыт указывает, что тиазидные диуретики обладают достаточно высокой антигипертензивной активностью, не уступающей b –адреноблокаторам, антагонистам кальция, ингибиторам АПФ и a 1–адреноблокаторам. В многочисленных исследованиях показано, что при лечении тиазидными диуретиками систолическое АД снижается в среднем на 10–20 мм рт.ст., а диастоличесоке АД – на 5–15 мм рт.ст. [8–10].
Сравнительные исследования показали, что нет существенной разницы в антигипертензивной активности низких (< 25 мг гидрохлортиазида в день или эквивалентные дозы других препаратов) и высоких доз (>25 мг) тиазидных диуретиков. По сводным данным 31 исследования, высокие дозы тиазидных диуретиков снижают уровни АД в среднем на 18/11 мм рт.ст., а низкие дозы – на 13/9 мм рт.ст. В то же время низкие дозы диуретиков гораздо лучше переносятся пациентами и не сопровождаются существенными электролитными и метаболическими нарушениями [11].
В отличие от b –адреноблокаторов, диуретики одинаково эффективно предотвращают сердечно–сосудистые осложнения у больных АГ как среднего, так и пожилого возрастов. В 18 рандомизированных исследованиях, в которых диуретики и b –адреноблокаторы применялись при лечении АГ у больных старше 60 лет, было обнаружено, что диуретики эффективно предотвращают развитие первичных и повторных нарушений мозгового кровообращения [12]. Однако в отличие от b –адреноблокаторов диуретики более эффективны в профилактике риска развития ИБС и летальных исходов, что делает их препаратами первого ряда при начальной терапии АГ.
Таким образом, тиазидные диуретики назначаются в небольших дозах (не более 25 мг в сутки), обладают достаточно высокой антигипертензивной активностью и хорошей переносимостью. Это единственный класс антигипертензивных препаратов, о которых известно, что они способны улучшить отдаленный прогноз у больных АГ.
Тиазидные и тиазидоподобные диуретики можно условно разделить на два поколения. Первое поколение – производные бензотиадиазона (гидрохлортиазид и др.) и фтелимидина (хлорталидон и др.); второе поколение – производные хлорбензамида (индапамид и др.), которые по химической структуре представляют собой производное хлорбензамида, содержащее метилиндолиновую группу.
Гемодинамический эффект индапамидоподобных диуретиков обусловлен их фармакологическим действием. В частности, индапамид - умеренный салуретический диуретик, связанный с ингибированием реабсорбции Na + , Cl – , H + и в меньшей степени К + и Мg2 + в проксимальных и дистальных канальцах короткого сегмента нефрона. Одновременно индапамид устраняет избыточное содержание ионов натрия в сосудистой стенке (вследствие его высокой липофильности), повышает синтез простагландина Е2 и простациклина I2, угнетает приток ионов Са в гладкомышечные клетки сосудов, что вызывает их дилатацию и снижает их чувствительность к прессорным агентам (катехоламинам, тромбоксану). Суммарный гемодинамический эффект индапамидов проявляется в виде:
- вазодилатирующего действия
- уменьшения ОПСС
- снижения системного артериального давления
- изменения вязкостных свойств крови за счет ингибирования агрегационной активности тромбоцитов.
Воздействие индапамидов на АД без существенного влияния на диурез проявляется в суточной дозе 2,5 мг, при увеличении которой диуретический эффект становится доминирующим.
По своей гипотензивной активности индапамид превосходит в 30 раз действие спиронолактонов, в 100 раз – фуросемида и в 300 раз – хлорталидона при применении в сопоставимых дозах [13]. Одним из идентифицированных антигипертензивных эффектов индапамида является воздействие на почечную продукцию и высвобождение простагландинов, ингибирование образования сосудистого вазоконстриктора – тромбоксана. Под действием индапамида у больных эсенциальной артериальной гипертензией увеличивалось выделение простагландина Е2, обладающего вазодилатирующей активностью. In vitro был верифицирован эффект ингибирования индапамидом синтеза тромбоксана А2 в тромбоцитах человека и стимулирования выделения вазодилатирующего простациклина I2 [14].
Терапевтическая эффективность индапамидовых диуретиков продемонстрирована в ряде крупных рандомизированных исследований. Отмечена их способность профилактировать развитие ИБС за счет снижения массы миокарда при АГ. Это свойство, нетипичное для других классов диуретиков, делает индапамид уникальным препаратом с кардиопротективным действием, выраженность которого не уступает b –адреноблокаторам и ингибиторам АПФ.
Особое внимание привлекает тот факт, что индапамидоподобные диуретики не обладают синдромом «отмены», не вызывают побочных метаболических нарушений: не оказывают отрицательного влияния на обмен глюкозы и уровень липидов крови. В исследованиях последних лет показано, что индапамид способствует нормализации глюкозного обмена у диабетиков 2 типа, профилактируя диабетическую нефропатию. Аналогичная закономерность отмечена при исследовании обмена холестерина и триглицеридов у пациентов с дислипопротеинемией. Индапамид снижает уровень атерогенного холестерина низкой плотности и триглицеридов, одновремено увеличивая концентрацию липопротеидов высокой плотности [15].
Таким образом, индапамид, сочетая в себе все положительные фармакодинамические, фармакокинетические и экономические достоинства, при отсутствии побочных эффектов других диуретиков, является препаратом, перспективным в плане терапевтической тактики у больных АГ и хронической сердечной недостаточностью.
ХСН довольно часто является следствием синдрома артериальной гипертензии и остается одной из главных причин в структуре причин инвалидизации и летальности от сердечно–сосудистой патологии. В настоящее время средствами выбора в лечении ХСН с систолической дисфункцией ЛЖ являются ингибиторы АПФ, а при диастолической дисфункции – диуретики. В основе ХСН у большинства больных АГ имеет место нарушение диастолической и систолической функции ЛЖ, поэтому наиболее перспективным является комбинированное лечение ингибиторами АПФ и диуретиками. С учетом вышеизложенного для лечения ХСН предпочтение должно отдаваться тиазидоподобным диуретикам – индапамидам с умеренным по силе и длительным по продолжительности действием [16]. Индапамид, снижая уровень внутриклеточного кальция, сохраняя содержание магния, уменьшает ригидность сосудистой стенки и способствует более эффективной релаксации кардиомиоцита в диастолу. При этом увеличивается синтез простациклинов, уменьшается агрегация тромбоцитов и выброс тромбоксана А2, что суммарно оказывает положительный гемодинамический эффект за счет уменьшения постнагрузки для ЛЖ.
Индапамид, улучшая микроциркуляцию в почке, устраняет микроальбуминурию, являющуюся маркером генерализованного поражения сосудов и предиктором сердечно–сосудистых и почечных осложнений.
Таким образом, использование диуретиков, в частности, индапамидоподобных, является актуальным и перспективным в профилактике и лечении АГ и ХСН.
1. Преображенский Д.В, Сидоренко Б.А. Дифференциальная медикаментозная терапия при артериальной гипертензии. Сonsilium Medicum. 2001. Т 3, 10, стр. 83
2. Преображенский Д.В., Сидоренко Б.А., Шатунова И. М., Марьенич А.В. Место диуретиков в лечении АГ. Индап. Москва, 2000.
3. Smith T.W., Brannwald E. The management of heart failure // Heart Disease. 1984. 587.
4. Grantham J.J., Chonko A.M. The physiological basis and clinical use of diuretics. Sodium and Water Homeostasis. New York, 1978, 179.
5. Шилов А.М., Князева С.А., Ушакова М.В. Бета–блокаторы в лечении АГ. Российские медицинские вести. 2001, VI, 4, стр. 31.
6. Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. // Arch. Intern. Med. 1997, V 157, 213.
7. Евсиков Е.М. Индапамид – современный гипотензивный препарат с сочетанием механизмов действия. Индап. Москва. 2000. 26.
8. Stimpel M. Arterial hypertension. Berlin – New York, 1996, 8.
9. Kaplan N.M. Clinical hypertension. 7 edition. Baltimore, 1998.
10. Opie L.H. Drugs for the heart. 4–edition. Philadelphia, 1995.
11. Ames R.P. A comparison of blood lipid and blood pressure responses during the treatment of systemic hypertension with indapamide and with thriazides. // Amer. J. Cardiol. 1996, 77, 128 – 168.
12. Psaty B., Smith N.L., Siscovick D.S. and all. Health outcomes associated with antihypertensive therapies used as first–line agents. A systematic review and meta–analysis. JAMA, 1997, 277, 739.
13. Ogilvie R.I. Diuretic treatment in essential hypertension. // Current Medical Research and Opinion. 1983, N8, 53.
14. Gbeassor F.M., Grose J.H., Le Bel M. Influence of diuretics on prostaglandin and thromboxane synthesis. // Clin. and Invest. Med., 1982, N5. 26.
15. Passeron J., Panly N., Despart J. International multicentre study of indapamide in the treatment of essential arterial hypertension. Postgrad. // Med. J., 1981, V 57, 53.
16. Куимов А.Д., Ложкина Н.Е., Казина Н.П. Лечение больных ХСН с синдромом АГ индапамидом в капсулированной форме и эналаприлом. Индап. Москва. 2000. 77.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
- Морфология болезни Иценко-Кушинга и ее клиника
- Показания для операции при рассекающем остеохондрите локтевого сустава
- Первичные опухоли неизвестной локализации - частота, патогенез
- Порог ощущения вестибулярного аппарата. Калорический раздражитель вестибулярного анализатора
- Диагностика синдрома Стерджа-Вебера на МРТ, КТ
