Профилактика поражений яичников при лучевой и химиотерапии. Лекарства
Добавил пользователь Алексей Ф. Обновлено: 20.01.2026
Химиопрепараты играют важную роль в лечении многих онкологических заболеваний, но обладают побочными эффектами. Например, циклофосфамид, который часто назначают при раке молочной железы, истощает репродуктивный потенциал яичников, что может привести к женскому бесплодию. Ученые обнаружили, что защитить яичники может эверолимус — препарат, который также используют для замедления роста опухолей.
Исследователи провели эксперимент на мышах и выяснили, что животные, которым давали химиопрепараты вместе с эверолимусом, в дальнейшем имели вдвое больше потомства, чем те, которым давали только химиотерапию.
Важен тот факт, что эверолимус — не новый препарат, его уже применяют у людей. А значит, в перспективе его получится быстрее, без многочисленных дорогих испытаний, внедрить в клиническую практику.
Кара Голдман (Kara Goldman), репродуктивный эндокринолог, доктор медицинских наук и первый автор исследования, отмечает:
Эверолимус может защитить репродуктивную функцию и стать альтернативой замораживанию яиц и эмбрионов — это ценные методы, но они дорогие, отнимают много времени, становятся менее эффективными с возрастом и не нормализуют работу яичников.
Молодые женщины, которым нужна химиотерапия, сталкиваются с тяжелым выбором. На одной чаше весов лечение, которое помогает спасти жизнь, на другой — способность в будущем иметь ребенка. Онкологи нуждаются в новых возможностях, которые помогали бы находить золотую середину.
Как это работает?
Механизм действия циклофосфамида состоит в том, что он повреждает ДНК быстро размножающихся, в частности, раковых, клеток. Но препарат обладает еще одним эффектом: он активирует в клетках яичников молекулярный сигнальный путь mTOR. Это заставляет клетки в фолликулах быстро размножаться — и их ДНК, как и у раковых клеток, становится мишенью для циклофосфамида. В итоге запасы яйцеклеток истощаются, наступает ранняя менопауза, женщина не может иметь потомство.
Эверолимус блокирует сигнальный путь mTOR и защищает яичники от истощения.
В ходе эксперимента ученые разделили мышей на 3 группы. Первой группе давали только химиопрепарат, второй — химиопрепарат в сочетании с эверолимусом, третьей — химиопрепарат в сочетании с другим блокатором mTOR — экспериментальным препаратом INK128.
Мыши, которые получали циклофосфамид в сочетании с одним из ингибиторов mTOR, в дальнейшем в среднем имели по 7,4 мышат, а те, которые получали только химиотерапию — по 3,4.
Новые перспективы открываются не только в онкологии
Все яйцеклетки в яичниках женщины закладываются еще до рождения и сохраняются на всю жизнь — новые уже не образуются. Существует такое понятие, как овариальный резерв — от него зависит способность женщины иметь детей.
У некоторых женщин уже к 40 годам истощается овариальный резерв и наступает менопауза, даже если они не получали химиотерапию. Возможно, в этом случае блокаторы mTOR тоже могли бы принести пользу.
Если дальнейшие испытания пройдут успешно, ученые планируют внедрять блокаторы mTOR в клиническую практику уже в следующем году.
Профилактика поражений яичников при лучевой и химиотерапии. Лекарства
Влияние химиотерапии на яичники. Факторы риска бесплодия
Степень токсического поражения половых желез, вызванная химиотерапией, варьирует.
Гистологические исследования ткани яичников после лечения цитотоксичными препаратами показывают большое разнообразие повреждений: от уменьшения количества фолликулов до их отсутствия и фиброза. Частоту нарушения функций яичников под воздействием проведенной химиотерапии трудно установить с достаточной точностью, поскольку токсическое действие на яичники оказывают и многие другие факторы.
Цитотоксические препараты могут повреждать созревающие фолликулы, примордиальные фолликулы, нарушать созревание фолликулов или оказывать комбинированное воздействие. Поражение созревающих фолликулов приводит к временной аменорее, тогда как поражение примордиальных фолликулов — к постоянной аменорее вследствие нарушения функций яичников.
Считают, что первичной мишенью отдельных цитотоксических препаратов бывают или гранулезные клетки яичника, или ооциты. Трудно точно сказать, что именно страдает в первую очередь, поскольку структурное и функциональное взаимодействие зернистых клеток яичника с ооцитами настолько тесное, что разрушение одного типа клеток приводит к поражению другого.

Нарушение менструального цикла, происходящее после химиотерапии, не всегда бывает прямым результатом токсического воздействия лекарственных препаратов на яичники. Тяжелое заболевание, недостаточность питания, психический и физический стресс могут стать причиной нарушения функций гипоталамо-гипофизарно-яичниковой системы. Кратковременные нарушения менструального цикла также чаще бывают результатом поражения растущих, а не примордиальных фолликулов.
Поражение всех развивающихся фолликулов задерживает менструацию, по меньшей мере, на 3 мес, поскольку примордиальный фолликул достигает стадии овуляции приблизительно за 85 дней.
Наиболее значимые факторы риска поражения половых желез — возраст больной, класс медикаментозного препарата и кумулятивная доза препарата. Риск поражения половых желез увеличивается с возрастом женщины. Скорее всего, это обусловлено малочисленностью сохранившихся ооцитов у женщин старшего возраста по сравнению с более молодыми.
По данным одного исследования, у пациенток, страдающих болезнью Ходжкина и получавших новэмбихин (мехлоретамин), винкристин, прокарбазин и преднизон (так называемый метод МОПП), последующая аменорея возникала у 20% женщин моложе 25 лет в сравнении с 45% женщин в возрасте 25 лет и старше. По данным другого исследования, частота ПЯН после химиотерапии по методу МОПП составила 61%.
Различные цитотоксические химиотерапевтические препараты имеют разную степень гонадотоксичности. Неспецифические цитостатики, применяемые при химиотерапии, считают более гонадотоксичными, чем специфические. У женщин, получающих высокие дозы алкилирующих неспецифических цитостатиков (в высокой степени гонадотоксичных), применяемых при химиотерапии, возникает наибольший риск возникновения ПЯН. В этой группе цитостатиков наиболее гонадотоксичным препаратом считают циклофосфамид.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Одной из первых стратегий, ставивших целью смоделировать ситуацию перед менархе, было назначение агонистов люлиберина. Она основана на наблюдении, отмечающем, что яичники девочек до полового созрения меньше реагируютк цитотоксическим препаратам, чем яичники взрослых женщин.
Существует гипотеза о том, что подавление ФСГ и повышение содержания ЛГ будет подавлять созревание фолликулов в яичнике и их пустое использование. Другие метоы основаны на особенностях протективного эффекта снижения кровоснабжения яичников, являющегося вторичным относительно вызванного лечением снижения концентрации эстрогенов или прямого воздействия на гонады через сфингозин-1-фосфат, или сохранении зародышевых стволовых клеток.
Этот способ был наиболее подробно изучен на приматах. В проспективном рандомизированном исследовании на макаках резус было установлено, что назначение агонистов люлиберина предупреждает повреждения, вызываемые циклофосфамидом, который используют при химиотерапии.
Ряд исследований применения этого способа у женщин также дал обнадеживающие результаты. В самом объемном из них при изучении историй болезни 90 женщин, больных лимфомой, которые получали химиотерапию и агонисты люлиберина, было установлено, что раннее нарушение функций яичников развилось в 7% наблюдений в сравнении с 30% наблюдений у женщин, которые получали только химиотерапию. Аналогичные результаты были получены в других исследованиях. В одном небольшом проспективном контролируемом исследовании было обнаружено, что у 18 женщин лечение агонистами люлиберина оказалось неэффективным для профилактики преждевременной яичниковой недостаточности (ПЯН).
Важнейший недостаток этих исследований заключается в том, что они основывались на историях болезни. Поскольку для контроля необходимо изучение катамнеза, а в дальнейшем больные продолжали получать курсы лечения, трудно разобраться в том, было ли вызвано снижение частоты нарушения функций яичников в изучаемой группе назначением агонистов люлиберина или недостаточно длительным наблюдением.

Некоторые исследователи задавались вопросом о роли супрессии гонад агонистами люлиберина в сохранении функций яичников у восприимчивых к лечению пациенток. Исследования показали, что рост и развитие примордиальных фолликулов инициируются посредством неизвестного механизма, независимого от гонадотропина. Яичники человека восприимчивы к люлиберину-1, но его физиологическая или фармакологическая роль неясна. Однако в 80% наблюдений рак яичников, несомненно, восприимчив к люлиберину, и назначение как агонистов, так и антагонистов люлиберина приводило к задержке роста раковых клеток.
Следовательно, вполне возможно, что аналоги люлиберина сохраняют только развивающиеся фолликулы, которые составляют менее 10% всего количества фолликулов в яичнике в любой конкретный момент. Если рост фолликула инициирован, он заканчивается либо овуляцией, либо атрезией. Вполне возможно, что введение в курс лечения агонистов люлиберина, которые «откладывают разрешение судьбы» фолликулов, создает впечатление о продолжении функционирования яичника в течение довольно короткого срока.
Наконец, есть наблюдения, позволяющие предположить, что терапия а-ГнРГ неэффективна у детей в препубертатном возрасте, у которых в случае назначения химиотерапии в больших дозах все же развивается яичниковая недостаточность. Meirow предположил, что поскольку у более молодых женщин существует больший резерв яичников, они избегают поражения яичников. Это не означает, что половые железы не повреждаются химиотерапией, просто у пациентки имеется достаточное количество ооцитов, чтобы нарушения функций яичников не наступили немедленно. Приведенные выше аргументы и контраргументы нуждаются в проведении проспективного рандомизированного исследования, которое позволит оценить эффективность лечения аналогами люлиберина как потенциального способа сохранения фертильности.
Пероральные контрацептивы и прогестины для защиты яичников. К сожалению, супрессивная терапия различными пероральными стероидами, используемыми в качестве пероральных контрацептивов, или прогестинами, не показала себя эффективной в профилактике повреждений, причиняемых химио- или лучевой терапией.
Ингибиторы апоптоза для защиты яичников. Торможение пусковых механизмов апоптоза потенциально способно остановить процесс апоптоза и защитить пациентку от преждевременной яичниковой недостаточности (ПЯН). Апоптоз играет существенную роль в динамике развития зародышевых клеток. К тому же под воздействием химиотерапевтических лекарственных средств апоптоз может искаженно активизироваться.
Сфингозин-1-фосфат считается примером ингибитора апоптоза. Церамид — сфинголипид, который считают «сигнальным знаком запуска» апоптоза в ответ на стресс. В одном из исследований было продемонстрировано, что ооциты мышей при нехватке энзима для синтеза церамида, кислотной сфингомиелиназы, и яичники полевых мышей, которых лечили сфингозин-1-фосфатом, противостояли возникновению апоптоза при воздействии доксорубицина.
Маркеры поражения яичников. Влияние лучевой терапии
Преждевременная яичниковая недостаточность (ПЯН) не всегда возникает у пациенток, получавших комбинированное лечение химиотерапевтическими препаратами, независимо от их возраста и типа химиотера-певтических агентов. Большинство молодых женщин с болезнью Ходжкина, лечившихся несколькими химиотерапевтическими препаратами и получавших лучевую терапию на области, исключающие яичники, сохраняли способность к деторождению, хотя их репродуктивные функции и начинали снижаться раньше, чем в контрольной группе.
Сывороточные маркеры поражения яичников. Концентрации ингибина В, АМГ и ФСГ используют как маркеры для определения нарушения функций яичников после проведения химиотерапии, хотя ни один из них нельзя считать идеальным показателем. Ингибин В и АМГ синтезируются зернистыми клетками яичников, ФСГ секретируется в гипофизе, ингибируется эстрадиолом и ингибином В. Повышение содержания ФСГ в сыворотке крови и снижение концентрации ингибина В и АМГ отражают угнетение функций яичников у выживших онкологических больных даже при наличии регулярных менструаций.
Химиотерапия при онкологических заболеваниях связана с транзиторным подавлением ингибина В у девочек в препубертатном возрасте. Следовательно, чувствительные к изменениям показатели концентраций ингибина В и ФСГ — потенциальные маркеры гонадо-токсичного эффекта химиотерапевтических препаратов у девочек в препубертатном периоде.
УЗИ-маркеры поражения яичников. Другим методом определения состояния яичников у таких пациенток служит УЗИ, при котором определяют объем яичников и количество антральных фолликулов. У пациенток, перенесших онкологические заболевания, с нормальными функциями яичников нередко обнаруживают нормальное количество антральных фолликулов, хотя яичники у них часто имеют меньший размер, чем в контрольной группе.
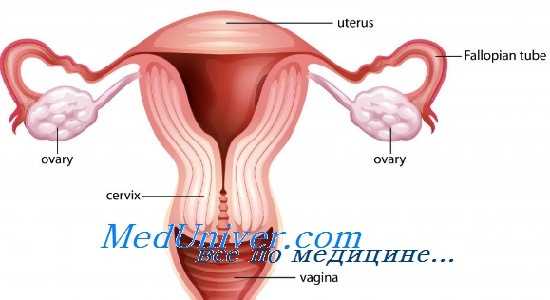
Влияние лучевой терапии на яичники
Лучевая терапия области малого таза повреждает как яичники, так и матку. Поражение яичников при лучевой терапии приводит к снижению репродуктивной функции и ПЯН. Поражения матки, вызванные лучевой терапией, проявляются нарушением роста эндометрия и олигоменореей. Это может существенно повлиять на последующие беременности.
При воздействии ионизирующей радиации наиболее уязвимыми оказываются фолликулы яичников ввиду воздействия на ДНК. Лучевая терапия приводит к атрофии яичников и уменьшению запаса фолликулов. В результате воздействия радиации происходит прогрессивное повышение содержания ФСГ и ЛГ и снижение концентрации эстрадиола в течение 4-8 нед после лучевой нагрузки.
На клеточном уровне облучение ооцитов сказывается на состоянии клеток и приводит к стремительно развивающемуся пикнозу, уплотнению хромосом, разрушению ядерной оболочки и вакуолизации цитоплазмы. Необратимость этих повреждений принято объяснять недостаточным количеством зарождающихся стволовых клеток в яичнике.
Однако недавние исследования показали присутствие зарождающихся стволовых клеток в яичниках у взрослых женщин, что доказывает способность ооцитов к восстановлению после окончания химио- или лучевой терапии.
Онкологические больные после лучевой терапии тазовой области или всего туловища относятся к группе повышенного риска по ПЯН. Степень поражения яичников связана с возрастом пациенток и общей дозой облучения яичников. Доза облучения 12 грэй (Гр; 1 рад = 1 сГр) приводила к стойкой яичниковой недостаточности у девочек в препубертатном периоде, в то время как доза всего 2 Гр давала такой же результат у женщин старше 45 лет. Обычно полагают, что однократной дозы от 6,5 до 8,0 Гр достаточно для развития стойкой яичниковой недостаточности у большинства женщин в постпубертатном периоде.
Процент уменьшения запаса примордиальных фолликулов в яичниках при лучевой терапии, направленной на область яичников, зависит от полученной дозы. Считают, что уже сравнительно малая доза облучения (3 Гр) достаточна для поражения 50% всех ооцитов у молодых женщин детородного возраста.
Проведен ряд исследований для определения зависимости поражения яичников от полученной дозы излучения у 90% пациенток в возрасте 15-17 лет. Когда средняя доза радиации, воздействовавшей на яичники, составляла 1,2 Гр, сохранялись функции яичников, тогда как при средней дозе 5,2 Гр функции яичников сохранялись только у 60% пациенток. Истощение яичников развивается практически у всех пациенток при воздействии на область таза облучения в дозах, необходимых для лечения рака шейки матки (85 Гр), рака прямой кишки (45 Гр) или общего облучения всего тела с пересадкой костного мозга (от 8 до 12 Гр на яичники). Если проводят также химиотерапию, доза облучения, вызывающая ПЯН, снижается.
Угнетение функций яичников происходит даже в тех случаях, когда облучение не направлено непосредственно на область яичников. Кратковременная лучевая терапия, направленная на периаортальные лимфатические узлы при лечении болезни Ходжкина, дает рассеянное облучение яичников дозой 1,5 Гр, в ближайшее время функции яичников при этом не нарушаются. Влияние этой дозы на развитие отдаленных по времени нарушений функций яичников остается менее ясным. Важно обсудить с онкологом, будет терапевтическая доза облучения направлена непосредственно на яичники или она будет рассеянной.
Химиотерапия рака яичника
Предполагается большая операция — с удалением не только обоих яичников, но и матки с трубами, и как фартук покрывающего органы брюшной полости, большого сальника. Вмешательство называется циторедуктивным, то есть с удалением всех обнаруженных опухолевых узлов, при невозможности полного удаления новообразования ограничиваются частичным, что значительно улучшает результат последующей химиотерапии.

Тактика лечения рака яичников
Рак яичников имеет несколько особенностей:
- Во-первых, опухолевые узлы возникают не только в яичниках, но и по брюшине. Распространение раковых клеток идёт по крови, лимфе и внутрибрюшной жидкости. При любом удалении от первоисточника образования в брюшной полости не считаются отдалёнными метастазами — это 3 стадия. Метастазы вне брюшной полости, к примеру, в лимфоузлах паха или в пупке, меняют стадию заболевания на 4.
- Во-вторых, выпот в брюшную полость или раковый асцит может быть при любой стадии заболевания и совсем не означает запущенного процесса, не влияет на стадию, но всегда констатируется дополнением литеры «С», например, стадия 1С или 2С.
- Третья особенность, опухолевые узлы можно удалять даже кусочками, что совершенно недопустимо при всех остальных злокачественных новообразованиях, поскольку способствует рассеиванию раковых клеток. Уменьшение общей массы рака яичников повышает эффективность химиотерапии.
Вот на этой особенности и базируется хирургическая тактика с максимальной задачей — удалить всё злокачественное, когда это не удаётся, можно получить вполне хороший общий терапевтический результата, если останутся узелки размером менее сантиметра.
При самой минимальной стадии с низкой степенью злокачественности, когда женщина хочет сохранить возможность выносить и родить ребёнка, удаляется придаток с больным яичником и часть второго, резецируется сальник.
В каких ситуациях химиотерапия проводится до операции?
Циторедуктивная операция не выполняется при большой опухоли, неподвижной относительно внутренних стенок таза, что означает прорастание ракового конгломерата в кости. Операция невозможна технически, внутри таза находятся мочевой пузырь и прямая кишка, проходят крупные нервные стволы и магистральные сосуды, они тоже впаиваются в раковый узел, из которого их вычленить просто невозможно. В этой ситуации лечение начинают с химиотерапии, которую называют индукционной, после 2–3 курсов опухоль уменьшается и становится операбельной.
В каких случаях после операции не проводят химиотерапию?
Практически всегда после удаления рака яичников вне зависимости от того, остались ли в брюшной полости опухолевые узлы или всё было удалено, проводится химиотерапия. Исключение делается только при минимальном высокодифференцированном раке 1 стадии из несветлоклеточного типа клеток, то есть когда опухоль поражает один или оба яичника, но не вышла за его пределы и не проросла поверхностную капсулу, без признаков асцита. В медицинских документах такое положение обозначается как стадия 1А или 1В.
При более агрессивном варианте рака яичников со степенью злокачественности G2 или G3, а также при светлоклеточной форме при 1А и 1В стадий проводится 6 курсов химиотерапии.
При всех остальных стадиях всегда показана послеоперационная 6-курсовая химиотерапия, а если противоопухолевое лечение проводилось до хирургического вмешательства, то суммарное число курсов должно быть кратно шести.

Какие препараты используются?
Эффективны около десятка лекарственных препаратов, но в схемах первой линии используется шесть лекарств. В комбинацию вводят не более двух цитостатиков, как правило, это препарат таксанового ряда и производное платины.
Из таксанов предпочтение отдаётся паклитакселу, доцетаксел обладает чуть более выраженной токсичностью при чуть меньшей результативности и по факту применяется при непереносимости паклитаксела.
Паклитаксел может вводиться меньшими дозировками еженедельно или однократно в большей дозе, что не отражается на результате лечения, но переносимость малых доз лучше. Введение паклитаксела в течение нескольких дней курса в небольшой дозе называется метрономной химиотерапией, предполагается, что при таком способе клетки рака не вырабатывают устойчивости к лекарству, что не получило подтверждения в клинической практике.
Оба платиновых производных карбоплатин и цисплатин одинаково эффективны, но осложнения при химиотерапии вызывают разные. Карбоплатин негативно воздействует на клетки крови, цисплатин — на почечные канальцы, и оба лекарственных средства повреждают периферическую нервную систему. Длительность введения цисплатина втрое дольше, чем карбоплатина.
Стандарты предусматривают проведение ослабленным пациенткам или отягощённым хроническими заболеваниями монотерапии карбоплатином или комбинацией цисплатина с доксорубицином и циклофосфаном.
При малочувствительном к лекарствам муцинозном и светлоклеточном раке тоже используют цисплатин или оксалиплатин в сочетании с другими цитостатиками.
Сколько курсов химиотерапии назначают при раке яичников
Оптимальное число курсов всегда неизменно — шесть с интервалом в 3 недели.
Если химиотерапевтическое лечение проводилось до операции, то общее число должно быть кратно 6, в случае нарастающей после каждого курса регрессии опухоли можно довести и до 8 суммарных курсов. Если при 4 стадии достигается регрессии или стабилизация процесса, то тоже ограничиваются шестью курсами с последующим наблюдением.
Применяются ли при заболевании таргетные препараты?
Пациенткам с 3 и 4 стадиями заболевания показано лечение таргетным препаратом бевацизумабом, ухудшающим кровоснабжение опухоли. Но при 3 стадии препарат вводится в схему только в случае неполной циторедукции, когда в брюшной полости остаются узлы более сантиметра, или вовсе не было операции. Бевацизумаб начинают вводить с 1–2 курса каждые 3 недели не меньше года или до появления признаков возобновления роста раковых узлов.
Обязателен бевацизумаб при рецидиве рака яичников, если он возник не во время использования таргетного препарата.
Когда полезно внутрибрюшинное введение химиопрепаратов?
При злокачественном процессе, сопровождающемся выработкой жидкости в брюшной полости, для улучшения состояния пациентки иногда требуется удаление избыточного асцита. Поскольку заболевание чувствительно к цитостатикам, после удаления асцита внутрь полости вводят химиопрепарат. Брюшная полость покрыта слизистой оболочкой, которая отлично всасывает лекарство, поэтому можно добиться быстрого результата.
В клинических исследованиях доказано, что внутрибрюшинное введение химиопрепаратов также эффективно, как и внутривенное. В стандарт послеоперационного лечения 3 стадии заболевания, когда остаточные опухоли не превышают сантиметрового размера, включено чередование внутрибрюшинного введения цисплатина и паклитаксела, причём последний вводится ещё и внутривенно в первый день каждого курса. Для такого многомесячного лечения во время циторедуктивной операции в брюшную полость устанавливается инфузионная порт-система.

Химиотерапия при рецидиве рака яичника
При возобновлении опухолевого роста, что регистрируется объективными методами исследования, например УЗИ, решается вопрос о проведении лекарственной терапии. Если при обследовании не находят новых узлов или увеличения размеров старых, а отмечается только двукратное увеличения уровня маркёра СА125, то пациентка просто наблюдается до появления признаков прогрессии заболевания.
- При развитии рецидива более чем через полгода после завершения последнего курса, в схему включается платиновый препарат и лекарство, не использовавшееся при первичном лечении.
- Если рецидив возник раньше полугода, опухоль считается устойчивой к платиновым производным, поэтому полезнее использовать лекарство, ранее не входившее в комбинацию.
- Если после завершения послеоперационной химиотерапии прошло более года, то эффект можно получить при использовании той же комбинации лекарств, что применялась раньше.
Разумеется, что во всех случаях рассматривается возможность оперативного лечения рецидивного процесса.
Химиотерапия сопровождается осложнениями, их можно уменьшить, если до начала лечения провести медикаментозную подготовку, а после завершения курса — реабилитационные мероприятия, и всё время осуществлять нутритивную поддержку — специальную диету, учитывающую исходное состояние, возможности тканей к восстановлению и сопротивляемости. В клиниках «Евроонко» решают все клинические и диагностические проблемы, мы заинтересованы в хорошем результате не меньше наших пациентов.
Читайте также:
- Глиома носа - лучевая диагностика
- Осмотическая резистентность эритроцитов в норме. Биохимические исследования в гематологии
- Выраженная артериальная гипертензия. Лечение артериальной гипертензии.
- Гистоморфология образования средостения. Дифференциация злокачественных опухолей средостения
- КТ, цистография при травме мочевого пузыря
