Промежуточные филаменты хрусталика
Добавил пользователь Alex Обновлено: 29.01.2026
Виментин представляет собой структурный белок, который у человека кодируется геном VIM . Его название происходит от латинского vimentum, что относится к массиву гибких стержней.
Виментин представляет собой белок промежуточного филамента (IF) типа III , который экспрессируется в мезенхимальных клетках. Белки ПФ обнаружены во всех клетках животных, а также в бактериях. IF, наряду с тубулином, микротрубочками и актиновыми микрофиламентами, составляет цитоскелет. Все белки IF экспрессируются в высокой степени регулируемым путем развития; виментин является основным цитоскелетным компонентом мезенхимальных клеток. Из-за этого виментин часто используется в качестве маркера мезенхимальных клеток или клеток, претерпевающих эпителиально-мезенхимальный переход (EMT) как во время нормального развития, так и во время метастатической прогрессии.
Содержание
- 1 Структура
- 2 Функция
- 3 Клиническая значимость
- 4 Взаимодействия
- 5 Ссылки
- 6 Дополнительная литература
- 7 Внешние ссылки
Структура
Мономер виментина, как и все другие промежуточные филаменты, имеет центральный α-спиральный домен, закрытый на каждом конце не- спиральным амино (головной) и карбоксильным (хвостовым) доменами.. Два мономера, вероятно, ко-трансляционно экспрессируются таким образом, чтобы облегчить их образование димера спиральной спирали, который является основной субъединицей сборки виментина.
α-спиральные последовательности содержат структуру гидрофобных аминокислот, которые способствуют образованию «гидрофобного уплотнения» на поверхности спирали. Кроме того, существует периодическое распределение кислотных и основных аминокислот, которое, по-видимому, играет важную роль в стабилизации димеров спиральной спирали. Расстояние между заряженными остатками является оптимальным для ионных солевых мостиков, что позволяет стабилизировать структуру α-спирали. Хотя этот тип стабилизации является интуитивно понятным для внутрицепочечных взаимодействий, а не для межцепочечных взаимодействий, ученые предположили, что, возможно, переход от внутрицепочечных солевых мостиков, образованных кислотными и основными остатками, к межцепочечным ионным ассоциациям, способствует сборке филамента.
Функция
Виментин играет важную роль в поддержке и закреплении положения органелл в цитозоле. Виментин прикрепляется к ядру, эндоплазматическому ретикулуму и митохондриям либо латерально, либо окончательно.
Динамическая природа виментина важна, когда предлагая ячейке гибкость. Ученые обнаружили, что виментин придает клеткам устойчивость, отсутствующую в сетях микротрубочек или актиновых филаментов, когда они подвергаются механическому стрессу in vivo. Таким образом, в целом считается, что виментин является компонентом цитоскелета, ответственным за поддержание целостности клетки. (Было обнаружено, что клетки без виментина чрезвычайно чувствительны при воздействии микропунктуры.) Трансгенные мыши, у которых отсутствует виментин, выглядели нормальными и не демонстрировали функциональных различий. Возможно, что сеть микротрубочек могла компенсировать отсутствие промежуточной сети. Этот результат подтверждает тесное взаимодействие между микротрубочками и виментином. Более того, когда присутствовали деполимеризаторы микротрубочек, происходила реорганизация виментина, что еще раз указывает на взаимосвязь между двумя системами. С другой стороны, раненые мыши, у которых отсутствует ген виментина, заживают медленнее, чем их аналоги дикого типа.
По сути, виментин отвечает за поддержание формы клеток, целостность цитоплазмы и стабилизацию взаимодействий с цитоскелетом. Было показано, что виментин устраняет токсичные белки в JUNQ и IPOD телец включения при асимметричном делении клеточных линий.
млекопитающих. Кроме того, обнаружено, что виментин контролирует транспорт липопротеин низкой плотности, ЛПНП, холестерин из лизосомы в место этерификации. При блокировании транспорта холестерина, полученного из ЛПНП, внутри клетки было обнаружено, что клетки накапливают гораздо более низкий процент липопротеина, чем нормальные клетки с виментином. Эта зависимость, по-видимому, является первым процессом биохимической функции в любой клетке, который зависит от клеточной сети промежуточных филаментов. Этот тип зависимости имеет разветвления на клетки надпочечников, которые зависят от эфиров холестерина, полученных из ЛПНП.
Виментин играет роль в формировании агресомы, где он образует клетку, окружающую ядро агрегированного
Клиническая значимость
Он был использован в качестве саркомы маркера опухоли для идентификации мезенхимы.
Метилирование виментина Ген был установлен как биомаркер рака толстой кишки, и он используется при разработке фекальных тестов на рак толстой кишки. Статистически значимые уровни метилирования гена виментина также наблюдались при некоторых патологиях верхних отделов желудочно-кишечного тракта, таких как пищевод Барретта, аденокарцинома пищевода и рак желудка кишечного типа. Высокие уровни метилирования ДНК в промоторной области также были связаны с заметным снижением выживаемости при гормон-положительном раке молочной железы. Подавление виментина было выявлено при кистозном варианте папиллярной карциномы щитовидной железы с использованием протеомного подхода. См. Также антитело к цитруллинированному белку для его использования в диагностике ревматоидного артрита.
Промежуточные филаменты хрусталика
Промежуточные филаменты хрусталика
• Хрусталик глаза содержит два специфических белка промежуточных филаментов, СР49 и филензин, которые входят в VI группу гомологичных последовательностей
• Эти специфические белки промежуточных филаментов сохранили свою структуру в процессе эволюции позвоночных
Клеткам хрусталика глаза позвоночных свойственны крайне жесткие критерии программы дифференцировки, что необходимо для последующего правильного функционирования ткани. Клетки должны:
• Обладать достаточной упругостью и в то же время эластичностью, которая допускает аккомодацию хрусталика.
• Сохранять полную прозрачность для того, чтобы не затемнять хрусталик.
• Сохранять перечисленные качества на протяжении всей жизни организма.
В клетках хрусталика содержатся два специфических белка, которые образуют «филаменты типа бус». Такое название они получили за характерный профиль поверхности, видимый в электронном микроскопе (остальные промежуточные филаменты имеют гладкую поверхность).
Эти белки называются СР49 (или факинин) и филензин. Они относятся к белкам VI типа. Оба белка имеют структурные характеристики, свойственные другим типам белков, однако их последовательности не гомологичны ни одной последовательности среди белков остальных групп.
Одним из наиболее существенных различий является наличие у них «знаковой» последовательности, свойственной белкам промежуточных филаментов, а именно последовательности на конце спирального участка. У CP49 на конце стержнеобразного домена находится последовательность Tyr-His-Gly-Ile-Leu-Asp-Gly-Glu, в то время как у других белков промежуточных филаментов на этом месте присутствует консервативная последовательность Tyr-Arg-Lys-Leu-Leu-Glu-Gly-Glu.
Гены, кодирующие СР49 и филензин, сильно отличаются от генов, кодирующих другие белки промежуточных филаментов. Такое своеобразие этих генов дает им селективное преимущество перед соответствующими генами других клеток, поскольку высоко гомологичные белки хрусталика сохраняются у всех позвоночных.
Последовательность, соответствующая CP49/факинину, обнаружена в геноме сростночелюстной рыбы Fugu ribripes, позвоночного организма, эволюционно очень далеко отстоящего от млекопитающих. Консервативность структуры проявляется даже у специфической последовательности, находящейся на конце спирального участка СР49/факинина.
Белки клеток хрусталика проявляют особые свойства в силу ряда причин. Во-первых, они обеспечивают развитие максимально прозрачного хрусталика. Во-вторых, поскольку хрусталик должен функционировать в течение всей жизни организма, его полимерные структуры должны обладать исключительной биохимической устойчивостью с тем чтобы не допустить деградации белков и изменений их структуры, которые могут привести к нарушению его физических или оптических характеристик и к утрате функции.
Считается, что специфические последовательности и морфологические особенности CP49 и филензина каким-то образом способствуют поддержанию свойств этих белков. В экспериментах на животных с измененным характером экспрессии белков филаментов хрусталика показано развитие последовательных нарушений функционирования хрусталика глаза. Также показано, что доминантные мутации в CP49 являются причиной развития ранней семейной катаракты у человека.
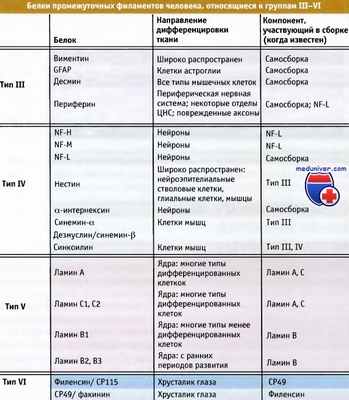
Белки промежуточных филаментов человека, объединенные в типы III—IV по принципу гомологии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Промежуточные нити
Промежуточные нити (филаменты) состоят из белков, специфичных для определённых клеточных типов; имеют диаметр 8–11 нм (табл. 3–1). Различают цитокератины эпителия, десмины мышц, виментины мезенхимы, ламины ядерной оболочки, а также нейрофиламенты, глиофиламенты и чётковидные волокна хрусталика. Промежуточные нити создают внутриклеточный каркас, обеспечивают упругость клетки, поддерживают упорядоченность расположения компонентов цитоплазмы. Иммуноцитохимические реакции с АТ конкретных типов промежуточных нитей нашли применение в цитодиагностике генеза опухолей.
Таблица 3‑1.Белки промежуточных филаментов (нитей) различных клеток
Филаментыибелки
Цитокератины кератиновых нитей эпителиальных клеток
Создают тянущее усилие, взаимодействуют с десмосомами. Маркёры опухолей эпителиального происхождения.
Десмины мышечных тканей
Образуют внутриклеточный каркас, взаимодействуя с сократительными структурами
Виментины клеток мезенхимного генеза
Маркёры опухолей соединительной ткани
Глиальный фибриллярный кислый белок глиофиламентов в астроцитах
Белки нейрофиламентов нервных клеток
Поддерживают форму отростков нейрона
Факинин и филензин чётковидных волокон хрусталика
Поддерживают структуру хрусталиковых волокон
Ламины ядерной пластинки ядерной оболочки
Организуют ядерную пластинку и лежащий около неё хроматин.
Депо кальция
Цистерны гладкой эндоплазматической сети многих клеток специализированы для накопления в них Ca 2+ путём постоянного откачивания Ca 2+ из цитозоля, где нормально содержание Ca 2+ находится на уровне 10 –7 М. Подобные депо кальция функционируют в любой клетке (гладкая эндоплазматическая сеть). Особенно велика роль кальциевых депо в скелетной и сердечной мышцах, нейронах, хромаффинных клетках, яйцеклетке, эндокринных клетках и т.д. Различные сигналы (например, гормоны, нейромедиаторы, факторы роста) влияют на функции клеток и их пролиферацию путём изменения концентрации в цитозоле внутриклеточного посредника — Ca 2+ . Например, условием сокращения мышечных элементов является резкое повышение концентрации Ca 2+ в цитозоле. Для этого необходимо постоянно откачивать ионы кальция из цитозоля и накапливать их в специальных депо, образованных Ca 2+ -запасающими цистернами гладкой эндоплазматической сети (их название в мышечных элементах — саркоплазматический ретикулум). Внутри цистерн находятсяCa 2+ -связывающиебелки(кальсеквестрин, кальретикулин и др.) В мембрану цистерн–депо Ca 2+ встроеныCa 2+ ‑насосы(Ca 2+ ‑АТФаза), постоянно закачивающие Ca 2+ внутрь цистерн, иCa 2+ ‑каналы, через которые происходит выброс Ca 2+ из депо при поступлении сигнала (рис. 3–10).
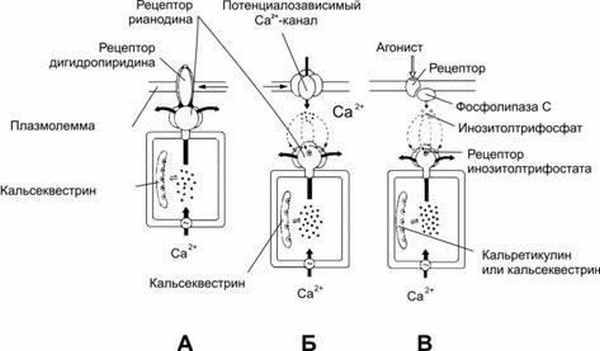
Рис.3–10.МеханизмвыбросаCa 2+ изцистернгладкойэндоплазматическойсетивсегда осуществляется при взаимодействии макромолекулярных структур плазмолеммы и стенки кальциевых депо.А—рецептор рианодинав мембране цистерны связан с Ca 2+ ‑каналом, активируется дигидропиридиновым рецептором плазмолеммы;Б— рецептор рианодина в мембране цистерны непосредственно не связан с белками плазмолеммы, но активируется Ca 2+ при незначительном повышении концентрации этого катиона в цитозоле за счёт поступления в клетку через потенциалозависимые Ca 2+ ‑каналы плазмолеммы;В— Ca 2+ освобождается из цистерн при активации рецепторов инозитолтрифосфата. Этот второй посредник образуется при участии фосфолипазы C в ответ на взаимодействие агониста со своим рецептором в плазмолемме. [11].
Известно несколько типов Ca 2+ ‑каналов, в т.ч. управляемые рецепторами рианодина и вторым посредником (инозитолтрифосфат).
Рецепторырианодинаактивируются двояко: через рецепторы дигидропиридина и через потенциалозависимые Ca 2+ ‑каналы плазмолеммы.
Рецепторыдигидропиридинавстроены в плазмолемму и реагируют на изменения её МП: изменение конформации рецепторов дигидропиридина активируетрецепторы рианодинаи приводит к выбросу Ca 2+ из депо. Подобный механизм функционирует в саркоплазматическом ретикулуме волокон скелетной мышцы.
Изменениямембранногопотенциалаоткрывают потенциалозависимые Ca 2+ ‑каналы плазмолеммы, в результате в клетке несколько повышается концентрация Ca 2+ . Этот Ca 2+ активируетрецепторы рианодина, и запасённый в депо Ca 2+ выбрасывается в цитозоль. Этот механизм функционирует в нейронах и кардиомиоцитах.
Инозитолтрифосфат. Каналы в мембране цистерн открываются под действием инозитолтрифосфата (рис. 2‑10), образующегося при воздействии на клетку внешнего сигнала. Например, при взаимодействииангиотензиновсо своими рецепторомами в плазматической мембране ГМК активируется фосфолипаза С, и образуется инозитолтрифосфат. Последний диффундирует в цитоплазме, связывается с рецепторами инозитолтрифосфата в мембране цистерн гладкой эндоплазматической сети и открывает Ca 2+ ‑каналы. Этот механизм функционирует в овоцитах, лимфоцитах, ГМК и других клетках.
Этанол—ингибиторрецепторовинозитолтрифосфата— участвует в развитии атаксии при алкогольной интоксикации. КлеткиПуркиньемозжечка имеютрецепторы рианодинаи инозитолтрифосфата в мембране цистерн, локализованных как в теле клетки (перикарион), так и в дендритах. Но в цистернах концевых разветвлений дендритов (шипики) присутствуют только рецепторы инозитолтрифосфата.
Цитоскелет
Цитоскелет ― опорно-двигательная система клетки, включающая немембранные белковые нитчатые образования, выполняющие как каркасную, так и двигательную функции в клетке. Эти нитчатые или фибриллярные структуры являются динамическими образованиями, они могут быстро возникать в результате полимеризации их элементарных молекул и так же быстро разбираться, исчезать при деполимеризации. К этой системе относятся микрофиламенты, промежуточные филаменты и микротрубочки.
Микрофиламенты (microfilamenti) толщиной 5―7 нм встречаются практически во всех типах клеток. Они располагаются в кортикальном слое цитоплазмы, непосредственно под плазмолеммой, пучками или слоями. Их можно видеть в псевдоподиях амеб или в движущихся отростках фибробластов, в микроворсинках кишечного эпителия. Микрофиламенты часто образуют пучки, направляющиеся в клеточные отростки. В состав пучков микрофиламентов кортикального слоя входят белки, сходные с теми, которые в мышечной ткани обеспечивают сокращение, главным образом актин, миозин, тропомиозин, а-актинин. Следовательно, микрофиламенты в совокупности с белками не что иное, как внутриклеточный сократительный аппарат, обеспечивающий не только подвижность клеток при активном амебоидном их перемещении, но, вероятно, и большинство внутриклеточных движений, таких как токи цитоплазмы, движение вакуолей, митохондрий, деление клетки. Кроме того, актиновые микрофиламенты выполняют и каркасную роль. Соединяясь с рядом стабилизирующих белков, они могут образовывать временные или постоянные (как в микроворсинках кишечного эпителия) пучки или сети, играющие большую роль в структурировании цитоплазмы.
Промежуточные филаменты – тоже белковые структуры. Это тонкие (10 нм) неветвящиеся, часто располагающиеся пучками нити. Их белковый состав различен в разных тканях. В эпителии в состав промежуточных филаментов входит кератин. Пучки кератиновых промежуточных филаментов в эпителиальных клетках образуют так называемые тонофибриллы, которые подходят к десмосомам. В состав промежуточных филаментов клеток мезенхимальных тканей (например, фибробластов) входит другой белок ― виментин, в мышечных клетках ― десмин, в нервных клетках в состав их нейрофиламентов также входит особый белок. К промежуточным филаментам относятся также белки ядерной ламины – фиброзного слоя, заякоревающего хроматин на ядерной оболочке. Роль промежуточных микрофиламентов, скорее всего, опорно-каркасная; эти фибриллярные структуры не так лабильны, как микротрубочки и микрофиламенты.
В последнее время с помощью иммуноморфологических методов стало возможным определить тканевое происхождение тех или иных опухолей именно по белкам их промежуточных филаментов, что очень важно для диагностики и правильного выбора типа химиотерапевтических противоопухолевых препаратов.
Микротрубочки. В клетках микротрубочки принимают участие в создании ряда временных (цитоскелет интерфазных клеток, веретено деления) или постоянных (центриоли, реснички, жгутики) структур.
Микротрубочки представляют собой прямые, неветвящиеся длинные полые цилиндры. Их внешний диаметр составляет около 24 нм. Микротрубочки состоят из димеров α и β тубулина. Микротрубочки обладают свойством динамической нестабильности.
Практически во всех эукариотических клетках в гиалоплазме можно видеть длинные неветвящиеся микротрубочки. В больших количествах они обнаруживаются в цитоплазматических отростках нервных клеток, фибробластов и других изменяющих свою форму клеток. Одно из функциональных значений таких микротрубочек цитоплазмы заключается в создании динамического, но одновременно устойчивого внутриклеточного каркаса (цитоскелета), необходимого для поддержания формы клетки.
При действии веществ, вызывающих деполимеризацию микротрубочек, сильно меняется форма клеток. Если отростчатую и плоскую клетку в культуре фибробластов обработать колхицином, то она теряет полярность и сжимается. Точно так же ведут себя другие клетки: колхицин прекращает рост клеток хрусталика, отростков нервных клеток.
Создавая внутриклеточный скелет, микротрубочки могут быть факторами ориентированного движения и клетки в целом, и ее внутриклеточных компонентов, задавать своим расположением векторы для направленных потоков разных веществ и для перемещения крупных структур. Разрушение микротрубочек митостатиками или действием холода нарушает транспорт веществ в аксонах нервных клеток, приводит к блокаде секреции и т.д.
По цитоплазматическим интерфазным микротрубочкам, как по рельсам, могут передвигаться различные мелкие вакуоли, например синаптические пузырьки, содержащие нейромедиаторы, в аксоне нервной клетки или митохондрии. Эти перемещения основываются на связи микротрубочек со специальными белками ― транслокаторами (динеины и кинезины), которые в свою очередь связываются с транспортируемыми структурами. Микротрубочки являются составной частью клеточного центра, ресничек и жгутиков. Система микротрубочек развивается в связи с центриолью, которая является местом, где происходят начальная полимеризация тубулинов и рост микротрубочек цитоскелета.
Рекомендуемая литература
И.А. Воробьев, Е.С. Надеждина. Центриолярный аппарат и его роль в организации микротрубочек
К вопросу о клинико-морфологических аспектах формирования контрактуры капсульного мешка при артифакии
В клинической практике офтальмохирургам нередко приходится сталкиваться с ситуацией, когда после удачно выполненной экстракции катаракты в отдаленном периоде наблюдается значительное снижение достигнутого функционального результата вследствие фиброзного перерождения капсульной сумки [5, 7-9, 11, 13-15, 17]. К факторам, способствующим развитию данного осложнения, относят такие заболевания, как псевдоэксфолиативный синдром (ПЭС), тапеторетинальная абиотрофия сетчатки, миопия и гиперметропя высоких степеней, глаукома, посттравматические состояния, воспалительные заболевания зрительного тракта. Среди общей соматической патологии в этом отношении можно выделить сахарный диабет и синдром Марфана [1, 2, 5-18].
Особенности техники операции, в частности, переход от передней капсулэктомии в различных ее вариантах к непрерывному линейному круговому капсулорексису, а также малый диаметр последнего (до 5,0 мм), повышают риск развития контрактуры капсульного мешка [9, 12, 14, 15, 17].
Важным фактором, определяющим поведение капсульного мешка в послеоперационном периоде, считается материал, из которого изготовлена ИОЛ. Хорошо известен факт, что линзы из ПММА и, в особенности, из силикона существенно увеличивают вероятность фиброза капсульного мешка в отдаленном послеоперационном периоде [5, 8, 10, 18]. По литературным данным, наиболее благоприятные результаты получены при имплантации ИОЛ из гидрофобного акрилового материала [10, 13, 18].
Одной из действенных мер профилактики сморщивания капсульной сумки хрусталика при экстракции осложненных катаракт считается имплантация внутрикапсульных колец (ВК). Как правило, они применяются для стабилизации капсульного мешка в условиях несостоятельности связочного аппарата хрусталика. Тем не менее, рядом исследователей отмечается способность ВК уменьшать степень редукции периметра капсульного мешка в послеоперационном периоде и соответственно, по меньшей мере, замедлять образование контрактуры. [1-4, 17] Среди других действенных лечебно-профилактических мероприятий следует отметить переднюю ИАГ-лазерную капсулотомию [7, 18].
К сожалению, полностью исключить риск образования контрактуры капсулы невозможно, что нередко связано с поздним обращением пациента. В связи с этим бывает необходимо использовать более инвазивные способы лечения с тем, чтобы повысить зрительные функции пациента и предотвратить дислокацию блока «ИОЛ-капсульный мешок» на глазное дно, которая неизбежно возникает на поздних стадиях развития данного процесса [7].
Исходя из вышесказанного, остается открытым целый ряд существенных вопросов, касающихся профилактики, своевременной диагностики, а также оперативного лечения данной патологии.
Цель провести анализ клинических случаев хирургического лечения контрактуры капсульного мешка хрусталика на артифакичных глазах.
Материал и методы
Материал данной работы основывается на анализе клинических случаев хирургической коррекции фиброза капсульного мешка, развившегося в различные сроки послеоперационного периода.
Пациентка К., 80 лет. Диагноз: OS Артифакия. Контрактура и фиброз капсульного мешка, децентрация блока «ИОЛ-капсульный мешок». Миопия средней степени. При поступлении: острота зрения — 0,02; внутриглазное давление (ВГД) в пределах нормы. Оперирована 5 мес. назад по поводу осложненной зрелой катаракты, имплантирована эластичная ИОЛ из гидрофильного акрила (рис. 1).
Пациентка М., 73 года. Диагноз: OS — Артифакия. Фиброз капсульного мешка, децентрация ИОЛ, Iа открытоугольная первичная глаукома. При поступлении: острота зрения — 0,08; ВГД — 17 мм рт.ст., компенсировано инстиляциями бетоптика. Оперирована 7 лет назад по поводу осложненной зрелой катаракты, в ходе операции имплантирована эластичная ИОЛ из гидрофильного акрила (рис. 2).
Обеим пациенткам до операции проведено ультразвуковое биомикроскопическое исследование, в ходе которого отмечали уплотнение и утолщение передней капсулы хрусталика, локальные дефекты цинновых связок, смещение блока «ИОЛ-капсульный мешок» как в горизонтальной, так и вертикальной плоскостях (рис. 3). Последнее было в большей степени выражено у второй пациентки (М., 73 года) (рис. 4).
Обеим пациенткам проводилось оперативное лечение, в ходе которого после выполнения роговичных парацентезов в переднюю камеру вводили мидриатик (1% р-р мезатона) и вискоадаптивный препарат (2,4% гиалуронат натрия Микровиск Фако производства компании Bohus Biotech AG, Швеция). Затем при помощи витреоретинальных ножниц калибра 25G проводили радиальную насечку фиброзно измененной передней капсулы; далее при помощи витреоретинального пинцета и ножниц 25G капсулорексис расширяли до 5,0 мм в диаметре (рис. 5). Отсепарованный фрагмент капсулы удаляли из передней камеры и направляли на гистологическое исследование. Затем фиксировали ИОЛ за один из гаптических элементов швом к склере в меридиане, соответствующем предварительно отсепарованному конъюнктивальному лоскуту, с помощью изогнутой иглы и нити (пролен 10/0). Нить фиксировали к склере несколькими зигзагообразными стежками. Центрацию капсульного мешка и расположенной в нем линзы достигали путем дозированного натяжения шва. Операцию заканчивали наложением узлового шва на конъюнктиву, инъекцией антибиотика (гентамицин) и дексаметазона.
Направленный на гистологическое исследование материал обрабатывали по следующей методике: после фиксации материала в растворе нейтрального формалина, его промывали проточной водой, обезвоживали в спиртах восходящей концентрации и заливали в парафин, затем выполняли гистологические срезы с применением окраски гематоксилин-эозином, а также по методике Ван Гизон. Препараты изучали под микроскопом фирмы Leica «DM LВ2» при х50, х100, х200, х400-кратном увеличении с последующим фотографированием.
Результаты и обсуждение
В целом, как операция, так и послеоперационный прериод протекали без особенностей. В послеоперационном периоде производили четырехкратное закапывание раствора антибиотика (тобрамицин) и дексаметазона по убывающей схеме в течение одного месяца.
На первые сутки у пациентки К. острота зрения — 0,9; ВГД — 14 мм рт.ст. У пациентки М. острота зрения — 0,8; ВГД — 13 мм рт.ст. При осмотре на щелевой лампе в обоих случаях отмечали стабильно центральное положение ИОЛ (рис. 6, 7). Правильное положение линзы подтверждало и ультразвуковое биомикроскопическое исследование, проведенное на 1 и 7-е сутки послеоперационного периода. По данным УБМ, смещения в горизонтальной и вертикальной плоскостях блока «ИОЛ-капсульный мешок» не регистрировали, отмечали утолщение и уплотнение задней и передней капсул (рис. 8, 9).
В иссеченном участке передней капсулы хрусталика пациентки, оперированной по поводу катаракты 5 мес. назад, выявлены следующие особенности: по внутренней поверхности передней капсулы хрусталика распространяется фиброзно-клеточный пролиферат, состоящий из клеток преимущественно вытянутой веретеновидной формы с овальными или палочковидными ядрами. Волокнистый компонент имеет линейную укладку с участками волнообразного хода фибрилл, что привело к появлению складчатости капсулы. Эпителиальные клетки передней капсулы хрусталика не дифференцируются (рис. 10).
У второй пациентки (срок после операции 7 лет) в исследуемом материале выявлено, что край капсулорексиса, выполненный в ходе факоэмульсификации, замурован в фиброзную ткань. Отмечено малое количество клеточных элементов, что свидетельствует о зрелости соединительной ткани. При окраске препаратов пикрофуксином по методике Ван Гизон, кроме фиброзных волокон, окрашенных в малиновый цвет, отмечается наличие фибрилл желто-оранжевого цвета, что соответствует мышечной дифференцировке, обусловливающей сократительную способность пролиферата (рис. 11).
Полученные результаты свидетельствуют о наличии прямой зависимости между временным фактором и степенью зрелости патологически образованных фибриллярных волокон с сократительной способностью, что согласуется с данными литературы. Так, в частности, бельгийскими исследователями (Reyntjens B. с соавт., 2004) было проведено иммуногистохимическое исследование аналогичного материала пациентов с контрактурой капсульного мешка после ФЭК, которое выявило высокие показатели экспрессии виментина. Последний представляет собой белок, из которого состоят промежуточные филаменты цитоскелета клетки, служащий маркером мезенхимальных клеток и эпителиально-мезенхимальной трансдифференцировки. Помимо этого, он играет важную роль в клеточной сократимости, миграции и пролиферации ?-гладкомышечного актина (?-SMA — белок, фибриллярная форма которого образует с миозином основной сократительный элемент мышц — актомиозин). При этом реакция на цитокератины была отрицательной, что обусловлено отсутствием экспрессии этих белков эпителиальными клетками передней капсулы хрусталика взрослого человека [17].
Данные морфологических исследований, проведенных нами, подтверждают мезенхимальное происхождение клеточных элементов, характеризующихся наличием сократительной способности. Указанные клетки, со временем достигая зрелости, приводят к прогрессивной контрактуре капсульного мешка.
Несомненно, наиболее раннее диагностирование данного патологического состояния позволяет применять наименее инвазивные методики лечения, к которым следует отнести ИАГ-лазерную капсулотомию. В ходе лазерного воздействия устраняется тракционное воздействие со стороны фиброзно измененной передней капсулы. И это служит эффективной мерой профилактики децентрации и дислокации капсульного мешка.
Тем не менее, позднее обращение пациентов, как правило, исключает возможность лазерной коррекции контракутры капсульного мешка. При этом единственным действенным способом репозиции децентрированного блока «ИОЛ-капсульный мешок» является его шовная фиксация вкупе с иссечением листка передней капсулы.
Выводы
1. В послеоперационном периоде сохранившиеся клетки передней капсулы хрусталика подвергаются трансдифференцировке в миофибробласты, обладающие сократительной способностью и синтезирующие фиброзные волокна, что при крайней степени своего развития приводит к формированию контрактуры капсульного мешка и его дислокации.
2. Развитие выраженного фимоза капсульного мешка отмечается в вариабельном временном диапазоне после хирургического лечения катаракты.
3. Морфологическая картина удаленных фрагментов передней капслулы подтверждает, что данный вид патологии имеет прогрессирующее течение.
4. Наличие ранних признаков контрактуры капсульного мешка обусловливает целесообразность проведения лазерной передней капсулотомии.
5. При далеко зашедшей стадии контрактуры, хирургическое лечение с использованием инструмента калибра 25G обеспечивает малотравматичность операции и позволяет получить высокие клинико-функциональные результаты в ранние сроки послеоперационного периода.
Читайте также:
