Регуляция функций клеток. Генетическая регуляция - промоутеры
Добавил пользователь Skiper Обновлено: 21.01.2026
Регуляция функций клеток. Генетическая регуляция - промоутеры
Все факты, изложенные в этой статье, указывают, что и химические, и физические функции клетки регулируются генами. Однако активность самих генов также должна находиться под контролем, в противном случае накопление какого-либо компонента клетки или какая-либо биохимическая реакция будут продолжаться до тех пор, пока не погубят клетку. Каждая клетка обладает мощными регуляторными механизмами обратной связи, координирующими разнообразные внутриклеточные процессы. Для каждого гена (их в клетке более 30000) предусмотрен как минимум один такой механизм.
В принципе для контроля биохимических функций клетки используют всего два способа: генетическую регуляцию (т.е. регуляции активности самих генов) и ферментативную регуляцию (т.е. регуляции активности синтезированных клеткой ферментов).
Оперон и его значение в биохимических реакциях синтеза. Функции промоутера. Процессы биохимического синтеза в клетке обычно идут с участием целых серий реакций, каждая из которых катализируется специальным ферментом. В свою очередь, все ферменты, необходимые для синтеза какого-либо вещества, часто кодируются последовательностью генов, лежащих единой группой на одной хромосоме. Участок ДНК, несущий такую группу генов, называется опероном, а гены, отвечающие за синтез определенных ферментов, — структурными генами.
На этом же рисунке можно увидеть участок ДНК, называемый промоутером. Как уже упоминалось, он представляет собой последовательность нуклеотидов, обладающих сродством к определенным участкам РНК-полимеразы. Чтобы начался синтез матричной РНК, РНК-полимераза должна прикрепиться к промоутеру перед тем как начать движение вдоль ДНК. Таким образом, промоутер необходим для активации оперона.
Регуляция функции оперона репрессором оператора. Это участок связывания с белком, называемым репрессором оператора. Такое название он получил потому, что его связывание с промоутером предотвращает прикрепление к последнему РНК-полимеразы и, как следствие, подавляет транскрипцию генов данного оперона. Другое название этого белка — белок-репрессор.
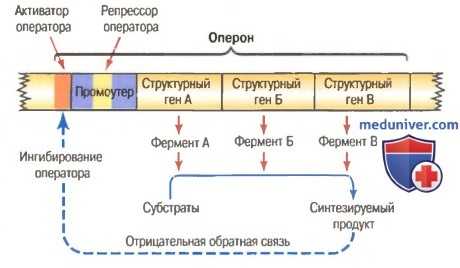
Роль оперона в регуляции синтеза небелковых продуктов клеток.
Небелковый внутриклеточный продукт запускает механизм отрицательной обратной связи для ингибирования оперона и таким образом автоматически регулирует свою концентрацию.
Регуляция функции оперона активатором оператора. Он примыкает к промоутеру спереди и связывается с белком, называемым активатором оператора. Связываясь с этим оператором, активатор оператора способствует прикреплению РНК-полимеразы к промоутеру и активирует оперон. Другое название этого белка — белок-активатор.
Механизмы отрицательной обратной связи в регуляции функции оперона. На рисунке показано, что при накоплении в клетке избыточного количества какого-либо продукта может включаться механизм отрицательной обратной связи для ингибирования функции оперона, отвечающего за синтез этого продукта. В основе этого механизма может лежать связывание белка-репрессора с оператором или разрыв связи между белком-активатором и оператором. В обоих случаях функция оперона будет подавляться. Как только синтезируемый продукт накапливается в количестве, достаточном для нормального функционирования клетки, деятельность оперона прекращается. Напротив, при разрушении этого продукта и снижении его концентрации в клетке оперон вновь активируется. Таким образом, клетка автоматически поддерживает необходимую ей концентрацию продукта.
Другие механизмы регуляции транскрипции оперона. За последние 20 лет было открыто много вариантов основных механизмов регуляции функции оперона. Не вдаваясь в подробности, опишем некоторые из них.
1. Регуляция функции оперона часто бывает опосредована регуляторныи геном, который может локализоваться в любой хромосоме. Этот ген отвечает за синтез белка-регулятора, контролирующего функцию оперона, действуя как белок-репрессор или белок-активатор.
2. В ряде случаев один и тот же белок-регулятор одновременно контролирует несколько разных оперонов. При этом некоторые белки действуют как репрессоры одних и активаторы других оперонов. Если таким способом одновременно регулируется функция нескольких синхронно действующих оперонов, то их вместе называют регулоном.
3. Белки-регуляторы некоторых оперонов прикрепляются к ДНК не в точке начала их транскрипции, а в более отдаленных участках. В некоторых случаях регуляция оперона осуществляется не на уровне ДНК, а при процес-синге РНК до ее выхода из ядра в цитоплазму. Иногда регуляция оперона происходит в цитоплазме во время трансляции РНК на рибосоме.
4. В ядросодержащих клетках ядерная ДНК «упакована» в структуры, называемые хромосомами. В каждой хромосоме спираль ДНК обвивается вокруг мелких белков (гистонов), которые с помощью других белков связываются воедино, образуя компактные структуры. Пока ДНК находится в таком компактном состоянии, она не может участвовать в синтезе РНК. Сейчас выясняются некоторые механизмы, посредством которых отдельные участки хромосом на время утрачивают компактную структуру, что делает возможным локальный синтез РНК. Однако даже в таких случаях некоторые факторы транскрипции регулируют скорость транскрипции отдельного оперона на хромосоме. Таким образом, в поддержании клеточных функций участвуют еще более сложные, чем считалось раньше, регуляторные механизмы. Наконец, внешние сигналы, включая некоторые гормоны, могут активировать отдельные области хромосом и некоторые факторы транскрипции, регулируя таким способом биохимические процессы, необходимые для функционирования клетки.
Каждая клетка несет более 30000 разных генов, а это значит, что и способов регуляции их активности тоже должно быть очень много. Механизмы генетической регуляции играют особенно важную роль в контроле внутриклеточной концентрации аминокислот и их производных, а также промежуточных субстратов и продуктов метаболизма углеводов, жиров и белков.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Регуляция работы генов. Значение гистонов. Структура оперона. Роль структурных генов, промотора, оператора, регулятора, факторов транскрипции (индукторов)
Работа генов в любом организме – прокариотическом, эукариотическом, одноклеточном или многоклеточном – контролируется и координируется.
Различные гены обладают неодинаковой временной активностью. Одни из них характеризуются постоянной активностью. Такие гены отвечают за синтез белков, необходимых клетке или организму на протяжении всей жизни, например, гены, продукты которых участвуют в синтезе АТФ. Большинство же генов обладает непостоянной активностью, они работают только в определенные моменты, когда появляется необходимость в их продуктах – белках. Гены различаются и по уровням своей активности (низкий или высокий).
Белки клетки классифицируются как регуляторные и структурные. Регуляторные белки синтезируются на регуляторных генах и контролируют работу структурных генов. Структурные гены кодируют структурные белки, выполняющие структурную, ферментативную, транспортную и другие функции (кроме регуляторной!).
Регуляция синтеза белка осуществляется на всех этапах этого процесса: транскрипции, трансляции и посттрансляционной модификации либо путем индукции, либо путем репрессии.
Регуляция активности генов эукариотических организмов намного сложнее регуляции экспрессии генов прокариот, что определяется сложностью организации эукариотического организма и особенно многоклеточного. В 1961 г. французские ученые Ф. Жакоб, Ж. Моно и А. Львов сформулировали модель генетического контроля синтеза белков, катализирующих усвоение клеткой лактозы – концепцию оперона.
Опероном называют группу генов, работа которых контролируется одним геном-регулятором.
Ген-регулятор – это ген, обладающий постоянной низкой активностью, на нем синтезируется белок-репрессор – регуляторный белок, который может соединяться с оператором, инактивируя его.
Оператор – точка начала считывания генетической информации, он управляет работой структурных генов.
В структурных генах лактозного оперона содержится информация о ферментах, участвующих в метаболизме лактозы. Поэтому лактоза будет служить индуктором – агентом, инициирующим работу oпepoна.
Промотор – место прикрепления РНК-полимеразы.
Терминатор – место окончания синтеза иРНК.
При отсутствии индуктора система не функционирует, поскольку "свободный" от индуктора – лактозы – репрессор соединен с оператором. В этом случае фермент РНК-полимераза не может катализировать процесс синтеза иРНК. Если в клетке оказывается лактоза (индуктор), она, взаимодействуя с репрессором, изменяет его структуру, в результате чего репрессор освобождает оператор. РНК-полимераза соединяется с промотором, начинается синтез иРНК (транскрипция структурных генов). Затем на рибосомах формируются белки по программе иРНК-лактозного оперона. У прокариотических организмов на одну молекулу иРНК переписывается информация со всех структурных генов оперона, т.е. оперон – это единица транскрипции. Транскрипция продолжается до тех пор, пока в цитоплазме клетки сохраняются молекулы лактозы. Как только все молекулы будут клеткой переработаны, репрессор закрывает оператор, синтез иРНК прекращается.
Таким образом, синтез иРНК и, соответственно, синтез белка должны строго регулироваться, поскольку у клетки недостаточно ресурсов для одновременной транскрипции и трансляции всех структурных генов. И про-, и эукариоты постоянно синтезируют только те иРНК, которые необходимы для выполнения основных клеточных функций Экспрессия остальных структурных генов осуществляется под строгим контролем регуляторных систем, запускающих транскрипцию только в том случае, когда возникает потребность в определенном белке (белках).
Хромосомы клетки. Митоз и его стадии
Спирали ДНК в ядре «упакованы» в хромосомы. Человеческая клетка содержит 46 хромосом, объединенных в 23 пары. Большинство генов, составляющих пару в гомологичных хромосомах, почти или полностью идентичны, и часто приходится слышать, что все гены в геноме человека имеют свою пару, хотя это не совсем правильно.
Наряду с ДНК в состав хромосом входит много белка, большая часть которого представлена мелкими положительно заряженными молекулами гистонов. Они образуют множество небольших, похожих на катушки структур, которые, располагаясь одна за другой, обвиваются короткими сегментами ДНК.
Эти структуры играют важную роль в регуляции активности ДНК, поскольку обеспечивают ее плотную «упаковку» и делают таким образом невозможным ее использование в качестве матрицы для синтеза новой ДНК. Существуют также регуляторные белки, которые, напротив, деконденсируют небольшие участки гистоновой упаковки ДНК, создавая таким образом возможность синтеза РНК.
Среди основных компонентов хромосом есть и негистоновые белки, которые, с одной стороны, являются структурными белками хромосом, а с другой — активаторами, ингибиторами или ферментами в составе регуляторных генетических систем.
Репликация хромосом в полном объеме начинается через несколько минут после завершения репликации ДНК. В течение этого времени вновь синтезированные цепи ДНК объединяются с белками. Две вновь образованные хромосомы до самого конца митоза остаются прикрепленными друг к другу в участке, близком к их центру и называемом центромерой. Такие разделившиеся, но не разошедшиеся хромосомы называют хроматидами.
Процесс деления материнской клетки на две дочерние называют митозом. Вслед за репликацией хромосом с образованием двух хроматид в течение 1-2 ч автоматически начинается митоз.
Одно из самых первых изменений в цитоплазме, связанных с митозом, происходит на поздних стадиях интерфазы и затрагивает центриоли.Центриоли так же, как ДНК и хромосомы, удваиваются во время интерфазы; обычно это происходит незадолго до репликации ДНК. Центриоль длиной около 0,4 мкм и диаметром около 0,15 мкм состоит из девяти параллельных триплетов— трубочек, собранных в виде цилиндра. Центриоли каждой пары лежат под прямым углом друг к другу. Пару центриолеи вместе с прилегающим к ней веществом называют центросомой.
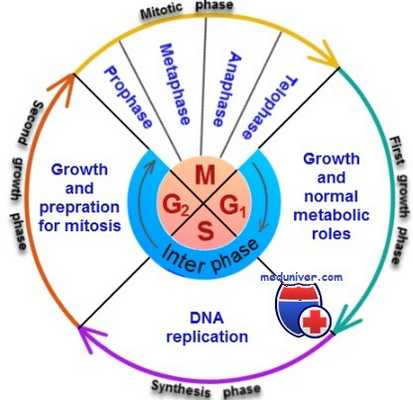
Фазы митоза клетки
Незадолго до начала митоза обе пары центриолей начинают перемещаться в цитоплазме, отдаляясь друг от друга. Это движение обусловлено полимеризацией белка микротрубочек, которые начинают расти от одной пары центриолеи к другой и за счет этого расталкивать их к противоположным полюсам клетки. В то же время от каждой пары центриолеи начинают расти другие микротрубочки, которые увеличиваются в длину и отходят от них радиально в виде лучей, образуя на каждом полюсе клетки так называемую астросферу. Отдельные ее лучи проникают через ядерную оболочку, способствуя таким образом разделению каждой пары хроматид во время митоза. Группу микротрубочек между двумя парами центриолеи называют веретеном деления, а весь набор микротрубочек вместе с центриолями — митотическим аппаратом.
Профаза. По мере образования веретена в ядре начинается конденсация хромосом (в интерфазе они состоят из двух слабосвязанных цепей), которые благодаря этому становятся хорошо различимы.
Прометафаза. Идущие от астросферы микротрубочки разрушают ядерную оболочку . В то же время другие микротрубочки, отходящие от астросферы, прикрепляются к центромерам, которые пока еще соединяют все хроматиды попарно, и начинают тянуть обе хроматиды каждой пары к разным полюсам клетки.
Метафаза. Во время метафазы астросферы отдаляются друг от друга еще больше. Считается, что их движение обусловлено отходящими от них микротрубочками. Эти микротрубочки сплетаются вместе и образуют веретено, которое и отталкивает центриоли друг от друга. Полагают также, что между микротрубочками веретена располагаются молекулы мелких сократительных белков, или «моторные молекулы» (возможно, они аналогичны актину), которые обеспечивают взаимное скольжение микротрубочек в противоположных направлениях, как это происходит при мышечном сокращении. Микротрубочки, прикрепившиеся к центромерам, подтягивают хроматиды к центру клетки и выстраивают их в виде метафазной пластинки по экватору веретена.
Анафаза. Во время этой фазы две хроматиды каждой пары отрываются друг от друга в области центромеры. Все 46 пар хроматид разделяются и образуют два самостоятельных набора из 46 дочерних хромосом. Каждый набор хромосом движется к противоположным астросферам, а полюсы делящейся клетки в это время расходятся все дальше.
Телофаза. В этой фазе два набора дочерних хромосом полностью расходятся, митотический аппарат постепенно разрушается, вокруг каждого набора хромосом за счет мембраны эндоплазматического ретикулума формируется новая ядерная оболочка. Вскоре после этого между двумя новыми ядрами появляется перетяжка, делящая клетку на две дочерних. Деление обусловлено образованием кольца из микрофиламентов актина и, возможно, миозина (два сократительных мышечных белка) в области перетяжки между дочерними клетками, которое отшнуровывает их друг от друга.
Регуляция активности генов в ходе онтогенеза у эукариот
Клетки различных тканей растений и животных отличаются друг от друга главным образом тем, что в них происходит синтез различных групп белков, что и определяет их структурную и функциональную специфику. Таким образом, проблема генетического контроля индивидуального развития тесно связана с проблемой дифференциальной экспрессии генов. Экспрессия генов зависит от факторов внешней и внутренней среды и, в то же время, находится под контролем генотипа. Например, известны особые гомеозисные гены, контролирующие экспрессию других генов.
Экспрессия генов закономерно изменяется в ходе онтогенеза. В качестве примера рассмотрим изменение структуры гемоглобина у человека. Гемоглобин – тетрамерный белок, в состав которого входят четыре полипептидных цепи и четыре молекулы гема. Каждая молекула гема содержит один атом железа, связывающий одну молекулу кислорода или молекулу углекислого газа. Две полипептидных цепи, входящие в состав одного тетрамера, носят общее название α, а две – общее название β. В целом структура тетрамера описывается формулой α2β2. Однако эта общая формула нуждается в уточнении. Полипептиды типа α представлены двумя подтипами – ζ и а. Оба подтипа кодируются дуплицированными генами, локализованными в 16-й хромосоме, однако гены ζ экспрессируются в раннем эмбриогенезе, а гены α – преимущественно у плодов и у взрослых организмов. Полипептиды типа β представлены подтипами ε, γ, δ, β. Кодирующие их гены расположены в 11-й хромосоме в указанном порядке, который соответствует порядку их экспрессии: ген ε экспрессируется на ранних стадиях развития эмбрионов, γ – у плода, δ – у новорождённых, β – у взрослых. В целом «взрослый» гемоглобин состоит из четырех цепей (двух цепей α и двух цепей β) и описывается формулой α2β2. Однако экспрессия гена δ у взрослого человека полностью не прекращается, и около 1% β-цепей замещено на гемоглобин δ (детский гемоглобин).
Регуляция экспрессии генов в ходе онтогенеза осуществляется на различных уровнях: генном, транскрипционном, посттранскрипционном, трансляционном и посттрансляционном (функциональном).
1 – Регуляцияэкспрессии генов на генном уровне
1.1. Модификация ДНК (замена мажорных «обычных» азотистых оснований – аденина, гуанина, цитозина и тимина – на минорные «редкие» азотистые основания, обычно на метил-цитозин или метил-гуанин). Доказано, что метилирование цитозина существенно влияет на экспрессию генов. Например, активные гены гемоглобина менее метилированы, чем неактивные.
1.2. Увеличение объема ДНК в клетке путем дифференциальной амплификации ДНК или за счет образования политенных хромосом.
Дифференциальная (избирательная, или селективная) амплификация ДНК, которая заключается в многократном копировании отдельных генов, например, генов рРНК. Это явление наблюдается у прокариот, а также у эукариот, например, в ооцитах многих животных, в частности, у амфибий. Амплификация связана с увеличением объема яйца в сотни и тысячи раз. Чтобы заполнить такой огромный объем клетки рибосомами, гены рДНК сами увеличиваются в числе настолько, что, например, у шпорцевой лягушки по окончании амплификации содержание рДНК почти равно количеству ДНК, заключенному в диплоидном наборе хромосом. Число ядрышек (органоидов, контролирующих образование рибосом) возрастает с 2 единиц до 1,5 тыс. Амплификация рРНК происходит и при мегаспорогенезе у растений. (Замечательная особенность молекулярного механизма амплификации заключается в том, что он осуществляется по принципу катящегося кольца – как у прокариот. Одна из копий гена рДНК покидает хромосому, превращается в экстрахромосомную копию, затем замыкается в кольцо, из которого как бы вытягивается хвост длиной в несколько десятков микрометров. Затем эта структура вновь циклизуется, образуя большое кольцо, на основе которого формируется ядрышко.)
Другим механизмом увеличения объема ДНК в клетке является образование политенных хромосом, например, в слюнных железах личинок двукрылых насекомых, в клетках зародышевого мешка Покрытосеменных растений. Частичная политения обнаружена и у млекопитающих: происходит многократное удвоение не всей молекулы ДНК, а только некоторых ее участков.
1.3. Различные случаи программированных количественных изменений ДНК. Примером регуляции, обусловленной транспозицией, служит феномен смены фаз (типа жгутиков) у сальмонелл. Действующий в клетках сальмонелл переключатель содержит промотор, который может изменять свою пространственную ориентацию. В одной ориентации промотор обеспечивает транскрипцию гена Н2, кодирующего синтез жгутиков одного типа, с одновременной репрессией гена H1, кодирующего синтез жгутиков другого типа. В противоположной ориентации промотора ген Н2 не экспрессируется, в то время как экспрессия гена H1 становится возможной.
1.4. Сплайсинг ДНК. Регуляция, связанная со сплайсингом ДНК, изучена на примере генов, кодирующих синтез антител.
Известно, что разнообразные чужеродные вещества – антигены, попадающие в наш организм, – связываются особыми белками – антителами, или иммуноглобулинами. Млекопитающие могут продуцировать до миллиона различных антител, которые вырабатываются Т- и В-лимфоцитами иммунной системы. Существует особый раздел генетики – иммуногенетика,– который изучает генетический контроль иммунного ответа. Основу молекул иммуноглобулинов составляет сложный белок, состоящий из четырех полипептидных цепей – двух тяжелых (Н) и двух легких (L), – связанных дисульфидными мостиками. Оба типа цепей имеют константные (С) и вариабельные (V) участки. Центр связывания антигена образуют вариабельные участки Н- и L-цепей. Механизм объединения константных и вариабельных участков в одной и той же полипептидной цепи подробно изучен. Доказано, что у эмбрионов фрагменты ДНК, кодирующие V- и С-участки, пространственно разделены. При развитии системы иммунитета у позвоночных животных и человека происходит дифференцировка лимфоцитов, в ходе которой гены, кодирующие V- и С-участки, перестраиваются таким образом, что в итоге они оказываются частями одного и того же гена, транскрибируемого как целое. Таким образом, сплайсинг ДНК обеспечивает сшивание консервативных (т.е. постоянно присутствующих) районов этих генов с различными варьирующими. В результате появляется большое число типов антител, поскольку любая консервативная область может быть присоединена к любой варьирующей.
Сплайсинг ДНК можно представить в виде схемы:
| L | I1 | V | J | I2 | C |
ß
1.5. Диминуция хроматина. У некоторых организмов (у аскарид, циклопов) в соматических клетках происходит необратимая утрата части генетического материала (от 20 до 80% ДНК). В полном объеме исходная генетическая информация сохраняется только в клетках зародышевого пути, т. е. в клетках, которые дадут в дальнейшем начало половым клеткам. Именно гаметы содержат всю полноту генетической информации данного вида и составляют непрерывный, потенциально бессмертный зародышевый путь. Смертны соматические клетки индивидуумов, представляющих собой как бы ответвления от зародышевого пути, возникающие после оплодотворения. А. Вайсман считал диминуцию хроматина универсальным механизмом дифференцировки клеток и тканей, однако в дальнейшем было показано, что этот способ дифференцировки встречается довольно редко. Например, подобное явление наблюдается у инфузорий: в диплоидном микронуклеусе полностью сохраняется исходный набор генов, а в полиплоидном макронуклеусе ~10% генов (правда, за счет полиплоидизации оставшаяся информация многократно дублируется).
1.6. Изменение активности целых хромосом.
Известно, что у самок млекопитающих в кариотипе присутствует две X-хромосомы, а у самцов одна X- и одна Y-хромосома. Несмотря на то, что женские особи млекопитающих имеют две Х-хромосомы, а мужские – только одну, экспрессия генов Х-хромосомы происходит на одном и том же уровне у обоих полов. Это объясняется тем, что у самок в каждой клетке полностью инактивирована одна Х-хромосома. Эту хромосому можно видеть в интерфазе в форме гетерохроматинового тельца, названного тельцем Барра. Х-хромосома инактивируется на ранней стадии эмбрионального развития, соответствующей времени имплантации. При этом в разных клетках отцовская и материнская Х-хромосомы выключаются случайно. Состояние инактивации данной Х-хромосомы наследуется в ряду клеточных делений. Таким образом, женские особи, гетерозиготные по генам половых хромосом, представляют собой мозаики. Широко известный пример проявления такой мозаичности — черепаховые кошки, имеющие черные и желтые пятна. Эти кошки гетерозиготны по гену С Y /С B (C Y – желтый мех, С B – черный мех). Желтые и черные пятна у них развиваются в результате случайной инактивации в раннем эмбриогенезе Х-хромосомы с аллелью С B или C Y . Черепаховую окраску почти всегда имеют кошки, если же изредка обнаруживаются коты такой окраски, то они имеют хромосомную конституцию XXY.
2 – Регуляцияэкспрессии генов на уровне транскрипции
Во многих случаях дифференцировка происходит путем регуляции транскрипции мРНК. Интенсивное функционирование отдельных генов или их блоков соответствует определенным этапам развития и дифференцировки.
При изучении гигантских политенных хромосом (в слюнных железах личинок дрозофил) и петель в хромосомах типа «ламповых щеток» (в ооцитах на стадии профазы I) было установлено, что мРНК синтезируется с разной скоростью в разных участках хромосом, в частности, образование пуфов и петель связано с повышением интенсивности синтеза мРНК.
Динамика образования пуфов. В гигантских политенных хромосомах часто наблюдаются вздутия определенных районов хромосом, обусловленные декомпактизацией отдельных дисков и интенсивным синтезом в них РНК. Эти вздутия называются пуфы (или кольца Бальбиани). Пуфы представляют собой места интенсивного синтеза мРНК. Динамика образования пуфов на гигантских хромосомах в процессе развития двукрылых является отражением смены активности генов. Формирование комплексов пуфов, характерных для клеток отдельных тканей и органов дифференцированного организма, является показателем общего уровня наиболее интенсивно протекающих метаболических процессов в данных клетках. При снижении синтетической активности петли синтезированная мРНК отделяется от хромосомы и пуфы политенных хромосом исчезают.
Установлена роль стероидных гормонов (в частности, экдизона – гормона окукливания) в индукции пуфов, а также роль белков, синтезированных ранними пуфами, в индукции поздних пуфов. Таким образом, стероидные гормоны и белки, вероятно, не единственные факторы, ответственные за переключение генов в онтогенезе, а, следовательно, и за смену фаз индивидуального развития организма. Механизм образования пуфов показан на рис. _____. Доказано, что после введения этого гормона молодым личинкам довольно быстро возникают специфические пуфы, причем продолжительность их образования зависит от количества введенного гормона.
Последовательность образования пуфов изменяется также при воздействиях различными химическими агентами или температурными условиями. Некоторые антибиотики, влияющие на обмен РНК (например, актиномицин), подавляют образование пуфов, а антибиотики, ингибирующие синтез белка (например, пуромицин), не влияют на этот процесс. Следовательно, активность пуфов находится под контролем гормональных факторов (закодированных в генотипе) и факторов внешней среды.
Особенно велика роль стероидных гормонов в регуляции генной активности у животных. Известно, что гормоны синтезируются в специализированных клетках желез внутренней секреции и циркулируют по всему организму. Однако отдельные гормоны активируют гены не во всех клетках, а только в клетках-мишенях, которые содержат специальные рецепторные белки, с которыми специфически связываются молекулы гормона. Это связывание происходит в цитоплазме, а затем образовавшийся комплекс проникает в ядро, где он взаимодействует с определенными негистоновыми белками хромосом. В отсутствие гормонов эти белки блокируют либо промоторные, либо иные, пока неизвестные регуляторные участки определенных генов. Комплекс «гормон – рецепторный белок» снимает блокирующее действие негистонового белка-репрессора, следствием чего являются транскрипция данного гена, созревание мРНК, транспорт ее в цитоплазму и синтез белка.
Образование и функционирование хромосом типа «ламповых щеток». Связь синтетической активности с морфологическими преобразованиями хромосом была установлена при изучении оогенеза у амфибий, в ходе которого образуются хромосомы типа «ламповых щеток». Эти хромосомы получили свое название за сходство со щетками, которыми когда-то чистили керосиновые лампы. Они имеют отчетливо выраженное хромомерное (узелковое) строение. Из хромомеров в виде петель вытянуты ДНК-вые оси хромосом. Поскольку хромосомы типа ламповых щеток существуют в диплотене и состоят из четырех хроматид, каждый участок таких хромосом представлен четырьмя хромомерами и четырьмя петлями. Окружение петель представляет собой гранулы и фибриллы, состоящие из вновь синтезированной РНК и белков. Таким образом, петли – это участки хромомера с интенсивной транскрипцией. Обычно в них легко различают тонкий конец, где начинает свое движение РНК-полимераза, и толстый конец, где транскрипция заканчивается. При снижении синтетической активности петли синтезированная РНК отделяется от хромосомы и петля спадает.
Число петель близко к числу типов РНК, присутствующих в цитоплазме. Эта РНК частично используется для синтеза рибосом и белков цитоплазмы яйца. Однако большая часть молекул мРНК, синтезированных хромосомами типа ламповых щеток, используется позже во время раннего эмбриогенеза.
Цитохимическое изучение хромосом типа «ламповых щеток» выявило их функциональное сходство с политенными хромосомами.
3 – Регуляцияэкспрессии генов на посттранскрипционном уровне: модификации (сплайсинг) мРНК
Регуляция на уровне процессинга РНК обеспечивает возможность образования различных типов зрелой, функционально активной мРНК. Процессинг РНК регулируется с помощью рибозимов (катализаторов рибонуклеиновой природы – низкомолекулярных РНК) и ферментов матураз.
Одной из форм сплайсинга является альтернативный сплайсинг, при котором одному участку ДНК и одному первичному транскрипту (пре-мРНК) может соответствовать несколько типов зрелой мРНК и, соответственно, несколько изотипов (т.е. разных форм) одного и того же белка, например, мышечного белка тропонина. Твердо установлено, что некоторые генетические заболевания человека (фенилкетонурия, некоторые гемоглобинопатии) обусловлены нарушением сплайсинга.
Сплайсинг РНК открыт сравнительно недавно, поэтому достоверных данных по регуляции активности генов на этом уровне недостаточно. Наиболее подробно изучена регуляция генов, контролирующих усвоение галактозы у дрожжей. Показано, что эти системы регуляции действуют как на уровне транскрипции, так и на посттранскрипционном уровне. При этом осуществляется многоступенчатая, или каскадная, регуляция, в которой участвуют элементы позитивного и негативного контроля, последовательно регулирующие активность друг друга.
4 – Регуляцияэкспрессии генов на уровне трансляции
Регуляция на уровне трансляции обусловлена различной активностью разных типов мРНК. Например, у прокариот некоторые мРНК транслируются только в присутствии эритромицина. У эукариот регуляция генной активности на уровне трансляции хорошо прослежена на примере морского ежа. Его неоплодотворенные яйца содержат большое количество «замаскированной» (нетранслируемой) мРНК. У дрозофилы подобные мРНК, кодирующие белки оболочки яйцеклетки, накапливаются в цитоплазме.
5 – Регуляцияэкспрессии генов на уровне посттрансляционной модификации белков.
Экспрессия генов на уровне посттрансляционной модификации полипептидов регулируется путем посттрансляционной модификацией белков (фосфорилированием, ацетилированием, расщеплением исходной полипептидной цепи на более мелкие фрагменты и т.д.). Например, белковый гормон инсулин, синтезирующийся в клетках поджелудочной железы, образуется в форме препроинсулина, из которого затем путем отщепления «лишних» пептидов образуется проинсулин. Из проинсулина вырезаются две субъединицы, представляющие собой А- и В-цепи инсулина. Эти две цепи сшиваются между собой с помощью дисульфидных мостиков. Четыре образовавшиеся АВ-структуры соединяются в белковый тетрамер, который присоединяет два иона Zn 2+ , и в результате образуется зрелый инсулин.
Широко распространен механизм регуляции активности ферментов, основанный на присоединении к ним молекул-эффекторов. Чаще всего в роли эффекторов выступают конечные продукты цепей биосинтеза, которые связываются с первым или с одним из первых ферментов данного метаболического пути и подавляют его активность, тем самым выключая всю цепь синтеза. Это ингибирование конечным продуктом, благодаря которому регулируются сразу несколько этапов метаболизма. Конечный продукт связывается с ферментом не в его активном центре, а в аллостерическом центре, и такое взаимодействие индуцирует изменение (инактивацию) активного центра фермента.
Транпортные белки клеточной мембраны. Диффузия через клеточную мембрану
Внеклеточная жидкость содержит много ионов натрия и мало — ионов калия. Соотношение этих ионов во внутриклеточной жидкости противоположное. Кроме того, во внеклеточной жидкости гораздо больше ионов хлора по сравнению с внутриклеточной жидкостью. В то же время концентрации фосфатов и белков внутри клеток значительно выше, чем во внеклеточной жидкости. Такие различия чрезвычайно важны для жизни клетки. Цель этой главы — объяснить, как эти различия обеспечиваются транспортными механизмами клеточных мембран.
Структура мембраны, покрывающей каждую клетку организма, изложена в главе 2 и представлена на рис. 2—3 и 4—2. Эта мембрана почти полностью состоит излипидного бислоя и большого числа белковых молекул, многие из которых пронизывают мембрану насквозь.
Липидный бислой не смешивается ни с внеклеточной, ни с внутриклеточной жидкостями, что создает барьер для перемещения молекул воды и водорастворимых веществ между внеклеточным и внутриклеточным пространствами. Это так называемые жирорастворимые вещества.

Химический состав внеклеточной и внутриклеточной жидкостей.
Молекулы белков в мембране обладают совсем другими свойствами для транспорта веществ. Их молекулярная структура нарушает непрерывность липидного бислоя, образуя альтернативный путь сквозь клеточную мембрану. Большинство из этих пронизывающих мембрану белков могут функционировать в качестве транспортных белков. Различные белки функционируют по-разному. Некоторые имеют проходящие через молекулу водные пространства, что делает возможным свободное движение воды и некоторых ионов или молекул; это так называемые белки каналов.
Другие белки, называемые белками-переносчиками, для транспорта молекул или ионов связываются с ними; конформационные изменения белковых молекул затем переносят вещества через внутреннюю структуру белка на другую сторону мембраны. И белки каналов, и белки-переносчики обычно обладают высокой избирательностью по отношению к типам молекул или ионов, позволяя только определенным из них проходить через мембрану. Примерно аналогичный механизм транспорта может возникнуть и у некачественных натяжных потолков.
Диффузия в сравнении с активным транспортом. Транспорт через клеточную мембрану непосредственно сквозь липидныи бислой или с помощью белков осуществляется одним из двух основных процессов: диффузией или активным транспортом.
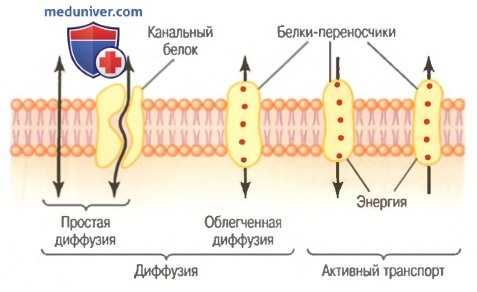
Транспортные пути через клеточную мембрану и основные механизмы транспорта.
Диффузия означает случайное движение молекул веществ через межмолекулярные пространства в мембране или в комбинации с белком-переносчиком, но существуют много вариаций этих основных механизмов. Энергией, обеспечивающей диффузию, является энергия обычного кинетического движения материи.
Активный транспорт означает движение ионов или других веществ через мембрану в комбинации с белком-переносчиком, который заставляет вещество двигаться против энергетического градиента, например из области низкой концентрации в область высокой концентрации. Такое движение требует дополнительного источника энергии помимо кинетической энергии. Далее представлены более детальные объяснения физических и физико-химических основ этих двух процессов.
Все молекулы и ионы в жидкостях организма, состоящих из воды и растворенных в ней веществ, находятся в постоянном движении, причем каждая частица движется в своем направлении. Движение этих частиц создает то, что физики называют теплом. Чем сильнее движение, тем выше температура. Это движение никогда и ни при каких условиях не прекращается, если только температура не равна абсолютному нулю.

Диффузия растворенной молекулы в течение 0,001 сек.
Когда движущаяся молекула А приближается к неподвижной молекуле Б, электростатические и другие ядерные силы молекулы А толкают молекулу Б, передавая ей часть энергии движения молекулы А. При этом молекула Б приобретает кинетическую энергию движения, тогда как молекула А замедляется, теряя часть своей кинетической энергии. В связи с этим одиночная молекула в растворе «отскакивает» от других молекул сначала в одном направлении, затем — в другом и т.д., совершая тысячи случайных «отскоков» в секунду. Такое непрерывное движение молекул относительно друг друга в жидкостях или газах называют диффузией.
Ионы диффундируют так же, как целые молекулы, и даже взвешенные коллоидные частицы рассеиваются подобным образом, однако скорость диффузии коллоидов гораздо меньше из-за их больших размеров.
Читайте также:
- Диагноз хронического мезотимпанита. Прогноз гнойного мезотимпанита
- Отсутствие фронтальных зубов. Артикуляционное равновесие.
- Психика и пищеварительный тракт. Нарушения пищеварения при стрессе
- Диагностика синдрома Стерджа-Вебера на МРТ, КТ
- Внутрисуставная инъекция контраста под флюороскопическим контролем (артрография): показания, противопоказания, методика
