Результаты кохлеарной имплантации при аплазии (гипоплазии) улиткового нерва
Добавил пользователь Владимир З. Обновлено: 23.01.2026
Прогноз, результаты кохлеарной имплантации у детей и взрослых
а) Результаты кохлеарной имплантации у постлингвально оглохших взрослых. В настоящее время общепризнано, что постлингвально оглохшие взрослые в большинстве случаев начинают распознавать слова в открытом звуковом поле. Поскольку эффективность кохлеарной имплантации у постлингвально оглохших взрослых более не подвергается сомнению, в последнее время опубликовано только несколько исследований об этом.
В недавно завершенном исследовании Nucleus Freedom® существенное улучшение наблюдалось только через шесть месяцев использования. Средний результат в HINT вырос с < 5% почти до 80%.
Gstoettner et al. оценили улучшение в 21 случае неотобранных постлингвально оглохших взрослых, получивших устройство MED-EL COMBI 40+®. Через 12 месяцев после имплантации понимание предложений составляло в среднем > 85%. Информация о новом имплантате MED-EL Pulsar® только появляется, но она весьма многообещающая.
В то время как общие результаты по слуху очень значительно улучшились в последнее десятилетие, индивидуальные результаты по слуху все еще варьируют и не поддаются прогнозированию.
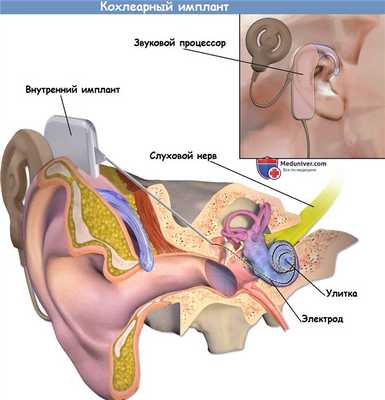
б) Результаты кохлеарной имплантации у детей. Waltzmann et al. оценили лечение 36 прелингвально глухих детей в возрасте менее пяти лет, получивших устройства Nucleus®. У всех детей развилось значительное распознавание речи в свободном ноле, и 37 из 38 детей стали использовать устную речь в качестве единственного средства общения. Blamey et al. оценили 47 прелингвально глухих детей со средними порогами без слухового аппарата 106 дБ, использующих кохлеарный имплантат, и сравнили их с 40 детьми со средними порогами 78 дБ, использующими слуховые аппараты. Обе группы проходили орально/ауральную реабилитацию.
За ними тщательно наблюдали, и проводили оценку через каждые три месяца. Результаты позволяют предположить, что все дети достигают 90% распознавания речи, но все они начинают ходить в среднюю школу с отсрочкой на 4-5 лет, если им не проводят интенсивную языковую терапию. Tomblin et al. показали, что грамматическое развитие значительно лучше у прелингвально глухих детей, получивших кохлеарный имплантат, по сравнению с не получившими.
Важным практическим способом оценки эффективности кохлеарной имплантации является установка соотношения использующих и не использующих имплантаты. Предположительно, дети, которые находят имплантаты полезными, используют их. А те дети, которые не находят имплантаты полезными для себя, не будут использовать их. Archbold et al. в течение трех лет наблюдали за 161 ребенком. Все дети использовали устройства. Родители характеризовали своих детей в 89% случаев как постоянно использующих устройства и в 11% как использующих «большую часть времени».
Учителя оценивали детей несколько лучше: 95% постоянно использующих и 4% использующих «большую часть времени». Ни родители, ни учителя не характеризовали ни одного ребенка как не использующего или редко использующего имплантат. Для объяснения различия в результатах рассматривалось большое количество факторов. Cheng et al. показали, что результаты по слуху у детей не зависят от причины глухоты. Длина электродной решетки и число активных электродов при неизменных порогах оказались неактуальными. После того как в улитку успешно установлено более 10 электродов, число электродов уже не коррелирует с послеоперационной эффективностью.
Было выдвинуто предположение, казавшееся логичным, что большая глубина введения обеспечит лучший эффект, но подтверждения не появилось. Hodges et al. показали, что введение устройства Nucleus 22® за 22 кольцо, не улучшило результат у 31 пациента.
Длительность глухоты оказалась значимым фактором, обладающим прогностической ценностью, как показано во многих исследованиях. Rubinstein et al. показали, что длительность глухоты вместе со значением дооперационных результатов теста CID объясняют до 70% наблюдаемых различий у реципиентов кохлеарных имплантатов.
Способ коммуникации, как оказалось, имеет значительное влияние на исход. Hodges et al. показали, что дети, использующие в качестве опыта коммуникации только устную речь показывают лучшие результаты, по сравнению с детьми, использующими тотальную коммуникацию. Действительно в их исследовании это было самым важным предиктором успеха. Geers и Nicholas в оценке 180 реципиентов кохлеарных имплантатов обнаружили, что дети в среде, требующей от них полагаться только на разговорную речь (а не на язык жестов), получали больше пользы от их кохлеарных имплантатов.
С другой стороны, Robbins et al. оценили 23 ребенка с глубокой прелингвальной потерей слуха, и не нашли разницы между использовавшими оральную коммуникацию и теми кто использовал тотальную коммуникацию.
в) Обучение речи и языку после кохлеарной имплантации. В результате кохлеарной имплантации было доказано не только улучшение в восприятии речи (слухе), но и улучшение способности к экспрессивной речи и языковых навыков. Однако доказательства, подтверждающие резкое улучшение в экспрессивных языковых навыках у реципиентов кохлеарных имплантатов накапливаются намного медленнее. Moog и Geers исследовали 22 прелингвально оглохших ребенка, получивших кохлеарные имплантаты. У всех них были показатели понимания речи статистически лучше, чем у детей со слуховыми аппаратами, у половины из них языковые показатели попадали в средний диапазон для нормально слышащих детей.
Tobey et al. показали, что понимание речи коррелирует с уровнем разборчивости речи, и оно лучше, если дети получают слуховую вербальную терапию, чем если их лечат в окружении с тотальной коммуникацией. Robbins et al. сравнили, с использованием шкалы языкового развития Reynell, 23 прелингвально оглохших ребенка с кохлеарными имплантатами с 89 глухими детьми, получавшими лечение без кохлеарной имплантации (без оссификации). Реципиенты кохлеарных имплантатов на семь месяцев опередили достижения, ожидавшиеся на основе предыдущих исследований развития. Уровень языкового развития был почти таким же, как и у нормально слышащих детей. Svirsky et al. сравнивали 43 ребенка с кохлеарными имплантатами с 52 детьми, использовавшими слуховые аппараты. У пользователей кохлеарных имплантатов было лучшее понимание речи, чем у детей со слуховыми аппаратами, а у детей при слуховой вербальной коммуникации понимание речи было лучше, чем у детей при тотальной коммуникации.
Myamoto et al. сообщили, что у детей с кохлеарными имплантатами отмечается намного больше достижений в экспрессивных языковых навыках после имплантации, чем ожидалось на основе наблюдения когорты из 89 неимплантированных глухих детей.
Geers et al. в когортном исследовании 181 ребенка, которым была выполнена имплантация в возрасте до пяти лет, определили, что более половины этих детей говорили и понимали английский язык на уровне, сравнимом с их слышащими ровесниками. Далее, они отметили, что такие результаты не гарантировано достигаются у детей с глубокой потерей слуха при использовании слуховых аппаратов, и поэтому язык жестов не обеспечивает ожидавшегося лингвистического преимущества. У детей не обучавшихся языку глухонемых и не пользовавшихся им регулярно, языковые навыки были лучше.
В общем, кохлеарные имплантаты позволяют детям вернуть нормальную возможность понимать речь и язык сразу же после установки, но они не могут полностью преодолеть ущерб, нанесенный ранней слуховой депривацией. Поэтому разрыв между хронологическим возрастом и возрастом по языковому развитию, который постоянно увеличивается у неимплантированых детей, после кохлеарной имплантации остается постоянным.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
«Проект: Аудиология» - сборник научно-практических материалов для профессионалов в области аудиологии и слухопротезирования, включающий материалы конференций, статьи по кохлеарной имплантации, отоневрологии и законодательные акты по сурдологии.

Аномалии развития внутреннего уха и кохлеарная имплантация
В.Е. Кузовков, Ю.К. Янов, С.В. Левин
Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи
Кохлеарная имплантация (КИ) в настоящее время является общепризнанным в мировой практике и наиболее перспективным направлением реабилитации лиц, страдающих сенсоневральной тугоухостью высокой степени и глухотой, с последующей интеграцией их в среду слышащих. В современной литературе достаточно широко освещены вопросы классификации аномалий развития внутреннего уха, в том числе применительно к КИ, описаны хирургические методики проведения КИ при данной патологии. Мировой опыт КИ у лиц с аномалиями развития внутреннего уха насчитывает более 10 лет. В то же время в отечественной литературе отсутствуют работы по данной тематике.
В Санкт-Петербургском НИИ уха, горла, носа и речи впервые в России стала выполняться КИ у лиц, имеющих аномалии развития внутреннего уха. Трехлетний опыт подобных операций, наличие успешных результатов таких вмешательств, а также недостаточное количество литературы по данному вопросу, послужили причиной выполнения данной работы.
Классификация аномалий развития внутреннего уха. Современное состояние вопроса.
С появлением в конце 80-х – начале 90-х г.г. компьютерной томографии (КТ) высокого разрешения и магнитно-резонансной томографии (МРТ) данные методики стали широко применяться для диагностики наследственной тугоухости и глухоты, особенно при определении показаний к КИ. С помощью этих прогрессивных и высокоточных методик были выявлены новые аномалии, которые не укладывались в существовавшие классификации F. Siebenmann [5] и K. Terrahe [7]. В результате чего R.K. Jackler [1, 2] были предложена новая классификация, расширенная и модифицированная N. Marangos [4] и L. Sennaroglu [5]. Однако, следует отметить, что, в частности, МРТ в настоящее время выявляет настолько тонкие детали, что обнаруживаемые мальформации бывает трудно классифицировать [3, 4].
В своей классификации аномалий развития внутреннего уха, основанной на данных обычной рентгенографии и первых данных КТ, R.K. Jackler [1] принимал во внимание отдельное развитие преддверно-полукружной и преддверно-улитковой частей единой системы. Автор предположил, что различные типы аномалий появляются в результате задержки или нарушения развития на определенной стадии последнего. Таким образом, обнаруживаемые типы мальформаций соотносятся с временем нарушения. Позже автор рекомендовал относить комбинированные аномалии к категории А, и предположил связь таких аномалий с наличием расширенного водопровода преддверия (табл.1).
В классификации N. Marangos [3] включены неполное или аберрантное развитие лабиринта (табл. 2, пункт 5).
Таблица 2
Классификация аномалий развития внутреннего уха по N. Marangos
| Категория | Подгруппа |
| А = неполное эмбриональное развитие | 1. Полная аплазия внутреннего уха (аномалия Michel) 2. Общая полость (отоцист) 3. Аплазия/гипоплазия улитки (нормальный «задний» лабиринт) 4. Аплазия/гипоплазия «заднего лабиринта» (нормальная улитка) 5. Гипоплазия всего лабиринта 6. Дисплазия Mondini |
| В = аберрантное эмбриональное развитие | 1. Расширенный водопровод преддверия 2. Узкий внутренний слуховой проход (внутрикостный диаметр менее 2 мм) 3. Длинный поперечный гребень (crista transversa) 4. Внутренний слуховой проход, разделенный на 3 части 5. Неполное кохлеомеатальное разделение (внутреннего слухового прохода и улитки) |
| С = изолированные наследственные аномалии | Х-связанная тугоухость |
| D | Аномалии при наследственных синдромах |
Таким образом, описаны четыре категории (A-D) аномалий развития внутреннего уха. Расширенным водопровод преддверия автор считает, если межкостное расстояние в средней части превышает 2 мм, тогда как другие авторы приводят цифру в 1,5 мм.
L. Sennaroglu [4] дифференцирует 5 основных групп (табл. 3): аномалии развития улитки, преддверия, полукружных каналов, внутреннего слухового прохода и водопровода преддверия или улитки.
Основные группы и конфигурации кохлеовестибулярных аномалий по L. Sennaroglu
| Основные группы | Конфигурация |
| Кохлеарные аномалии | Аномалия Michel / аплазия улитки / общая полость / неполное разделение тип I / гипоплазия улитки / неполное разделение тип II / нормальная улитка |
| Вестибулярные аномалии | Преддверие: отсутствие / гипоплазия / расширение (включая аномалию Michel и общую полость) |
| Аномалии полукружных каналов | Отсутствие / гипоплазия / увеличенные размеры |
| Аномалии внутреннего слухового прохода | Отсутствие / узкий / расширенный |
| Аномалии водопроводов преддверия и улитки | Расширенный / нормальный |
Кохлеарные мальформации (табл. 4) были разделены автором по степени выраженности на шесть категорий в зависимости от времени нарушения нормального хода эмбрионального развития. Эта классификация аномалий развития улитки включает неполное разделение I и II типов.
Таблица 4
Классификация аномалий улитки по времени нарушения внутриутробного развития по L. Sennaroglu
| Кохлеарные мальформации | Описание |
| Аномалия Michel (3-я неделя) | Полное отсутствие кохлеовестибулярных структур, часто – апластичный внутренний слуховой проход, чаще всего – нормальный водопровод преддверия |
| Аплазия улитки (конец 3-ей недели) | Улитка отсутствует, нормальное, расширенное или гипопластическое преддверие, и система полукружных каналов, часто – расширенный внутренний слуховой проход, чаще всего – нормальный водопровод преддверия |
| Общая полость (4-ая неделя) | Улитка и преддверие – единое пространство без внутренней архитектуры, нормальная или деформированная система полукружных каналов, либо ее отсутствие; внутренний слуховой проход чаще расширен, чем сужен; чаще всего – нормальный водопровод преддверия |
| Неполное разделение тип II (5-ая неделя) | Улитка представлена единой полостью без внутренней архитектуры; расширенное преддверие; чаще всего – расширенный внутренний слуховой проход; отсутствующая, расширенная или нормальная система полукружных каналов; нормальный водопровод преддверия |
| Гипоплазия улитки (6-ая неделя) | Четкое разделение кохлеарных и вестибулярных структур, улитка в виде пузырька небольших размеров; отсутствие или гипоплазия преддверия и системы полукружных каналов; суженный или нормальный внутренний слуховой проход; нормальный водопровод преддверия |
| Неполное разделение, тип II (аномалия Мондини) (7-ая неделя) | Улитка в 1,5 завитка, кистозно расширенные средний и апикальный завитки; размеры улитки близки к норме; незначительно расширенное преддверие; нормальная система полукружных каналов, расширенный водопровод преддверия |
Учитывая вышеизложенные современные представления о видах кохлеовестибулярных нарушений, мы используем классификации R.K. Jackler и L. Sennaroglu, как наиболее соответствующие находкам, встречающимся в собственной практике.
Принимая во внимание небольшое число прооперированных пациентов, ниже представлен один случай успешной КИ при аномалии развития внутреннего уха.
Случай из практики.
В СПб НИИ ЛОР в марте 2007 года обратились родители пациентки К., 2005 года рождения с жалобами на отсутствие у ребенка реакции на звуки и отсутствие речи. В ходе обследования был установлен диагноз: Хроническая двухсторонняя сенсоневральная тугоухость IV степени, врожденной этиологии. Вторичное расстройство рецептивной и экспрессивной речи. Последствия перенесенной внутриутробной цитомегаловирусной инфекции, внутриутробного поражения центральной нервной системы. Резидуально-органическое поражение центральной нервной системы. Левосторонний спастический верхний монопарез. Аплазия I пальца левой кисти. Дисплазия тазобедренных суставов. Спастическая кривошея. Тазовая дистопия гипоплазированной правой почки. Задержка психомоторного развития.
По заключению детского психолога – познавательные способности ребенка в пределах возрастной нормы, интеллект сохранен.

При проведении игровой аудиометрии в слуховых аппаратах выявлены реакции на звуки интенсивностью 80-95 дБ в диапазоне частот от 250 до 1000 Гц.
КТ височных костей выявила наличие двухсторонней аномалии развития улитки в виде неполного разделения I типа (табл. 4). При этом данное утверждение верно как для левого, так и для правого уха, несмотря на различную, на первый взгляд, картину (рис.1).
Рис. 1. Данные КТ пациентки К.

Примечание: Так, справа (1) улитка представлена небольшой полостью, максимальный размер которой составляет не более 5 мм, преддверие и полукружные каналы отсутствуют. Слева (2) улитка представлена единой полостью без внутренней архитектуры, отмечается наличие расширенного преддверия (рис. 2, стрелка); расширенная система полукружных каналов (рис. 3, стрелка).
Рис.2. Расширенное преддверие слева

Рис. 3. Расширенная и деформированная система полукружных каналов слева
После обследования пациентке проведена КИ на левом ухе классическим доступом через антромастоидотомию и заднюю тимпанотомию, с введением электрода через кохлеостому. Для операции использовался специальный укороченный электрод (Med-El, Австрия), имеющий рабочую длину активного электрода около 12 мм, специально разработанный для применения в случаях аномалии или оссификации улитки.
Несмотря на сохранные слуховые косточки и сухожилие стременной мышцы, акустические рефлексы со стременной мышцы в ходе операции зафиксированы не были. Однако, при проведении телеметрии нервного ответа, были получены четкие ответы при стимуляции 7 электродов из 12.

Послеоперационная трансорбитальная рентгенография улиток выявила, что активный электрод импланта находится в общей полости (рис. 4, стрелка), приняв форму идеальной окружности.
Рис. 4. Трансорбитальная рентгенография. Укороченный электрод в общей полости.
При контрольном аудиологическом обследовании через год после операции у пациентки обнаружены реакции в свободном звуковом поле на звуки интенсивностью в 15-20 дБ в диапазоне частот от 250 до 4000 Гц. Речь пациентки представлена одно- и двусложными словами («мама», «дай», «пить», «киса» и др.), простой фразой из не более двух одно- или двусложных слов. Учитывая то, что возраст пациентки на момент повторного обследования составлял менее 3 лет, результаты слухоречевой реабилитации в данном случае следует считать отличными.
Современная классификация аномалий развития внутреннего уха не только дает представление о многообразии такой патологии и времени появления дефекта в процессе внутриутробного развития, но и является полезной при определении показаний к проведению кохлеарной имплантации, в процессе выбора тактики для проведения вмешательства. Представленное в работе наблюдение позволяет оценить возможности кохлеарной имплантации, как средства реабилитации, в сложных случаях, расширяет представления о показаниях к проведению имплантации.
Аудиторные нейропатии (заболевания профиля аудиторных нейропатий): подходы к диагностике и реабилитации
Г.А. Таварткиладзе
Российский научно-практический центр аудиологии и слухопротезирования ФМБА России, Москва, Россия, 117513; Кафедра сурдологии РМАПО Минздрава России, Москва, Россия, 123395
Журнал: Вестник оториноларингологии. 2014;(2): 9-16
Принятые сокращения:
АН - аудиторные нейропатии,
ОАЭ - отоакустическая эмиссия,
КСВП - коротколатентные слуховые вызванные потенциалы,
ВВК - внутренние волосковые клетки,
НВК - наружные волосковые клетки,
МП - микрофонный потенциал.
Аудиторные нейропатии (заболевания профиля аудиторных нейропатий) (АН) являются одной из наиболее интригующих и сложных патологий как для диагностики, так и для выбора метода реабилитации. Несмотря на то, что в последнее время данная патология привлекает все большее внимание исследователей и клиницистов, первые статьи, посвященные АН, относятся к 1996 г. [1, 2]. Сегодня во всем мире под наблюдением находятся тысячи пациентов с АН, и число их увеличивается с каждым годом. По данным G. Rance [3] и T. Picton [4], порядка 10% детей, родившихся с сенсоневральной тугоухостью, могут иметь АН. Этот показатель повышается до 15-20% у детей с выраженной степенью тугоухости [5].
Основным клиническим проявлением АН является сенсоневральное снижение слуха разной выраженности (от умеренного до глухоты) с сохранной функцией наружных волосковых клеток. У больных регистрируется отоакустическая эмиссия (ОАЭ), но отсутствуют коротколатентные слуховые вызванные потенциалы (КСВП).
К АН относят функциональные нарушения или патологические изменения в периферическом отделе слухового анализатора (в функциональном комплексе, сформированном внутренними волосковыми клетками (ВВК), нейронами спирального ганглия и синапсами 1-го порядка между ВВК и улитковым нервом). При этом в качестве патофизиологической модели рассматриваются нарушения временной суммации разрядов первичных афферентов.
К основным этиологическим факторам, лежащим в основе развития АН, относятся генетическая и митохондриальная патология [6, 7], вес при рождении менее 1500 г, неонатальная гипербилирубинемия (более 350 мкМоль/л) [8], врожденные пороки развития; асфиксия при родах и пр. [9, 10].
Диагноз «аудиторная нейропатия» используется для описания нарушений слуха, обусловленных дисфункцией ВВК или синапсов между ВВК и волокнами слухового нерва наследственной природы и/или дисфункцией непосредственно слухового нерва. Патология ВВК (аналогичная карбоплатиновой интоксикации у экспериментальных животных) или их синапсов с нервными волокнами выражается в отсутствии КСВП.
Процессы демиелинизации в афферентных волокнах 1-го типа сопровождаются подавлением генерации и распространения ПД в пределах волокна, что в свою очередь ведет к резкому снижению амплитуды КСВП и удлинению ЛП.
Митохондриальная патология сопровождается угнетением синтеза АТФ, энергетическим дефицитом, снижением синхронности разрядов волокон за счет медленного восстановления отдельных нейронов после генерации ПД и резким снижением амплитуды и удлинением ЛП КСВП.
Во всех случаях регистрируются ОАЭ и микрофонный потенциал (МП), определяемый при проведении электрокохлеографии, свидетельствующие о сохранности наружных волосковых клеток (НВК).
Учитывая неточность термина (повреждение ВВК - патология нерва, генетическая природа глухоты, изолированное повреждение нерва при шумовой травме), было принято решение о переименовании аудиторной нейропатии в «аудиторную десинхронизацию» [11].
Дополнительно было предложено подразделение АН на подтипы [12]:
тип 1 - пресинаптический (локализация процесса до места генерации ПД - немиелинизированная, дистальная часть слухового нерва);
тип 2 - постсинаптический (проксимальная часть слухового нерва).
В 2008 г. терминология была пересмотрена с учетом локализации патологического процесса [13]. При вовлечении в процесс слухового нерва и сохранности внутренних волосковых клеток и синапсов было предложено обозначать патологию как заболевание слухового нерва, а при сохранности слухового нерва и поражении синапса - как заболевание слухового синапса. Однако учитывая сложность четкого выделения подтипов, принципиальное значение приобретает проведение дополнительных исследований.
- распространенность термина;
- наличие спектра тугоухости от незначительной степени снижения слуха до глухоты;
- введение термина «спектр» позволило распространить его не только на патологию нерва, но и на ВВК и синапс.
- незначительные проблемы со слухом и пониманием речи или их отсутствие при патологических аудиологических тестах;
- нарушение разборчивости речи (особенно в шуме) при нормальных порогах слуха (рис. 1);
- флюктуирующая тугоухость;
- функциональная глухота.

Рисунок 1. Разборчивость фонем в шуме в норме и у больного с аудиторной нейропатией.

Рисунок 2. Данные тональной аудиометрии, регистрации КСВП, ОАЭ и микрофонного потенциала у больного с односторонней аудиторной нейропатией.
- Может ли пациент с отсутствием КСВП, нормальной ОАЭ, нормальными порогами слышимости и нормальной разборчивостью иметь заболевание?
- Насколько патологическими должны быть КСВП? Имеет ли заболевание пациент со снижением слуха в 25 дБ и порогами КСВП на щелчок 50 дБ?
При обследовании детей с АН рекомендуется следующий набор тестов:
- анамнез и консультация педиатра;
- отоскопия, КТ и МРТ улитки и слухового нерва;
- медицинское генетическое исследование;
- офтальмологическое исследование;
- неврологическое исследование.
При определении реабилитационных стратегий рассматриваются три основные принципа: 1) этиология заболевания позволяет определить, является ли патологическое состояние постоянным или преходящим [10, 24, 25], и сделать выбор между медикаментозным или хирургическим лечением либо электроакустической коррекцией;
2) учитывая то, что дети с АН и особенно те, кто находился в палатах интенсивной терапии, относятся к группе риска по сопутствующей патологии, раннее выявление отставания в развитии может оптимизировать дальнейшую тактику реабилитации; 3) у детей с АН могут вторично развиваться внутричерепные и периферические нейропатии.
АН может быть как двусторонней, так и односторонней. У всех детей с АН и особенно тех, у кого имеется одностороннее поражение и отсутствуют анамнестические данные, указывающие на возможность развития АН [26], а также с односторонней аномалией челюстно-лицевого скелета [27] необходимо рассматривать вероятность наличия аплазии или гипоплазии слухового нерва. С этой целью рекомендуется проведение КТ и МРТ.
Следует иметь в виду, что у некоторых детей слуховая функция восстанавливается в течение первых двух лет жизни [10].
У детей в возрасте до 24 мес следует очень осторожно относиться к результатам регистрации КСВП (при их отсутствии). Для принятия решения о реабилитации необходимо динамическое наблюдение!
Корковые ВП: среднелатентный СВП, длиннолатентный СВП, Mismatch Negativity (MMN), Р300
При невозможности определить пороги слышимости у детей, а также для определения прогноза реабилитационных мероприятий рекомендуется регистрация СВП коркового происхождения [15, 36, 37]. Больные, у которых регистрировались длиннолатентные СВП и отрицательный потенциал рассогласования (MMN), имели достоверно больший процент распознавания слов и лучшие результаты при использовании усиления [15].
Наличие MMN (рис. 3) указывает на активное кодирование акустических характеристик на корковом уровне, что способствует восприятию речи.
Отсутствие электрически вызванных средне- и длиннолатентных СВП у больных АН коррелирует с ухудшением восприятия речи.
В некоторых случаях возможна также регистрация корковых ВП у больных при отсутствии средне- и коротколатентных СВП (рис. 4), что коррелирует с данными, свидетельствующими о том, что у некоторых больных с отсутствием КСВП сохраняется некоторая способность к различению речи.
У больных с АН отмечается достоверное изменение потенциала N100 на большие изменения частоты или интенсивности, чем в контрольной группе. Удлинение ЛП N100 также более выражено при АН (больше на низких частотах и больше при изменении интенсивности, чем частоты). Отмечается также более выраженное подавление амплитуды при изменении частоты. Исключение составляют лишь больные с пресинаптической природой АН, у которых амплитуда увеличивается.
Отмеченные изменения характерны как для нарушения временной обработки (низкие частоты), так и для невральной адаптации (высокие частоты).
Из 118 детей с диагностированной АН у 42% была отмечена недоношенность и нахождение в палатах интенсивной терапии, искусственная вентиляция легких и гипербилирубинемия [38]. Авторы отметили, что у 2/3 детей, которым была проведена МРТ, имелось по крайней мере одно внутричерепное осложнение, а у 41% - 2 и более внутричерепных осложнений.
Скрининг
При проведении скрининга, основанного на регистрации ОАЭ, АН не выявляются. Это свидетельствует о том, что для повышения эффективности универсального аудиологического скрининга необходимо проведение сочетанной регистрации ОАЭ и КСВПВ.
В соответствии с рекомендациями Joint Committee of Infant Hearing [39] новорожденным, находящимся в палатах интенсивной терапии более 5 дней, должна проводиться регистрация КСВП.
Учитывая то, что при повышенном уровне билирубина и/или низком весе при рождении может иметь место восстановление слуховой функции [10, 24], для принятия решения о реабилитации (имплантация) необходимо динамическое наблюдение. Кроме того, регистрация КСВП должна проводиться детям, в семье которых имелись нарушения слуха в детстве, а также детям с сенсорными моторными нейропатиями.
- Мутация гена DFNB9 (OTOF) в хромосоме 2р 22-23 ответственна за продукцию белка Otoferlin. Белок локализуется в ВВК [7, 40]. Мутация гена OTOF ответственна за множество несиндромальных форм нейропатий [41]. При этом изменения имеют место только в синаптической области ВВК. Otoferlin является сенсором вхождения Ca2+ в ВВК из синапса.
- Мутация гена DFND59, кодирующего белок Pejvakin, в хромосоме 2q31.1-31.3, приводит к повреждению белка, обнаруженного в клетках спирального ганглия и структур слуховых проводящих путей. В отличие от мутации OTOF имеет место невральная тугоухость [42].
- Несиндромальный доминантный тип прогрессирующей АН, обусловленный патологией хромосомы 13q14-21 (AUNA1) [12, 43]. Ген неизвестен, равно как и механизм действия. Симптоматика аналогична той, которая имеет место при мутации гена DFND59.
- Мутация гена DIAPH3, кодирующего белок Diaphanous, приводит к нарушению регуляции актина, стабилизации микротубул, что сопровождается нарушением синаптической передачи. Формируется несиндромальный доминантный тип АН [44].
- Мутация гена R445H приводит к нарушению синтеза белка OPA1, что сопровождается развитием постсинаптической АН за счет нарушения функции окончаний немиелинизированной части слухового нерва. КИ активируют проксимальную миелинизированную часть нерва [45, 46].
- Мутация гена MPZ приводит к потере ганглионарных клеток центральных и периферических волокон слухового нерва [47]. При этом ВВК и НВК (повреждается до 30% клеток в верхушечном завитке) не повреждаются. Снижение слуха обусловлено нарушениями на аксональном уровне. Дополнительный эффект оказывает рассинхронизация разрядов оставшихся волокон.
Слухопротезирование
На диагностическом этапе ситуация осложняется за счет того, что не регистрируются электрофизиологические ответы и приходится ориентироваться на поведенческие реакции ребенка на звуки и речь. При отсутствии динамики рекомендуется слухопротезирование.
При АН нарушается временная обработка и кодирование временных характеристик речи, что приводит к диссоциации результатов тональной и речевой аудиометрии. Учитывая то, что СА обеспечивают усиление, но не компенсируют дефицита временной обработки, результаты протезирования детей с АН всегда хуже, чем результаты у детей с сенсоневральной тугоухостью.
Исходя из предпосылки о том, что улучшение соотношения сигнал/шум у этих детей будет сопровождаться улучшением восприятия речи и развития языка [50], следует предусматривать использование FM-систем.
- Наличие ОАЭ свидетельствует о нормальной функции НВК. Не повредятся ли НВК при использовании усиления?
- Нарушение временной обработки не может быть компенсировано при помощи усиления. Что следует рекомендовать - одностороннее или двусторонне использование FM-систем?
- Следует ли исключать при протезировании использование компрессии, которая, как известно, вносит искажения во временную обработку усиленного сигнала? Если да, то как будет исключена акустическая травма?
- Как следует вести себя при флюктуирующей тугоухости?
- Когда следует ставить вопрос о кохлеарной имплантации?
В соответствии с протоколом, принятым в 2008 г., больным рекомендуется использование линейного усиления (исключение компрессии), использование низкочастотной фильтрации или высокочастотной транспозиции.
Как было отмечено выше [9], у половины детей с АН слухопротезирование эффективно. У этих детей, в отличие от пациентов с отсутствием эффекта, регистрируются корковые СВП. В наших наблюдениях положительный эффект от электроакустической коррекции был отмечен у 38 больных (46,35%).
Современные технологии слухопротезирования определяют необходимость измерения RECD (различия в уровнях звукового давления, измеренные в реальном ухе и камере связи объемом 2 см3) и использования формул предписания усиления и выхода слухового аппарата (DSLv5, NAL), для чего обязательно измерение порогов слышимости. Однако если у детей с сенсоневральной тугоухостью пороги могут быть определены при регистрации частотно-специфичных КСВП или ССВП, то у детей с АН это невозможно. В результате этого определение поведенческих порогов производится в возрасте 6-9 мес.
Кохлеарная имплантация
При отсутствии эффекта от адекватного слухопротезирования (отсутствие прогресса в понимании речи и развитии слуховых и языковых навыков) вне зависимости от поведенческих порогов рекомендуется КИ.
Дополнительно к критериям отбора детей на КИ у больных с АН должны приниматься во внимание следующие факторы:
1. Учитывая то, что у ряда детей имеет место улучшение или восстановление слуха, наблюдаемое в возрасте до 2 лет, родители должны быть информированы об этом. Решение о КИ принимается только при отсутствии динамики поведенческих порогов и КСВП. До 2-летнего возраста должны использоваться подходы к ранней реабилитации, основанные на стимуляции восприятия и продукции речи.
2. Заключение о функциональной сохранности слухового нерва должно основываться на современных методиках МРТ.
3. Дети с отсутствием прогресса в восприятии и продукции речи должны рассматриваться в качестве кандидатов для КИ вне зависимости от порогов слышимости. КИ должно предшествовать слухопротезирование.
Особое внимание должно быть уделено предоперационному промонториальному тестированию (электрическая стимуляция). При наличии нормальных электрически вызванных КСВП исключается возможность нарушения процессов миелинизации. Процесс может быть локализован на уровне ВВК и синапсов.
КИ способствует улучшению временной обработки сигналов за счет вызывания синхронных разрядов волокон слухового нерва. Как правило, КСВП регистрируются в ответ на электрическую стимуляцию у имплантированных больных.
Во всех случаях, кроме процессов демиелинизации, методом выбора является кохлеарная имплантация [28].
Следует еще раз подчеркнуть, что у детей первого года жизни с прелингвальной глухотой вне зависимости от причин, вызвавших АН, показано слухопротезирование [15].
Личный опыт: плюсы и минусы кохлеарной имплантации для взрослых

Многие люди считают, что установка кохлеарного имплантата делает человека слышащим. Это абсолютно не так. Глухой человек, которому проведена операция по установке кохлеарного имплантата, всё равно остаётся глухим. Никто не становится сразу слышащим как по волшебству. Существует много плюсов и минусов, о которых стоит знать до согласия на операцию. Правда состоит в том, что кохлеарные имплантаты могут помочь людям с глубокой потерей слуха или глухотой улучшить их коммуникативные навыки в слышащем мире. Тем не менее, не у всех слабослышащих есть позитивный опыт в сфере протезирования слуха. Некоторые глухие люди активно протестуют против использования кохлеарной имплантации.
Также есть пользователи кохлеарных имплантатов, которые возмущены тем эффектом, который производит устройство на их окружение: часто после установки имплантата друзья и семья отказываются предпринимать усилия при общении с пациентом, поскольку теперь-то он их слышит. Важно понимать, что для получения преимуществ от установленного имплантата пользователю требуется потратить много времени и сил. Ведь вы же не просто нажимаете на кнопку и «бум!» – вы можете слышать. Также стоит отметить, что такой метод восстановления слуха подходит не каждому. К тому же человек, имеющий слуховой опыт и затем потерявший слух, получит больше преимуществ от вживления ему кохлеарного имплантата по сравнению с человеком, родившимся глухим и не обладающим воспоминаниями о звуке.
История Тома
Том был слышащим и стал кандидатом на кохлеарную имплантацию уже во взрослом возрасте, когда он внезапно потерял слух. После установки имплантата он сказал: «Я активно боролся за то, чтобы мои речевые процессоры передавали звуки как можно «ближе» к натуральным. Я хотел снова слышать, что моя собака лает, а не крякает, как больная утка. Я хотел слышать тиканье часов, а не глухие стуки. И после 8 месяцев регулярных занятий со специалистом и самостоятельной тренировки слуха я обрёл тот бионический слух, о котором мечтал, максимально приближенный к естественному».
Как работает улитка?
Основной аппарат слуха человека состоит из трёх частей: наружного уха, среднего уха, внутреннего уха. Внутреннее ухо соединено со средним посредством овального и круглого окошек. Колебания, возникающие в овальном окошке, переходят на жидкость. Благодаря этому раздражаются рецепторы волосковых клеток, находящиеся в улитке, что приводит к образованию нервных импульсов.
Что делает кохлеарная имплантация?
Кохлеарные имплантаты – электронные девайсы, позволяющие людям с глубокой потерей слуха и полной глухотой воспринимать звуковые сигналы. Имплантаты преобразуют звуки в электрические стимулы, а речевой процессор, являющийся частью устройства, улавливает звуки из внешней среды и оцифровывает их. Эти цифровые сигналы затем отправляются к крошечным проводам с большим количеством электродов, которые имплантируются в улитку. Каждый электрод соответствует определенной частоте сигнала. Затем мозг получает сигнал через слуховой нерв. Проблема может возникнуть, когда два электрода стимулируют одни и те же нейронные популяции или перекрёстные нейронные популяции, что в итоге приводит к путанице звуков при их восприятии.
Насколько хорошо работает кохлеарный имплантат?
Кохлеарные имплантаты не подходят одинаково хорошо всем глухим людям, и не каждый человек с ослабленным слухом может стать кандидатом на получение кохлеарного имплантата. Поэтому международная команда специалистов-аудиологов старается предупредить кандидатов на вживление имплантатов о том, что не стоит возлагать на операцию нереалистичные ожидания. Также они предлагают операцию только будучи уверенными в преимуществе слуховых имплантатов для пользователя. Конечно же, они не могут со стопроцентной точностью предсказать результат реабилитации. По статистике, большинство пациентов получают все желаемые преимущества. Те, у кого потеря слуха не является врожденной, восстанавливают свою способность слышать при помощи кохлеарной имплантации гораздо быстрее, чем те, кто родился глухим и не имел слухового опыта. Так как я тоже отношусь ко второй категории пациентов, мой аудиолог сразу сообщил мне, что не стоит возлагать нереалистичных ожиданий на результаты от операции. Мне всё равно по-прежнему придётся читать по губам. Но благодаря реабилитационной терапии, прослушиванию музыки и аудиокниг во время выполнения повседневных задач, постоянных уточнений у окружающих меня людей, верно ли я расслышала звук, я продвинулась довольно далеко в освоении слуха и речи. Теперь я могу даже пользоваться телефоном и переговариваться с человеком, находящимся в другой комнате. Но всё равно многое зависит от того, как именно говорит собеседник, и иногда это осложняет точность моего восприятия.
С моими слуховыми аппаратами у меня не было надежды на понимание речи. С кохлеарными имплантатами у меня эта надежда появилась, и с большим количеством практики, упорства и труда я смогла продвинуться в развитии своей способности слышать. Это как подготовка к марафону – вы получаете то, что вложили. Важно помнить, что все люди разные и результаты при активации кохлеарного имплантата у них тоже разные. Имплантат не вылечит глухоту, но, по моему опыту, он гораздо лучше, чем слуховой аппарат.
- наличие и уровень остаточного слуха;
- продолжительность отсутствия слуха или утери части спектра слухового восприятия;
- ваш возраст, общее состояние здоровья и другие медицинские данные;
- функционирует ли ваш слуховой нерв;
- тип имплантируемого устройства;
- опыт хирурга;
- послеоперационные осложнения.
Плюсы кохлеарной имплантации
- Слух
Улучшает ваше слуховое восприятие, упрощает общение с друзьями и семьёй. - Восприятие речи
Кохлеарная имплантация значительно улучшает восприятие речи в условиях шума. - Карьера
Кохлеарная имплантация может значительно расширить ваши профессиональные возможности, устраняя опасения работодателя по поводу наличия у вас потери слуха. - Обучаемость
Кохлеарный имплантат улучшает качество восприятия информации, способствуя лучшему обучению и позволяя при изучении материала обходиться без посторонней помощи. - Безопасность
Кохлеарная имплантация даёт возможность своевременно реагировать на возникновение потенциальной опасности, например, услышать сирену или раскаты грома. - Музыка и телефон
Многие пациенты после установки им кохлеарного имплантата могут наслаждаться музыкой и пользоваться телефоном. - Уверенность в себе и независимость
Пользователи кохлеарных имплантатов испытывают прилив уверенности в себе, имея возможность полноценно участвовать в диалогах.
Минусы кохлеарных имплантатов
- Фоновый шум
Фоновые шумы, такие как голоса людей вокруг и звуки на улице, могут отрицательно влиять на восприятие речи пользователем кохлеарного имплантата. Дополнительные аксессуары могут значительно улучшить качество слуха в подобных ситуациях. - Операция
Любая операция сопряжена с риском. - Ограничение в спортивной активности
Вам придётся с осторожностью подходить к любым видам физической активности, включая высококонтактные и водные виды спорта. - Обслуживание
Наличие кохлеарного имплантата подразумевает регулярное обслуживание у специалиста. (замена батареек, замена проводов или речевого процессора). - Побочные эффекты
Требуется время, чтобы привыкнуть к кохлеарному имплантату. Устройство может раздражать вашу кожу или вы можете испытывать мускульные спазмы, онемение или паралич лицевой мышцы. К счастью, это крайне редкое явление. - Реабилитационные занятия
Звуки передаются через девайс и могут первое время восприниматься мозгом «ненатурально». Вам придётся пройти серию реабилитационных занятий и много тренировать слух самостоятельно, чтобы достигнуть наилучшего результата. - Никаких гарантий
Нет никаких гарантий, что имплантат сработает отлично именно в вашем случае. Вы можете потерять остаточный слух.
Я не могу согласиться этой точкой зрения. У меня два кохлеарных имплантата и всё равно я считаю себя глухой. Я имею в виду, что мне до сих пор приходится тяжело в шумных условиях и при общении сразу с несколькими людьми. Я никогда не стану слышащей, и это нормально. Я не только приняла свою глухоту, но теперь ещё и обладаю преимуществом избирательного слуха. Я понимаю, что глухие люди таким образом борются за уникальность своей культуры, и это здорово. Но каждый человек имеет полное право принимать решение о кохлеарной имплантации и не обязан его отстаивать перед кем-либо.
Вывод
Кохлеарная имплантация не даст вам нормальный слух, но позволит слышать гораздо лучше во многих ситуациях. Когда я говорю «гораздо лучше», я имею в виду сравнение кохлеарных имплантатов со слуховыми аппаратами. Современные имплантаты гораздо более высокотехнологичны и имеют больше преимуществ, чем их предшественники. Но до сих пор кохлеарные имплантаты не способны вернуть вам нормальный слух. Вам необходимо взвесить все плюсы и минусы прежде, чем решиться на операцию, поскольку это решение принадлежит не сообществу, не вашим друзьям и семье и даже не лечащему врачу, а вам и только вам. И я призываю также уважать мнения других людей по этому поводу и не судить их.
Кохлеарные имплантаты и слуховые аппараты очень разные. Теперь я знаю, почему слышащие люди с трудом понимают, что значит не слышать, а глухие не понимают, что такое слышать. Это как ночь и день. Я прошла сложный путь от практически нулевого слуха до почти полного слухового восприятия. Это было похоже на американские горки, но я бы сделала это снова, если потребовалось.
Тина Ай – профессиональный специалист
по зрительному восприятию речи,
пользователь двух кохлеарных имплантатов.
Читайте также:
- Профилактика ИБС при артериальной гипертензии. Ингибиторы АПФ
- Рубцовые стриктуры заднего прохода. Лечение рубцовых стриктур заднего прохода.
- Результаты фенестрации при отосклерозе. Операция Розена
- Дегенеративные заболевания межпозвоночных дисков: дегенерация, пролабирование, грыжа диска
- Симптомы этмоидита и его лечение
