Сердечная деятельность при эпилепсии. Становление эпилептического очага
Добавил пользователь Валентин П. Обновлено: 09.01.2026
Что такое юношеская миоклоническая эпилепсия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аграновича Андрея Олеговича, невролога со стажем в 12 лет.
Над статьей доктора Аграновича Андрея Олеговича работали литературный редактор Вера Васина , научный редактор Татьяна Гаврилова и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Юношеской миоклонической эпилепсией (синдромом Янца) называют эпилептический синдром, который проявляется внезапными подёргиваниями в мышцах — миоклоническими приступами (от греч. "myos" — мышца, "klonos" — беспорядочное движение). Заболевание обычно развивается в подростковом возрасте.
Подёргивания в первую очередь возникают в мышцах верхнего плечевого пояса и рук. Сначала пациенты не обращают на них внимания, но со временем эпизоды возникают всё чаще и ухудшают качество жизни. Например, во время приступов из рук могут выпадать предметы. В дальнейшем появляются подёргивания ног, из-за которых человек может упасть.
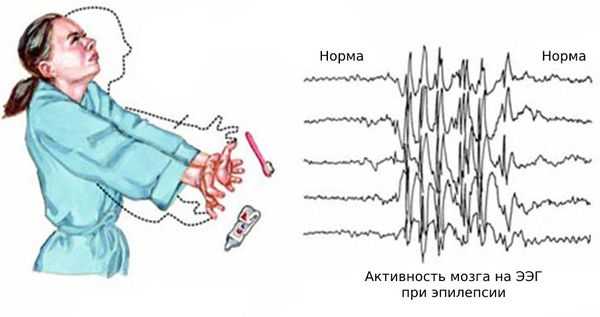
Нередко к этим эпизодам присоединяются генерализованные судорожные приступы — судороги возникают по всему телу и пациент теряет сознание. Также возникают абсансы — бессудорожные приступы с отключением сознания и амнезией на этот период. Как правило, частота генерализованных приступов невысокая: от одного за всю жизнь до раза в месяц. Подёргивания обычно случаются утром после пробуждения. Ярким провоцирующим фактором может стать недосыпание или вынужденное пробуждение. Также в трети случаев отмечается фотосенситивность — чувствительность к ритмическим вспышкам света.
Распространённость
Юношеская миоклоническая эпилепсия составляет 5–10 % среди всех эпилепсий и чуть больше четверти среди генетических генерализованных эпилепсий [5] . Заболевание проявляется в возрасте от 7 до 21 года, чаще в 11–15 лет, и более распространено среди женщин (61 %) [2] .
Причины заболевания
По классификации Международной противоэпилептической лиги за 2017 год, юношеская миоклоническая эпилепсия относится к генетическим болезням [1] . Заболевание имеет полигенное наследование, то есть контролируется двумя или более генами. Его развитие связано с локусами (участками ДНК): 6p11-12 (EJM1), 15q14 (EJM2), 6р21 (EJM3), 5q12-q14 (EJM4), 5q34-q35 (EJM5), 2q22-q23 (EJM6), 1p36 (EJM7), 3q26 (EJM8), 2q33-q36 (EJM9). Выделить ген, сильнее всего влияющий на развитие заболевание, пока не удалось [3] [4] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы юношеской миоклонической эпилепсии
Основным симптомом заболевания являются миоклонические вздрагивания (миоклонии) — патологические непроизвольные сокращения мышц или их групп [7] . Во время приступа пациенты испытывают ощущение, похожее на лёгкий удар током. В ответ на него возникают молниеносные движения в мышцах: от лёгкого подёргивания кончиков пальцев до патологического вздрагивания всего тела, которое может привести к падению.
Чаще всего подёргивания возникают в верхнем плечевом поясе: мышцах рук и плеч с обоих сторон. Из-за этого пациенты нередко выпускают предметы из рук, например разбивают кружки и роняют зубные щётки. Однако возможны различные вариации миоклоний.
Приступы учащаются в утренние часы, особенно при недосыпе или вынужденном пробуждении.
В 90 % случаев, помимо миоклонических эпизодов, отмечаются и генерализованные судорожные приступы [6] . После серии вздрагиваний в патологический процесс часто вовлекаются обе стороны тела.
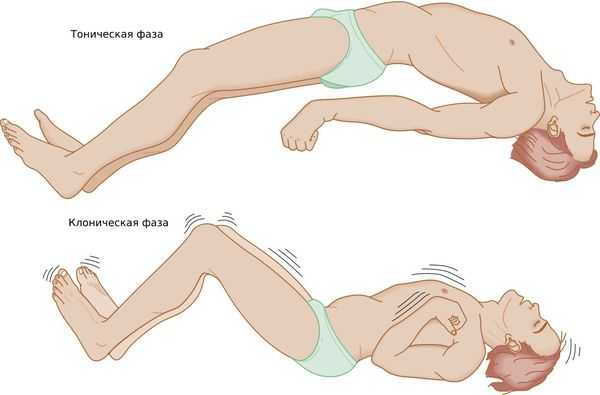
Генерализованный тонико-клонический приступ — состояние, при котором полностью отключается сознание. Приступ начинается с тонической фазы: напряжения в мышцах и специфического вскрикивания или хрипения. Руки полусогнуты и приподняты вверх или прижаты к телу. В этот момент из-за спазма дыхательной мускулатуры меняется цвет лица: оно синеет или сереет.
Далее развивается клоническая фаза, которая проявляется ритмичными подёргиваниями в конечностях. Она завершается полным мышечным расслаблением.
Третий вид эпилептических приступов при юношеской миоклонической эпилепсии — это абсансы [8] . Во время эпизода больной застывает, его взгляд устремлён в одну точку, сознание отключено. Состояние длится до 15 секунд и часто воспринимается окружающими как задумчивость. Сами пациенты могут не замечать эти приступы или воспринимать их как "провалы в памяти".
Патогенез юношеской миоклонической эпилепсии
Мозг человека состоит из двух основных типов клеток: нейронов и глии. Нейроны — это электрически возбудимые клетки, которые обрабатывают, хранят и передают информацию с помощью электрических и химических сигналов. Глиальные клетки играют в этом процессе вспомогательную роль.
Нейроны могут соединяться друг с другом и образовывать нервные сети. В пределах одного нейрона и его отростков информация передаётся в виде электрического возбуждения. В синапсе (месте контакта между нервными клетками) оно приводит к выделению различных химических веществ — нейромедиаторов.
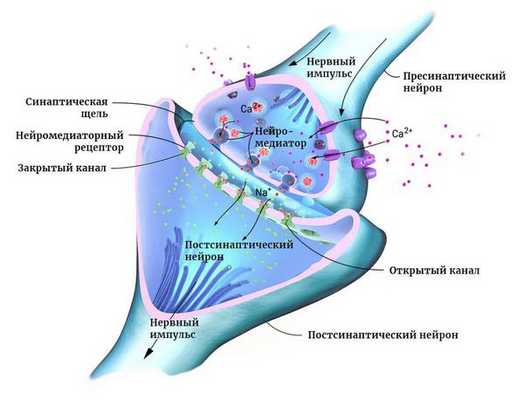
Нейромедиатор взаимодействует с рецепторами на мембране следующего нейрона. В результате в нём возникает электрическое возбуждение. Или не возникает — это зависит от конкретного нейромедиатора, активного в данный момент.
Чтобы заряд менялся в сторону возбуждения, в клетку должны поступать положительно и отрицательно заряженные ионы. Они проходят через ионные каналы в её мембране. Ионными каналами называют белки, образующие п о́ ру для обмена клетки с окружающей средой ионами K+, Na+ и другими [9] .
В нервных сетях между возбуждением и торможением работы нейронов поддерживается постоянный баланс. При сдвиге равновесия в сторону возбуждения происходит эпилептический приступ.
К юношеской миоклонической эпилепсии приводят мутации в генах ионных каналов. Однако выявлены нарушения и в других генах, также влияющих на процессы возбуждения в головном мозге [4] .
Классификация и стадии развития юношеской миоклонической эпилепсии
В Международной классификации болезней (МКБ-10) юношеская миоклоническая эпилепсия шифруется кодом G40.3 [10] .
В 2017 году Международная лига борьбы с эпилепсией (ILAE) обновила классификацию заболевания, выделив четыре уровня диагностики:
1. Определить тип приступа: фокальный (возникающий из одного очага), генерализованный и с неизвестным началом. Миоклонические, тонико-клонические приступы и абсансы относятся к генерализованным приступам.
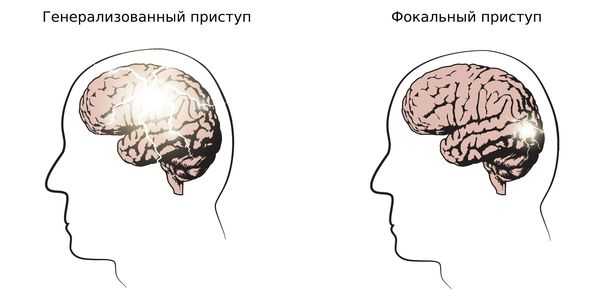
2. Установить тип эпилепсии: фокальная, генерализованная, сочетанная (фокальная + генерализованная) и неизвестная. Юношеская миоклоническая эпилепсия относится к генерализованной эпилепсии.
3. Определить эпилептический синдром. Юношеская миоклоническая эпилепсия как раз и является синдромом. Синдром включает типы приступов, возраст дебюта заболевания, характерные изменения на ЭЭГ, провоцирующие факторы и зачастую прогноз заболевания. Все эти факторы определяют лечебную тактику [11] .
4. Выявить причины заболевания: генетические, структурные, метаболические, иммунные, инфекционные и с неизвестной этиологией. Юношеская миоклоническая эпилепсия в большинстве случаев вызвана генетическими факторами.
Классификация юношеской миоклонической эпилепсии проводится в зависимости от течения заболевания. Главный критерий — это наличие миоклонических приступов. Также выделяют варианты течения с добавлением генерализованных судорожных приступов и/или абсансов.
Осложнения юношеской миоклонической эпилепсии
Пациенты часто не обращают внимания на патологические сокращения мышц, поэтому к неврологу и эпилептологу больной зачастую обращается после появления генерализованных тонико-клонических приступов. В результате противоэпилептические препараты назначают с опозданием. На фоне этого приступы могут учащаться и угрожать здоровью и жизни пациента травмами и утоплениями.
Серьёзным осложнением эпилепсии, в том числе и юношеской миоклонической эпилепсии, является внезапная смерть (SUDEP — Sudden Unexpected Death EPilepsy). Среди людей, страдающих эпилепсией, риск внезапной смерти в 20 раз выше, чем среди населения в целом [12] .
Точные причины SUDEP не установлены. Предполагается, что гибель пациентов связана с нарушением дыхания и развитием аритмии после приступа. Вероятность внезапной смерти при эпилепсии повышается при наличии генерализованных тонико-клонических приступов. Также важно, когда заболевание проявилось и сколько оно длится [12] .
При наличии дневных генерализованных приступов в течение предыдущего года риск развития SUDEP возрастает в 27 раз, ночных — в 15 раз. Проживание в одиночестве повышает риск внезапной смерти в 5 раз. Также SUDEP чаще встречается при злоупотреблении психоактивными веществами и алкоголем [13] .
Снизить риск внезапной смерти при эпилепсии можно, если придерживаться назначенного лечения: не пропускать приём противоэпилептических препаратов, не менять самостоятельно его частоту и дозировку [14] [15] .
Диагностика юношеской миоклонической эпилепсии
Основной диагностический критерий заболевания — это наличие миоклонических приступов.
Сбор анамнеза
На приёме врач спрашивает о необычных внезапных состояниях:
- вздрагиваниях в теле;
- дежавю — состоянии, при котором человек ощущает, что когда-то уже был в подобной ситуации или месте;
- потере сознания и т. д.
Пациенты могут не обращать внимания на такие симптомы и считать их своей особенностью. Абсансы и генерализованные тонико-клонические приступы с потерей сознания, особенно во сне, они могут и вовсе забывать. Поэтому при сборе анамнеза важно выяснить обстоятельства приступа не только у самих пациентов, но и у родственников и очевидцев.
Электроэнцефалограмма (ЭЭГ)
Основным способом диагностики эпилепсии является электроэнцефалограмма — метод исследования, при котором регистрируется суммарная электрическая активность клеток коры головного мозга.
Сейчас диагноз "эпилепсия" устанавливают с помощью длительного видео-ЭЭГ мониторинга — электроэнцефалограмма записывается параллельно с одной или несколькими видеокамерами, датчиком ЭКГ и при необходимости дополнительным контролем мышечной активности, частоты и глубины дыхания.

Основной фон биоэлектрической активности при юношеской миоклонической эпилепсии, как правило, соответствует возрастной норме. Патологическая активность проявляется короткими и генерализованными разрядами полиспайков (островолновых комплексов), которые регистрируются при миоклонических вздрагиваниях и полипик-волновыми комплексами между приступами.
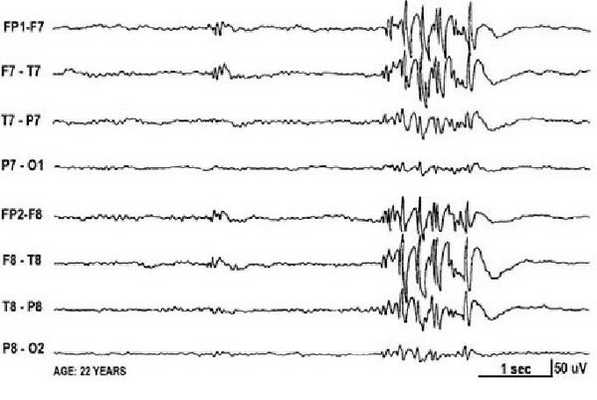
При заболевании часто встречается феномен фотосенситивности. Для её выявления во время ЭЭГ пациента просят закрыть глаза и проводят ритмичную фотостимуляцию с частотой около 15 Гц [16] .
Эпилептическая фотосенситивность — это предрасположенность к приступам под влиянием света. Может протекать бессимптомно или проявляться эпилептическими приступами под воздействием провоцирующих факторов: видеоигр, работы за компьютером, просмотра телевизора, мигающего освещения в ночных клубах и света природного происхождения.
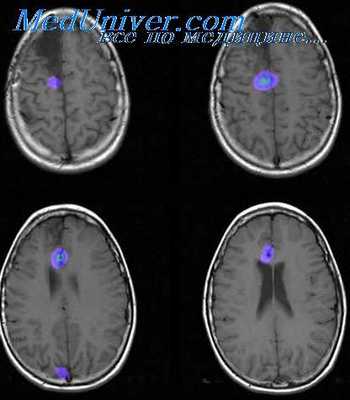
На МРТ патологические изменения в головном мозге при юношеской миоклонической эпилепсии не выявляются [17] .
Интеллект и неврологический статус при заболевании находятся в норме. Выражена эмоциональная неустойчивость и признаки невротического развития личности: резкая смена настроения, вспыльчивость и повышенная тревожность
Лечение юношеской миоклонической эпилепсии
Образ жизни
При эпилепсии следует соблюдать режим сна и бодрствования, исключить алкоголь и избегать резких вспышек света. Также нужно по возможности уменьшить стрессы, переживания и тревоги [20] .
Антиэпилептические препараты
Приём антиэпилептических препаратов (АЭП) позволяет устранить до 90 % приступов. Монотерапия (лечение одним препаратом) при юношеской миоклонической эпилепсии применяется в 79 % случаев, дуотерапия (двумя препаратами) — 17 %, политерапия (несколькими препаратами) — 4 % [16] .
Прекращать приём лекарств рекомендуется не ранее чем через пять лет полной клинико-нейрофизиологической ремиссии. Но даже спустя 4–7 лет ремиссии рецидивы после отмены терапии возникают у 70 % больных. Поэтому пациентам с юношеской миоклонической эпилепсией может быть рекомендован пожизненный приём АЭП [21] .

Ранее лидерами в лечении юношеской миоклонической эпилепсии являлись препараты вальпроевой кислоты. Они эффективны для прекращения приступов, но вызывают много побочных эффектов:
Также выявлено, что они обладают повышенным тератогенным эффектом по сравнению с другими АЭП. Тератогенное действие — это нарушение эмбрионального развития ребёнка при приёме препаратов матерью. Поэтому назначение вальпроатов, в особенности у молодых женщин, ограничено [18] .
В настоящее время препаратом выбора стартовой терапии является "Леветирацетам". Он хорошо переносится и эффективно устраняет все три вида приступов, в том числе сопровождающихся фотосенситивностью [19] .
Также используется препарат "Ламотриджин". Он эффективно подавляет генерализованные тонико-клонические судороги и абсансы, но в половине случаев способствует учащению миоклоний. Его применение в монотерапии у пациентов с частыми миоклоническими приступами ограничено, но лекарство можно использовать в комбинированной терапии [21] .
Помимо перечисленных препаратов, могут применяться "Топирамат", "Зонисамид", "Перампанел" и "Фенобарбитал".
Чтобы избежать учащения приступов и усиления симптомов, важно ограничить приём "Карбамазепина", "Окскарбазепина", "Фенитоина", "Габапентина" и "Вигабатрина". Эти лекарства могут повышать гипервозбудимость мембраны клеток головного мозга, что приводит к обострению состояния [21] .
Прогноз. Профилактика
Прогноз определяется индивидуально в зависимости от частоты приступов, эффективности АЭП, возраста начала заболевания и т. д. Лечение часто не помогает пациентами с тремя видами приступов [21] .
Без приёма противоэпилептических препаратов (АЭП) приступы могут сохраняться всю жизнь. Их частота, как правило, снижается только после 40 лет [20] .
Эффективность АЭП в предотвращении приступов достигает 90 %. При отмене терапии часто возникают рецидивы, поэтому потребуется длительный приём препаратов, иногда пожизненный.
Качество жизни значительно ухудшается при частых миоклонических и генерализованных тонико-клонических приступах, при которых пациенты рискуют получить травмы.
Профилактика
Особое внимание стоит уделить образу и режиму жизни пациента. Самыми мощными провоцирующими факторами являются недосыпание и злоупотребление алкоголем. А учитывая, что дебют заболевания приходится на подростковый возраст, молодые люди часто нарушают эти рекомендации, особенно в студенческие годы.
Пациент, у которого выявили фотосенситивность, предрасположен к приступам под воздействием мерцающего света. Поэтому им необходимо ограничить просмотр телевизора и работу за компьютером, исключить видеоигры и избегать посещения ночных клубов.
У всех пациентов с эпилепсией имеются определённые социальные ограничения: они не могут работать в некоторых сферах, водить автомобиль и нести военную службу. Все они определяются индивидуально соответствующими комиссиями.
Сердечная деятельность при эпилепсии. Становление эпилептического очага
При изучении сердечной деятельности (пульс, артериальное давление, ЭКГ) во время одиночных припадков и эпилептического статуса также обнаружены определенные различия. Одиночный припадок сопровождается умеренной тахикардией, иногда аритмией, в то время как при эпилептическом статусе, даже при выключении судорог мышечными релаксантами, каждый из приступов может сопровождаться пароксизмальиой тахикардией с ритмом 300 и более систол в минуту, а также грубой аритмией с тяжелыми гемодинамическими нарушениями.
Это указывает на распространение при эпилептическом статусе пароксизмальиых гиперсинхронных разрядов на аппараты мозгового ствола, выполняющие витальные функции. Последнее, по-вндимому, следует расценивать как следствие отказа механизмов, действующих при одиночных припадках и играющих защитную роль по отношению к такой витальной функции, как церебральная регуляция сердечной деятельности.
Приведенные в разделе 5 морфологические данные позволяют предполагать, что развивающиеся в ходе эпилептического статуса сосудисто-гипоксические изменения в стволово-гипоталамических отделах мозга выводят из строя прежде всего защитные, противосудорожиые механизмы. Позже повреждаются системы, реализующие судорога, и последние прекращаются уже на фоне глубокого коматозного состояния.
Результаты наших исследований показывают, что прн эпилепсии в мозговом стволе функционируют аппараты троякого рода: 1) ингибиторные, принимающие участие в непосредственном прекращении судорожного приступа; 2) защитные, охраняющие системы с витальными функциями; 3) противосудорожиые, предупреждающие развитие следующего припадка.

Таким образом, ингибиториые механизмы играют также важную роль в прекращении эпилептической активности, конечным итогом чего является активация электронного насоса. Возможны н другие механизмы, а именно инактивация путем деполяризации.
В специальных экспериментальных исследованиях показано участие в антиэпилептической системе орбитофронтальной коры. В качестве модели эпилепсии был использован метод создания эпилептического очага в сенсомоторной области коры путем применения алюминиевой пасты (хронические опыты) и аппликации пенициллина (острые опыты).
Регистрировалась суммарная электроэнцефалографическая активность в корковых и подкорковых областях мозга кролика, в том числе в орбитофронтальной коре и в хвостатом ядре до аппликации патологического агента и в различные периоды после его применения.
Отмечались время развития судорожного приступа, характер, длительность и тяжесть его течения, а также определенные характеристики судорожного приступа: 1) при раздражении орбитофронтальной коры электрическим током в досудорожном периоде; 2) при электрокоагуляции орбитофронтальной коры н последующей аппликации эпилептического агента.
Становление эпилептического очага сопровождалось характерными, последовательно меняющимися изменениями электроэнцефалографической картины в корковых н подкорковых структурах мозга. При этом в тормозно-модулнрующих структурах мозга (хвостатое ядро, орбитофронтальная кора) довольно часто наблюдалось длительно сохраняющееся снижение фоновой электроэнцефалографической активности.
Мы полагаем, что эти данные могут свидетельствовать об угнетении или, во всяком случае, об изменении функций данных структур.
Эпилептический очаг. Формирование эпилептического очага
В эксперименте на животных эпилептический процесс может развиваться стремительно, и вторичные эпилептические очаги нередко возникают через десятки минут после образования первичного. На приводимых ниже рисунках, взятых из нашей экспериментальной работы, представлены подобные данные. Стрнхиинный эпилептический очаг формировался в сенсомоторной коре левого полушария.
Проводились курарезация животного, искусственная вентиляция легких. Видно начало распространения эпилептической активности из первичного очага. Однако последующие приступы возникали уже в других структурах, а именно в сенсомоторной коре интактного полушария (зеркальный очаг), а также по так называемому центрэнцефалическому типу.
Концепция эпилептического очага подтверждается в случаях парциальных и вторично-генерализованных припадков. Наиболее сложно объяснить механизм первичных генерализованных припадков, при которых эпилептический очаг не идентифицирован. В Международной классификации эпилепсии, принятой в Киото в 1981 г., предусматривается выделение вторично-генерализованной эпилепсии с первично-генерализованными припадками.
Этим самым признается, что первично-генерализованные припадки (судорожные и абсаисы) могут быть проявлением органического (диффузного или миогоочагового) поражения мозга. Классическими примерами являются младенческий спазм и синдром Леннокса — Га сто. Однако накопленные данные позволяют считать, что подобный механизм может иметь место и в ряде других случаев эпилепсии с генерализованными припадками без фокального начала.
При этом на ЭЭГ возникают двусторонние синхронные и симметричные разряды эпилептических припадков. Так, Е. Marcus и С. Watson (1968) показали, что двустороннее поражение больших полушарий головного мозга может вызывать ритмическую генерализованную синхронную активность пик-волн даже при удалении подкоркового белого вещества.
В работах С. А. Чхенкели (1977—1982) приведены полученные во время стереотаксических операций данные о том, что поясная извилина может принимать участие в возникновении генерализованной бнлатеральио-сннхрониой активности даже в тех случаях, когда эпилептический очаг локализуется в височных структурах. Возможность развития судорожных эпилептических припадков, клинически протекающих как первично-генерализованные, при височных очагах была показана в исследованиях, проведенных П. М. Сараджишвили (1979).
Начиная с 1971 г., мы неоднократно публиковали материалы о верифицированных случаях генерализованных припадков, вызванных очагами в областях лобного полюса или медиобазалькой лобной коры, что особенно часто имело место при эпилептическом статусе.
В данной серии исследований у 5,6% больных ВЭ с височными или височно-лобными эпилептическими очагами на ЭЭГ обнаружены пароксизмы генерализованных синхронных разрядов пик-волн частотой 2—3,5 в секунду. У части больных эти разряды были к тому же и абсолютно симметричными. Кроме того, у 14,5% больных парциальной иноменативной эпилепсией установлена локализация эпилептогенного поражения в орбитофронтальной части лобной доли головного мозга. У этих больных наблюдались генерализованные припадки без фокального начала.
Приведенные данные подтверждают возможность развития генерализованных припадков при эпилептогенных поражениях височных медиобазальных и лобных орбитофронтальных структур.
Эпилептизация нейронов. Механизмы эпилептизации нейронов
Можно поддержать мнение П. М. Сараджишвили и Т. Ш. Геладзе (1977) о том, что расстройства метаболической генерации энергии и изменение баланса ингибиторных и возбуждающих интермедиаторов конвергируют на критический элемент конечного общего звена, ответственного за развитие эпилептической активности. Им служит электролитный метаболизм, в узком смысле энергозавнсимый калий-натриевый насос.
Нарушение процессов метаболического воспроизведения энергии (при гипоксии) и расстройства баланса интермедиаторов влекут за собой изменения дифференцированного распределения электролитов, деполяризацию и колебания стабильности мембран. К этому следует добавить возможность первичного, обусловленного воздействием анте-, пери- или постнатальных факторов расстройства, ведущего к нарушениям локального электролитного метаболизма.
Степень эпилептизации нейронов в очаге различна. Максимально эпилептизированные нейроны рассматриваются как пейсмекеры эпилептической активности. Они обладают способностью давать почти постоянные стереотипные разряды с короткими интерспайковыми интервалами, не зависящими от континума сои — бодрствование. Другая часть нейронов менее эпилепти зирована н может вовлекаться в эпилептическое возбуждение под влиянием пейсмекерных нейронов в связи с воздействием различных факторов, в частности сиа.
При этом критическая масса охваченных эпилептическим возбуждением нейронов может становится достаточной для возникновения эпилептического припадка.
Между степенью эпилептогенности эпилептических нейронов и частотой припадков имеется логарифмическая корреляция. Построение концептуальной математической модели эпилепсии показало, что для образования эпилептического очага необходимо наличие 103—105 эпилептических нейронов.
К внутренним механизмам эпилептизации нейронов привлекаются, как указывалось выше, события в их окружении, в частности изменения глии. Потеря эластичности последней может также способствовать деформации мембран нейронов. Тенденция к отеку глин как результат увеличения концентрации К+ вызывает механическую тракцию деидритов и их деформацию.
Основными патофизиологическими свойствами эпилептического очага являются повышение синаптической проводимости, синхронность и синфазность разрядов эпилептических нейронов. Интегральным результатом этих изменений служит способность очага генерировать гиперсннхронный разряд.
Различие между эпилептическим нейроном и эпилептическим очагом можно видеть при изучении электрографических феноменов, регистрируемых от эпилептического нейрона и эпилептического очага. В то время как от эпилептического нейрона регистрируются низкоамплитудные высокочастотные пиковые потенциалы, очаг выдают известные электрографические эпилептические феномены, а именно спайки, острые волны и в особенности разряды типа пик-волны.
Указанное различие в электрографических характеристиках эпилептического нейрона и эпилептического очага возникает благодаря тому, что эпилептический очаг представляет собой совокупность не просто эпилептических нейронов, а определенным образом организованных нейронных ансамблей. Эта особенность организации связана, с одной стороны, с изменениями синаптического аппарата нейронов очага, с другой —с ролью внеочаговых факторов.
Пик-волновая характеристика разрядов, возникающих спонтанно в эпилептическом очаге или под влиянием афферентных стимулов (пик-волновая форма вызванного ответа), свидетельствует о нарушении информационной функции и памяти нейронных ансамблей очага, перекодирующих информацию специфическим эпилептическим образом или выдающих ее спонтанно.
Важнейшим свойством эпилептического очага способность к навязыванию режима своей работы другим отделам мозга. Это приводит, с одной стороны, к формированию вторичных и третичных эпилептических очагов, с другой— к изменению информационной функции нейронов всего мозга.
Еще одной существенной чертой эпилептических очагов является способность индуцировать образование вторичных и даже третичных эпилептических фокусов. Наиболее часто встречается и наиболее изучено образование зеркальных очагов, возникающих в симметричных отделах другого полушария. По-видимому, образование зеркальных эпилептических очагов происходит по тем же механизмам, что я развитие первичного очага при модели киндлинг-эпилепсии, т. е. под влиянием постоянной бомбардировки зеркального пункта интактного полушария эпилептическими разрядами, поступающими из первичного эпилептического очага, что приводит к постепенной эпнлептизации нейронов зеркального пункта.
Кардиоваскулярные расстройства у больных эпилепсией
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

Б.Г. Гафуров, Н.Д. абдурахманова, б.С. бусаков, Институт усовершенствования врачей, г. Ташкент, Республика Узбекистан Гафуров Бахтияр Гафурович
Проблеме кардиоваскулярных расстройств при эпилепсии уже давно уделяется особое внимание. На материале обследованных 70 больных эпилепсией нами были изучены такие вопросы, как особенности кардиоваскулярных нарушений у больных с различными клиническими формами эпилепсии и эпилептических припадков при различной тяжести течения заболевании, а также вопросам внутрисуточного распределения этих расстройств в межприступном периоде. Обследование включало исследование сердца – суточный холтеровский мониторинг ЭКГ и суточный мониторинг артериального давления (СМАД). Полученные данные свидетельствуют о наличии электрически значимых, но субклинических проявлений кардиоваскулярных расстройств у больных эпилепсией. В ходе исследований было выявлено наличие нарушений ритма и проводимости сердца, а также внутрисуточное колебание АД, соответствующие определённым клиническим формам эпилепсии. .
Актуальность
Эпилепсия – одно из наиболее распространённых заболеваний нервной системы. Распространённость эпилепсии в популяции в последние годы увеличилась с 0,8 до 1,2% [2]. Несмотря на успехи современной неврологии, до настоящего времени остаются актуальными многие вопросы, касающиеся соматической сферы больных эпилепсией. В частности, недостаточно изучена проблема сердечно-сосудистой патологии этих больных. Клинический опыт свидетельствует о большом постоянстве сосудистых нарушений при эпилепсии: цианотичная окраска лица, изменение артериального давления в сосудах плеча и височных артериях являются постоянными спутниками эпилептического припадка [2].
При анализе работ, посвящённых физиологии и патофизиологии сердца, нарушениям сердечного ритма [3,4], обращает на себя внимание определённая близость биоэнергетических механизмов, участвующих в нормальных и патологических механизмах как сердца, так и головного мозга. Исходя из патофизиологических представлений, можно предполагать, что любой судорожный припадок отражается в гемодинамике и не только локальной, но и общей. Сосудистая система мозга тесно связана с коронарными сосудами. Об этом свидетельствует тот факт, что при острых нарушениях мозгового кровообращения с большим постоянством наблюдаются и коронарные нарушения [1]. Неоднократно предпринимались попытки выявить определённые связи между состоянием биоэлектрической активности головного мозга и изменениями сердечного ритма, влияние отдельных структур мозга, в частности диэнцефально-лимбических отделов, на ритм сердечных сокращений. Ведущую роль в возникновении аритмического синдрома при эпилепсии отводят дисфункции надсегментарных вегетативных образований [5, 6, 7]. В эксперименте брадикардия была вызвана одновременной активацией гипоталамической и мезенцефальной областей [6, 8]. Обсуждается роль лимбической системы в аритмогенезе [8, 9].
При эпилепсии изучали закономерности возникновения вторичных сердечных аритмий на высоте судорожного эпилептического припадка, при развитии эпилептического статуса. Подобные нарушения сердечного ритма авторы называли одной из причин внезапной смерти больных эпилепсией [9, 10, 11, 12, 13]. Такими крупными исследователями, как В. Пенфильд с соавторами [14] и многими другими, было доказано, что непосредственно после судорожного припадка давление крови у больного эпилепсией повышается. Болдырев А.И. [15] изменения кровяного давления при эпилепсии описывал в рамках вегетативных реакций, сопряжённых с дисфункцией гипоталамической области. В норме влияние коры головного мозга на кровяное давление осуществляется через гипоталамус, но как показали работы Г.Н. Сметанкина (1963), кора больших полушарий головного мозга может осуществлять свое влияние на регуляцию кровяного давления, минуя гипоталамус при чрезвычайных ситуациях. Во время эпилептического припадка, а особенно при их серии или при эпилептическом статусе, в организме больного возникает именно такая «чрезвычайная ситуация», при котором нервная регуляция сердечно-сосудистой системы нарушается особенно резко и не исключена возможность, что в этих условиях, как в экспериментах Г.Н. Сметанкина, кора, пребывающая в резком возбуждении, вмешивается в регуляцию сердечно-сосудистой системы, минуя гипоталамические структуры.
Значительные электрофизиологические, мембранные, биохимические сдвиги, характерные для эпилептического процесса [16, 17], нарушения иммунных механизмов [4, 18], заставляют рассматривать эпилепсию не только как патологию головного мозга, но как патологию целостного организма [2]. Несмотря на то, что проблеме кардиоваскулярных расстройств при эпилепсии уже давно уделяется внимание, недостаточно изученными являются такие вопросы, как особенности кардиоваскулярных нарушений у больных с различными клиническими формами эпилепсии и эпилептических припадков при различной тяжести течения заболевании, а также вопросам внутрисуточного распределения этих расстройств в межприступном периоде.
Целью настоящей работы было изучение особенностей кардиоваскулярных расстройств у больных с различными формами эпилепсии.
Материал и методы исследования
Обследовали 70 больных эпилепсией (36 мужчин, 34 женщины) в возрасте от 16 до 42 лет. Длительность заболевания составила от 6 мес. до 18 лет. Все больные в зависимости от клинической формы были разделены на 2 группы – идиопатическую (42 больных – 60%) и симптоматическую (28 больных – 40%) форму. Исключались пациенты с органической соматической патологией, в том числе с выявленной сердечно-сосудистой патологией.
Обследование включало исследование сердца – суточный холтеровский мониторинг ЭКГ и суточный мониторинг артериального давления (СМАД), электроэнцефалографию, с диагностической целью проводились КТ, МРТ исследования. Контрольная группа состояла из 15 практически здоровых лиц от 18 до 36 лет, которым для сравнения проводились холтеровский суточный мониторинг ЭКГ и суточный мониторинг АД.
Больные обеих групп с идиопатической и симптоматической эпилепсией были разделены на подгруппы в зависимости от клинической формы припадка (таблица 1).
Как видно из таблицы 1, эпилептические припадки по типу первично-генерализованных (ПГЭ), парциальных (ПЭ) и вторично-генерализованных (ВГЭ) наблюдались внутри групп как идиопатической, так и симптоматической эпилепсией. Следует отметить некоторое преобладание пациентов с ПГЭ в группе с идиопатической эпилепсией (ИЭ) и ВГЭ в группе симптоматической эпилепсии (СЭ). Что касается бессудорожных форм эпиприпадков (абсансов), то при некото¬ром преобладании таких клинических форм пароксизмов в группе ИЭ несколько чаще выявлялись больные с атипичными формами абсансов.
Обследование сердечно-сосудистой системы больных эпилепсией выявило широкий спектр нарушений ритма и проводимости сердца, частота которых зависит от формы эпилепсии (таблица 2).
Из 70 обследованных больных эпилепсией нарушение электрической активности сердца были выявлены у 46 (65,7%) больных. В целом различные формы нарушения электрической активности сердца встречались чаще, чем в контрольной группе, причем в группе больных с СЭ они достоверно преобладали. Среди 28 больных с СЭ кардиоваскулярные нарушения были обнаружены у 21 (75%) больного, тогда как среди 42 больных с ИЭ такие нарушения были обнаружены у 25 (59,5%) больных. Наиболее часто встречались синоатриальная блокада II cтепени I типа – 12 больных (26,1±6,5%), суправентрикулярная экстрасистолия – 11 больных (23,9±6,3%), суправентрикулярная пароксизмальная тахикардия – 8 больных (17,4±5,6%), гетеротропные ритмы и комплексы – 7 больных (15,2±5,3%).
Сопоставление данных холтеровского мониторинга ЭКГ в зависимости от клинической формы эпилептического припадка у больных с ПГЭ, ПЭ, ВГЭ (таблица 3) выявило достоверно более высокую встречаемость нарушений ритма и проводимости сердца по типу блокад при ПЭ и ВГЭ. Это было обусловлено, главным образом, более высокой частотой у них гетеротропных ритмов p были синусовая тахикардия, суправентрикулярная миграция водителя ритма, суправентрикулярная пароксизмальная тахикардия, а также суправентрикулярные и желудочковые экстрасистолии. Сочетание двух типов аритмий наблюдалось у 2 больных ПГЭ, у 3 больных с ПЭ и у 3 больных со ВГЭ, трех типов аритмий соответственно у 1, 2 и 2, четырех типов у 1 больного со ВГЭ.
При анализе связи нарушений ритма и проводимости сердца у больных эпилепсией со временем суток (таблица 4) было обнаружено достоверное преобладание эпизодов карлись синоатриальная блокада II cтепени I типа – 12 больных диоваскулярных нарушений в утреннее и дневное время у больных с ИЭ (76,9±8,3%), причём основная доля приходилась на группу больных с ПГЭ (65,4±9,3%). Тогда как в группе больных с СЭ такие нарушения чаще встречались в ночное время (60,0±11,0%), при этом наиболее высокий удельный вес приходился на группу больных с ПЭ (35,0±10,7%) и ВГЭ (40,0±11,0%).
Проведенное нами исследование суточного мониторинга артериального давления у 70 больных эпилепсией (таблица 5) выявило у 31 больного значительное внутрисуточное колебание АД. Причём у одного и того же больного мы наблюдали как повышение, так и снижение среднесуточного АД (САД). При этом эпизоды колебания АД в дневное время чаще встречались в группе с ИЭ (76,9±8,3%), причём больший удельный вес приходился на группу больных с ПГЭ (65,4±9,3%). В группе больных с СЭ эпизоды колебания давления чаще происходили в ночное время (60,0±11,0%), достоверно часто при этом наблюдалось снижение АД в группе больных с ПЭ (35,0±10,7%) и ВГЭ (40,0±11,0%).
Полученные данные свидетельствуют о наличии электрически значимых, но субклинических проявлений кардиоваскулярных расстройств у больных эпилепсией, что согласуется с результатами исследований других авторов [5, 19, 20]. Вместе с тем, в нашей работе впервые проанализирован характер этих нарушений в зависимости от клинической формы эпилепсии и эпилептических припадков, а также от времени суток. Заслуживает внимания обсуждение их с позиции вегетативной дизрегуляции. Было выявлено, что нарушения ритма и проводимости сердца с большей частотой встречаются у больных с ПЭ и ВГЭ. Обращает на себя внимание существенное преобладание у них нарушений проводимости (синоатриальных и атриовентрикулярных блокад) и гетеротропных ритмов и комплексов, которые по данным многих авторов [5, 21, 22] обусловлены повышени¬ем тонуса парасимпатической нервной системы. Это предположение также подтверждается наличием у этих групп больных колебания АД (особенно снижение) в ночное время. В то же время, синусовая тахикардия, тахиаритмии, экстрасистолии, а также эпизоды повышения АД больше в дневное время, чаще встречавшиеся в группе больных ПГЭ, может быть обусловлена относительной симпатикотонией. Одним из важных аспектов изучения особенностей кардиоваскулярных расстройств у больных эпилепсией является оценка их с точки зрения внезапных сердечных эпизодов. С этой точки зрения по данным специалистов потенциально опасным являются такие изменения, как суправентрикулярная пароксизмальная тахикардия, наджелудочковые и желудочковые экстрасистолии, блокады. Отсюда следует, что при обследовании больных эпилепсией целесообразно проведение суточного мониторинга ЭКГ и АД.
Таблицы и рисунки в прикреплённом файле.
Читайте также:
