Серологическая диагностика аутоиммунной гемолитической анемии
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Аутоиммунная гемолитическая анемия (АИГА) — группа редких приобретенных гематологических болезней и синдромов, характеризующихся гемолизом (разрушением) эритроцитов, вследствие образования аутоантител к антигенам этих компонентов крови.
АИГА может возникнуть в любом возрасте, чаще ей подвержены женщины (60%). Патология развивается постепенно или внезапно.
Выделяют два основных типа АИГА: тепловую (аутоантитела наиболее активны/атакуют эритроциты при температуре 37-40 °C) и холодовую — с холодовыми гемолизинами (аутоантитела наиболее активны при температуре менее 30 °C, эритроциты разрушаются даже при локальном воздействии холода, например, когда человек пьет холодную воду или моет руки в холодной воде).
Причины
Причины возникновения заболевания изучены недостаточно. На сегодняшний день известно, что примерно 50% случаев т-АИГА являются идиопатическими (развиваются спонтанно). Тогда как х-АИГА ассоциированы с другими заболеваниями или возникают с ними одновременно: аутоиммунными, онкологическими, инфекционными (системная красная волчанка, лимфолейкоз, неходжкинская лимфома, вирус Эпштейна — Барр, цитомегаловирус, микоплазменная пневмония, гепатит, ВИЧ). Играть роль в развитии АИГА может и прием определенных лекарств, например, препаратов пенициллинового ряда (лекарственно индуцированная АИГА).
Симптомы
У некоторых людей заболевание может протекать бессимптомно, особенно если АИГА развивается постепенно (разрушение эритроцитов не настолько масштабно). В основном же симптомы АИГА схожи с клиническими проявлениями других типов анемии (слабость, повышенная утомляемость, бледность кожных покровов).
Симптомы при более тяжелом течении заболевания (быстром разрушении эритроцитов) включают желтушность кожных покровов и видимых слизистых оболочек, слабость, повышенную утомляемость с тахикардией и одышкой при физической нагрузке, ощущение дискомфорта в животе, чувство переполнения, холодные конечности и периферический цианоз (при холодовой АИГА). При физикальном осмотре выявляется спленомегалия (патологическое увеличение размеров селезенки) различной степени.
Если АИГА развивается на фоне другой патологии, преобладать могут симптомы основного заболевания, например: увеличение и болезненность лимфатических узлов, лихорадка, сильные боли в спине и ногах, головные боли, рвота, диарея, изменение цвета мочи на темно-коричневый.
Диагностика
Диагностика АИГА включает физикальный осмотр, общий и биохимический анализы крови, морфологическое исследование эритроцитов. Основным критерием диагностического поиска является определение аутоантител с помощью прямого антиглобулинового теста (прямой пробы Кумбса).
Лечение аутоиммунной гемолитической анемии
Первой линией терапии тепловой аутоиммунной гемолитической анемии являются глюкокортикостероиды. Высокодозная монотерапия преднизолоном может назначаться в течение 3-6 недель с постепенным снижением дозы или отменой в дальнейшем. Однако из-за сильно выраженных побочных эффектов такого лечения все чаще используют краткосрочную пульс-терапию метилпреднизолоном или дексаметазоном. Примерно треть пациентов достигают ремиссии, остальным же необходима поддерживающая терапия ГКС.
При неэффективности стероидной терапии рассматривается возможность проведения спленэктомии (хирургическое удаление селезенки), биологической терапии (ритуксимаб) или иммуносупрессивной терапии (циклоспорин, азатиоприн и др.).
Прогноз зависит от первопричины заболевания, своевременно начатого и правильно подобранного лечения. Благоприятный прогноз (достижение ремиссии, длительная ремиссия) полностью связан с положительным терапевтическим ответом у пациента и отсутствием осложнений.
Пациентам с холодовой аутоиммунной гемолитической анемией рекомендуется избегать триггеров (холода, в том числе инфузий холодных растворов), а также пройти лечение основного заболевания (например, лимфомы), если с ним связано развитие х-АИГА. Терапия первой линии при х-АИГА — ритуксимаб. ГКС не является терапией выбора из-за низкого терапевтического ответа у пациентов. Также неэффективна и спленэктомия. В тяжелых случаях рекомендован плазмоферез.
Особенности и преимущества лечения аутоиммунной гемолитической анемии в клинике Рассвет
Аутоиммунная гемолитическая анемия достаточно редкое заболевание крови, по мере его изучения критерии диагностики и лечения дорабатываются и обновляются.
Гематологи клиники Рассвет придерживаются стандартизированных диагностических критериев и терапевтических подходов, разработанных Международной консенсусной группой по АИГА. Мы осознаем важность точного диагностического поиска у таких пациентов, поскольку течение заболевания и эффективное лечение зависят от типа задействованных антител. Для диагностики первичной АИГА мы используем моноспецифический прямой антиглобулиновый тест, обязательно выясняем причины манифестации вторичной АИГА, т. е. выявляем основное заболевание, с которым связано развитие гемолитической анемии.
При лечении т-АИГА мы используем глюкокортикостероиды. Ритуксимаб назначаем только на раннем этапе тяжелого течения заболевания, а также при отсутствии быстрого терапевтического ответа на стероиды. Ритуксимаб в сочетании с антинеопластическим препаратом назначаем пациентам с х-АИГА в случаях, если их состояние требует лечения по клиническим признакам.
Гематология Рассвета представлена врачами высокой квалификации, имеющими большой опыт в выявлении и лечении сложнодиагностируемых и редких болезней. В своей работе наши специалисты используют международные протоколы лечения, применяют только безопасные, доказанные и эффективные методы.
Диагностика и лечение хронической аутоиммунной гемолитической анемии
Больная Ш., 80 лет, пенсионерка. Из анамнеза известно, что в течение последних двух лет неоднократно проходила амбулаторное и стационарное лечение по поводу хронической B12–фолиеводефицитной анемии, диагностированной на основании анемического синдрома в сочетании с гиперхромией и макроцитозом эритроцитов. Стернальная пункция, определение уровня витамина B12 и фолиевой кислоты не проводились. Отмечался временный незначительный положительный эффект лечения витамином B12. С конца 2011 года, несмотря на ежемесячное введение витамина B12 в дозе 500γ в сочетании с фолиевой кислотой, стала нарастать анемия (14.02.2012 г. гемоглобин – 54 г/л). Для обследования и лечения госпитализирована в больницу № 40 с диагнозом: B12–фолиеводефицитная анемия тяжелой степени. ИБС. Стенокардия напряжения II ф. к. Гипертоническая болезнь II ст. Желчнокаменная болезнь. Хронический калькулезный холецистит. Мочекаменная болезнь. Конкремент правой почки, простые кисты обеих почек. Полипы желудка.
При поступлении жалобы на выраженную общую слабость, головокружения, головную боль, учащенное сердцебиение, перебои в работе сердца.
При объективном осмотре отмечены субиктеричность кожи и слизистых оболочек, умеренная гепатомегалия (+2 см) и спленомегалия (+ 2 см).
Результаты клинического анализа в динамике представлены в таблице 1.
Таблица 1. Клинические анализы крови пациентки Ш. в динамике
| 15.02.12 | 54 | 1.39 | 10.5 | 133 | 80 | 2 | 66 | 21 | 9 | 2 | - | 75 |
| 11.03.12 | 50 | 1.41 | 11.8 | 114 | 98 | 4 | 75 | 11 | 4 | 3 | 1 | 78 |
| 15.03.12 | 49 | 1.31 | 17.8 | 121 | 288 | 4* | 60 | 23 | 5 | 1 | - | 78 |
| 20.03.12 | 72 | 1.93 | 11.4 | 116 | 297 | 2 | 73 | 14 | 7 | 2 | 0 | 46 |
| 27.03.12 | 66 | 1.9 | 11 | 108 | 202 | 2 | 60 | 26 | 7 | 3 | 0 | 40 |
| 12.04.12 | 70 | 1.75 | 1.9 | 112 | 104 | 3 | 62 | 24 | 11 | 0 | 0 | 27 |
| 26.04.12 | 93 | 2.56 | 5.7 | 109 | 148 | 3 | 74 | 13 | 9 | 0 | 0 | 11 |
| 24.06.12 | 111 | 3.42 | 4.7 | 97 | 7 | 2 | 69 | 21 | 10 | 0 | 1 | 15 |
| 16.08.12 | 120 | 3.97 | 5.8 | 93 | 12 | - | 71 | 19 | 9 | 1 | 0 | 40 |
Примечание: * в лейкоцитарной формуле 15.03.12 выявлялись также миелоциты (2%) и метамиелоциты (5%).
При поступлении выявлены гиперхромная анемия (гемоглобин 54 г/л, эритроциты 1,39×10 12 /л , MCV 133 фл), ретикулоцитоз (80‰), ускорение СОЭ (75 мм/час), анизоцитоз, пойкилоцитоз и анизохромия эритроцитов.
В биохимическом анализе крови – повышение уровня креатинина (189 ммоль/л), билирубина (58 ммоль/л) за счет непрямого билирубина.
УЗИ органов брюшной полости: гепатоспленомегалия; камни желчного пузыря; диффузные изменения поджелудочной железы; простые кисты обеих почек, конкремент правой почки.
ФГДС: два полипа желудка размером до 0,5 см.
Учитывая высокий риск сердечно-сосудистых осложнений у пожилой пациентки с анемией тяжелой степени, проведены трансфузии эритроцитарной взвеси. На основании клинико-лабораторных данных (спленомегалия, гипербилирубинемия, гиперхромная анемия с ретикулоцитозом) и неэффективности лечения витамином B12 и фолиевой кислотой заподозрена гемолитическая анемия.
При исследовании крови на антиэритроцитарные антитела выявлены аутоантитела класса IgG ++++.
Результаты стернальной пункции представлены в таблице 2.
Таблица 2.Миелограмма пациентки Ш. от 17.02.12 г.
Заключение
Клеточный костномозговой пунктат. Эритропоэз – нормобластический. Гиперплазия эритроидного ростка – 74,8%. Со стороны эритрокариоцитов отмечаются клетки с цитоплазматическими мостиками, скопления в виде «эритроидных островков».
Мегакариоциты различной степени зрелости с умеренным тромбоцитообразованием.
На основании данных миелограммы (гиперплазия эритроидного ростка при нормобластическом типе кроветворения) и выявления антиэритроцитарных антител диагностирована аутоимунная гемолитическая анемия с тепловыми антителами. При дополнительном обследовании признаков вторичного характера анемии не выявлено.
С 11.03.12 г. начата пульс-терапия метипреднизолоном в дозе 500 мг 1 раз в день внутривенно в сочетании с пероральным приемом преднизолона в дозе 45 мг в сутки под прикрытием гастропротекторов. После 5 дней лечения анемический синдром продолжал нарастать, появился выраженный сдвиг лейкоцитарной формулы влево, увеличение количества ретикулоцитов (табл.1). Доза преднизолона перорально увеличена до 75 мг в сутки, к лечению добавлен азатиоприн по 100 мг/сутки per os, проведена трансфузия1 дозы эритроцитарной взвеси.
С 20.03.12 г. с учетом сохраняющегося гемолиза (ретикулоциты 297‰) проведен второй курс пульс-терапии метилпреднизолоном в дозе 500 мг в сутки № 4, однократно введен внутривенно циклофосфан в дозе 600 мг.
Лечение больная переносила хорошо. С 27.03.12 г. отмечена тенденция к увеличению уровня гемоглобина без поддерживающих гемотрансфузий. Решено продолжить введение циклофосфана по 200 мг в сутки, отменить азатиоприн. Анемический синдром продолжал уменьшаться: к 12.04.12 г. уровень гемоглобина достиг 70 г/л, снизился гемолиз (ретикулоцитов 104‰), однако развилась лейкопения (1,9×10 9 /л), в связи с чем циклофосфан был временно отменен. После восстановления количества лейкоцитов лечение циклофосфаном по 200 мг дважды в неделю было возобновлено на фоне постепенного снижения дозы преднизолона.
Больная в удовлетворительном состоянии 28.04.12 г. выписана из стационара. На амбулаторном этапе продолжено введение циклофосфана по 200 мг в сутки 2 раза в неделю, преднизолон в течение месяца полностью отменен.
В течение нескольких месяцев получала поддерживающую терапию циклофосфаном по 200 мг в сутки 2 раза в неделю (суммарная доза составила 7200 мг). На этом фоне уровень гемоглобина стабилен в пределах 100–120 г/л, количество ретикулоцитов не превышает 20%.
Комментарий к клиническому случаю
Аутоиммунная гемолитическая анемия (АИГА) – гетерогенная группа заболеваний и синдромов, обусловленных повышенным разрушением эритроцитов вследствие образования аутоантител. Частота АИГА во всех возрастных группах составляет 1:40000 – 1:80000, причем женщины болеют в 2 раза чаще мужчин. Выделяют первичные (идиопатические) и вторичные АИГА, которые чаще всего развиваются при лимфомах, солидных опухолях и заболеваниях соединительной ткани. По серологическим свойствам различают АИГА с тепловыми (85%) и холодовыми (15%) антителами; по месту разрушения эритроцитов выделяют АИГА с внутриклеточным (наиболее частым), внутрисосудистым и смешанным гемолизом.
Клинические проявления АИГА:
- анемия;
- иктеричность кожи и склер;
- умеренная спленомегалия;
- субфебрильная температура тела.
При внутрисосудистом гемолизе моча приобретает темно-бурую или черную окраску.
Лабораторные критерии:
- анемия с высоким ретикулоцитозом;
- повышение уровня билирубина за счет непрямого;
- наличие антиэритроцитарных антител (при холодовой форме часто не выявляются);
- гиперплазия эритроидного ростка костного мозга.
Стандарт первой линии терапии АИГА – пероральные глюкокортикостероиды в начальной дозе 1 мг/кг в сутки, возможно проведение пульс-терапии метилпреднизолоном в дозе 0,5–1,0 г/сутки внутривенно в течение 3-5 дней. Второй линией терапии является спленэктомия, которая используется при отсутствии эффекта глюкокортикостероидов в течение 4–6 месяцев. У пожилых пациентов показано назначение иммунодепрессивных и цитостатических препаратов (азатипоприн, циклофосфон, циклоспорин). Значительно реже используют моноклональные антитела (ритуксимаб) и иммуноглобулин. Выживаемость больных АИГА в течение 5 лет составляет 75%.
При анализе данного случая обращает внимание длительное латентное течение заболевания у больной преклонного возраста с гиперхромной анемией, что послужило причиной ошибочного диагноза B12–дефицитной анемии (для АИГА характерен нормохромный характер анемии). С учетом возраста пациентки и наличия сопутствующих заболеваний было принято решение о подключении к лечению цитостатической терапии, позволившее получить ремиссию заболевания, отменить глюкокортикостероиды и отказаться от проведения спленэктомии.
Серологическая диагностика аутоиммунной гемолитической анемии
Серологическая диагностика аутоиммунной гемолитической анемии
Совершенствование серологических методов диагностирования сделало возможным выделение форм аутоиммунной гемолитической анемии в следующие две группы: с холодовыми антителами и с тепловыми антителами. В настоящее время, как следствие проведенных в 1960—1970 гг. исследований (Dacie, Winer, Dausset, Van Loghemm, Evans Витебский, Dacie и Worledge, Schubothe, Пировский, Rosse, Mtiller-Eberhard) антитела, вызывающие аутоиммунный гемолиз получили четкую характеристику и, по методу выявления, делятся на полные (агглютинины или гемолизины) и неполные антитела.
Полные антитела выявляются простыми реакциями агглютинации и гемолиза, в присутствии комплемента, в то время как неполные антитела обнаруживаются с помощью теста Кумбса, по существующим дифференциальным способам, с возможной сенсибилизацией гематий трипсином или папаином.
Иммунолог, стремящийся правильно диагностировать аутоиммунный гемолиз, должен проделать все сравнительные испытания на полные или неполные антитела при теплой (т.е. комнатной температуре, точнее при 37°С) или холодной (4°С) температуре. В целях определения наличия и концентрации холодовых антител реакция проводится при температуре 37°С — когда они отрицательны — затем при постепенно понижающихся температурах: 25°, 20°, 15°, 10° и 4°С.
Правильно проведенные испытания определяют эти две группы аутоиммунной гемолитической анемии, в которых иммунологические параметры характернее клинических. Частные исследования дополнительно уточнили разницу между физическими постоянными молекул иммуноглобулина и специфичности этих двух групп антител.
При гемолитической анемии с тепловыми антителами постановка диагноза требует проведения прямого теста Кумбса; лишь примерно в 40% случаев косвенный тест Кумбса, для выявления свободных антител в сыворотке, дает положительный результат (Dacie и Worlledge). Сенсибилизация гематий с помощью протеолитических ферментов привела к росту показателя частоты свободных антител и их титра.
В случаях острого тяжелого расплавления крови коэффициент антител в сыворотке высокий, при этом они смываются с еще негемолизированных красных кровяных телец, отличающихся одинаковыми иммунобиологическими особенностями. Редко при реакциях инкубации в присутствии свежего комплемента обнаруживаются и гемолизины.
Антитела составлены из иммуноглобулинов и в соответствии с их характеристикой представляются следующие 3 ситуации:
1) блокирующие антитела типа IgM (50% случаев) или свободные антитела, выявляемые соответственно прямой или косвенной реакцией Кумбса с помощью антигаммаглобулиновой сыворотки;
2) свободные антитела IgG, выявляемые косвенной реакцией Кумбса, с помощью антигаммаглобулиновой сыворотки и блокирующих антител, которые восстановили комплемент и вызывают положительную реакцию с антигаммаглобулиновой сывороткой или только сывороткой антиионгамма;
3) антитела вида нонгамма, которые, по существу не иммуноглобулины, а фракции комплемента (бета1-E или бета1-С), вступающие в отрицательную реакцию с сывороткой антигамма, но положительную с сывороткой антинонгамма или, лучше, со специфической сывороткой антикомплемент.
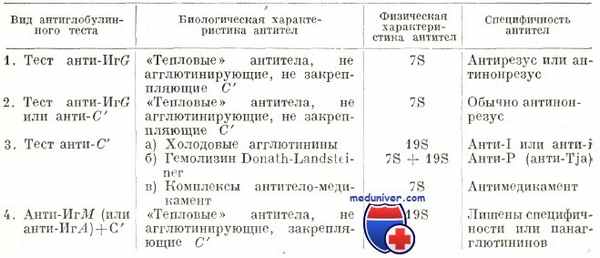
Характеристика аутоантител при генуинной аутоиммунной гемолитической анемии в зависимости от иммунологических испытаний (видоизменение по Leddy)
В смывах с гематий, дающих эту положительную реакцию, выявляются фракции комплемента (С3 и С4), наличие, в небольшом количестве, или отсутствие фракций IgG или IgA, реже IgM. При таком положении реакции антиген-антитело между соответствующими иммуноглобулинами и антигенами эритроцитов зафиксировали большое количество комплемента, маскирующего иммуноглобулины или, возможно, отделяющиеся от оболочки красных кровяных телец.
Во вторичных формах, за счет РКВ или лимфопролиферации, наблюдаются большие количества зафиксированного комплемента, причем функция этого процесса активируется не только иммуноглобулинами, но и другими путями; итак, воздействуя на оболочку гематий создается явление расплавления (Gotze и Muller-Eberhardt). Подобный этому процесс развивается и в аутоиммунной гемолитической анемии после сенсибилизации к отдельным медикаментозным препаратам, в том числе альфаметилдопа.
Диагноз гемолитической анемии за счет тепловых аутоантител уточняется с помощью исследований, требуемых при каждом из трех положений в отдельности, при этом серологическая лаборатория должна располагать соответствующими реагентами и применять подходящую технику. Крупной ошибкой считается отклонение диагноза аутоиммунной гемолитической анемии лишь на основе прямого или косвенного теста Кумбса с помощью сыворотки антигамма.
В клинике, в период гемолиза, у 90% больных реакция Кумбса с сывороткой антигамма дает положительный результат, в связи с наличием IgG, который закрепляется на красных кровяных тельцах и, возможно, связывает комплемент. В более половины случаев связывает лишь комплемент, сохраняющийся и в межприступные периоды. Подобная стойкость комплемента указывает на более тяжелый прогноз, как это бывает, в частности, при злокачественной лимфопролиферации (Swisher и сотр., Speiser).
При гемолитической анемии за счет холодовых антител способы диагностирования одинаковы с применяемыми при анемии за счет тепловых антител, с той лишь разницей, что в первом случае чаще наблюдаются полные антитела — агглютинины или гемолизины — в то время как неполные антитела чаще связывают комплемент. Вот почему помимо необходимости проводить исследование в холодной обстановке и условиях особой предосторожности, требуются также специфические их особенностям реакции.
В принципе аутоантитела — вида IgM, при этом получается реакция прямой агглютинации или реакция гемолиза со связыванием комплемента, в связи с чем они рассматриваются как полные антитела.
Прижизненно, при большой концентрации, закрепляясь на красных кровяных тельцах полные антитела подвергают их процессе агглютинации или внутрисосудистому расплавлению и связывают комплемент.
При воздействии сывороткой антигамма (анти-IgM) на негемолизированные гематии реакция Кумбса лишь в редких случаях дает положительный результат, в то время как применение сывороток антинонгамма или антикомплемент приводит обычно к положительному результату, при этом не забывать, что на красных кровяных тельцах остаются закрепленными лишь фракции комплемента, а IgG — отпадает.
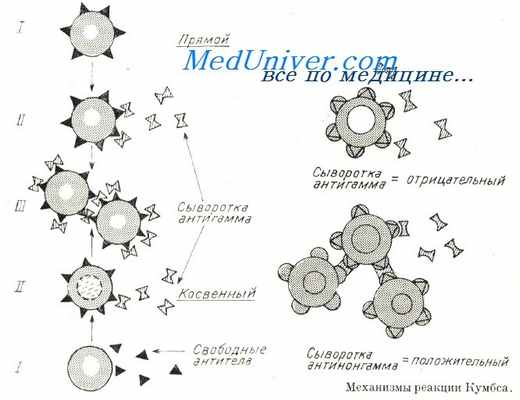
Механизмы реакции Кумбса
Техническая обстановка отличается от наблюдаемой при гемолитической анемии с тепловыми антителами, при этом представляются следующие положения:
1) полные антитела высокого титра (до 10-6), обусловливают реакцию агглютинации почти со всеми группами красных кровяных телец и действуют как панагглютинины, также реакцию гемолиза, при котором действуют как гемолизины; реакции осуществляются в холодной обстановке — при температуре 4°, когда титр сыворотки невысок, в то время как при высоком титре последней реакция происходит и при температуре 15—20°С;
2) неполные свободные антитела, которые, с сывороткой антигамма, дают косвенную положительную реакцию Кумбса, особенно после сенсибилизации гематий протеолитическими ферментами;
3) неполные блокирующие антитела на красных кровяных тельцах, связывающие комплемент, обусловливают положительную реакцию Кумбса с сыворотками антинонгамма или антикомплемент; лишь в очень редких случаях отмечается прямая положительная реакция Кумбса с сывороткой антигамма в тепловых условиях (анти-IgM или анти-IgG) (Leddy). Следует отметить, что, в периоды острого расплавления крови связанный на гематиях комплемент выпадает в сыворотку. Это составляет постоянное явление при пароксизмальной гемоглобинурии на холоде и реже при обычной форме гемолитической болезни на холоде.
В этих случаях, за исключением периода расплавления крови, реакция Кумбса, равно как и все остальные исследования на полные антитела, даже с применением всех известных способов, не всегда выявляют наличие аутоантител. Однако в принципе прямая или косвенная реакция Кумбса с сывороткой антинонгамма, в частности под воздействием протеолитического фермента, дают положительный результат.
Наши исследования показали, что большинство тепловых антител относятся к виду IgG, тем не менее они связывают комплемент. Лишь в редких случаях отмечается смешанное связывание комплемента, всеми классами иммуноглобулинов. При видах с Холодовыми антителами преимущественно связывается вид С, а в 3 случаях IgG + С, однако реакция осуществляется как в условиях холода, так и тепла.
Исследования на антителах из кровотока ули смытых с красных кровяных телец в острые периоды болезни выявили, вообще, однотипную структуру IgM (19 S) с цепями К, как в IgM при болезни Waldenstrom. При вторичных формах, после вирусной инфекции или иммунологического дисглобулинемического заболевания, особенно с криоглобулинами, антитела приобретают двухклонусный характер с цепями каппа и ламбда (Cooper). Одноклонусная однородность характерна генуинным формам и формам, обнаруживаемым при злокачественной иммунопролиферативной болезни (Х.Л.Л., Л.С, болезнь Вальденштрёма).
По Harboe холодовые агглютинины, появляющиеся после вирусной или микоплазматичесжой инфекции преставляет собой преходщие IgM поликлонусного вида небольшого титра, в связи с чем на красных кровяных тельцах закреплен лишь комплемент.
При хронических генуинных формах, даже в случае их сочетания с криоглобулинами и иммунными аггрегатами, явлением Raynaud и гемоглобинурией холодовые агглютинины вида IgM высокого титра, одноклонусные, с легкими цепями вида каппа, реже ламбда. Поскольку холодовые антитела макроглобулины вида IgM они утрачивают свою активность при исследованиях в пробирке под воздействием меркаптоэтанола или d, 1-пеницилламина (Evans).
После вирусного мононуклеоза лишь в редких случаях появляются агглютинины в холодовой среде. Не исключена возможность сенсибилизации больного, в период выздоворления, частицами вируса и реактивным сывороточным белком — видимо альфа2-гаптоглобин или. бета-глобулин (Rosse). Продолжение послевирусной иммунной реакции обусловливает развитие специфических антител, которые хотя и дают положительную реакцию в холодовой среде, тем не менее принадлежат группе IgG.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Серологическая диагностика аутоиммунной гемолитической анемии
- Главная >
- Образование >
- Электронная информационно-образовательная среда >
- Образовательные мероприятия >
- Вебинары >
- Классификация гемолитических анемий. Аутоиммунная гемолитическая анемия: диагностика и лечение
Классификация гемолитических анемий. Аутоиммунная гемолитическая анемия: диагностика и лечение
ФГБУ «НМИЦ гематологии» Минздрава России приглашает вас принять участие в серии образовательных интерактивных онлайн семинаров
«Орфанные заболевания в практике гематолога: учимся на клинических примерах».
Программа научно-практического семинара
«Классификация гемолитических анемий. Аутоиммунная гемолитическая анемия: диагностика и лечение»
Приглашаем заинтересованных принять участие.
Дата проведения: 7 апреля 2021 г.
Время проведения: 15:00—16:00.
Модератор:
Лукина Елена Алексеевна, профессор, д. м. н., зав. отделением орфанных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России, г. Москва
Классификация гемолитических анемий. Аутоиммунная гемолитическая анемия: диагностика и лечение
Цветаева Нина Валентиновна — кандидат медицинских наук, старший научный сотрудник отделения орфанных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России, г. Москва
- современная классификация гемолитических анемий;
- лабораторная диагностика;
- клиническая и лабораторная характеристика наиболее распространенных форм врожденных гемолитических анемий;
- определение, классификация и диагностика аутоиммунной гемолитической анемии;
- принципы патогенетической терапии и возможности терапевтического воздействия
15:20—15:50
Разбор клинических случаев:
Никулина Ольга Федоровна — кандидат медицинских наук, врач-гематолог отделения орфанных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России, г. Москва
15:55—16:00
Дискуссия, ответы на вопросы интернет-аудитории.
Лукина Елена Алексеевна
профессор, д. м. н., зав. отделением орфанных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России, г. Москва
Цветаева Нина Валентиновна
кандидат медицинских наук, старший научный сотрудник отделения орфанных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России, г. Москва
Никулина Ольга Федоровна
кандидат медицинских наук, врач-гематолог отделения орфанных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России, г. Москва
Количество мест на мероприятии ограничено.
Минимальный порог участия в трансляции для получения баллов НМО — 50 минут и 2 подтверждения периодической проверки присутствия с помощью всплывающих окон.
Аутоиммунная гемолитическая анемия
Аутоиммунная гемолитическая анемия обусловлена аутоантителами, которые реагируют с эритроцитами при температуре ≥ 37 ° С (гемолитическая анемия с тепловыми антителами) или < 37 ° С (болезнь холодовых антител). Тип гемолиза обычно внесосудистый. Прямой антиглобулиновый тест (прямая проба Кумбса) позволяет установить диагноз и предположить причину. Лечение зависит от причины и может включать применение кортикостероидов, внутривенных иммуноглобулинов, иммуносупрессантов, спленэктомию, также требуются отказ от гемотрансфузий (за исключением случаев опасной для жизни анемии), избегания триггеров (например, простуды) и отмены препаратов.
Этиология аутоиммунной гемолитической анемии
Аутоиммунная гемолитическая анемия вызвана патологиями, которые не относятся к эритроцитам Нарушений, не относящихся к эритроцитам По окончании срока нормальной продолжительности жизни (около 120 дней) эритроциты удаляются из кровотока. Гемолиз определяется как преждевременная деструкция и, следовательно, укорочение продолжительности. Прочитайте дополнительные сведения .
Гемолитическая анемия, обусловленная тепловыми антителами
Гемолитическая анемия с тепловыми антителами является наиболее распространенной формой аутоиммунной гемолитической анемии (АИГА); она чаще встречается среди женщин. Тепловые антитела, как правило, вступают в реакцию при температуре ≥ 37 ° С. Аутоиммунную гемолитичемкую анемию можно классифицировать как:
Вторичные (возникают в связи с основным заболеванием, таким как системная красная волчанка (СКВ) Системная красная волчанка (СКВ) Системная красная волчанка – хроническое мультисистемное воспалительное заболевание аутоиммунной природы; поражает преимущественно молодых женщин. Наиболее часто заболевание проявляется артралгиями. Прочитайте дополнительные сведенияНекоторые препараты (например, альфа-метилдопа, леводопа—см. таблицу Лекарственные средства, которые вызывают гемолитическую анемию тепловых агглютининов Лекарственные средства, которые вызывают гемолитическую анемию тепловых агглютининов ) стимулируют продукцию аутоантител к Rh-антигенам (аутоиммунная гемолитическая анемия, ассоциированная с применением альфа-метилдопы). Другие препараты стимулируют продукцию аутоантител к мембранному комплексу антибиотик – эритроцит как часть транзиторного гаптенового механизма; гаптен может быть стабильным (высокие дозы пенициллина, цефалоспорины) или нестабильным (хинидин, сульфаниламиды).
При гемолитической анемии тепловых агглютининов, гемолиз происходит в основном в селезенке и не связан с непосредственным лизисом эритроцитов. Он часто достигает тяжелой степени и может приводить к летальному исходу. Большая часть тепловых аутоантител относится к IgG. Они являются панагглютининами и чаще всего характеризуются ограниченной специфичностью.
Болезнь холодовых агглютининов
Болезнь холодовых агглютининов (болезнь холодовых антител) вызывают аутоантитела, которые активны при температурах < 37 ° С. Причины включают:
Идиопатические (как правило, связаны с клональной популяцией В-клеток)
Инфекции, особенно микоплазменная пневмония или инфекционный мононуклеоз (антитела направлены против I или I антигенов)
Лимфопролиферативные нарушения (антитела, как правило, направлены против антигена I)
Инфекции, как правило, вызывают острое заболевание, в то время как идиопатическое заболевание (распространенная форма у пожилых людей), зачастую, носит хронический характер. Наблюдается преимущественно внесосудистый гемолиз, который осуществляется мононуклеарной фагоцитарной системой печени и селезенки. Анемия, как правило, не достигает тяжелой степени (гемаглобин > 7,5 г/дл [70,5 г/л]). Холодовые аутоагглютинины обычно относятся к IgM. Температурная амплитуда антител более важна, чем их титр; повышение температуры (приближение к нормальной температуре тела), при которой данные антитела реагируют с эритроцитами, усиливает гемолиз.
Пароксизмальная холодовая гемоглобинурия
Пароксизмальная холодовая гемоглобинурия (ПХГ, синдром Доната – Ландштейнера) относится к редкому типу болезни холодовых агглютининов. ПХГ чаще встречается у детей. Гемолиз возникает при воздействии холода, даже локальном (употребление холодных напитков, мытье рук в холодной воде). При низкой температуре антитело IgG связывается с Р-антигеном на поверхности эритроцитов и вызывает внутрисосудистый гемолиз и гемоглобинурию при последующем нагревании. Данное заболевание чаще всего развивается после перенесенной неспецифической вирусной инфекции, однако может возникать и на фоне полного здоровья, а также у некоторых пациентов с врожденным или приобретенным сифилисом Сифилис Сифилис вызывается спирохетой Treponema pallidum и характеризуется 3 последовательными клиническими, симптоматическими стадиями, отделенными периодами бессимптомной скрытой инфекции. Прочитайте дополнительные сведения . Тяжесть анемии и скорость ее развития варьирует, может наблюдаться фульминантное течение. У детей это заболевание часто разрешается самостоятельно.
Симптомы и признаки аутоиммунной гемолитической анемии
Симптомы гемолитической анемии с тепловыми антителами обусловлены анемией. При тяжелом течении могут наблюдаться лихорадка, боль в груди, обмороки, печеночная или сердечная недостаточность. Характерна легкая спленомегалия.
Болезнь холодовых агглютининов манифестирует как острая или хроническая гемолитическая анемия. Могут присутствовать другие криопатические симптомы или признаки (например, акроцианоз, синдром Рейно Синдром Рейно Синдром Рейно – спазм сосудов кистей в ответ на воздействие холода или эмоционального напряжения, вызывающий обратимый дискомфорт и изменение цвета кожи (бледность, цианоз, эритема или их комбинация). Прочитайте дополнительные сведенияМожет присутствовать гепатоспленомегалия. К симптомам ПХГ относятся следующие проявления: сильная боль в спине и ногах, головная боль, рвота, диарея, выделение мочи темно-коричневого цвета.
Диагностика аутоиммунной гемолитической анемии
Мазок периферической крови, количество ретикулоцитов, лактатдегидрогеназа (ЛДГ)
Прямой антиглобулиновый тест
Аутоиммунную гемолитическую анемию следует подозревать у любого пациента с гемолитической анемией (о чем может свидетельствовать наличие анемии и ретикулоцитоза). В мазке периферической крови обычно выявляются микросфероциты и большое количество ретикулоцитов с небольшим количеством или отсутствием шистоцитов, что указывает на внесосудистый гемолиз. Лабораторные исследования обычно указывают на гемолиз (например, повышение ЛДГ и непрямого билирубина). Высокий показатель среднего объема эритроцитов (MCV) может быть следствием сильного ретикулоцитоза. Гемолитическая анемия при низком количестве ретикулоцитов встречается редко, но может возникать и является признаком тяжелого заболевания.
Аутоиммунная гемолитическая анемия диагностируется путем выявления аутоантител с помощью прямого антиглобулинового теста (прямой реакции Кумбса). Антиглобулиновую сыворотку добавляют к отмытым эритроцитам пациента; агглютинация свидетельствует о наличии иммуноглобулинов или комплемента (С), связанного с эритроцитами. При гемолитической анемии с синдромом тепловых агглютининов IgG присутствует почти всегда, а также могут присутствовать C3 (C3b и C3d). При болезни холодовых антител присутствует С3, а IgG обычно отсутствует. Данный тест в отношении диагностики аутоиммунной гемолитической анемии имеет чувствительность ≥ 98%; ложноотрицательные результаты могут наблюдаться в том случае, если плотность антител крайне низкая либо, достаточно редко, если они относятся к классу IgA или IgM. В большинстве случаев аутоиммунной гемолитической анемии с тепловыми антителами антитело представляет собой IgG, который идентифицируют только как панагглютинин, это означает, что антигенную специфичность антитела определить не возможно. При болезни холодовых агглютининов антитело, как правило, является IgM и направлено против углеводов I/i на поверхности эритроцитов. Обычно можно определить титр антител, но он не всегда коррелирует со степенью активности заболевания. Прямой антиглобулиновый тест (прямая проба Кумбса) может быть положительным при отсутствии аутоиммунной гемолитической анемии, поэтому его следует проводить только в надлежащих клинических условиях. Ложноположительный прямой антиглобулиновый тест может быть результатом присутствия клинически незначимых антител.
Непрямой антиглобулиновый тест (непрямая проба Кумбса) является дополнительным тестом, который заключается в смешивании плазмы пациента с нормальными эритроцитами, чтобы определить, находятся ли такие антитела в свободном состоянии в плазме. Как правило, положительный непрямой антиглобулиновый тест в сочетании с отрицательным прямым тестом означает наличие аллоантител, обусловленных беременностью, предшествующими гемотрансфузиями, перекрестной лектиновой активностью, а не иммунным гемолизом. Необходимо учитывать, что даже обнаружение тепловых антител не свидетельствует о наличии гемолиза, поскольку положительная проба Кумбса наблюдается у 1/10000 здоровых доноров крови.
Прямой антиглобулиновый тест (прямая проба Кумбса)
Прямая проба Кумбса применяется для определения эритроцит-связывающих антител (IgG) или наличия комплемента (С3) на мембранах эритроцитов. Эритроциты больного инкубируют с антителами к человеческим иммуноглобулинам IgG и С3. Если антитела класса IgG или С3 связываются с мембраной эритроцитов, происходит агглютинация - положительный результат Положительный результат предполагает наличие аутоантител к эритроцитам, если пациент не получал переливание крови в течение последних 3 мес, аллоантитела к перелитым эритроцитам (обычно наблюдается при острой или отсроченной гемолитической реакции) или лекарственно-зависимые антиэритроцитарные антитела.
Читайте также:
- Лефлуномид при ревматоидном артрите. Цикслоспорин и этанерцепт при ревматоидном артрите
- Турецкое седло. Рентгеновские снимки турецкого седла
- Органосохраняющие операции при раке молочной железы
- Признаки предсердного ритма. ЭКГ при выскальзывающем ритме предсердий
- Эхокардиография при дефекте межпредсердной перегородки. ЭхоКС признаки ДМПП
